Т-клеточные лимфомы у взрослых
Категории МКБ: Болезнь Сезари (C84.1), Грибовидный микоз (C84.0), Другие и неуточненные t-клеточные лимфомы (C84.5), Лимфома t-зоны (C84.2), Неходжкинская лимфома неуточненного типа (C85.9), Периферическая t-клеточная лимфома (C84.4)
Разделы медицины: Онкогематология
Общая информация
- Версия для печати
- Скачать или отправить файл
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения и социального развития Республики Казахстан
от «29» ноября 2016 года
Протокол №16
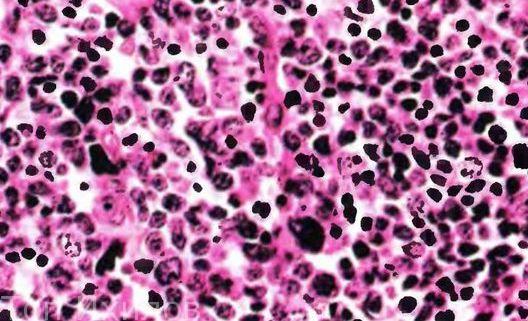
Грибовидный микоз (С84.0)– злокачественная опухоль лимфоидной ткани, характеризующаяся поражением лимфоидно-ретикулярной системыв следствии избыточной пролиферацией Т-хелперов на коже[1].
Синдром Сезари (С84.1) –это Т-клеточная лимфома кожи, характеризующаяся эритродермией, генерализованной лимфоаденопатией и наличием в крови циркулирующих злокачественных Т-лимфоцитов (клеток Сезари).
Экстранодальная NK/Т-клеточная лимфома, назальный тип (С84.2) – агрессивная лимфоидная опухоль аналогом которой считают активированные NK-клетки или цитотоксические Т-лимфоциты, которые характеризуются экспрессией на своей поверхности СО56-антигены. Название «назальный тип» обусловлено частой первичной локализацией опухоли в верхних дыхательных путях (уст:«летальная срединная гранулема»). Опухоль часто поражает кожу, легкие, тонкую кишку, почки.
Анапластическая крупноклеточная лимфома (С84.4) – редкая и агрессивная периферическая T-клеточная неходжкинская лимфома, принадлежащая к группе CD30-положительных лимфопролиферативных заболеваний, которая поражает лимфатические узлы и внеузловые места. Она включает два подтипа, основанных на экспрессии белка, названного киназой анапластической лимфомы (ALK): ALK+ и ALK-[2].
Периферическая T-клеточная лимфома неспецифицированная (ПТКЛН) (С84.4) – одна из наиболее агрессивных форм неходжкинских лимфом. При ней в опухолевый процесс вовлекаются костный мозг, печень, селезёнка и кожа, кроме того при поражении костного мозга лимфома может трансформироваться в лейкоз. Этот вид лимфомы обычно плохо поддается лечению.
Гепатолиенальная (гепатоспленическая) Т-клеточная лимфома (ГЛТЛ)(С84.5)— Т-клеточное лимфопролиферативное заболевание, характеризующееся преимущественным поражением печени, селезенки и костного мозга (КМ).
Ангиоиммунобластная Т-клеточная лимфома (АИЛ) (С85.9) -агрессивная, T-клеточная неходжкинская лимфома, которая характеризуется клональной перестройкой генов Т-клеточного рецептора [3].
Соотношение кодов МКБ-10 и МКБ-9:
| МКБ-10 | МКБ-9 | ||
| Код | Название | Код | Название |
| С84.1 | Грибовидный микоз | 40.11 | Биопсия лимфатической структуры |
| С84.1 | Болезнь Сезари | ||
| 40.21 | Иссечение глубокого шейного лимфатического узла | ||
| С84.2 | Лимфома T-зоны | 40.23 | Иссечение подмышечного лимфатического узла |
| 40.24 | Иссечение пахового лимфатического узла | ||
| С84.4 | Периферическая T-клеточная лимфома) | 40.29 | Простое иссечение другой лимфатической структуры |
| 40.30 | Локальное иссечение лимфоузла | ||
| С84.5 | Другие и неуточненные T-клеточные лимфомы | 41.50 | Полная спленэктомия |
| С85.9 | Неходжкинская лимфома неуточненного типа | 86.11 | Биопсия кожи и подкожных тканей |
Дата разработки/пересмотра протокола: 2016 год
Пользователи протокола: ВОП, терапевты, онкологи, гематологи.
Категория пациентов: взрослые
Шкала уровня доказательности:
Таблица 1. Шкала уровней доказательности[1]
| УД | Характеристика исследований, которые легли в основу рекомендаций |
| А | Высококачественный мета-анализ, систематический обзор рандомизированных клинических исследований (РКИ) или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов |
[1]Наиболее часто встречающаяся Т-клеточная опухоль кожи, составляющая 1 % всех неходжкинских лимфом и половину Т-клеточных кожных лимфом. Средний возраст ко времени диагностики 57 лет, соотношение мужчин и женщин 2:1. Заболеваемость ГМ в мире равна 6–7 случаев на 1 млн населения [35]. Гистологическая картина представлена инфильтратом плеоморфных (церебриформных) лимфоидных клеток малых и средних размеров, наличием интраэпидермальных лимфоцитов, окруженных светлым перинуклеарным ободком («haloed lymphocytes»). Лимфоидный инфильтрат разрушает зону эпидермально-дермального стыка и распространяется в эпидермис с образованием микроабсцессов Потрие.
[2]АККЛ представляет собой две различные нозологические формы – АККЛ, ALK+ и АККЛ,ALK-, ключевое различие между которыми заключается в наличии или отсутствии экспрессииALK протеина. Химерный белок ALK-NPM является продуктом транслокации междухромосомами 2 и 5. Локус р23 на хромосоме 2 кодирует киназу анапластической лимфомы(ALK), трансмембранный рецептор, близкий лейкоцитарным тирозиновым киназам, чьяфизиологическая экспрессия в постнатальном периоде ограничивается клетками центральнойнервной системы. Локус q35 5-й хромосомы содержит ген нуклеофосмина (NРM), кодирующийкислый фосфопротеин, локализующийся в ядре и в зоне расположения ядрышковых организаторов. Так как белок ALK в норме выявляется только в нервной ткани, то обнаружение его при лимфоме свидетельствует об аберрантной экспрессии гена, обусловленной транслокацией t(2;5).
[3]АИЛ составляет около 15% всех ПТКЛ. Заболевание распространено среди взрослогонаселения. Случаи АИЛ в детском возрасте до настоящего времени не были описаны.Клиническая картина характеризуется генерализованной лимфаденопатией, гепатоспленомегалией, кожными высыпаниями и В-симптомами. При АИЛ часто наблюдаютсяполиклональная гипергаммаглобулинемия и гемолитическая анемия с положительной пробойКумбса. Течение заболевания в большинстве случаев сопровождается иммунодефицитом ирецидивирующими инфекциями.
Неопухолевым аналогом АИЛ считается субпопуляция Т-лимфоцитов – Т-хелперыфолликулярного центра (ТFH). Они имеют уникальный фенотип, экспрессируя наряду с Т-клеточными антигенами, маркеры, характерные для В-лимфоцитов герминального центра — BCL6 и CD10. Их биологическая роль заключается в выработке хемокинов (CXCR5 и CXCL13), индуцирующих пролиферацию фолликулярных дендритических клеток и миграцию В-лимфоцитов в лимфатический узел за счет усиления их адгезии к эндотелию венул, что облегчает прохождение В-лимфоцитов через сосудистую стенку.
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
+7 938 489 4483 / +7 707 707 0716 / + 375 29 602 2356 / office@medelement.com
Мне интересно! Свяжитесь со мной
Классификация
Классификация[4,5,6]:
| Экстранодальные формы | · Экстранодальная NK/ T- клеточная лимфома, назальный тип; · Гепатоспленическая Т- клеточная лимфома; |
| Кожные формы | · Грибовидный микоз; · Синдром Сезари; |
| Нодальные формы | · Периферическая Т- клеточная лимфома, неуточненная; · Ангиоиммунобластная Т- клеточная лимфома; · Анапластическая крупноклеточная лимфома, ALK- позитивная; · Анапластическая крупноклеточная лимфома, ALK- негативная. |
Стадирование ГМ/СС согласно рекомендациям ISLE—EORTC:
Кожа:
Т1– ограниченные пятна, папулы, и/или бляшки, покрывающие Т1а – только пятна
Т1b – бляшки ± пятна
Т2 –пятна, папулы, и/или бляшки, покрывающие >10% кожного покрова.
Т2а – только пятна
Т2b — бляшки ± пятна
Т3 – один или более узлов (≥1 см в диаметре)
Т4– сливающаяся эритема, покрывающая ≥80% поверхности тела
Лимфатические узлы:
N0 – нет увеличения периферических лимфатических узлов, их биопсия не требуется
N1 – периферические лимфатические узлы увеличены; гистопатология Dutch grade 1 или NCI LN0-2
N1a – клон-негативны
N1b – клон-позитивны
N2 – периферические лимфатические узлы увеличены; гистопатология Dutch grade 2 или NCI LN3
N2a – клон-негативны
N2b – клон-позитивны
N3 – периферические лимфатические узлы увеличены; гистопатология Dutch grade 3-4 или NCI LN4, клон-позитивны или негативны
NX – периферические лимфатические узлы увеличены, нет гистологического подтверждения
Внутренние органы:
M0 – нет вовлечения внутренних органов
M1 – вовлечение внутренних органов (с уточнением органа и морфологическим подтверждением)
Кровь:
B0 – отсутствие значительного вовлечения крови: атипичные (Сезари) клетки составляют ≤5% лимфоцитов периферической крови
B0a – клон-негативны
B0b – клон-позитивны
B1 – умеренное вовлечение крови: атипичные (Сезари) клетки составляют >5% лимфоцитов периферической крови
B1a – клон-негативны
B1b – клон-позитивны
B2 – значительное вовлечение крови: ≥1000/μL клеток Сезари с позитивным клоном

Э NK-ТКЛ
Прогностический индекс для ЭNK-ТКЛ
| Факторы риска (по 1 баллу) | Группа риска |
| Уровень ЛДГ > нормы | Низкий риск- 0 баллов |
| В-симптомы | Низкий промежуточный риск – 1 балл |
| Лимфоузлы, N1-N3, но не М1 | Высокий промежуточный риск – 2 балла |
| Стадия по AnnArborIV | Высокий риск – 3 или 4 балла |
АККЛ, ALK+;АККЛ, ALK-; АИЛ; ПТКЛн, ГЛТЛ
Стадия устанавливается в соответствии с классификацией Ann Arbor(Классификацию по Ann Arbor см. в Приложении 3).Для оценки индивидуального риска раннего прогрессирования используются международный прогностический индекс (IPI) и международный прогностический индекс для ПКТЛ(PIT)
Международный прогностический индекс для ЛПЗ (IPI)
| Факторы риска (по 1 баллу) | Прогностические группы | Баллы |
| Возраст > 60 лет | Низкий риск | 0 или 1 |
| Концентрация ЛДГ > норма | Низкий промежуточный | 2 |
| Соматический статус ECOG 2-4 | Высокий промежуточный | 3 |
| Стадия по AnnArborIII-IV | Высокий | 4 или 5 |
| Экстранодальные поражение >1 группы |
Общий прогностический индекс для периферических Т-клеточных лимфом (PIT)
| Факторы риска (по 1 баллу) | Прогностические группы | Общая выживаемость |
| Возраст > 60 лет | Группа 1 – 0 баллов | 62% |
| Концентрация ЛДГ > норма | Группа 2 – 1 балл | 53% |
| Соматический статус ECOG 2-4 | Группа 3 – 2 балла | 33% |
| Вовлечение костного мозга | Группа 4 – 3 или 4 балла | 18% |
Диагностика (амбулатория)
ДИАГНОСТИКА НА АМБУЛАТОРНОМ УРОВНЕ [4,5,6,7]
Диагностические критерии: Жалобы, анамнез, данные физикального исследования играют важную роль в диагностике и в дифференциальной диагностике лимфом, но неспецифичны в связи с чем не относятся к диагностическими критериями.
Жалобы:
· экстранодальные поражения – кожа, костный мозг, мягкие ткани, легкие, печень, желудочно-кишечный тракт;
· чувство тяжести в животе;
· утомляемость;
· потеря массы тела;
· плохой аппетит;
· ночная потливость;
· прогрессирующая слабость;
· феномен одновременного прогрессирования и регрессирования отдельных высыпаний;
· пойкилодермия (пятнистая пигментация, телеангиоэктазии, атрофия кожи);
· множественность высыпаний, несколько зон вовлечения;
· характерная локализация высыпаний на участках кожи, не подвергающихся солнечномуоблучению;
· кожный зуд, часто сопровождающий высыпания;
· увеличение лимфатических узлов в любой зоне, селезенки, печени;
· деструкции в области срединых структур лица – полость носа, рта, ротоглотка, орбита. При диссеминации поражаются дыхательные пути, кожа, мягкие ткани, желудочно-кишечный тракт, яичники.
Физикальное обследование:
· количество и размер высыпаний (наличие пятен и бляшек указывает на возможнуюассоциацию с ГМ);
· наиболее частая локализация высыпаний — верхние и нижние конечности. В 25 % случаев наблюдается спонтанная регрессия кожных поражений;
· идентификация пальпируемых л/у и органомегалиипредставлена одним или несколькими узлами, имеющимитенденцию к изъязвлению;
· кашель без выделения мокроты – возникает за счет сдавления дыхательных путей увеличенными лимфоузлами средостения;
· повышение температуры тела, преимущественно в вечернее и ночное время;
· снижение массы тела (более 10-15 кг в течение 2-3 месяцев);
· бледность кожных покровов;
· увеличение лимфоузлов различной локализации;
· увеличение размеров печени и селезенки.
Лабораторныеисследования:
· общий анализ крови – подсчет лейкоформулы, тромбоцитов в мазке: может определяться снижение количества эритроцитов, снижение уровня гемоглобина, лимфатический лейкоцитоз. Цветной показатель обычно остается в пределах нормы. Количество лейкоцитов чаще остается в пределах нормы. Уровень тромбоцитов может быть в пределах нормы, ускорение СОЭ. Могут наблюдатся реактивные изменения, в том числе иногда эозинофилия.
· биохимический анализ крови–лактатдегидрогеназа, общий белок, альбумин, креатинин, мочевина, электролиты, мочевая кислота — для выявления синдрома лизиса опухоли, а также сопутствующего поражения органов. Может наблюдаться поликлональная гипергаммаглобулинемия. Часто сопровождается имунным гемолизом с положительной пробой Кумбса, увеличением циркулирующих имунных комплексов, криоглобулинов, присутствием ревматоидного фактора.
· коагулограмма – повышение уровня Д-димеров
Инструментальныеисследования:
· УЗИ периферических и внутрибрюшных лимфоузлов – увеличение размеров и изменение структуры лимфоузлов;
· цитологическое исследование биопсийного материала – с целью верификации морфологической формы ЛПЗ;
· гистологическое исследование – с целью верификации морфологической формы ЛПЗ;
· иммуногистохимическое исследование – с целью верификации морфологической формы ЛПЗ.
· компьютерная томография с контрастированием (грудная клетка, брюшная полость, малый таз) при АКЛК.
Диагностические критерии ГМ:
| Методы | Характерно | ||
| Основные | Гистология | Гистологическое заключение должно учитывать клеточный состав дермального инфильтрата и его расположение. Основными диагностическими критериями ГМ, являются: · наличие в инфильтрате плеоморфных («церебриформных») лимфоидных клеток малых и средних размеров · наличие лимфоидных клеток, располагающихся цепочкой в базальном ряду эпидермиса (3 и более) · наличие интраэпидермальных лимфоцитов, окруженных светлым перинуклеарным ободком (haloed lymphocytes) 78 · повышенное количество интраэпидермальных лимфоцитов при отсутствии спонгиоза («диспропорциональный эпидермотропизм») · размер эпидермальных лимфоцитов больше, чем дермальных · внутриэпидермальные скопления лимфоцитов (микроабсцессы Потрие) · фиброз и/или отек сосочковой части дермы. Для повышения достоверности гистологического исследования необходимо отменятьлечение любыми наружными препаратами, особенно содержащими кортикостероиды, а такжесистемными кортикостероидами и иммуносупрессантами за 2 недели до проведения биопсии.В неясных случаях рекомендуется проведение нескольких биопсий из разных очагов иповторных биопсий через 2-4 недели (без назначения наружной терапии). | |
| ИГХ | При иммуногистохимическом исследовании ГМ характеризуется инфильтратом из α/β Т-хелперов, которые имеют следующийиммунофенотип: βF1+ CD3+ CD4+ CD5+ CD7+ CD8-CD45RO+. Реже встречаются Т-цитотоксический (βF1+ CD3+ CD4- CD5+ CD8+) и γ/δ (βF1- CD3+CD4- CD5+ CD8+) фенотипы. В этих случаях требуется клинико-морфологическая корреляция для исключения CD8+ агрессивной эпидермотропной Т-клеточной лимфомы и γ/δ Т-клеточной лимфомы. В поздних стадиях ГМ может наблюдаться полная или частичная потеря экспрессии пан-Т-клеточных антигенов CD3, CD5 и CD7, появление экспрессии цитотоксических протеинов TIA-1, гранзима В и перфорина, а также аберрантный CD4+/CD8+ или CD4-/CD8- фенотип. | ||
| Характерный иммунофенотип | Опухолевые клетки при ГМ имеют фенотип зрелых Т-лимфоцитов памяти (CD3+CD4+CD45RO+CD8–). Редко может наблюдаться фенотип CD4–CD8+. Демонстрацией аберрантного фенотипа при ГМ является утратапан-Т-клеточных антигенов CD2, CD3, CD5, CD7, что вомногих случаях служит важным дополнением к диагнозу. | ||
| Дополнительно | ПЦР | ПЦР-исследование для определения реаранжировки гена Т-клеточного рецептора (ТКР)является вспомогательным методом, так как моноклональность инфильтрата обнаруживается в 90% случаев бляшечной и опухолевой стадий ГМ и лишь в 50-60% — в пятнистой стадии. | |
Диагностические критерии СС:
| Международным обществом лимфом кожи (ISCL) и Европейской организацией по изучению и лечению рака (EORTC) выработаны следующие критерии диагностики СС: |
| · Отсутствие предшествующего ГМ · Генерализованная эритродермия (диффузная эритема, покрывающая не менее 80% поверхности тела с/без шелушения) · Наличие в крови доминантного клона Т-лимфоцитов (определяется при помощи ПЦР или Southern blot) · Наличие одного или более следующих признаков: o абсолютное количество клеток Сезари в крови ≥ 1000 клеток/мм3 o повышено содержание CD3+ или CD4+ клеток периферической крови с коэффициентом отношения CD4/CD8 ≥ 10 (определяется при помощи проточной цитометрии) o повышено содержание CD4+ клеток периферической крови с аберрантным иммунофенотипом, включающем отсутствие экспрессии CD7 (≥ 40% CD4+СD7-клеток) или CD26 (≥ 30% CD4+CD26- клеток) · Гистологическое, иммуногистохимическое и молекулярно-биологическое (определение реаранжировки гена Т-клеточного рецептора методом ПЦР) исследования кожи и лимфатических узлов (л/у) (в случае их увеличения ≥ 1,5 см) являются дополнительными методами диагностики в неясных диагностических ситуациях у пациентов с хронической эритродермией неясной этиологии. |
Экстранодальная NK/Т-клеточная лимфома, назальный тип
| Методы | Характерно |
| Основные | Гистология |
Диагностические критерии АКЛК:
| Методы | Характерно | |
| Основные | Гистология | Основной морфологической чертой является наличие «диагностических» клеток – клеток с эксцентрично расположенным ядром подковообразной или почкообразной формы и эозинофильно окрашенной зоной в парануклеарной области цитоплазмы. На ранних стадиях заболевания опухоль поражает лимфатический узел частично, нередко отмечается рост опухолевых клеток в синусах, что симулирует метастатический рак. |
| Характерный иммунофенотип | В опухолевых клетках выявляется один или более Т-клеточных антигенов – CD2, CD3, CD7,CD45RO, хотя возможна утрата части или даже всех из них. Это приводит к тому, что до 30-50% опухолей, по данным иммуногистохимии имеет «нулевой» фенотип. В клетках опухоли обнаруживается экспрессия цитотоксических молекул — TIA-1, гранзима B и перфорина. |
Диагностические критерии АИЛ:
| Методы | Характерно |
| Основные | Гистологическое |
Диагностические критерии ПТКЛн:
| Методы | Характерно |
| Основные | Гистологическое |
Диагностические критерии ГЛТЛ:
| Методы | Характерно |
| Основные | Гистологическое |

Диагностический алгоритм: Диагностический алгоритм включат в себя выявление образования с помощью методов лучевой диагностики, проведение биопсии иили удаление выявленного образования с последующим гистологическим и иммуногистохимическим исследованиями. По индивидуальным показаниям перечень диагностических мероприятий может быть расширен.
Диагностика (стационар)
ДИАГНОСТИКА НА СТАЦИОНАРНОМ УРОВНЕ
Диагностические критерии на стационарном уровне[4,5,6,7]:
Решающее значение для верификации диагноза лимфомы имеют гистологическое и иммуногистохимическое исследования. Дополнительные методы необходимы для определения распространенности опухолевого процесса и стратификации пациентов по группам риска. Такие критерии как анамнез, жалобы и объективный статус не специфичны и диагностически не значимы. (см. амбулаторный уровень)
Лабораторные исследования:
NB! Основные принципы:
· диагноз должен быть установлен на основании исследования хирургически удаленного (резекция) лимфоузла или участка экстранодального поражения, при этом количество материала должно быть достаточным для фиксации в формалине и приготовления парафиновых блоков. Обязательно выполнение иммуногистохимического исследования с использованием минимальной панели антител (CD20, CD45, CD3);
· пункционная биопсия или трепанобиопсия опухоли с диагностической целью могут быть выполнены только в исключительных случаях, при необходимости немедленного лечения;
· возможна также заморозка части свежего биопсийного материала для молекулярных исследований, однако определение профиля экспрессии генов остается исследовательским подходом;
· морфологическое исследование должно быть максимально достоверным, выполненным патологом экспертом и соответствовать критериям текущей классификации ВОЗ.
Жалобы, физикальное обследование: см. амбулаторный уровень.
Лабораторные исследования: см. амбулаторный уровень.
Инструментальные иследования: см. амбулаторный уровень, а также:
· КТ ОГК и ОБП с контрастированием;
· ПЭТ/КТ всего тела.
Диагностические критерии: морфологическая классификация по гистологическим признакам и иммунофенотипу опухолевого субстрата смотреть см. амбулаторный уровень.«диагностические критерии»
Диагностический алгоритм: Диагностический алгоритм включат в себя выявление образования с помощью методов лучевой диагностики, проведение биопсии иили удаление выявленного образования с последующим гистологическим и иммуногистохимическим исследованиями. По индивидуальным показаниям перечень диагностических мероприятий может быть расширен(см. амбулаторный уровень).
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований[5,6,7]
Алгоритм гистологическрй дифференциальной диагностики ГМ и СС
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Грибовидный микоз | Наличие в инфильтрате плеоморфных («церебриформных») лимфоидных клеток малых и средних размеров. Наличие лимфоидных клеток, располагающихся цепочкой в базальном ряду эпидермиса (3 и более). Наличие интраэпидермальных лимфоцитов, окруженных светлым перинуклеарным ободком (haloed lymphocytes) 78. Повышенное количество интраэпидермальных лимфоцитов при отсутствии спонгиоза («диспропорциональный эпидермотропизм»). Размер эпидермальных лимфоцитов больше, чем дермальных. Внутриэпидермальные скопления лимфоцитов (микроабсцессы Потрие). Фиброз и/или отек сосочковой части дермы. | ||
| Синдром Сезари | Наличие клеток Сезари в исследуемом материале |
Алгоритм гистологическрй дифференциальной диагностики классической лимфомы Ходжкина и Т-клечных лимфом
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Лимфома Ходжкина | Немотивированные лихорадки , лимфоаденопатия и органомегалия | Гистология | В биоптатах лимфоузлов больных с ЛХ удается обнаружить большое количество клеток БШ, эозинофилов и гранулоцитов, при ИФТ СD30 и CD15 позитивны |
| Неходжкинские лимфомы | Гистология | Картина лимфоузла менее полиморфна и состоит из лимфоидных элементов преимущественно высокой, промежуточной или высокой степени зрелости, многие из которых имеют свой характерный иммунофенотип и кариотип | |
| АИЛ | Гистология | Присутствие крупных бластных клеток с морфологией центробластов/иммунобластов | |
| ПТКЛн | Гистология | Чаще всего преобладают клетки среднего и крупного размера с неправильной формой ядер, хроматин бывает мелкодисперсным или гиперхромным, вкрупных клетках прослеживаются ядрышки. В части наблюдений основную массу составляют клетки мелкого размера. Полиморфный инфильтрат включает реактивные элементы (эозинофильные гранулоциты, плазматические клетки, эпителиоидные гистиоциты). | |
| АКЛК | Гистология | клеток с эксцентрично расположенным ядром подковообразной или почкообразной формы и эозинофильно окрашенной зоной в парануклеарной области цитоплазмы. |
Лечение
Препараты (действующие вещества), применяющиеся при лечении
| Алюминия гидроксид (Aluminium hydroxide) |
| Губка гемостатическая |
| Азитромицин (Azithromycin) |
| Аллопуринол (Allopurinol) |
| Альбумин человека (Albumin human) |
| Амикацин (Amikacin) |
| Аминофиллин (Aminophylline) |
| Амиодарон (Amiodarone) |
| Амлодипин (Amlodipine) |
| Амоксициллин (Amoxicillin) |
| Амфотерицин B (Amphotericin B) |
| Анидулафунгин (Anidulafungin) |
| Антиингибиторный коагулянтный комплекс (Antiingibitorny coagulant complex) |
| Аспарагиназа (Asparaginase) |
| Атенолол (Atenolol) |
| Атракурия бесилат (Atracurium besylate) |
| Атропин (Atropine) |
| Ацикловир (Acyclovir) |
| Белиностат (Belinostat)) |
| Бендамустин (Bendamustine) |
| Бетаметазон (Betamethasone) |
| Брентуксимаб ведотин (Brentuximab Vedotin) |
| Бупивакаин (Bupivacaine) |
| Валацикловир (Valacyclovir) |
| Валганцикловир (Valganciclovir) |
| Ванкомицин (Vancomycin) |
| Варфарин (Warfarin) |
| Винбластин (Vinblastine) |
| Виндезин (Vindesine) |
| Винкристин (Vincristine) |
| Винорелбин (Vinorelbine) |
| Вода для инъекций (Water for Injection) |
| Вориконазол (Voriconazole) |
| Вориностат (Vorinostat) |
| Ганцикловир (Ganciclovir) |
| Гемцитабин (Gemcitabine) |
| Гентамицин (Gentamicin) |
| Гепарин натрия (Heparin sodium) |
| Гидроксиэтилкрахмал (Hydroxyethyl starch) |
| Далтепарин (Dalteparin) |
| Даунорубицин (Daunorubicin) |
| Дексаметазон (Dexamethasone) |
| Декстроза (Dextrose) |
| Диазепам (Diazepam) |
| Дифенгидрамин (Diphenhydramine) |
| Добутамин (Dobutamine) |
| Доксорубицин (Doxorubicin) |
| Допамин (Dopamine) |
| Изотретиноин (Isotretinoin) |
| Имипенем (Imipenem) |
| Иммуноглобулин человеческий нормальный (Human normal immunoglobulin) |
| Инсулин человеческий (Insulin human) |
| Интерферон альфа (Interferon alfa) |
| Итраконазол (Itraconazole) |
| Ифосфамид (Ifosfamide) |
| Калия хлорид (Potassium chloride) |
| Кальция глюконат (Calcium gluconate) |
| Кальция фолинат (Calcium folinate) |
| Кальция хлорид (Calcium chloride) |
| Каптоприл (Captopril) |
| Карбоплатин (Carboplatin) |
| Каспофунгин (Caspofungin) |
| Кетамин (Ketamine) |
| Кетопрофен (Ketoprofen) |
| Клавулановая кислота (Clavulanic acid) |
| Клотримазол (Clotrimazole) |
| Колистиметат натрия (Colistimethate sodium) |
| Лактулоза (Lactulose) |
| Левофлоксацин (Levofloxacin) |
| Леналидомид (Lenalidomide) |
| Лидокаин (Lidocaine) |
| Лизиноприл (Lisinopril) |
| Линезолид (Linezolid) |
| Магния сульфат (Magnesium sulfate) |
| Маннитол (Mannitol) |
| Меропенем (Meropenem) |
| Месна (Mesna) |
| Метилпреднизолон (Methylprednisolone) |
| Метилурацил (Диоксометилтетрагидропиримидин) (Methyluracil (Dioxomethyltetrahydropyrimidine)) |
| Метотрексат (Methotrexate) |
| Метронидазол (Metronidazole) |
| Микафунгин (Micafungin) |
| Митоксантрон (Mitoxantrone) |
| Моксифлоксацин (Moxifloxacin) |
| Мометазон (Mometasone) |
| Морфин (Morphine) |
| Надропарин кальция (Nadroparin calcium) |
| Натрия ацетат (Sodium acetate) |
| Натрия гидрокарбонат (Sodium hydrocarbonate) |
| Натрия фолинат (Sodium folinate) |
| Натрия хлорид (Sodium chloride) |
| Норэпинефрин (Norepinephrine) |
| Оксалиплатин (Oxaliplatin) |
| Омепразол (Omeprazole) |
| Ондансетрон (Ondansetron) |
| Офлоксацин (Ofloxacin) |
| Памидроновая кислота (Pamidronic acid) |
| Пипекурония бромид (Pipekuroniyu bromide) |
| Пиперациллин (Piperacillin) |
| Повидон — йод (Povidone — iodine) |
| Пралатрексат (Pralatrexate) |
| Преднизолон (Prednisolone) |
| Преднизон (Prednisone) |
| Прокарбазин (Procarbazine) |
| Пропофол (Propofol) |
| Проспидия хлорид (Prospidium chloride) |
| Ритуксимаб (Rituximab) |
| Рокурония бромид (Rocuronium) |
| Сальбутамол (Salbutamol) |
| Смеси для энтерального питания |
| Спиронолактон (Spironolactone) |
| Сульфаметоксазол (Sulphamethoxazole) |
| Тазобактам (Tazobactam) |
| Талидомид (Thalidomide) |
| Тикарциллин (Ticarcillin) |
| Тинзапарин натрия (Tinzaparin sodium) |
| Тиопентал-натрий (Thiopental sodium) |
| Тобрамицин (Tobramycin) |
| Торасемид (Torasemide) |
| Трамадол (Tramadol) |
| Триметоприм (Trimethoprim) |
| Фамотидин (Famotidine) |
| Фамцикловир (Famciclovir) |
| Фенилэфрин (Phenylephrine) |
| Фенобарбитал (Phenobarbital) |
| Фентанил (Fentanyl) |
| Филграстим (Filgrastim) |
| Флударабин (Fludarabine) |
| Флуконазол (Fluconazole) |
| Фолиевая кислота (Folic acid) |
| Фондапаринукс натрия (Fondaparinux sodium) |
| Фуросемид (Furosemide) |
| Хлорамбуцил (Chlorambucil) |
| Хлоргексидин (Chlorhexidine) |
| Цефепим (Cefepime) |
| Цефоперазон (Cefoperazone) |
| Циклофосфамид (Cyclophosphamide) |
| Циластатин (Cilastatin) |
| Ципрофлоксацин (Ciprofloxacin) |
| Цисплатин (Cisplatin) |
| Цитарабин (Cytarabine) |
| Эноксапарин натрия (Enoxaparin sodium) |
| Эпинефрин (Epinephrine) |
| Эритромицин (Erythromycin) |
| Эртапенем (Ertapenem) |
| Этопозид (Etoposide) |
| Этретинат (Etretinate) |
Группы препаратов согласно АТХ, применяющиеся при лечении
| (A10AB) Инсулины и их аналоги короткого действия |
Лечение (амбулатория)
ЛЕЧЕНИЕ НА АМБУЛАТОРНОМ УРОВНЕ [4,5,6,7]
Тактика лечения:
Тактика лечения на амбулаторном уровне для первичных пациентов сводится к выявлению лимфопролиферативного заболевания и верификации диагноза (если позволяет соматический статус пациента). Для пациентов с установленным диагнозом амбулаторное лечение сводится к низкотоксичным курсам и химиотерапии и лучевой терапии.
Немедикаментозное лечение:
Режим:общеохранительный.
Диета: нейтропеническим пациентам не рекомендуется соблюдать определенную диету (УД В)[8,9,10,11,12,13]:
Медикаментозное лечение:На этапе дообследования, по индивидуальным показаниям возможно проведение симптоматической терапии.
После верификации: применение низкотоксичных курсов ХТ и лучевой терапии.
Перечень основныхлекарственных средств: антинеопластические, иммуносупрессивные и антибактериальные лекарственные средства
Антинеопластические и иммуносупрессивные лекарственные средства:
· аспарагиназа, лиофилизат для приготовления раствора для в/в и в/м введения, 10000 МЕ;
· белиностат*, концентрат для приготовления раствора для инфузий 500 мг;
· бендамустин, порошок для приготовления раствора для инъекций 25мг, 100 мг;
· бетаметазона диприпионат*,мазь для наружного применения 0.05%; туба алюминиевая 15г, 30г;
· брентуксимаб ведотин, порошок для приготовления раствора для инъекций 50 мг;
· винбластин, лиофилизат для приготовления раствора для в/в введения 5 мг;
· виндезин* — лиофилизированный порошок для инъекционных растворов во флаконах по 1 мг и 5 мг;
· винкристин, 1 мг, для инъекций;
· винорельбин, концентрат для приготовления раствора для в/в инфузий 10 мг/1 мл, 50 мг/5 мл; капсулы мягкие 20 мг, 30 мг;
· гемцитабин, лиофилизат для приготовления раствора для инфузий 1500мг, 1000 мг, 200 мг;
· даунорубицин, порошок лиофилизированный для приготовления раствора для инъекций или раствор для в/в введения 20мг;
· дексаметазон, раствор для инъекций 4мг/мл 1 мл;
· доксорубицин, для инфузий, 10мг и 50 мг;
· изотретионин, капсулы 8мг, 16 мг;
· интерферон альфа, раствор для инъекций 3 млн МЕ/мл, 6 млн МЕ/мл
· ифосфамид*, порошок для приготовления раствора для инъекций 1000мг;
· карбоплатин, концентрат для приготовления раствора для внутривенных инфузий 150мг/15мл, 450мг/45мл;
· карбоплатин, раствор для инъекций 150мг/15мл, 450мг/45мл; концентрат для приготовления раствора для инфузий 10 мг/мл, 150 мг/15 мл;
· леналидомид, капсулы 5 мг, 10 мг, 15 мг и 25 мг;
· метилпреднизолон, порошок для приготовления раствора для в/в инфузий, 250 мг;
· метотрексат, раствор для инъекций10 мг/ 0,5мл, 15 мг/0,75 мл, 50 мг/мл, таблетки 2,5 мг;
· митоксантрон, концентрат для приготовления раствора для в/в инфузий 10 мг/5 мл, 20 мг/10 мл, 25 мг/12,5 мл, 30 мг/15 мл;
· мометазона фуорат, мазь 0,1% , крем для наружного применения 1мг/г;
· оксалиплатин,лиофилизат/порошок для приготовления раствора для инъекций 50 мг и 100 мг;
· пегилированный липосомальный доксорубицин*, концентрат для приготовления раствора для в/в введения 20 мг/10 мл, 50мг/25мл;
· преднизолон*, раствор для инъекций 30мг/мл, таблетки 5 мг;
· преднизон*, таблетки 1 мг, 5 мг, 20 мг, 50мг;
· прокарбазин *, капсулы 50 мг;
· ритуксимаб, концентрат для приготовления раствора для в/в инфузий 10мг/50мл, 10мг/10мл;
· талидомид*, таблетки 25 мг, 50 мг, 100 мг;
· флударабин, лиофилизат для приготовления раствора для в/в введения 50 мг;
· циклофосфамид, лиофилизат/порошок для приготовления раствора для инъекций 200 мг, 500 мг, 1000 мг;
· цисплатин*, концентрат для приготовления раствора для инфузий 0,5 мг/мл, 50 мг/100 мл;
· цитарабин, порошок лиофилизированный для приготовления раствора для инъекций 100 мг, 1000 мг;
· этопозид, концентрат для приготовления раствора для в/в инфузий 100 мг/5 мл;
· этретинат*, Капсулы 10 мг, 25 мг.
Перечень дополнительных лекарственных средств:
Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов:
· филграстим, раствор для инъекций 0,3мг/мл,1 мл;
· трамадол 50мг, капсулы;
· ондансетрон, раствор для инъекций 8 мг/4мл;
· омепразол, капсула 20 мг;
Антибактериальные средства:
· амоксициллин/клавулановая кислота, таблетка, покрытая пленочной оболочкой, 1000мг;
· моксифлоксацин, таблетка, 400 мг;
· офлоксацин, таблетка, 400 мг;
· ципрофлоксацин таблетка, 500 мг;
· эритромицин, таблетка 250мг;
Противогрибковые лекарственные средства – по показаниям:
· анидулафунгин, лиофилизированный порошок для приготовления раствора для инъекций, 100 мг/флакон (не представлен в КНФ);
· вориконазол, таблетка, 50 мг (не представлен в КНФ);
· итраконазол, раствор для приема внутрь10мг/мл 150,0;
· каспофунгин, лиофилизат для приготовления раствора для инфузий 70 мг (после регистрации);
· клотримазол, раствор для наружного применения 1% 15мл;
· метронидазол, таблетка, 250 мг;
· микафунгин, порошок лиофилизированный для приготовления раствора для инъекций 50 мг,100 мг;
· флуконазол, капсула/таблетка 150 мг;
Противовирусные лекарственные средства – по показаниям:
· ацикловир, таблетка, 400 мг;
· валацикловир, таблетка, 500мг;
· вальганцикловир, таблетка, 450мг;
· вориконазол, таблетка, 50 мг;
· ганцикловир*, лиофилизат для приготовления раствора для инфузий 500мг;
· фамцикловир, таблетки, 500мг №14.
Лекарственные средства, применяемые при пневмоцистозе:
· сульфаметоксазол/триметоприм, таблетка 480 мг;
Дополнительные иммуносупрессивные лекарственные средства:
· дексаметазон, раствор для инъекций 4мг/мл 1 мл; (для люмбальных пункций)
· метилпреднизолон, таблетка, 16 мг;
· преднизолон, раствор для инъекций 30 мг/мл 1мл,таблетка, 5 мг.
Растворы, применяемые для коррекции нарушений водного, электролитного и кислотно-основного баланса:
· вода для инъекций, раствор для инъекций 5мл;
· декстроза, раствор для инфузий 5% 250мл;
· натрия хлорид, раствор для инфузий 0,9% 500мл;
Лекарственные средства, влияющие на свертывающую систему крови:
· гепарин, раствор для инъекций 5000 МЕ/мл, 5 мл;
· надропарин, раствор для инъекций в предварительно наполненных шприцах, 2850 МЕ анти-Ха/0,3 мл, 5700 МЕ анти-Ха/0,6 мл;
· эноксапарин, раствор для инъекций в шприцах 4000 анти-Ха МЕ/0,4 мл,8000 анти-Ха МЕ/0,8 мл.
Другие лекарственные средства:
· амлодипин, таблетка/капсула 5 мг;
· атенолол, таблетка 25мг;
· ацикловир, крем для наружного применения, 5% — 5,0;
· гепарин, гель в тубе 100000ЕД 50г;
· дексаметазон, капли глазные 0,1% 8 мл;
· дифенгидрамин, раствор для инъекций 1% 1 мл;
· инсулин человеческий 100ЕД;
· каптоприл, таблетка 50мг;
· кетопрофен, раствор для инъекций 100 мг/2мл;
· клотримазол, крем для наружного применения 1% 30г;
· лактулоза, сироп 667г/л по 500 мл;
· левофлоксацин, таблетка, 500 мг;
· лидокаин, раствор для инъекций, 2% по 2 мл;
· лизиноприл, таблетка 5мг;
· метронидазол, гель стоматологический 20г;
· омепразол, капсула 20 мг;
· повидон – йод, раствор для наружного применения 1 л;
· сальбутамол, раствор для небулайзера 5мг/мл-20мл;
· спиронолактон, капсула 100 мг;
· тобрамицин, капли глазные 0,3% 5мл
· торасемид, таблетка 10мг;
· фентанил, система терапевтическая трансдермальная 75 мкг/ч; (для лечения хронических болей у онкологических больных)
· хлоргексидин, раствор 0,05% 100мл;
Другие виды лечения: нет.
Показания для консультации специалистов:
· консультация онколога – при подозрении на лимфопролиферативные заболевания;
· консультации других узких специалистов – по показаниям.
Профилактические мероприятия:
Профилактика послеоперационных, цитотоксических, постлучевых осложнений – сопроводительная терапия (антибактериальная, антиэметогенная, колониестимулирующая, дезинтоксикационная, дегидратационная, гормонотерапия и т.д.).
Мониторинг состояния пациента:
· оказание консультативной и диагностической помощи больным со ЗНО и с подозрением на них и, при необходимости, направление больного в онкологический диспансер;
· лечение в соответствии со стандартами оказания медицинской помощи больным со ЗНО;
· диспансерное наблюдение за больными со ЗНО и некоторыми формами предопухолевых заболеваний;
· консультации и патронаж на дому больных со ЗНО (по показаниям);
· контроль за своевременной госпитализацией больных для специального, паллиативного и симптоматического лечения, анализ причин отказов от госпитализации;
· анализ и разбор диагностических ошибок с врачами амбулаторно-поликлинических учреждений;
· методическая помощь врачам общей сети по организации профилактических осмотров, диспансеризации больных с предопухолевыми и хроническими заболеваниями, санитарно-просветительной работы среди населения;
· в день установления диагноза направляется учетная форма “Извещение о больном впервые в жизни установленным диагнозом злокачественного новообразования”в онкологическое учреждение регионального уровня (областное, республиканское, краевое) по месту постоянного жительства больного в 3-дневный срок с момента заполнения.
Индикаторы эффективности лечения:
Для первичных пациентов:
· своевременное направление пациента в специализированное учреждение.
Для пациентов получающих химиотерапию:
· эффективность лечения оценивается по критериям Lugano (смотреть Приложение 4, настоящего КП)
Лечение (скорая помощь)
ДИАГНОСТИКА И ЛЕЧЕНИЕ НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ[5]
Диагностические мероприятия: сбор жалоб и анамнеза.
Медикаментозное лечение: симптоматическая терапия.
Лечение (стационар)
ЛЕЧЕНИЕ НА СТАЦИОНАРНОМ УРОВНЕ
Тактика лечения
Грибовидный микоз[14]
При назначении терапии ГМ рекомендовано соблюдать следующие принципы:
· подходы к лечению определяются массой опухоли и скоростьюпрогрессии;
· по возможности необходимо избегать подавления иммунногоответа;
· при необходимости системного лечения предпочтительно назначение иммуномодулирующей терапии, а нехимиотерапии;
· комбинированная или мультимодальная (например, сочетание системной иммуномодулирующей и наружной) терапия более эффективна, чем любаямонотерапия;
· своевременная диагностика и лечение инфекционных осложнений (иногда даже при отсутствии клинических признаков инфекционного процесса на коже) приводит к улучшению состоянияпациента;
· большое значение имеет лечение зуда, значительно снижающего качество жизни.
Синдром Сезари [14]
Выбор вида терапии при СС должен базироваться на определении степени тяжести заболевания (учитываются степень инфильтрации кожи, наличие/отсутствие кожных узлов, выраженность лимфаденопатии, степень интенсивности вовлечения крови, уровень повышения ЛДГ и лейкоцитов в периферической крови), скорости его прогрессирования и влияния на качество жизни пациента.
Другие Т-клеточные лимфомы [4,15]
Лечебная тактика определяется распространенностью (стадией) заболевания, морфологическим вариантом/пролиферативной фракцией опухоли, возрастом и соматическим статусом пациента. Определяющим в стратификации пациентов является возможность проведения высокодозной индукционной ПХТ/консолидации аутологичной ТСКК.

Алгоритм 1. Инициальная терапия для ПТКЛ

Алгоритм 2. Лечение рецидивирующих и рефрактерных ПТКЛ
Немедикаментозное лечение:
· Режим: общеохранительный.
· Диета:Стол №15. Нейтропеническим пациентам не рекомендуется соблюдать определенную диету (УДВ).
При почечной недостаточности используется диета №7[8,9,10,11,12,13].
Медикаментозное лечение:
Перечень основных лекарственных средств:
Антинеопластические и иммуносупрессивные лекарственные средства:
· аспарагиназа, лиофилизат для приготовления раствора для вв и вм введения, 10000 МЕ
· белиностат*, концентрат для приготовления раствора для инфузий 500 мг ;
· бендамустин, порошок для приготовления раствора для инъекций 25мг, 100 мг;
· бентаметазона дипропионат*, мазь для наружного применения 0.05%; туба алюминиевая 15г, 30г;
· брентуксимаб ведотин, порошок для приготовления раствора для инъекций 50 мг;
· винбластин, лиофилизат для приготовления раствора для внутривенного введения 5 мг;
· виндезин* — лиофилизированный порошок для инъекционных растворов во флаконах по 1 мг и 5 мг;
· винкристин, 1 мг, для инъекций;
· винорельбин, концентрат для приготовления раствора для внутривенных инфузий 10 мг/1 мл, 50 мг/5 мл; капсулы мягкие 20 мг, 30 мг;
· вориностат*, капсулы 100 мг;
· гемцитабин, лиофилизат для приготовления раствора для инфузий 1500мг, 1000 мг, 200 мг;
· даунорубицин, порошок лиофилизированный для приготовления раствора для инъекций или раствор для внутривенного введения 20мг;
· дексаметазон, раствор для инъекций 4мг/мл 1 мл;
· доксорубицин, для инфузий, 10мг и 50 мг;
· изотретионин, капсулы 8мг, 16 мг
· интерферон альфа, раствор для инъекций 3 млн МЕ/мл, 6 млн МЕ/мл
· ифосфамид*, порошок для приготовления раствора для инъекций 1000мг;
· карбоплатин, концентрат для приготовления раствора для внутривенных инфузий 150мг/15мл, 450мг/45мл
· карбоплатин, раствор для инъекций 150мг/15мл, 450мг/45мл; концентрат для приготовления раствора для инфузий 10 мг/мл, 150 мг/15 мл;
· леналидомид, капсулы 5 мг, 10 мг, 15 мг и 25 мг;
· метилпреднизолон, порошок для приготовления раствора для внутривенных инфузий, 250 мг;
· метотрексат, раствор для инъекций10 мг/ 0,5мл, 15 мг/0,75 мл, 50 мг/мл, таблетки 2.5 мг
· митоксантрон, концентрат для приготовления раствора для внутривенных инфузий 10 мг/5 мл, 20 мг/10 мл, 25 мг/12,5 мл, 30 мг/15 мл;
· мометазона фуорат, мазь 0,1% , крем для наружного применения 1мг/г
· оксалиплатин, лиофилизат/порошок для приготовления раствора для инъекций 50 мг и 100 мг
· пегилированный липосомальный доксорубицин*, концентрат для приготовления раствора для внутривенного введения 20 мг/10 мл, 50мг/25мл;
· пралатрексат*, концентрат для приготовления раствора для инфузий 20 мг, 40 мг
· преднизолон*, раствор для инъекций 30мг/мл, таблетки 5 мг;
· прокарбазин *, капсулы 50 мг;
· проспидин*, субстанция-порошок 0,5-2 кг;
· ритуксимаб, концентрат для приготовления раствора для внутривенных инфузий 10мг/50мл, 10мг/10мл;
· талидомид*, таблетки 25 мг, 50 мг, 100 мг;
· флударабин, лиофилизат для приготовления раствора для внутривенного введения 50 мг
· циклофосфамид, лиофилизат/порошок для приготовления раствора для инъекций 200 мг, 500 мг, 1000 мг;
· цисплатин*, концентрат для приготовления раствора для инфузий 0.5 мг/мл, 50 мг/100 мл;
· цитарабин, порошок лиофилизированный для приготовления раствора для инъекций 100 мг, 1000 мг;
· этопозид, концентрат для приготовления раствора для внутривенных инфузий 100 мг/5 мл.
Перечень дополнительных лекарственных средств:
Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов:
· кальция фолинат ИЛИ натрия фолинат, раствор
· омепразол, порошок лиофилизированный для приготовления раствора для инъекций 40 мг;
· ондансетрон, раствор для инъекций 8 мг/4мл;
· памидроновая кислота 90мг/10мл *,концентрат для приготовления раствора для инфузий;
· трамадол 100мг/2 мл, раствор для инъекций (после регистрации);
· урометиксан, растовор для инъекций 400 мг;
· фамотидин, порошок лиофилизированный для приготовления раствора для инъекций 20 мг;
· филграстим, раствор для инъекций 0,3мг/мл,1 мл.
Антибактериальные средства:
· азитромицин, таблетка/капсула, 500 мг; порошок лиофилизированный для приготовления раствора для внутривенных инфузий, 500 мг;
· амикацин, порошок для инъекций, 500 мг/2 мл или порошок для приготовления раствора для инъекций, 0,5 г;
· амоксициллин/клавулановая кислота, таблетка, покрытая пленочной оболочкой, 1000мг;порошок для приготовления раствора для внутривенного и внутримышечного введения 1000 мг+500 мг;
· ванкомицин, порошок/лиофилизат для приготовления раствора для инфузий 1000 мг;
· гентамицин, раствор для инъекций 80мг/2мл;
· имипинем, циластатин порошок для приготовления раствора для инфузий, 500 мг/500 мг;
· левофлоксацин, раствор для инфузий 500 мг/100 мл;таблетка, 500 мг;
· линезолид,раствор для инфузий2 мг/мл;
· меропенем, лиофилизат/порошок для приготовления раствора для инъекций 1,0 г;
· моксифлоксацин, таблетка, 400 мг;раствор для инфузий 400 мг/250 мл
· офлоксацин, таблетка, 400 мг;раствор для инфузий 200 мг/100 мл;
· пиперациллин, тазобактам порошок для приготовления раствора для инъекций 4,5г;
· тикарциллин/клавулановая кислота, порошок лиофилизированный для приготовления раствора для инфузий 3000мг/200мг;
· цефепим, порошок для приготовления раствора для инъекций 500 мг;1000 мг;
· цефоперазон, сульбактам порошок для приготовления раствора для инъекций 2 г;
· ципрофлоксацин, раствор для инфузий 200 мг/100 мл, 100 мл; таблетка, 500 мг;
· эритромицин, таблетка 250мг;
· эртапенем лиофилизат, для приготовления раствора для внутривенных и внутримышечных инъекций 1 г.
Противогрибковые лекарственные средства:
· амфотерицин В*,лиофилизированный порошок для приготовления раствора для инъекци, 50 мг/флакон;
· анидулофунгин, лиофилизированный порошок для приготовления раствора для инъекций, 100 мг/флакон;
· вориконазол,порошок для приготовления раствора для инфузий 200 мг/флакон;таблетка, 50 мг;
· итраконазол, раствор для приема внутрь10 мг/мл 150,0;
· каспофунгин,лиофилизат для приготовления раствора для инфузий 50 мг;
· колистиметат натрия*, лиофилизат для приготовления раствора для инфузий 1 млн ЕД/флакон;
· метронидазол, таблетка, 250 мг;раствор для инфузий 0,5% 100мл;
· микафунгин, порошок лиофилизированный для приготовления раствора для инъекций 50 мг, 100 мг;
· флуконазол, капсула/таблетка 150 мг;раствор для инфузий 200 мг/100 мл, 100 мл.
Противовирусные лекарственные средства:
· ацикловир, крем для наружного применения, 5% — 5,0; таблетка, 400 мг;порошок для приготовления раствора для инфузий, 250 мг;
· валацикловир, таблетка, 500 мг;
· вальганцикловир , таблетка, 450 мг;
· ганцикловир*, лиофилизат для приготовления раствора для инфузий 500мг;
· фамцикловир, таблетки,500мг №14.
Лекарственные средства, применяемые при пневмоцистозе:
· сульфаметоксазол/триметоприм, концентрат для приготовления раствора для инфузий (80 мг+16 мг)/мл, 5 мл;таблетка 480 мг.
Дополнительные иммуносупрессивные лекарственные средства:
· дексаметазон, раствор для инъекций 4 мг/мл 1 мл;
· метилпреднизолон, таблетка, 16 мг;
· преднизолон, раствор для инъекций 30 мг/мл 1мл;таблетка, 5 мг.
Растворы, применяемые для коррекции нарушений водного, электролитного и кислотно-основного баланса, парентерального питания:
· альбумин, раствор для инфузий 10 % — 100 мл, 20 % — 100 мл;
· вода для инъекций, раствор для инъекций 5 мл;
· декстроза, раствор для инфузий 5% — 250 мл, 500 мл;
· декстроза, раствор для инъекций 40% — 10 мл, 20 мл;
· калия хлорид, раствор для внутривенного введения 40 мг/мл, 10 мл;
· кальция глюконат, раствор для инъекций 10%, 5 мл;
· кальция хлорид,раствор для инъекций 10% 5 мл;
· магния сульфат, раствор для инъекций 25% 5 мл;
· маннитол, раствор для инъекций 15%-200,0;
· натрия хлорид, раствор для инфузий 0,9% — 250 мл, 500 мл;
· натрия хлорид, калия хлорид, натрий уксуснокислый раствор для инфузий во флаконе 200 мл, 400 мл;
· натрия хлорид, калия хлорид, натрия ацетат раствор для инфузий 200 мл, 400 мл;
· натрия хлорид, калия хлорид, натрия гидрокарбонат раствор для инфузий 400мл;
· гидроксиэтилкрахмал (пентакрахмал), раствор для инфузий 6 % 500 мл;
· нутрикомп* 500 мл в контейнерах.
Лекарственные средства, применяемые для проведения интенсивной тепрапии (кардиотонические средства для лечения септического шока, миорелаксанты, вазопрессоры и средства для наркоза):
· аминофиллин, раствор для инъекций 2,4%, 5 мл;
· амиодарон, раствор для инъекций, 150 мг/3 мл;
· атракурий безилат, раствор для инъекций, 25 мг/2,5 мл;
· атропин, раствор для инъекций, 1 мг/ мл;
· диазепам, раствор для внутримышечного и внутривенного применения 5 мг/мл 2 мл;
· добутамин*,раствор для инъекций 250 мг/50,0 мл;
· допамин, раствор/концентрат для приготовления раствора для инъекций 4% , 5 мл;
· инсулин простой;
· кетамин, раствор для инъекций 500 мг/10 мл;
· морфин, раствор для инъекций 1% 1 мл;
· норэпинефрин*,раствор для инъекций 20 мг/мл 4,0;
· пипекурония бромид, порошок лиофилизированный для инъекций 4 мг;
· пропофол,эмульсия для внутривенного введения 10 мг/мл — 20 мл, 50 мл;
· рокурония бромид, раствор для внутривенного введения 10 мг/мл, 5 мл;
· тиопентал натрий, порошок для приготовления раствора для внутривенного введения 500мг;
· фенилэфрин, раствоp для инъекций 1% 1мл;
· эпинефрин, раствор для инъекций 0,18 % 1 мл.
Лекарственные средства, влияющие на свертывающую систему крови:
· антиингибиторный коагулянтный комплекс, лиофилизированный порошок для приготовления инъекционного раствора, 500 МЕ;
· гепарин, раствор для инъекций 5000 МЕ/мл — 5 мл, гель в тубе 100000 ЕД 50г;
· губка гемостатическая, размер 7*5*1;
· губка гемостатическая рассасывающаяся, размер 8*3;
· надропарин, раствор для инъекций в предварительно наполненных шприцах, 2850 МЕ анти-Ха/0,3 мл, 5700 МЕ анти-Ха/0,6 мл;
· эноксапарин, раствор для инъекций в шприцах 4000 анти-Ха МЕ/0,4 мл, 8000 анти-Ха МЕ/0,8 мл.
Другие лекарственные средства:
· амлодипин, таблетка/капсула 5 мг;
· атенолол, таблетка 25мг;
· бупивакаин, раствор для инъекций 5 мг/мл, 4 мл;
· гепарин, гель в тубе 100000 ЕД 50г;
· дексаметазон, капли глазные 0,1% , 8 мл;
· дифенгидрамин, раствор для инъекций 1% 1 мл;
· иммуноглобулин человека нормальный [IgG+IgA+IgM]раствор для внутривенного введения 50 мг/мл- 50 мл;
· каптоприл,таблетка 50 мг;
· кетопрофен, раствор для инъекций 100 мг/2 мл;
· лактулоза, сироп 667 г/л по 500 мл;
· лидокаин, раствор для инъекций, 2% по 2 мл;
· лизиноприл, таблетка 5мг;
· метилурацил, мазь для местного применения в тубе 10% 25 г;
· метронидазол, гель стоматологический 20 г;
· омепразол, капсула 20 мг,порошок лиофилизированный для приготовления раствора для инъекций 40 мг;
· повидон– йод, раствор для наружного применения 1 л;
· сальбутамол, раствор для небулайзера 5 мг/мл-20 мл;
· спиронолактон,капсула 100 мг;
· тобрамицин, капли глазные 0,3% 5 мл
· торасемид,таблетка 10 мг;
· трамадол, раствор для инъекций 100 мг/2 мл,раствор для приема внутрь (капли) 100 мг/1 мл 10 мл(после регистрации);
· трамадол, таблетки 50 мг;
· фамотидин, порошок лиофилизированный для приготовления раствора для инъекций 20 мг;
· фенобарбитал, таблетка 100 мг;
· фентанил, система терапевтическая трансдермальная 75 мкг/ч (для лечения хронических болей у онкологических больных) ;
· фолиевая кислота, таблетка, 5 мг;
· фуросемид, раствор для инъекций 1% 2 мл;
· хлоргексидин, раствор 0,05% 100 мл
Грибовидный микоз(УД С-D) [14]
Терапия ранних стадий (IA—IIA) ГМ.
Для пациентов в IA стадии с небольшими очагами поражения кожи допускается тактика «наблюдай и жди» под строгим наблюдением врача.
У пациентов с IA, IB и IIA стадиями используются следующие виды наружней терапии(НТ):
· топические кортикостероиды (класс I, бетаметазона дипропионат 0,05% или мометазона фуорат 0,1%) наносятся на поверхность высыпаний 2 раза в день до полногоразрешения.
· узковолновое ультрафиолетовое облучение (УФО) спектра В. Облучение проводится 2-3 раза в неделю, первая экспозиция должна быть не более 70% от ранее определенной минимальной эритемной дозы. Последующие экспозиции проводятся следующим образом: при отсутствии эритемы – время экспозиции увеличивается на 40%, при слабой эритеме – на 20%, при выраженной эритеме – остается тем же. Рекомендовано для пятен итонких бляшек. Непосредственные побочные эффекты – эритема, зуд, ощущениежжения.
· ПУВА-терапия (псорален + ультрафиолетовое облучение (УФО) спектра А). За 2 часа до облучения пациент принимает перорально 8-метоксипсорален в дозе 0,6 мг/кг, начальная доза облучения зависит от типа кожи (0.25-1.0 Дж/см2), затем с каждым сеансом доза повышается на 0,25-0,5 Дж/см2 или более в зависимости от выраженности эритемы. Лечение проводится 3-4 раза в неделю до разрешения высыпаний (30-35 сеансов). Общая доза варьирует от 50 до 80 Дж/см2, что бывает достаточным для достижения клинической ремиссии. Применяется при распространенных и более инфильтрированных элементах, фолликулярной форме ГМ. Побочные эффекты включают эритему, тошноту, зуд, фотодерматит ифотокарциногенез.
При отсутствии или недостаточном эффекте НТ в качестве второй линии при ранних стадиях ГМ могут использоваться:
· ретиноиды (13-цис-ретиноевая кислота (изотретиноин, этретинат) в дозе 0,5–1 мг/кг массы тела в течение 2–3 месяцев, могут назначаться в комбинации с ПУВА,IFN-α.
· интерферон-α (IFN-α) также может использоваться как препарат первой линии для IIB, III и СС и эффективен в умеренно высоких дозах: 3-10 МЕ ежедневно или 3 раза в неделю. Можно комбинировать с ПУВА, ретиноидами ихимиотерапией.
· метотрексат назначают в дозах от 25 до 75 мг в неделю, можно комбинировать сIFN-α.
Терапия поздних стадий (IIB—IVB) ГМ(УД С-D) [14].
Для лечения поздних стадий применяются:
· ингибиторы гистондеацетилаз (HDAC). Вориностат назначается перорально по 400 мг ежедневно.назначается перорально по 400 мг ежедневно. Лечение проводят до достижения полного контроля (отсутствие признаков дальнейшего прогрессирования) или до появления признаков неприемлемойтоксичности.
· электронно-лучевая терапия является крайне эффективным методом лечения ГМ/СС и может применяться как при ранних, так и при поздних стадиях как терапия первой линии и при рецидивах/прогрессированиизаболевания
· в качестве системной химиотерапии может применяться монотерапия циклофосфамидом или гемцитабином или режимы, применяемые для лечения нодальных лимфом: CHOP, EPOCH, CMED/ABV, флударабин +IFN-α.
Рецидивы ГМ(УД С-D) [14].
При рецидиве или прогрессировании ГМ необходимо выполнять повторную биопсию кожи для исключения крупноклеточной трансформации, при необходимости – повторную процедуру стадирования. Тактика лечения рецидивов также базируется на определении стадии заболевания, учитывается развитие резистентности к предыдущим видамтерапии.
Синдром Сезари(УД С-D) [14]
При назначении терапии рекомендовано соблюдать теже принципы, которые лежат в основе лечения ГМ:
· подходы к лечению определяются массой опухоли и скоростьюпрогрессии.
· по возможности необходимо избегать подавления иммунного ответа
· при необходимости системного лечения предпочтительно назначение иммуномодулирующей терапии, а не химиотерапии.
· комбинированная или мультимодальная (например, сочетание системной иммуномодулирующей терапии и наружной).
· своевременная диагностика и лечение инфекционных осложнений (иногда даже при отсутствии клинических признаков инфекционного процесса на коже) приводит к улучшению состояния пациента.
· большое значение имеет лечение зуда, значительно снижающего качество жизни.
Терапия первой линии(УД С-D) [14]
Наиболее эффективным методом первой линии терапии в настоящее время у пациентов с СС является экстракорпоральный фотоферез (ЭКФ). Перед проведением ЭКФ необходимо определить циркулирующий клон Т-лимфоцитов в крови. ЭКФ не показан пациентам с поражением л/у и висцеральных органов (стадии IVA и IVB). Сеансы проводят один раз в день в течение 2-х дней с 4-х недельным перерывом. Для устранения отрицательного воздействия на организм фотоокисленных продуктов в период проведения фотофереза рекомендуется назначение антиоксидантов (токоферола, бета- каротина, селена).
Интерферон-α (IFN—α) также может использоваться как препарат первой линии для СС, он эффективен в более высоких дозах, чем при ГМ: 9-18 MU ежедневно в течение 3-х месяцев, затем 3 раза в неделю. При непереносимости высоких доз назначают 3-6 MU ежедневно или 3 раза внеделю.
Терапия низкими дозами метотрексата ( Виды комбинированной терапии, рекомендованные для лечения СС, приведены в таблице (см. ниже).
Таблица. Виды комбинированной терапии, используемые при лечении синдрома Сезари (терапия первой линии)
| Комбинация | |
| системной терапии | наружной терапии |
| IFN-α | ПУВА |
| Метотрексат | Кортикостероидные кремы |
| ЭКФ | ТОК |
| IFN-α | ТОК |
| Комбинация | |
| системной терапии | системной терапии |
| ЭКФ | IFN-α |
| ЭКФ | Метотрексат |
| IFN-α | Метотрексат |
| ПУВА — псорален+ультрафиолетовое облучение спектра А ЭКФ – экстракорпоральный фотоферез ТОК – тотальное облучение кожи | |
Терапия второй линии(УД С-D) [14]
Вторая линия терапии применяется при отсутствии ответа на лечение, рефрактерном течении заболевания или его прогрессировании, несмотря на проведенное лечение первой линии. Выбор лечения зависит от возраста пациента, степени тяжести поражения крови, общего соматического статуса и предыдущихметодов.
В терапии второй линии при лечении СС используются следующие препараты:
· хлорамбуцил в сочетании с системными глюкокортикостероидами: хлорамбуцил 2-12 мг/день + преднизолон 20мг/день;
· ингибиторы гистондеацетилаз (HDACi) (Вориностат). Назначается перорально по 400 мг ежедневно до достижения полного контроля (отсутствие признаков дальнейшего прогрессирования) или же до появления признаков неприемлемойтоксичности;
· пегилированный липосомальный доксорубицин: вводится в дозе 20-30 мг/м2в/в каждые 2- 4недели;
· гемцитабин: 1200 мг/м2в 1, 8 и 15 день 28-дневного цикла (3-6курсов);
· деоксикоформицин (деоксикоформицин): 4-8 мг/м2/день 3 дня каждые 28дней;
· сочетание флударабина (25 мг/м2каждые 3-4 недели) и циклофосфамида (250 мг/м2/день 3 дня 1 раз в месяц) в течение 3-6месяцев.
Поддерживающая терапия(УД С-D) [14]:
Наружные глюкокортикостероиды используются в виде поддерживающей терапии у пациентов с СС. При длительном применении их отмена обычно ассоциирована с рецидивом заболевания. Побочные эффекты включают атрофию кожи (при длительном наружном применении) и подавление функции надпочечников и/или остеопороз (при распространенной аппликации).
К дополнительным видам терапии относится фототерапия: ПУВА-терапия и узковолновое УФО спектра В (311 нм) (смотреть стационарный уровень, тактика лечения: «Грибовидный микоз»).
Применение лейкафереза улучшает результаты стандартных видов терапии, уменьшает зуд и количество клеток Сезари в крови.
Экстранодальная NK/Т-клеточная лимфома, назальный тип(УД С-D) [6,14]:
Выбор терапевтической тактики при NK/T-клеточной лимфоме данной нозологии зависит от стадии заболевания.
Рекомедуемые курсы ХТ:
· AspaMetDex;
· SMILE;
· GELOX;
· GEMOX.
При локальных формах (I-IIE) возможно проведение только ЛТ в дозе 50 Гр и более (ПР от 52 до 100%), однако системные рецидивы развиваются в 25-40% случаев.
При рецидивах и резистентных формах экстранодальной NK/T-клеточной лимфомы эффективны режимы химиотерапии на основе L-аспарагиназы (AspMetDex, SMILE).
АККЛ, ALK+;АККЛ, ALK-; АИЛ; ПТКЛн:
| Основные режимы | Альтернативные режимы | |
| Первая линияинициальной терапии | ||
| АККЛ, ALK+ | CHOEP (УД С) [18,19] | CHOP-21 (УД С) [16,17,18,19] |
| АККЛ, ALK-; АИЛ; ПТКЛн | DA-EPOCH (УД В) [20,21,22] CHOEP (УД С) [18,19] CHOP-21 (УД С) [16,17,18,19] CHOP-14 (УД С) [16,17,18,19] | HyperCVAD (УД С) [23,24] |
| Консолидация в первой ремиссии | ||
| АККЛ, ALK+*; АККЛ, ALK-; АИЛ; ПТКЛн | ВДХТ+аутоТКМ(УД В) [4,15] | ЛТ (если НЕ кандидат на ТКМ)[4,15] |
| Вторая линия терапии | ||
| ПТКЛн | Белиностат (УД D) [25] Брентуксимаб ведотин(УД D) [26,27,28,29] Пралатрексат(УД D) [30] Ромидепсин(УД D) [31,32] DHAP (УДC) [33,34] ESHAP (УДD) [35] GDP (УДC) [36,37,38] GemOX (УДC) [39] ICE (УДC) [40] | Бендамустин(УД D) [43] Гемцитабин(УД D) [41,42] Леналидомид(УД D) [46] GVD(УД D) [44] |
| АИЛ | Белиностат(УД D) [25] Ромидепсин(УД D)[31,32] DHAP (УДC) [33,34] ESHAP (УДD) [35] GDP (УДC) [36,37,38] GemOX (УДC) [39] ICE (УДC) [40] | Бендамустин(УД D) [43] Гемцитабин(УД D) [41,42] Леналидомид(УД D) [46] Пралатрексат(УД D) [30] |
| АККЛ | Белиностат(УД D) [25] Ромидепсин(УД D)[31,32] DHAP (УДC) [33,34] ESHAP (УДD) [35] GDP (УДC) [36,37,38] GemOX (УДC) [39] ICE (УДC) [40] | Бендамустин(УД D) [43] Гемцитабин(УД D) [41,42] Леналидомид(УД D) [46] Пралатрексат(УД D) [30] |
| *Пациентам с АККЛ, ALK+ из группы низкого рискапроведение консолидирующей ВДХТ+аутоТКМ не показано | ||
Гепатолиенальная (гепатоспленическая) Т-клеточная лимфома(УД С) [4,15]
Одна из форм Т-клеточных лимфом, которая имеет крайне неблагоприятный прогноз[1].
Выполнение трансплантации аллогенного костного мозга в первой линии терапии одно из потенциально эффективных терапевтическихрешений.
В качестве режима индукции ремиссии перед выполнением трансплантации костного мозга рекомендовано проведение курсов ICE, IVACиHyper-CVAD и чередование высоких доз метотрексата (1 г/м 2 )/цитозара (3 г/м 2 ), ESHAP, при возможности – предпочтительно заменить антрациклиновые антибиотики на пегилированные формы (липосомальныйдоксорубицин).
В отдельных случаях для снижения массы опухоли и цитопенического синдрома, которые могут мешать проведению химиотерапии, возможно выполнение спленэктомии.
Рецидивы, резистентные формы (УД С) [7,14]
Основные мировые рекомендации при рецидиве и прогрессиях – терапия в рамках клинических исследований по комбинации с новыми препаратами. Решающим в выборе тактики терапии 2-й линии является возраст, соматический статус пациента, возможность трансплантации аллогенных стволовых кроветворных клеток. При наличии возможности в качестве режима индукции предпочтение отдают высокодозным программам (курсы с препаратами платины, гемцитабина, Dexa-BEAM).
Для пожилых пациентов и/или пациентов с отягощенным соматическим статусом – клинические исследования новых препаратов (пралатрексат, ромидепсин, белиностат) или паллиативная терапия. Для CD30-позитивных Т-клеточных лимфом высокая эффективность продемонстрирована при использовании брентуксимаба ведотина – моноклонального анти- CD30 антитела, коньюгированного с монометилаурастином Е. Данный препарат применяется в качестве терапии перед выполнением трансплантации костного мозга (аутологичных или аллогенных стволовых клеток крови).
Лучевая терапия[6,14]:
Грибовидный микоз:
· Локальная лучевая терапия используется у пациентов с небольшим количеством высыпаний (10-20 Гр на курс).
· Тотальное облучение кожи (ТОК) обычно проводится пациентам с распространенными высыпаниями и может назначаться как терапия первой или второй линии больных с Т2и Т3 стадиями с отсутствием эффекта от топической терапии. ТОК проводится с использованием нескольких (чаще всего шести) электронных полей (переднее, заднее, правое и левое передние косые поля, правые и левые задние косые поля). Во время лечения экранируются глаза и ногти. РОД – 1-1,2-1,5 Гр, СОД – 30-40 Гр. Необходимо помнить о лучевых повреждениях – эритема кожи, частичная или полная алопеция, дистрофия ногтей, выраженная сухость кожи. У большинства больных эти проявления обратимы (
Синдром Сезари:
Тотальное облучение кожи (ТОК) в дозе 20-40 Гр рекомендовано комбинировать с другими видами системной терапии или применять как монотерапию с паллиативными целями.
Экстранодальная NK/Т-клеточная лимфома, назальный тип
· Лучевая терапия в самотоятельном варианте (используется при наличии противопоказаний к ХТ) в суммарных дозах- 50-60Гр.
· Одновременная химиолучеваятерапия:
— лучевая терапия (СОД 44-54 Гр) и одновременное выполнение редуцированного (2/3) курса DeVIC; суммарно до 3 курсовХТ;
— лучевая терапия (СОД 44-54 Гр) и еженедельное введение цисплатина (930 мг/м2), с последующей консолидацией – 3 курсаVIPD.
· Последовательная химиолучеваятерапия:
— локальные стадии – ХТ по программе VIPD с последующей лучевой терапией 45- 50Гр;
— стадии II-IV– SMILE (2-4 цикла) с последующей лучевой терапией 45-50Гр;
Рекомендуемая суммарная доза облучения для ПТКЛ:
· в консолидации после химиотерапии: 30-36Гр;
· лучевая терапия в качестве первой линии терапии для рефрактерных форм и для пациентов, не являющихся кандидатами для проведения химиотерапии: 40-55Гр;
· в комбинации с ВДХТ+аутоТКМ: 20-36Гр.
Клинические и технические требования к проведению ЛТ(смотреть Приложение6, настоящего КП).
Трансплантация УД В[14,15]
Грибовижный микоз:
Аллогенная трансплантация стволовых клеток может быть рекомендована пациентам молодого возраста в поздних стадиях заболевания при отсутствии эффекта от других видов терапии
Синдром Сезари:
Аллогенная трансплантация костного мозга может рассматриваться как потенциально возможный вид лечения у пациентов с СС с агрессивным течением и отсутствием эффекта от стандартных режимов терапии.
Другие Т-клеточные лимфомы:
Высокодозная химиотерапия и последующая аутотрансплантация гемопоэтическихстволовых клеток (аутоТГСК) является эффективным методом лечения пациентов с множественной миеломой, рецидивами и первично-резистентными формами лимфом.[2]
Показания к ТГСК:
Европейской группой по трансплантации костного мозга и крови (EBMT) определены следующие показания для ТГСК при неходжкинских лимфомах (2014год).
Показания к ТГСК при Т-клеточных лимфомах:
| Диагноз | Статус | Совместимая родственная алло ТГСК | Совместимая неродственная алло ТГСК | Несовместимая по 1 антигену неродственная или несовместимая родственная алло ТГСК | ауто ТГСК |
| ПТКЛ | Первая ремиссия | Терапевтическая опция | Терапевтическая опция | Не рекомендуется | Терапевтическая опция |
| ХЧР;≥2ПР | Стандарт | Стандарт | Терапевтическая опция | Терапевтическая опция | |
| Резистентность | Терапевтическая опция | Терапевтическая опция | Терапевтическая опция | Не рекомендуется |
Противопоказания к ТГСК:
Противопоказание к ТКМ – это активная лимфома сбольшой опухолевой массой. Кроме того, противопоказаниями для проведения как ауто, так и алло ТГСК являются активные инфекции, в том числе грибковые и вирусные, несанированные скрытые очаги инфекций, различные некомпенсированные сопутствующие заболевания сердечно-сосудистой системы, почек, печени, психические заболевания или расстройства, статус Карновского менее80 или ECOG статус выше 2. Следует оценить возможность переносимости высокодозной химиотерапии пациентами старше 60 лет. Рекомендовано ориентироваться не на фактический, а на биологический возраст пациента.
Сопроводительная терапия:
| Проблема | Рекомендации |
| Тошнота и рвота | Все препараты из группы 5-НТ3 антагонистов первого поколения обладают схожей эффективностью. Вопрос о возможно большей эффективности препаратов второго поколения изучается. Дексаметазон усиливает эффекты 5-НТ3 антагонистов и в большей степени уменьшает отсроченную тошноту и ровту. При использовании с препаратами второго поколения 5-НТ3 антагонистов доза дексаметазона может быть снижена до 8 мг. Пациентам, которые получают высоко- и средне- эметогенные химиопрепараты рекомендуется назначать NK1 антагонисты. Рекомендуемая схема профилактики тошноты: ондансетрон 8 мг 2 раза в сутки, апрепитант 125 мг 1 р/сутки, 80 мг во 2 и 3 сутки, дексаметазон 12 мг 1 р/сутки. Оланзапин – атипичный нейролептик, который эффективнее,чем апрепитант профилактирует отсроченные тошноту и рвоту. |
| Гранулоцитарный, гранулоцитарно-моноцитарный колониестимулирующие факторы | Не оказывают влияния на общую выживаемость и летальность пациентов с фебрильной нейтропенией. Могут применяться для достижения более полного выполнения протоколов лечения. Филграстим в дозе 5 мкг/кг назначается на следующий или через 3-4 дня после завершения химиотерапии и вводится до повышения уровня нейтрофилов выше надира. Основным показанием для назначения Г(ГМ)-КСФ является мобилизация ГСК для ауто- или аллогенной трансплантации костного мозга. |
| Ассоциированные с лимфомой тромботические и тромбоэмболические осложнения | Смотреть Приложение 7, настоящего КП. |
| Синдром лизиса опухоли | Смотреть Приложение 8, настоящего КП |
| Коррекция водно-электролитных нарушений | Смотреть Приложение 9, настоящего КП |
Основные схемы химиотерапии:
Бендамустин+Ритуксимаб (BR):
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Бендамустин | 90 мг/м 2 /сут | 1-2 | в/в, в течение 1-2х часов. |
| Ритуксимаб | 375 мг/м 2 /сут | 1 | в/в, капельно |
| Курс повторяется каждый 21 день (максимально до 8 циклов) | |||
Брентуксимаб ведотин:
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Брентуксимаб ведотин | 1,8мг/кг/сут | 1 | в/в, капельно, в течение 30 минут. Вводить обязательно сразу после разведения |
| Курсы повторяют каждые 21 сут. | |||
R-CHOP:
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м 2 /сут | 0 или 1 | в/в, капельно |
| Доксорубицин | 50 мг/м 2 /сут | 1 | в/в, капельно |
| Циклофосфамид | 750 мг/м 2 /сут | 1 | в/в, капельно |
| Винкристин | 1,4 мг/м 2 /сут | 1 | в/в (суммарно не более 2 мг) |
| Преднизолон | 100 мг | 1-5 | внутрь |
| Курс повторяют каждые 21 день. | |||
R-CHOEP:
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м 2 /сут | 0 или 1 | в/в, капельно |
| Доксорубицин | 50 мг/м 2 /сут | 1 | в/в, капельно |
| Циклофосфамид | 750 мг/м 2 /сут | 1 | в/в, капельно |
| Винкристин | 1,4 мг/м 2 /сут | 1 | в/в (суммарно не более 2 мг) |
| Этопозид | 100 мг/м 2 | 1-3 | в/в, капельно |
| Преднизолон | 40мг/м 2 | 1-5 | внутрь |
| Курс повторяют каждые 21 день. | |||
DA-EPOCH+/R:
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м 2 /сут | 0 | в/в, капельно |
| Этопозид | 50 мг/м 2 /сут | 1-4 | непрерывная 96-часовая инфузия |
| Доксорубицин | 10 мг/м 2 /сут | ||
| Винкристин | 0,4 мг/м 2 /сут | ||
| Циклофосфамид | 750 мг/м 2 /сут | 5 | в/в, в течение 1 часа |
| Преднизолон | 60 мг/м 2 | 5 | Внутрь, 2 раза в день |
| G-КСФ | 300 мкг | 6-15 | П/к 1р /сут |
| Курс повторяют каждые 21 день. В данной дозировке проводится 1 курс. Далее дозы этопозида, доксорубицина и циклофосфана корректируются относительно предыдущего в зависимости от низшего уровня показателей крови, определенных во время и после проведения курса, по следующей схеме: · нейтрофилы выше 0,5 х 109/л, тромбоциты выше 25 х 109/л – увеличение доз на 25%; · Нейтрофилы менее 0,5 х 109/л при 1-2 измерениях, тромбоциты выше 25 х 109/л – сохранение доз предыдущего курса; · Нейтрофилы менее 0,5 х 109 при 3 и более измерениях, тромбоциты ниже 25 х 109/л – редукция доз на 25%. | |||
Леналидомид
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Леналидомид | 25 мг/сут | 1-21 | внутрь |
| Курс повторяют каждые 28 дней. | |||
DHAP:
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Дексаметазон | 40 мг | 1-4 | в/в или внутрь |
| Цисплатин | 100 мг/м 2 /сут | 1 | в/в капельно, 24-часовая инфузия |
| Цитарабин | 2000 мг/м 2 | 2 | в/в, капельно, в течение 3 часов; 2 раза в день |
| Курсы повторяют каждые 21-28сут. | |||
ICE:
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Этопозид | 100 мг/м 2 /сут | 1-3 | в/в, капельно |
| Ифосфамид | 5000 мг/м 2 | 2 | в/в, 24-часовая инфузия + урометиксан в аналогичной дозе |
| Карбоплатин | 400 мг/м 2 /сут | 2 | в/в капельно |
| Курсы повторяют каждые 14 сут. | |||
GVDдля пациентов до ВДХТ+аутоТГСК:
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Гемцитабин | 1000 мг/м 2 /сут | 1 и 8 | в/в |
| Винорельбин | 20 мг/м 2 /сут | 1 и 8 | в/в |
| Пегилированный липосомальный доксорубицин | 15 мг/м 2 /сут | 1 и 8 | в/в |
| Курсы повторяют каждые 21 сут. | |||
GVDдля пациентов после ВДХТ+аутоТГСК:
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Гемцитабин | 800 мг/м 2 /сут | 1 и 8 | в/в |
| Винорельбин | 15 мг/м 2 /сут | 1 и 8 | в/в |
| Пегилированный липосомальный доксорубицин | 10 мг/м 2 /сут | 1 и 8 | в/в |
| Курсы повторяют каждые 21 сут. | |||
GDP:
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Цисплатин | 100 мг/м 2 /сут | 1 | в/в, капельно |
| Гемцитабин | 1000 мг/м 2 /сут | 1,8 | в/в, капельно |
| Дексаметазон | 40 мг | 1-4 | внутрь |
| Лечение возобновляется на 22й день | |||
ESHAP
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Этопозид | 40 мг/м 2 /сут | 1-4 | в/в, капельно, в течение часа |
| Метилпреднизолон | 500 мг/сут | 1-5 | в/в, капельно, в течение 15 минут |
| Цисплатин | 25 мг/м 2 /сут | 1-4 | в/в, непрерывная 24-часовая инфузия |
| Цитарабин | 2000 мг/м 2 /сут | 5 | в/в, капельно, в течение 2 часов |
| Курсы повторяют каждые 21-28 сут. | |||
GemOх
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Гемцитабин | 1000 мг/м 2 /сут | 1 | в/в, капельно |
| Оксалиплатин | 100 мг/м 2 /сут | 1 | в/в, капельно |
| Лечение возобновляется на 22й день | |||
SMILE
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Метотрексат | 2000 мг/м 2 | 1 | в/в кап., в течение 6 часов |
| Ифосфамид | 1500 мг/м 2 | 2-4 | в/в кап |
| L-аспаргиназа | 6000 МЕ/м 2 | 8, 10, 12, 14, 16, 18, 20 | в/в кап |
| Этопозид | 100 мг/м 2 | 2-4 | в/в кап |
| Дексаметазон | 40 мг | 2-4 | в/в кап |
| Каждый очередной курс начинается после восстановления нейтрофилов | |||
AspMetDex
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Метотрексат | 3000мг/м 2 | 1 | в/в кап., в течение 6 часов |
| L-аспаргиназа | 6000 МЕ/м 2 | 2, 4, 6, 8 | в/в кап |
| Дексаметазон | 40 мг | 2-4 | в/в кап |
| Курс повторяется каждый 21 день | |||
DeVic
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Карбоплатин | 200мг/м 2 | 1 | в/в кап. |
| Ифосфамид | 1200мг/м 2 | 1-3 | в/в кап |
| Этопозид | 67 мг/м 2 | 1-3 | в/в кап |
| Дексаметазон | 40 мг | 1-3 | в/в кап |
| Курс повторяется каждый 21 день | |||
деоксикоформицин (2-деоксиформицин, DCF)
| Название препарата | Расчетная доза | Дни введения | Примечания |
| деоксикоформицин | 4мг/м 2 | 1 | в/в |
| Курс повторяется 2 недели (введение продолжается до 3 месяцев или при достижении полного ответа + 2дополнительных курса) | |||
Интерферон альфа (INFα)
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Интерферон | 3 млн МЕ | 3 раза в неделю | подкожно |
| 1 млн МЕ | 2-3 раза в неделю | Подкожно (при глубокой лейкопении) | |
| Оценка эффективности проводитьяс через 2-3 месяца, после достижения ответа на лечение продолжается (6-12 месяцев в целом). | |||
Флударабин
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Флударабин | 25 мг/м 2 | 1-5 | в/в |
| Курс повторяется каждые 4 недели (до 8 циклов) | |||
Блоковые режимы лечения:
R-HyperCVAD/R-HMA:
Циклы 1, 3, 5, 7 (HyperCVAD):
· циклофосфамид 300 мг/м 2 в/в каждые 12 часов, дни 1-3 (всего 6 введений);
· дексаметазон 40 мг в/в или внутрь, дни 1-4, 11-14;
· доксорубицин 50 мг/м 2 в/в непрерывной 24-часовой инфузией в центральный катетер, день 4;
· винкристин 2 мг в/в, дни 4, 11.
Циклы 2, 4, 6, 8 (HMA):
· метотрексат 1000 мг в/в непрерывной 24-часовой инфузией, день 1;
· цитарабин 3 г/м 2 (у больных старше 60 лет – 1 г/м2) в/в каждые 12 часов, дни 2-3 (всего 4 введения);
· метилпреднизолон 50 мг в/в каждые 12 часов, дни 1-3 (всего 6 введений);
· ритуксимаб 375 мг/м2 в/в или ритуксимаб 1400 мг п/к (кроме первого введения), дни 1,11 (циклы 1, 3) и дни 2, 8 (циклы 2, 4) – всего 8 введений;
· профилактика поражения ЦНС проводится на каждом курсе, суммарно 16интратекальных введений:
— метотрексат 12 мг интратекально, день 2;
— цитарабин 100 мг интратекально, день 7.
Хирургическое вмешательство, с указанием показаний для оперативного вмешательства:
· иссечение глубокого шейного лимфатического узла;
· иссечение подмышечного лимфатического узла;
· иссечение пахового лимфатического узла;
· простое иссечение другой лимфатической структуры;
· локальное иссечение лимфоузла;
· полная спленэктомия;
· биопсия кожи и подкожных тканей.
Цель проведения процедуры/вмешательства: верификация диагноза ЛПЗ
Показания:исключение/подтверждение диагноза ЛПЗ.
Противопоказание: отказ пациента от проведения оперативного вмешательства
Методика проведения процедуры/вмешательства: В асептических условиях проводится процедура взятия ткани лимфатического узла, лимфатической структуры или образования. Проведение тонкоигольной биопсии нежелательно,
так как в этом случае количество клеток для цитологического исследования недостаточно и оценить структуру лимфатического узла, структуры и т.д. будет невозможно. В зависимости от локализации (предполагаемого объема операции) решается вопрос о стационарном или амбулаторном ведении пациента.
Показания для консультации специалистов:
· консультации узких специалистов – по индивидуальным показаниям.
Показания для перевода в отделение интенсивной терапии и реанимации:нарушение витальных функций.
Индикаторы эффективности лечения[14].
Грибовидный микоз
Ответ на лечение определяется в соответствии с критериями, предложенными ISCL, EORTC и Американским консорциумом по кожным лимфомам(USCLC):
| Кожныепокровы | Полная ремиссия (ПР): 100% исчезновение очагов кожного поражения. Частичная ремиссия (ЧР): 50%-99% разрешения очагов кожного поражения от исходного уровня, отсутствие появления новых узлов (Т3) у пациентов с Т1, Т2 или Т4 стадиями. Стабилизация заболевания: От Прогрессированиезаболевания: ≥25% увеличения очагов кожного поражения от исходного уровня; или появление новых узлов (Т3) у пациентов с Т1, Т2 или Т4 стадиями; или отсутствие ответа – увеличение высыпаний от наименьшего уровня на 50% от исходного уровня у больных с достигнутой ПР или ЧР. Рецидив: появление кожных высыпаний у пациентов в полной ремиссии. |
| Лимфатическиеузлы | Полная ремиссия: все лимфатические узлы ≤1,5 см в наибольшем диаметре (длинная ось) или гистологически негативные, также – л/у N3 и ≤1,5 см в наибольшем диаметре и >1 см в наименьшем диаметре должны быть ≤1 см в наименьшем диаметре или гистологически негативны Частичная ремиссия: суммарное снижение ≥50% СПР (сумма произведений максимального продольного размера × максимального поперечного размера каждого пораженного л/у) и отсутствие новых л/у >1,5 см в диаметре по длинной оси или >1 см по короткой оси Стабилизация заболевания: отсутствие критериев для полной, частичной ремиссии и прогрессирования заболевания Прогрессирование заболевания: повышение ≥50% СПР от исходных размеров, или новый л/у >1,5 см в диаметре по длинной оси или >1 см по короткой оси, или отсутствие ответа: увеличение СПР на >50% от максимального эффекта у пациентов в ЧР Рецидив: появление новых гистологически доказанных N3 л/у >1,5 см в наибольшем диаметре |
| Висцеральныеорганы | Полная ремиссия: отсутствие увеличения органа при физикальном осмотре и отсутствие патологических изменений при томографии (биопсия любых новых очагов, появившихся после лечения, для исключения лимфомы). Частичная ремиссия: ≤50% регрессии очагов печени, селезенки или других изначально пораженных органах при возможности измерить объем поражения (СПР), отсутствие увеличения органа в размерах и вовлечения новых органов Стабилизация заболевания: отсутствие критериев для полной и частичной ремиссии и прогрессирования заболевания Прогрессирование заболевания: >50% увеличения органа в размере, или поражение нового органа, или отсутствие ответа: увеличение СПР на >50% от максимального эффекта у пациентов в частичной ремиссии Рецидив: вовлечение нового органа у пациентов с полной ремиссией |
| Периферическаякровь | Полная ремиссия: В0 Частичная ремиссия: у больных со стадией заболевания B2 – снижение количественных параметров поражения крови >50% от исходного уровня Стабилизация заболевания: отсутствие критериев для полной и частичной ремиссии и прогрессирования заболевания Прогрессирование заболевания: B0 → B2; или повышение >50% от исходного уровня (5000 опухолевых клеток/µL) Рецидив: повышение уровня опухолевых лимфоцитов в крови у пациентов с ПР ≥ В1 |
Учитывая критерии ответа для кожи, лимфатических узлов, висцеральных органов и крови, определяется общий критерий ответа на лечение (представлена в таблице).
| Схема определения общего ответа на лечение | |||
| Определение | Кожа | Л/у Кровь Внутренниеорганы | |
| ПР | Полное исчезновение всех клинических симптомов болезни | ПР | Все категории в ПР/интактны |
| ЧР | Регресс измеряемых показателей | ПР | |
Синдром Сезари
При СС используются критерии ответа на лечение, предложенные ISCL, EORTC и Американским консорциумом по кожным лимфомам (USCLC) (смотреть пункт Индикаторы эффективности лечения «Грибовидный микоз»).
АККЛ, ALK+;АККЛ, ALK-; АИЛ; ПТКЛн, ГЛТЛ
Оценка эффективности проведенной терапии проводится согласно критериям Lugano (смотреть Приложение 4, настоящего КП).
Дальнейшее ведение [4]
Грибовидный микоз, Синдром Сезари
Пациенты необходимо проходить регулярные обследования:
· с ранними стадиями – ежегодно (физикальный осмотр с картированием кожи, рентгенография органов грудной клетки и УЗИ периферических лимфатическихузлов)
· с поздними стадиями – каждые 6 месяцев (физикальный осмотр с картированием кожи, УЗИ периферических лимфатических узлов, КТ органов грудной клетки, брюшной полости и малоготаза).
АККЛ, ALK+;АККЛ, ALK-; АИЛ; ПТКЛн, ГЛТЛ
· рекомендуется проводить сбор анамнеза и тщательное физикальное обследование один раз каждые три месяца на протяжении первых двух лет и затем один раз в год, акцентируя внимание на возможности развития вторичных опухолей и/или отсроченных побочных эффектов химиотерапии [D];
· развернутый анализ крови с обязательным определением уровня ЛДГ рекомендуется проводить на 3, 6, 12 и 24 месяцах наблюдения. Далее — только припоявлении подозрительных клинических симптомов у пациентов, подлежащих проведению дальнейшей терапии [D];
· необходимо проведение минимального адекватного радиологического контроля, включающего КТ обследование на 6, 12, 24 месяцах после окончания лечения [D]. Рутинный ПЭТ-контроль не рекомендуется;
· пациенты группы высокого риска, у которых возможно дальнейшее проведение терапии в случае рецидива, могут подлежать более частому наблюдению.
МЕДИЦИНСКАЯ РЕАБИЛИТАЦИЯ: согласно клинического протокола по реабилитации.
ПАЛЛИАТИВНАЯ ПОМОЩЬ: согласно клинического протокола по паллиативной помощи.
[2]По данным Европейской группы по трансплантации костного мозга (ЕВМТ) более половины всех ТГСК выполнены у пациентов с лимфопролиферативными заболеваниями, а среди аутоТГСК 87% приходится на пациентов с лимфомами (Ходжкина и неходжкинскими) и множественной миеломой. В последнее десятилетие увеличивается количество аллогенных трансплантаций (аллоТГСК), выполненных при различных лимфомах. Более широкое использование аллоТГСК связано с наличием эффекта “трансплантат-против-лимфомы”, впервые продемонстрированным R. Jones и соавторами в 1991 году, и с внедрением режимов кондиционирования со сниженной токсичностью.
[1]CHOP иCHOP-подобные режимы неэффективны при данной нозологии: общая выживаемость даже у пациентов, получивших трансплантацию аутологичных стволовых клеток крови, составила 13 месяцев.
Госпитализация
Показания для плановой госпитализации:
· проведение курсов химиотерапии;
· проведение биопсии лимфатического узла или экстранодального образования;
· мобилизация гемопоэтических стволовых клеток;
· аутологичная трансплантация гемопоэтических стволовых клеток.
Показания для экстренной госпитализации:
· соматически тяжелый пациент (ECOG≥3).
Информация
Источники и литература
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗСР РК, 2016
- 1. Scottish Intercollegiate Guidelines Network (SIGN). SIGN 50: a guideline developer’s handbook. Edinburgh: SIGN; 2014. (SIGN publication no. 50). [October 2014]. Available from URL: http://www.sign.ac.uk. 2. Гематология: руководство для врачей/ под.ред. Н.Н. Мамаева. – 2-е изд., доп.и испр. – СПб.: СпецЛит, 2011. 3. Steven H. Swerdlow,1 Elias Campo, et al., The 2016 revision of the World Health Organization classification of lymphoid neoplasms. BLOOD, 19 MAY 2016 x VOLUME 127, NUMBER 20 4. F. d’Amore1, P. Gaulard2, L. Trümper3 et al., , Peripheral T-cell lymphomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-upAnnals of Oncology 26 (Supplement 5): v108–v115, 2015 doi:10.1093/annonc/mdv201 5. Алгоритмы диагностики и лечения злокачественных новообразований. Под редакцией д.м.н., проф. О.Г. Суконко, д.м.н. С.А. Красного. Минск 2012 6. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Non-Hodgkin`s Lymphomas. www.nccn.org 3.2016/ 7. Oncopedia.Recommendations from the society for diagnosis and therapy of haematological and oncological diseases. Guidelines` 2016 8. Carr SE, Halliday V. Investigating the use of the neutropenic diet: a survey of UK dietitians. J Hum Nutr Diet. 2014 Aug 28. 9. Moody K, Finlay J, Mancuso C, Charlson M. Feasibility and safety of a pilot randomized trial of infection rate: neutropenic diet versus standard food safety guidelines. J PediatrHematolOncol. 2006 Mar; 28(3):126-33 10. Gardner A, Mattiuzzi G, Faderl S, Borthakur G, Garcia-Manero G, Pierce S, Brandt M, Estey E. Randomized comparison of cooked and noncooked diets in patients undergoing remission induction therapy for acute myeloid leukemia. J ClinOncol. 2008 Dec 10; 26(35):5684-8. 11. Carr SE, Halliday V. Investigating the use of the neutropenic diet: a survey of UKdietitians. J Hum Nutr Diet.2014 Aug 28. 12. Boeckh M. Neutropenic diet— good practice or myth?Biol Blood Marrow Transplant. 2012 Sep; 18(9):1318-9. 13. Trifilio, S., Helenowski, I., Giel, M. et al. Questioning the role of a neutropenic diet following hematopoetic stem cell transplantation. Biol Blood Marrow Transplant. 2012; 18: 1387–1392. 14. Российские клинические рекомендации по диагностике и лечению лимфопрлиферативных заболеваний . под.рук. проф. И.В. Поддубной и проф.В.Г.Савченко. 2016 г. 15. C. Dearden, R. Johnson, R. Pettengell et al.,Guidelines for the Management of Mature T-cell and NK-cell Neoplasms (Excluding cutaneous T-cell Lymphoma), Date for Guideline Review June 2013 16. Savage KJ, Chhanabhai M, Gascoyne RD, Connors JM. Characterization of peripheral T-cell lymphomas in a single North American institution by the WHO classification. Ann Oncol 2004;15:1467-1475 17. Pfreundschuh M, Trümper L, Kloess M, Schmits R, et al. German High-Grade Non-Hodgkin’s Lymphoma Study Group. Two-weekly or 3-weekly CHOP chemotherapy with or without etoposide for the treatment of young patients with good-prognosis (normal LDH) aggressive lymphomas: results of the NHL-B1 trial of the DSHNHL. Blood 2004;104:626-33 18. Pfreundschuh M, Trümper L, Kloess M, Schmits R, et al. German High-Grade Non-Hodgkin’s Lymphoma Study Group. Two-weekly or 3-weekly CHOP chemotherapy with or without etoposide for the treatment of elderly patients with aggressive lymphomas: Results of the NHL-B2 trial of the DSHNHL. Blood 2004;104:634-41. 19. Schmitz N, Trumper L, Ziepert M, et al. Treatment and prognosis of mature T-cell and NK-cell lymphoma: an analysis of patients with T-cell lymphoma treated in studies of the German High-Grade Non-Hodgkin Lymphoma Study Group. Blood 2010;116:3418-3425. 20. Dunleavy K, Shovlin M, Pittaluga S, et al. DA-EPOCH Chemotherapy is highly effective in ALK-positive and ALK-negative ALCL: Results of a prospective study of PTCL subtypes in adults [abstract]. Blood 2011;118:Abstract 1618. 21. Wilson WH, Bryant G, Bates S, et al. EPOCH chemotherapy: toxicity and efficacy in relapsed and refractory non-Hodgkin’s lymphoma. J Clin Oncol 1993;11:1573-582. 22. Peng YL, Huang HQ, Lin XB, et al. [Clinical outcomes of patients with peripheral T-cell lymphoma (PTCL) treated by EPOCH regimen]. Ai Zheng 2004;23:943-946. 23. Escalon MP, Liu NS, Yang Y, et al. Prognostic factors and treatment of patients with T-cell non-Hodgkin lymphoma: the M. D. Anderson Cancer Center experience. Cancer 2005;103:2091-2098 24. Pozadzides JV, Perini G, Hess M, et al. Prognosis and treatment of patients with peripheral T-cell lymphoma: The M. D. Anderson Cancer Center experience [abstract]. J Clin Oncol 2010;28: Abstract 8051. 25. O’Connor OA, Horwitz S, Masszi T, et al. Belinostat in patients with relapsed or refractory peripheral T-cell lymphoma: Results of the pivotal phase II BELIEF (CLN-19) study. J Clin Oncol 2015;33:2492-2499 26. Pro B, Advani R, Brice P, et al. Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: Results of a phase II study. J Clin Oncol 2012;30:2190-2196. 27. Jacobsen ED, Advani RH, Oki Y, et al. A Phase 2 Study of Brentuximab Vedotin in Patients with Relapsed or Refractory CD30-Positive Non-Hodgkin Lymphomas: Interim Results [abstract]. Blood 2012;120: Abstract 2746 28. Advani RH, Brice P, Bartlett NL, et al. Three-year survival results from an ongoing phase 2 study of brentuximab vedotin in patients with relapsed or refractory systemic anaplastic large cell lymphoma. Blood 2013;122:1809. 29. Horwitz SM, Advani RH, Bartlett NL, et al. Objective responses in relapsed T-cell lymphomas with single agent brentuximab vedotin. Blood 2014;123 3095-3100 30. O’Connor OA, Pro B, Pinter-Brown L, et al. Pralatrexate in patients with relapsed or refractory peripheral T-cell lymphoma: Results from the pivotal PROPEL study. J Clin Oncol 2011;29:1182-1189. 31. Coiffier B, Pro B, Prince HM, et al. Results From a Pivotal, Open-Label, Phase II Study of Romidepsin in Relapsed or Refractory Peripheral T-Cell Lymphoma After Prior Systemic Therapy. J Clin Oncol 2012;30:631-636. 32. Coiffier B, Pro B, Prince HM, et al. Romidepsin for the treatment of relapsed/refractory peripheral T- cell lymphoma: pivotal study update demonstrates durable responses]. J Hematol Oncol 2014;7:11. 33. Velasquez WS, Cabanillas F, Salvador P, et al. Effective salvage therapy for lymphoma with cisplatin in combination with high-dose Ara-C and dexamethasone (DHAP). Blood 1988;71:117-122 34. Mey UJ, Orlopp KS, Flieger D, et al. Dexamethasone, high-dose cytarabine, and cisplatin in combination with rituximab as salvage treatment for patients with relapsed or refractory aggressive non-Hodgkin’s lymphoma. Cancer Invest 2006;24:593-600 35. Velasquez WS, McLaughlin P, Tucker S, et al. ESHAP — an effective chemotherapy regimen in refractory and relapsing lymphoma: a 4-year follow-up study. J Clin Oncol 1994;12:1169-1176. 36. Crump M, Baetz T, Couban S, et al. Gemcitabine, dexamethasone, and cisplatin in patients with recurrent or refractory aggressive histology B-cell non-Hodgkin lymphoma: a Phase II study by the National Cancer Institute of Canada Clinical Trials Group (NCIC-CTG). Cancer 2004;101:1835-1842. 37. Dong M, He XH, Liu P, et al. Gemcitabine-based combination regimen in patients with peripheral T-cell lymphoma. Med Oncol 2013;30:351. 38. Connors JM, Sehn LH, Villa D, et al. Gemcitabine, dexamethasone, and cisplatin (GDP) as secondary chemotherapy in relapsed/refractory peripheral T-cell lymphoma [abstract]. Blood 2013;122:Abstract 4345 39. Lopez A, Gutierrez A, Palacios A, et al. GEMOX-R regimen is a highly effective salvage regimen in patients with refractory/relapsing diffuse large-cell lymphoma: A phase II study. Eur J Haematol 2008;80:127-132 40. Zelenetz AD, Hamlin P, Kewalramani T, et al. Ifosfamide, carboplatin, etoposide (ICE)-based second-line chemotherapy for the management of relapsed and refractory aggressive non-Hodgkin’s lymphoma. Ann Oncol 2003;14[suppl 1]:i5-10. 41. Zinzani PL, Baliva G, Magagnoli M, et al. Gemcitabine treatment in pretreated cutaneous T-cell lymphoma: Experience in 44 patients. J Clin Oncol 2000;18:2603-2606 42. Zinzani PL, Magagnoli M, Bendandi M, et al. Therapy with gemcitabine in pretreated peripheral T-cell lymphoma patients. Ann Oncol 1998;9:1351-1353. 43. Damaj G, Gressin R, Bouabdallah K, et al. Results from a prospective, open-label, phase II trial of bendamustine in refractory or relapsed T-cell lymphomas: the BENTLY trial. J Clin Oncol 2013;31:104-110. 44. Qian Z, Song Z, Zhang H, et al. Gemcitabine, navelbine, and doxorubicin as treatment for patients with refractory or relapsed T-cell lymphoma. Biomed Res Int. 2015;2015:606752 45. Apperley J., Carreras E., Gluckman E., Masszi T. The 2014 revised edition of theEBMT-ESH Handbook on Haemopoietic Stem Cell Transplantation 46. Wiernik PH, Lossos IS, Tuscano JM, et al. Lenalidomide monotherapy in relapsed or refractory aggressive non-Hodgkin’s lymphoma. J Clin Oncol 2008;26:4952-4957.
Информация
Сокращения, используемые в протоколе:
полимеразная цепная реакция
fludeoxyglucose (англ. фтордезоксиглюкоза)
International Prognostic Index
Список разработчиков протокола с указанием квалификационных данных:
1) Кемайкин Вадим Матвеевич – к.м.н, директор департатмента онкологии, АО «Национальный научный центр онкологии и трансплантологии», главный внештатный гематолог МЗСР РК.
2) Гайнутдинова Ольга Владимировна – врач гематолог, АО «Национальный научный центр онкологии и трансплантологии».
3) Клодзинский Антон Анатольевич – к.м.н., врач гематолог, ТОО «Центр гематологии»
4) РамазановаРайгульМухамбетовна –д.м.н., заведующая курсом гематологии, АО «Казахский медицинский университет непрерывного образования».
5) ГаббасоваСаулеТелембаевна – заведующая отделением гемобластозов, РГП на ПХВ «Казахский научно-исследовательский институт онкологии и радиологии».
6) КаракуловРоманКаракулович –д.м.н., Академик МАИ, главный научный сотрудник отделения гемобластозов «Казахский научно-исследовательский институт онкологии и радиологии».
7) Рапильбекова Гульмира Курбановна – д.м.н., профессор АО «Национальный научный центр материнства и детства», старший ординатор акушерского отделения №1, врач акушер-гинеколог.
8) Калиева Мира Маратовна – к.м.н, доцент кафедры клинической фармакологии и фармакотерапии КазНМУ им. С. Асфендиярова.Указание на отсутствие конфликта интересов: нет.
Список рецензентов:
1) Тургунова Людмила Геннадиевна – д.м.н., профессор, РГП на ПХВ «Карагандинский государственный медицинский университет», заведующая кафедрой терапевтических дисциплин факультета непрерывного
профессионального развития, врач-гематолог.Пересмотр протокола:через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1
Индекс Карновского/Шкала ECOG-ВОЗ
Общее состояние онкологического больного рекомендовано оценивать по индексу Карновского (0-100%) или Шкале ECOG-ВОЗ (0-4 балла).Индекс Карновского Активность,% Шкала ECOG-ВОЗ Балл Состояние нормальное жалоб нет 100 Нормальная активность 0 Способен к нормальной деятельности, незначительные симптомы или признаки заболевания 90 Есть симптомы заболевания, но ближе к нормальному состоянию 1 Нормальная активность с усилием 80 Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе 70 Больше 50% дневного времени проводит не в постели, но иногда нуждается в отдыхе 2 Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей 60 Нуждается в значительной помощи и медицинском обслуживании 50 Нуждается в пребывании в постели более 50% дневного времени 3 Инвалид, нуждается в специальной помощи, в т.ч. медицинской 40 Тяжелая инвалидность, показана госпитализация, хотя смерть не предстоит 30 Не способен обслуживать себя, прикован к постели 4 Тяжелый больной. Необходимы активное лечение и госпитализация 20 Умирающий 10 Приложение 2
Классификация лимфом. ВОЗ 2016 год.
В- клеточные опухоли:
· Хронический лимфолейкоз/ лимфома из малых лимфоцитов;
· Моноклональный В-клеточный лимфоцитоз;
· В-пролимфоцитарный лейкоз;
· Лимфома селезенки из клеток маргинальной зоны;
· Волосатоклеточный лейкоз;
· Лимфома/ лейкоз селезенки, неклассифицируемый:
— диффузная мелкоклеточная В- клеточная лимфома красной пульпы селезенки;
— волосатоклеточный лейкоз- подобный вариан.
· Лимфоплазмоцитарная лимфома
— Макроглобулинемия Вальденстрема
· Моноклональные гаммапатии неясного генеза (MGUS), IgM:
— болезнь α- тяжелых цепей;
— болезнь γ- тяжелых цепей;
— болезнь μ- тяжелых цепей.
· Моноклональные гаммапатии неясного генеза (MGUS), IgG/A:
— плазмоклеточная миелома;
— солитарная плазмоцитома кости;
— экстрамедуллярная миелома;
— болезнь накопления моноклональных иммуноглобулинов.
· Экстранодальная лимфома из клеток маргинальной зоны лимфоидной ткани, ассоциированной со слизистой оболочкой (MALT- лимфом);
· Нодальная лимфома из клеток маргинальной зоны;
· Нодальная лимфома из клеток маргинальной зоны, педиатрический вариант;
· Фолликулярная лимфома:
— In situ фолликулярная неоплазия;
— Фолликулярная лимфома дуоденального типа.
· Фолликулярная лимфома, педиатрический вариант;
· Крупноклеточная В- клеточная лимфома с IRF4;
· Первичная кожная центрофолликулярная лимфома;
· Лимфома из клеток мантии:
— In situ неоплазия из клеток мантии;
· Диффузная крупноклеточная В- клеточная лимфома, NOS:
— GCB-тип(анг. germinal center B-cell-like);
— ABC-тип (англ. activated B-cell-like).
· В-клеточная лимфома, богатая T-клетками/гистиоцитами;
· Первичная ДВККЛ центральной нервной сиситемы (ЦНС);
· Первичная кожная диффузная крупноклеточная В- клеточная лимфома с поражением нижних конечностей;
· EBV1+ DLBCL, NOS;
· EBV1+, кожно-слизистая язва;
· ДВККЛ, связанная с хроническим воспаленнием;
· Лимфоматоидный гранулематоз;
· Первичная медиастинальная (тимическая) крупноклеточная В- клеточная лимфома;
· Внутрисосудистая крупноклеточная В- клеточная лимфома;
· ALK + крупноклеточная В- клеточная лимфома;
· Плазмобластная лимфома;
· Первичная экссудативная лимфома;
· HHV81 DLBCL, NOS*;
· Лимфома Беркитта;
· Беркитоподобная лимфома с абберацией 11q;
· В-клеточная лимфома высокой степени злокачественности, с мутациями MYC и BCL2 и /или BCL6;
· В-клеточная лимфома высокой степени злокачественности, NOS;
· В- клеточная лимфома, неклассифицируемая, с признаками, промежуточными между диффузной крупноклеточной В- клеточной лимфомой и лимфомой Ходжкина;Т/ NK- клеточные опухоли:
· Т- клеточный пролимфоцитарный лейкоз;
· Т- клеточный гранулярный лимфоцитарный лейкоз;
· Хроническое лимфопролиферативное NK- клеточное заболевание;
· Агрессивный NK- клеточный лейкоз;
· Системная EBV Т-клеточная лимфома у детей;
· Гидроаоспенновидно- подобнаялимфома;
· Т- клеточная лимфома/ лейкоз взрослых;
· Экстранодальная NK/ T- клеточная лимфома, назальный тип;
· Ассоциированная с энтеропатией Т- клеточная лимфома;
· Мономорфная эпителиотропная кишечная Т-лимфома;
· Индолетние Т-клеточные лимфопролиферативные заболевания ЖКТ;
· Гепатоспленическая Т- клеточная лимфома;
· Подкожная панникулит- подобная Т- клеточная лимфома;
· Грибовидный микоз;
· Синдром Сезари;
· Первичные кожные CD30- позитивные Т- клеточные лимфомы;
· Лимфоматоидный папуллез;
· Первичная кожная анапластическая крупноклеточная лимфома;
· Первичная кожная γδ Т- клеточная лимфома;
· Первичная кожная CD8+ агрессивная эпидермотропная цитотоксическая Т- клеточная лимфома;
· Первичная кожная CD8+ Т- клеточная лимфома
· Первичная кожная периферическая CD8+ Т- клеточная лимфома
· Первичная кожная CD4+ мелко/ среднеклеточная Т- клеточная лимфома;
· Периферическая Т- клеточная лимфома, неуточненная;
· Ангиоиммунобластная Т- клеточная лимфома;
· Фолликулярная Т-клеточная лимфома;
· Нодальная периферическая Т-клеточная лимфома с фенотипом TFH;
· Анапластическая крупноклеточная лимфома, ALK- позитивная;
· Анапластическая крупноклеточная лимфома, ALK- негативная;
· Грудной имплантат-ассоциированной анапластическая крупно-клеточная лимфома;Лимфома Ходжкина:
· Нодулярная с лимфоидным преобладанием лимфома Ходжкина;
· Классическая лимфома Ходжкина;
· Лимфома Ходжкина, вариант нодулярный склероз;
· Лимфома Ходжкина, вариант, богатый лимфоцитами;
· Лимфома Ходжкина, смешанноклеточный вариант;
· Лимфома Ходжкина, вариант с лимфоидным истощением.Пострансплантационные лимфопролиферативные заболевания (PTLD):
· Плазматическая гиперплазия (PTLD);
· Инфекционный мононуклеоз (PTLD);
· Багровая фолликулярная гиперплазия;
· Полиморфная PTLD;
· Мономорфная PTLD (B- и T-/NK-клеточные типы)
· Классическая лимфома Ходжкина (PTLD).Новообразования гистиоцитарных и дендритных клеток:
· Гистиоцитарная саркома;
· Гистиоцитоз из клеток Лангергаса;
· Саркома из клеток Лангергаса;
· Неопределенный опухоль дендритных клеток;
· Саркома из дендритных клеток;
· Саркома фолликулярных дендритных клеток;
· Опухоль из ретикулярных фибробластических клеток;
· Рассеянная юношеская ксантогранулома
· Болезнь Эрдгейма-ЧестерПриложение 3
Классификация лимфом Ann Arbor, модификация Cotswold
Стадия I · Поражение одной лимфатической зоны или структуры *
· Локализованное поражение одного экстралимфатического органа или ткани в пределах одного сегментаСтадия II · Поражение двух или более** лимфатических зон по одну сторону диафрагмы
· Локализованное в пределах одного сегмента поражение одного
экстралимфатического органа или ткани и его регионарных лимфатических узлов с или без поражения других лимфатических областей по ту же сторону диафрагмыСтадия III · Поражение лимфатических узлов или структур по обе стороны диафрагмы ***
· Локализованное в пределах одного сегмента поражение одного
экстралимфатического органа или ткани и его регионарных лимфатических узлов с поражением других лимфатических областей по обе стороны диафрагмыСтадия IV · Диссеминированное (многофокусное) поражение одного или нескольких экстралимфатических органов, с или без поражения лимфатических узлов
· Изолированное поражение экстралимфатического органа с поражением
отдаленных (не регионарных) лимфатических узлов
· Поражение печени и/или костного мозгаДля всех стадий А · Отсутствие признаков В-стадии В **** Один или более из следующих симптомов:
· Лихорадка выше 38°С не менее трех дней подряд без признаков воспаления
· Ночные профузные поты
· Похудание на 10% массы тела за последние 6 месяцевE · Локализованное экстранодальное поражение (при I-IIIстадиях) S · Поражение селезенки (при I-IIIстадиях) Х · Массивное (bulky) опухолевое поражение –очаг более 10 см в диаметре или медиастинально-торакальный индекс***** более 1/3 * К лимфатическим структурам относят лимфатические узлы, селезенку, вилочковую железу, кольцо Вальдейера, червеобразный отросток, пейеровы бляшки
** При лимфоме Ходжкина для второй стадии необходимо дополнительно арабской цифрой указывать количество пораженных лимфатических зон (например, стадия II4)
*** Рекомендуется различать стадию III1, с поражением верхних абдоминальных лимфатических узлов (ворота печени, селезенки, чревные л/у), и стадию III2, с поражением забрюшинных лимфузлов
**** Кожный зуд исключен из симптомов интоксикации
***** Медиастинально-торакальный индекс – отношение ширины срединной тени в самом широком месте к диаметру грудной клетки в самом широком ее месте – на уровне Th5-6на стандартных прямых рентгенограммахПриложение 4
Критерии LUGANO для оценки ответа при НХЛ
ПЭТ должно быть проведено с контрастным усилением и КТ (можно провести одновременно или по отдельности).Ответ Локализация (Вовлечение органов и систем) ПЭТ КТ (метаболический ответ) КТ (радиологический ответ) d Лимфатические узлы и экстралимфатические поражения 1,2 или 3* балла по шкале Deauville, с/без остаточной массой Все критерии из перечисленных: Лимфатические узлы / нодальные массы должны регрессировать к ≤1.5 см
Без экстралимфатического пораженияПолный ответ Не измеряемые очаги Не применяется Отсутствуют Увеличение в размерах внутренних органов Не применяется Уменьшение до нормальных размеров Новые очаги Не обнаружено Не обнаружено Костный мозг Нет данных за накопление фтордезоксиглюкозы в мозге Нормальная по морфологии; при сомнительном результате — проточная цитометрии и негативная ИГХ Лимфатические узлы и экстралимфатические поражения 4 или 5 баллов по шкале Deauville с меньшим накоплением FDG по сравнению результатом в дебюте. Нет новых очагов поражения или прогрессирования.
В промежуточном рестадировании эти данные свидетельствуют об ответе заболевания на лечение.
В конце лечения эти результаты могут свидетельствовать об остаточной болезни.Все критерии из перечисленных:
-уменьшение размеров лимфатических узлов и экстралимфатических поражений на ≥ 50%;
-когда степень поражения невозможно оценить на КТ из-за малых размеров (ориентировочный размер 5х5 мм);
-полное отсутствие поражения, 0х0 мм;
-для узлов >5 мм х 5 мм, но меньше, чем в норме, (рекомендовано использование фактического измерения для расчета);Частичный ответ Неизмеряемые очаги Не применяется Отсутствуют / нормальные, регресиированные, но нет увеличения Увеличение в размерах внутренних органов Не применяется Уменьшение размеров селезенки на 50% в длину (но не достигших размеров нормы) Новые очаги Не обнаружены Не обнаружены Костный мозг Остаточное поглощение FDG выше, чем поглощение в нормальном костном мозге, но снижено по сравнению с исходным уровнем (диффузное поглощение сочетается с реактивными изменениями после проведенной химиотерапии). Если имеются стойкие очаговые изменения в костном мозге на фоне ответа, рассмотреть дальнейшую оценку ответа с биопсией, или интервал сканирования. Не применяется a 3 балла по шкале Deauville у многих пациентов указывает на хороший прогноз при стандартной терапии, особенно при промежуточном рестадировании. Однако, в испытаниях с участием ПЭТ, где исследовались деэскалация доз химиопрепаратов, ответ 3 балла по шкале Deauville расценивался как неадекватный ответ (чтобы избежать недостаточного лечения).
Критерии LUGANO для оценки ответа при НХЛ
ПЭТ должно быть проведено с контрастным усилением и КТ (можно провести одновременно или по отдельности).Ответ Локализация (Вовлечение органов и систем) ПЭТ КТ (метаболический ответ) КТ (радиологический ответ) d Нет ответа или стабилизация заболевания Целевые узлы и узловые массы
Экстралимфатические пораженияSPD — сумма произведения перпендикулярных диаметров для множественных повреждений
LDi — самый длинный поперечный диаметр поражения
SDi — короткая ось перпендикулярна к LDI
PPD — крест произведение LDI и перпендикулярного диаметраПриложение 5

Оценка эффективности проведенной терапии по шкале Deauville
Приложение 6
Клинические и технические требования к лучевой терапии
Клинические требования
Оптимальный интервал между окончанием ХТ и началом лучевой терапии – 2-4 недели (но не более 6 недель).
Очень важным для планирования лучевой терапии является качество стадирования заболевания до начала химиотерапии. Описание очагов поражения по данным клинического осмотра, КТ, МРТ должно включать анатомически точную их локализацию, количество, максимальные размеры в сантиметрах, особенно зон массивного поражения, указание 3-х размеров зоны поражения, включая протяжённость. При описании поражения средостения обязательно определение медиастинально-торакального индекса (МТИ) по прямому рентгеновскому снимку. Для атипично расположенных пораженных лимфатических узлов, помимо описания их, необходимо указывать их координаты (расстояние в см по горизонтали и вертикали от легко определяемых анатомических ориентиров). Всю указанную выше информацию рекомендуется изображать графически на анатомической схеме человеческого тела во фронтальной проекции.
До начала ХТ при наличии полной информации об объеме исходного поражения рекомендуется совместная консультация гематологов-онкологов и радиологов. Особо должны быть выделены зоны сомнительного или вероятного поражения, лечебная тактика в отношении которых должна быть предварительно согласована и повторно обсуждена после окончания ХТ.
При всех поддиафрагмальных поражениях в случае планирования облучения селезёнки рекомендуется радиоизотопное исследование функции почек. При наличии единственной левой почки либо при значительном нарушении функции правой почки следует обсудить целесообразность спленэктомии, как альтернативы ее облучению.Технические требования
Для проведения лучевой терапии можно использовать гамма-излучение Со60, фотонное излучение энергией 6 МЭВ и 18 МЭВ (18 МЭВ используется в случае глубокого расположения мишени, при больших значениях передне-задних размеров). Электронное излучение различных энергий может использоваться для лечения поверхностно расположенных лимфатических узлов.
Расчёт дозы ЛТ должен проводиться в соответствии с МКРЕ-50-62, где указаны относительные точки и суммарные дозы. Разовая очаговая доза не должна превышать 1,8-2,0 Гр, лечение проводится ежедневно 5 раз в неделю. Следует избегать начала ЛТ в пятницу и окончания курса ЛТ в понедельник.
В зависимости от технической оснащенности радиологического отделения могут использоваться различные методики лучевой терапии: от лечения несколькими фигурными полями (требующего четкой стыковки смежных полей облучения во избежание пере- или недооблучения) до новейших методик конформной лучевой терапии (IMRT, RAPIDARC), сводящих к минимуму лучевое воздействие на нормальные ткани.
Для точного воспроизведения положения пациента во время лечения необходимо использовать фиксирующие приспособления – подголовники, индивидуальные пластиковые маски, подставки для нижних конечностей. При облучении всех пораженных зон, кроме паховых и бедренных лимфатических узлов, используются встречные передне-задние фигурные поля (они формируются с помощью защитных блоков или многолепестковых коллиматоров диафрагмы ускорителя).
При дополнительном облучении отдельных групп лимфатических узлов возможно любое расположение полей, минимизирующее лучевое повреждение здоровых тканей. При ЛТ остаточных объёмных опухолей рекомендуется объёмное планирование облучения, применение методики облучения тангенциальными полями, использование компенсаторных клиньев, методик конформной лучевой терапии (3D CRT).
При поражении лимфоидной ткани кольца Вальдейера облучение проводится с двух боковых встречных полей (необходима предварительная санация полости рта, использование защитных кап).
Каждое лечебное поле должно подтверждаться рентгеновскими снимками с помощью симулятора или системой контроля изображения на ускорителе.Объёмы облучения
Для выбора адекватного объёма облучения необходимо помнить об определении областей и зон поражения. На V международном симпозиуме по лимфоме Ходжкина в 2001г. было уточнено, что термином «зона» обозначаются анатомические зоны, по которым устанавливается стадия заболевания в соответствии с классификацией Ann Arbor. Термин «область» – более широкое понятие, область может включать в себя одну или более зон. Так в одну область были включены шейные, над- и подключичные лимфатические узлы с одной стороны. Также в одну область объединены медиастинальные лимфатические узлы и лимфатические узлы корней легких, одной областью считаются лимфатические узлы «верхнего этажа» брюшной полости (ворота печени, ворота селезенки и корень брыжейки) и одной областью – лимфатические узлы “нижнего этажа” брюшной полости — парааортальные и мезентериальные (рисунок 1).
Рисунок 1. Области и зоны поражения при лимфомах
Приложение 7
Факторы риска и профилактика тромботических и тромбоэмболических осложнений
Факторы риска и профилактика тромботических и тромбоэмболических осложнений у пациентов, которые получают талидомид или леналидомидФакторы риска Рекомендуемые действия Индивидуальные факторы риска
· Ожирение (ИМТ более 30 кг/м 2 );
· Предшествующие тромботические события;
· Центральный венозный катетер или искусственный водитель ритма;
· Ассоциированные заболевания и состояния: заболевания ССС, хроническая болезнь почек, диабет, острые инфекции, иммобилизация;
· Хирургические вмешательства: общая хирургия, травма, любая анестезия;
· Использование эритропоэтина;
· Тромбофилии.· Нет факторов риска или один фактор риска (индивидуальный или связанный с лимфопролиферативным заболеванием): ацетилсалициловая кислота 80-325 мг 1 раз в сутки;
· 2 и более индивидуальных или связанных с лимфопролиферативным заболеванием факторов риска:
— Низкомолекулярные гепарины (эквивалент эноксапарина 40 мг 1 раз в сутки);
ИЛИ
— Полная доза варфарина (целевое значение МНО 2-3)Факторы риска связанные с лимфопролиферативным заболеванием:
· Само наличие лимфомы, миеломы в особенности при большой инициальной опухолевой массе;
· Повышенная вязкость крови.Факторы, связанные с лечением:
Сочетание талидомида или леналидомида с:
· Высокими дозами дексаметазона (более 480 мг в месяц);
· Доксорубицином;
· Полихимиотерапией.· Низкомолекулярные гепарины (эквивалент эноксапарина 40 мг 1 раз в сутки);
ИЛИ
· Полная доза варфарина (целевое значение МНО 2-3).Прогностическая модель ассоциированных с химиотерапией тромбоэмболических осложнений KhoranaА.А. и соавт.
Характеристики пациента Баллы Верифицированная лимфома 1 Количество тромбцитов до начала химотерапии 350 тыс/мкл и выше 1 Уровень гемоглобина ниже 100 г/л или использование эритропоэтинов 1 Уровень лейкоцитов до начала химиотерапии выше 11 тыс/мкл 1 ИМТ выше 35 кг/м 2 1 Общее количество баллов Категория риска Риск симптомной тромбоэмболии 0 Низкий 0,8-3% 1, 2 Промежуточный 1,8-8,4% 3 и более Высокий 7,1-41% Рекомендации American Society of Clinical Oncology по профилактике и лечению тромбозов вен и тромбоэмболий у онкологических больных*
Цель Препарат Схема 1 Профилактика Госпитализированные онкологи- ческие больные хирургического или терапевтического профиля 3 Нефракционированный гепарин 5000 ЕД каждые 8 ч 2 Далтепарин 5000 МЕ/сут Эноксапарин 40 мг/сут Фондапаринукс 4 2,5 мг/сут Лечение ТВ и ТЭЛА Начальное 5 Далтепарин 4 100 МЕ/кг каждые 12 ч 200 МЕ/кг/сут 7 Эноксапарин 6 1 мг/кг каждые 12 ч 1,5 мг/кг/сут 6 Гепарин 80 ЕД/кг в/в струйно, затем 18 ЕД/кг/ч в/в (скорость введения корректируют с учетом АЧТВ**) Фондапаринукс 6 < 50 кг — 5 мг/сут 50–100 кг — 7,5 мг/сут > 100 кг —10 мг/сут Тинзапарин 175 МЕ/кг/сут Долгосрочное 3 Далтепарин 200 МЕ/кг/сут в течение 1 мес., затем 150 МЕ/кг/сут Варфарин 5–10 мг/сут внутрь, дозу корректируют так, чтобы МНО составляло 2–3 Примечание*. Общая длительность антикоагулянтной терапии зависит от особенностей случая. Больным с активным злокачественным процессом обычно требуется терапия продолжительностью не менее 6 мес.
Относительные противопоказания к назначению антикоагулянтов включают следующее:
· некупируемое кровотечение;
· острая стадия внутричерепного кровоизлияния;
· расслаивающая аневризма аорты или аневризма сосудов головного мозга;
· бактериальный эндокардит;
· перикардит;
· обострение язвы желудка или других отделов ЖКТ;
· тяжелая, злокачественная артериальная гипертензия или гипертензия без надлежащего лечения;
· тяжелая травма головы;
· беременность (варфарин);
· гепариновая тромбоцитопения (гепарин, нефракционированный и низкомолекулярный);
· введение эпидурального катетера.
Сокращения: АЧТВ — активированное частичное тромбопластиновое время; МНО — международное нормализованное отношение.
1 Если нет особых показаний, все дозы вводятся подкожно.
2 Используется также введение 5000 МЕ каждые 12 ч, но этот режим, по-видимому, менее эффективен.
3 Длительность равна сроку госпитализации или времени до перехода на амбулаторное лечение.
4 FDA США не одобрило применение для этой цели.
5 Минимальный срок 5–7 дней; переход на варфарин возможен, только если МНО находится в допустимых границах 2 дня подряд.
6 Большую роль играет выведение почками. При клиренсе креатинина менее 30 мл/мин препарат назначать нежелательно; если применение все-таки необходимо, следует ориентироваться на анти-Ха-активность.
7 Как правило, используется АЧТВ, в 1,5–2,5 раза превышающее контрольное значение. Лучший метод определения терапевтического диапазона АЧТВ, соответствующего уровню гепарина 0,3–0,7 МЕ/мл, — это хромогенное определение уровня фактора Xa.Приложение 8
Синдром лизиса опухоли
При разрушении опухолевых клеток образуется пять основных субстанций, которые выводятся исключительно почками: продукты распада пурина ® ксантин, гипоксантин и мочевая кислота; калий; фосфат.
Аллопуринол тормозит распад ксантина и гипоксантина до мочевой кислоты путем ингибирования ксантиноксидазы, снижая образование уратов в сыворотке крови.
При превышении порога растворимости ксантин, гипоксантин и мочевая кислота могут кристаллизоваться в почечных канальцах и собирательных трубочках. Фосфат, соединяясь с кальцием, образует фосфат кальция и выпадает как в почечных канальцах, так и в концевых капиллярах тканей, следствием чего являются гипокальциемия, олиго/анурия и тканевые некрозы. Растворимость ксантина и мочевой кислоты в щелочной среде намного выше, чем в кислой, но щелочная среда напротив благоприятствует выпадению в осадок фосфата кальция. Кроме того при рh>7,5 может кристаллизоваться гипоксантин. Следовательно перезащелачивание мочи тоже может благоприятствовать выпадению продуктов клеточного распада.
Если перед началом циторедуктивной терапии наблюдается повышение уровня мочевой кислоты и/или калия, и/или фосфатов и/или креатинина, то мероприятия по нормализации этих показателей должны быть проведены до начала циторедуктивной терапии. Однако начало этой терапии не должно откладываться более чем на 24 часа.
Главным мероприятием является инициирование и поддержание высокого диуреза — 100-250 мл/м 2 / час. Если этого удается добиться, то метаболические нарушения бывают редко.
Если адекватного диуреза несмотря на достаточный объём инфузии, применение различных мочегонных средств (лазикс, маннитол, альбумин) добиться не удается, должны быть своевременно сделаны все необходимые приготовления к гемодиализу. Причиной олиго/анурии в этом случае является распространённое опухолевое поражение почек и/или обструкция опухолью (лимфомой) нисходящих мочевых путей, либо развитие тяжёлой уратной или кальциево-фосфатной нефропатии, либо комбинация этих патологических состояний.
Гиперкалиемия является наиболее опасным осложнением синдрома острого лизиса опухоли. Если после проведения профилактических/терапевтических мероприятий уровень калия повышается или при предшествующей гиперкалиемии не происходит его быстрого снижения, то угрожающее состояние может развиться в течение нескольких ближайших часов.
Тяжелый синдром острого лизиса опухоли часто осложняется развитием гипокоагуляционной фазы синдрома диссеминированного внутрисосудистого свертывания (ДВС), требующего массивной заместительной терапии свежезамороженной плазмой (не мене 1000 мл 2 раза в день), концентратами тромбоцитов и нередко – проведения плазмафереза.Профилактика синдрома лизиса опухоли
1. Аллопуринол — 10 мг/кг в сутки в 2-3 приема (max – 600 мг/сутки) в течение 3 — 8 дней.
Инфузионная терапия:
· Объем = 3000-5000 мл/м 2 /сутки.
· 5% раствор глюкозы « 0,9% раствор NaCl = 1 : 1.
· Удельная плотность мочи < 1010.
· Контроль баланса жидкостей. Баланс: количество выделенной мочи = количество введенной жидкости — потери жидкости с дыханием.
· Контрольное взвешивание 1-2 раза в сутки.
· Интенсивность контроля за диурезом должна соответствовать ситуации и возрасту пациента.
· при недостаточном мочевыведении — лазикс 1-10 мг/кг в сутки внутривенно или инфузией, при сопутствующей гипопротеинемии даже умеренной — альбумин, при необходимости — допамин 3-5 мкг/кг/мин.
· Инициальная инфузия — без калия. Умеренная гипокалиемия — желательна.
· Защелачивание мочи: — NaHCO340 — 80 ммоль/л добавить к постоянной инфузии (или 100-200 ммоль/м 2 /сутки параллельной инфузией).
· Регулирование необходимого объёма NaHCO3 соответственно pH мочи
· значение pH мочи=7,0 является идеальным! — сохраняется достаточная растворимость для мочевой кислоты и ксантина и отсутствует опасность образования фосфорнокальциевых конкрементов.
Лабораторный контроль каждые 12-24 часа: биохимический анализ крови — Na + , K + , Cl — , Ca ++ , фосфаты, мочевая кислота, креатинин, мочевина, белок, альбумин.Приложение 9
Коррекция водно-электролитных нарушений
Гиперурекимия · увеличить объем инфузии до 5000 мл/м 2 /сутки.
· стабилизировать рH мочи на уровне = 7,5 при нормальном содержании фосфатов в крови и на уровне = 7,0 при повышенной концентрации фосфатов в крови. Однако постоянно держать pH мочи на уровне 7,5 нельзя в связи с опасностью кристаллизации гипоксантина.Гипекалиемия при К + >6 ммоль/л:
· подготовить пациента к гемодиализу и перевести в соответствующий центр с возможностью проведения гемодиализа;
· как неотложное мероприятие: глюкоза – 1г/кг + инсулин 0,3 Eд/кг, в качестве 30-минутной инфузии (это приводит только к перераспределению K + внутри клетки, а через 2 — 4 часа распределение K + возвращается к исходному. Следовательно, это только выигрыш во времени для подготовки к гемодиализу).
· при ЭКГ-изменениях: глюконат кальция 10% — 0,5 — 1(-2) мл/кг внутривенно медленно (опасность брадикардии) + NaHCO3 — 2 ммоль/кг внутривенно медленно струйно.
при К>7 ммоль/л: срочно — гемодиализ! и если есть техническая возможность — трансвенозный сердечный регулятор ритма.Гиперфосфатемия (P ++ >1,5 mmol/l или 3 мг/100 мл)
· увеличить объем инфузии до 5000 мл/м 2 /сутки.
· pH мочи не должен быть более 7,0
· назначить aluminiumhydroxid — 0,1 г/кг р.о. (для связывания фосфатов пищи).
· при гипокальциемии — введение кальция показано только при развитии симптомов гипокальцемии (из-за выпадения в осадок фосфата кальция). Глюконат кальция 10% — 0,5 — 1 (- 2) мл/кг внутривенно, медленно (монитор, опасность брадикардии).
· если фосфат > 10 мг/100 мл (5 mмоль/л) или фосфат кальция > 6,0 ммоль/л – срочно гемодиализГипокальциемия Коррекция проводится только при появлении клинических симптомов гипокальциемии:
· глюконат кальция 10% — 0,5 — 1 мл/кг внутривенно, медленно (монитор, опасность брадикардии);
· контроль концентрации Mg ++ При гипомагнезиемии: коррекция магния — 0,2 — 0,8 мэкв/кг в сутки длительной внутривенной инфузией (25% раствор сернокислой магнезии 0,1-0,4 мл/кг в сутки).Олиго-/анурия Отделение мочи менее 50 мл/м 2 в час, несмотря на введение фуросемида 10 мг/кг в сутки и инфузионную терапию в объеме 130-200 мл/м 2 в час
«Обычное» определение < 5 мл/м 2 в час к данной ситуации не применимо. Диурез должен оцениваться только вместе с объёмом реально вводимой жидкости.
Возможные причины:
· УЗИ: Обструкция мочевыводящих путей; Инфильтрация почек;
· лаборатория: K + , Ca ++ , мочевая кислота, фосфат;
· моча: кристаллы уратов, кристаллы фосфата кальция;
· терапия: гемодиализ, самое позднее при подъёме K + > 6 mmol/L.Показания к гемодиализу · K + > 7 mmol/L или подъём > 6 mmol/L несмотря на достаточную инфузионную терапию и диуретики;
· фосфат > 10 мг/100 мл (5 ммоль/л) или продукт CaxP> 6,0 ммоль/л;
· отделение мочи менее 50 мл/м 2 в час, несмотря на введение фуросемида 10 мг/кг в сутки и инфузионную терапию в объеме 130-200 мл/м 2 в час;
· двусторонняя высокая или полная обструкция мочевыводящих путей.Лимфома

Лимфома – это злокачественное заболевание, которое характеризуется поражением лимфатических узлов и внутренних органов, в которых скапливаются «опухолевые» лимфоциты.
Смотрите также
Дата создания материала: 01-05-2020
Дата обновления: 11-05-2023Лимфома (lymphoma) – злокачественная опухоль клеток иммунитета.При ней лимфоциты увеличиваются до гигантских размеров, бесконтрольно делятся и поражают лимфатическую систему: лимфоузлы, костный мозг, вилочковую железу.
От других онкологических заболеваний лимфома отличается диссеминацией по всему организму: с током лимфы переродившиеся злокачественные клетки попадают во внутренние органы и критически нарушают их работу. Болезнь долго течет бессимптомно, а когда начинает проявляться, то часто весь организм уже поражен.
Большинство лимфом характеризуется прогрессирующим течением и высокой злокачественностью с метастазированием. Тем не менее при раннем их выявлении благоприятный прогноз достигает ~90%.
Статистические данные о лимфомах:
- Ежегодно в России выявляют около 25 000 пациентов с раком данного типа – это 4% от всех онкобольных.
- Мужчины болеют чаще, чем женщины.
- Возрастной пик заболеваемости – 30-34 года и после 60 лет.
- В группе риска – больные с артритом двух и более суставов.
- Провоцирующий фактор – дефицит селена в организме.
- Есть предположение, что окрашивание волос чаще 1 раза в месяц темной краской увеличивают риск развития лимфомы на 26%.
- Считается что витамин Д обладает защитными свойствами против лимфомы.
- Благодаря современным методикам и препаратам за последние 10 лет смертность от лимфом в России снизилась на 27%.
Виды лимфом
Различают две основные группы заболевания – лимфому Ходжкина и неходжкинские лимфомы. Они развиваются из разного типа клеток, отличаются характером течения и по-разному реагируют на терапию.
Лимфома Ходжкина (ЛГМ) – лимфогранулематоз, злокачественная гранулема.ХарактеризуетсяпоражениемВ-лимфоцитов. Отличается агрессивным течением, при этом хорошо поддается лечению Источник:
И.И. Яковцова, В.Д. Садчиков, В.М. Садчикова, О.В. Долгая, С.В. Данилюк, А.Е. Олейник Лимфома Ходжкина: эволюция клинических классификаций // Вестник проблем биологии и медицины, 2013, №3, т.2 (103), с.62-69 .Неходжкинские лимфомы (НХЛ) поражают не только В-, но и Т-лимфоциты. Всего выделено 30 подтипов.Большинство из них менее агрессивно, но и труднее лечится.
Классификация неходжкинских лимфом в соответствии с 4-й редакцией ВОЗ 2008 года:
- В-лимфобластная НХЛ;
- болезнь тяжелых цепей;
- В-клеточный пролимфоцитарный лейкоз;
- волосатоклеточный лейкоз;
- диффузная В-крупноклеточая НХЛ;
- лейкоз Беркитта;
- НХЛ из клеток мантийной зоны;
- лимфоплазмоцитарная НХЛ;
- медиастинальная диффузная В-крупноклеточая НХЛ;
- нодальная В-клеточная НХЛ маргинальной зоны;
- первичная экссудативная НХЛ;
- плазмоклеточная плазмоцитома/миелома;
- селезеночная НХЛ маргинальной зоны;
- фолликулярная НХЛ;
- хронический лимфолейкоз;
- экстранодальная В-клеточная НХЛ маргинальной зоны;
- Т-лимфобластная НХЛ;
- агрессивный NK-клеточный лейкоз;
- анапластическая крупноклеточная НХЛ с первичным поражением кожи;
- анапластическая крупноклеточная НХЛ с первичным системным поражением;
- ангиоиммунобластная Т-клеточная НХЛ;
- гепатолиенальная Т-клеточная НХЛ;
- грибовидный микоз Сезари;
- неуточненная периферическая Т-клеточная НХЛ;
- Т-клеточная панникулитоподобная НХЛ подкожной клетчатки;
- Т-клеточный лейкоз;
- Т-клеточный лейкоз из больших гранулярных лимфоцитов;
- Т-клеточный пролимфоцитарный лейкоз;
- экстранодальная NK/T-клеточная лимфома назального типа;
- энтеропатическая Т-клеточная НХЛ.
Самые распространенные в клинической практике лимфомы: Ходжкина, фолликулярная и диффузная В-крупноклеточная Источник:
Г.С. Тумян Неходжкинские лимфомы // Клиническая онкогематология, 2015, 8(4), с.455-470 .По характеру поражения и патогенезу все лимфомы делятся на 3 основные группы:
- агрессивные – для них характерно быстрое развитие с ярко выраженной симптоматикой;
- экстранодальные – первичное поражение формируется не в лимфатических узлах, а сразу во внутренних органах;
- индолентные – отличаются своим медленным и благоприятным течением; могут не требовать терапии, иногда достаточно регулярно наблюдаться у врача.
Для каждого вида лимфом существует особая схема лечения.
Стадии лимфом
В зависимости от распространенности опухоли определяют стадию патологического процесса. В соответствии с международной классификацией Ann Arbor выделяют 4 стадии заболевания:
- На 1-й стадии в лимфомный процесс может быть вовлечена одна группа лимфатических узлов.
- На 2-й допускается вовлечение двух и более групп по одну сторону от диафрагмы.
- На 3-й стадии опускается поражение лимфатических узлов по обе стороны диафрагмы.
- На 4-й стадии в процесс вовлекаются внутренние органы – мозг, сердце, печень, селезенка, желудок, кишечник.
Каждую стадию дополнительно маркируют титрами А и Б. Титр А указывает на отсутствие ключевых симптомов – лихорадки, сильной ночной потливости и резкого снижения веса. Титр Б указывает, что такие проявления есть.
Причины возникновения лимфом
Единого причинного фактора развития заболевания не выделено. На данный момент ученые считают, что патпроцесс запускается комплексом причин. К ним относят:
- наследственную предрасположенность;
- регулярные контакты с токсинами и канцерогенами;
- вирус герпеса, гепатита, хеликобактер пилори и другие инфекционные заболевания;
- аутоиммунные и иммунодефицитные состояния;
- повторяющиеся пневмонии;
- иммуноподавляющую терапию после пересадки почек, стволовых леток и т. д.;
- операции по вставке грудных имплантатов (предположительно).
Симптомы
Помимо основных симптомов – лихорадки, сильной ночной потливости и резкого снижения веса – для патологии характерны:
- слабость и повышенная утомляемость;
- повышение температуры;
- потеря веса;
- увеличение лимфатических узлов (часто, но не всегда; при этом они безболезненны и не уменьшаются в результате лечения антибиотиками, как при инфекционных заболеваниях).
Иногда возможен кожный зуд. При поражениях опухолью грудной клетки возможны затрудненное дыхание, одышка и кашель. При локализации новообразования в брюшной полости наблюдают расстройства пищеварения, тошноту, рвоту, распирающие боли в животе и нижней части спины. При поражении костного мозга больные жалуются на боли в костях. Если в патологию вовлечены лицевые и черепные структуры, есть жалобы на головные боли и распирающие боли в лице и шее.
Диагностика лимфом
Диагноз ставят по результатам микроскопического исследования биоптата – образца лимфоидной ткани. По результатам дифференциальной биопсии определяют тип опухоли.
Чтобы выявить опухоли в разных частях тела, применяют методы лучевой диагностики: рентгенографию, сцинтиграфию, магнито-резонансную, позитронно-эмиссионную и компьютерную томографию. При необходимости уточнить некоторые особенности патпроцесса назначают лабораторные анализы крови – иммуноферментотипирование методом проточной цитометрии, молекулярно-генетические и цитогенетические исследования Источник:
Wang HW, Balakrishna JP, Pittaluga S, Jaffe ES Diagnosis of Hodgkin lymphoma in the modern era // Br J Haematol. 2019 Jan;184(1):45-59. doi: 10.1111/bjh.15614. Epub 2018 Nov 8 .Методы лечения
Наиболее распространенные методы лечения лимфом:
- лучевая терапия;
- химиотерапия;
- радиотерапия;
- биологическая терапия;
- трансплантация стволовых клеток;
- хирургическое вмешательство.
Они применяются как в виде отдельных курсов, так и в комплексе. Выбор лечебной схемы зависит от вида опухоли и общего состояния больного.
Лечебная тактика
Индолентные лимфомы могут не требовать лечения, а только наблюдения онкогематолога. Терапия показана при первых признаках прогрессирования патпроцесса. При локализованных опухолях достаточно радиотерапевтического облучения пораженных структур. При генерализованных формах показана химиотерапия.
При агрессивном течении заболевания одна из наиболее эффективных лечебных схем – химиотерапия по протоколу СНОР в сочетании с иммунотерапевтическимипрепаратами из группы моноклональных антител. При высокоагрессивных видах опухолей может быть назначена высокодозная химиотерапия в сочетании с трансплантацией кроветорных стволовых клеток.
Лечение отдельных типов лимфом
Основной метод лечения лимфомы Ходжкина ЛГМ – химиотерапия. Противоопухолевые цитотоксины назначают в разных лекарственных формах. Химиотерапия носит цикличный характер – медикаментозные курсы чередуются с периодами реабилитации Источник:
Sermer D, Pasqualucci L, Wendel HG, Melnick A, Younes A Emerging epigenetic-modulating therapies in lymphoma // Nat Rev Clin Oncol. 2019 Aug;16(8):494-507.doi: 10.1038/s41571-019-0190-8 .Радиотерапия – излучение высокой мощности – в качестве самостоятельного лечения ЛГМ может быть оправдана в отдельных случаях – когда в процесс вовлечена одна, максимум две группы лимфатических узлов. Чаще ее назначают в комплексе с химиотерапией. На поздних стадиях заболевания метод показан в качестве паллиативного лечения.
Биологические препараты – моноклональные антитела – при лечении лимфомы применяют для активизации иммунной системы. Лучевую терапию проводят регионарно, в области вовлеченных в онкологический процесс лимфоузлов.
В некоторых случаях при лечении ЛГМ оправдано удаление селезенки. Если увеличенные лимфатические узлы сдавливают соседние органы,может быть показано их иссечение.
При рецидивах заболевания, а также с целью уничтожения раковых клеток, на которые не действуют стандартные дозировки лучевой и химиотерапии, назначают высокие терапевтические дозы, разрушающие вместе с опухолью ткани костного мозга. После такого курса показана трансплантация органа. Взятые заранее собственные либо донорские стволовые клетки формируют новую иммунную систему.
Хорошие результаты в лечении НХЛ демонстрирует также комбинация лучевой и химиотерапии. В некоторых случаях успешно применяют инновационную техникулюмбально-пункционного введения противоопухолевых антител.
НХЛ с агрессивным течением плохо поддаются лечению. Наиболее эффективный метод борьбы с этим заболеванием – пересадка костного мозга.
Прогнозы
Прогноз для пациентов с лимфомами зависит от стадии процесса, возраста и состояния больного, а также от результатов терапии. При лимфоме Ходжкина пациенты молодого возраста на ранних стадиях,как правило, полностью выздоравливают. У 8 из 10 удается добиться устойчивой ремиссии. Пятилетняя выживаемость при 1-й стадии составляет 95%, при 4-й – 65%.
При НХЛ селезенки, лимфоузлов и слизистых средняя пятилетняя выживаемость – порядка 70%. При НХЛ ЖКТ, слюнных желез, глазных орбит средняя пятилетняя выживаемость – около 60%. Менее благоприятный прогноз у агрессивных НХЛ молочных желез, яичников, ЦНС и костей – пятилетняя выживаемость в среднем меньше 30%.
Клинические рекомендации после лечения лимфом и профилактика
Избегайте факторов риска – интоксикаций и контакта с канцерогенами. Вакцинируйтесь, а если заболели инфекционной болезнью – не занимайтесь самолечением.
При первых признаках лимфомы обращайтесь к врачу. Ежегодно проходите профилактические медосмотры, придерживайтесь правильного питания и старайтесь вести здоровый образ жизни.
Источники:
- И.И. Яковцова, В.Д. Садчиков, В.М. Садчикова, О.В. Долгая, С.В. Данилюк, А.Е. Олейник. Лимфома Ходжкина: эволюция клинических классификаций // Вестник проблем биологии и медицины, 2013, №3, т.2 (103), с.62-69.
- Г.С. Тумян. Неходжкинские лимфомы // Клиническая онкогематология, 2015, 8(4), с.455-470.
- Wang HW, Balakrishna JP, Pittaluga S, Jaffe E. Diagnosis of Hodgkin lymphoma in the modern era // Br J Haematol. 2019 Jan;184(1):45-59. doi: 10.1111/bjh.15614. Epub 2018 Nov 8.
- Sermer D, Pasqualucci L, Wendel HG, Melnick A, Younes A. Emerging epigenetic-modulating therapies in lymphoma // Nat Rev Clin Oncol. 2019 Aug;16(8):494-507.doi: 10.1038/s41571-019-0190-8.
3.00 из 5. Голосов: 6
Спасибо за вашу оценку.
Информация проверена экспертом
Михайлов Алексей Геннадьевич оперирующий онколог, врач высшей квалификационной категории, к.м.н. стаж: 22 года
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
Читайте также
- Неходжкинская лимфома
- Лимфома Ходжкина
- Множественная миелома
Т-клеточная лимфома кожи
Т-клеточная лимфома кожи (ТКЛК) — это разнородная группа заболеваний, относящихся к неходжкинским лимфомам, основной чертой которых является инфильтрация кожи злокачественными моноклональными Т-лимфоцитами.
- Почему развивается Т-клеточная лимфома кожи
- Виды Т-клеточных лимфом кожи и их стадии
- Как проявляется лимфома кожи, симптомы
- Диагностика Т-клеточной лимфомы кожи
- Как проводится лечение лимфомы кожи
- Трансплантация костного мозга и стволовых клеток
- Процесс восстановления после лечения
- Прогноз
Почему развивается Т-клеточная лимфома кожи
Возникновение Т-клеточной лимфомы связано с мутацией зрелых Т-лимфоцитов, что приводит к их бесконтрольному размножению, миграции в кожу и ее инфильтрации. Что именно вызывает мутацию, неизвестно. Предполагается, что она может быть спровоцирована стимуляцией антигенами в результате сбоя работы иммунной системы.
Спровоцировать сбой иммунной системы могут следующие факторы:
- Вирусные инфекции: вирус Эпштейн-Барра, цитомегаловирус, вирус простого герпеса, ретровирусы, лимфотропный вирус человека и др.
- Некоторые химические вещества, которые используются в промышленности, сельском хозяйстве, строительстве и др.
- Ионизирующее излучение, в том числе лучевая терапия в анамнезе.
- Избыточное воздействие УФ-лучей на кожу.
Т-клеточная лимфома кожи может быть первичной и вторичной. Первичные формы начинаются с поражения кожи. При вторичных сначала поражается лимфоидный орган (например, лимфоузлы), в результате чего в нем происходит размножение и накопление лимфоцитов, потом они мигрируют в кожу и инфильтрируют ее.
Виды Т-клеточных лимфом кожи и их стадии
Выделяют следующие виды Т-клеточной лимфомы кожи:
- Грибовидный микоз.
- Синдром Сезари.
- CD30+ Т-клеточные лимфомы — лимфатоидный папулез (ЛП) и кожная анапластическая крупноклеточная лимфома (КАКЛ).
- Панникулитоподобная Т-клеточная лимфома подкожной клетчатки.
- Первичная кожная агрессивная эпидермотропная CD8+ Т-клеточная лимфома.
- Первичная кожная мелко/среднеклеточная CD4+ Т-клеточная лимфома.
Наиболее часто встречаемые первые 2 типа опухоли. При их стадировании заболевания учитываются следующие факторы:
- Степень поражения кожных покровов.
- Вовлеченность в процесс лимфатических узлов.
- Лимфоидное поражение внутренних органов.
- Поражение системы кроветворения.
Их стадирование происходит согласно следующей схеме:
- 1А стадия. Имеются кожные поражения в виде пятен, которые занимают менее 10% кожного покрова, лимфоузлы не увеличены, в крови обнаруживается незначительное количество атипичных клеток Сезари.
- 1В стадия. Помимо пятен на коже, образуются бляшки, но объем высыпаний не превышает 10% от кожного покрова. Остальные признаки такие же, как на 1А стадии.
- 2А стадия. К вышеперечисленным симптомам добавляется поражение лимфатических узлов.
- 2В стадия. На коже появляются узлы.
- 3 стадия. Кожные проявления генерализуются, образуют сливающуюся эритему и покрывают более 90% поверхности тела.
- При 4 стадии, в крови обнаруживается большое количество атипичных клеток Сезари (более 1000 на микролитр), плюс присоединяется лимфоидное поражение внутренних органов.

Пациентов с синдромом Сезари изначально относят к 4 стадии заболевания, поскольку у них имеется обширная эритродермия и большое количество атипичных лимфоцитов в крови.
Остальные нозологии Т-клеточных лимфом, не являющиеся грибовидным микозом и синдромом Сезари, стадируются на основании следующих признаков:
- Т1А — имеется единичный очаг поражения не превышающий 5 см.
- Т1В — единичный очаг поражения, превышающий 5 см.
- Т2 — имеются множественные высыпания кожи, не выходящие за пределы 1-2 зон
- Т2А — зона поражения не превышает 15 см.
- Т2В — зона поражения не превышает 30 см.
- Т2С — высыпания распространяются более чем на 30 см.
- Т3 — имеется поражение кожи, затрагивающее не рядом расположенные зоны, либо высыпания занимают более 3 зон.
Поражение лимфатических узлов:
- N0 — нет увеличения лимфоузлов, ни центральных, ни периферических.
- N1 — поражена 1 группа периферических ЛУ, которые осуществляют лимфодренаж от пораженного участка кожи.
- N2 — поражено более 1 группы ЛУ, липо есть признаки поражения ЛУ, не осуществляющих дренаж вовлеченной области кожи.
- N3 имеются данные за поражение центральных ЛУ.
Поражение внутренних органов:
- М0 — поражения внутренних органов не обнаружено.
- М1 — есть данные за поражение внутренних органов (требуется морфологическое подтверждение).
Как проявляется лимфома кожи, симптомы
Симптоматические проявления будут зависеть от типа Т-клеточной лимфомы.
Симптомы грибовидного микоза:
- Высыпания в виде пятен и бляшек различной формы и цвета. Они носят множественный характер и располагаются на участках кожи, не подвергающихся инсоляции (зона купальника).
- Феномен одновременного прогрессирования и регресса разных элементов сыпи.
- Пойкилодермия — в зоне клеточных высыпаний имеется пятнистая пигментация, расширение кровеносных сосудов и атрофические изменения кожи.
- Наличие зуда.
В зависимости от стадии заболевания, грибовидный микоз будет иметь следующие особенности. На начальном этапе (1 стадия) отмечается наличие множественных или единичных пятен, которые могут достигать размеров в 20 см. Пятна зудят и могут шелушиться. Внешне они напоминают псориаз или экзему. На этой стадии заболевание может существовать годами и даже десятилетиями. Пятна могут спонтанно регрессировать и образовываться снова. Учитывая то, что клиническая картина сходна с другими дерматологическими нозологиями, правильный диагноз сразу поставить сложно, как правило, на это занимает достаточно длительное время.
Для второй стадии пятна начинают трансформироваться в бляшки — пораженная кожа утолщается и как бы приподнимается над здоровой, ее цвет становится красно-синюшным. Бляшки могут спонтанно регрессировать, или, наоборот, увеличиваться в размерах и сливаться друг с другом. На их поверхности может быть шелушение.
На 3 стадии образуются кожные опухоли в виде куполообразных красно-синюшных узлов, с гладкой поверхностью. Узлы увеличиваются в размерах и распадаются, при этом образуются язвы с кровянисто-гнойным отделяемым.
Панникулитоподобная Т-клеточная лимфома подкожной клетчатки проявляется множественными плотными бляшками, либо узлами различного цвета, которые преимущественно располагаются на нижних конечностях. Клинически напоминают панникулит (воспаление подкожной клетчатки).
Первичная CD4+кожная лимфома из мелких/крупных клеток проявляется единичными или множественными узлами синюшно-багрового цвета. В отличие от грибовидного микоза, узлы появляются сразу, без этапа пятна и бляшки.
Клиническим проявлением синдрома Сезари является наличие обширной эритемы (покраснения кожи), которая распространяется не менее чем на 80% покровов тела. Эритема может шелушится, но не обязательно. Характерно увеличение лимфоузлов до размеров ореха. Чаще всего, поражаются паховые и подмышечные ЛУ.
CD30+ Т-клеточная лимфома проявляется рецидивирующими сгруппированными или диссеминированными папулезными высыпаниями. Отдельные элементы могут спонтанно регрессировать в течение нескольких недель, причем на данном фоне могут образовываться новые папулы. В ряде случаев элементы сыпи могут некротизироваться с образованием некротических язв размером от 1 до 4 см, которые самопроизвольно разрешаются с формированием рубца.
Диагностика Т-клеточной лимфомы кожи
Для постановки диагноза необходимо комплексное обследование:
- Осмотр кожных высыпаний.
- Морфологическое и иммунотипическое исследование биоптатов кожи из очагов поражения. Чтобы результаты биопсии были более информативным, необходима отмена всех наружных препаратов, а также системных глюкокортикостероидов за две недели до забора материала. В сомнительных случаях проводят повторную биопсию через 2-4 недели после предыдущей и материал берут из разных очагов.
- Молекулярно-генетические исследования для определения характерных генетических мутаций.
При подозрении на синдром Сезари проводят такое же обследование, как и при грибовидном микозе (ГМ), плюс добавляют следующие данные:
- Определение площади поражения кожи. Если есть узлы, определяют их количество и размер наибольшего из них.
- Производят определение количества клеток Сезари с помощью проточной цитометрии.
Запись на консультацию круглосуточно
Как проводится лечение лимфомы кожи
Для лечения лимфомы кожи используется химиотерапия. Схемы будут определяться типом заболевания и его стадией.
Лечение грибовидного микоза
При 1А стадии возможна тактика наблюдения — «наблюдай и жди». При прогрессировании до 1В и 2А стадии проводится наружная терапия, при этом используются следующие средства:
- Топические кортикостероиды. Их необходимо наносить на поверхность пятен и бляшек.
- УФО спектра В — узковолоконное ультрафиолетовое облучение лучами спектра В. Может применяться для пятен и тонких бляшек.
- ПУВА-терапия — псорален + УФО лучами спектра А. Данный вид лечения эффективен при толстых бляшках и фолликулярной форме ГМ.
- Локальная лучевая терапия в СОД 10-20 Гр. Применяется при единичных высыпаниях.
- Тотальная лучевая терапия (ТЛК). Проводится при наличии распространенных высыпаний, которые не реагируют на топические стероиды. Облучение проводится в суммарной очаговой дозе 30-40 Гр с фракционированием разовой очаговой дозы 1,2-1,5Гр. В качестве поддерживающего лечения после ТЛК применяется ПУВА-терапия. Т-клеточная лимфома кожи является чувствительной к облучению опухолью, поэтому лучевая терапия может применяться, как терапия первой линии при лечении ранних и поздних лимфом, так и для лечения рецидивов.

Если наружная терапия лимфомы кожи не оказала эффекта, добавляют вторую линию терапии, в рамках которой могут использоваться следующие системно действующие препараты:
- Ретиноиды.
- Интерфероны.
- Вериностат — ингибитор гистондеацетилазы.
- Цитостатики метотрексат или проспидин.
Лечение поздних стадий (2В-4В) лимфомы кожи
На поздних стадиях лимфомы кожи используется химиотерапия и электронно-лучевая терапия. Химиотерапия проводится с помощью вориностата. Его необходимо принимать перорально до достижения контроля заболевания (критериями контроля является отсутствие признаков прогрессирования). В случае развития неприемлемых токсических реакций препарат отменяют.
Лечение синдрома Сезари
Лечение СС базируется на следующих принципах:
- Комбинированное лечение (наружное и системное) является более эффективным, чем монотерапия.
- По возможности, следует избегать назначения цитостатиков, поскольку они подавляют иммунитет.
- Необходима своевременная диагностика и лечение инфекционных осложнений.
- Поскольку одним из основных симптомов, снижающих качество жизни пациентов, является зуд. Необходимо его эффективное устранение.
Терапия первой линии
Наилучшую эффективность в рамках терапии первой линии у больных с СС показал экстракорпоральный фотоферез (ЭКФ). Из цельной крови выделяют лейкоциты, которые обрабатывают фотосенсибилизирующим веществом и затем обрабатывают светом с заданной длиной волны. Это приводит к их гибели. За одну процедуру можно удалить только часть клеток, поэтому сеансы повторяют с определенной периодичностью — 1 раз в день в течение 2-х дней с последующим 4-х недельным перерывом.
Также может использоваться альфа-интерферон, только в более высоких дозах, чем при лечении ГМ, или метотрексат в низких дозах, при недоступности других видов терапии.
Для достижения лучшего эффекта, эти методы лечения комбинируют с методами наружной терапии, которые используются при ГМ, например:
- Альфа-интерферон + ПУВА.
- Метотрексат + наружные глюкокортикостероиды.
- ЭКФ + ТОК и др.
Терапия второй линии
При отсутствии эффекта от лечения первой линии, переходят ко второй. Здесь уже используются цитостатические препараты:
- Хлорамбуцил.
- Доксорубицин.
- Вориностат.
- Гемцитабин.
- Пентостатин.
- Флударабин+циклофосфамид.

Устранение зуда
Часто больных кожной лимфомой беспокоит зуд. Он может иметь ярко выраженный характер и существенно снижать качество жизни таких людей. Для борьбы с этим симптомом используются следующие препараты и методы терапии:
- Увлажняющие кремы.
- Антигистамины.
- Антибиотики. Доказано, что кожа больных СС обширно колонизирована золотистым стафилококком, поэтому назначение антибактериальных препаратов благоприятно сказывается не только на выраженности зуда, но и на общем течении заболевания.
Если зуд носит нестерпимый характер, назначается габапентин, который используется для лечения боли при нейропатиях. Начинают с дозировки 900 мг/сут, постепенно увеличивая ее до 3600 мг/сут. Для улучшения сна могут назначаться снотворные препараты.
Лечение лимфоматоидного папулеза
В настоящее время нет методов лечения, способных изменить ход течения заболевания или предотвратить его трансформацию в лимфому. Сам лимфоматоидный папулез не влияет на продолжительность жизни, поэтому тактика воздержания является предпочтительной — «наблюдай и жди».
Если имеются многочисленные генерализованные высыпания, используется ПУВА-терапия и низкие дозы метотрексата. Во время терапии наблюдается частичное исчезновение высыпаний, но после отмены лечения, они образуются снова. Полной ремиссии удается достичь редко.
В связи с этим, для контроля лечения необходима поддерживающая терапия с помощью данных методов, но необходимо помнить о возможных осложнениях. Например, ПУВА может спровоцировать развитие рака кожи, а метотрексат — фиброз печени.
Если имеются крупноузелковые элементы (более 2 см), которые не разрешаются самопроизвольно или под действием терапии, их можно удалить хирургически. Тем более при их наличии необходима биопсия для исключения вторичной анапластичной крупноклеточной лимфомы. Альтернативой может стать локальная лучевая терапия. В целом пациенты с ЛП должны пожизненно наблюдаться у врача, поскольку есть вероятность трансформации их заболевания в другие формы лимфом.
Лечение АКЛК
При одиночных или сгруппированных высыпаниях показано их хирургическое удаление или локальное облучение. Такая тактика позволяет добиться полной ремиссии у 95% пациентов. Но независимо от применяемого метода лечения, у 40% больных возникают рецидивы. Если они ограничены только кожными проявлениями, без затрагивания лимфатических узлов и внутренних органов, других методов лечения не требуется, можно использовать предыдущую тактику.
Для больных с множественными высыпаниями рекомендованы низкие дозы метотрексата (5-25 мг/нед). Если желаемый эффект не наступает, добавляют терапию альфа-интерфероном. При наличии очагов внекожного проявления необходима системная химиотерапия по протоколу CHOP.
Трансплантация костного мозга и стволовых клеток
При неэффективности других методов лечения, молодым пациентам с поздними стадиями заболевания может быть рекомендована химиотерапия с последующей аллогенной трансплантацией гемопоэтических стволовых клеток (ГСК). Процедура проводится следующим образом.
Первый этап — это химиотерапия, которая призвана уничтожить клон злокачественных Т-лимфоцитов. Этот этап называется кондиционирование. В рамках химиотерапии используются следующие препараты и режимы:
- CHOP — циклофосфамид, доксорубицин, винкристин, преднизолон
- EPOCH — этопозид, циклофосфамид, доксорубицин, винкристин, преднизолон.
- Пентостатин.
- Флурадабин+ интерферон альфа или циклофосфамид.
- Гемцитабин.
Вторым этапом является пересадка гемопоэтических клеток донора. Для реципиента эта процедура не представляет проблем и выглядит как обычное переливание крови. В течение последующих 3-4 недель трансплантат начинает приживаться в костном мозге, о чем свидетельствует повышение уровня лейкоцитов в крови. Генетически, это лейкоциты донора, и они должны полностью заменить иммунную системы больного. Весь этот процесс занимает от нескольких месяцев до года.
Процесс восстановления после лечения
Первый год после аллогенной трансплантации можно сравнить с периодом новорожденности — человек получает полностью новую иммунную систему, которая никогда раньше не сталкивалась с инфекционными заболеваниями. На ее «обучение» нужно время, и в этот период рекомендуется соблюдать ряд правил, которые помогут предотвратить инфицирование. Более подробно о них расскажут в больнице.
После того как иммунная система восстановится, необходимо будет заново пройти полный курс вакцинации, который выполняется в детском возрасте.
Прогноз
Прогноз заболевания зависит от клинической формы Т-клеточной лимфомы и ее стадии. Для пациентов с ранней стадией ГМ прогноз благоприятный, поскольку эта лимфома кожи очень редко прогрессирует до более серьезных стадий, и средняя продолжительность жизни таких больных составляет 12 лет.
Для пациентов с изначально более поздними стадиями Т-клеточной лимфомы (2В и больше) без признаков поражения внутренних органов, средняя продолжительность жизни составляет 5 лет, при этом для больных с поражением лимфоузлов прогноз несколько хуже, чем при системном обширном поражении кожи. Для больных, у которых лимфома кожи поразила внутренние органы, средняя продолжительность жизни составляет 2,5 года.
CD 30+ Т-клеточные лимфомы характеризуются относительно доброкачественным течением. В частности, лимфоматоидный папулез не влияет на продолжительность жизни больных, за исключением случаев трансформации в другие виды лимфом, в том числе грибовидный микоз, лимфому Ходжкина и др. Трансформация возникает у 4-25% больных и может возникнуть в период дебюта ЛП, после его излечения и даже предшествовать ему. Кожная анапластическая крупноклеточная лимфома также характеризуется благоприятным прогнозом, пятилетней выживаемости достигают 96% больных.
Источник https://diseases.medelement.com/disease/%D1%82-%D0%BA%D0%BB%D0%B5%D1%82%D0%BE%D1%87%D0%BD%D1%8B%D0%B5-%D0%BB%D0%B8%D0%BC%D1%84%D0%BE%D0%BC%D1%8B-%D1%83-%D0%B2%D0%B7%D1%80%D0%BE%D1%81%D0%BB%D1%8B%D1%85/14979
Источник https://oncology-spb.ru/zabolevaniya/krov/limfoma
Источник https://www.euroonco.ru/onkogematologiya/limfoma/t-kletochnaya-limfoma-kozhi