Пневмония схема лечения в амбулаторных условиях
А.И. Синопальников
Российская медицинская академия непрерывного профессионального образования, Москва, Россия
Пневмония остается серьезной проблемой общественного здравоохранения в связи с неприемлемо высокой заболеваемостью и смертностью. К числу вопросов, требующих решения, следует прежде всего отнести трудности в установлении первоначального клинического диагноза пневмонии, стратификацию риска неблагоприятного исхода заболевания, оптимизацию выбора эмпирической антибиотикотерапии, относительную нехватку новых антибиотиков и важность знания местных особенностей микробиологической чувствительности пневмотропных микроорганизмов. В статье обсуждается проблема ведения взрослых больных внебольничной пневмонией (ВП). Представлены сведения об эпидемиологии, диагностике, стратификации больных ВП по степени риска неблагоприятного исхода заболевания с целью определения пациентов этой категории, которые могли бы получать амбулаторное лечение без ущерба конечной эффективности и безопасности, а также антибактериальной терапии больных ВП в амбулаторных условиях, в т.ч. с применением новых антибиотиков.
Ключевые слова: внебольничная пневмония, амбулаторное лечение, антибиотикотерпия, вакцинация
Введение
Прошло более четверти века с момента публикации первого международного руководства по ведению взрослых больных внебольничной пневмонией (ВП) [1]. Этот документ, подготовленный экспертами Американского торакального общества и увидевший свет в 1993 г., не только оказался пионерским, но и имел далеко идущие последствия, радикально изменив существовавшие на тот момент подходы к диагностике и лечению пациентов данной категории.
В 1881 г. L. Paster [2] и G.M. Sternberg [3] независимо друг от друга описали микроорганизм, позднее названный A. Fraenkel пневмококком, что подчеркивало причинно-следственные связи между данным возбудителем и воспалением легких [4]. А два десятилетия спустя W. Osler не без доли сарказма определил клиническую сущность пневмонии как «надежного лоцмана человека на пути к его смерти» [5]. Введение в клиническую практику сывороточной терапии, особенно вакцин и антибиотиков, оказало значительное влияние на результативность лечения и профилактики пневмонии в течение ХХ в. Однако последние 50–60 лет не были отмечены никакими существенными нововведениями в терапии ВП. Одновременно с этим все чаще описываются новые возбудители заболевания (в частности, SARS-CoV, MERS-CoV, SARS-CoV-2) и патогены с множественной лекарственной устойчивостью, что вызывает обоснованное беспокойство во врачебном сообществе.
Все вышесказанное указывает на то, что пневмония остается серьезной проблемой общественного здравоохранения с неприемлемо высокой заболеваемостью и смертностью [6].
К числу вопросов, требующих решения, следует прежде всего отнести трудности в установлении первоначального клинического диагноза ВП, стратификацию риска неблагоприятного исхода заболевания, оптимизацию выбора эмпирической антибиотикотерапии, относительную нехватку новых антибиотиков и важность знания местных особенностей микробиологической чувствительности пневмотропных микроорганизмов. Между тем неопределенность в диагностике ВП также приводит к чрезмерному использованию антибиотиков и росту антибиотикорезистентности бактерий. К сожалению, с нетерпением ожидавшаяся новая версия согласительных рекомендаций Американского торакального общества/Американского общества инфекционных болезней [7] не смогла приблизиться к решению большинства из них.
Эпидемиология
Инфекции дыхательных путей (в т.ч. и ВП) остаются наиболее распространенными инфекционными заболеваниями в амбулаторной практике [8]. Однако определение истинной заболеваемости ВП остается сложной задачей, поскольку пациенты с легкими системными и респираторными симптомами нечасто обращаются за медицинской помощью. Так, например, на одного семейного врача во Франции в течение года приходится менее семь случаев ВП [9]. Здесь же следует принимать во внимание и то обстоятельство, что распространенность/доступность подтверждающих диагностических тестов (рентгенография органов грудной клетки и др.) на месте оказания медицинской помощи широко варьируется.
С учетом этих ограничений предполагаемая годовая заболеваемость ВП составляет 5–11 случаев на 1000 взрослых [10]. Важно также учитывать и выраженную сезонную вариабельность заболеваемости ВП (чаще заболевание наблюдается во второй половине осени–зимой), U-образное возрастное распределение (чаще у детей и пожилых людей), гендерную асимметрию (чаще у мужчин), а также ее заведомо бόльшую распространенность среди лиц с известными факторами риска (алкоголь, курение, хронические бронхолегочные заболевания, почечная недостаточность, дефицит питания и др.) или принимающих соответствующие лекарственные средства (ингаляционные глюкокортикостероиды, ингибиторы протонной помпы, антипсихотические препараты, ингибиторы дипептидилпептидазы-4) [11, 12].
Результаты популяционных исследований, проведенных в Европе, свидетельствуют, что частота ВП, требующей госпитализации, варьируется в диапазоне 1,98–2,6 на 1000 населения в год, что может отражать различия изучаемых групп населения и организации здравоохранения в той или иной стране [13, 14]. Отсюда следует, что около 75% больных получают лечение в амбулаторных условиях, поскольку заболевание в этих случаях протекает в нетяжелой форме и характеризуется достаточно низкой летальностью.
В противоположность летальность среди госпитализируемых больных достигает 5–15% [15, 16].
Лечение больных ВП обходится в США более чем в 8 млрд долл. ежегодно, причем более 90% этой суммы приходится на расходы на стационарное лечение [17]. Поэтому особое значение приобретает решение лечащего врача о госпитализации пациента и выписке его из стационара.
Диагностика
Проявления ВП включают респираторные (кашель, мокрота, одышка, боль в груди) и конституциональные симптомы (лихорадка, недомогание, гриппоподобные симптомы, нарушение сознания и др.), а также соответствующие физические проявления (тахипноэ, тахикардия, артериальная гипотензия, очаговая статоакустическая симптоматика – участок бронхиального дыхания, инспираторная крепитация, фокус мелкопузырчатых влажных хрипов, усиление бронхофонии). Поскольку эти проявления недостаточно чувствительны и специфичны для установления окончательного диагноза заболевания, рекомендуется проведение рентгенографии грудной клетки, подтверждающей в случае ВП наличие очагово-инфильтративных изменений в легких.
Следующие клинические данные повышают вероятность обнаружения инфильтративных изменений и должны побуждать к проведению рентгенологического исследования, в т.ч. и в амбулаторных условиях: а) отсутствие ринореи; б) одышка и/или учащенное дыхание; в) соответствующая очаговая аускультативная симптоматика; г) конституциональные симптомы – лихорадка, тахикардия >100/мин; д) повышенные концентрации биомаркеров (например, С-реактивный белок >20–30 мг/л). Если при этом подтверждается более двух из этих критериев, вероятность наличия инфильтрата легочной ткани у пациента с симптомами острой инфекции нижних дыхательных путей повышается с 18% [18].
Обнаружение очагово-инфильтративных изменений в легких на рентгенограмме обычно оказывается достаточным для того, чтобы надежно отличить ВП от острого бронхита. Последний, за редким исключением, не нуждается в лечении антибиотиками, поскольку побочные эффекты антибиотикотерапии в таких случаях перевешивают их благотворное влияние на симптомы [19]. Прокальцитонин является еще одним биомаркером, который может быть использован, чтобы помочь избежать ненужного назначения антибиотиков амбулаторным пациентам с инфекциями нижних дыхательных путей (14). Если точечные анализы недоступны, можно использовать подход «отсроченного назначения», минимизирующий необоснованную антибиотическую агрессию.
Стратификация
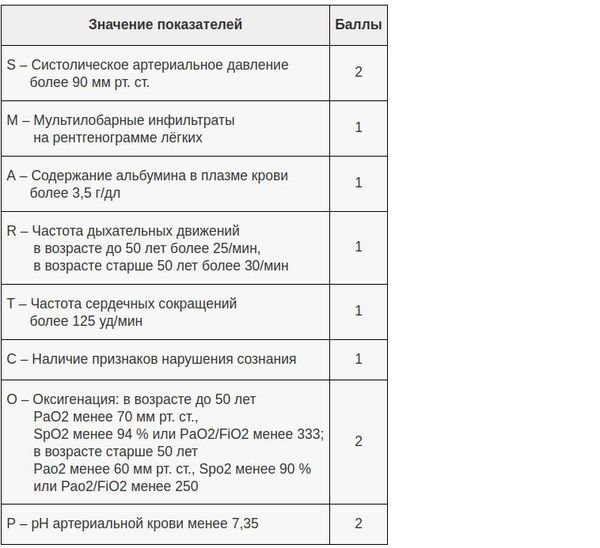
Затраты на госпитализацию, возможность возникновения внутрибольничных инфекций и тромбоэмболических осложнений требуют тщательного учета показаний к госпитализации больных ВП и выделение пациентов той категории, которые бы могли получать амбулаторное лечение без ущерба конечной эффективности и безопасности. Впечатление врача от клинической тяжести заболевания должно быть объективировано с помощью правильно обоснованных критериев. Определенные надежды в этом плане возлагались на шкалы оценки прогноза ВП, которые косвенно могли бы указывать на предпочтительное место лечения больного – на дому, в палатном отделении стационара или в отделении реанимации и интенсивной терапии (ОРИТ). И хотя эти шкалы оценки тяжести и прогноза ВП хорошо зарекомендовали себя при выявлении пациентов с высоким риском неблагоприятного исхода, они, строго говоря, не предназначались для выделения категории «амбулаторных больных» (табл. 1).
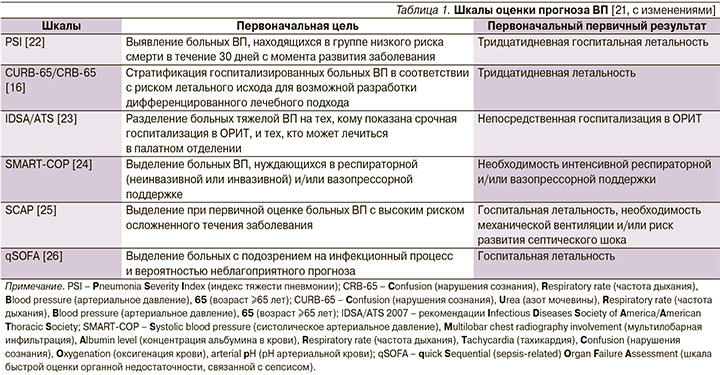
Из доступных в настоящее время шкал оценки прогноза ВП наиболее практичной в условиях первичной медицинской помощи оказалась шкала CRB-65, не требующая каких-либо лабораторных тестов и позволяющая достаточно безопасно выделять категорию больных (0 баллов) для амбулаторного лечения (табл. 2) [27, 28].
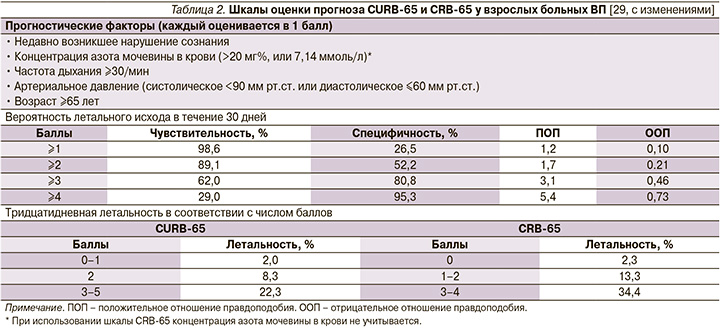
Тем не менее больные, перенесшие интеркуррентную пневмонию на фоне ряда заболеваний внутренних органов, несмотря на низкий балл по упомянутым шкалам могут иметь плохой прогноз [30–32]. В связи с этим отрицательная прогностическая ценность шкалы CRB-65 может быть значительно улучшена, если ее «обогатить» такими дополнительным параметрами, как показатель оксигенации гемоглобина кислородом (SaO2) по данным пульсоксиметрии, высокий риск обострения/декомпенсации сопутствующей патологии, факт длительного пребывания больного на постельном режиме (табл. 3).
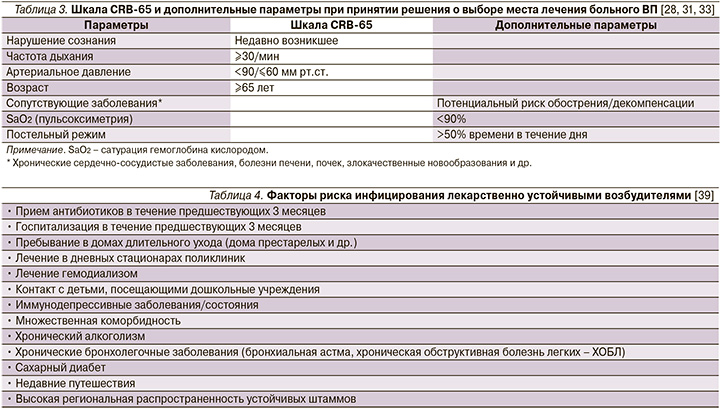
Подобная модификация шкалы CRB-65 присутствует, в частности, на страницах согласительных рекомендаций Немецкого респираторного общества, Немецкого химиотерапевтического общества им. Пауля-Эрлиха, Немецкого общества инфекционистов (German S3 guideline) при принятии решения о выборе места лечения больного ВП (см. рисунок) [34].
Антибактериальная терапия
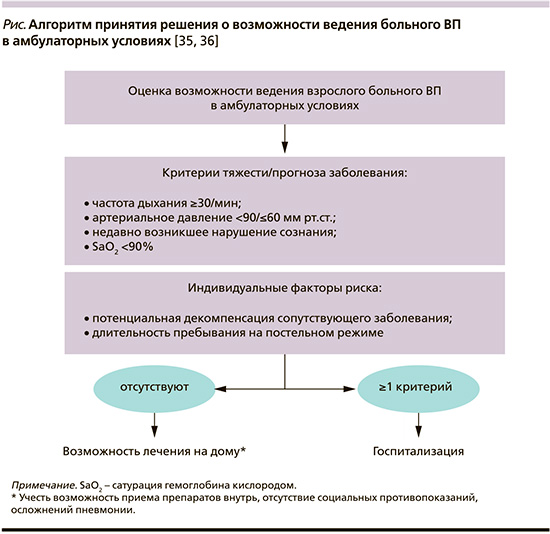
Если врач считает целесообразным лечить больного ВП в амбулаторных условиях, антибактериальная терапия (АБТ) должна быть начата как можно раньше [7]. Более чем в половине случаев возбудителя/возбудителей ВП не удается идентифицировать, а с учетом значительных затрат на определение «виновного» микроорганизма становится очевидным, что пациенты в амбулаторных условиях лечатся эмпирически [37, 38]. В настоящее время выбор большинством экспертов антибиотика первой линии в лечении больных ВП без факторов риска «встречи» с лекарственно устойчивыми возбудителями (табл. 4) останавливается на амоксициллине (табл. 5).
Этот выбор аргументируется результатами ряда исследований, свидетельствующих о высокой терапевтической эффективности амоксициллина в лечении ВП, несмотря на отсутствие активности в отношении «атипичных» возбудителей [7], доказанной безопасностью препарата по сравнению с другими вариантами антибиотикотерапии [44], драматическим ростом устойчивости пневмококка к макролидам в ряде стран и регионов, в т.ч. и в Российской Федерации [45]. Сказанное в отношении амоксициллина тем более важно, что в Кокрейновском обзоре, первоначально опубликованном в 2009 г., а затем дополненном и расширенном в 2014 г., при сравнении различных антибиотиков и групп антибиотиков в лечении взрослых амбулаторных больных ВП была продемонстрирована их сопоставимая эффективность [46, 47]. Впрочем, трудности в поиске доказательств превосходства того или иного режима эмпирической АБТ распространяются и на контингент больных ВП, требующих госпитализации. Так, в ходе недавно проведенного исследования при сравнении эффективности монотерапии β-лактамами, фторхинолонами, комбинации β-лактамов и макролидов не были установлены различия в 90-дневной кумулятивной летальности, а также медиане длительности стационарного этапа лечения [48].
У больных ВП, возникшей и протекающей на фоне хронических инвалидизирующих заболеваний внутренних органов (болезни сердца, легких, почек, печени, сахарный диабет, хронический алкоголизм, злокачественные новообразования и др.), рекомендуется применение антибиотиков более широкого спектра действия, что связано с повышенным риском инфицирования патогенами, устойчивыми к «незащищенным» пенициллинам (например, Haemophilus influenzae, Moraxella catarrhalis и Staphylococcus aureus), а также большей вероятностью неблагоприятных исходов в случаях неудачи стартовой терапии [7]. В обсуждаемых международными экспертами клинических рекомендациях предпочтение отдается «защищенным» аминопенициллинам (амоксициллин/клавуланат и др.) или цефалоспоринам II–III поколений, назначаемых в рамках монотерапии или в комбинации с макролидами или доксициклином (табл. 6).
Очевидно, что имеющиеся различия (строго говоря, не носящие принципиального характера) в представленных подходах к эмпирической АБТ амбулаторных больных ВП в большей степени отражают национальные эпидемиологические данные антибиотикорезистентности ключевых возбудителей заболевания, их потенциальное экологическое влияние, а также учитывают затратную эффективность лекарственных средств. С этих позиций следует рассматривать и точку зрения Российского респираторного общества (РРО) и Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ). Так, на страницах проекта клинических рекомендаций, подготовленного экспертами РРО/МАКМАХ, предложено выделять две группы амбулаторных больных ВП [49]. В первую группу включены пациенты без хронических сопутствовавших заболеваний, не принимавшие за последние 3 месяца системных антибиотиков в течение 2 и более последовательных дней и не имевшие других факторов риска инфицирования редкими и/или полирезистентными возбудителями (ПРВ) – пребывание в доме престарелых или других учреждениях длительного ухода, наличие госпитализаций по любому поводу в течение ≥2 суток за последние 90 дней, внутривенная инфузионная терапия, наличие сеансов диализа или лечение ран в домашних условиях в предшествовавшие 30 дней. Во вторую группу включены больные ВП с сопутствовавшими заболеваниями (ХОБЛ, сахарный диабет, хроническая сердечная недостаточность, хроническая болезнь почек со снижением скорости клубочковой фильтрации, цирроз печени, алкоголизм, наркомания, дефицит питания) и/или принимавшие за последние 3 месяца антибиотики ≥2 дней и/или имевшие другие факторы риска инфицирования редкими и/или ПРВ, указанными выше.
Пациентам с ВП без значимых сопутствующих заболеваний и других факторов риска инфицирования редкими и/или ПРВ рекомендуется в качестве терапии выбора амоксициллин, альтернативы – макролиды (табл. 7).

Позиция российских экспертов, отдающих предпочтение амоксициллину при лечении данной категории пациентов (и к слову, совпадающая с соответствующим положением большинства зарубежных рекомендаций), аргументируется рядом обстоятельств. Аминопенициллины сохраняет высокую активность в отношении ключевого возбудителя ВП в данной группе пациентов – S. pneumoniae, а частота выделения нечувствительных к амоксициллину изолятов H. influenzae в нашей стране остается невысокой [50, 51]. При этом, как уже упоминалось выше, хотя аминопенициллины in vitro и не перекрывают всего спектра потенциальных возбудителей ВП (в частности, не действуют на M. pneumoniae и Chlamydophila pneumoniae), в рандомизированных клинических исследованиях по эффективности они не уступают макролидам и респираторным хинолонам [52]. В связи со стремительным ростом устойчивости S. pneumoniae к макролидам в ряде регионов РФ и как следствие – увеличением риска терапевтической неудачи [53, 54] их назначение в качестве препаратов первого ряда не рекомендуется. Макролиды могут применяться при невозможности использовать аминопенициллины (индивидуальная непереносимость, аллергические реакции немедленного типа на бета-лактамы в анамнезе), а также при наличии клинических/эпидемиологических указаний на «атипичную» этиологию ВП [10, 42, 55, 56].
Больным ВП, у которых заболевание протекает на фоне значимых сопутствующих заболеваний и/или при наличии других факторов риска инфицирования редкими и/или ПРВ, рекомендуются в качестве антибиотиков выбора «защищенные» аминопенициллины (амоксициллин/клавуланат и др.), альтернативы – респираторные фторхинолоны или цефдиторен (см. табл. 7).
Подобный выбор больными второй группы объясняется большей вероятностью этиологической роли грамотрицательных бактерий (в т.ч. обладающих некоторыми механизмами вторичной антибиотикорезистентности) [42, 55, 57]. Альтернативой служат «респираторные» фторхинолоны (левофлоксацин, моксифлоксацин, гемифлоксацин) или цефдиторен. Фторхинолоны in vitro имеют определенные преимущества перед «защищенными» аминопенициллинами (более высокая активность в отношении энтеробактерий, действие на M. pneumoniae, C. pneumoniae, пенициллинорезистентные пневмококки), однако это не определяется при сравнении клинической эффективности. Кроме того, подобное «сдержанное» отношение к назначению фторхинолонов способно уменьшать селекцию лекарственно устойчивых возбудителей и сохранять возможность их использования при неэффективности антибиотиков первого ряда [58].
Несмотря на определенную роль «атипичных» возбудителей в этиологии ВП у пациентов данной группы, рутинное назначение комбинации β-лактамного антибиотика и макролида не рекомендуется, т.к. на сегодняшний день не доказано, что такая стратегия улучшает исходы лечения при возможном увеличении риска нежелательных лекарственных побочных эффектов и селекции антибиотикорезистентности [10, 40–42].
Эффективный клинический «ответ» больного ВП на АБТ обычно определяется стойкой апирексией, нормализацией частоты сердечных сокращений, дыхания, артериального давления и SaO2 (табл. 8) [23]. Для амбулаторных пациентов неудача лечения обычно определяется как необходимость госпитализации или коррекции АБТ спустя 48–72 часа.

Хотя существует не так много данных, оценивающих отсутствие «ответа» на АБТ ВП в амбулаторных условиях, частота терапевтической неудачи, по-видимому, маловероятна и колеблется от 2,3 [59] до 7,5–8% [60, 61], что скорее всего связано с сопутствующими заболеваниями, а не с выбором антибиотиков или особенностями клинического течения самой пневмонии.
Длительность АБТ
Рекомендуемая продолжительность лечения для всех схем эмпирической АБТ больного ВП составляет не менее 5 дней, причем обычно 5–7 дней лечения считается достаточным для ведения пациента в амбулаторных условиях [7, 37, 62]. Подобные рекомендации строятся на результатах многочисленных рандомизированных контролируемых исследований и мета-анализов. Так, в частности, в ходе одного из них, включившего 21 клиническое исследование и 4861 амбулаторного и госпитализированного больного ВП, получавшего «короткую» (≤6 дней) и «длительную» (≥7 дней) терапию, были продемонстрированы сходные результаты клинического выздоровления между сравниваемыми группами (отношение риска (ОР)=0,99; 95% доверительный интервал (ДИ)=0,97–1,01) [63]. При этом результативность «короткий» и «длительной» АБТ оказалась сопоставимой в группе как амбулаторных (ОР=0,98, 95% ДИ: 0,97–1,01), так и госпитализированных больных (ОР=1,00, 95% ДИ: 0,92–1,09). Небезынтересным оказался и тот факт, что «короткие» курсы ассоциировались с меньшим числом серьезных побочных эффектов (ОР=0,73, 95% ДИ: 0,55–0,97) и более низкой кумулятивной летальностью (ОР=0,73, 95% ДИ: 0,55–0,97) по сравнению с «традиционной» или «длительной» продолжительностью лечения.
Впрочем, если подходить к вопросу об оптимальной продолжительности АБТ взрослых больных ВП в амбулаторных условиях более строго, то следует признать, что до настоящего времени не проведено ни одного рандомизированного контролируемого исследования, в рамках которого изучались бы эффективность и безопасность короткого и длительного («традиционного») курсов лечения (с одним и тем же антибиотиком и в той же суточной дозировке). А значит, влияние продолжительности АБТ на течение и исходы ВП для взрослых амбулаторных пациентов остается неясным [64].
Новые антибиотики
Наряду с популяризацией подходов к рациональной АБТ ВП, в т.ч. и избеганием необоснованной антибиотической «агрессии» при небактериальных инфекциях дыхательных путей (по самым скромным оценкам, доля больных заведомо вирусными респираторными инфекциями, получающими антибиотики, превышает 50%) [65, 66], еще одной действенной стратегией в противоборстве с глобальной пандемией антибиотикорезистености является создание и внедрение в повседневную клиническую практику новых антибиотиков. Из их числа наиболее перспективными для амбулаторного лечения взрослых больных ВП представляются омадациклин и лефамулин (табл. 9). Омадациклин – это новый антибиотик широкого спектра действия, относящийся к классу тетрациклинов, назначаемый внутрь или внутривенно 1 раз в сутки и одобренный FDA (Food and Drug Administration) в октябре 2018 г. в качестве лечения ВП [67].

В августе 2019 г. FDA для лечения больных ВП одобрило лефамулин, относящийся к подклассу плевромутилинов [68], антимикробное действие которых объясняется ингибированием синтеза бактериальных белков [69]. Новый антибиотик доступен в лекарственных формах для перорального и внутривенного введений. Недавно были опубликованы результаты двух исследований, продемонстрировавших сопоставимую клиническую эффективность (non-inferiority) лефамулина и моксифлоксацина [70, 71]. При этом T.M. File et al. [70] свидетельствовали о сходных частоте и структуре нежелательных лекарственных реакций (НЛР) лефамулина и моксифлоксацина, тогда как в публикации, описывающей исследование E. Alexander et al. [71], сообщалось о большей частоте нетяжелых НЛР в группе пациентов, принимавших новый антибиотик. Последнее обстоятельство, а также стоимость лефамулина (цена суточной дозы препарата составляет 275 USD, что существенно дороже стоимости фторхинолона), тем не менее не мешают видеть в этом антибиотике новое перспективное направление лечения ВП, в т.ч. и в амбулаторных условиях [72, 73].
Профилактика
Гриппозная и пневмококковая вакцины общепринято рекомендуются в качестве профилактической меры лицам старше 60 лет и больным, страдающим рядом неинфекционных инвалидизирующих заболеваний внутренних органов. Данные о профилактической эффективности гриппозной вакцины для больных ВП ограниченны, тем не менее ее применение признается оправданным ввиду доказанной эффективности против гриппа, а также значимости гриппозной инфекции в развитии ВП и тяжести ее течения [74, 75].
С целью специфической профилактики пневмококковых инфекций, в т.ч. пневмококковой ВП у взрослых, используются вакцины двух типов: 23-валентная пневмококковая полисахаридная вакцина (ППСВ23) и 13-валентная пневмококковая конъюгированная вакцина (ПКВ13). [76–79]. Согласно проекту рекомендаций РРО/МАКМАХ [49], всем пациентам с высоким риском развития пневмококковых инфекций 1 рекомендуется иммунизация пневмококковыми вакцинами. Лиц в возрасте 65 лет и старше, а также иммунокомпрометированных пациентов 2 рекомендуется первоначально вакцинировать однократно ПКВ13, а затем (не позднее, чем через 12 месяцев) – ППСВ23 с последующей ревакцинацией ППСВ23 каждые 5 лет. Пациентам 18–64 лет, относящимся к группе высокого риска развития пневмококковой инфекции, но не являющимся иммунокомпрометированными, рекомендуется вакцинация ППСВ23 однократно. Сходной считается и точка зрения Комитета советников по иммунизационной практике [82].
Поскольку курение – ведущий фактор риска развития хронического бронхита/ХОБЛ, очевидна необходимость более широкого распространения программ по борьбе с курением как эффективного способа уменьшить риск развития ВП [83]. К числу других неспецифических, но достаточно действенных профилактических подходов следует относить оптимизацию лечения сопутствующих сердечно-сосудистых и бронхолегочных заболеваний, выявление и лечение возможной дисфагии с целью предотвращения аспирации. Cтрогая переоценка показаний к применению тех групп лекарственных средств, которые могут обусловить развитие ВП (седативные и антипсихотические препараты, ингибиторы протонной помпы, ингаляционные глюкокортикостероиды при ХОБЛ), плюс оптимальная гигиена полости рта [34] являются еще одними из важных мер профилактики пневмонии, серьезность которых зачастую недооценивается в рутинной клинической практике.
Заключение
Несмотря на то что, согласно существующей практике в странах Западной Европы и Северной Америки, абсолютное большинство больных ВП получают лечение в амбулаторных условиях, до настоящего времени основная масса исследований, направленных на поиск оптимальных терапевтических подходов при этом заболевании, касается госпитализированных пациентов.
С момента публикации первых клинических рекомендаций по диагностике, лечению и профилактике ВП у взрослых в 1993 г. [1] основные проблемы по ведению больных ВП, а именно: установление первоначального диагноза, стратификация пациентов по степени риска неблагоприятного исхода заболевания, эмпирический выбор антибиотиков, понимание важности локальных моделей чувствительности респираторных патогенов и др., сохраняют свою актуальность. Активное развитие в последние годы молекулярной биологии и популяризация методов генного зондирования существенно видоизменили и расширили наши традиционные представления об этиологии ВП (продемонстрировав, в частности, значительный «удельный вес» вирусов в ряду причин заболевания). Еще одна проблема – повсеместный рост устойчивости возбудителей к антибиотикам, что актуализирует важность создания новых антибиотиков и популяризацию действенных направлений и методов профилактики ВП.
____________________
1 К группам высокого риска развития пневмококковых инфекций относятся [80, 81]:
• пациенты в возрасте 65 лет и старше;
• лица с сопутствующими хроническими заболеваниями бронхолегочной (ХОБЛ, бронхиальная астма в сочетании с хроническим бронхитом и эмфиземой, принимающих длительно системные глюкокортикостероиды), сердечно-сосудистой систем (ишемическая болезнь сердца, хроническая сердечная недостаточность, кардиомиопатии и др.), сахарным диабетом, хроническими заболеваниями печени (включая цирроз), хронической болезнью почек, нефротическим синдромом, алкоголизмом, кохлеарными имплантами, ликвореей, функциональной или органической аспленией (серповидно-клеточная анемия, спленэктомия);
• пациенты с иммунодефицитом (ВИЧ-инфекция, злокачественные новообразования, иммуносупрессивная терапия и др.);
• лица, проживающие в домах престарелых и других учреждениях закрытого типа;
• курильщики.
2 К иммунокомпрометированным относятся пациенты с врожденными и приобретенными иммунодефицитами (в т.ч. ВИЧ-инфекцией и ятрогенными иммунодефицитами); пациенты, страдающие нефротическим синдромом, хронической болезнью почек и требующие диализа; лица с кохлеарными имплантами (или подлежащие кохлеарной имплантации); ликвореей; пациенты, страдающие гемобластозами и получающие иммуносупрессивную терапию; лица с врожденной или приобретенной (анатомической или функциональной) аспленией; гемоглобинопатиями (в т.ч. серповидно-клеточной анемией); находящиеся в листе ожидания на трансплантацию органов или после таковой [81].
Литература
1. Niederman M.S., Bass J.B. Jr., Campbell G.D., et al. Guidelines for the initial management of adults with community-acquired pneumonia: diagnosis, assessment of severity, and initial antimicrobial therapy. Am Rev Respir Dis. 1993;148:1418–26.
2. Pasteur L. Note on the new disease caused by the saliva of a child who died of rabies. C R Acad Sci. 1881;92:159–65. Doi: 10.1016/S2352-3018(15)00108-3.
3. Sternberg G.M. The pneumonia-coccus of Friedlander (Micrococcus Pasteuri, Sternberg). Am J Med Sci. 1885;90:106–23.
4. Fraenkel A. Weitere Beitrage zur Lehre von den Mikrococcen der genuinen fibrinosen Pneumonie
5. Osler W. The principles and practice of medicine. New York: D. Appleton and Company; 1901.
6. GBD 2013 Mortality and Causes of Death Collaborators. Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death 2013 a systematic analysis for the Global Burden of Disease Study 2013. Lancet 2015;385:117–71. Doi: 10.1016/S0140-6736(14)61682-2.
7. Metlay J.P., Waterer G.W., Long A.C., et al. Diagnosis and Treatment of Adults with Community-acquired Pneumonia. An Official Clinical Practice Guideline of the American Thoracic Society and Infectious Diseases Society of America. Am J Respir Crit Care Med. 2019;200:e45–e67. Doi: 10.1016/S0140-6736(14)61682-2.
8. Zweigner J., Meyer E., Gastmeier P., Schwab F. Rate of antibiotic prescriptions in German outpatient care – are the guidelines followed or are they still exceeded? GMS Hyg. Infect Control. 2018;13:Doc04. Doi:10.3205/dgkh000310.
9. Socie´te´ Francaise de Me´decine Ge´ne´rale. Observatoire de la Me´decine Ge´ne´ral. Donne´es en consultation pour: Pneumophatie Aigue. URL: http://omg.sfmg.org/content/donnees/donnees.php. (Accessed 28 October 2018).
10. Lim W.S., Baudouin S.V., George R.C., et al., Pneumonia Guidelines Committee of the BTS Standards of Care Committee. BTS guidelines for the management of community-acquired pneumonia in adults: update 2009. Thorax. 2009;64(Suppl. 3);iii1–55.
11. Almirall J., Serra-Prat M., Bolıbar I., Balasso V. Risk factors for community-acquired pneumonia in adults: a systematic review of observational studies. Respir. 2017;94:299–311. Doi: 10.1159/000479089.
12. Liapikou A., Cilloniz C., Torres A. Drugs that increase the risk of community-acquired pneumonia: a narrative review. Expert Opin Drug Saf. 2018;17:991–1003. Doi: 10.1080/14740338.2018.1519545.
13. Trotter C.L., Stuart J.M., George G., et al. Increasing hospital admissions for pneumonia, England. Emerg Infect Dis. 2008;14:727–33. Doi: 10.3201/eid1405.071011.
14. Almirall J., Bolibar I., Vidal J., et al. Epidemiology of community-acquired pneumonia in adults: a population-based study. Eur Respir. J 2000;15:757–63. Doi: 10.1034/j.1399-3003.2000.15d21.x.
15. Fine M.J., Auble T.E., Yealy D.M., et al. A prediction rule to identify low-risk patients with community-acquired pneumonia. N Engl J Med. 1997;336:243–50. Doi: 10.1056/NEJM199701233360402.
16. Lim W.S., van der Eerden M.M., Laing R., et al. Defining community acquired pneumonia severity on presentation to hospital: an international derivation and validation study. Thorax. 2003;58:377–82. Doi:10.1136/thorax.58.5.377.
17. Raut M., Schein J., Mody S., et al. Estimating the economic impact of a half-day reduction in length of hospital stay among patients with community-acquired pneumonia in the US. Curr Med Res Opin. 2009;25:2151–57. Doi: 10.1185/03007990903102743.
18. Van Vugt S.F., Broekhuizen B.D., Lammens C., et al. Use of serum C-reactive protein and procalcitonin concentrations in addition to symptoms and signs to predict pneumonia in patients presenting to primary care with acute cough: diagnostic study. BMJ. 2013;346:f2450. Doi: 10.1136/bmj.f2450.
19. Smith S.M., Fahey T., Smucny J., Becker L.A. Antibiotics for acute bronchitis. Cochrane Database Syst Rev. 2014;3:CD000245. Doi: 10.1002/14651858.CD000245.pub3.
20. Schuetz P., Muller B., Christ-Crain M., et al. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Cochrane Database Syst Rev. 2012;9:CD007498. Doi: 10.1002/14651858.CD007498.pub2.
21. Ranzani O.T., Taniguchi L.U., Torres A. Severity scoring systems for pneumonia: current understanding and next steps. Curr Opin Pulm Med. 2018;24:227–36. Doi: 10.1097/MCP.0000000000000468.
22. Fine M.J., Auble T.E., Yealy D.M., et al. A prediction rule to identify low-risk patients with community-acquired pneumonia. N Engl J Med. 1997;336:243–50. Doi: 10.1056/NEJM199701233360402.
23. Mandell L.A., Wunderink R.G., Anzueto A., et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults. Clin Infect Dis. 2007;44(Suppl. 2):27–72.
24. Charles P.G., Wolfe R., Whitby M., et al. SMART-COP: a tool for predicting the need for intensive respiratory or vasopressor support in community-acquired pneumonia. Clin Infect Dis. 2008;47:375–84. Doi: 10.1086/589754.
25. Espana P.P., Capelastegui A., Gorordo I., et al. Development and validation of a clinical prediction rule for severe community-acquired pneumonia. Am J Respir Crit Care Med. 2006;174:1249–56. Doi: 10.1164/rccm.200602-177OC.
26. Singer M., Deutschman C.S., Seymour C.W., et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315:801–10. doi: 10.1001/jama.2016.0287.
27. Chalmers J.D., Singanayagam A., Akram A.R., et al. Severity assessment tools for predicting mortality in hospitalised patients with community-acquired pneumonia. Systematic review and meta-analysis. Thorax. 2010;65:878–83. doi: 10.1136/thx.2009.133280.
28. Bauer T.T., Ewig S., Marre R., Suttorp N., Welte T: CRB-65 predicts death from community-acquired pneumonia. J Intern Med. 2006;260:93–101. doi: 10.1111/j.1365-2796.2006.01657.x.
29. Kaysin A., Viera A.J. Community-acquired pneumonia: diagnosis and management. Am Fam Physician. 2016;94:698–706.
30. Corrales-Medina V.F., Musher D.M., Wells G.A., et al. Cardiac complications in patients with community-acquired pneumonia: incidence, timing, risk factors, and association with short-term mortality. Circulation. 2012;125:773–81. Doi: 10.1161/CIRCULATIONAHA.111.040766.
31. Ewig S., Bauer T., Richter K., et al. Prediction of in-hospital death from community-acquired pneumonia by varying CRB-age groups. Eur Respir J. 2013;41:917–22. Doi: 10.1183/09031936.00065212.
32. Choudhury G., Chalmers J.D., Mandal P., et al. Physician judgement is a crucial adjunct to pneumonia severity scores in low-risk patients. Eur Respir J. 2011;38:643–48. doi: 10.1183/09031936.00172910.
33. Kolditz M., Ewig S., Schutte H., et al. Assessment of o xyg enation and comorbidities improves outcome prediction in patients with community-acquired pneumonia with a low CRB-65 score. J Intern Med. 2015;278:193–202.
34. Ewig S., Hoffken G., Kern W.V., et al. Management of adult c ommunity-acquired pneumonia and prevention – update 2016. Pneumologie. 2016;70:151–200. Doi: 10.1055/s-0042-101873.
35. Kolditz M., Braeken D., Ewig S., Rohde G. Severity assessment and the immediate and long-term prognosis in community-acquired pneumonia. Semin Respir Crit Care Med. 2016;37:886–96. Doi: 10.1055/s-0036-1592127.
36. Kolditz M., Ewig S. Community-acquired pneumonia in adults. Dtsch Arztebl Int. 2017;114:838–48. Doi: 10.3238/arztebl.2017.0838.
37. Musher D.M., Thorner A.R. Community-acquired pneumonia. N Engl J Med. 2014;371:1619–28. doi: 10.1056/NEJMra1312885.
38. Mandell L.A., Wunderink R.G., Anzueto A., et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults. Clin Infect Dis. 2007;44(Suppl. 2):27–72.
39. Козлов Р.С., Зырянов С.К., Синопальников А.И. и др. Резолюция совета экспертов «Эмпирическая антибактериальная терапия инфекций дыхательных путей с учетом факторов риска резистентной флоры» (28.10.2017, Москва). Справочник поликлинического врача. 2018;1:6–10.
40. NICE. National Institute for Health and Care Excellence. Clinical Guideline
41. Cao B., Huang Y., She D.Y., et al. Diagnosis and treatment of communityacquired pneumonia in adults: 2016 clinical practice guidelines by the Chinese Thoracic Society, Chinese Medical Association. Clin Respir J. 2018;12:1320–60.
42. Boyles T.H., Brink A., Calligaro G.L., et al. South African Thoracic Society; Federation of Infectious Diseases Societies of Southern Africa. South African guideline for the management of community-acquired pneumonia in adults. J Thorac Dis. 2017;9:1469–502. Doi: 10.21037/jtd.2017.05.31.
43. Correa R.A., Costa N.A., Lundgren F., et al. 2018 recommendations for the management of community acquired pneumonia. J Brasil Pneumol. 2018;44:405. Doi: 10.1590/S1806-37562018000000130.
44. Zaroff J.G., Craig T.C., Palmetto N., et al. Association of azithromycin use with cardiovascular mortality. JAMA. Network Open. 2020;3(6):e208199. doi: 10.1001/jamanetworkopen.2020.8199.
45. Иванчик Н.В., Чагарян А.Н., Сухорукова М.В. и др. Антибиотикорезистентность клинических штаммов Streptococcus pneumoniae в России: результаты многоцентрового эпидемиологического исследования «ПеГАС 2014–2017». Клиническая микробиология и антимикробная химиотерапия. 2019;21(3):230–37. [Ivanchik N.V., Chagaryan A.N.,
Sukhorukova M.V. et al. Antibiotic resistance of clinical strains of Streptococcus pneumoniae in Russia: results of a multicenter epidemiological study «PeGAS 2014–2017». Klinicheskaya mikrobiologiya i antimikrobnaya khimioterapiya. 2019;21(3):230–37. (In Russ.)].
46. Bjerre L.M., Verheij T.J., Kochen M.M. Antibiotics for community acquired pneumonia in adult outpatients. Cochrane Database Syst Rev. 2009;(4):CD002109. Doi:10.1002/14651858.CD002109.pub3.
47. Pakhale S., Mulpuru S., Verheij T.J., et al. Antibiotics for community-acquired pneumonia in adult outpatients. Cochrane Database Syst. Rev. 2014;(10):CD002109. Doi:10.1002/14651858.CD002109.pub4.
48. Postma D.F., van Werkhoven C.H., van Elden L.J.,et al. Antibiotic treatment strategies for community-acquired pneumonia in adults. N Engl J Med. 2015;372:1312–23. Doi: 10.1056/NEJMoa1406330.
49. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Внебольничная пневмония у взрослых. Клинические рекомендации (проект). 2019.
50. Козлов Р.С., Сухорукова М.В., Сивая О.В. и др. Чувствительность к антимикробным препаратам клинических штаммов Streptococcus pneumoniae, выделенных в различных регионах РФ в 2010–2013 гг. Клиническая микробиология и антимикробная химиотерапия. 2015;17(Приложение 1):31.
51. Sivaya O., Kozlov R., Sukhorukova M., et al. Long-term surveillance of antimicrobial resistance of H. influenzae in Russia: are there any changes in ten years? ECCMID 2016, Amsterdam, 9–12 April, Poster # EV0302.
52. Maimon N., Nopmaneejumruslers C., Marras T.K.Antibacterial class is not obviously important in outpatient pneumonia: a meta-analysis. Eur Respir J. 2008;31:1068–76. Doi: 10.1183/09031936.00109007.
53. Lonks J.R., Garau J., Gomez L., et al. Failure of macrolide antibiotic treatment in patients with bacteremia due to erythromycin-resistant Streptococcus pneumoniae. Clin Infect. Dis. 2002;35:556–64. Doi: 10.1086/341978.
54. Daneman N., McGeer A., Green K., et al. Macrolide resistance in bacteremic pneumococcal disease: implications for patient management. Clin Infect Dis. 2006;43:432–38.
55. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике (пособие для врачей). Клиническая микробиология и антимикробная химиотерапия. 2010;12:186–225.
56. Woodhead M., Blasi F., Ewig S. and the ERS/ESCMID Task Force. Guidelines for the management of adult lower respiratory tract infections. Clin Microbiol Infect. 2011;17(Suppl. 6):1–59. Doi: 10.1111/j.1469-0691.2011.03672.x.
57. Niederman M.S. In the Clinic: Community-Acquired Pneumonia. Ann Intern Med. 2015;163:1–17. Doi: 10.7326/AITC201510060.
58. Athlin S., Lidman C., Lundqvist A., et al. Management of community-acquired pneumonia in immunocompetent adults: updated Swedish guidelines 2017. Infect. Dis. (Lond). 2018;50:247–72. Doi: 10.1080/23744235.2017.1399316.
59. Cilloniz C., Ewig S., Polverino E., et al. Community-acquired pneumonia in outpatients: aetiology and outcomes. Eur Respir J. 2012;40:931–38. Doi: 10.1183/09031936.00168811.
60. Fantin B., Aubert J.P., Unger P., et al. Clinical evaluation of the management of community-acquired pneumonia by general practitioners in France. Chest. 2001;120:185–92. doi: 10.1378/chest.120.1.185.
61. Minogue M.F., Coley C.M., Fine M.J., et al. Patients hospitalized after initial outpatient treatment for community-acquired pneumonia. Ann Emerg Med. 1998;31:376–80. Doi: 10.1016/s0196-0644(98)70350-6.
62. Prina E., Ranzani O.T., Torres A. Community-acquired pneumonia. Lancet. 2015;386:1097–108. doi: 10.1016/S0140-6736(15)60733-4.
63. Tansarli G.S., Mylonakisa E. Systematic review and meta-analysis of the efficacy of short-course antibiotic treatments for community-acquired pneumonia in adults. Antimicrob. Agents Chemother. 2018;62(9):e00635–18. Doi: 10.1128/AAC.00635-18.
64. López-Alcalde J., Rodriguez-Barrientos R., Redondo-Sánchez J., et al. Short-course versus long-course therapy of the same antibiotic for community-acquired pneumonia in adolescent and adult outpatients. Cochrane Database Syst Rev. 2018;9:CD009070. Doi: 10.1002/14651858.CD009070.pub2.
65. Silverman M., Povitz M., Sontrop J.M., et al. Antibiotic prescribing for nonbacterial acute upper respiratory infections in elderly persons. Ann Intern Med. 2017;166:765–74. Doi: 10.7326/M16-1131.
66. McDonagh M.S., Peterson K., Winthrop K., et al. Interventions to reduce inappropriate prescribing of antibiotics for acute respiratory tract infections: summary and update of a systematic review. J Int Med Res. 2018;46:3337–57. Doi: 10.1177/0300060518782519.
67. Froes F., Pereira J.G., Povoa P. Outpatient management of community-acquired pneumonia. Curr Opin Pulm Med. 2019;25:249–56. Doi: 10.1097/MCP.0000000000000558.
68. U.S. Food and Drug Administration. FDA approves new antibiotic to treat community-acquired bacterial pneumonia. URL: www.fda.gov/news-events/pressannouncements/fda-approves-new-antibiotic-treat-community-acquiredbacterial-pneumonia.
69. Rodvold K.A. Introduction: lefamulin and pharmacokinetic/ pharmacodynamic rationale to support the dose selection of lefamulin. J Antimicrob Chemother. 2019;74(Suppl 3):iii2–4. Doi: 10.1093/jac/dkz084.
70. File T.M., Goldberg L., Das A., et al. Efficacy and safety of intravenous-to-oral lefamulin, a pleuromutilin antibiotic, for the treatment of community-acquired bacterial pneumonia: the phase III Lefamulin Evaluation Against Pneumonia (LEAP 1) Trial. Clin Infect Dis. 2019;69:1856–67. Doi: 10.1093/cid/ciz090.
71. Alexander E., Goldberg L., Das A.F., et al. Oral lefamulin vs moxifloxacin for early clinical response among adults with community-acquired bacterial pneumonia: the LEAP 2 randomized clinical trial. JAMA.
72. Nabriva Therapeutics. Nabriva Therapeutics receives U.S. FDA approval of Xenleta™ (lefamulin) to treat community-acquired bacterial pneumonia (CABP). URL: https://investors.nabriva.com/news-releases/news-release-details/nabriva-therapeutics-receives-us-fda-approval-xenleta.
73. Malani P.N. Lefamulin – a new antibiotic for community-acquired pneumonia. JAMA.
74. Teng F., Liu X., Guo S.B., et al. Community-acquired bacterial co-infection predicts severity and mortality in influenza-associated pneumonia admitted patients. J Infect Chemother. 2019;25:129–36. Doi: 10.1016/j.jiac.2018.10.014.
75. Cantan B., Luyt C.E., Martin-Loeches I. Influenza Infections and Emergent Viral Infections in Intensive Care Unit. Semin Respir Crit Care Med. 2019;40:488–97. Doi: 10.1055/s-0039-1693497.
76. Bonten M.J., Huijts S.M., Bolkenbaas M., et al. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med. 2015;372:1114–25. Doi: 10.1056/NEJMoa1408544.
77. Frenck R.W. Jr., Gurtman A., Rubino J., et al. Randomized, controlled trial of a 13-valent pneumococcal conjugate vaccine administered concomitantly with an influenza vaccine in healthy adults. Clin Vaccine Immunol. 2012;19:1296–303. Doi: 10.1128/CVI.00176-12.
78. Schwarz T.F., Flamaing J., Rumke H.C., et al. A randomized, double-blind trial to evaluate immunogenicity and safety of 13-valent pneumococcal conjugate vaccine given concomitantly with trivalent influenza vaccine in adults aged ≥65 years. Vaccine. 2011;29:5195–202. Doi: 10.1016/j.vaccine.2011.05.031.
79. Ofori-Anyinam O., Leroux-Roels G., Drame M., et al. Immunogenicity and safety of an inactivated quadrivalent influenza vaccine co-administered with a 23-valent pneumococcal polysaccharide vaccine versus separate administration, in adults ≥50years of age: Results from a phase III, randomized, non-inferiority trial. Vaccine. 2017;35:6321–28. Doi: 10.1016/j.vaccine.2017.09.012.
80. Centers for Disease Control and Prevention (CDC). Recommendations of the Advisory Committee on Immunization Practices (ACIP). URL: https://www.cdc.gov/vaccines/schedules/downloads/adult/adult-combined-schedule.pdf.
81. Козлов Р.С., Авдеев С.Н., Брико Н.И. и др. Вакцинопрофилактика пневмококковых инфекций у взрослых. Резолюция совета экспертов (Москва, 16 декабря 2017 г.). Клиническая микробиология и антимикробная химиотерапия. 2018;20:5–8.
82. Matanock A., Lee G., Gierke R., et al. Use of 13-Valent Pneumococcal Conjugate Vaccine and 23-Valent Pneumococcal Polysaccharide Vaccine Among Adults Aged ≥65 Years: Updated Recommendations of the Advisory Committee on Immunization Practices. Morb Mortal Wkly Rep. 2019;68:1069–75. Doi: 10.15585/mmwr.mm6846a5.
83. Hedlund J., Kalin M., Ortqvist A. Recurrence of pneumonia in middle-aged and elderly adults after hospital-treated pneumonia: aetiology and predisposing conditions. Scand J Infect. Dis. 1997;29:387–92. Doi: 10.3109/00365549709011836.
Пневмония — симптомы и лечение
Что такое пневмония? Причины возникновения, диагностику и методы лечения разберем в статье доктора Макаровой Евгении Андреевны, пульмонолога со стажем в 14 лет.
Над статьей доктора Макаровой Евгении Андреевны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Пульмонолог Cтаж — 14 лет
Медицинский центр «Арт-Медика»
Поликлиника №2 на Победы 376в
Областная больница №4
Дата публикации 31 июля 2018 Обновлено 3 августа 2021
Определение болезни. Причины заболевания
Пневмония, или воспаление лёгких (Pneumonia) — вариант острой респираторной инфекции, поражающей лёгочную ткань. Лёгкие состоят из небольших мешотчатых образований (альвеол), которые в ходе акта дыхания здорового человека должны наполняться воздухом. При пневмонии альвеолы заполнены жидкостью (экссудатом) и гноем, которые ухудшают газообмен. [1]
Внебольничная пневмония (ВП) — это острое инфекционное заболевание, особенно часто встречающееся среди жителей городов. По статистике, предоставленной разными авторами, в России пневмонией ежегодно заболевает около 1 500 000 человек. В структуре смертности на долю пневмоний в России в 2015 году приходилось до 50% (в группе болезней органов дыхания), в 2016 году смертность от этого заболевания достигла 21 на каждые 100 тысяч жителей. [2]
Перечень возможных возбудителей ВП включает более сотни микроорганизмов (вирусы, грибы, простейшие, но главным образом — бактерии). Однако чаще всего заболевание ассоциировано с относительно небольшим кругом микробных агентов, среди которых:
- пневмококк (S. pneumoniae);
- микоплазма (M. pneumoniae);
- хламидофила (C. pneumoniae);
- гемофильная палочка (H. influenzae);
- респираторные вирусы;
- энтеробактерии;
- золотистый стафилококк (S. aureus);
- легионелла пневмофила (L. pneumophila).
Факторы риска
Наибольшему риску развитию пневмонии подвержены:
- дети до двух лет;
- люди старше 65 лет.
К другим факторам риска относятся:
- лечение в больнице;
- хронические заболевания — астма, хроническая обструктивная болезнь легких (ХОБЛ) или болезни сердца;
- ослабленная иммунная система — высокому риску подвержены пациенты с ВИЧ, а также люди, перенёсшие трансплантацию органов, получающие химиотерапию или длительно принимающие стероиды;
- курение [12] .
Факторами риска неблагоприятного исхода являются: возраст, мужской пол и сопутствующие заболевания [3] .
Заразна ли пневмония
Пневмонию может вызывать множество различных микроорганизмов. Многие из них передаются от человека к человеку, однако не у всех при воздействии одних и тех же микробов развивается пневмония.
Как передаётся пневмония
Вирусы и бактерии, приводящие к развитию пневмонии, могут передаваться воздушно-капельным и контактно-бытовым путём. Грибковая пневмония обычно развивается, когда люди вдыхают микроскопические частицы грибка из окружающей среды.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы пневмонии
Переохлаждение организма нередко становится причиной, запускающей процесс развития воспаления лёгких у взрослых. Затем последовательно появляются симптомы заболевания.
Как распознать симптомы пневмонии:
- неожиданный и очень быстрый подъём температуры тела до фебрильных цифр (свыше 38 °C);
- неспецифические проявления системной интоксикации организма (подавленность, вялость, утомляемость, мышечная слабость, сонливость, головная боль);
- через 3-4 дня возникает сухой кашель, который спустя ещё несколько дней становится влажным — начинает откашливаться слизь (мокрота), часто она имеет ржавый или бурый цвет;
- может появиться боль в грудной клетке на стороне пораженного лёгкого (или же с обеих сторон, если воспаление двустороннее), которая усиливается при кашле и дыхании;
- при дыхании могут выслушиваться хрипы в грудной клетке (слышны не у всех больных);
- одышка (частое дыхание) — является результатом массивного поражения лёгкого и проявлением дыхательной недостаточности;
- одна из сторон грудной клетки (поражённая) может отставать при дыхании. [4]
Признаки пневмонии у взрослого:
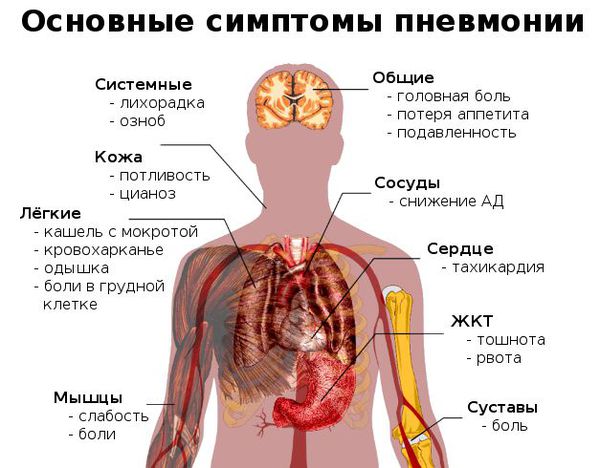
Признаки пневмонии у ребёнка
У детей симптомы пневмонии обычно выражены сильнее — они болеют с более высокой температурой, при которой могут развиться фебрильные судороги. Кроме того, дети, особенно совсем маленькие, зачастую плохо умеют откашливать мокроту, поэтому не всегда удаётся заметить её гнойный характер — жёлтый или зелёный цвет и неприятный запах.
Патогенез пневмонии
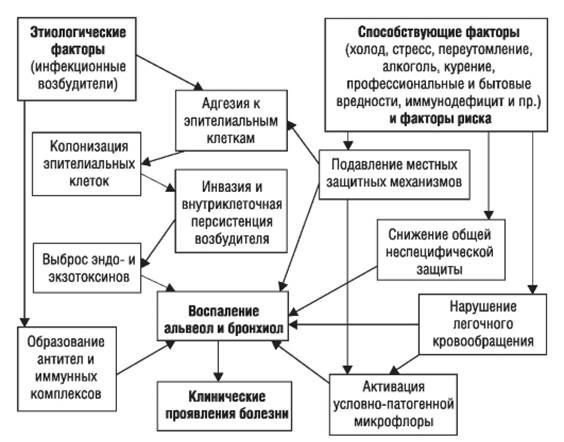
Ведущие механизмы, которые приводят к развитию ВП:
- проникновение в нижние дыхательные пути содержимого ротоглотки (аспирация);
- вдыхание аэрозольной взвеси, содержащей различные микробные агенты;
- проникновение микроорганизмов из очага инфекции, расположенного за пределами лёгких, через кровь;
- перемещение инфекционных агентов из соседних поражённых органов (прямой контакт) или в результате присоединения инфекции с ранящими предметами (оружие) в грудную клетку. [3]
Стартовым импульсом развития пневмонии лёгких становится прикрепление (адгезия) микробных агентов к поверхностной мембране клеток эпителия бронхов, особенно при предшествующей дисфункции реснитчатого мерцательного эпителия и изменении мукоцилиарного клиренса.
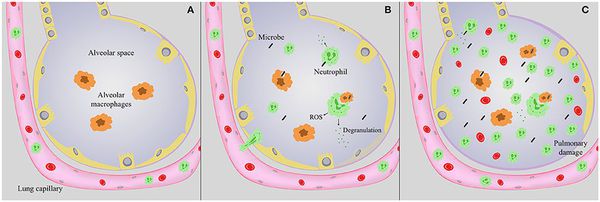
Следующим шагом в образовании воспаления является размножение микробного агента в клетках бронхиального эпителия. Нарушение целостности мембраны этих клеток приводит к интенсивной продукции биологически активных веществ — цитокинов. Они вызывают направленное движение (хемотаксис) макрофагов, нейтрофилов и целого ряда иных клеток в область воспаления.
На следующих стадиях воспалительного процесса очень значимую роль играет последовательное проникновение (инвазия), жизнедеятельность микроорганизмов внутри клеток и продукция токсинов. Все эти процессы в итоге заканчиваются экссудативным воспалением внутри альвеол и бронхиол. Наступает фаза клинических проявлений болезни. [4]
Классификация и стадии развития пневмонии
В Международной классификации болезней 10-го пересмотра (МКБ-10) в разделе «Х. Болезни органов дыхания» выделяют следующие виды пневмонии:
- неклассифицированную вирусную пневмонию (аденовирусную и другие);
- пневмококковую пневмонию (S. pneumoniae);
- пневмонию, вызванную гемофильной палочкой (H. influenzae);
- неклассифицированную бактериальную пневмонию, возникшую по причине воздействия клебсиеллы (Klebsiella pneumoniae), стафилококка (Staphylococcus spp), стрептококка группы В и других срептококков, кишечной палочки (Escherichia coli), других аэробных грамотрицательных бактерий и миклопазмы (Mycoplasma pneumoniae). Также к этой группе относятся другие бактериальные пневмонии и пневмонии неуточненной этиологии.
- пневмонию, возникшую по причине воздействия других инфекционных возбудителей: хламидий (Chlamydia spp), а также иных установленных возбудителей инфекций.
- пневмонию, возникающую при заболеваниях, классифицированных в других рубриках (при актиномикозе, сибирской язве, гонорее, нокардиозе, сальмонеллёзе, туляремии, брюшном тифе, коклюше; при цитомегаловирусной болезни, кори, краснухе, ветряной оспе; при микозах; при паразитозах; при орнитозе, ку-лихорадке, острой ревматической лихорадке, спирохетозе);
- пневмонию без уточнения возбудителя.
Данная классификация построена по этиологическому принципу, то есть основывается на виде возбудителя, послужившего причиной воспаления лёгких. [5]
Также отдельно выделяют аспирационную пневмонию, которая возникает при вдыхании или пассивном попадании в лёгкие различных веществ в большом объёме, чаще всего — рвотных масс, которые вызывают воспалительную реакцию.
К аспирационной пневмонии приводят:
- затекание желудочного содержимого в дыхательные пути при реанимации, шоке, нарушениях сознания (в том числе при алкогольной и героиновой интоксикации);
- нарушение глотания при различных неврологических нарушениях и заболеваний пищевода.
Особенности лечения аспирационной пневмонии — использование эндоскопических методов промывания и очищения дыхательных путей, антибактериальных и отхаркивающих препаратов.
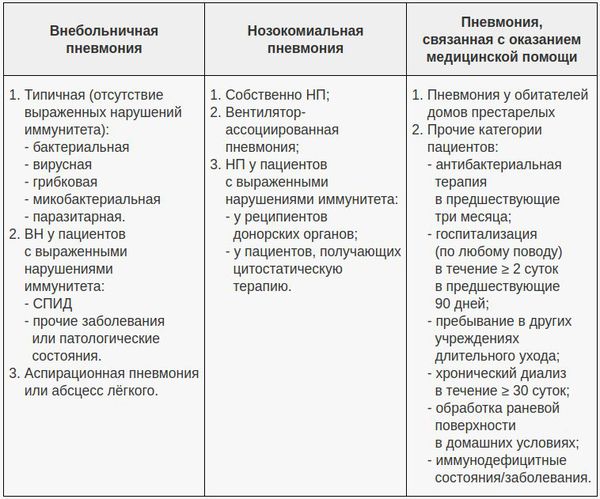
В современной клинической практике самой популярной является классификация, учитывающая три основных фактора: условия появления пневмонии, особенности инфицирования лёгочной ткани и статус иммунной системы пациента. В этом аспекте очень важно отличать внебольничную пневмонию (ВП) и внутрибольничную пневмонию (нозокомиальную, НП), поскольку концепции их лечения разнятся. Внебольничной считают пневмонию, развившуюся за пределами стационара либо выявленную в первые 48 часов после госпитализации в стационар. С 2005 года ряд авторов выделяет пневмонию, связанную с медицинским вмешательством. [6]
Признаки внебольничной, внутрибольничной (нозокомиальной) и связанной с оказанием медицинской помощью пневмонии
Осложнения пневмонии
Многие авторы выделяют две категории осложнений, развивающихся при пневмонии — «лёгочные» и «внелёгочные».
К «лёгочным» осложнениям относятся:
- парапневмонический плеврит;
- эмпиема плевры;
- абсцесс и гангрена лёгкого;
- острая дыхательная недостаточность;
- респираторный дистресс-синдром.
«Внелёгочными» осложнениями являются:
- септический шок;
- полиорганная недостаточность;
- менингит;
- миокардит;
- ДВС-синдром.
В настоящее время такое деление представляется весьма условным, поскольку интоксикационный синдром при пневмонии распространяется на весь организм.
Плеврит — воспалительное заболевание, при котором в плевральной полости скапливается избыточное количество жидкости. Наблюдается особенно часто при бактериальной и вирусной природе возбудителя.
Абсцесс лёгкого — патологический инфекционный процесс, проявляющийся образованием в лёгочной ткани более или менее ограниченной полости (> 2 см в диаметре) из-за местного отмирания тканей и последующего гнойного распада. Очень часто к развитию абсцессов приводит инфицирование анаэробными микроорганизмами.
Эмпиема плевры — скопление гноя в плевральной полости, довольно часто становится крайне неблагоприятным исходом течения экссудативного плеврита.
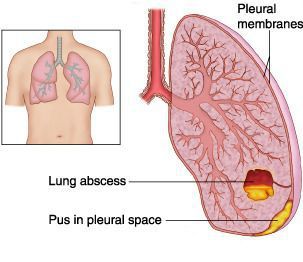
Острая дыхательная недостаточность — резкое нарушение дыхания, при котором уменьшается транспорт кислорода в лёгкие, а обеспечение должного газового состава артериальной крови становится невозможным. В результате недостаточного поступления кислорода наступает «кислородное голодание» (гипоксия). Значительный дефицит кислорода угрожает жизни больного и может потребовать развёртывания мероприятий неотложной интенсивной терапии.
Сепсис — является самым грозным и тяжёлым осложнением пневмонии. Он развивается при проникновении инфекционного агента в кровь, и далее происходит его циркуляция по кровяному руслу. Особенность сепсиса заключается в образовании гнойных очагов во всём теле. Клинические проявления сепсиса очень яркие: температура тела повышается до фебрильных цифр, возникает тяжёлый синдром интоксикации, проявляющийся головной болью, тошнотой, рвотой, реже диареей, кожа становится «землистого» оттенка).
ДВС-синдром — патология со стороны системы гемостаза (свёртывающей и противосвёртывающей системы крови), приводящее к изменению нормальной микроциркуляции в сосудистом русле за счёт массивного кровотечения с одновременным образованием тромбов. [7]
Диагностика пневмонии
Диагностические исследования при ВП направлены на уточнение диагноза, определение возбудителя, оценку тяжести течения и прогноза заболевания, а также на обнаружение осложнений.
Алгоритм диагностики при подозрении на ВП включает:
- подробный сбор анамнеза;
- анализ жалоб пациента;
- физикальное обследование;
- лабораторные и инструментальные исследования, объём которых может быть определен в индивидуальном порядке и обусловлен тяжестью течения ВП, появлением и характером осложнений, сопутствующими болезнями пациента.
Диагноз ВП является доказанным при выявлении у пациента очаговой инфильтрации лёгочной ткани, подтвержденной рентгенологически и, как минимум, двух из перечисленных ниже признаков:
- остро возникшая лихорадка вначале заболевания (температура тела > 38,0 °С);
- кашель с мокротой;
- физические признаки, выявленные в ходе полного физикального обследования (местная крепитация или мелкопузырчатые хрипы, бронхиальное дыхание, притупление звука при перкуссии);
- увеличение общего количества лейкоцитов (> 10·109/л) и/или палочкоядерный сдвиг (> 10%).
Важно! При отсутствии или недоступности рентгенологического подтверждения очаговой инфильтрации в лёгких диагноз «ВП» считается неуточненным. При этом диагноз «Пневмония» может быть обоснован данными эпиданамнеза (истории болезни), наличием соответствующих жалоб и местных проявлений. [3]
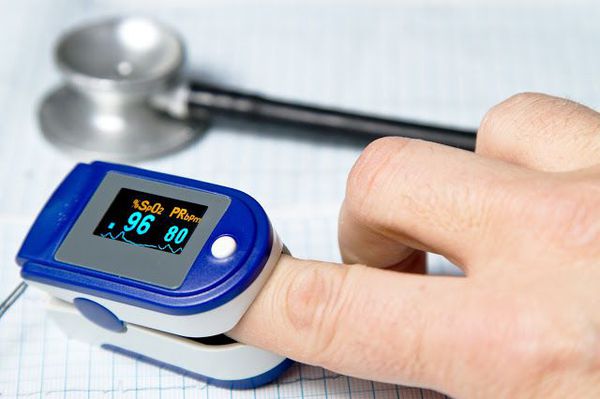
Очень важным моментом в диагностике пневмоний является использование метода пульсоксиметрии. Во всех клинических рекомендациях озвучена необходимость измерения сатурации у каждого пациента с воспалением лёгких. [9]
В настоящий момент существует целый ряд диагностических приёмов, позволяющих разделить все ВН на две категории — тяжёлые и нетяжёлые. Так, главной задачей шкал оценки тяжести (бальных систем) является выявление пациентов с неблагоприятным прогнозом и высоким риском осложнений. [8] Примеры таких шкал являются:
- PSI – индекс тяжести пневмонии;
- Шкала CURB-65;
- Шкала SMART-COP.
После определения степени тяжести лечащий врач принимает решение о месте лечения — амбулаторное наблюдение или госпитализация.
Как отличить воспаление лёгких от ОРВИ, гриппа и бронхита
Чтобы отличить воспаление лёгких от сезонных ОРВИ, гриппа и бронхита необходима визуализация лёгких — рентгенография органов грудной клетки, цифровая флюорография или компьютерная томография органов грудной клетки. Эти методы позволяют обнаружить инфильтраты в лёгочной ткани.
Лечение пневмонии
Какой врач лечит заболевание
Пневмонию лечит терапевт или пульмонолог.
Когда обратиться к врачу
К врачу следует обратиться при появлении проблем с дыханием, болях в груди, постоянной лихорадке (свыше 38 °C) и кашля, особенно с мокротой.
Показания при заболевании
Лечение пациентов с ВП является комплексным и основывается на нескольких базовых принципах:
- назначение антимикробных препаратов;
- адекватная респираторная поддержка при необходимости;
- использование неантибактериальных лекарственных средств (только в случае появления показаний);
- профилактика осложнений.
Чрезвычайно важным является своевременное обнаружение и лечение декомпенсации или обострения сопутствующих заболеваний, так как их наличие/тяжесть может кардинальным образом влиять на течение пневмонии. [10]
Антимикробные препараты
Важно! Антибактериальная терапия (АБТ) может быть назначена только врачом, в противном случае резко возрастает риск лекарственной устойчивости (резистентности) микроорганизмов.
Основные группы антимикробных препаратов, используемых при лечении пневмонии:
- бета-лактамные антибиотики (пенициллины и цефалоспорины);
- макролиды;
- респираторные фторхинолоны.
В некоторых случаях при наличии особых показаний могут быть использованы препараты других групп (тетрациклины, аминогликозиды, линкозамиды, ванкомицин, линезолид).
При вирусных пневмониях (как правило, ассоциированных с вирусом гриппа) наибольшее значение имеют ингибиторы нейраминидазы (оселтамивир и занамивир), которые обладают высокой активностью в отношении вирусов гриппа А и Б.
При лечении амбулаторных пациентов предпочтение отдают пероральным антибиотикам (обычно в таблетированной форме). При лечении пациентов в стационаре используют ступенчатый подход: начинают с парентерального введения антибиотиков (предпочтителен внутривенный путь), в дальнейшем по мере клинической стабилизации пациента переводят на пероральный приём (таблетки).
Длительность антимикробной терапии нетяжёлой ВП определяется индивидуально, при тяжёлой ВП неуточнённой этиологии — продолжается как минимум 10 дней. Осуществление более длительных курсов АБТ (от 14 до 21 дней) рекомендовано только при развитии осложнений болезни, наличии очагов воспаления за пределами лёгочной ткани, инфицировании S.aureus, Legionella spp., неферментирующими микроорганизмами (P.aeruginosa).
В клинической практике очень важным является решение о возможности прекращения АМТ в нужный момент. Для этого разработаны критерии достаточности:
- стойкое снижение температуры тела < 37,2ºС в течение не менее 48 часов;
- отсутствие проявлений интоксикационного синдрома;
- нормализация частоты дыхания ( < 20/мин);
- отсутствие гнойной мокроты;
- снижение количества лейкоцитов в крови ( < 10·109/л), нейтрофилов (< 80 %), юных форм (< 6 %);
- отсутствие отрицательной динамики на рентгенограмме. [3]
Респираторная поддержка
Острая дыхательная недостаточность (ОДН) является ведущей причиной смерти пациентов с ВП, поэтому адекватная респираторная поддержка — важнейший компонент лечения таких пациентов (конечно же, в совокупности с системной антибиотикотерапией). Респираторная поддержка показана всем пациентам с ВП при РаО2 < 55 мм рт.ст. или SрO2 < 88 % (при дыхании воздухом). [4]
Кислородотерапия проводится в случае умеренной нехватки кислорода в крови при помощи простой носовой маски или маски с расходным мешком.
Искусственная вентиляция лёгких (ИВЛ) используется в том случае, если даже при ингаляциях кислородом целевой уровень насыщения крови кислородом не достигается.
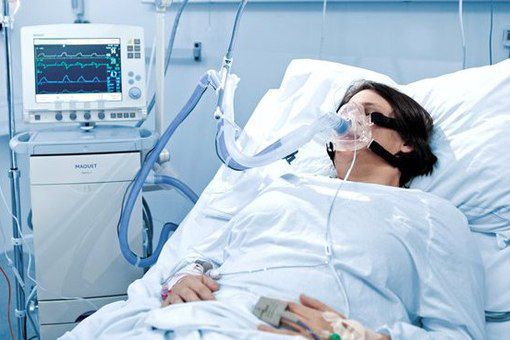
Показания к ИВЛ при ОДН на фоне ВП:
- абсолютные: остановка дыхания, нарушение сознания (сопор, кома), психомоторное возбуждение, нестабильная гемодинамика (АД сист < 70 мм рт.ст., ЧСС < 50/мин);
- относительные: ЧДД >35/мин РаО2/FiО2 < 150 мм рт.ст., повышение РаСО2 >20 % от исходного уровня, нарушение сознания.
Неантибактериальная терапия
Представлена тремя основными классами препаратов:
- системные глюкокортикостероиды (ГКС);
- внутривенные иммуноглобулины (ИГ);
- некоторые иммуностимуляторы.
Глюкокортикостероиды
Вопрос о назначении ГКС рассматривается в первую очередь при тяжёлой ВП, которая осложнена септическим шоком. ГКС способствуют ограничению разрушающего влияния системного воспаления с помощью различных геномных и негеномных эффектов.
Иммуноглобулины
Применение ИГ при терапии инфекций, осложнённых сепсисом, основано на разнообразных эффектах: от нейтрализации бактериальных токсинов до восстановления реактивности клеток при феномене «иммунного паралича».
В лечении сепсиса наиболее эффективны поликлональные ИГ, которые по сравнению с плацебо снижают относительный риск смерти. Рутинное применение внутривенных ИГ пациентами с тяжёлой ВП, осложнённой сепсисом нецелесообразно.
Иммуностимуляторы
Интерес к этим препаратам связан с их способностью усиливать фагоцитоз, образование и созревание нейтрофилов. Однако в связи с отсутствием убедительной доказательной базы на текущий момент они практически не используются в рутинной практике.
Противопоказания при заболевании
При пневмонии крайне не рекомендуется заниматься самолечением, особенно с использованием антибиотиков. В настоящий момент существует много групп антибактериальных препаратов, для подбора адекватной терапии врач задаст несколько вопросов об истории заболевания, лекарственной непереносимости, предыдущем использовании антибиотиков и о том, какие ещё препараты пациент принимает регулярно. В остром периоде заболевания рекомендовано воздержаться от активного использования физиотерапевтических методов лечения, особенно связанных с нагреванием тканей.
Прогноз. Профилактика
Благоприятный или неблагоприятный исход при ВП зависит от нескольких факторов:
- возраст пациента;
- тяжесть течения;
- наличие/отсутствие сопутствующих заболеваний.
Риск смерти минимален у пациентов молодого и среднего возраста с нетяжёлым течением ВП и не имеющих сопутствующие заболевания. У пациентов пожилого и старческого возраста существует риск летального исхода при наличии значимой сопутствующей патологии (ХОБЛ, злокачественные новообразования, алкоголизм, диабет, хроническая сердечная недостаточность), а также в ситуациях развития тяжёлой ВП.
Основная причина смерти больных с тяжёлой ВП — устойчивая нехватка кислорода, септический шок и недостаточность всех органов и систем. Согласно исследованиям, основными факторами, связанными с неблагоприятным прогнозом больных с тяжёлой ВП, являются:
- возраст > 70 лет;
- проведение ИВЛ;
- двусторонняя локализация пневмонии;
- сепсис и инфицирование сине-гнойной палочкой.
Говоря о России, отдельно следует упомянуть позднее обращение пациентов за квалифицированной медицинской помощью. Это становится дополнительным фактором риска неблагоприятного исхода.
Как предотвратить пневмонию
В настоящий момент во всём мире доступны весьма эффективные средства, позволяющие защитить себя и своих близких от этого грозного заболевания — пневмококковые и гриппозные вакцины.
С целью специфической профилактики пневмококковых инфекций, в том числе пневмоний, у взрослых используются две вакцины:
- 23-валентная неконъюгированная вакцина (содержит очищенные капсулярные полисахаридные антигены 23 серотипов S.pneumoniae);
- 13-валентная пневмококковая конъюгированная вакцина.
Все пациенты с высоким риском пневмоний должны быть защищены такими вакцинами. [11]
Список литературы
- Всемирная организация здравоохранения. Пневмония. — Информационный биллютень, ноябрь 2016. [Электронный ресурс]. Дата обращения: 27.07.2018.
- Вовк Е.И., Верткин А.Л. Внебольничная пневмония в начале ХХI века: плата за жизнь в большом городе. — Лечащий Врач, 2008. — № 8. — С. 63-65.
- Министерство здравоохраниня РФ. Клинические рекомендации. Внебольничная пневмония. Пересмотр 2018 года (проект).
- Чучалин А.Г. Респираторная медицина. Руководство в 3-х томах. — М.: Литтерра, 2017. — Т. 2. — С. 29-67.
- Международная классификация болезней 10-го пересмотра // Грипп и пневмония (J09 — J18). 1990-2018.
- Ежлова Е.Б., Демина Ю.В, Ефимов Е.И., Бруснигина Н.Ф., Малеев В.В., Тартаковский И.С., Биличеко Т.Н., Шкарин В.В., Ковалишена О.В., Чубукова О.А., Благонравова А.С. Внебольничные пневмонии: классификация, патогенез, этиология, эпидемиология, лабораторная диагностика на современном этапе. Аналитический обзор. — М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2013.
- Чучалин А.Г., Синопальникова А.И. Клинические рекомендации. Внебольничная пневмония у взрослых / Российское респираторное общество. — М.: Атмосфера, 2005.
- Фесенко О.В., Синопальников А.И. Тяжелая внебольничная пневмония и шкалы оценки прогноза. — Практическая пульмонология, 2014. — № 2. — С. 20-26.
- Малкович Н.Н., Лукашевич И.В., Сенюк Б.П., Окипняк И.В., Микитюк О.П., Глубоченко Е.В., Бачук-Понич Н.В., Широкова С.В., Скрипник Ж.Д. Пульсоксиметрия: линические аспекты использования в пульмонологической и кардиологической практике // Современные исследования медико-биологических наук: совершенствование диагностики, разработка средств профилактики и терапии болезней — Киров, 2013. — С. 195-201.
- Синопальников А.И., Фесенко А.В. Внебольничная пневмония. — М.: ГЭОТАР-Медиа, 2017.
- Игнатова Г.Л., Антонов В.Н. Профилактика инфекций дыхательных путей. — Поликлиника, 2016. — № 4. — С. 17-21.
- Pneumonia // Mayo Clinic, 2020.
Амбулаторное лечение пневмонии в Юсуповской больнице
Если пациент проходит лечение пневмонии дома, ему обеспечивают постоянное наблюдение пульмонолога и возможность в любой момент получить консультацию онлайн. Специалисты клиники реабилитации проводят эффективные физиотерапевтические процедуры, занятия лечебной физкультурой, делают массаж.

Причины заболевания
Причиной пневмонии является возбудитель инфекции и сниженный иммунитет. К основным возбудителям легочной инфекции относят:
- Стафилококки;
- Стрептококки;
- Легионеллы;
- Микоплазму;
- Гемофильную палочку;
- Хламидии.
Самый распространённый возбудитель воспаления – стрептококк. На фоне развития сопутствующих заболеваний и ослабленной иммунной системы он способен проникать в легкие и провоцировать там развитие воспалительного процесса.
Виды
В зависимости от возбудителя, вызвавшего воспаление лёгких, различают следующие виды пневмонии:
- бактериальные;
- вирусные;
- смешанные (бактериально-вирусные);
- грибковые;
- пневмонии, вызванные простейшими.
- Пульмонологи различают следующие формы пневмонии по степени тяжести: легкая, средняя, тяжелая, крайне тяжелая. В зависимости от локализации патологического процесса выделяют следующие виды пневмонии:
- очаговая (в пределах ацинуса и дольки);
- сегментарная, полисегментарная (в пределах одного или нескольких сегментов);
- долевая (в пределах одной доли);
- тотальная, субтотальная (может охватывать всё лёгкое).
Воспалительный процесс в лёгких бывает односторонним или двухсторонним.
Причины и факторы риска пневмонии
Наиболее частыми возбудителями пневмонии являются пневмококки. Воспаление легких могут вызвать следующие микроорганизмы:
- β-гемолитический стрептококк группы;
- стафилококк;
- гемофильная палочка;
- клебсиелла;
- энтеробактерии.
В последние годы отмечается рост пневмоний, вызванных микоплазмой, легионеллой и хламидиями. Относительно новым заболеванием, при котором развивается интерстициальная пневмония, является Ку-лихорадка. Источником микроорганизмов является домашний мелкий и крупный рогатый скот. На фоне иммунодефицитного состояния возникает воспаление легких, вызванной пневмоцистой.
Повсеместно распространены грибы и актиномицеты. Они развиваются в почве, попадают в воздух, а через него – на слизистые оболочки дыхательных путей и вызывают пневмонию. Роль вирусов в природе пневмонии неоднозначна. Первичные вирусные пневмонии возникают обычно в первые 3 дня заболевания, а вирусно-бактериальные – не раньше 3-5 дня. Большинство вирусных пневмоний вызывает вирус гриппа. Воспаление лёгких также развивается под воздействием аденовируса, корона-вируса, респираторно-синцитиального вируса.
Ведущая роль в происхождении госпитальных пневмоний принадлежит условно-патогенным микроорганизмам и микробам-оппортунистам. Воспаление легких развивается на фоне снижения иммунологической резистентности организма, возникшего после облучения или инвазивных процедур, при приеме иммуносупрессоров.
Микроорганизмы, выявленные в окружающей среде больниц, условно разделяют на представителей микрофлоры самих больных (стрептококки, стафилококки) и возбудителей, появившихся во внешней среде не от человека (легионеллы).
Аспирационные пневмонии возникают при вдыхании колонизирующих слизистую оболочку анаэробов, фузобактерий, бактероидов, стафилококков, пептострептококка и грамотрицательных палочек. Широко распространены госпитальные пневмонии на фоне иммунодепрессантной терапии, причиной которых являются цитомегаловирус, вирусы простого герпеса, а также энтеровирусы Коксаки и ECHO.
Половина пневмоний развивается под воздействием смешанной микрофлоры. В этом случае сложно идентифицировать возбудителя воспаления лёгких. У 40% пациентов, страдающих пневмонией, выявляют ассоциации пневмококка или других грамположительных кокков с вирусными агентами. Легионеллезную инфекцию выявляют чаще в сочетании с аденовирусной и гриппозной инфекцией, вызванной вирусом гриппа В, пневмококком, гемофильной палочкой, микоплазмой и хламидиями.
К основным факторам риска внебольничной пневмонии относится:
- алкоголизм;
- курение;
- хронические обструктивные заболевания лёгких;
- внутривенное введение наркотиков;
- пребывание под кондиционерами и увлажнителями воздуха.
Риск развития госпитальной пневмонии повышается после операций, травмы головы, инсульта. Воспаление легких чаще развивается у пациентов, получающих высокие дозы глюкокортикоидов, антибиотики, цитостатики.
Стадии пневмонии
Типичным примером бактериальной легочной инфекции является крупозная пневмония, вызванная пневмококком. Воспалительный процесс в легких при крупозной пневмонии проходит ряд фаз. В начальной фазе пневмонии (стадии прилива) образуется серозный или серозно-геморрагический экссудат с малым содержанием фибрина. Он возникает вследствие расширения капилляров и повышения проницаемости их стенок с выходом плазмы в межуточную ткань и в полость альвеол. Развивается альвеолярный отек, ткань пораженного отдела легкого отечная, упругая, с поверхности стекает серозно-геморрагическая жидкость.
После этого наступает стадия опеченения легочной ткани. Она связана с миграцией клеток из крови в легочную ткань и в полость альвеол с последующим захватыванием и перевариванием возбудителя и выпадением фибрина. Фибрин растягивает альвеолы, лёгкое выглядит увеличенным. В зависимости от преобладания в альвеолярной жидкости эритроцитов или лейкоцитов различают красное и серое опеченение.
Нарушается функция гладких мышц респираторного отдела, не происходит очищение бронхов. В воспалительный процесс вовлекается плевра. В плевральной полости скапливается серозный экссудат с включениями фибрина.
Пневмония в стадии разрешения характеризуется рассасыванием экссудата, со временем исчезает воспалительный отек. В экссудате отмечаются признаки обратного развития воспалительной реакции. Изменения в межуточной ткани определённое время после нормализации клинического состояния пациента сохраняются. Если лизис фибрина нарушается, появляются плотные очаги в пределах легочных долек.
Иной характер носят пневмонии, причиной которых являются стафилококки и стрептококки. Эти микроорганизмы вырабатывают токсины, вызывающие некроз легочной ткани. Развиваются нагноительные процессы. В острой стадии наблюдается выраженный отек легочной ткани, происходит обширное отслаивание бронхиального эпителия с инфильтрацией и образованием участков некроза в стенках бронхов. Тромбируются капилляры, появляются участки абсцедирования.
Первая стадия воспаления легких длится от нескольких часов до трёх суток. У пациента резко повышается температура тела, появляется сухой кашель, наблюдается одышка, он жалуется на боли при вдохе и кашле. Длительность второй фазы – от одних до трех суток. Боли становятся сильнее, температура тела стабильно повышенная, появляется «ржавая» мокрота. Дыхание при пневмонии учащено.
Третья стадия пневмонии длится от 4 до 8 суток. Кашель становится продуктивным, больной отхаркивает гнойную или слизистую мокроту. Боли притупляются, одышка уменьшается. Температура тела снижается. Во время четвертой стадии заболевания происходит рассасывание экссудата, восстановление воздушности легких и наступает выздоровление.
При пневмонии половина грудной клетки отстает при дыхании. Уже в первый день заболевания врачи обнаруживают притупление перкуторного звука с тимпаническим оттенком. К концу первого дня или на второй день выслушивается начальная крепитация. В последующие дни притупление становится более отчетливым, во время аускультации слышно бронхиальное дыхание, усиливаются бронхофония и голосовое дрожание, исчезает крепитация. В стадии разрешения пневмонии бронхиальное дыхание сменяется везикулярным, вновь появляется крепитация.
Можно лечить пневмонию дома
Тактика лечения воспаления легких напрямую зависит от возбудителя заболевания, клинического течения заболевания, возраста пациента, наличия сопутствующей патологии. Назначить эффективную терапию может только опытный врач, основываясь на результатах проведенных исследований.
Лечение предполагает прием антибиотиков. Если результатов анализов приходиться ждать около недели, то больному назначают антибиотики широкого спектра действия. Если же возбудитель воспаления лёгких установлен, врач прописывает пациенту препарат, к которому наиболее чувствителен инфекционный агент. В некоторых случаях лечение воспаления легких проходит в домашних условиях, но при четком соблюдении всех рекомендаций врача и регулярном обследовании.
Ни в коем случае нельзя принимать антибиотики и другие препараты самостоятельно. Это чревато осложнениями и переходом пневмонии в хроническую форму. Многие больные считают, что могут без помощи врача найти в аптеке препарат для лечения воспаления легких, и приступают к домашнему курсу терапии. При этом состояние больного, как правило, ухудшается, а у возбудителя пневмонии вырабатывается резистентность к препарату. В дальнейшем лечить заболевание становится крайне сложно.
При подозрении на пневмонию в обязательном порядке требуется квалифицированная медицинская помощь. Некоторые люди, заболев, не торопятся обращаться к врачу. Вместо этого они самостоятельно назначают себе курс лечения, идут в аптеку, покупают массу препаратов. Иногда такая терапия оказывается эффективной и больной выздоравливает. х неадекватная терапия приводит к осложнениям пневмонии.
Лечение в больнице или амбулаторно
Воспаление легких может классифицироваться по степени тяжести, типу возбудителя, локализации воспалительного очага, бывает также вне- и внутрибольничной.
Зачастую дискомфорт вызывает не только само заболевание, но и необходимость лечения в стационарных условиях. При неизбежности госпитализации и больной, и его близкие хотят знать, сколько держат в больнице с воспалением легких. Большинство людей пугает перспектива оказаться на больничной койке, и даже при очень плохом самочувствии они стараются убедить лечащего врача в том, что им будет лучше лечиться в домашних условиях. Несмотря на то, что большая часть случаев пневмонии лечится амбулаторно, если врач назначает терапию в стационаре, значит у него на это имеются достаточно веские основания.

Увы, врачам нередко приходится сталкиваться с недоверием пациента и его близких, которым кажется, что сроки лечения затянулись. В таких случаях в разных источниках они пытаются найти ответ на вопрос: сколько лечат воспаление легких в больнице? Им необходимо понять, что одна и та же инфекция у разных людей может требовать разных терапевтических подходов и лечение может длиться так же по-разному.
Кому показано лечение в больнице
Прежде чем разбираться, сколько лежат с пневмонией в отделении стационара, нужно знать, что работа врачей основана на определенных стандартах, соответствующих международным нормам. Исходя из них амбулаторное лечение показано больным, имеющим легкую и средне-тяжелую форму воспаления легких. Курс терапии в домашних условиях длится, как правило, 1-3 недели.
Длительность лечения зависит от нескольких факторов:
- природы возбудителя инфекции;
- степени тяжести заболевания;
- ответа организма больного на антибактериальную терапию;
- общего состояния пациента.
- Тяжелая форма воспаления легких требует обязательного лечения в условиях стационара. Для определения потребности в госпитализации используется шкала CURB65 и данные клинической оценки.
- Учитываются следующие факторы:
- преклонный возраст больного (более 65 лет);
- пониженное систолическое или диастолическое давление (ниже критических показателей);
- уровень мочевины в крови, превышающий 7ммоль/л;
- признаки нарушения сознания.
Каждый из факторов оценивается в один балл. Ноль баллов означает возможность лечения больного амбулаторно. От одного до трех баллов – ему необходима госпитализация.
В условиях стационара должны лечиться люди, имеющие тяжелые сопутствующие заболевания, сильное обезвоживание, острую дыхательную недостаточность, гнойную мокроту, высокую температуру и признаки сильной интоксикации, а также двусторонний воспалительный процесс.
Как лечат заболевание в больнице
В основе лечения пневмонии лежит антибактериальная терапия. В клинике терапии Юсуповской больницы используются препараты нового поколения, обладающие высокой эффективностью и минимальным количеством побочных действий.
Первые три-четыре дня после начала лечения считают наиболее опасным периодом. Интоксикация и лихорадка вынуждают больного соблюдать постельный режим. Для того чтобы предотвратить застой в легких и формирование пролежней, ему необходимо периодически вставать хотя бы на несколько минут. После того, как температура нормализуется, больному разрешают непродолжительные прогулки.
Длительность нахождения больного в условиях стационара при пневмонии зависит от того, насколько эффективна медикаментозная терапия и вспомогательные меры.
Пациенту рекомендуется употребление большого количества жидкости, особенно негазированной минеральной воды, травяных чаев, морсов, соков.
При лечении пневмонии дома пульмонологи советуют выполнять следующие рекомендации:
- Соблюдение определённой диеты. Следует воздержаться от приема жирной пищи, поскольку организм затрачивает слишком много энергии для ее переваривания. Нужно больше употреблять в пищу овощей и фруктов, богатых витаминами и микроэлементами, что позволит организму быстрее справиться с бактериями и вирусами;
- Пить в день не менее двух литров жидкости. Это может быть как простая вода, так и фруктовые соки, морсы, отвары трав, молоко. Достаточное потребление жидкости способствует нейтрализации в крови токсических веществ, а также увеличивает отделение мокроты;
- Придерживаться постельного режима и исключить неадекватные физические нагрузки.
- Методы лечения пневмонии с годами изменились, но тактика ведения пациента дома осталась неизменной. Прежде всего больному необходимо соблюдать постельный режим и регулярно наблюдаться у доктора. Динамический контроль состояния здоровья проводят при помощи рентгенографии органов грудной клетки и лабораторных анализов.
- Больному ни в коем случае нельзя самостоятельно прекращать прием антибиотиков даже при заметном улучшении самочувствия. При преждевременном снижении дозы препарата в крови микроорганизмы могут начать повторно размножаться, приводя к хронической инфекции. Пневмония дома лечится, но при условии выполнения всех рекомендаций врача.
Если заболевание диагностировано несвоевременно или антибактериальная терапия оказывается неэффективной, пациента госпитализируют в клинику терапии.
Физиотерапия при пневмонии
Физиотерапевтические процедуры – это способ лечения, который заключается в использовании физических факторов внешней среды. Эффективность физиотерапевтических процедур доказана в лечении большинства заболеваний. Физиотерапия способствует снятию отеков, помогает остановить воспалительный процесс, укрепляет и повышает иммунитет, восстанавливает дыхательную функцию при пневмонии.
Виды физиопроцедур при пневмонии
Виды физиопроцедур, которые применяются при лечении пневмонии:
- электрофорез. С помощью процедуры вводится лекарственный препарат через кожный покров. Действие тока оказывает раздражающее действие, вызывает улучшение кровообращения, усиливает обменные процессы. При пневмонии лекарственный препарат вводится с помощью электрофореза в нужном месте грудной клетки, что облегчает лечение заболевания. Для проведения электрофореза используют: новокаин, гепарин, лидазу, эуфиллин и другие препараты;
- УВЧ. Процесс прогревания тканей с помощью электромагнитного поля ультравысокой частоты. Процесс может проходить с непрерывным или импульсным воздействием тока. Хорошо помогает во время острой пневмонии после стабилизации состояния и снижения температуры тела. Снижается отек тканей, уменьшается секреция мокроты, УВЧ негативно влияет на размножение микроорганизмов;
- ингаляции. Пары с содержанием лекарственных средств, ультразвуковое воздействие позволяет проникать в самые дальние отделы дыхательной системы больного. Ингаляция улучшает отхождение мокроты, снимает спазм бронхов;
- магнитотерапия. Различные методы воздействия на ткани организма с помощью низко- или высокочастотных магнитных полей;
- лечение волновым воздействием. Назначается сантиметроволновая, дециметроволновая, ультравысокочастотная волновая терапия. Такая терапия проводится в комплексном лечении пневмонии и других воспалительных процессов;
- ИК облучение. Назначается при сильных застойных явлениях. Инфракрасное облучение помогает улучшить кровообращение, стимулирует фагоцитоз;
- лечебный массаж грудной клетки. Массаж назначается в комплексе с терапевтическим лечением и процедурами. Лечебный массаж помогает восстановить эластичность тканей органа, улучшает кровообращение, снимает спазмы;
- индуктотермия. Воздействие на пораженную область тела высокочастотным магнитным излучением. Улучшает лимфообращение, обмен веществ, снимает спазмы бронхов.
- дыхательная и лечебная гимнастика. С помощью гимнастики врачи добиваются повышения иммунитета, борются со слабостью, кашлем, улучшают функцию дыхания.
Рассасывающая терапия при пневмонии
Во время пневмонии происходит поражение легочной ткани, развивается кашель с мокротой, поднимается высокая температура. Помимо антибактериальных препаратов, витаминов, средств, повышающих иммунитет, врач назначает физиопроцедуры, рассасывающую терапию.
В качестве рассасывающей терапии проводятся УВЧ (ультравысокая частота электромагнитного тока), электрофорез, лечебная физкультура, массаж грудной клетки и дыхательная гимнастика. Рассасывающая терапия помогает освобождению бронхов от мокроты, улучшает функцию дыхания, усиливает обменные процессы и кровообращение в легких и останавливает воспалительный процесс.
Физиопроцедуры при воспалении легких: показания и противопоказания
Физиотерапия при воспалении легких имеет показания и противопоказания. Не проводятся физиопроцедуры при следующих состояниях:
- высокая температура тела;
- острая фаза заболевания;
- кома или бессознательное состояние;
- онкологическое заболевание;
- истощение организма;
- наличие кардиостимулятора;
- декомпенсированное заболевание сердца;
- эпилепсия и другие психические расстройства в острой фазе;
- сахарный диабет (назначается с осторожностью).
- Показаниями для применения физиопроцедур служат большое количество заболеваний:
- бронхит, пневмония, бронхиальная астма, ОРВИ, грипп;
- неврозы, депрессия, усталость, слабость;
- дыхательная недостаточность;
- ЛОР-заболевания;
- урологические заболевания;
- заболевания ЖКТ;
- гинекологические заболевания;
- гормональные и эндокринные патологии;
- заболевания опорно-двигательной системы.
Сроки полного излечения
О полном выздоровлении пациента можно говорить при отсутствии у него кашля, нормализации температуры тела, спокойном и свободном дыхании, а также отсутствии признаков воспаления на рентген-снимке. Сколько лежат в больнице с пневмонией до достижения вышеперечисленных результатов? Как правило, достаточно трех недель, однако наблюдение врача понадобится еще полгода после выздоровления.
Лечение затяжной пневмонии, связанной с тяжелыми хроническими заболеваниями, врожденными патологиями, вторичным иммунодефицитом, длится вдвое дольше вышеуказанного срока.
Больничный лист при легкой форме воспаления легких выдается на 17-20 дней, при пневмонии средней тяжести – на 20-24 дня, при тяжелой форме заболевания – на 40-48 дней.
Пневмония является довольно опасным заболеванием, а при отсутствии адекватной терапии грозит развитием тяжелых осложнений, в том числе непоправимых.
При первых тревожных симптомах не следует рассчитывать на свои силы и заниматься самолечением, только помощь профессионала может предупредить печальные последствия.
Высококвалифицированные специалисты клиники терапии Юсуповской больницы гарантируют эффективность лечения воспаления легких. Благодаря индивидуальному подходу, применению ультрасовременных лечебных методик и новейших лекарственных препаратов нашим врачам удается достичь высоких результатов в борьбе с любыми заболеваниями дыхательных путей, в том числе пневмонией. В отделении стационара имеется все необходимое для комфортного пребывания пациентов: уютные палаты, полноценное диетическое питание и круглосуточная поддержка медицинского персонала.
Записаться на консультацию врача и уточнить нюансы госпитализации можно на нашем сайте, а также связавшись с врачом-координатором по телефону Юсуповской больницы.
Источник https://pharmateca.ru/ru/archive/article/39421
Источник https://probolezny.ru/pnevmoniya/
Источник https://yusupovs.com/articles/terapia/mozhno-li-lechit-pnevmoniyu-doma-1/