Медикаментозный гипотиреоз на фоне лечения тироксином
О.Д. Остроумова (1, 2), В.О. Качан (3), А.И. Кочетков (1), Г.С. Краснов (4)
1) Российская медицинская академия непрерывного профессионального образования, Москва, Россия; 2) Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет), Москва, Россия; 3) Самарский государственный медицинский университет, Москва, Россия; 4) Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, Москва, Россия
Гипотиреоз (ГТ) – эндокринопатия, характеризующаяся дефицитом тиреоидных гормонов в организме, которая может быть вызвана различными причинами. В последние годы в связи с развитием фармацевтической промышленности отмечается рост случаев лекарственно-индуцированного ГТ. ГТ считается лекарственно-индуцированным, если пациент принимает препарат, о котором известно, что он может вызывать снижение функции щитовидной железы (ЩЖ) либо ГТ купируется отменой данного препарата. К факторам риска развития ГТ, вызванного приемом лекарственных средств, относят уже существующий ГТ, сопутствующие аутоиммунные заболевания, ранее существовавший тиреоидит Хашимото, тироидэктомия, реализация эффекта Вольфа–Чайкова (блокада синтеза тиреоидных гормонов при введении в организм большого количества йода), йодная нагрузка, проживание в районах с достаточным потреблением йода, пожилой возраст, женский пол, наследственный анамнез (наличие заболеваний ЩЖ у родственников), нарушения питания. Наиболее часто лекарственно-индуцированный ГТ развивается на фоне приема амиодарона, антибиотиков тетрациклинового ряда, ингибиторов тирозинкиназы, противоопухолевых, противотуберкулезных, противоэпилептических лекарственных средств, а также йодсодержащих контрастных веществ. Для терапии лекарственно-индуцированного ГТ необходима отмена препарата, на фоне которого он развился, кроме того, прибегают к заместительной терапии левотироксином натрия. В качестве профилактики лекарственно-индуцированного ГТ рекомендуется по возможности избегать применения препаратов, обладающих данным побочным эффектом, употреблять адекватное количество йода для профилактики йододефицита, своевременно корректировать нарушения функции ЩЖ.
Ключевые слова: гипотиреоз, лекарственно-индуцированный гипотиреоз, щитовидная железа
Введение
Щитовидная железа (ЩЖ) – орган, особенно уязвимый в плане воздействия различных внешних факторов, что проявляется изменениями в ее функционировании и физиологической регуляции деятельности. К одним из наиболее частых проявлений нарушения функции ЩЖ относится гипотиреоз (ГТ) – эндокринопатия, характеризующаяся дефицитом тиреоидных гормонов в организме [1]. По эпидемиологическим данным, во всем мире от ГТ страдают от 0,25 до 4,2% населения. В странах с выраженным йододефицитом преобладают врожденный ГТ, ГТ беременных и аутоиммунные поражения (тиреоидит Хашимото).
В регионах с достаточным количеством йода распространенность ГТ колеблется от 1 до 2%, повышаясь до 7% у лиц пожилого возраста [2]. Однако в последние годы в связи с развитием фармацевтической промышленности отмечается увеличение числа случаев патологии ЩЖ, которая вызывается приемом тиреотоксичных лекарственных средств (ЛС).
Имеются исследования, подтверждающие развитие ГТ, ассоциированного с приемом достаточно большого количества лекарственных средств (ЛС). Помимо антитиреоидных ЛС, угнетающее влияние которых на работу ЩЖ не считают нежелательным, поскольку они используются для лечения ее гиперфункции, ГТ могут вызывать следующие препараты и группы препаратов [1, 3–5]: аналоги соматостатина, амиодарон (антиаритмическое йодсодержащее ЛС), антибиотики (миноциклин, доксициклин, рифампицин), антиретровирусные ЛС, дофамин и его агонисты, глюкокортикоиды, ингибиторы тирозинкиназы, контрастные вещества (йодосодержащие), противоопухолевые ЛС, противотуберкулезные ЛС, противоэпилептические ЛС, психотропные ЛС (соли лития), цитокины (интерферон α), эстрогены. Подробный перечень этих препаратов и механизмы развития ГТ на фоне их приема указаны в таблице.
Распространенность
Распространенность лекарственно-индуцированного ГТ точно не установлена. Однако имеются ретроспективные исследования, касающиеся его распространенности, индуцированного приемом отдельных препаратов. Например, по данным ретроспективного анализа, в Великобритании и США в регионах с достаточным потреблением йода распространенность амиодарон-индуцированного ГТ составила 1,7–3%, в регионах с йододефицитом – 6,4% [3]. По данным последних исследований, он может возникать у 5–25% больных, принимающих амиодарон [1]. Хорошо изучена распространенность ГТ, вызываемого приемом препаратов лития: он встречается у 4–34% пациентов [3], по данным некоторых исследований, частота его возникновения может достигать 52% [1, 6]. Ретроспективные исследования свидетельствуют о том, что распространенность ГТ, индуцированного приемом ингибиторов тирозинкиназы, составляет порядка 38,5–68% [3].
Рост случаев лекарственно-индуцированного ГТ в настоящее время требует систематизации данных о его патогенезе, уточнения перечня ЛС, способных его индуцировать, разработки методов профилактики и тактики ведения таких пациентов.
Патофизиология
Механизмы лекарственно-индуцированного ГТ включают дефицит гормонов ЩЖ как центрального, так и периферического генеза и делятся на следующие основные группы: ингибирование синтеза и/или высвобождение тиреоидных гормонов в организме, иммунные воздействия, воспалительные реакции, ингибирование тирозинкиназы, ингибирование синтеза тиреотропного гормона гипофиза (ТТГ), нарушение всасывания левотироксина при одновременном приеме с рядом других препаратов [1]. Большую роль играют нарушения ферментативных процессов, которые могут обусловливаться ингибированием протеолитических ферментов, ответственных за отщепление трийодтиронина (Т3) и тироксина (Т4) от тиреоглобулина, а также ингибированием 5’-монодейодиназы, катализирующей превращение Т3 в Т4. Часто встречается лекарственно-индуцированный ГТ после перенесенных аутоиммунных заболеваний ЩЖ у пациентов, не получающих заместительной терапии [3]. Механизмы развития ГТ, индуцированного приемом отдельных препаратов, описаны в таблице.
Клинические проявления
Лекарственно-индуцированный ГТ может протекать без выраженных проявлений, что сопровождается отклонениями уровней тиреоидных гормонов и неспецифическими симптомами: общей слабостью, сонливостью, ухудшением внимания и памяти, увеличением времени реакции, признаками депрессии [7]. Развитию клинической симптоматики ГТ, как правило, способствуют более высокие дозы индуцирующих его ЛС и поздняя диагностика гормонального дефицита [8, 9]. Клинические проявления лекарственно-индуцированного ГТ очень разнообразны и могут не отличаться от ГТ иной этиологии, при этом в последнее время все чаще встречаются атипичные формы [10]. В таких случаях уместно говорить о т.н. масках ГТ. Выделяют терапевтические, гематологические, гинекологические, эндокринологические, дерматологические неврологические, психиатрические заболевания-маски, под видом которых может протекать ГТ [10]. Особенно затруднена диагностика атипичных форм ГТ у пациентов пожилого возраста, что может быть связано как с тяжестью сопутствующих заболеваний и их медикаментозным лечением, так и с психосоматическим состоянием таких пациентов [10]. Дефицит тиреоидных гормонов, вызванный приемом ЛС, часто выявляется при наличии уже диагностированной патологии ЩЖ (например, диффузного токсического зоба), однако может возникать и на фоне эутиреоза.
Среди клинических симптомов лекарственно-индуцированного ГТ выделяют следующие [3]: атаксия, брадикардия, жесткость волос или алопеция, запоры, повышенная влажность кожи, депрессия, одышка, усталость, слабость, зоб, охриплость голоса, гипотермия, особенно дистальных отделов конечностей, нарушения менструального цикла, ослабление слуха, нарушения памяти и мышления, миалгии, парестезии, отеки на лице, конечностях (микседема), набор массы тела, вызванный задержкой жидкости, желтуха.
Факторы риска
Исходя из вышеизложенных патофизиологических механизмов лекарственно-индуцированного ГТ, выделяют следующие факторы риска его развития, общие для всех случаев (всех ЛС) [3]: уже существующий ГТ, сопутствующие аутоиммунные заболевания, ранее существовавший тиреоидит Хашимото, тироидэктомия, реализация эффекта Вольфа–Чайкова (блокада синтеза тиреоидных гормонов при введении в организм большого количества йода), йодная нагрузка, проживание в районах с достаточным потреблением йода, пожилой возраст, женский пол, наследственный анамнез (наличие заболеваний ЩЖ у родственников), нарушения питания.
Повышенный риск развития лекарственно-индуцированного ГТ связан с наличием в организме пациента циркулирующих антител к структурам ЩЖ, возникновением у его ближайших родственников ГТ такой этиологии. Большую роль играет срыв механизмов адаптации ЩЖ после значительной йодной нагрузки. Имеются исследования по выявлению факторов риска развития отдельных случаев лекарственно-индуцированного ГТ. Так, возникновение ГТ, вызванного приемом интерферона α связывают с такими факторами, как женский пол, европеоидная раса, отсутствие табачной зависимости, наличие антител к пероксидазе ЩЖ и предшествующего заболевания ЩЖ [3].
Рассмотрим более подробно отдельные препараты, вызывающие лекарственно-индуцированный ГТ (за исключением антитиреоидных ЛС).
Отдельные препараты, вызывающие лекарственно-индуцированный ГТ
Алоэ. Имеются отдельные сообщения о влиянии сока алоэ на развитие ГТ. Например, в 2005 г. был зафиксирован случай субклинического ГТ у женщины 56 лет, вызванный приемом 10 мл сока алоэ ежедневно на протяжении 11 месяцев. Пациентка жаловалась на вялость, усталость, общую слабость. Лабораторные показатели Т3 и Т4 были снижены относительно нормы, в то время как уровень ТТГ оказался нормальным. При проведении ультразвукового исследования (УЗИ) ЩЖ было обнаружено гипоэхогенное узловое образование, которое подвергалось спонтанной редукции в течение 6 месяцев после отмены приема сока алоэ, уровни тиреоидных гормонов также пришли в норму [11].
Аналоги соматостатина. Доказана терапевтическая эффективность аналогов соматостатина для пациентов с синдромом гипофизарной резистентности к тиреоидным гормонам и тиреотропиномам [1]. Длительное использование аналогов соматостатина снижает уровень ТТГ и его реакцию на стимул тиреотропин-рилизинг-гормоном, не влияя на уровень сывороточных гормонов ЩЖ [12]. По данным исследований, для развития центрального ГТ, вызванного приемом аналогов соматостатина, необходимы крайне высокие дозы.
Антагонисты андрогенов. Абира-терона ацетат используется для терапии опухолей предстательной железы. Одновременно с противоопухолевым действием абиратерон вызывает субклинический ГТ, однако остается неизвестным, является ли индукция ГТ одним из его побочных эффектов или же это просто фармакокинетический феномен [13].
Амиодарон. Хорошо изучены аспекты возникновения ГТ при приеме амиодарона (амиодарон-индуцированная тиреопатия), возникающего благодаря высокому содержанию йода в препарате, он обычно развивается в первые 6–18 месяцев лечения. Индуцированный приемом амиодарона ГТ встречается примерно у 5–25% пациентов, чаще у женщин и лиц пожилого возраста на фоне существующей патологии ЩЖ [1, 14–16]. Амиодарон – антиаритмический препарат, производное бензофурана, содержание йода в котором составляет 37–39% от его молекулярной массы. В связи с этим имеется структурное сходство амиодарона, его метаболитов и гормонов ЩЖ, поэтому амиодарон ведет себя как их частичный агонист. Каждая таблетка амиодарона (200 мг) содержит около 75 мг йода, а суточная доза амиодарона у различных пациентов может достигать 600 мг. Рекомендуемая суточная норма поступления йода в организм человека составляет 150–250 мкг, следовательно, объем поступающего с амиодароном йода в 50–100 раз выше нормы у пациентов, которые его принимают [1, 17]. Кроме того, период полувыведения амиодарона составляет около 100 дней, при этом он снижается у пациентов с ожирением на 22%, у пациентов старше 65 лет – на 46% [1]. В организме амиодарон накапливается в мышечной (включая скелетную мускулатуру и миокард), соединительной, жировой тканях, в печени, а также в самой ЩЖ, поэтому его антитиреоидный эффект сохраняется достаточно долгое время после отмены (месяцы и годы) [1].
Антитиреоидное действие амиодарона обусловливается как наличием в его структуре большого количества йода, так и его собственными свойствами. Среди причин ГТ, вызванного присутствием йода в препарате, выделяют снижение транспорта йода, снижение синтеза гормонов ЩЖ (эффект Вольфа–Чайкова), блокирование выделения гормонов ЩЖ [1].
Выделяют собственные антитиреоидные эффекты амиодарона на ЩЖ: ингибирование 5’-дейодиназы типа I и/или типа II, ингибирование 5’-дейодиназы типа II, снижение внутриклеточного транспорта Т4, антагонистическое действие на рецепторы Т3, прямое цитотоксическое действие на клетки ЩЖ [1].
Амиодарон-индуцированный ГТ, по данным исследований, обычно проявляется в первые 6–18 месяцев лечения пациентов и чаще возникает у женщин, пожилых пациентов, в районах с достаточным потреблением йода [1, 16]. ГТ, вызванный приемом амиодарона, часто сопутствует аутоиммунному тиреоидиту, лечению радиоактивным йодом, послеоперационным осложнениям после резекции ЩЖ, предрасполагающим хроническим заболеваниям (таким, как талассемия) или потенцирует уже существующий ГТ. Стоит отметить, что концентрация амиодарона и его кумулятивные дозы могут быть одинаковыми для пациентов как с эутиреозом, так и с амиодарон-индуцированным ГТ.
Прекращение приема препарата пациентами с ранее нормальной функцией ЩЖ способствует восстановлению ее функции в течение 2–4 месяцев в 60% случаев. В 40% ГТ может сохраняться еще 5–8 месяцев [1]. У пациентов с предшествовавшей дисфункцией ЩЖ ГТ будет сохраняться даже после прекращения приема амиодарона, что требует назначения заместительной терапии левотироксином [18].
Амиодарон также может вызывать деструктивный тиреоидит из-за прямого цитотоксического повреждения фолликулярных клеток ЩЖ, вызванного тиреотоксикозом. Примерно в 15% случаев впоследствии развивается ГТ, также требующий своевременной диагностики и коррекции.
Поскольку амиодарон – это антиаритмический препарат, решение о терапии кордарон-индуцированного ГТ принимается с учетом состояния сердечно-сосудистой системы, а также степени дисфункции ЩЖ и возраста пациента [1, 18]. Многие авторы отмечают, что субклинический ГТ, вызванный приемом амиодарона, чаще всего не требует отмены препарата или назначения специальной терапии, однако обязательным указывают контроль уровней тиреоидных гормонов у пациентов с уже выявленным ГТ. Если необходима заместительная терапия левотироксином, начинают с низких доз, которые затем постепенно повышают каждые 4 недели под контролем оценки сердечно-сосудистой системы и уровня сывороточного ТТГ [19]. В связи с вышеуказанными особенностями развития и лечения амиодарон-индуцированного ГТ у пациентов, принимающих амиодарон, необходимо каждые 3–12 месяцев проводить исследование уровней тиреоидных гормонов и ТТГ.
Антибиотики. Кроме того, в некоторых исследованиях сообщается о возможности развития дефицита гормонов ЩЖ, вызванного приемом антибиотиков тетрациклинового ряда (например, миноциклина, доксициклина, рифампицина) [1].
Миноциклин, доксициклин. Среди тетрациклинов наибольшим антитиреоидным эффектом обладает миноциклин [1]. Черная ЩЖ, ставшая такой благодаря приему миноциклина, была описана еще в 1967 г. Однако другие тетрациклины, особенно доксициклин, также способны вызывать изменение функции ЩЖ, хотя и на порядок медленнее, чем миноциклин. К настоящему времени зарегистрировано около 150 случаев развития черной пигментации ЩЖ в результате окисления миноциклина пероксидазой ЩЖ. Кроме того, миноциклин обладает зобогенным действием, т.к. конкурентно связывается с пероксидазой и таким образом ингибирует процессы синтеза тиреоидных гормонов [1].
Рифампицин индуцирует работу оксигеназ печени, что уменьшает период полувыведения тиреоидных гормонов в организме и также может приводить к развитию лекарственно-индуцированного ГТ [5].
Антидепрессанты. Имеются описания отдельных клинических случаев возникновения ГТ, индуцированного приемом антидепрессантов-ингибиторов обратного захвата серотонина: эсциталопрама, пароксетина, сертралина. При этом симптомы депрессии могли не только не купироваться, но и ухудшаться, а ГТ мог протекать как бессимптомно, так и с прогрессирующим ухудшением состояния пациента [20–22].
Антиретровирусные препараты. Данные о функции ЩЖ у пациентов, получающих антиретровирусную терапию, разнятся. Однако имеются сообщения о развитии субклинического ГТ у пациентов, которым была назначена высокоактивная антиретровирусная терапия (особенно ставудин) [23].
Глюкокортикостероиды (ГКС). Суточные колебания уровня ТТГ у здорового человека зависят в т.ч. от действия ГКС (утром уровень ТТГ низкий, ночью – высокий). Прием ГКС в высоких дозах способствует подавлению ТТГ путем угнетения его секреции из передней доли гипофиза, однако обычно не вызывает центрального ГТ. По другим сообщениям, высокие дозы ГКС вызывают стойкое снижение концентрации Т3 в сыворотке на 30% в течение нескольких дней после начала терапии благодаря ингибированию дейодиназы ЩЖ, при этом также снижается секреция Т4 [4]. Имеются данные о возникновении ГТ у пациентов с кортикотрофными микроаденомами, т.к. у таких пациентов избыток кортизола в организме оказывает ингибирующее действие на ось «гипоталамус–гипофиз–щитовидная железа» [24].
Дофамин и его агонисты. Дофамин и его агонисты подавляют секрецию ТТГ, активируя его D2-рецепторы. Как и в случае с аналогами соматостатина и ГКС, для развития дофамин-индуцированного ГТ чаще всего необходимы дозы, превышающие терапевтические.
Ингибиторы тирозинкиназы. Ингибиторы тирозинкиназы применяются для лечения онкологических заболеваний, в т.ч. рака ЩЖ. Вследствие активации ими печеночных ферментов ускоряется метаболизм тиреоидных гормонов и развивается ГТ у 27% пациентов [2, 5]. Известно, что сунитиниб, используемый в лечении почечно-клеточного рака, иматиниб-резистентных стромальных опухолей желудочно-кишечного тракта, папиллярного рака ЩЖ и других заболеваний, индуцирует возникновение ГТ примерно в 40% случаев [25]. Сорафениб, применяемый в лечении нескольких типов сóлидных опухолей, способен вызывать ГТ примерно в 25% случаев. Подобные изменения возникают и при приеме других ингибиторов тирозинкиназы, особенно акситиниба (распространенность – 6–92%) кабозантиниба (15–78,8%), линифаниба (4,5–44%), мотесаниба (5–41%) и т.д. [3] Возможность развития индуцированного ингибиторами тирозинкиназы ГТ различные авторы связывают с возникновением деструктивного тиреоидита, проявлением антипероксидазного эффекта, запуском или обострением аутоиммунного действия на клетки ЩЖ [25], однако точный механизм остается неизвестным.
Ингибиторы фактора некроза опухоли а (ФНО-α). В ряде случаев инфликсимаб – ингибитор ФНО-α может вызывать ГТ, что подтверждается описаниями нескольких клинических случаев. В частности, в одном из них у пациента, принимавшего инфликсимаб для терапии системной красной волчанки, симптомы основного заболевания полностью купировались, однако развилась симптоматика ГТ, а также в крови снизился уровень свободного Т4 до 0,28 нг/л и повысился уровень ТТГ. По данным УЗИ в ЩЖ были обнаружены гетерогенные участки, соответствующие аутоиммунному тиреоидиту, но антитела к пероксидазе ЩЖ не были обнаружены. Пациенту была назначена заместительная терапия левотироксином натрия, после чего симптомы ГТ купировались в течение 3 месяцев [26].
Интерфероны. У пациентов с хроническими воспалительными или онкологическими заболеваниями часто развивается ГТ, индуцированный приемом цитокинов. Терапия интерфероном α может вызывать выработку антител к пероксидазе ЩЖ [22], ингибируя таким образом процессы синтеза Т3 и Т4 примерно в 2–8% случаев [24]. Интерферон β, применяемый в лечении рассеянного склероза, также может вызывать различные тиреопатии, включая ГТ [27, 28].
Антипсихотические ЛС. Имеются описания случаев развития ГТ, индуцированного приемом кветиапина, причем у одной пациентки была купированная тиреопатия в анамнезе [29], у другой – ГТ у ближайших родственников [30]. По данным клинических исследований считается, что кветиапин-индуцированный ГТ возникает у 0,4% пациентов (10 из 2386 человек), из которых 6 нуждаются в заместительной терапии [29].
Противоопухолевые ЛС. Описаны случаи ГТ при приеме противоопухолевых препаратов и проведении лучевой терапии пациентов с онкологическими заболеваниями различной локализации, причем радиационный риск сохранялся более 25 лет после окончания лечения, а функциональные нарушения наблюдались на любом из звеньев оси «гипоталамус–гипофиз-щитовидная железа» [31–33].
Бексаротен. Бексаротен используется в терапии кожной Т-клеточной лимфомы и вызывает ГТ в 90% случаев его применения благодаря центральному действию на гипофиз и подавлению выработки ТТГ [1]. Однако бексаротен обладает также периферическим антитиреоидным действием, стимулируя метаболизм гормонов ЩЖ за счет индукции глюкуронилтрансфераз и сульфотрансфераз. Бексаротен-индуцированный ГТ возникает через несколько дней после начала терапии и полностью купируется отменой препарата [1].
Ипилимумаб, тремелимумаб. По данным зарубежных источников, ГТ, индуцированный приемом анти-CTLA4 антител, встречается у 1,5–6,8% пациентов [2].
Пембролизумаб, ниволумаб. Анти-PD-1 антитела, такие как пембролизумаб, ниволумаб, способны вызывать аутоиммунное повреждение центрального звена оси «гипоталамус–гипофиз–щитовидная железа» путем индукции аутоиммунного гипофизита [32]. Однако число подобных случаев, описанных в литературе, невелико. Имеется сообщение о ниволумаб-индуцированном ГТ, возникшем через 4 месяца после начала терапии у пожилой пациентки, страдавшей колоректальным раком. Наблюдалось снижение уровней тиреоидных гормонов и повышение уровня ТТГ, что было связано с аутоиммунным поражением ЩЖ на фоне приема препарата. После прекращения лечения ниволумабом и проведения заместительной терапии тироксином функция ЩЖ была восстановлена [32].
Важно отметить, что вероятность развития ГТ при комбинации анти-CTLA4 антител и анти-PD-1 антител (например, ипилимумаба и ниволумаба) увеличивается и составляет 4–27% [2].
Алдеслейкин. Алдеслейкин – препарат рекомбинантного интерлейкина-2 человека, который может индуцировать ГТ, причем развитие ГТ значительно коррелирует с благоприятным ответом на лечение [33].
Алемтузумаб. Препарат анти-CD52 антител, используемый в терапии рассеянного склероза, также вызывает ГТ [34].
Бевацизумаб, цедираниб. Бевацизумаб – препарат рекомбинантных гиперхимерных моноклональных IgG1 антител, ингибирующих фактор роста эндотелия сосудов. Исследованы его побочные эффекты в отношении детей с опухолями центральной нервной системы, среди которых выявлен ГТ [35]. Цедираниб также ингибирует фактор роста эндотелия сосудов; ГТ, вызванный его приемом, обнаружен у 43% пациентов в одном из исследований [36].
Талидомид, леналидомид. Талидомид первоначально применялся в качестве седативного средства с 1956 г., однако через 5 лет был запрещен из-за его тератогенного действия. В последние десятилетия у талидомида были обнаружены иммуномодулирующие, противовоспалительные и антиангиогенные свойства, что позволило применять его в терапии новообразований, а также ВИЧ-инфекции, реакции «трансплантат против хозяина», саркоидоза, болезни Крона и других. С 1960-х гг. зарегистрировано несколько случаев талидомид-индуцированного ГТ, симптомами которых были в т.ч. усталость, запор и брадикардия. Патогенез ГТ, вызванного талидомидом, неизвестен, однако предполагают, что препарат либо ингибирует секрецию гормонов ЩЖ путем прямого воздействия на тиреоциты, либо индуцирует аутоиммунное повреждение ЩЖ [37]. ГТ может также вызывать другой антиангиогенный препарат – леналидомид, который используется в гематологии. Ретроспективные исследования возникновения тиреопатий после приема леналидомида показывают, что у пациентов с предшествовавшей дисфункцией ЩЖ распространенность ГТ, индуцированного леналидомидом, оказалась выше, чем у пациентов с эутиреозом (17 и 6% соответственно) [38].
Лейпролид. Агонист гонадотропин-рилизинг гормона, ингибирует секрецию гонадотропина, применяется в терапии некоторых гормонально-зависимых опухолей. Имеются отдельные сообщения о ГТ, индуцированном приемом лейпролида [39].
В отечественной и зарубежной литературе имеются сведения о возникновении лекарственно-индуцированного ГТ у пациентов, получающих противотуберкулезные препараты второй линии [40–42].
Существует вероятность развития ГТ у пациентов, получающих противотуберкулезную терапию, особенно при туберкулезе с множественной лекарственной устойчивостью. Клиника ГТ, вызванного приемом ПАСК, этионамида и протионамида, неяркая, что может быть расценено как проявление туберкулеза. По данным статистики, ГТ, индуцированный приемом противотуберкулезных препаратов, возникает в 10–40% случаев [14]. Важно отметить, что вероятность развития лекарственно-индуцированного ГТ у пациентов с туберкулезом и вирусом иммунодефицита человека (ВИЧ) существенно повышается, поскольку, как уже было сказано выше, антиретровирусные препараты также могут приводить к дисфункции ЩЖ [42]. Также отмечается риск возникновения ГТ у пациентов, получающих для терапии туберкулеза тиоуреидоиминометилпиридиния перхлорат, механизм действия которого связан с наличием в его структуре остатка тиомочевины, способного ингибировать тиопероксидазу и таким образом нарушать процессы синтеза гормонов ЩЖ [41].
Противоэпилептические препараты. Существуют описания клиники ГТ, индуцированного приемом противоэпилептических лекарственных средств [9]. Прием противоэпилептических препаратов (таких, как фенитоин, фенобарбитал, карбамазепин, оскарбазепин, габапентин, вальпроат) может приводить к повышению скорости метаболического клиренса и печеночного метаболизма Т4 в результате потенцирования работы ферментов цитохрома-P450 (CYP3A), катализирующих окислительно-восстановительные реакции. Таким образом, снижается концентрация общего и свободного Т4 в сыворотке крови на 20–40% от исходной, а также концентрация общего и свободного Т3 (снижение менее выражено) [4, 9, 43].
Соли лития. В психиатрической практике достаточно распространен ГТ, вызванный приемом препаратов лития. Поперечные исследования выявляют его наличие у 40–50% пациентов, получавших литиевые препараты в течение 5–10 лет, причем чаще индуцированный литием ГТ встречается у женщин в первые 2 года лечения, тогда как у мужчин для этого может потребоваться порядка 59 месяцев [1, 3]. Карбонат лития является препаратом, широко используемым в психиатрии, в т.ч. для коррекции биполярных расстройств (по статистическим данным, его принимает 1 человек из 200). Литий обладает тропностью к клеткам ЩЖ, содержание лития в ней в 3–4 раза превышает концентрацию в плазме [23]. Он увеличивает содержание йода в ЩЖ, ингибирует связывание йодтирозина и блокирует выброс гормонов ЩЖ, что способствует повышению секреции ТТГ и приводит к реализации зобогенного эффекта препаратов лития, в т.ч. благодаря прямой индукции пролиферации клеток. Распространенность ГТ, вызванного приемом солей лития, по данным разных исследований, варьируется от 6 до 52%, и обычно литий-индуцированный ГТ является субклиническим [23]. Лишь в редких случаях сообщается о тяжелой клинике литий-индуцированного ГТ, вплоть до развития миксидемной комы [25, 43]. Сопутствующие аутоиммунные заболевания увеличивают риск развития ГТ: порядка 50% пациентов с аутоиммунными патологиями, принимающих препараты лития, имеют ГТ [23].
Эстрогены. Препараты эстрогенов в больших дозах способны ингибировать функцию ЩЖ, угнетая транспорт Т4 в ткани путем повышения уровня тироксинсвязывающего глобулина и таким образом снижая биодоступность Т4 [4, 5].
Кроме рассмотренных выше ситуаций возникновения лекарственно-индуцированного ГТ он может также вызываться нарушением всасывания левотироксина из-за приема отдельных препаратов [4, 5]. Левотироксин назначают пациентам с ГТ для восполнения уровня гормонов ЩЖ, в т.ч. в качестве заместительной терапии после резекции ЩЖ, а также в составе комплексной терапии гипертиреоза, аутоиммунного тиреоидита. ГТ может возникнуть при одновременном приеме левотироксина и следующих ЛС [4, 5]: препаратов кальция, препаратов железа, секвестрантов желчных кислот, сукральфата, кофеина, гидроксида алюминия, севеламера.
Для снижения негативного влияния указанных препаратов на всасывание левотироксина таким пациентам рекомендуется принимать левотироксин утром натощак [4, 5].
Йодсодержащие контрастные вещества. Широкое использование йодсодержащих контрастных веществ в диагностике массы патологий различных органов и систем вызывает определенную настороженность, поскольку количество йода в этих препаратах достигает 400 мг/мл. Такая йодная нагрузка может оказывать антитиреоидное действие, т.к. даже минимальное дейодинирование приводит к высвобождению в системный кровоток от 14 до 175 мг йодида [4]. И хотя ингибирующее действие йода купируется спонтанно через несколько дней после исследования с йодсодержащим контрастным веществом, нарушения уровней тиреоидных гормонов и ТТГ могут сохраняться еще несколько недель.
Диагностика и дифференциальная диагностика
Диагностических тестов, позволяющих дифференцировать лекарственно-индуцированный ГТ от ГТ иной этиологии, не существует. ГТ считается лекарственно-индуцированным, если пациент принимает препарат, о котором известно, что он может вызвать снижение функции ЩЖ, либо ГТ купируется отменой данного препарата [17]. Клинические данные необходимо интерпретировать с учетом уже имеющихся нарушений функции ЩЖ или оси «гипоталамус–гипофиз–щитовидная железа» [3].
Дифференциальную диагностику лекарственно-индуцированного ГТ проводят со следующими заболеваниями и состояниями: аутоиммунный тиреоидит Хашимото, врожденный ГТ, генные дефекты процессов синтеза/транспорта/активации тиреоидных гормонов, ятрогенная деструкция ЩЖ (хирургическая/радиационная), идиопатическая атрофия, йододефицит.
Ведение пациентов с лекарственно-индуцированным ГТ
В большинстве случаев при лекарственно-индуцированном ГТ необходима отмена препарата, на фоне применения которого он развился. Однако зачастую препарат, вызвавший развитие лекарственно-обусловленного ГТ, принимают по жизненным показаниям, поэтому его отмена невозможна. В таких случаях назначается заместительная терапия (левотироксин натрия) для нормализации уровня ТТГ. Начальная доза левотироксина составляет 1,6–1,7 мкг/кг/сут и может повышаться каждые 4–6 недель до восстановления эутиреоза у пациента. Более низкие дозы (25 мкг/сут) назначают пожилым пациентам и пациентам с сопутствующей кардиоваскулярной патологией. Для больных амиодарон-индуцированным ГТ доза левотироксина может быть повышена, чтобы ингибировать центральное и периферическое превращение Т4 в Т3 [3].
При наличии заболеваний ЩЖ антиаритмическим препаратом выбора может стать пропафенон. Это, в частности, указано в обновленных алгоритмах ведения в клинической практике пациентов с коморбидной патологией, опубликованных в 2019 г. [44]. В документе обращается внимание на то, что у пациентов с фибрилляцией предсердий (ФП) и сопутствующей патологией ЩЖ в отсутствие выраженных нарушений гемодинамики (фракция выброса левого желудочка >40%) и перенесенного в анамнезе инфаркта миокарда может быть назначен пропафенон, обладающий также свойствами β-адреноблокатора. Кроме того, в алгоритмах [44] подчеркивается высокая эффективность и хорошая переносимость комбинированной антиаритмической терапии, основанной на уменьшенных дозах пропафенона, у пациентов с нарушением тиреоидного статуса (в т.ч. при ГТ), причем допустима даже комбинация данного антиаритмического препарата с β-адреноблокаторами.
Следует отметить, что высокая эффективность и безопасность применения пропафенона (препарат Пропанором) подтверждены российским многоцентровым рандомизированным исследованием ПРОСТОР [45], в котором рассматриваемый препарат сравнивался с амиодараном (препарат Кордарон). По данным анализа, за 12 месяцев в исследование были рандомизированы 137 человек, в статистический анализ вошли 100 из них (средний возраст около 55 лет, приблизительно 55% – мужчины). Основными критериями включения служили наличие пароксизмальной и/или персистирующей формы ФП (2С класс по Levy), сопутствующая артериальная гипертензияония (АГ) 1–3-й степеней и/или стабильная стенокардия I–III функциональных классов, фракция выброса левого желудочка >50%. В группу пропафенона могли также включаться пациенты с заболеваниями ЩЖ, периферических сосудов, сахарным диабетом и хронической обструктивной болезнью легких. В работу не включались лица с перенесенным инфарктом миокарда, острым коронарным синдромом, брадикардией с частотой сердечных сокращений менее 50 ударов в минуту, пороками сердца. Пропафенон назначали в дозе 450 мг/сут, амиодарон – в дозе 100–400 мг/сут. Аутоиммунный тиреоидит имел место у 8,5% пациентов в группе пропафенона. По результатам анализа авторы пришли к выводу, согласно которому антиаритмическая эффективность пропафенона не уступает таковой амиодарона, но по сравнению с последним пропафенон обладает лучшим профилем безопасности для пациентов с артериальной гипертензией, ишемической болезнью сердца с сохраненной систолической функцией левого желудочка, поскольку при его применении не возникало побочных эффектов (в т.ч. со стороны ЩЖ), тогда как в группе амиодарона частота побочных эффектов составила 31,6%.
Пропафенон обладает также превосходством над амиодароном в отношении купирования приступов ФП в условиях оказания скорой медицинской помощи. Здесь заслуживает внимания многоцентровое рандомизированное исследование ПРОМЕТЕЙ-ИНСК [46], целью которого стало сравнение эффективности и безопасности применения пропафенона и амиодарона для острого восстановления синусового ритма у пациентов с пароксизмальной формой ФП на догоспитальном этапе. В работу включались мужчины и женщины в возрасте от 18 лет и старше с пароксизмами ФП любого генеза, верифицированными электрокардиографически, длительностью минимум 1 час, но не более 48 часов без применения пероральных антикоагулянтов или до 7 суток включительно, на фоне приема последних. У всех пациентов была сохраненной систолическая функция левого желудочка (фракция выброса >40%). Основные критерии невключения: острый коронарный синдром, другие нестабильные формы ишемической болезни сердца, перенесенный инфаркт миокарда в анамнезе, брадикардия менее 45 в 1 минуту, а также синдром слабости синусового узла и нарушения АВ-проводимости. Первичными конечными точками служили восстановление синусового ритма на фоне применения пропафенона в инъекционной форме по сравнению с аналогичными формами амиодарона. В исследование последовательно вошли 388 пациентов: 228 (58,7%) мужчин и 160 (41,3%) женщин в возрасте 29–78 лет (средний возраст – 66,29±11,14 года) с пароксизмом ФП длительностью в среднем 195 минут (3,25 часа). Эффективность изучаемых препаратов оценивалась до восстановления синусового ритма в течение 24 часов наблюдения. В 1-й группе (амиодарон) эффективность составила 61,7%, во 2-й (пропафенон) – 77,6% (p=0,012). Среднее время восстановления в 1-й группе – 110 минут, во 2-й – 22 (p=0,0001). Купирование пароксизма ФП до 60 минут составило в 1-й группе 25,83%, во 2-й – 64,5% (p<0,05). Авторы пришли к выводу, что инъекционный пропафенон – эффективный и безопасный антиаритмический препарат, который может служить альтернативой амиодарону при фармакологической кардиоверсии ФП у пациентов без органической патологии сердца. Инъекционный пропафенон может применяться в условиях скорой медицинской помощи для купирования пароксизма ФП, так, его максимальный эффект наступает до 30 минут в отличие от амиодарона, при использовании которого в большинстве случаев не происходит быстрого купирования аритмии при внутривенном введении.
Следует отметить, что высокая клиническая эффективность пропафенона признается и ведущими мировыми экспертами. Так, в Европейских рекомендациях по ведению пациентов с ФП 2016 г. [47] обращается внимание на высокий потенциал данного препарата в медикаментозной кардиоверсии у пациентов с таким типом аритмии, а также на возможность использовать его даже в качестве средства профилактики возникновения пароксизмов ФП.
Профилактика
В качестве профилактики лекарственно-индуцированного ГТ рекомендуется по возможности избегать применения препаратов, обладающих данной нежелательной побочной реакцией. В частности, при необходимости проведения антиаритмической терапии препаратом выбора вместо амиодарона может служить пропафенон, доказавший свою эффективность и безопасность среди прочего в отношении тиреоидного статуса, что отражено в актуальных алгоритмах ведения пациентов с коморбидной патологией [44]. Также необходимо употреблять адекватное количество йода для профилактики йододефицита, своевременно корректировать нарушения функции ЩЖ. Важную роль играет санитарно-просветительская работа с населением, так как знание ранних симптомов лекарственно-индуцированного ГТ позволяет добиваться лучшего эффекта в его терапии.
Перед началом терапии препаратами, которые могут вызывать ГТ, многие клиницисты рекомендуют проводить предварительное исследование функции ЩЖ, а в процессе терапии повторять его каждые 3–12 месяцев для раннего выявления лекарственно-индуцированного ГТ [1, 42].
Заключение
Число случаев лекарственно-индуцированного ГТ продолжит расти, а перечень инициирующих состояние лекарств расширяться. При назначении следует учитывать имеющиеся факторы риска развития лекарственно-индуцированного ГТ, а также необходимость проведения профилактических мероприятий. ГТ, индуцированный приемом лекарственных средств, важно своевременно диагностировать и подобрать оптимальный метод терапии.
Вклад авторов
Остроумова О.Д. – разработка концепции статьи, сбор и редактирование материалов
Качан В.О. – сбор и редактирование материалов.
Кочетков А.И. – сбор и редактирование материалов.
Краснов Г.С. – сбор материалов, координация деятельности авторов.
Литература
1. Rizzo L.F.L., Mana D.L., Serra H.A. Drug-induced hypothyroidism. Med. (B Aires). 2017;77(5):394–404.
2. Taylor P.N., Albrecht D., Scholz A., et al. Global epidemiology of hyperthyroidism and hypothyroidism. Nat Rev Endocrinol. 2018;14(5):301–16. Doi: 10.1038/nrendo.2018.
3. Tisdale J.E., Miller D.A. Drug-induced diseases: prevention, detection, and management. 2nd ed. Bethesda, Md.: American Society of Health-System Pharmacists, 2010.
4. George J., Joshi S.R. Drugs and Thyroid. J Assoc Phys India. 2007;55:215–12.
5. Maynard S., Miller R.G. Drug-Induced Hypothyroidism. Labmed. 2017
6. Tisdale J.E., Miller D.A. Drug Induced Diseases: Prevention, Detection, and Management. 3rd ed. Bethesda, Md.: American Society of Health-System Pharmacists, 2018.
7. Mir S.A., Wani A.I., Masoodi S.R., et al. Lithium toxicity and myxedema crisis in an elderly patient. Indian J Endocrinol Metab. 2013;17(Suppl. 3):S654–56. Doi: 10.4103/2230-8210.123558.
8. Luster M., Duntas L.H., Wartofsky L., ed. The Thyroid and Its Diseases. A Comprehensive Guide for the Clinician. Springer International Publishing, 2019.
9. Miyake Z., Ishii K., Tamaoka A. Hypothyroidism induced by phenytoin and gabapentin: Case Rep. Med. (Baltimore). 2018;97(43):e12938. Doi: 10.1097/MD.0000000000012938.
10. Вернигородский В.С., Власенко М.В., Паламарчук А.В. и др. Терапевтические маски гипотиреоза. Мiжнародний ендокринологический журнал. 2018;14(5):503–7.
11. Pigatto P.D., Guzzi G. Aloe Linked to Thyroid Dysfunction. Arch Med Res. 2005;36(5):608. Doi: 10.1016/j.arcmed.2005.03.022.
12. Colao A., Merola B., Ferone D., et al. Acute and chronic effects of octreotide on thyroid axis in growth hormonesecreting and clinically non-functioning pituitary adenomas. Eur J Endocrinol. 1995;133(2):189–94.
13. Heidegger I., Nagele U., Pircher A., et al. Latent hypothyreosis as a clinical biomarker for therapy response under abiraterone acetate therapy. Anticancer Res. 2014;34(1):307–11.
14. Trohman R.G., Sharma P.S., McAninch E.A., et al. Amiodarone and the thyroid physiology, pathophysiology, diagnosis and management. Trends Cardiovasc Med. 2019;29(5):285–95. Doi: 10.1016/j.tcm.2018.09.005.
15. Eskes S.A., Wiersinga W.M. Amiodarone and thyroid. Best Pract Res Clin Endocrinol Metab. 2009;23(6):735–51. Doi: 10.1016/j.beem.2009.07.001.
16. De Leo S., Braverman L.E. Amiodarone-Induced Thyroid Dysfunction. In: Luster M., Duntas L., Wartofsky L. The Thyroid and Its Diseases. Springer, Cham, 2019. P. 417–33.
17. Udovcic M., Pena R.H., Patham B., et al. Hypothyroidism and the Heart. Methodist Debakey Cardiovasc J. 2017;13(2):55–9. Doi: 10.14797/mdcj-13-2-55.
18. Fukuchi H., Nakashima M., Araki R., et al. Effect of obesity on serum amiodarone concentration in Japanese patients: population pharmacokinetic investigation by multiple trough screen analysis. J Clin Pharm Ther. 2009;34(3):329–36. Doi: 10.1111/j.1365-2710.2008.00987.x.
19. Rizzo L.F., Bruno O.D. Amiodarona y disfunción tiroidea. Med. (B Aires). 2012;72(1):63–74.
20. Mazokopakis E.E., Karefilakis C.M., Starakis I.K.Escitalopram-induced subclinical hypo-thyroidism. A case report. Hormon. (Athens). 2012;11(1):101–3. Doi: 10.1007/BF03401543.
21. Takahashi M., Sawayama E., Sawayama T., Miyaoka H. Reversible paroxetine-induced symptomatic hypothyroidism. Pharmacopsychiat. 2007;40(5):201–2. Doi: 10.1055/s-2007-985884.
22. Mccowen K.C., Garber J.R., Spark R. Elevated serum thyrotropin in thyroxine-treated patients with hypothyroidism given sertraline. N Engl J Med. 1997;337(14):1010–1. Doi: 10.1056/NEJM199710023371415.
23. Baruah M.P., Singh R.J. Effects of drugs on thyroid function. Thyroid Res Pract. 2012;9(1):3–6. Doi: 10.4103/0973-0354.92387.
24. Mathiodakis N., Thapa S., Wand G.S., Salvatori T. ACTHsecreting pituitary microadenomas are associated with a higher prevalence of central hypothyroidism compared to other microadenoma types. Clin Endocrinol. (Oxf). 2012;77(6):871–76. Doi: 10.1111/j.1365-2265.2012.04442.x.
25. Geenen V. Drug-induced thyroid dysfunction. 2016 Apr 16
26. Cerniglia B., Judson M.A. Infliximab-Induced Hypothyroidism: A Novel Case and Postulations concerning the Mechanism. Case Rep Med. 2013;2013:216939. Doi: 10.1155/2013/216939.
27. Monzani F., Caraccio N., Meucci G., et al. Effect of 1-year treatment with interferon-beta1b on thyroid function and autoimmunity in patients with multiple sclerosis. Eur J Endocrinol. 1999;141(4):325–31.
28. Durelli L., Ferrero B., Oggero A., et al. Thyroid function and autoimmunity during interferon-1b treatment: a multicenter prospective study. J Clin Endocrinol Metab. 2001;86(8):3525–32. Doi: 10.1210/jcem.86.8.7721.
29. Ramaswamy S., Siddiqui Z., Saharan S., et al. Quetiapine-induced hypothyroidism. J Psychiat Neurosci. 2005;30(1):57.
30. Liappas J., Paparrigopoulos T., Mourikis I., et al. Hypothyroidism induced by quetiapine: a case report. J Clin Psychopharmacol. 2006;26(2):208–9. Doi: 10.1097/01.jcp.0000203227.56494.ff.
31. Inskip P.D., Veiga L.H.S., Brenner A.V., et al. Hypothyroidism after Radiation Therapy for Childhood Cancer: A Report from the Childhood Cancer Survivor Study. Radiat Res. 2018;190(2):117–32. Doi: 10.1667/RR14888.1.
32. Lin C., Guo Z., Mo Z. Nivolumab-induced hypothyroidism: A case report. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2019;44(2):222–24. Doi: 10.11817/j.issn.1672-7347.2019.02.016.
33. Weijl N.I., Van der Harst D., Brand A., et al. Hypothyroidism during immunotherapy with interleukin-2 is associated with antithyroid antibodies and response to treatment. J Clin Oncol. 1993;11(7):1376–83. Doi: 10.1200/JCO.1993.11.7.1376.
34. CAMMS223 Trial Investigators, Coles A.J., Compston D.A., Selmaj K.W., et al. Alemtuzumab vs. interferon beta-1a in early multiple sclerosis. N Eng J Med. 2008;359(17):1786–801. Doi: 10.1056/NEJMoa0802670.
35. Reismüller B., Azizi A.A., Peyrl A., et al. Feasibility and tolerability of bevacizumab in children with primary CNS tumors. Pediatric. Blood Cancer. 2010;54(5):681–86. Doi: 10.1002/pbc.22409.
36. Matulonis U.A., Berlin S., Ivy P., et al. Cediranib, an oral inhibitor of vascular endothelial growth factor receptor kinases, is an active drug in recurrent epithelial ovarian, fallopian tube, and peritoneal cancer. J Clin Oncol. 2009;27(33):5601–606. Doi: 10.1200/JCO.2009.23.2777.
37. De Savary N., Lee R., Vaidya B. Severe hypothyroidism after thalidomide treatment. J R Soc Med. 2004;97(9):443–43. Doi: 10.1258/jrsm.97.9.443.
38. Figaro M.K., Clayton Jr.W., Usoh C., et al. Thyroid abnormalities in patients treated with lenalidomide for hematological malignancies: results of a retrospective case review. Am J Hematol. 2011;86(6):467–70. Doi: 10.1002/ajh.22008.
39. Eyal O., Rose S.R. Autoimmune thyroiditis during leuprolide acetate treatment. J Pediatr. 2004;144(3):394–96.
40. Щегерцов Д.Ю., Филинюк О.В., Буйнова Л.Н.и др. Нежелательные побочные реакции при лечении больных туберкулезом с множественной лекарственной устойчивостью возбудителя. Туберкулез и болезни легких. 2018;96(3):35–43.
41. Потанина О.Н. Гипотиреоз у больных туберкулезом, получающих тиоуреидоиминометилпиридиния перхлорат. Медицинский альянс. 2018;1:41–5.
42. Munivenkatappa S., Anil S., Naik B., et al. Drug-Induced Hypothyroidism during Anti-Tuberculosis Treatment of Multidrug-Resistant Tuberculosis: Notes from the Field. JTR. 2016;4(3):105–10. Doi: 10.4236/jtr.2016.43013.
43. Lai E.C.C., Yang Y.H.K., Lin S.J., et al. Use of antiepileptic drugs and risk of hypothyroidism. Pharmacoepidemiol. Drug Saf. 2013;22(10):1071–79. Doi: 10.1002/pds.3498.
44. Оганов Р.Г., Симаненков В.И., Бакулин И.Г. и др. Коморбидная патология в клинической практике. Алгоритмы диагностики и лечения. Кардиоваскулярная терапия и профилактика. 2019;18(1):5–66.
45. Миллер О.Н., Старичков С.А., Поздняков Ю.М.и др. Эффективность и безопасность применения пропафенона (Пропанорма®) и амиодарона (Кордарона®) у больных с фибрилляцией предсердий на фоне артериальной гипертонии, ишемической болезни сердца и хронической сердечной недостаточности с сохраненной систолической функцией левого желудочка многоцентровое открытое рандомизированное проспективное сравнительное исследование простор. Росcийский кардиологический журнал. 2010;(4):55–71.
46. Тарасов А.В., Косых С.А., Бушуева Е.В. и др. Сравнение эффективности инъекционных форм антиаритмических препаратов пропафенона и амиодарона при проведении фармакологической кардиоверсии пароксизмальной фибрилляции предсердий. Consilium Medicum. 2019;21(1):81–6.
47. Kirchhof P., Benussi S., Kotecha D., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur J Cardiothorac Surg. 2016;50(5):e1–88. Doi: 10.1093/ejcts/ezw313.
Об авторах / Для корреспонденции
Автор для связи: О.Д. Остроумова, д.м.н., профессор, зав. кафедрой терапии и полиморбидной патологии, Российская медицинская академия непрерывного профессионального образования; профессор кафедры клинической фармакологии и пропедевтики внутренних болезней, Первый Московский государственный медицинский университет им. И.М. Сеченова, Москва, Россия; e-mail: ostroumova.olga@mail.ru
Адрес: 125993, Россия, Москва, ул. Баррикадная, 2/1, стр. 1
Гипотиреоз — симптомы и лечение
Что такое гипотиреоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., терапевта со стажем в 29 лет.
Над статьей доктора Курашова О. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Терапевт Cтаж — 29 лет Кандидат наук
Дата публикации 11 апреля 2019 Обновлено 26 апреля 2021
Определение болезни. Причины заболевания
Гипотиреоз — это заболевание эндокринной системы, возникающее из-за длительно низкого уровня тиреоидных гормонов, вырабатываемых щитовидной железой, и проблем с их воздействием на организм преимущественно на тканевом уровне.
Ежегодно на каждую тысячу человек приходится 0,6-3,5% заболевших гипотиреозом. [3] [6] [8] Данное нарушение может возникнуть в любом возрасте, но обычно оно возникает у пожилых людей старше 60 лет. [14] Среди новорождённых гипотиреоз встречается в одном случае из 4-5 тысяч.
К факторам риска относятся:
- аутоиммунный тиреоидит ;
- гипертиреоз ;
- подострый и послеродовой тиреоидит;
- аутоиммунные заболевания (B1-дефицитная анемия, болезнь Аддисона, сахарный диабет I типа);
- рак тканей головы и шеи (леченый);
- курение;
- болезни щитовидной железы у родственников;
- применение радиоактивного йода при лечении рака щитовидной железы ;
- приём некоторых препаратов (амиодарон, α-интерферон, карбонат лития, йод-, бромсодержащие и другие лекартсва). [15]
В 80% случаев гипотиреоз связан с поражением защитных сил организма, т. е. аутоиммунным тиреоидитом. Он является ведущей причиной первичного гипотиреоза у взрослых людей. [3]
Риск возникновения аутоиммунного тиреоидита зависит от возраста и пола пациента: у женщин в возрасте 40-50 лет он возникает в 10-15 раз чаще, чем у мужчин. [6] [9]
При аутоиммунном тиреоидите даже на фоне длительной ремиссии функциональное состояние щитовидной железы в разное время может значительно различаться. Так, с возрастом деструктивные изменения в щитовидной железе постепенно нарастают. Этот фактор, а также наличие тиреоидных аутоантител могут спровоцировать переход субклинического (скрытого) гипотиреоза, протекающего на фоне аутоиммунного тиреоидита, в явный. Частота таких случаев составляет около 5 % в год.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы гипотиреоза
Симптомы гипотиреоза крайне обманчивы, разнообразны и не всегда заметны. Их проявление зависит от степени выраженности заболевания.
К основным клиническим проявлениям относятся: [9] [11] [14]
- Обменно-гипотермический синдром. Характерно постоянное чувства холода, снижение температуры тела, увеличение веса.
- Нарушение нервной системы и органов чувств. Человек становится заторможенным, вялым, появляется сонливость, ухудшается память, нарушается носовое дыхание и слух, голос становится низким и грубым, а речь замедленной. На лице и конечностях может возникнуть плотный отёк. Кожа утолщается, становится сухой и холодной, приобретает бледный окрас с желтоватым оттенком, волосы становятся тусклыми и ломкими, подверженными выпадению.
- Нарушение сердечно-сосудистой системы. Наблюдается пониженное или нормальное артериальное давление. У части пациентов возникает мягкая диастолическая гипертензия.
- Изменения со стороны ЖКТ. Замедляется перистальтика кишечника, возникают запоры, изменения желчного пузыря и его протоков, снижается аппетит, вплоть до развития анорексии.
- Анемический синдром. Из-за недостатка гормонов щитовидной железы возникает депрессия костно-мозгового кроветворения, нередко развивается В12-дефицитная и постгеморрагическая анемия, время кровотечения увеличивается.
- Дисфункция почек. Почечный кровоток и скорость клубочковой фильтрации снижаются, как и эффективность почечного плазмотока, уровень глюкозы и натрия в крови становится ниже нормы.
- Сбои репродуктивной системы. У женщин происходит нарушение овуляции, менструальные циклы становятся короткими и редкими, возникает бесплодие. В большинстве случаев развивается вторичная гиперпролактинемия, которая сопровождается самопроизвольным вытеканием молока из молочной железы и отсутствием месячных. На фоне декомпенсированного гипотиреоза беременность наступает крайне редко. Снижение либидо наблюдается у лиц обоего пола. У мужчин может развиваться эректильная дисфункция, нарушение сперматогенеза.
- Нарушение опорно-двигательной системы. Как правило, замедляется костное ремоделирование, снижается интенсивность резорбции (рассасывания) кости и костеобразования. Часто возникает снижение плотности костной ткани и рабдомиопатия, причём как с гипертрофией (увеличением) мышц, так и с их атрофией.
Патогенез гипотиреоза
Тиреоидные гормоны, которые вырабатывает щитовидная железа, называются «трийодтиронин» (Т3) и «тироксин» (Т4). Они влияют практически на все процессы, протекающие в организме. Стимулирующее влияние на них оказывает тиреотропный гормон гипофиза (ТТГ).
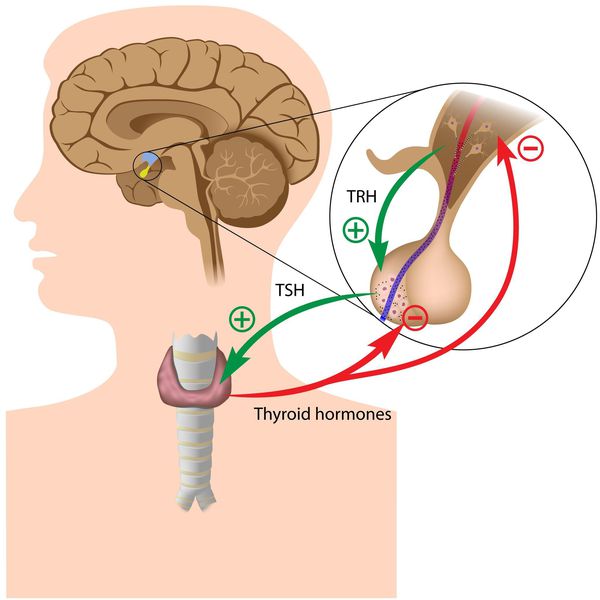
Синтез тиреоидных гормонов начинается после того, как щитовидная железа захватывает йод. Он является регулятором гормоногенеза и размножения тиреоцитов — клеток эпителия щитовидной железы. Попав в тиреоциты, йодид окисляется до активной формы при помощи тиреопероксидазы — микросомального антигена, к которому образуются антитела, в частности при аутоиммунном тиреоидите. [4] [6] [7] Уровень поступления йода изменяет чувствительность тиреоцитов к воздействию ТТГ, которая усиливается при дефиците йода. [3] [6]
Исходя из этого механизма возникновения гормонов щитовидной железы, патогенетически гипотиреоз делится на три типа:
- первичный (тиреогенный);
- вторичный (гипофизарный);
- третичный (гипоталамический);
- периферический (тканевой).
Первичный гипотиреоз возникает в 80-95% случаев и чаще всего обусловлен нарушениями общей структуры щитовидной железы, которые являются врождёнными или приобретёнными, а также сбоем секреторной функции её клеток.
Вторичный и третичный гипотиреоз возникают в 3-4% случаев. Они связаны с заболеваниями таких участков головного мозга, как аденогипофиз или гипоталамус в результате которых наблюдается стойкая нехватка гормонов щитовидной железы и нарушение секреции ТТГ гипофиза. [4] [6]
Периферический гипотиреоз развивается крайне редко — в 0-1% случаев. Основным фактором его возникновения является резистентность (сопротивляемость) тканей-мишеней (например, мозга, гипофиза, сердца, костей, печени) гормонам Т4 и Т3. [5] [6] [7]
В патогенезе аутоиммунных заболеваний щитовидной железы взаимодействуют генетические и средовые факторы. Однако точная роль тех и других не определена. Ведущее значение в гибели тиреоцитов при этих заболеваниях придают клеточным механизмам, т.е. цитотоксическим эффектам аутореактивных Т- лимфоцитов. [3] [5] Отсутствие при аутоиммунных поражениях щитовидной железы классических признаков гнойного воспаления (боли, отёка и других), обычно сопровождающих массивный некроз ткани, указывает в таких случаях на иной механизм гибели тиреоцитов. В последние годы установлено, что Т-лимфоциты способны вызывать гибель клеток-мишеней не только путём некроза, но в основном путём индукции их разрушения. [3] [5] [7] [9]
Классификация и стадии развития гипотиреоза
В Международной классификации болезней десятого пересмотра выделены две формы гипотиреоза:
- Субклинический (скрытый) гипотиреоз, развившийся в результате йодной недостаточности.
- Иные формы гипотиреоза:
- врожденный гипотиреоз с диффузным зобом;
- врождённый гипотиреоз без зоба;
- гипотиреоз, возникший по причине приёма лекарств и других экзогенных веществ;
- постинфекционный гипотиреоз;
- атрофия щитовидной железы (приобретённая);
- другие уточнённые гипотиреозы;
- неуточнённый гипотиреоз.
Первичный гипотиреоз подразделят на три большие группы:
- Врождённый гипотиреоз.
- Гипотиреоз, связанный с уменьшением количества функционирующей ткани щитовидной железы:
- возникающий после операции
- развивающийся после облучения
- вызванный аутоиммунным нарушением щитовидной железы
- связанный с вирусным заболеванием щитовидной железы
- возникающий на фоне новообразований щитовидной железы.
- Гипотиреоз, связанный с нарушением выработки тиреоидных гормонов:
- эндемический зоб — возникает в районах с йододефицитом;
- спорадический зоб с гипотиреозом — развивается в случае дефектов биосинтеза гормонов;
- медикаментозный гипотиреоз — появляется в результате приёма тиреостатиков и других препаратов;
- зоб и гипотиреоз, развившиеся в связи с употреблением продуктов, содержащих вредные вещества. [3][5][7][9]
В последнее время разработана классификация первичного гипотиреоза, которая основывается на выраженности симптомов и результатах гормональных исследований (определяющий показатель — уровень ТТГ). В неё включают:
- Субклинический (скрытый) гипотиреоз — симптомы размыты или отсутствуют, уровень ТТГ повышен, содержание Т4 в норме.
- Манифестный — возникает типичная клиническая картина гипотиреоза, уровень ТТГ повышен, концентрация Т4 снижена:
- компенсированный.
- декомпенсированный.
- Осложнённый — развивается кретинизм, сердечная недостаточность, выпот в серозные полости, вторичная аденома гипофиза. [2]
Осложнения гипотиреоза
Гипотиреоидная кома («спячка») — это угрожающее жизни состояние, которое чаще развивается у пожилых людей, которые долгое время не лечили тяжёлый гипотиреоз, который был у них довольно долгое время. [3] [5] [7] [9]
К основным провоцирующим факторам такого осложнения относят:
- охолаждение;
- сердечно-сосудистые заболевания;
- острые инфекции;
- травмы;
- кровопотерю;
- хирургические вмешательства;
- приём алкоголя или лекарств, угнетающих функцию центральной нервной системы;
- стрессовые ситуации. [6][7][8]
При гипотиреоидной коме температура тела, как правило, снижается до 24-32,2°С, возникают судороги и угнетение дыхания. Лечение такого состояния нужно начинать незамедлительно. [14] Но даже при своевременном обнаружении осложнения и незамедлительном лечении смерть может наступить в 25-60% случаев. [15]
Но появление осложнений может вызвать не только отсутствие лечения, но и неграмотная медикаментозная терапия. Например, передозировка лекарствами может привести к избыточному синтезу гормонов щитовидной железы и патологиям со стороны сердечно-сосудистой системы. В связи с этим крайне важно соблюдать все рекомендации врача по лечению заболевания и ни в коем случае не лечиться самостоятельно.
Диагностика гипотиреоза
Диагностика гипотиреоза включает в себя подробный опрос пациента, осмотр и лабораторные исследования.
Так как симптомы гипотиреоза неспецифичны, он может скрываться под масками других заболеваний. Поэтому по проявлениям его иногда можно спутать с железодефицитной анемией, депрессией, аменореей, невритом и другими нарушениями. [15] [16] В связи с этим важную роль в определении гипотиреоза играют лабораторные исследования. Они показаны всем пациентам с нарушениями щитовидной железы и предполагают оценку уровня ТТГ и свободного Т4. [2] [12] Определение уровня Т3 в крови, как правило, не является информативным, так как при первичном гипотиреозе этот показатель находится в норме. [14]
На явное наличие гипотиреоза будет указывать высокий уровень ТТГ и низкий уровень свободного Т4 в крови. При субклиническом гипотиреозе уровень ТТГ также будет повышен, а уровень свободного Т4 будет находиться в пределах нормы.
После того как наличие гипотиреоза подтверждено, при помощи показателя ТТГ также определяется характер заболевания и наличие возможных осложнений. Уровень ТТГ также позволяет в значительном большинстве случаев оценить адекватность проводимой терапии: об этом будет свидетельствовать стойкий уровень ТТГ в крови в пределах нормы. [6] [7] [8]
В достаточно редких случаях проводят пробу с тиреолиберином для оценки аутоиммунных заболеваний щитовидной железы. [6] [9] [15]
Дополнительные методы диагностики, такие как УЗИ щитовидной железы, сцинтиграфия или пункционная биопсия, используются для уточнения характера и степени выраженности заболевания. [6] [11] [12] [16]
Так как с возрастом учащаются случаи узлового зоба, выраженный шейный кифоз может смещать трахею кзади и вниз, что затрудняет пальпаторную оценку состояния щитовидной железы, в результате чего своевременная диагностика заболевания не проводится. [4] [5] [6] [7] [8]
В связи с тем, что гипотиреоз не всегда проявляет себя, среди населения принято проводить массовую диагностику данного заболевания — скрининг. Так, определение уровня ТТГ позволяет обнаружить первичный гипотиреоз у людей без каких-либо других его проявлений, а также у новорождённых (исследование проводится на 4-5 сутки жизни). При планировании беременности и на ранних её сроках также важно пройти исследование на гипотиреоз. [3] [5] [7] [9]
Лечение гипотиреоза
Цель лечения гипотиреоза — это поддержание уровня ТТГ в пределах 0,5-1,5 мМЕ/л.
Единственным методом лечения является пожизненная заместительная терапия. Начинать её стоит при уровне ТТГ более 10 мЕД/л, высоких титрах антител к ТПО и других показателях. Для этого предпочтительны препараты левотироксина натрия. Его применение противопоказано лишь в случае нелеченого тиреотоксикоза и недостаточности коры надпочечников, остром инфаркте миокарда, аллергии и индивидуальной непереносимости препарата. [16]
Обычно лечение проводится в условиях стационара. Показаниями к госпитализации пациентов с гипотиреозом служат:
- тяжёлая степень заболевания;
- наличие выраженной сердечной патологии;
- гипотиреоидная кома.
Заместительная терапия первичного (манифестного) гипотиреоза показана пожизненно с назначением тироксина в средней дозе 1,6-1,8 мкг/кг. Пациентам с кардиальной патологией доза рассчитывается, исходят из расчёта 0,9 мкг/кг. Стоит отметить, что в связи с уменьшением метаболизма тиреоидных гормонов потребность в них с возрастом снижается. [5] [7] [9]
Дозы тироксина зависят от причин и патогенеза заболевания. Потребность в препарате у людей со спонтанным гипотиреозом выше, чем у пациентов с гипотиреозом, возникшим после хирургического лечения и применения радиоактивного йода.
Уровень ТТГ при диагностике гипотиреоза напрямую связан с оптимальной заместительной дозой тироксина: у большинства женщин она составляет 75-100 мкг, а у мужчин — до 150 мкг в день приёма.
Первый контроль уровня ТТГ после начатого лечения проводят через 2-3 месяца, затем один раз в шесть месяцев (при обязательном условии соблюдения пациентом схемы лечения). [6] [9] [13]
При субклиническом гипотиреозе существует риск развития манифестной формы заболевания со всеми характерными проявлениями. Так, явный гипотиреоз возникает у 20-50% пациентов в течение 4-8 лет, а присутствие антитиреоидных антител увеличивает риск до 80%. [8] [9] [10] Потому людям со скрытым гипотиреозом следует длительно наблюдаться у специалистов.
Проблемы при лечении гипотиреоза
Лечение тироксином безопасно, просто и сравнительно дешево. Но, несмотря на многолетний опыт его использования, при нём всё же могут возникать многие проблемы. Основная из них связана с несоблюдением пациента схемы лечения. Так, одновременное повышение уровней Т4 и ТТГ, по всей вероятности, будет указывать на то, что за несколько дней до визита к врачу пациент не выполнял его назначений.
Снижение эффективности установленной дозы тироксина часто связано с меньшим содержанием гормона в таблетках (например, в непатентованных препаратах) или взаимодействием лекарств при одновременном приёме других препаратов. [9] [13]
Недостаточность дозы также может быть связана с уменьшением всасывания тироксина, нарушением энтеропечёночного кровотока, ускорением кругооборота или выделением гормона с мочой, медленным снижением тиреоидной функции после лечения гипертиреоза.
Существуют и другие особенности и проблемы при лечении гипотиреоза. [6]
Лучшим критерием подбора дозы тироксина при аутоиммунном тиреоидите является исследование ТТГ и свободного Т4. При этом лечение нацелено на компенсацию гипотиреоза благодаря той же заместительной терапии и редукция зоба при помощи супрессивной терапии. [6] [9] Критериями эффективности лечения при этом будут служить:
- уменьшение зоба в объёме;
- снижение плотности щитовидной железы;
- уменьшение титра антител до нормы;
- поддержание уровня ТТГ в пределах нормы.
Назначение препаратов тиреогормонов при аутоиммунном тиреоидите без нарушения функции щитовидной железы нецелесообразно, а операция может привести к состоянию, способному значительно ухудшить качество жизни пациента с возможностью развития тяжёлого гипотиреоза и инвалидизации. [9] [13]
Прогноз. Профилактика
Прогноз заболевания при своевременной диагностике и лечении благоприятный. [10] Осложнить его, особенно в отношении трудоспособности и состояния здоровья в целом, могут фибрилляция предсердий и выраженная сердечная недостаточность, развивающиеся на фоне тиреотоксикоза. [5]
Специфической профилактики заболевания не существует. Снизить риск развития гипотиреоза можно только при помощи сбалансированного правильного питания , употребления достаточного количества йода с пищей (включения в рацион морепродуктов) и контроля гормонального баланса. Крайне важно проходить профилактические осмотры и являться на контрольные приёмы к лечащему врачу. [5] [11] [12]
В качестве неспецифической профилактики патологий щитовидной железы стоит проходить санаторно-курортное лечение по показаниям врача.
Доказано, что медикаментозная терапия при гипотиреозе становится более эффективной в сочетании с радоновыми процедурами, а азотные ванны, не содержащие радон, оказывают профилактическое воздействие. [1] [5] Благодаря этому удаётся добиться стойкости ремиссии заболевания.

Рекомендуется проведение до трёх курсов таких процедур с интервалом от 8 до 12 месяцев. Подбор схем лечения в санатории (в т.ч. медикаментозных), рациональное использование природных и климатических факторов определяют ближайший и отдалённый результат оздоровления.
Список литературы
- Казначеев В.П., Эфендиев Б.А., Эфендиева Т.С. и др. Актуальные проблемы курортологии. — Белокуриха, 2003. — С. 5-9.
- Дедов И.И., Трошина Е.А., Антонова С.С. и др. Аутоиммунные заболевания щитовидной железы: состояние проблемы // Пробл. эндокринологии. — 2002. — № 2. — С. 6-13.
- Балаболкин М.И. Эндокринология. — М., 1998. — 582 с.
- Бельфиоре А. Тонкоигольная аспирационная биопсия щитовидной железы // Thyroid International. — 2002. — № 2. — С. 3-15.
- Брызгалина С.М., Шимотюк Е.М., Курашова О.Н. Синдром гипотиреоза. Клинические варианты. Диагностика. — Новокузнецк, 2010. — 35 с.
- Браверман Л.И. Болезни щитовидной железы / пер. с англ. — М., 2000. — 432 с.
- Кандрор В.И. Аутоиммунные заболевания щитовидной железы и апоптоз // Пробл. эндокринологии. — 2002. — № 1. — С. 45-48.
- Кандрор В.И. Молекулярно-генетические аспекты тиреоидной патологии // Пробл. эндокринологии. — 2001. — № 5. — С. 3-6.
- Фадеев В.В., Шевченко И.В., Мельниченко Г.А. Аутоиммунные полигландулярные синдромы // Пробл. эндокринологии. — 2000. — № 3. — С. 31-45.
- Фадеев В.В., Мельниченко Г.А., Герасимов Г.А. Аутоиммунный тиреоидит. Первый шаг к консенсусу // Пробл. эндокринологии. — 2001. — № 4. — С. 7-13.
- Фадеев В.В. Гипотиреоз. — М., 2004.
- Российская ассоциация эндокринологов. Федеральные клинические рекомендации по диагностике и лечению гипотиреоза. — М., 2014.
- Приказ Министерства здравоохранения РФ от 5 мая 2016 года № 279н «Об утверждении порядка организации санаторно-курортного лечения».
- Hershman J.M. Hypothyroidism // MSD Manual. — 2018.
- Patil N., Jialal I. Hypothyroidism // StatPearls Publishing. — 2019.
- Абдулхабирова Ф.М., Бабарина М.Б. Современные методы диагностики и лечения синдрома гипотиреоза // Трудный пациент. — 2014.
Гипотиреоз, вызванный медикаментами и другими экзогенными веществами (E03.2)
Амиодарон-индуцированный гипотиреоз — снижение функции щитовидной железы (гипотиреоз) на фоне приема амиодарона.
Амиодарон — жирорастворимый бензофурановый антиаритмический препарат, оказывающий комплексное воздействие на щитовидную железу (ЩЖ), в том числе и на гормональный обмен. Амиодарон имеет довольно высокое содержание йода и может усугубить дисфункцию ЩЖ на фоне уже имеющейся ее патологии, а также стать причиной развития деструктивного тиреоидита Тиреоидит — воспаление щитовидной железы
у пациентов с нормальной ЩЖ.
Общий показатель заболеваемости гипер- и гипотиреозом у пациентов, получающих амиодарон, составляет 14-18%. С учетом особенно длительного периода полураспада препарата, данные проблемы могут возникнуть и спустя несколько месяцев после отмены терапии амиодароном.
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
+7 938 489 4483 / +7 707 707 0716 / + 375 29 602 2356 / office@medelement.com
Мне интересно! Свяжитесь со мной
Классификация
Амиодарон-индуцированные тиреопатии:
1. Амиодарон-индуцированный гипотиреоз.
2. Амиодарон-индуцированный тиреотоксикоз:
— тип I;
— тип II.
Этиология и патогенез
Этиология
Амиодарон содержит большое количество йода (39% веса); одна таблетка (200 мг) препарата содержит 74 мг йода, при метаболизме которого высвобождается около 7 мг йода в сутки. При приеме амиодарона в организм ежедневно поступает 7-21 г йода (физиологическая потребность в йоде около 200 мкг).
Амиодарон в больших количествах накапливается в жировой ткани и печени. Период полувыведения препарата составляет в среднем 53 дня и более, в связи с чем амиодарон-индуцированные тиреопатии могут возникать спустя долгое время после отмены препарата.
В качестве средства для лечения жизненно опасных желудочковых аритмий амиодарон был разрешен к применению в 1985 году. Амиодарон также эффективен в лечении пароксизмальной суправентрикулярной тахикардии, фибрилляции и трепетания предсердий. Применение препарата снижает риск кардиоваскулярной смертности и повышает выживаемость больных с сердечной недостаточностью.
Патогенез
Амиодарон вмешивается в обмен и регуляцию тиреоидных гормонов на всех уровнях. Ингибируя дейодиназу 2 типа, он нарушает конверсию Т4 и ТЗ в тиротропоцитах гипофиза, в результате чего происходит снижение чувствительности гипофиза к тиреоидным гормонам. У многих пациентов, получающих амиодарон, особенно в начале терапии, определяется некоторое повышение уровня ТТГ при нормальном уровне тиреоидных гормонов (эутиреоидная гипертиротропинемия).
Эффекты, оказываемые амиодароном на ЩЖ:
— блокирует органификацию йода и нарушает синтез тиреоидных гормонов в ЩЖ;
— может приводить к развитию тиреотоксикоза в результате специфического тиреоидита или развития «йод-базедовой» болезни;
— замедляет клиренс Т4, подавляет 5′- дейодирование Т4 и реверсивного Т3;
— стимулирует секрецию ТТГ.
Выделяют кратковременные (менее 3 месяцев) и длительные (более 3 месяцев) эффекты амиодарона на функцию ЩЖ.
Прием амиодарона в течение 3 месяцев у пациентов с эутиреозом Эутиреоз — нормальное функционирование щитовидной железы, отсутствие симптомов гипо- и гипертиреоза
приводит к снижению содержания Т3 и повышению содержания Т4, свободного Т4, реверсивного Т3, ТТГ. Вероятно, содержание ТТГ повышается в результате снижения внутриклеточного транспорта Т4, ингибирования 5′ -дейодиназы 1 и 2-го типа, а также вследствие нарушения связывания Т3 ядерным рецептором в гипофизе. Повышение общ. Т4, св. Т4 и реверсивного Т3 связано с ингибированием 5′ -дейодиназы 1 и 2 -го типа.
Возникновение гипотиреоза объясняется эффектом Вольфа-Чайкова, воздействием амиодарона на содержание тиреоидных гормонов и ТТГ в сыворотке крови, влиянием на течение предшествующих аутоиммунных процессов в ЩЖ, возможно — запуском апоптоза Апоптоз — запрограммированная смерть клетки при помощи внутренних механизмов.
.
Эпидемиология
Степень риска нарушения функции щитовидной железы зависит не от ежедневной или накопившейся дозы амиодарона, а от йодного обеспечения в регионе проживания. У больных, проживающих в областях с достаточным потреблением йода, чаще развивается амиодарон-индуцированный гипотиреоз Гипотиреоз — синдром недостаточности щитовидной железы, характеризующийся нервно-психическими расстройствами, отеками лица, конечностей и туловища, брадикардией
, а в регионах с низким потреблением йода чаще отмечают тиреотоксикоз Тиреотоксикоз — патологическое состояние, обусловленное поступлением в организм чрезмерного количества гормонов щитовидной железы и характеризующееся повышением основного обмена, нарушениями функций нервной и сердечно-сосудистой систем.
.
Распространенность гипотиреоза на фоне приема амиодарона колеблется от 6% (в странах с низким потреблением йода) до 13% (в странах без йододефицита).
Чаще всего амиодарон-индуцированный гипотиреоз Гипотиреоз — синдром недостаточности щитовидной железы, характеризующийся нервно-психическими расстройствами, отеками лица, конечностей и туловища, брадикардией
отмечают у женщин пожилого возраста. Риск развития гипотиреоза у женщин с повышенным содержанием антител к тиреоидной пероксидазе (АТ-ТПО) и/или к антител к тиреоглобулину (АТ-ТГ) возрастает в 13 раз по сравнению с мужчинами.
Факторы и группы риска
В группе риска — женщины пожилого возраста с пароксизмальными нарушениями ритма, принимающие амиодарон.
Клиническая картина
Cимптомы, течение
Классические признаки амиодарон-индуцированного гипотиреоза:
— утомляемость, сонливость, ухудшение внимания;
— сухость кожи;
— зябкость;
— запоры;
— отечный синдром;
— брадиаритмия Брадиаритмии — группа аритмий, выражающаяся в замедлении сокращений желудочков сердца; пульс падает менее 60 ударов в минуту
.
Субклинический вариант гипотиреоза может протекать бессимптомно, но возможны признаки легкой тиреоидной недостаточности (изменения в эмоциональной сфере, ухудшение памяти, депрессия) в сочетании с нарушениями липидного обмена (повышение ЛПНП, коэффициентов общий холестерин/ЛПВП, ЛПНП/ЛПВП и снижение ЛПВП).
Депрессия при амиодарон-индуцированном гипотиреозе характеризуется чувством паники и сниженным эффектом от лечения антидепрессантами. Считается, что субклинический гипотиреоз не является причиной развития депрессии, но он может снижать порог развития депрессивных состояний и затруднять коррекцию этих нарушений.
Со стороны сердечно-сосудистой системы у лиц с субклиническим гипотиреозом и ИБС Ишемическая болезнь сердца (ИБС) — патологическое состояние, характеризующееся абсолютным или относительным нарушением кровоснабжения миокарда вследствие поражения коронарных артерий
может отмечаться обострение коронарной недостаточности, а также тенденция к повышению показателей диастолического артериального давления по сравнению с пациентами в эутиреозе.
Другие признаки, встречающиеся у пациентов с субклиническим гипотиреозом:
— развитие гипохромной анемии;
— миалгии Миалгия — боль в мышцах
;
— снижение ахиллова рефлекса Рефлекс ахиллов — физиологический рефлекс: подошвенное сгибание стопы при ударе молоточком по пяточному (ахиллову) сухожилию
.
Жалобы больных, как правило, связываются с гипотиреозом только после обнаружения гормональных изменений, но у 25-50% пациентов их можно выявить при целенаправленном расспросе.
Диагностика
У пациентов, получающих амиодарон, оценку функции щитовидной железы необходимо проводить каждые 6 месяцев. В процессе этого чаще всего обнаруживаются те или иные изменения.
Амиодарон-индуцированные тиреопатии могут развиться и через год после отмены препарата, что требует внимательного изучения анамнеза. Особое внимание в этом плане следует обращать на пожилых пациентов с аритмиями сердца.
Диагностика гипотиреоза основана на определении сниженного уровня свободного Т4 и повышенного уровня ТТГ либо изолированного повышения ТТГ при субклиническом гипотиреозе. Уровень Т3 не является надежным индикатором, так как у эутиреоидных пациентов, принимающих амиодарон, он может быть низким, а при гипотиреозе — в пределах нормы.
Инструментальные исследования
УЗИ и сцинтиграфия Сцинтиграфия — радиоизотопный метод визуализации распределения радиофармацевтического препарата в организме, органе или ткани.
щитовидной железы имеют характерную картину в основном при амиодарон-индуцированном тиреотоксикозе.
Лабораторная диагностика
1. Повышение уровня ТТГ — как правило, более 20 МЕ/л.
2. Снижение св. Т4.
Дифференциальный диагноз
Амиодарон-индуцированный гипотиреоз дифференцируют с аутоиммунным тиреоидитом и синдромом гипотиреоза при эндемическом зобе.
В анамнезе прямая связь с приемом амиодарона, связанным с лечением нарушений ритма сердца.
Лечение
Амиодарон-ассоциированный гипотиреоз может быть устранен двумя путями:
1. Отмена амиодарона. После отмены препарата эутиреоз обычно восстанавливается, но на это могут потребоваться месяцы в связи с длительным периодом выведения лекарства.
2. Подбор заместительной терапии тиреоидными гормонами при продолжающемся приеме препарата.
На практике в подавляющем большинстве случаев отмена амиодарона невозможна, так как препарат применяется по жизненным показаниям, особенно для лечения тяжелых желудочковых тахиаритмий. В таких случаях лечение амиодароном обычно продолжают и пациентам назначается L-тироксин для снижения уровня ТТГ до верхней границы нормы.
Рекомендуется начинать заместительную терапию тиреоидными гормонами с минимальных доз 12,5-25 мкг в сутки с постепенным повышением ее с интервалом 4-6 недель до эффективной под контролем ТТГ, ЭКГ или мониторирования ЭКГ по Holter, не допуская при этом декомпенсации кардиальной патологии или развития аритмии.
При субклиническом течении гипотиреоза вопрос о заместительной терапии решается индивидуально — в зависимости от возраста, наличия или отсутствия ИБС .
Назначение L-тироксина может быть показано при сопутствующем нарушении липидного профиля, депрессии; для коррекции выявленных нарушений, подбирается минимально эффективная доза.
Уровень ТТГ является главным параметром при мониторинге заместительной терапии. Пациент должен оставаться под наблюдением с целью оценки динамики состояния на фоне лечения первые 6 недель, а затем каждые 3 месяца. При отсутствии изменений в лабораторных показателях липидного спектра и клинической симптоматики, препарат отменяют.
Показанием к назначению терапии L-тироксином пациентам с сопутствующей кардиальной патологией и субклиническим гипотиреозом является уровень ТТГ выше 10 мЕд/л — для профилактики развития клинического гипотиреоза и дислипидемии .
Показанием к назначению терапии L-тироксином пациентам с сопутствующей кардиальной патологией и субклиническим гипотиреозом при уровне ТТГ менее 10 мЕд/л является наличие дислипидемии .
Алгоритм лечения амиодарон-ассоциированного гипотиреоза
Источник https://pharmateca.ru/ru/archive/article/38883
Источник https://probolezny.ru/gipotireoz/
Источник https://diseases.medelement.com/disease/%D0%B3%D0%B8%D0%BF%D0%BE%D1%82%D0%B8%D1%80%D0%B5%D0%BE%D0%B7-%D0%B2%D1%8B%D0%B7%D0%B2%D0%B0%D0%BD%D0%BD%D1%8B%D0%B9-%D0%BC%D0%B5%D0%B4%D0%B8%D0%BA%D0%B0%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D0%BC%D0%B8-%D0%B8-%D0%B4%D1%80%D1%83%D0%B3%D0%B8%D0%BC%D0%B8-%D1%8D%D0%BA%D0%B7%D0%BE%D0%B3%D0%B5%D0%BD%D0%BD%D1%8B%D0%BC%D0%B8-%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%B0%D0%BC%D0%B8-e03-2/2018