Лучший антибиотик при лечении фурункулов
О.В. Жукова (1), Л.С. Круглова (1), А.Н. Львов (1), А.Г. Стенько (2)
(1) Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения г. Москвы (2) ЗАО «Клиника активного долголетия – Институт красоты на Арбате», Москва
Лечение больных пиодермией на практике представляет собой достаточно сложную задачу в связи с учащением случаев резистентности бактерий. Показаниями к назначению системной антибиотикотерапии являются хроническое течение, распространенность процесса, наличие общих явлений, регионарные осложнения (лимфаденит, лимфангит), локализация глубоких пиодермий на лице и шее. Рокситромицин обладает широким спектром антимикробного действия, высокой бактериостатической активностью по отношению к чувствительным к нему инфекциям, высокой биодоступностью с избирательным действием в очаге воспаления, имеет минимум побочных эффектов и удобный режим приема. Препарат отвечает современным требованиям рациональной антибиотикотерапии и может быть рекомендован к эффективному применению в клинической практике для лечения различных клинических форм пиодермий.
Ключевые слова: стафилококк, пиодермия, Эспарокси, рокситромицин, стрептококк
Этиология и патогенез пиодермий
Пиодермии (pyon – гной+derma – кожа) – гнойничковые болезни кожи – группа острых и хронических, поверхностных и глубоких воспалительных процессов в коже, вызываемых как патогенными (стрепто-, стафилококками), так и условно-патогенными кокками, реже – полимикробной ассоциацией: протеем, энтерококками, синегнойной или кишечной палочками, бактероидами. По международной классификации пиодермии включены в гетерогенную группу инфекций кожи и мягких тканей – ИКМТ (SSTIs – skin and soft-tissue infections). Пациенты с ИКМТ могут наблюдаться у дерматовенерологов, хирургов, терапевтов, педиатров, гинекологов и врачей других специальностей. ИКМТ занимают лидирующие позиции не только в структуре заболеваний дерматологического профиля от 17 до 43%, но, по данным обращаемости на общий амбулаторный прием, – до 38%, среди первичных обращений к хирургу – до 70% [1–3].
Пиодермии могут встречаться в любом возрасте, однако наиболее подвержены данному заболеванию дети, пожилые люди, а также лица с иммунодефицитными состояниями различной этиологии. ИКМТ отличаются разнообразием клинических проявлений, склонностью к рецидивированию, хронизации и торпидному течению. Инфекционный процесс при пиодермиях в ряде случаев не ограничивается лишь местным эффектом – развитием локального воспаления, а может приводить к серьезным последствиям, например к синдрому стафилококкового и стрептококкового токсического шока или к возникновению заболеваний, протекающих без воспалительных явлений (точечный кератолизис) [4].
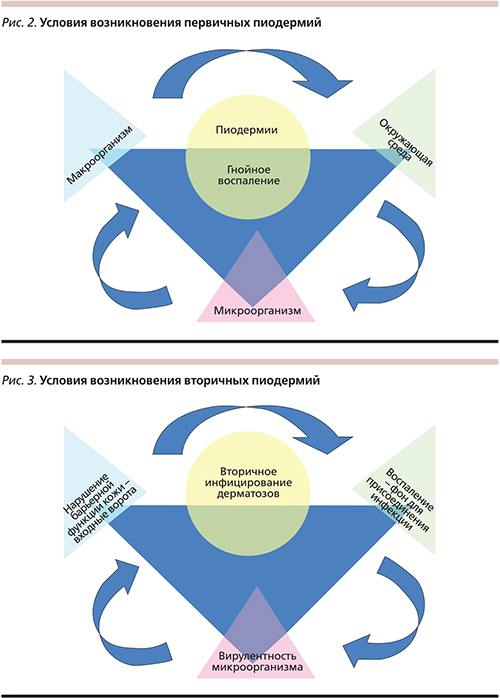
Клинических классификаций пиодермий на сегодняшний день несколько. В российской дерматологии общепризнанна классификация, предложенная Jadasson (1949) в модификации А.А. Каламкаряна (1954) и С.Т. Павлова (1957), согласно которой пиодермии в зависимости от возбудителя традиционно разделяют по этиологическому принципу – стафилодермии и стрептодермии, а также смешанные – стрептостафилодермии. По клиническому течению заболевания выделяют острые и хронические формы; по глубине поражения – поверхностные и глубокие. По механизму возникновения принято различать первичные пиодермии (с этиологическим фактором – гноеродным возбудителем) и вторичные, возникшие на фоне уже существующего воспаления (атопический дерматит, экзема, чесотка) – вторичное инфицирование (рис. 1).
В любом случае для развития пиодермии необходимо сочетание трех факторов: вид патогена и его вирулентность, состояние макроорганизма, а также разнообразные эндогенные и экзогенные предрасполагающие факторы, снижающие барьерную и защитную функции кожи. При этом при первичных пиодермиях воспаление служит следствием (рис. 2), а при вторичном инфицировании – условием (фоном) для ее возникновения (рис. 3).

В патогенезе развития первичных пиодермий ведущая роль отводится вирулентности микроорганизма. Возбудителями ИКМТ наиболее часто становятся стафилококки (Staphylococcus аureus, Staphylococcus epidermidis) и β-гемолитические стрептококки (Streptococcus pyogenes), реже – грамотрицательные микроорганизмы и зооантропофильные трихофитоны. Высокая вирулентность стафилококков и стрептококков связана с выработкой широкого спектра иммуномодулирующих белков, включая токсины (эксфолиатины, энтеротоксины), экзоэнзимы (коагулаза, лейкоцидин, стрептокиназа, гиалуронидаза стрептолизина, гемолизин и др.), которые облегчают проникновение патогенов в кожу, приводят к повреждению и нарушению метаболизма в тканях эпидермиса и дермы. Необходимо также отметить роль трансформации сапрофитных форм возбудителя (резидентная микрофлора кожи) в патогенные.
В группе патогенных стафилококков особую эпидемиологическую значимость за последние десятилетия приобрел золотистый стафилококк (S. аureus), который помимо пиодермий может вызывать эндоваскулярную инфекцию, пневмонии, септический артрит, эндокардит, остеомиелит, а в педиатрической практике – поверхностные пиодермии и ургентные состояния [5]. Известно, что S. аureus обладает способностью быстро приобретать устойчивость к противомикробным препаратам, что представляет серьезную угрозу общественному здравоохранению во всем мире. Еще в середине 1990-х гг. в США был зарегистрирован всплеск т.н. MRSA-инфекций (Methicillin-resistant Staphylococcus aureus), вызванных резистентными к пенициллину, метициллину и другим β-лактамным антибиотикам штаммами S. аureus. Тогда же были выделены две группы резистентных стафилоккоков, имеющих различное эпидемиологическое значение: внутрибольничные штаммы метициллин-резистентного стафилококка (HA-MRSA – healthcare-associated Methicillin-resistant S. aureus) и внебольничные (СА-MRSA – сommunity-acquired Methicillin-resistant S. aureus), как раз последние и наиболее широко распространены в популяциях (до 90% всех стафилококков), могут вызывать первичные пиодермии у лиц разного возраста даже без фоновых факторов риска. Такая высокая вирулентность СА-MRSA обусловлена выработкой специфического цитотоксина – лейкоцидина Пантона–Валентина (PVL – Panton–Valentine leucocidina) и компонента генной регуляторной системы ACME (аргинин – катаболический подвижный элемент) [6].
Еще одним общепризнанным фактором развития резистентности бактерий, в т.ч. S. аureus, служит эмпирическое, бесконтрольное применение антибиотиков, т.к. в этом случае происходит отбор устойчивых бактерий синантропной микробиоты [5, 6]. Назначение системных антибиотиков приводит к качественному и количественному изменению нормальной микробиоты кожи, способствующему колонизации патогенных возбудителей, обмену внехромосомными генетическими элементами (плазмидами R) и контаминации уже устойчивыми штаммами.
Вторым условием развития ИКМТ является реактивность макроорганизма, состоятельность его адаптивных и регуляторных систем, нарушения в которых могут быть обусловлены перенесенными в преморбидный период соматическими заболеваниями или нарушенными в результате хронического соматического заболевания.
В первую очередь это касается иммунной и эндокринной систем, нарушения в которых, как правило, носят вторичный (приобретенный) характер и формируются на фоне сопутствующих заболеваний (метаболический синдром, сахарный диабет, недостаточная активность гипофизарно-надпочечниковой системы, щитовидной, половых желез), что прежде всего способствует снижению механизмов адаптивного иммунитета. Немаловажное значение в развитии ИКМТ имеют очаги хронических инфекций в различных органах: пародонтоз, кариес, гингивит, тонзиллит, фарингит, инфекции урогенитального тракта, дисбактериоз, кишечные интоксикации, снижающие антибактериальную резистентность организма и способствующие развитию специфической сенсибилизации. Особое эпидемиологическое значение имеет периодическое носительство Staphylococcus epidermidis, Staphylococcus pyogenes vax. аureus, отмеченное среди 60% здорового населения на коже и слизистых оболочках. При этом доказано, что штаммы S. аureus, обитающие на слизистой оболочке носоглотки, более патогенны, чем находящиеся на коже, т.к. у постоянных носителей здесь происходит накопление наиболее вирулентных и резистентных к антибиотикам штаммов с дальнейшей диссеминацией на кожные покровы [7]. Существенную роль в хронизации процесса играют нарушения в центральной и вегетативной нервных системах, стрессы, эмоциональное или физическое перенапряжение, которые приводят к истощению резервных возможностей организма и снижают защитные свойства. В то же время при хронической пиодермии безусловна роль различных врожденных или приобретенных иммунодефицитных состояний (ВИЧ-инфекция, прием глюкокортикостероидов, цитостатиков и иммунодепресантов), затрагивающих различные звенья антибактериальной защиты организма.
Третьим фактором в развитии первичных ИКМТ служит неблагоприятное воздействие окружающей среды, реализующееся через нарушение целостности жиро-рогового слоя и ощелачивания поверхности кожи, что способствует размножению микробов и создает «входные ворота» для проникновения инфекции. К основным неблагоприятным внешним факторам относятся перегревание с повышением потоотделения или длительное охлаждение, способствующее нарушению микроциркуляции и снижению пото- и салоотделению, повышенная влажность, приводящая к мацерации кожи, повышенное загрязнение, в т.ч. профессиональными факторами (маслами, цементом, угольной пылью), вызывающее микротравматизацию кожи.
Диагностика и клиническая картина пиодермий
Диагностика пиодермии базируется на клинических проявлениях ИКМТ, эпидемиологическом анамнезе и объективных методах, в большей степени необходимых при назначении лечения (микроскопия и культуральное исследование – посев на питательные среды). Диагноз первичной пиодермии, как правило, не вызывает затруднений, в большинстве случаев проведения дифференциальной диагностики требуют вторично инфицированные дерматозы, а также глубокие пиодермии, которые приходится дифференцировать с васкулитами, группой акнеформных дерматозов, буллезными дерматозами и другими заболеваниями. Клинические проявления стафилодермий, как правило, связаны с первичной локализацией патологического процесса в сально-волосяном фолликуле и характеризуются появлением поверхностных форм: остиофолликулитом, фолликулитом или стафилококковым (вульгарным) сикозом, или глубокими формами (фурункул, карбункул). Гидраденит, который долгое время относили к глубоким стафилодермиям, теперь рассматривают как проявление акне с характерным поражением апокриновых желез. Для стафилодермий характерно образование пустулы, в центре которой формируется полость, заполненная гнойным экссудатом, по периферии располагается зона эритематозно-отечной воспалительной кожи. При глубоком нагноительном процессе формируется рубец. Поверхностные стрептодермии клинически проявляются импетиго (заеды, околоногтевая фликтена), стрептодермией крупных складок, сухой стрептодермией (простой лишай лица).
К глубоким относится вульгарная эктима. Стрептококковые пиодермии чаще развиваются на гладкой коже, вокруг естественных отверстий (полости рта, носа) и начинаются с образования фликтены – поверхностно расположенного пузыря с дряблой складчатой покрышкой, внутри которого содержится серозно-гнойное содержимое. Тонкие стенки фликтены быстро вскрываются, и содержимое изливается на поверхность кожи, ссыхаясь в медово-желтые слоистые корочки. Процесс склонен к распространению по периферии в результате аутоинукуляции. Клиническими проявлениями смешанных пиодермий являются контагиозное (вульгарное) импетиго и хроническая язвенная пиодермия.
За рубежом ИКМТ подразделяют по клиническому течению и патогенезу развития нагноительного процесса.
Так, выделяют следующие три группы:
- первичные пиодермии, которые вызываются S. aureus и β-гемолитическими стрептококками (преимущественно группы А) и развиваются на неизмененной коже (фолликулит, импетиго, рожистое воспаление);
- вторичные пиодермии, развивающиеся на фоне сопутствующей соматической патологии (например, пролежни, диабетическая язва стопы, инфекции после укусов животных, послеоперационные раневые и посттравматические инфекции), а также на фоне дерматозов, сопровождающихся зудом (аллергический дерматит, экзема, чесотка и т.д.);
- глубокие некротические инфекции, представляющие наиболее тяжелую форму ИКМТ (целлюлит полимикробной этиологии – синергидный целлюлит, некротизирующий фасциит, мионекроз – газовая гангрена).
Терапевтические мероприятия при пиодермиях
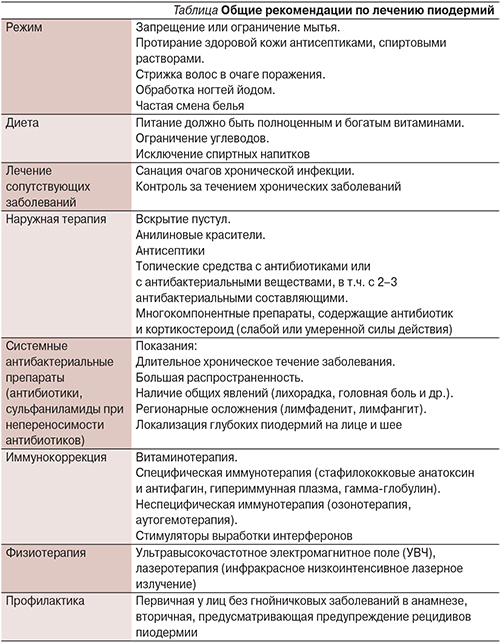
От своевременной диагностики и проведения адекватного этиопатогенетического лечения пиодермий во многом зависит эффективность проводимой терапии и прогноз заболевания. К основным принципам терапии относятся использование комплексных методов этиопатогенетической терапии, направленных на элиминацию возбудителя, а также иммунных препаратов, способствующих нормализации функциональной активности иммунной системы больного, индивидуальный подход к выбору препаратов системного и топического действий в зависимости от тяжести клинических проявлений, длительности и особенности течения пиодермии, биологии возбудителя, сопутствующих заболеваний и характера иммунных расстройств. Избирательный подход к терапии больных обеспечивается полноценным учетом анамнеза, клинических и лабораторных данных. Основные клинические рекомендации по лечению пиодермий представлены в таблице.
Основным и единственным методом этиотропного лечения больных ИКМТ остаются антибиотики. При острых поверхностных нераспространенных процессах (импетиго, фолликулиты, паронихии) терапия может быть ограничена местным применением антибиотиков и антисептиков.
Показаниям к назначению системной антибиотикотерапии:
- глубокие формы пиодермий фурункулы (особенно с локализацией на лице и шее), карбункул, гидраденит, рожистое воспаление, целлюлит;
- наличие симптомов общей интоксикации в виде лихорадки, головной боли, слабости, а также развития регионарных осложнений (лимфаденит, лимфангит);
- распространенный процесс;
- длительное хроническое рецидивирующее течение.
Перед назначением антибактериального препарата желательно производить посев гноя с определением чувствительности выделенного микроорганизма к различным антибиотикам и по результатам исследования назначать соответствующий препарат. Однако на практике это не всегда выполнимо. Как показывает анализ современной литературы и собственный клинический опыт, сегодня наиболее часто в лечении бактериальных инфекций кожи используются следующие группы антибиотиков: макролиды; цефалоспорины (1–4-го поколений); тетрациклины; фторхинолоны. Пенициллин и его дюрантные препараты в современной практике применяются достаточно редко, т.к. подавляющее число штаммов пиококков приобрело способность продуцировать фермент β-лактамазу (пенициллиназу), подавляющую антибактериальную активность пенициллина. Тетрациклины, аминогликозиды также используются значительно реже, что связано и с резистентностью микроорганизмов и с наличием противопоказаний. Фторхинолоны при пиодермиях используются только при неэффективности других групп антибиотиков.
На сегодняшний день именно группа макролидов отвечает всем современным требованиям к выбору антибиотика: широкий спектр антимикробного действия и минимально выраженная антибиотикорезистентность к микробным агентам, высокий профиль безо-пасности, отсутствие клинически значимого взаимодействия с другими лекарственными препаратами, минимальный риск развития аллергических реакций, удобство применения для пациента (наличие пероральной формы, удобного режима дозирования) и доступная цена.
Макролиды используются в клинической практике уже более 50 лет, первым природным антибиотиком из этой группы был эритромицин. На сегодняшний день существует три поколения макролидов, которые отличаются по происхождению (природные и полусинтетические) и химической структуре в зависимости от числа атомов углерода в макроциклическом лактонном кольце:
- первое: эритромицин, олеандомицин;
- второе: спирамицин, рокситромицин, джозамицин, кларитромицин и др.;
- третье: азитромицин.
В современной клинической практике преимущественно используются макролиды 2-го и 3-го поколений. Антибактериальный эффект макролидов основан на нарушении синтеза рибосомальных белков микробной клетки, что приводит к ингибированию процесса репликации возбудителя. Макролиды в низких концентрациях оказывают бактериостатическое, в высоких – бактерицидное действия, обусловливающих целесообразность их назначения в острой фазе воспаления [8]. Данная группа относится к «тканевым антибиотикам», т.е. при распределении в организме они накапливаются преимущественно не в кровяном русле, а в тех органах и тканях, где имеется воспаление, тем самым создавая высокие концентрации препарата. Хорошо распределяясь в организме, макролиды способны проникать через гистогематологические барьеры, за исключением гематоэнцефалического, значительно превосходя в этом β-лактамные антибиотики [9].
Одним из современных эффективных антибиотиков является рокситромицин (Эспарокси, Германия), который относится к макролидам второго поколения. Препарат принимается однократно в сутки в дозе 300 мг или по 150 мг 2 раза в сутки, длительность курса подбирается индивидуально с учетом клинической картины. Назначение с интервалом 12 часов обеспечивает поддержание эффективных концентраций в крови в течение 24 часов. При длительном применении 150 мг 2 раза в сутки или 300 мг 1 раз в сутки равновесная концентрация в крови достигается между 2-м и 4-м днями. Липофильность молекулы рокситромицина обеспечивает помимо высокого уровня всасывания в кишечнике еще и отличное проникновение препарата в ткани [8, 9]. Быстрое проникновение его из крови в ткани обеспечивается также низким уровнем связывания с белками крови, что дает возможность достигать быстрого терапевтического эффекта при инфекциях, поражающих клетки и ткани [10]. Высокая концентрация препарата в области поражения позволяет активно воздействовать на патогенный очаг, тем самым обеспечивая быстрый клинический эффект и скорейшее выздоровление [10, 11]. Современные макролиды (в частности, рокситромицин) проявляют эффективность в отношении многих микроорганизмов, что обусловливает их высокую востребованность в дерматовенерологической практике [12].
Немаловажное значение в реализации антибактериальной активности рокситромицина (как и других макролидов 2–3-го поколений) имеет его взаимодействие с нейтрофилами. Благодаря своей способности проникать внутрь нейтрофилов и создавать в них высокие концентрации он положительно влияет на основные функции данных клеток, стимулируя хемотаксис, активность фагоцитоза и киллинга [8]. Таким образом, помимо противомикробного действия он обладает умеренной противовоспалительной активностью. Активируя клетки макрофагального ряда, рокситромицин способен проникать в них и при миграции фагоцитирующих клеток в очаг воспаления поступать туда вместе с ними [10, 12].
Рокситромицин оказывает минимальное влияние на нормальную микрофлору человеческого организма и не вызывает дисбиоза. Поэтому он рассматривается не только как высокоэффективный, но и как достаточно безопасный антибиотик. Побочные эффекты при его приеме в целом встречаются редко. Наиболее частыми побочными эффектами служат симптомы со стороны желудочно-кишечного тракта (тошнота, тяжесть в эпигастральной области), как правило, выраженные умеренно, не требующие отмены препарата и быстро проходящие при приеме лекарства после еды [11].

Под нашим наблюдением находились 38 пациентов с различными клиническими формами пиодермий (рис. 4), среди них 24 женщины и 14 мужчин в возрасте от 14 до 52 лет (медиана – 26,4±4,7 года), которым была показана системная антибиотикотерапия.
Острый процесс отмечен у 21 (55,3%) пациента, с хронической пиодермией были 17 (44,7%) больных. Все пациенты получали комплексное лечение, включившее прием рокситромицина в дозе 150 мг 2 раза в сутки или 300 мг 1 раз в сутки на протяжении 7 дней при всех клинических формах, за исключением рожистого воспаления, когда прием препарата был увеличен до 10 дней. В результате комплексной терапии при острой пиодермии клиническое выздоровление было констатировано у 95% пациентов, у 1 (5%) пациента с множественными фурункулами на 3-и сутки эффект отсутствовал, в связи с чем ему была изменена тактика лечения. У пациентов с хроническими формами пиодермии эффективность составила 88,2%, у 2 (11,8%) пациентов с рожистым воспалением в отдаленный период наблюдений (6 месяцев) вновь отмечен рецидив заболевания. Однако данные по лечению пациентов с рожистым воспалением в этом случае позволяют рассматривать их как положительные; так, рецидивы при данной патологии в большей степени обусловлены фоновыми заболеваниями, степень компенсации которых не всегда может быть под контролем, а возникновение рецидивов в отдаленный период как раз и свидетельствует о необходимости проведения адекватного лечения у смежных специалистов.
Побочные эффекты в виде тошноты и субъективных ощущений отмечены среди 7,9% пациентов, однако данные явлениея носили проходящий характер и не требовали отмены препарата. Аллергических реакций не было отмечено ни в одном из клинических случаев.
Таким образом, рокситромицин обладает широким спектром антимикробного действия, высокой бактериостатической активностью по отношению к чувствительным к нему инфекциям, высокую биодоступность с избирательным действием в очаге воспаления, имеет минимум побочных эффектов и удобный режим приема. Следовательно, препарат отвечает современным требованиям рациональной антибиотикотерапии и может быть рекомендован к эффективному применению в клинической практике для лечения различных клинических форм пиодермий.
Литература
- Масюкова С.А., Гладько В.В., Устинов М.В., Владимирова Е.В., Тарасенко Г.Н., Сорокина Е.В. Бактериальные инфекции кожи и их значение в клинической практике дерматолога. Consilium medicum. 2004;6.(3):180–85.
- Белькова Ю.А., Козлов Р.С., Кречикова О.И. Эффективность и безопасность местного использования комбинации бацитрацина и неомицина в сравнении с хлорамфениколом в терапии неосложненных хирургических инфекций кожи и мягких тканей у взрослых амбулаторных пациентов. Клин. микробиол. антимикроб. химиотер. 2013;15(2):131–42.
- Мурашкин Н.Н., Глузмина М.Н., Галустян Л.С. Гнойничковые поражения кожи в практике детского дерматолога: свежий взгляд на старую проблему. РЖКВБ: Научно-практический журнал. 2008;4:67–71.
- Белоусова Т.А., Горячкина М.В. Бактериальные инфекции кожи: проблема выбора оптимального антибиотика. РМЖ. 2005;13(16):1086–89.
- Касихина Е.И. Применение комбинации антибиотиков широкого спектра действия для наружного лечения пиодермий. Consilium medicum. Дерматология. 2015;2:5–10.
- Diep B.A., Stone G.G., Basuino L. The arginine catabolic mobile element and staphylococcal chromosomal cassette mec linkage: convergence of virulence and resistance in the USA300 clone of methicillin-resistant Staphylococcus aureus. J. Infect. Dis. 2008;197:1523–30.
- Grossman E.M., Nanda S., Gordon J.R. Clearance of nasal Staphylococcus aureus colonization with triple antibiotic ointment. J. Drugs. Dermatol. 2012;11(12):1490–92.
- Талашова С.В. Некоторые аспекты применения антибактериальных препаратов в педиатрии на примере макролидов. РМЖ. 2009;17(7):464–66.
- Пронкин Е.А. Применение препарата рокситромицин (Эспарокси) в лечении негонококкового уретрита у мужчин. Фарматека. 2014;12:18–22.
- Bryskier A. Roxitromycin: review of its antimicrobial activity. J. Antimicrob. Chemother. 1998;41(Suppl. B):1–21.
- Ridgway G.L. A review of the in vitro activity of roxithromycin againstgenital pathogens. J. Antimicrob. Chemother. 1987;20(Suppl. B):7–11.
- Василькин Д.А., Поцелуева Л.А., Файзул-лина Е.В., Зинатуллина Г.М. Перспективы применения в дерматологии различных полиморфных форм антибиотиков рокситромицина и линкомицина. Здоровье – основа человеческого потенциала – проблемы и пути их решения. 2010;5(1):48–52.
Об авторах / Для корреспонденции
Л.С. Круглова – д.м.н., проф., главный научный сотрудник Московского научно-практического Центра дерматовенерологии и косметологии Департамента здравоохранения г. Москвы; тел. 8 (495) 952-49-84
О.В. Жукова – к.м.н., доцент, главный врач Московского научно-практического Центра дерматовенерологии и косметологии Департамента здравоохранения г. Москвы; тел. 8 (495) 952-49-84
А.Н. Львов – д.м.н., проф., рук.научного отдела Московского научно-практического Центра дерматовенерологии и косметологии Департамента здравоохранения г. Москвы; тел. 8 (495) 952-49-84
А.Г. Стенько – д.м.н., зав. отделением дерматокосметологии, ЗАО «Клиника активного долголетия – Институт красоты на Арбате», Москва
Похожие статьи
- Роль макролидов в лечении патологии ЛОР-органов
- Современные подходы к лечению микоплазменных инфекций дыхательных путей
- Применение препарата Эспарокси в лечении инфекций ЛОР-органов
- Применение Эспарокси в профилактике осложнений после хирургических вмешательств в стоматологии
- Принципы фармакотерапии обострений неосложненного хронического бронхита, вызванных бактериальной инфекцией
Стафилококк ауреус: лечение и признаки стафилококковой инфекции
Стафилококковая инфекция — это целый набор инфекционных недугов, которые в свою очередь могут вызывать серьезные и опасные для жизни патологии. Одной из таких болезней выступает фурункулез, который при невнимательном отношении к нему, может дать серьезные осложнения в виде заражения крови. Правильное лечение стафилококковой инфекции очень важно проводить вовремя, также не меньшую роль играют и профилактические меры.
Возбудителем стафилококковой инфекции является та же бактерия, которая вызывает первые симптомы фурункула — это золотистый стафилококк. Его называют так потому, что под микроскопом он имеет золотистую расцветку, благодаря которой легко выделяется на фоне остальных микробов.

Каковы ваши шансы достичь долголетия: пройдите тест от ученых
Признаки стафилококковой инфекции

Золотистый стафилококк может привести к развитию множества различных заболеваний. При прямом проникновении возбудителя в ткани могут развиваться кожные инфекции. Среди них чаще всего встречаются фурункулы и карбункулы, абсцессы и флегмоны. Для этих болезней типично поражение кожи, подкожной клетчатки или волосяного фолликула с образованием гнойных полостных элементов.
Нередко встречается стафилококковая пневмония, сопровождающаяся быстрым разрушением легочной ткани и формированием полостей. Золотистый стафилококк может стать причиной эндокардита, ангины, остеомиелита, синдрома токсического шока и синдрома ошпаренной кожи.
Общие признаки стафилококковой инфекции включают:
- повышение температуры тела;
- тошноту и рвоту;
- головные боли;
- бледность кожных покровов;
- наличие местных изменений (если поражена кожа — гнойничковых высыпаний, если поражено горло — покраснения и налета).
Совсем недавно было выяснено, что золотистый стафилококк играет роль в развитии экземы. Специалист Х. Конг из института национального здоровья в Бетесде (Мэриленд, США) вместе со своими коллегами провела исследование на эту тему. У 11 детей, страдающих от экземы, были взяты образцы кожных бактерий. При этом в исследовании принимали участие пациента с острой формой болезни, а также выздоровевшие дети. Контрольные пробы были взяты у 7 здоровых малышей.
Выяснилось, что у детей с острой экземой преобладали определенные штаммы золотистого стафилококка, в то время как у выздоровевших малышей главенствовала другая флора. С целью узнать, как именно возбудитель влияет на организм человека, его образцы были пересажены на кожу мышей. В результате этого штаммы стафилококка, взятые у детей с острой экземой, вызвали более интенсивное воспаление у грызунов.
Профилактические меры для предотвращения развития стафилококковой инфекции
Профилактика стафилококковой инфекции проводится практически так же, как и дополнительное лечение фурункула. В первую очередь, нужно как можно лучше укреплять свой иммунитет. Также не менее важным является соблюдение элементарных правил личной гигиены. Стафилококк — устойчивая бактерия, при необходимости она может ждать подходящего для заражения момента очень долго, при первой возможности проникать в организм и начинать размножаться.
Кроме того, необходимо соблюдать следующие правила:
- Вести здоровый образ жизни, исключить вредные привычки;
- Поддерживать в норме витаминный баланс;
- Контролировать качество и чистоту употребляемой пищи;
- Придерживаться санитарно-гигиенических норм;
- Если в помещении проживает ребёнок, то нужно обязательно поддерживать максимальную чистоту.
Лечение стафилококковой инфекции

Как правило, стафилококк практически неуязвим к большинству антибиотиков, которые назначают врачи. Для поиска подходящего препарата специалисты проводят множество тестов и анализов и лишь после этого назначают конкретное лечение.
Еще одним способом устранения данной болезни является употребление бактериофаговых лекарств. Но, к сожалению, большинство штаммов стафилококка имеют устойчивость и к этим медикаментам, поэтому врачи в первую очередь проводят исследования на фагочувствительность. Если по результатам анализов бактерия оказывается уязвимой к таковым препаратам, назначается специальный курс лечения ними.
К сожалению, стафилококковой инфекцией можно заболеть не один раз в своей жизни. Организм способен вырабатывать антитела только к одному виду стафилококка, а их насчитывается более 30.
Лечение стафилококка ауреус, устойчивого к метициллину
В последние годы все чаще и чаще выявляется золотистый стафилококк, имеющий устойчивость к группе бета-лактамных антибиотиков (пенициллинам и цефалоспоринам). Именно с его жизнедеятельностью связано большинство внутрибольничных инфекций и послеоперационных осложнений. Согласно данным статистики, этот возбудитель ежегодно вызывает до 10 тысяч летальных исходов. Именно поэтому лечение стафилококка ауреус, который имеет устойчивость к метициллину, является одной из серьезных задач современной медицины.
Довольно перспективные результаты показали новые лекарственные препараты, которые были созданы исследователями из университета Коннектикута под руководством Стефани М. Рив. Особенность работы этих лекарства заключается в нарушении работы одного из бактериальных ферментов, участвующих в метаболизме фолиевой кислоты.
Для исследования было взято 9 штаммов метициллин-резистентного стафилококка, 6 из которых были устойчивы к ко-тримоксазолу. Некоторые из них также показали устойчивость и к препаратам тетрациклинового ряда. Тем не менее, новые лекарственные средства отлично справились с этими возбудителями.
Несмотря на блестящий успех, специалисты вовсе не спешат останавливаться на достигнутом. Теперь их целью является обнаружение новых механизмов устойчивости бактерий к антибиотикам и борьба с ними.
Читайте далее

Где можно сдать анализ на гепатит
Можно ли обследоваться на наличие гепатита бесплатно? Какие анализы и где можно сдавать, какие нужны направления и подготовка.

Какие болезни диагностируют по слюне?
Как проводят диагностику по слюне, какие болезни можно так обнаружить, и почему это лучше анализа крови — в статье MedAboutMe

Какие проблемы с кожей помогут решить средства с гиалуроновой кислотой?
Сухость кожи, чувство стянутости — всё это и другие проблемы, которые решают средства с гиалуроновой кислотой.
Антибиотики нового поколения: польза и вред
Возбудители инфекционных заболеваний проходят непрерывные мутации, позволяющие им выжить в агрессивной окружающей среде. Самая большая опасность для них — это антибиотики. Вырабатывая к ним устойчивость, бактерии продолжают активно размножаться в организме. По этой причине ведутся постоянные поиски новых версий препаратов. Поколения антибиотиков это — усовершенствованные их формы, устраняющие резистентные микроорганизмы. У каждой группы современного антибиотика уже есть несколько поколений.

Проблему устойчивости патогенов, как это ни печально, формируют сами люди. Они сокращают курс терапии, самостоятельно уменьшают дозы, тем самым устраивая бактериям передышку, чтобы окрепнуть и произвести мутацию. Появляются так называемые супербактерии. Врачам приходится увеличивать дозы или назначать другой вид антибиотика, что в разы повышает его токсичность. В некоторых случаях пациенты умирают не от исходного возбудителя, а от побочных эффектов подобного лечения. После мощной атаки на иммунитет, человек уже не может бороться с рядовыми возбудителями (грибками рода Кандида, стафилококками и т.д). К сожалению, в России продолжается патологическая практика приема антибиотиков без назначения. Мало кто помнит о том, что от вирусов они вообще не помогают. Повсеместно антибактериальные препараты пьют «от простуды», ОРЗ или для «профилактики» инфекционных осложнений.
Рассмотрим современные препараты из последних поколений антибиотиков. Решение об их использовании принимает только врач. Торговых названий в нашей статье нет, так как все антибиотики рецептурные, будут указаны только действующие вещества или МНН (международное непантентованное название).
Механизм действия антибиотиков
По механизму действия антибиотики можно разделить на две большие группы: бактерицидные — они убивает бактерии и бактериостатические — замедляют размножение. Также выделяют антибактериальные препараты узкого и широкого спектра действия.
Патогенные бактерии различаются еще по типу клеточной оболочки. В зависимости от этого меняется их чувствительность к антибиотикам. Микроорганизмы делят на грамположительные и грамотрицательные. Патогены бывают:
- аэробные — им нужен кислород;
- анаэробные — им кислород не требуется и даже вреден;
- факультативные, т.е. универсальные.
Аминогликозиды (I поколение — неомицин, II — гентамицин, III — тобрамицин, сизомицин, VI — изепамицин).
Препараты из данной группы широкого спектра и бактерицидного действия. К ним чувствительны грамотрицательные аэробные патогены. Назначают в основном при лечении: пневмонии, вызванной клебсиеллой, синегнойной палочкой, пневмококком; от диареи (от энтеробактерий); внутрибольничной инфекции (синегнойная палочка); эндокардита; блефарита; конъюнктивита; для предупреждения осложнений после операций в офтальмологии; от наружного отита; от вагинита и для профилактики инфекций в гинекологии.
Аминогликозид в виде таблеток не выпускают, это инъекции, глазные капли, суппозитории вагинальные. Работают они эффективно только в комплексе с другими антибиотиками. Ими лечат также туберкулез, сепсис (заражение крови). Монотерапия аминогликозидами возможна только в случае заражения грамотрицательными бактериями (чума, гонорея). Оказывают побочный эффект преимущественно на почки и слух.
Линкозамиды (линкомицин, клиндамицин)
Эти препараты активны в отношении грамположительных анаэробных патогенов. Также помогают при заражении некоторыми паразитами (малярия). Замедляют рост бактерий, но в больших дозах убивают их. Назначают пациентам, не переносящим пенициллины. Целесообразны линкозамиды при заболеваниях, вызванных устойчивыми формами золотистого стафилококка.
Это могут быть инфекции: в стоматологии и в органах брюшной полости. Используют для: профилактики перитонита; лечения акне; малярии; дифтерии; инфекций ЛОР-органов; урогенитального тракта; эндокардита.
Препараты из данной группы токсичны для ЖКТ, вызывают диарею, боль, а также изменение вкуса.
Тетрациклины (тетрациклин, окситетрациклин, миноциклин, доксициклин, тигециклин)
Относятся к широкому спектру с бактериостатическим действием. Активны против аэробных грамположительных и грамотрицательных бактерий.
Назначают от: риккетсиоза, чумы, сибирской язвы, холеры, листериоза, цистита, пиодермии, хламидиоза, микоплазмоза, бруцеллеза, боррелиоза, хеликобактера пилори (гастрит и язва желудка), сифилиса, малярии, острого и хронического бронхита, пневмонии, трахомы.
Из побочных эффектов пациентов беспокоит аллергия, диарея, кандидоз, нарушения функции печени и почек, повышение чувствительности к свету.
Макролиды (азитромицин, кларитромицин, джозамицин, рокситромицин)
Дают бактериостатический эффект против внутриклеточных микроорганизмов и грамположительных кокков.
Подходят для пациентов с аллергией на пенициллин. Назначают для лечения: дифтерии, боррелиоза, половых инфекций, пневмонии, бронхита, инфекций ЛОР-органов, кожи и мягких тканей, мочевыводящих путей и лимфатической системы. Негативно могут влиять на ЖКТ, печень, сердце.
Карбапенемы (меропенем, эртапенем)
Бета-лактамные антибиотики, действующие на анаэробные и аэробные грамположительные и грамотрицательные патогены. Их назначают при резистентности возбудителей к другим антибиотикам. Лечат инфекции брюшной полости, мочевыводящих путей, дыхательной системы, а также: перитонит, аппендицит, рожа, эндометрит, менингит, септицемия.
Побочное действие: диарея, запор, боль в ЖКТ, нарушения со стороны сердца и почек (отеки), нейтропения, флебит.
Монобактамы (Азтреонам)
Бета-лактамные антибиотик, активен в отношении аэробных грамотрицательных бактерий. Лекарства из этой группы прописывают в случае аллергии на пенициллины и цефалоспорины. К монобактамам чувствительны энтеробактерии, клебсиеллы (кишечные расстройства, пневмония, некоторые внутрибольничные инфекции). Назначают от: инфекций костей, кожи и мягких тканей, мочевыводящих путей, системы дыхания и ЖКТ.
Нежелательные эффекты: диарея, аллергия, стоматит, кандидамикоз.

Пенициллины (амоксициллин, оксациллин)
Бета-лактамные антибиотики природного и синтетического происхождения. Действуют на грамположительные и грамотрицательные микроорганизмы бактерицидным образом. Лечат их помощью: шигеллез, сальмонеллез, менингит, сепсис, брюшной тиф, эндокардит, заражение клостридиями, кишечной палочкой. Инфекции ЛОР-органов, дыхательной системы, ЖКТ, в гинекологии, инфекции кожи и мягких тканей.
Побочные эффекты: диарея, диспепсия, головная боль, аллергия, тахикардия.
Цефалоспорины
Бета-лактамы широкого спектра активности. Существует пять поколений цефалоспоринов:
- Цефазолин
- Цефокситин
- Цефтриаксон, цефотаксим
- Цефепим
- Цефтобипрола медокарил, Цефтаролина фосамил
В зависимости от заболевания назначают препараты из разных поколений: эндокардит, предупреждение заражения при операциях, инфекции кожи, сепсис. Цефалоспорины уничтожают: бактероиды, гемофильную палочку, клебсиеллы, стрептококки, эшерихия коли, синегнойную палочку, энтеробактерии. Лекарства из 4 и 5 поколений назначают при резистентных формах заражения. Используют для лечения: бронхита, пневмонии, инфекций кожи, желчных протоков, ЖКТ, урогенитального тракта, при менингите и заражении крови.
В целом вышеописанные бета-лактамы вызывают часто аллергию и особенно анафилаксию. Могут негативно влиять на печень, ЖКТ, почки, свертываемость крови.
Гликопептиды (далбаванцин, телаванцин, ванкомицин)
Действуют на аэробные и анаэробные грамположительные бактерии, их применяют для борьбы с устойчивым золотистым стафилококком (MRSA), а также с энтерококком. Используются для лечения: инфекций ЖКТ, легких, кожи (абсцесс кожи, фурункул, карбункул), импетиго, флегмона, раневая инфекция.
Нежелательные эффекты: нарушения функции почек, сердца, ЖКТ, свертываемости крови, также вызывают аллергические реакции.
Фторхинолоны (ципрофлоксацин, левофлоксацин и моксифлоксацин)
Препараты действуют бактерицидно, относится к широкому спектру действия. Активны против: стафилококков, микобактерий, энтеробактерий. И их помощью лечат туберкулез, микоплазмоз, хламидиоз, инфекции мочевыводящих путей, простатит, пневмонию, сибирскую язву, фурункулез, пиодермию, флегмону. С осторожностью назначают людям с заболеваниями почек, сердца и с аллергией.
Побочные эффекты: грибковые поражения, лейкопения, анафилактический шок, головная боль, бессонница, колебания уровня сахара в крови.
Вывод
Протоколы терапии инфекционных заболеваний позволяют врачу по симптомам предварительно определиться с типом возбудителя. Хотя, если позволяет время, перед назначением антибиотика проводится анализ. Выявленные штаммы возбудителей могут быть чувствительны к антибиотикам ранних поколений и нет смысла и даже вредно сразу переходить на новые. Самое лучшее лечение инфекции — это адресное воздействие на выявленную бактерию. Не существует антибиотика широкого спектра действия нового поколения, подходящего всем. Врач должен придерживаться пяти принципов «верно» в терапии инфекции: выбирать верного пациента, лекарство, дозу, способ введения и время терапии. Только так можно избежать появления новых устойчивых штаммов среди населения.
В странах, где слабый уровень медицины и контроля за оборотом антибиотиков, наблюдается низкий иммунитет у граждан и большое количество неизлечимых инфекций. Даже лучшие антибиотики нового поколения не помогают от некоторых форм туберкулеза, сепсиса, гонореи, воспаления легких, кишечника, инфекций новорожденных. Супербактерии, естественно, поражают не одного человека, а провоцируют локальные вспышки заболеваний. Учитывая, массовые путешествия граждан по миру, риск эпидемий может возрастать.
Начиная с 2015 года, ВОЗ проводит всемирную неделю правильного использования антибактериальных препаратов. Если не принять меры против распространения устойчивости бактерий, люди могут оказаться безоружным перед рядовыми инфекциями, как это было до изобретения антибиотиков. Проблема устойчивости к противомикробным препаратам (УПП) входит в десятку глобальных угроз человечеству. Инфекционный контроль, предупреждение заболеваний, надлежащие санитарные условия и гигиена, обеспечение населения качественной водой и продуктами питания — это главные меры против УПП со стороны государства. Доступный медицинский сервис и жесткой контроль за использованием антибиотиков, повышение профессионального уровня врачей, просвещение населения также помогут решить проблему. Кроме того, по информации ВОЗ в настоящее время в мире разрабатывается крайне мало инновационных антибиотиков. Поэтому в этой области необходимы дополнительные проекты и финансирование.
Источники
- Козлов Р.С., Голуб А.В. // Стратегия использования антимикробных препаратов как попытка ренессанса антибиотиков. //Клиническая антимикробная химиотерапия — 2011;
- Яковлев C.B., Довгань E.B. // Аспекты эффективности антибиотиков. // Справочник поликлинического врача— 2014.
Информация представлена в ознакомительных целях и не является медицинской консультацией или руководством к лечению со стороны uteka.ru.
Источник https://pharmateca.ru/ru/archive/article/31942
Источник https://medaboutme.ru/articles/lechenie_i_profilaktika_stafilokokkovoy_infektsii/
Источник https://uteka.ru/articles/lekarstvennye-preparaty/antibiotiki-novogo-pokoleniya/