Заболевания крови
Болезни крови можно разделить на злокачественные и незлокачественные.
Основные группы незлокачественных заболеваний: анемии различной природы, болезни лейкоцитов и тромбоцитов, геморрагические заболевания, васкулиты, реактивные лимфаденопатии, лейкемоидные реакции. Злокачественные заболевания крови или гемобластозы, включают острые лейкозы, хронический миелолейкоз, гистиоцитозы и лимфомы.

Анемия и её формы
Это патологическое состояние, которое характеризуется пониженным уровнем эритроцитов и/или гемоглобина в крови, из-за чего ухудшается передача кислорода в ткани и возникает гипоксия (кислородное голодание тканей). При легких формах анемии симптомами могут являться: общая слабость, утомляемость, снижение концентрации внимания. Пациенты с более выраженной анемией могут отмечать снижение аппетита, сердцебиение, шум в ушах, одышку. Диагностируются бледность кожных покровов, видимых слизистых и ногтевых лож. При тяжелой форме анемии возможно развитие сердечной недостаточности.
- Железодефицитная анемия — это уменьшение количества и размеров эритроцитов, которое наблюдается в результате недостатка железа для образования гемоглобина.
Гемоглобин — это белок, который содержится в эритроцитах и переносит кислород в ткани. Если изменение эритроцитов становится значительным, у человека возникают жалобы. Главные причины анемии у взрослых: кровотечения, нарушение всасывания железа в ЖКТ и недостаток железосодержащей пищи. Кровопотери могут происходить из-за обильной менструации или из-за язв в желудке или кишечнике. Беременные и женщины после родов могут страдать железодефицитной анемией из-за повышенного потребления железа плодом и кровопотерь в родах. Уменьшение всасывания железа в желудочно-кишечном тракте может возникать при хроническом гастрите, после операций на желудке или кишечнике, целиакии (непереносимость глютена).
- Фолиеводефицитная анемия — патология крови, обусловленная недостатком фолиевой кислоты.
Диагностика основана на клинической картине заболевания, изменениях в общем анализе крови, который выявляет сниженное количество эритроцитов и гемоглобина, определяют цветной показатель (эта анемия относится к нормохромным) и содержание белка в сыворотке крови (понижен). B12-дефицитная анемия (пернициозная) — заболевание, обусловленное нарушением кроветворения из-за недостатка в организме витамина B12. Костный мозг и ткани нервной системы особенно чувствительны к дефициту этого витамина.
- Гемолитические анемии – это группа заболеваний, характеризующихся патологически интенсивным разрушением эритроцитов, повышенным образованием продуктов их распада, а также реактивным усилением эритропоэза.
Все гемолитические анемии принято делить на две основные группы: наследственные и приобретенные.
- Апластическая анемия
Характеризуется угнетением кроветворной функции костного мозга и проявляется недостаточным образованием эритроцитов, лейкоцитов и тромбоцитов (пангемоцитопенией) или только одних эритроцитов (парциальная гипопластическая анемия)
Лимфаденопатия
Увеличение лимфатических узлов. По природе увеличения: опухолевые и неопухолевые формы. По распространенности: локальная (увеличение строго одной группы лимфатических узлов или нескольких групп, расположенных в одной или двух смежных анатомических областях) и генерализованная (увеличение лимфатических узлов в двух или более несмежных зонах). По времени: непродолжительная и продолжительная.
Стадии:
- острая
- хроническая
- рецидивирующая
Геморрагические диатезы
Обусловлены развитием нарушения гемостаза и появлением повышенной кровоточивости.
- первичные (наследственные), проявляющиеся в раннем возрасте
- приобретенные (вторичные), возникающие на основе каких-либо имеющихся у пациента соматических заболеваний
Тромбоцитопении
Группа заболеваний, при которых наблюдается снижение количества тромбоцитов в связи с повышенным их разрушением или потреблением, а также недостаточным образованием. Повышенное разрушение тромбоцитов — наиболее частый механизм развития тромбоцитопении. По сути своей – это группа геморрагических диатезов с геморрагическими проявлениями на уровне сосудов микроциркуляции. Делят на наследственные и приобретенные.
Медицинский центр «Sante» оснащен собственной клинико-диагностической лабораторией, современным оборудованием, в штате работают высококвалифицированные врачи-гематологи, которые в кратчайшие сроки выявят причину, озвучат рекомендации по лечению и наблюдению.
Гемолитическая анемия. Причины, симптомы, диагностика и лечение патологии

Сайт предоставляет справочную информацию. Адекватная диагностика и лечение болезни возможны под наблюдением добросовестного врача. У любых препаратов есть противопоказания. Необходима консультация специалиста, а также подробное изучение инструкции!
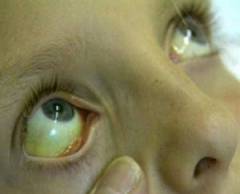
Гемолитическая анемия является самостоятельным заболеванием крови или патологическим состоянием организма, при котором происходит разрушение циркулирующих в крови эритроцитов посредством различных механизмов. Исходя из причин гемолитические анемии разделяют на эритроцитарные и неэритроцитарные. При эритроцитарных анемиях причина гемолиза кроется в различных наследственных дефектах самого эритроцита, таких как аномальное строение цитоскелета клетки, нарушение в строении гемоглобина и недостаточность определенных ферментов эритроцита. Неэритроцитарные гемолитические анемии отличаются нормальным строением красных кровяных телец, а их разрушение происходит под влиянием внешних патогенных факторов, таких как механическое воздействие, аутоиммунная агрессия, инфекционные агенты и др.
Поскольку симптомокомплекс гемолитических анемий одинаков для большинства вызвавших их причин, огромное значение приобретает правильно собранный анамнез, а также дополнительные лабораторные и параклинические исследования.
Лечение гемолитических анемий должно проводиться лишь после установления окончательного диагноза, однако далеко не всегда это представляется возможным ввиду высоких темпов разрушения эритроцитов и недостаточности времени на постановку диагноза. В таких случаях на первый план выступают мероприятия, направленные на жизнеобеспечение пациента, такие как переливание донорской крови, плазмаферез, эмпирическое лечение антибактериальными препаратами и глюкокортикоидными гормональными препаратами.
- Среднее количество железа, содержащееся в крови взрослого человека, составляет порядка 4 грамм.
- Суммарное количество эритроцитов в теле взрослого человека в пересчете на сухую массу составляет в среднем 2 кг.
- Регенераторная способность эритроцитарного ростка костного мозга достаточно велика. Однако, для того чтобы регенераторные механизмы успели активизироваться, требуется длительное время. По этой причине хронический гемолиз значительно легче переносится пациентами, чем острый, даже если при этом уровень гемоглобина достигает 40 – 50 гл.
Что такое эритроциты?
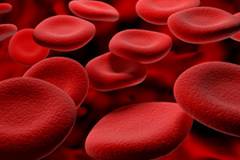
Эритроциты являются наиболее многочисленными форменными элементами крови, основной функцией которых является осуществление переноса газов. Таким образом, эритроциты осуществляют снабжение периферических тканей кислородом и удаление из организма углекислого газа – конечного продукта полного распада биологических веществ.
Нормальный эритроцит обладает рядом параметров, которые обеспечивают успешное выполнение им своих функций.
- форма двояковогнутого диска;
- средний диаметр — 7,2 – 7,5 мкм;
- средний объем — 90 мкм 3 ;
- длительность «жизни» — 90 – 120 дней;
- нормальная концентрация у мужчин — 3,9 – 5,2 х 10 12 л;
- нормальная концентрация у женщин — 3,7 – 4,9 х 10 12 л;
- нормальная концентрация гемоглобина у мужчин — 130 – 160 гл;
- нормальная концентрация гемоглобина у женщин — 120 – 150 гл;
- гематокрит (соотношение форменных элементов крови к жидкой ее части) у мужчин — 0,40 – 0,48;
- гематокрит у женщин — 0,36 – 0,46.
Правильная форма эритроцита с точки зрения физиологии имеет большое значение. Во-первых, она обеспечивает наибольшую площадь соприкосновения эритроцита с сосудистой стенкой во время прохождения по капилляру, а соответственно и высокую скорость газообмена. Во-вторых, измененная форма эритроцитов часто свидетельствует о низких пластических свойствах цитоскелета эритроцита (система белков, организованных в сеть, поддерживающую необходимую форму клетки). Вследствие изменения нормальной формы клетки происходит преждевременное разрушение таких эритроцитов при прохождении через капилляры селезенки. Присутствие в периферической крови эритроцитов различной формы именуется пойкилоцитозом.
Особенности структуры эритроцита
Цитоскелет эритроцита является системой микротрубочек и микрофиламентов, придающих эритроциту ту или иную форму. Микрофиламенты состоят из трех видов белков — актина, миозина и тубулина. Данные белки способны активно сокращаться, изменяя форму эритроцита для осуществления необходимой задачи. Например, для прохождения через капилляры эритроцит вытягивается, а по выходу из узкого участка снова принимает первоначальную форму. Данные преобразования происходят при использовании энергии АТФ (аденозинтрифосфат) и ионов кальция, являющихся пусковым фактором в перестройке цитоскелета.
Еще одной особенностью эритроцита является отсутствие ядра. Данное свойство крайне выгодно с эволюционной точки зрения, поскольку позволяет более рационально использовать пространство, которое бы занимало ядро, и вместо него поместить в эритроцит большее количество гемоглобина. Более того, ядро значительно бы ухудшило пластические свойства эритроцита, что недопустимо, учитывая, что данная клетка должна проникать через капилляры, диаметр которых в несколько раз меньше ее собственного.
Гемоглобин является макромолекулой, заполняющей 98% объема зрелого эритроцита. Он располагается в ячейках цитоскелета клетки. Подсчитано, что в среднем эритроците содержится приблизительно 280 – 400 миллионов молекул гемоглобина. Он состоит из белковой части – глобина и небелковой части – гема. Глобин, в свою очередь, состоит из четырех мономеров, два из которых мономеры α (альфа) и остальные два – мономеры β (бета). Гем является сложной неорганической молекулой, в центре которой располагается железо, способное окисляться и восстанавливаться в зависимости от условий среды. Основной функцией гемоглобина является захват, транспортировка и высвобождение кислорода и углекислого газа. Данные процессы регулируются кислотностью среды, парциальным давлением газов крови и другими факторами.
- гемоглобин А (HbA);
- гемоглобин А2 (HbA2);
- гемоглобин F (HbF);
- гемоглобин Н (HbH);
- гемоглобин S (HbS).
Мембрана эритроцита состоит из двойного липидного слоя, пронизанного различными белками, выполняющими роль насосов для разнообразных микроэлементов. К внутренней поверхности мембраны прикрепляются элементы цитоскелета. На внешней поверхности эритроцита располагается большое количество гликопротеидов, выполняющих роль рецепторов и антигенов – молекул, определяющих уникальность клетки. На сегодняшний день на поверхности эритроцитов обнаружено более 250 видов антигенов, наиболее изученными из которых являются антигены системы АВ0 и системы резус-фактора.
По системе АВ0 различают 4 группы крови, а по резус-фактору – 2 группы. Открытие данных групп крови ознаменовало начало новой эры в медицине, поскольку позволило производить переливание крови и ее компонентов пациентам со злокачественными заболеваниями крови, массивными кровопотерями и др. Также благодаря переливанию крови значительно возросла выживаемость пациентов после массивных хирургических вмешательств.
- агглютиногены (антигены на поверхности эритроцитов, которые при контакте с одноименными агглютининами вызывают осаждение красных кровяных телец) на поверхности эритроцитов отсутствуют;
- присутствуют агглютиногены А;
- присутствуют агглютиногены В;
- присутствуют агглютиногены А и В.
- резус-положительная – 85% населения;
- резус-отрицательная – 15% населения.
Несмотря на тот факт, что, теоретически, переливая полностью совместимую кровь от одного пациента другому анафилактических реакций быть не должно, периодически они случаются. Причиной такого осложнения является несовместимость по остальным типам эритроцитарных антигенов, которые, к сожалению, практически не изучены на сегодняшний день. Кроме того, причиной анафилаксии могут быть некоторые компоненты плазмы – жидкой части крови, Поэтому согласно последним рекомендациям международных медицинских гидов переливание цельной крови не приветствуется. Вместо этого переливаются компоненты крови – эритроцитарная масса, тромбоцитарная масса, альбумины, свежезамороженная плазма концентраты факторов свертывания и т. д.
Упомянутые ранее гликопротеиды, расположенные на поверхности мембраны эритроцитов, формируют слой, называющийся гликокаликсом. Важной особенностью данного слоя является отрицательный заряд на его поверхности. Поверхность внутреннего слоя сосудов также имеет отрицательный заряд. Соответственно, в кровеносном русле эритроциты отталкиваются от стенок сосуда и друг от друга, что предотвращает образование кровяных сгустков. Однако стоит произойти повреждению эритроцита или ранению стенки сосуда, как отрицательный их заряд постепенно сменяется на положительный, здоровые эритроциты группируются вокруг места повреждения, и формируется тромб.
Понятие деформируемости и цитоплазматической вязкости эритроцита тесно сопряжено с функциями цитоскелета и концентрацией гемоглобина в клетке. Деформируемостью называется способность эритроцита клетки произвольно изменять свою форму для преодоления препятствий. Цитоплазматическая вязкость обратно пропорциональна деформируемости и возрастает вместе с увеличением содержания гемоглобина по отношению к жидкой части клетки. Увеличение вязкости происходит при старении эритроцита и является физиологическим процессом. Параллельно с увеличением вязкости происходит уменьшение деформируемости.
Тем не менее, изменение данных показателей может иметь место не только при физиологическом процессе старения эритроцита, но еще и при многих врожденных и приобретенных патологиях, таких как наследственные мембранопатии, ферментопатии и гемоглобинопатии, которые более подробно будут описаны далее.
Эритроцит, как и любая другая живая клетка, нуждается в энергии для успешного функционирования. Энергию эритроцит получает при окислительно-восстановительных процессах, происходящих в митохондриях. Митохондрии сравниваются с электростанциями клетки, поскольку преобразуют глюкозу в АТФ в ходе процесса, именуемого гликолизом. Отличительной способностью эритроцита является то, что его митохондрии образуют АТФ только путем анаэробного гликолиза. Иными словами, данные клетки не нуждаются в кислороде для обеспечения своей жизнедеятельности и поэтому доставляют тканям ровно столько кислорода, сколько получили при прохождении через легочные альвеолы.
Несмотря на то, что об эритроцитах сложилось мнение как об основных переносчиках кислорода и углекислого газа, помимо этого они выполняют еще ряд важных функций.
- регуляция кислотно-щелочного равновесия крови посредством карбонатной буферной системы;
- гемостаз – процесс, направленный на остановку кровотечения;
- определение реологических свойств крови – изменение численности эритроцитов по отношению к общему количеству плазмы приводит к сгущению или разжижению крови.
- участие в иммунных процессах – на поверхности эритроцита находятся рецепторы для прикрепления антител;
- пищеварительная функция – распадаясь, эритроциты высвобождают гем, самостоятельно трансформирующийся в свободный билирубин. В печени свободный билирубин превращается в желчь, использующуюся для расщепления жиров пищи.
Жизненный цикл эритроцита
Эритроциты образуются в красном костном мозге, проходя через многочисленные стадии роста и созревания. Все промежуточные формы предшественников эритроцитов объединяются в единый термин – эритроцитарный росток.
По мере созревания предшественники эритроцита претерпевают изменение кислотности цитоплазмы (жидкой части клетки), самопереваривание ядра и накопление гемоглобина. Непосредственным предшественником эритроцита является ретикулоцит – клетка, в которой при рассмотрении под микроскопом можно встретить некоторые плотные включения, являвшиеся некогда ядром. Ретикулоциты циркулируют в крови от 36 до 44 часов, за которые они избавляются от остатков ядра и заканчивают синтез гемоглобина из остаточных цепей матричной РНК (рибонуклеиновой кислоты).
Регуляция созревания новых эритроцитов осуществляется посредством прямого механизма обратной связи. Веществом, стимулирующим рост числа эритроцитов, является эритропоэтин – гормон, вырабатываемый паренхимой почек. При кислородном голодании выработка эритропоэтина усиливается, что приводит к ускорению созревания эритроцитов и в конечном итоге – восстановлению оптимального уровня насыщения тканей кислородом. Второстепенная регуляция деятельности эритроцитарного ростка осуществляется посредством интерлейкина-3, фактора стволовых клеток, витамина В12, гормонов (тироксин, соматостатин, андрогены, эстрогены, кортикостероиды) и микроэлементов (селен, железо, цинк, медь и др.).
По истечении 3 – 4 месяцев существования эритроцита происходит его постепенная инволюция, проявляющаяся выходом внутриклеточной жидкости из него по причине износа большинства транспортных ферментных систем. Вслед за этим происходит уплотнение эритроцита, сопровождающееся снижением его пластических свойств. Снижение пластических свойств ухудшает проходимость эритроцита через капилляры. В конечном итоге такой эритроцит попадает в селезенку, застревает в ее капиллярах и разрушается лейкоцитами и макрофагами, располагающимися вокруг них.
После разрушения эритроцита в кровеносное русло выделяется свободный гемоглобин. При скорости гемолиза менее 10% от общего числа эритроцитов в сутки гемоглобин захватывается белком под названием гаптоглобин и оседает в селезенке и внутреннем слое сосудов, где разрушается макрофагами. Макрофаги уничтожают белковую часть гемоглобина, но высвобождают гем. Гем под действием ряда ферментов крови трансформируется в свободный билирубин, после чего транспортируется в печень белком альбумином. Наличие в крови большого количества свободного билирубина сопровождается появлением желтухи лимонного оттенка. В печени свободный билирубин связывается с глюкуроновой кислотой и выделяется в кишечник в виде желчи. При наличии препятствия оттоку желчи она поступает обратно в кровь и циркулирует в виде связанного билирубина. В таком случае также появляется желтуха, однако более темного оттенка (слизистые и кожные покровы оранжевого или красноватого цвета).
После выхода связанного билирубина в кишечник в виде желчи происходит его восстановление до стеркобилиногена и уробилиногена при помощи кишечной флоры. Большая часть стеркобилиногена превращается в стеркобилин, который выделяется с калом и окрашивает его в коричневый цвет. Остаточная часть стеркобилиногена и уробилиноген всасывается в кишечнике и поступает обратно в кровоток. Уробилиноген трансформируется в уробилин и выделяется с мочой, а стеркобилиноген повторно поступает в печень и выводится с желчью. Данный цикл с первого взгляда может показаться бессмысленным, однако, это заблуждение. Во время повторного попадания продуктов распада эритроцитов в кровь осуществляется стимуляция активности иммунной системы.
При увеличении скорости гемолиза от 10% до 17 – 18% от общего числа эритроцитов в сутки резервов гаптоглобина становится недостаточно, для того чтобы захватывать высвобождающийся гемоглобин и утилизировать его путем, описанным выше. В таком случае свободный гемоглобин с током крови поступает в почечные капилляры, отфильтровывается в первичную мочу и окисляется до гемосидерина. Затем гемосидерин поступает во вторичную мочу и выводится из организма.
При крайне выраженном гемолизе, темпы которого превышают 17 – 18% от общего количества эритроцитов в сутки, гемоглобин поступает в почки в слишком большом количестве. Из-за этого не успевает происходить его окисление и в мочу поступает чистый гемоглобин. Таким образом, определение в моче избытка уробилина является признаком легкой гемолитической анемии. Появление гемосидерина свидетельствует о переходе в среднюю степень гемолиза. Обнаружение гемоглобина в моче говорит о высокой интенсивности разрушения эритроцитов.
Что такое гемолитическая анемия?
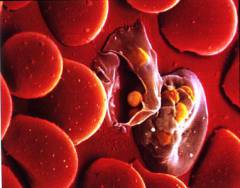
Гемолитическая анемия является заболеванием, при котором значительно укорачивается длительность существования эритроцитов за счет ряда внешних и внутренних эритроцитарных факторов. Внутренними факторами, приводящими к уничтожению эритроцитов, являются различные аномалии строения ферментов эритроцитов, гема или клеточной мембраны. Внешними факторами, способными привести к разрушению эритроцита, являются различного рода иммунные конфликты, механическое разрушение эритроцитов, а также заражение организма некоторыми инфекционными заболеваниями.
Гемолитические анемии классифицируются на врожденные и приобретенные.
- мембранопатии;
- ферментопатии;
- гемоглобинопатии.
- иммунные гемолитические анемии;
- приобретенные мембранопатии;
- анемии из-за механического разрушения эритроцитов;
- гемолитические анемии, вызванные инфекционными агентами.
Подпишитесь на Здоровьесберегающий видеоканал


Врожденные гемолитические анемии
Мембранопатии
Как описывалось ранее, нормальной формой эритроцита является форма двояковогнутого диска. Такая форма соответствует правильному белковому составу мембраны и позволяет эритроциту проникать через капилляры, диаметр которых в несколько раз меньше диаметра самого эритроцита. Высокая проникающая способность эритроцитов, с одной стороны, позволяет им максимально эффективно выполнять основную свою функцию – обмен газов между внутренней средой организма и внешней средой, а с другой стороны – избегать избыточного их разрушения в селезенке.
Дефект определенных белков мембраны приводит к нарушению ее формы. С нарушением формы происходит снижение деформируемости эритроцитов и как следствие усиленное их разрушение в селезенке.
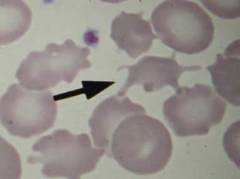
На сегодняшний день различают 3 вида врожденных мембранопатий:
- акантоцитоз
- микросфероцитоз
- овалоцитоз
Акантоцитозом называется состояние, при котором в кровеносном русле больного появляются эритроциты с многочисленными выростами, называемые акантоцитами. Мембрана таких эритроцитов не является округлой и под микроскопом напоминает кант, отсюда и название патологии. Причины акантоцитоза на сегодняшний день изучены не полностью, однако прослеживается четкая связь между данной патологией и тяжелым поражением печени с высокими цифрами показателей жирности крови (общий холестерин и его фракции, бета-липопротеиды, триацилглицериды и др.). Сочетание данных факторов может иметь место при таких наследственных заболеваниях как хорея Гентингтона и абеталипопротеинемия. Акантоциты не в состоянии пройти через капилляры селезенки и поэтому вскоре разрушаются, приводя к гемолитической анемии. Таким образом, выраженность акантоцитоза напрямую коррелирует с интенсивностью гемолиза и клиническими признаками анемии.
Микросфероцитоз – заболевание, которое в прошлом встречалось под названием семейной гемолитической желтухи, поскольку при нем прослеживается четкое аутосомно-рецессивное наследование дефектного гена, ответственного за формирование двояковогнутой формы эритроцита. В результате у таких больных все сформированные эритроциты отличаются сферической формой и меньшим диаметром, по отношению к здоровым красным кровяным тельцам. Сферическая форма обладает меньшей площадью поверхности по сравнению с нормальной двояковогнутой формой, поэтому эффективность газообмена таких эритроцитов снижена. Более того, они содержат меньшее количество гемоглобина и хуже видоизменяются при прохождении через капилляры. Данные особенности приводят к укорочению длительности существования таких эритроцитов посредством преждевременного гемолиза в селезенке.
С детства у таких пациентов происходит гипертрофия эритроцитарного костномозгового ростка, компенсирующая гемолиз. Поэтому при микросфероцитозе чаще наблюдается легкая и средней тяжести анемия, появляющаяся преимущественно в моменты ослабления организма вирусными заболеваниями, недостаточным питанием или интенсивным физическим трудом.
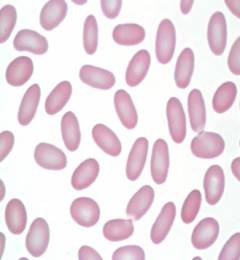
Овалоцитоз является наследственным заболеванием, передающимся по аутосомно-доминантному типу. Чаще заболевание протекает субклинически с наличием в крови менее чем 25% овальных эритроцитов. Гораздо реже встречаются тяжелые формы, при которых число дефектных эритроцитов приближается к 100%. Причина овалоцитоза кроется в дефекте гена, ответственного за синтез белка спектрина. Спектрин участвует в построении цитоскелета эритроцита. Таким образом, из-за недостаточной пластичности цитоскелета эритроцит не способен восстановить двояковогнутую форму после прохождения через капилляры и циркулирует в периферической крови в виде клеток эллипсоидной формы. Чем выраженнее соотношение продольного и поперечного диаметра овалоцита, тем скорее наступает его разрушение в селезенке. Удаление селезенки значительно снижает темпы гемолиза и приводит к ремиссии заболевания в 87% случаев.
Ферментопатии
Эритроцит содержит ряд ферментов, при помощи которых поддерживается постоянство его внутренней среды, осуществляется переработка глюкозы в АТФ и регуляция кислотно-щелочного баланса крови.
- дефицит ферментов, участвующих в окислении и восстановлении глутатиона (см. ниже);
- дефицит ферментов гликолиза;
- дефицит ферментов, использующих АТФ.
Глутатион является трипептидным комплексом, участвующим в большинстве окислительно-восстановительных процессов организма. В частности, он необходим для работы митохондрий – энергетических станций любой клетки, в том числе и эритроцита. Врожденные дефекты ферментов, участвующих в окислении и восстановлении глутатиона эритроцитов, приводят к снижению скорости продукции молекул АТФ – основного энергетического субстрата для большинства энергозависимых систем клетки. Дефицит АТФ приводит к замедлению обмена веществ эритроцитов и их скорому самостоятельному уничтожению, называемому апоптозом.
Гликолиз является процессом распада глюкозы с образованием молекул АТФ. Для осуществления гликолиза необходимо присутствие ряда ферментов, которые многократно преобразуют глюкозу в промежуточные соединения и в итоге высвобождают АТФ. Как указывалось ранее, эритроцит является клеткой, не использующей кислород для образования молекул АТФ. Такой тип гликолиза является анаэробным (безвоздушным). В результате из одной молекулы глюкозы в эритроците образуется 2 молекулы АТФ, использующиеся для поддержания работоспособности большинства ферментных систем клетки. Соответственно врожденный дефект ферментов гликолиза лишает эритроцит необходимого количества энергии для поддержания жизнедеятельности, и он разрушается.
АТФ является универсальной молекулой, окисление которой высвобождает энергию, необходимую для работы более чем 90% ферментных систем всех клеток организма. Эритроцит также содержит множество ферментных систем, субстратом которых является АТФ. Высвобождаемая энергия расходуется на процесс газообмена, поддержание постоянного ионного равновесия внутри и снаружи клетки, поддержание постоянного осмотического и онкотического давления клетки, а также на активную работу цитоскелета и многое другое. Нарушение утилизации глюкозы как минимум в одной из вышеупомянутых систем приводит к выпадению ее функции и дальнейшей цепной реакции, итогом которой является разрушение эритроцита.
Гемоглобинопатии
Гемоглобин – молекула, занимающая 98% объема эритроцита, ответственная за обеспечение процессов захвата и высвобождения газов, а также за их транспортировку от легочных альвеол к периферическим тканям и обратно. При некоторых дефектах гемоглобина эритроциты значительно хуже осуществляют перенос газов. Кроме того, на фоне изменения молекулы гемоглобина попутно изменяется и форма самого эритроцита, что также отрицательно отражается на длительности их циркуляции в кровеносном русле.
- количественные – талассемии;
- качественные – серповидноклеточная анемия или дрепаноцитоз.
Серповидноклеточная анемия является наследственным заболеванием, при котором вместо нормального гемоглобина А формируется аномальный гемоглобин S. Данный аномальный гемоглобин значительно уступает в функциональности гемоглобину А, а также изменяет форму эритроцита на серповидную. Такая форма приводит к разрушению эритроцитов в срок от 5 до 70 дней в сравнении с нормальной длительностью их существования – от 90 до 120 дней. В результате в крови появляется доля серповидных эритроцитов, величина которой зависит от того, является мутация гетерозиготной или гомозиготной. При гетерозиготной мутации доля аномальных эритроцитов редко достигает 50%, а больной испытывает симптомы анемии только при значительной физической нагрузке или в условиях сниженной концентрации кислорода в атмосферном воздухе. При гомозиготной мутации все эритроциты больного являются серповидными и поэтому симптомы анемии проявляются с рождения ребенка, а болезнь характеризуется тяжелым течением.
Приобретенные гемолитические анемии
Иммунные гемолитические анемии
При данном типе анемий разрушение эритроцитов происходит под действием иммунной системы организма.
- аутоиммунные;
- изоиммунные;
- гетероиммунные;
- трансиммунные.
Изоиммунные анемии развиваются при переливании пациенту крови несовместимой по АВ0 системе и резус-фактору или, иными словами, крови другой группы. В данном случае накануне перелитые эритроциты разрушаются клетками иммунной системы и антителами реципиента. Аналогичный иммунный конфликт развивается при положительном резус-факторе в крови плода и отрицательном – в крови беременной матери. Такая патология именуется гемолитической болезнью новорожденных детей.
Гетероиммунные анемии развиваются в случае появления на мембране эритроцита чужеродных антигенов, признаваемых иммунной системой пациента как чужеродные. Чужеродные антигены могут появиться на поверхности эритроцита в случае употребления некоторых медикаментов или после перенесенных острых вирусных инфекций.
Трансиммунные анемии развиваются у плода, когда в организме матери присутствуют антитела против эритроцитов (аутоиммунная анемия). В данном случае мишенью иммунной системы становятся как эритроциты матери, так и эритроциты плода, даже если не выявляется несовместимость по резус-фактору, как при гемолитической болезни новорожденных.
Приобретенные мембранопатии
Представителем данной группы является пароксизмальная ночная гемоглобинурия или болезнь Маркиафавы-Микели. В основе данного заболевания находится постоянное формирование небольшого процента эритроцитов с дефектной мембраной. Предположительно эритроцитарный росток определенного участка костного мозга претерпевает мутацию, вызванную различными вредоносными факторами, такими как радиация, химические агенты и др. Образовавшийся дефект делает эритроциты неустойчивыми к контакту с белками системы комплемента (один из основных компонентов иммунной защиты организма). Таким образом, здоровые эритроциты не деформируются, а дефектные эритроциты уничтожаются комплементом в кровеносном русле. В результате выделяется большое количество свободного гемоглобина, который выделяется с мочой преимущественно в ночное время.
Анемии из-за механического разрушения эритроцитов
- маршевую гемоглобинурию;
- микроангиопатическую гемолитическую анемию;
- анемию при пересадке механических клапанов сердца.
Микроангиопатическая гемолитическая анемия развивается из-за деформации и последующего разрушения эритроцитов при острых гломерулонефритах и синдроме диссеминированного внутрисосудистого свертывания. В первом случае по причине воспаления почечных канальцев и соответственно окружающих их капилляров просвет их сужается, а эритроциты деформируются при трении с их внутренней оболочкой. Во втором случае во всей кровеносной системе происходит молниеносная агрегация тромбоцитов, сопровождающаяся образованием множества фибриновых нитей, перекрывающих просвет сосудов. Часть эритроцитов сразу застревает в образовавшейся сети и образует множественные тромбы, а оставшаяся часть на высокой скорости проскальзывает через данную сеть, попутно деформируясь. В результате деформированные таким образом эритроциты, называющиеся «венценосными», какое-то время еще циркулируют в крови, а затем разрушаются самостоятельно или при прохождении через капилляры селезенки.
Анемия при пересадке механических клапанов сердца развивается при столкновении эритроцитов, двигающихся с высокой скоростью, с плотным пластиком или металлом, из которого состоит искусственный клапан сердца. Темпы разрушения зависят от скорости кровотока в области клапана. Гемолиз усиливается при совершении физической работы, эмоциональных переживаниях, резком повышении или снижении артериального давления и повышении температуры тела.
Гемолитические анемии, вызванные инфекционными агентами
Такие микроорганизмы как плазмодии малярии и токсоплазма гонди (возбудитель токсоплазмоза) используют эритроциты в качестве субстрата для размножения и роста себе подобных. В результате заражения данными инфекциями возбудители проникают в эритроцит и размножаются в нем. Затем по прошествии определенного времени численность микроорганизмов настолько возрастает, что разрушает клетку изнутри. При этом в кровь выделяется еще большее количество возбудителя, который заселяется в здоровые эритроциты и повторяет цикл. В результате при малярии каждые 3 – 4 дня (в зависимости от вида возбудителя) наблюдается волна гемолиза, сопровождающаяся подъемом температуры. При токсоплазмозе гемолиз развивается по аналогичному сценарию, однако чаще имеет неволновое течение.
Причины гемолитической анемии
Резюмируя всю информацию из предыдущего раздела, можно с уверенностью сказать, что причин гемолиза огромное множество. Причины могут крыться как в наследственных заболеваниях, так и в приобретенных. Именно по этой причине огромное значение придается поиску причины гемолиза не только в системе крови, но и в остальных системах организма, поскольку зачастую разрушение эритроцитов является не самостоятельным заболеванием, а симптомом другой болезни.
- попадание в кровь различных токсинов и ядов (ядохимикаты, пестициды, укусы змей и т. д.);
- механическое разрушение эритроцитов (во время многочасового хождения, после имплантации искусственного клапана сердца и др.);
- синдром диссеминированного внутрисосудистого свертывания;
- различные генетические аномалии строения эритроцитов;
- аутоиммунные болезни;
- паранеопластический синдром (перекрестное иммунное уничтожение эритроцитов вместе с опухолевыми клетками);
- осложнения после переливания донорской крови;
- заражение некоторыми инфекционными болезнями (малярия, токсоплазмоз);
- хронический гломерулонефрит;
- тяжелые гнойные инфекции, сопровождающиеся сепсисом;
- инфекционный гепатит B, реже С и D;
- беременность;
- авитаминозы и др.
Симптомы гемолитической анемии

Симптомы гемолитической анемии вписываются в два основных синдрома — анемический и гемолитический. В случае, когда гемолиз является симптомом другого заболевания, то клиническая картина осложняется и его симптомами.
- бледность кожных покровов и слизистых оболочек;
- головокружение;
- выраженная общая слабость;
- скорая утомляемость;
- одышка при обычной физической нагрузке;
- сердцебиение;
- частый пульс и др.
- желтушно-бледный окрас кожных покровов и слизистых оболочек;
- моча темно-коричневого, вишневого или алого цвета;
- увеличение размеров селезенки;
- болезненность в левом подреберьи и др.
Диагностика гемолитической анемии
Диагностика гемолитической анемии проводится в два этапа. На первом этапе диагностируется непосредственно гемолиз, происходящий в сосудистом русле или в селезенке. На втором этапе проводятся многочисленные дополнительные исследования для определения причины разрушения эритроцитов.
Первый этап диагностики
Гемолиз эритроцитов бывает двух видов. Первый вид гемолиза называется внутриклеточным, то есть разрушение эритроцитов происходит в селезенке посредством поглощения дефектных эритроцитов лимфоцитами и фагоцитами. Второй вид гемолиза называется внутрисосудистым, то есть разрушение эритроцитов имеет место в кровеносном русле под действием циркулирующих в крови лимфоцитов, антител и комплемента. Определение вида гемолиза крайне важно, поскольку дает исследователю подсказку, в каком направлении далее продолжать поиски причины разрушения красных кровяных телец.
- гемоглобинемия – наличие свободного гемоглобина в крови вследствие активного разрушения эритроцитов;
- гемосидеринурия – наличие в моче гемосидерина – продукта окисления в почках избыточного гемоглобина;
- гемоглобинурия – наличие в моче неизмененного гемоглобина, признака крайне высокой скорости разрушения эритроцитов.
- общий анализ крови – снижение количества эритроцитов иили гемоглобина, увеличение количества ретикулоцитов;
- биохимический анализ крови – увеличение общего билирубина за счет непрямой фракции.
- мазок периферической крови – при различных способах окраски и фиксации мазка определяется большинство аномалии строения эритроцита.
Второй этап диагностики
Причин развития гемолиза огромное множество, соответственно их поиск может занять непозволительно много времени. В таком случае необходимо максимально детально выяснить анамнез заболевания. Иными словами, требуется выяснить места, которые посещал пациент в последние полгода, где работал, в каких условиях жил, очередность появления симптомов заболевания, интенсивность их развития и многое другое. Такая информация может оказаться полезной для сужения круга поиска причин гемолиза. При отсутствии таковой информации осуществляется ряд анализов на определение субстрата наиболее частых заболеваний, приводящих к разрушению эритроцитов.
- прямой и непрямой тест Кумбса;
- циркулирующие иммунные комплексы;
- осмотическая резистентность эритроцитов;
- исследование активности ферментов эритроцита (глюкоза-6-фосфатдегидрогназа (Г-6-ФДГ), пируваткиназа и др.);
- электрофорез гемоглобина;
- проба на серповидность эритроцитов;
- проба на тельца Гейнца;
- бактериологический посев крови;
- исследование «толстой капли» крови;
- миелограмма;
- проба Хема, проба Хартмана (сахарозная проба).
Осмотическая резистентность эритроцитов
Снижение осмотической резистентности эритроцитов чаще развивается при врожденных формах гемолитических анемий, таких как сфероцитоз, овалоцитоз и акантоцитоз. При талассемии, напротив, наблюдается увеличение осмотической резистентности эритроцитов.
Исследование активности ферментов эритроцитов
С данной целью сначала осуществляют качественные анализы на наличие или отсутствие искомых ферментов, а затем прибегают к количественным анализам, осуществляемым при помощи ПЦР (полимеразной цепной реакции). Количественное определение ферментов эритроцитов позволяет выявить их снижение по отношению к нормальным значениям и диагностировать скрытые формы эритроцитарных ферментопатий.
Электрофорез гемоглобина
Исследование осуществляется с целью исключения как качественных, так и количественных гемоглобинопатий (талассемий и серповидноклеточной анемии).
Проба на серповидность эритроцитов
Сутью данного исследования является определение изменения формы эритроцитов по мере снижения парциального давления кислорода в крови. В случае если эритроциты принимают серповидную форму, то диагноз серповидноклеточной анемии считается подтвержденным.
Проба на тельца Гейнца
Целью данной пробы является обнаружение в мазке крови специальных включений, являющихся нерастворимым гемоглобином. Данная проба осуществляется для подтверждения такой ферментопатии как дефицит Г-6-ФДГ. Однако нужно помнить, что тельца Гейнца могут появиться в мазке крови при передозировке сульфаниламидов или анилиновых красителей. Определение данных образований осуществляется в темнопольном микроскопе или в обычном световом микроскопе при специальном окрашивании.
Бактериологический посев крови
Бак-посев проводится с целью определения видов циркулирующих в крови инфекционных агентов, которые могут взаимодействовать с эритроцитами и вызывать их разрушение прямым путем или посредством иммунных механизмов.
Исследование «толстой капли» крови
Данное исследование проводится с целью выявления возбудителей малярии, жизненный цикл которых тесно сопряжен с разрушением эритроцитов.
Миелограмма
Миелограмма является результатом пункции костного мозга. Данный параклинический метод позволяет выявить такие патологии как злокачественные заболевания крови, которые посредством перекрестной иммунной атаки при паранеопластическом синдроме разрушают и эритроциты. Помимо этого в пунктате костного мозга определяется разрастание эритроидного ростка, что свидетельствует о высоких темпах компенсаторной продукции эритроцитов в ответ на гемолиз.
Проба Хема. Проба Хартмана (сахарозная проба)
Обе пробы проводятся с целью определения длительности существования эритроцитов того или иного пациента. Для того чтобы ускорить процесс их разрушения, тестируемый образец крови помещают в слабый раствор кислоты или сахарозы, а затем оценивают процент разрушенных эритроцитов. Проба Хема считается положительной при разрушении более 5% эритроцитов. Проба Хартмана считается положительной, когда разрушается более 4% эритроцитов. Положительная проба свидетельствует о пароксизмальной ночной гемоглобинурии.
Помимо представленных лабораторных тестов для установления причины гемолитической анемии могут быть проведены другие дополнительные тесты и инструментальные исследования, назначаемые специалистом в области того заболевания, которое предположительно является причиной гемолиза.
Лечение гемолитической анемии
Лечение гемолитических анемий является сложным многоуровневым динамическим процессом. Предпочтительно начинать лечение после полноценной диагностики и установления истинной причины гемолиза. Однако в некоторых случаях разрушение эритроцитов происходит настолько быстро, что времени на установление диагноза оказывается недостаточно. В таких случаях в качестве вынужденных мер производится восполнение потерянных эритроцитов посредством переливания донорской крови или отмытых эритроцитов.
Лечением первичных идиопатических (неясной причины) гемолитических анемий, а также вторичных гемолитических анемий вследствие заболеваний системы крови занимается врач-гематолог. Лечение вторичных гемолитических анемий по причине других заболеваний выпадает на долю того специалиста, в поле деятельности которого находится данное заболевание. Таким образом, анемию, вызванную малярией, будет лечить врач-инфекционист. Аутоиммунную анемию будет лечить врач-иммунолог или аллерголог. Анемию вследствие паранеопластического синдрома при злокачественной опухоли будет лечить онкохирург и т. д.
Лечение гемолитической анемии медикаментами
Основой лечения аутоиммунных болезней и, в частности, гемолитической анемии являются глюкокортикоидные гормоны. Они применяются длительное время – сначала для купирования обострения гемолиза, а затем в качестве поддерживающего лечения. Поскольку глюкокортикоиды обладают рядом побочных действий, то для их профилактики осуществляется вспомогательное лечение витаминами группы B и препаратами, снижающими кислотность желудочного сока.
Помимо снижения аутоиммунной активности большое внимание должно уделяться профилактике ДВС-синдрома (нарушение процесса свертываемости крови), в особенности при средней и высокой интенсивности гемолиза. При низкой эффективности глюкокортикоидной терапии препаратами последней линии лечения являются иммунодепрессанты.
| Медикамент | Механизм действия | Способ применения |
| Преднизолон | Является представителем глюкокортикоидных гормонов, обладающих наиболее выраженным противовоспалительным и иммуносупрессивным действием. | 1 – 2 мгкгсутки внутривенно, капельно. При выраженном гемолизе дозу препарата увеличивают до 150 мгсутки. После нормализации показателей гемоглобина дозу медленно снижают до 15 – 20 мгсутки и продолжают лечение еще 3 – 4 месяца. После этого дозу снижают по 5 мг каждые 2 – 3 дня до полной отмены препарата. |
| Гепарин | Является прямым антикоагулянтом короткого действия (4 – 6 часов). Данный препарат назначается для профилактики ДВС-синдрома, часто развивающегося при остром гемолизе. Применяется при нестабильном состоянии пациента для более совершенного контроля свертываемости. | 2500 – 5000 МЕ подкожно каждые 6 часов под контролем коагулограммы. |
| Надропарин | Является прямым антикоагулянтом длительного действия (24 – 48 часов). Назначается пациентам со стабильным состоянием для профилактики тромбоэмболических осложнений и ДВС. | 0,3 млсутки подкожно под контролем коагулограммы. |
| Пентоксифиллин | Периферический вазодилататор с умеренным антиагрегантным действием. Увеличивает поступление кислорода к периферическим тканям. | 400 – 600 мгсутки в 2 – 3 приема внутрь в течение минимум 2 недель. Рекомендуемая длительность лечения 1 – 3 месяца. |
| Фолиевая кислота | Относится к группе витаминов. При аутоиммунной гемолитической анемии используется с целью восполнения его запасов в организме. | Лечение начинают с дозы 1 мгсутки, а затем увеличивают ее до появления стойкого клинического эффекта. Максимальная суточная доза – 5 мг. |
| Витамин В12 | При хроническом гемолизе запасы витамина В12 постепенно истощаются, что приводит к увеличению диаметра эритроцита и снижению его пластических свойств. Во избежание данных осложнений осуществляется дополнительное назначение данного препарата. | 100 – 200 мкгсутки внутримышечно. |
| Ранитидин | Назначается с целью снижения агрессивного действия преднизолона на слизистую желудка посредством снижения кислотности желудочного сока. | 300 мгсутки в 1 – 2 приема внутрь. |
| Хлористый калий | Является внешним источником ионов калия, которые вымываются из организма в процессе лечения глюкокортикоидами. | 2 – 3 г в сутки под ежедневным контролем ионограммы. |
| Циклоспорин А | Препарат из группы иммунодепрессантов. Применяется в качестве последней линии лечения при неэффективности глюкокортикоидов и спленэктомии. | 3 мгкгсутки внутривенно, капельно. При выраженных побочных эффектах осуществляется отмена препарата с переходом к другому иммунодепрессанту. |
| Азатиоприн | Иммунодепрессант. | 100 – 200 мгсутки в течение 2 – 3 недель. |
| Циклофосфамид | Иммунодепрессант. | 100 – 200 мгсутки в течение 2 – 3 недель. |
| Винкристин | Иммунодепрессант. | 1 – 2 мгнеделю капельно в течение 3 – 4 недель. |
При дефиците Г-6-ФДГ рекомендуется избегать применения препаратов, входящих в группу риска. Тем не менее, при развитии острого гемолиза на фоне данного заболевания осуществляется немедленная отмена препарата, вызвавшего разрушение эритроцитов, и при острой необходимости переливается отмытая донорская эритроцитарная масса.
При тяжелых формах серповидноклеточной анемии или талассемии, требующих частых переливаний крови, назначается Дефероксамин – препарат, связывающий избыток железа и выводящий его из организма. Таким образом осуществляется профилактика гемохроматоза. Еще одним выходом для пациентов с тяжелой формой гемоглобинопатий является пересадка костного мозга от совместимого донора. При успешности данной процедуры существует вероятность значительного улучшения общего состояния пациента, вплоть до полного выздоровления.
В случае, когда гемолиз выступает в качестве осложнения определенного системного заболевания и является вторичным, все лечебные мероприятия должны быть направлены на излечение заболевания, ставшего причиной разрушения красных кровяных телец. После излечения первичного заболевания прекращается и разрушение эритроцитов.
Операция при гемолитической анемии
При гемолитической анемии наиболее практикующейся операцией является спленэктомия (удаление селезенки). Данная операция показана при первом рецидиве гемолиза после проведенного лечения глюкокортикоидными гормонами аутоиммунной гемолитической анемии. Помимо этого спленэктомия является предпочтительным методом лечения таких наследственных форм гемолитических анемий как сфероцитоз, акантоцитоз, овалоцитоз. Оптимальным возрастом, при котором рекомендуется удаление селезенки в случае вышеперечисленных заболеваний, является возраст 4 – 5 лет, однако в индивидуальных случаях операция может быть проведена и в более раннем возрасте.
Талассемия и серповидноклеточная анемия длительное время может лечиться посредством переливания донорских отмытых эритроцитов, однако при наличии признаков гиперспленизма, сопровождающегося снижением количества и остальных клеточных элементов крови, операция по удалению селезенки является оправданной.
Профилактика гемолитических анемий

Профилактика гемолитических анемий подразделяется на первичную и вторичную. Первичная профилактика подразумевает меры, предотвращающие возникновение гемолитических анемий, а вторичная – снижение клинических проявлений уже существующего заболевания.
Первичная профилактика идиопатических аутоиммунных анемий не производится за отсутствием причин таковых.
- избегании сопутствующих инфекций;
- избегании нахождения в среде с низкой температурой при анемии с холодовыми антителами и с высокой температурой при анемии с тепловыми антителами;
- избегании укусов змей и нахождении в среде с высоким содержанием токсинов и солей тяжелых металлов;
- избегании употребления медикаментов из расположенного ниже списка при дефиците фермента Г-6-ФДГ.
- антималярийные средства — примахин, памахин, пентахин;
- обезболивающие и жаропонижающие — ацетилсалициловая кислота (аспирин);
- сульфаниламиды — сульфапиридин, сульфаметоксазол, сульфацетамид, дапсон;
- другие антибактериальные препараты — хлорамфеникол, налидиксовая кислота, ципрофлоксацин, нитрофураны;
- противотуберкулезные средства — этамбутол, изониазид, рифампицин;
- препараты других групп — пробенецид, метиленовый синий, аскорбиновая кислота, аналоги витамина К.
Основные заболевания крови у детей

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
У детей, особенно раннего возраста, наиболее часто встречается такое заболевание крови, как анемия. Под анемией понимают снижение количества гемоглобина (менее 110 г/л), или числа эритроцитов (менее 4х 10 12 /л), или того и другого. В зависимости от степени снижения содержания гемоглобина различают легкие (Нb 90-110 г/л), среднетяжелые (Нb 60-80 г/л) и тяжелые (Нb менее 60 г/л) формы анемии.
Анемия у детей клинически проявляется различной степенью бледности кожи и видимых слизистых оболочек. При остро возникших анемиях (постгеморрагических) больные жалуются на головокружение, шум в ушах, над сердцем выслушивается систолический шум, а на сосудах — шум «волчка». Наиболее часто у детей первых трех лет отмечаются железодефицитные анемии, у детей школьного возраста — постгеморрагические, развивающиеся после выраженных или скрытых кровотечений (особенно желудочно-кишечных, почечных и маточных). У больных, страдающих анемиями, важно знать регенераторную способность костного мозга. Для этого определяют число ретикулоцитов. Ретикулоцитоз всегда указывает на достаточную регенераторную функцию костного мозга. В то же время отсутствие ретикулоцитов в периферической крови или очень низкие их показатели (не соответствующие степени анемии) могут быть одним из признаков гипоплазии (гипопластических анемий).
При анемии, как правило, обнаруживают эритроциты неправильной формы (пойкилоцитоз) и разной величины (анизоцитоз). Особое место занимают гемолитические анемии. Они могут быть врожденными или приобретенными. Клинически гемолиз часто сопровождается повышением температуры тела, бледностью и различной степени желтухой, увеличением печени и селезенки. При гемолитической анемии Минковского-Шоффара наблюдается микросфероцитоз. При приобретенных гемолитических анемиях размеры эритроцитов обычно не изменены.
Часто синдром гемолиза наблюдается при эритроцитопатиях, в основе которых лежит снижение активности ферментов в эритроцитах, при гемоглобинопатиях, при которых имеется врожденное нарушение структуры глобиновой части гемоглобина.
Особое место занимает гемолитическая болезнь новорожденных, обусловленная антигенной несовместимостью эритроцитов плода и матери. Эта несовместимость может быть по резус-фактору (ЛИ) или по системе АВ0. Первая форма протекает более тяжело. В этих случаях эритроциты плода проникают в кровь матери и вызывают выработку гемолизинов. Материнские гемолизины по мере увеличения гестационного возраста трансплацентарно переходят к плоду и вызывают у него гемолиз, что клинически при рождении проявляется анемией, тяжелой желтухой (вплоть до ядерной), увеличением печени и селезенки. При особенно тяжелых формах плод может погибнуть (водянка плода).
Лейкоцитоз и лейкопения у детей
Изменения белой крови могут выражаться в увеличении и снижении числа лейкоцитов. Повышение числа лейкоцитов (у детей выше 10х10 9 /л) называется лейкоцитозом, снижение (менее 5х10 9 /л) _ лейкопенией. Важно знать, за счет каких форменных элементов белой крови происходит повышение или снижение числа лейкоцитов. Изменение числа лейкоцитов чаще может происходить за счет нейтрофилов или лимфоцитов. Реже наблюдается изменение числа эозинофилов и моноцитов. Нейтрофильный лейкоцитоз — абсолютный нейтрофилез — свойствен септическим и гнойно-воспалительным заболеваниям (сепсис, пневмония, гнойные менингиты, остеомиелит, аппендицит, гнойный холецистит). Нейтрофилез при гнойно-септических заболеваниях сопровождается некоторым омоложением — сдвигом в лейкоцитарной формуле влево до палочкоядерных и юных, реже до миелоцитов. Менее выражен нейтрофилез при дифтерии, скарлатине. При злокачественных заболеваниях крови у детей — гемопатиях (особенно при лейкозах) — может наблюдаться особенно высокий лейкоцитоз, характерной особенностью которого является наличие в периферической крови незрелых форменных элементов (лимфо- и миелобластов). При хроническом лейкозе лейкоцитоз особенно высок (несколько сотен тысяч), причем в формуле белой крови присутствуют все переходные формы лейкоцитов. При остром лейкозе в формуле крови обычно наблюдается hiatus leicemicus, когда в периферической крови присутствуют как особенно незрелые клетки, так и в небольшом числе зрелые (сегментоядерные нейтрофилы) без переходных форм. Лимфоцитарный лейкоцитоз — абсолютный лимфоцитоз — свойствен бессимптомному инфекционному лимфоцитозу (иногда выше 100х10 9 /л), коклюшу — (20. 30)х 10 9 /л, инфекционному мононуклеозу. При первых двух заболеваниях — лимфоциты зрелые, при инфекционном же мононуклеозе необычной формы — широкоцитоплазменные. Лимфоцитоз за счет незрелых клеток — лимфобластов — свойствен лимфоидному лейкозу. Относительный лимфоцитоз отмечается при вирусных инфекциях (грипп, острые респираторно-вирусные заболевания, корь, краснуха и др.).
Эозинофильные лейкемоидные реакции в виде нарастания числа эозинофилов в периферической крови свойственны аллергическим заболеваниям (бронхиальная астма, сывороточная болезнь), гельминтозам (аскаридоз, токсокароз и др.) и протозойным инфекциям (лямблиоз и др.). Иногда наблюдаются моноцитарные лейкемоидные реакции, природа которых не всегда ясна. Относительный моноцитоз свойствен коревой краснухе, малярии, лейшманиозу, дифтерии, ангине Венсана-Симановского, эпидемическому паротиту и др.
Лейкопении чаще наблюдаются за счет снижения содержания нейтрофилов — нейтропении. Нейтропенией у детей считается снижение абсолютного числа лейкоцитов (нейтрофилов) на 30% ниже возрастной нормы. Нейтропении могут быть врожденными и приобретенными. Часто они возникают после приема лекарственных препаратов (особенно цитостатических — 6-меркаптопурина, циклофосфана и др., используемых при лечении онкологических больных, а также сульфаниламидов, амидопирина), в период выздоровления от брюшного тифа, при бруцеллезе, в период сыпи при кори и краснухе, при малярии. Лейкопении свойственны вирусным инфекциям, а также ряду заболеваний, отличающихся особо тяжелым течением.
Нейтропения в сочетании с тяжелой анемией отмечается при гипопластической анемии. Относительная и абсолютная лимфопения наблюдается при иммунодефицитных состояниях. Она развивается через несколько месяцев от начала клинических признаков иммунодефицита (преимущественно за счет Т-лимфоцитов).
Геморрагический синдром у детей
Под термином «геморрагический синдром» понимают повышенную кровоточивость в виде кровотечений из слизистых оболочек носа, появления кровоизлияний в кожу и суставы, желудочно-кишечных кровотечений и т. д. В клинической практике целесообразно выделять несколько типов кровоточивости.
- При гематомном типе определяются обширные кровоизлияния в подкожную клетчатку, под апоневрозы, в серозные оболочки, в мышцы и суставы с развитием деформирующих артрозов, контрактур, патологических переломов. Наблюдаются профузные посттравматические и послеоперационные кровотечения, реже — спонтанные. Выражен поздний характер кровотечений, т. е. спустя несколько часов после травмы. Гематомный тип характерен для гемофилии А и В (дефицит VIII и IX факторов).
- Петехиально-пятнистый, или микроциркуляторный, тип характеризуется петехиями, экхимозами на коже и слизистых оболочках, спонтанными или возникающими при малейших травмах кровотечениями — носовыми, десневыми, маточными, почечными. Гематомы образуются редко, опорно-двигательный аппарат не страдает. Послеоперационные кровотечения, кроме кровотечений после тонзиллэктомии, не отмечаются. Часты и опасны кровоизлияния в головной мозг; как правило, им предшествуют петехиальные кровоизлияния в кожу и слизистые оболочки. Микроциркуляторный тип наблюдается при тромбоцитопениях и тромбоцитопатиях, при гипо- и дисфибриногенемиях, дефиците X, V и II факторов.
- Смешанный (микроциркуляторно-гематомный) тип характеризуется сочетанием двух ранее перечисленных форм и некоторыми особенностями: преобладает микроциркуляторный тип, гематомный тип выражен незначительно (кровоизлияния преимущественно в подкожную клетчатку). Кровоизлияния в суставы редки. Такой тип кровоточивости наблюдается при болезни Виллебранда и синдроме Виллебранда-Юргенса, поскольку дефицит коагулянтной активности плазменных факторов (VIII, IX, VIII + V, VII, XIII) сочетается с дисфункцией тромбоцитов. Из приобретенных форм такой тип кровоточивости может быть обусловлен синдромом внутрисосудистого свертывания крови, передозировкой антикоагулянтов.
- Васкулитно-пурпурный тип обусловлен экссудативно-воспалительными явлениями в микрососудах на фоне иммуноаллергических и инфекционно-токсических нарушений. Наиболее распространенным заболеванием этой группы является геморрагический васкулит (или синдром Шенлейна-Геноха). Геморрагический синдром представлен симметрично расположенными, преимущественно на конечностях в области крупных суставов, элементами, четко отграниченными от здоровой кожи. Элементы сыпи выступают над ее поверхностью, представлены папулами, волдырями, пузырьками, которые могут сопровождаться некрозом и образованием корочек. Возможно волнообразное течение, «цветение» элементов от багряного до желтого цвета с последующим мелким шелушением кожи. При васкулитно-пурпурном типе возможны абдоминальные кризы с обильными кровотечениями, рвотой, макро- и (чаще) микрогематурией.
- Ангиоматозный тип характерен для различных форм телеангиэктазий. Наиболее частый тип — болезнь Рандю-Ослера. При этом типе кровоточивости нет спонтанных и посттравматических кровоизлияний в кожу, подкожную клетчатку и другие органы, но имеются повторные кровотечения из участков ангиоматозно-измененных сосудов — носовое, кишечное, реже — гематурия и легочные.
Клиническое выделение этих вариантов кровоточивости позволяет определять комплекс лабораторных исследований, необходимых для уточнения диагноза или причины геморрагического синдрома.
Недостаточность костномозгового кроветворения
Миелофтиз может развертываться остро, когда наблюдается поражение какими-то миелотоксическими факторами, например большой дозой бензола или проникающей радиацией. Иногда такая реакция возникает у детей вследствие индивидуальной высокой чувствительности к антибиотикам (например, левомицетину), сульфаниламидам, цитостатикам, средствам противовоспалительным или обезболивающим. При тотальном поражении всех ростков костномозгового кроветворения говорят о «панмиелофтизе», или тотальной аплазии кроветворения. Общие клинические проявления могут включать в себя высокую лихорадку, интоксикацию, геморрагические сыпи или кровотечения, некротическое воспаление и язвенные процессы на слизистых оболочках, локальные или генерализованные проявления инфекций или микозов. В крови — панцитопения при отсутствии признаков регенерации крови, в пунктате костного мозга — обеднение клеточными формами всех ростков, картина клеточного распада и опустошения.
Гораздо чаще недостаточность кроветворения у детей проявляется как медленно прогрессирующее заболевание, и его симптоматика соответствует наиболее вовлеченному ростку кроветворения. В педиатрической практике могут встречаться больные с врожденными конституциональными формами недостаточности кроветворения.
Конституциональная апластическая анемия, или анемия Фанкони, в наиболее типичных случаях выявляется после 2-3 лет, но иногда и в старшем школьном возрасте. Дебютирует заболевание с возникновения моноцитопении либо анемии, либо лейкопении, либо тромбоцитопении. В первом огучае поводом для обращения являются общая слабость, бледность, одышка, боли в сердце. При втором варианте — упорные по течению инфекции и поражения слизистой оболочки полости рта, при третьем варианте дебюта — повышенная кровоточивость и «синяки» на коже. В течение нескольких недель, иногда месяцев и редко дольше, происходит закономерный переход в бицитопению (два ростка) и, наконец, панцитопению периферической крови. Костномозговой недостаточности у большинства больных сопутствуют множественные аномалии скелета и особенно типична аплазия одной из лучевых костей. Собственно анемия при такой панцитопении отличается явной тенденцией к увеличению размеров циркулирующих эритроцитов (макроцитарная анемия), нередко и лейкоцитов. При цитогенетическом исследовании подтверждается эффект повышенной «ломкости» хромосом в лимфоидных клетках.
Наиболее значимые врожденные заболевания, сопровождающиеся моноцитопеническим синдромом по периферической крови, представлены ниже.
- врожденная гипопластическая анемия;
- Блекфена-Дайемонда;
- транзиторная эритробластопения детского возраста;
- транзиторная аплазия при заболеваниях с хроническим гемолизом эритроцитов.
- болезнь Костманна;
- синдром Швекма’на-Дайемонда;
- циклическая нейтропения.
- тромбоцитопения при аплазии лучевой кости;
- амегакариоцитарная тромбоцитопения.
Многие заболевания крови у детей, равно как и негематологические заболевания, проявляются цитопеническими синдромами вне зависимости от врожденной недостаточности костномозгового кроветворения. В этих случаях наблюдается либо преходящая приобретенная низкая продуктивность кроветворения, как это бывает, например, при недостаточности питания, либо относительная недостаточность кроветворения при большой скорости потерь клеток крови или их разрушения.
Низкая эффективность эритропоэза, имитирующая клинически гипопластическую анемию, может возникать при недостаточности естественных физиологических стимуляторов эритропоэза. К ним можно отнести гипоплазию почек или хроническую почечную недостаточность с выпадением продукции эритропоэтина.
Недостаточность щитовидной железы также нередко проявляется упорной анемией. Иногда причину ингибирования эритропоэза можно видеть в нескольких факторах патогенеза основного соматического заболевания, включающих в себя и нарушения питания, и миелодепрессивный эффект хронического воспаления, и нередкие побочные эффекты применяемых лекарственных средств.
Алиментарно-дефицитные, или «нутритивные», анемии
В странах или ре-гионах с широкой распространенностью голодания детей по типу белково-энергетической недостаточности анемизация является естественной спутницей голода и по генезу всегда полиэтиологична. Наряду с факторами пищевой недостаточности, в ее происхождении серьезную роль играют многочисленные острые и хронические инфекции, гельминтозы и паразитозы. В странах с несколько более устроенной жизнью и санитарной культурой алиментарные анемии чаще всего выявляются у детей раннего возраста, где ограниченный ассортимент продуктов питания не дает возможности сбалансированного обеспечения всем комплексом необходимых нутриентов. Особенно критической представляется обеспеченность железом детей, родившихся преждевременно или с низкой массой тела. При преждевременных родах ребенок лишается периода накопления нутриентов (депонирования), относящегося по срокам к последним неделям беременности. У них отсутствуют необходимые новорожденному депо жировых энергетических веществ и, в частности, железа, меди и витамина В12. Грудное молоко, особенно у плохо питающейся кормящей матери, не может компенсировать отсутствия депонированных компонентов питания. Дефицит железа представляет собой опасность для кислородного обеспечения как через дефицит гемоглобина крови, так и через нарушения тканевых механизмов передачи кислорода от крови к тканям. Отсюда и особая настороженность педиатров, наблюдающих детей раннего возраста, в отношении обеспеченности ребенка адекватным питанием и предупреждения его анемизации. Введение в питание ребенка цельного коровьего молока или его смесей также может отразиться на обеспечении его железом в конце 1-2-го года жизни. Здесь нередко возникают потери железа с эритроцитами, выходящими в просвет кишечника диапедезом. Наконец, в подростковом периоде, особенно у девушек, начавших менструировать, снова появляется высокая вероятность необеспеченности железом и возникновения малокровия. Педиатрическая практика пользуется несколькими лабораторными подходами к выявлению начавшегося дефицита железа, в частности через определение содержания ферритина, насыщения трансферрина железом и т. д. Однако первой линией диагностики являются, несомненно, гематологические исследования, направленные на относительно раннее выявление начальных признаков анемизации.
Перечень нутриентов, дефицит которых закономерно приводит к анемизации, а иногда и лейкопении, может быть довольно широким. Уже указывалось на сочетание дефицитов железа и меди в раннем возрасте и при расстройствах питания во всех возрастных группах. Описаны и случаи мегалобластной анемии у детей с дефицитом витамина или фолиевой кислоты, или тиамина, гипохромная анемия при дефиците витамина В6, гемолитическая анемия при недостатке витамина Е у маловесных детей.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12], [13]
Гемоглобинопатии у детей
Они довольно широко распространены у представителей этнических групп, вышедших из Африки, Азии, Среднего Востока и Средиземноморья. Заболевания этой группы обусловлены носительством и генетической наследуемостью аномальных структур глобина в составе гемоглобина. Представителями этой группы, встречающимися наиболее часто, являются серповидно-клеточная анемия и талассемии (большая и малая). Общими проявлениями гемоглобинопатий являются хроническая анемия, сплено- и гепатомегалия, гемолитические кризы, полиорганные поражения вследствие гемосидероза или гемохроматоза. Интеркуррентные инфекции провоцируют кризы основного заболевания.
Ключ к распознаванию — биохимическое исследование гемоглобина. Распознавание возможно уже в I триместре беременности по данным биопсии трофобласта.
Острые лейкозы у детей
Лейкозы являются самой частой формой злокачественных новообразований у детей. При этом подавляющее большинство острых лейкозов исходят из лимфоидной ткани (85%). Это связано, вероятно, и с исключительно бурным темпом роста лимфоидных образований у детей, превосходящим темпы роста любых других органов и тканей организма. Кроме самой мощной ростовой стимуляции через системы гормона роста и инсулина, лимфоидные образования дополнительно стимулируются и многочисленными инфекциями, иммунизациями, а также травмами. Выявлено, что «пик» частоты детских лейкозов приходится на возрастной период от 2 до 4 лет, и наивысшая частота лейкозов наблюдается у самых благополучных по семье, бытовому окружению и питанию детей. Своеобразным исключением являются дети с болезнью Дауна, также имеющие высокий риск возникновения лейкозов.
В клинической картине лейкоза сочетаются признаки вытеснения нормального гемопоэза с анемией, тромбоцитопенией и нередко геморрагическими проявлениями, гиперпластические изменения кроветворных органов — увеличение печени, селезенки, лимфатических узлов, нередко десен, яичек у мальчиков и любых внутренних органов, на которые распространяется опухолевая пролиферация. Главный путь в диагностике — констатация разрастания анаплазированных гемопоэтических клеток в миелограмме или биоптатах костей. Вот уже более 20 лет как острый лимфобластный лейкоз у детей перестал быть фатальным заболеванием. Применение современных схем полихимиотерапии, иногда в сочетании с пересадками костного мозга, гарантирует либо длительное выживание, либо практическое излечение болезни у большинства больных.
Другие морфологические формы острых лейкозов могут протекать более упорно, и отдаленные результаты их лечения пока несколько хуже.

[14], [15], [16], [17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27], [28], [29]
Источник https://sante.by/gematologiya/zabolevaniya-krovi
Источник https://www.polismed.com/articles-gemoliticheskaja-anemija-prichiny-simptomy-diagnostika-lechenie.html
Источник https://ilive.com.ua/health/osnovnye-zabolevaniya-krovi-u-detey_108813i15942.html