Псевдомембранозный колит
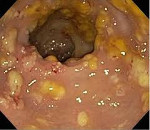
Псевдомембранозный колит – это острое воспаление толстого кишечника, вызываемое условно патогенными клостридиями и возникающее на фоне приема антибиотиков или (реже) других лекарственных средств. Клинические проявления могут варьировать. Обычно выявляются боли в животе и продолжительная диарея в сочетании с признаками общей интоксикации. В тяжелых случаях возможны грубые повреждения кишечной стенки, выраженные расстройства обмена и летальный исход. Заболевание диагностируется на основании симптомов, данных осмотра, анализов крови и кала, эндоскопического исследования. Лечение – отмена антибиотика, диета, этиотропная терапия, коррекция обменных нарушений.
МКБ-10
K52.8 Другие уточненные неинфекционные гастроэнтериты и колиты
- Причины
- Симптомы колита
- Диагностика
- Лечение псевдомембранозного колита
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Псевдомембранозный колит – тяжелое осложнение приема антибиотиков, реже лечения препаратами других групп, в результате которого у больного развивается специфический дисбактериоз, сопровождающийся воспалением толстого кишечника с образованием характерных пленок на слизистой оболочке. Дисбактериоз и воспаление слизистой вызывают анаэробные грамположительные бактерии Clostridium difficile. В тяжелых случаях псевдомембранозный колит сопровождается выраженной интоксикацией, повреждениями стенки кишечника вплоть до перфорации, общей дегидратацией и грубыми электролитными расстройствами, нередко – в сочетании нарушениями белкового обмена. Возможен летальный исход. Лечение осуществляют специалисты в области клинической проктологии и гастроэнтерологии.

Псевдомембранозный колит
Причины
Причиной псевдомембранозного колита является нарушение нормальной кишечной микрофлоры, сопровождающееся избыточным размножением условно патогенной бактерии Clostridium difficile. В подавляющем большинстве случаев дисбактериоз, предшествующий развитию псевдомембранозного колита, возникает на фоне приема антибиотиков, однако в отдельных случаях состав микрофлоры кишечника может меняться под влиянием цитостатиков, иммуносупрессоров и слабительных средств.
Чаще всего псевдомембранозный колит вызывают такие антибиотики, как клиндамицин, амоксициллин, ампициллин, линкомицин и препараты из группы цефалоспоринов. Реже псевдомембранозный колит развивается при приеме левомицетина, эритромицина, тетрациклина и пенициллина. Из-за подавления микробов-симбионтов в кишечнике начинают размножаться Clostridium difficile. Эти бактерии в небольшом количестве содержатся в ЖКТ примерно у 3% населения.
Размножающиеся клостридии выделяют токсические вещества, оказывающие негативное влияние на слизистую оболочку кишечника и вызывающие развитие псевдомембранозного колита. Некоторые антибиотики усиливают повреждающее действие токсинов, что еще больше усугубляет возникшие нарушения. Стенка кишечника теряет свои барьерные свойства и начинает интенсивно секретировать жидкость в просвет кишки. Токсичные соединения всасываются в организм, вызывая развитие интоксикации. Жидкость перемещается в просвет кишечника, развивается обезвоживание, возникают электролитные расстройства.
В тяжелых случаях у больных псевдомембранозным колитом выявляются нарушения белкового обмена. Страдает сердечно-сосудистая система. Возможно формирование токсического мегаколона и прободение стенки кишечника с излитием кишечного содержимого в брюшную полость. Причиной летального исхода при псевдомембранозном колите может стать перитонит, обусловленный инфицированием брюшной полости микроорганизмами, содержащимися в каловых массах, или обезвоживание и нарушение функций различных органов и систем в результате интоксикации и грубых обменных расстройств.
Псевдомембранозный колит может рассматриваться, как внутрибольничная инфекция. Болезнь часто развивается при лечении в стационарных условиях, особенно – при пребывании в одной палате с пациентами, страдающими данной патологией. Факторами, увеличивающими вероятность развития псевдомембранозного колита и одновременно усугубляющими его течение, являются пожилой возраст, декомпенсированные соматические заболевания, болезни ЖКТ, бесконтрольный прием антацидов, почечная недостаточность, злокачественные опухоли, иммунные нарушения (в том числе – при СПИДе), ослабление организма после обширных хирургических вмешательств, а также состояния различного генеза, требующие проведения интенсивной терапии.
Симптомы колита
Клиническая картина псевдомембранозного колита определяется тяжестью патологии. При легких формах наблюдаются поносы и схваткообразные боли в животе на фоне ухудшения общего состояния организма. Стул обильный, водянистый, возможно – с примесями слизи. Общая интоксикация при псевдомембранозном колите проявляется в виде повышения температуры тела, слабости, разбитости, головной боли, тошноты и рвоты. Выраженность диареи и интоксикационного синдрома могут различаться. Все признаки исчезают после отмены антибиотиков.
При тяжелой форме болезни и псевдомембранозном колите средней степени тяжести клиническая симптоматика сохраняется в течение 1-2 и более недель после прекращения антибиотикотерапии. Пациенты страдают от изнуряющей диареи. Кал приобретает специфический вид «рисового отвара» желтоватой или зеленоватой окраски. В каловых массах больных псевдомембранозным колитом выявляются примеси слизи и крови. Потери значительных количеств жидкости с калом обуславливают развитие дегидратации и расстройств водно-электролитного обмена, проявляющихся слабостью, учащением пульса, снижением артериального давления, нарушением тонуса мышц и парестезиями. Возможны судороги. Отмечается уменьшение количества выделяемой мочи.
Отличительными особенностями тяжелой формы псевдомембранозного колита являются более бурное течение и появление крови в фекальных массах с первых дней заболевания. Наблюдается быстрое нарастание интоксикации, в сочетании с интенсивными схваткообразными болями в левой половине живота (преимущественно – в проекции сигмовидной кишки). Тяжелым осложнением псевдомембранозного колита может стать образование патологического расширения кишечника (мегаколона) с последующим разрывом кишки и развитием перитонита. О развитии мегаколона свидетельствует ухудшение состояние пациента с гипертермией до 39 градусов и выше в сочетании с уменьшением частоты дефекаций и увеличением объема живота.
У некоторых пациентов с псевдомембранозным колитом выявляется реактивный артрит. Иногда наблюдается экссудативная энтеропатия – невоспалительное поражение кишечника, сопровождающееся нарушениями белкового обмена и гипопротеиновыми отеками, обусловленными потерей большого количества белка через желудочно-кишечный тракт. Известны случаи стремительного развития псевдомембранозного колита с быстрым обезвоживанием, развитием гиперкалиемии и последующей остановкой сердца.
Диагностика
Диагноз устанавливается специалистом-проктологом или гастроэнтерологом с учетом анамнеза (прием антибиотиков или других препаратов, способных спровоцировать развитие заболевания), жалоб, данных физикального исследования и дополнительных диагностических процедур. В ходе внешнего осмотра больного псевдомембранозным колитом врач отмечает гипертермию, артериальную гипотонию, тахикардию, увеличение объема живота и болезненность при пальпации. В общем анализе крови определяется лейкоцитоз. При исследовании кала выявляются кровь и слизь. При бактериологическом исследовании фекальных масс обнаруживаются Clostridium difficile.
При проведении эндоскопического исследования у пациентов с псевдомембранозным колитом визуализируется слизистая оболочка, покрытая характерными желтоватыми фибринозными пленками (псевдомембранами). Обычно для подтверждения диагноза достаточно ректороманоскопии, поскольку псевдомембранозный колит чаще поражает дистальные отделы толстой кишки. В сомнительных случаях и при необходимости оценить состояние верхних отделов толстого кишечника проводят колоноскопию. При подозрении на развитие мегаколона назначают радиологические исследования (КТ, рентгенографию).
Лечение псевдомембранозного колита
Лечение данной патологии преимущественно консервативное. Больным отменяют антибиотики, назначают специальную диету, рекомендуют употреблять больше жидкости для предупреждения дегидратации. При легких формах псевдомембранозного колита этиотропные препараты обычно не требуются. При среднетяжелой и тяжелой форме болезни используют метронидазол. При наличии противопоказаний к применению данного препарата проводят терапию ванкомицином. Для восстановления нормальной микрофлоры кишечника назначают препараты бифидум и лактобактерий.
При тяжелых формах псевдомембранозного колита осуществляют инфузионную терапию для восстановления объема жидкости, устранения интоксикации, коррекции потерь белка и электролитных нарушений. При псевдомембранозном колите, осложненном токсическим мегаколоном, показано хирургическое вмешательство – сегментарная резекция пораженной части кишечника. Перфорация кишки является показанием к проведению неотложной операции – удалению пораженного отдела кишки, промыванию и дренированию брюшной полости для предупреждения развития перитонита.
Прогноз и профилактика
Прогноз при псевдомембранозном колите определяется тяжестью заболевания. Средняя вероятность гибели пациентов с данной патологией при отсутствии лечения составляет около 30%. При легких формах псевдомембранозного колита обычно наблюдается выздоровление после прекращения антибиотикотерапии. При колитах средней тяжести клиническая симптоматика сохраняется в течение нескольких недель, в последующем возможны рецидивы. Тяжелые формы псевдомембранозного колита часто завершаются гибелью пациентов. Шансы на благополучный исход при мегаколоне и перфорации кишечника еще больше снижаются, поскольку оперативные вмешательства приходится проводить в условиях резкого ослабления организма больного. Кроме того, перфорация толстой кишки часто осложняется перитонитом даже при раннем оперативном вмешательстве, что обусловлено наличием большого количества бактерий в кишечном содержимом.
Основной профилактической мерой является обоснованное назначение антибиотиков, выбранных с учетом индивидуальных противопоказаний, состояния больного и риска развития псевдомембранозного колита. Необходимо одновременное использование средств для предупреждения дисбактериоза, особенно – при продолжительной антибиотикотерапии. В группу высокого риска возникновения псевдомембранозного колита включают больных в возрасте старше 65 лет и пациентов, постоянно принимающих средства из группы антагонистов гистаминовых рецепторов. Больным из этой группы не рекомендуется назначать антибиотики, часто провоцирующие псевдомембранозный колит.
Псевдомембранозный колит

Каждое достижение в медицине имеет свою цену Ричард К. Рут Слева бело-желтые бляшки в сигмовидной кишке, справа — сливающиеся бляшки, образующие псевдомембранозные поля в ободочной кишке Этиология Бактерии Clostridiulm difficil
#02-03/99 Ключевые слова / keywords: Гастроэнтерология, Gastroenterology
1999-02-24 00:00
52758 прочтений
Каждое достижение в медицине имеет свою цену
Ричард К. Рут
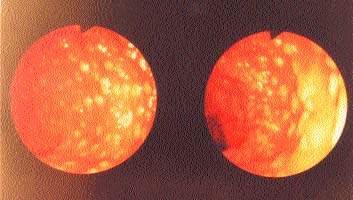 |
| Слева бело-желтые бляшки в сигмовидной кишке, справа — сливающиеся бляшки, образующие псевдомембранозные поля в ободочной кишке |
- Этиология
Бактерии Clostridiulm difficile (КД) являются достаточно крупными (от 0,5-1,9 до 3,0-16,9 мкм) подвижными грамположительными бактериями, относящимися к группе облигатных анаэробов (род Clostridiulm), образующих в неблагоприятных условиях овальные субтерминальные споры, которые устойчивы к нагреванию и способны к длительному (в течение нескольких лет) переживанию в аэробных условиях. Температурный оптимум роста вегетативных форм — 30-37ОС. Важнейшими факторами патогенности КД являются энтеротоксин А и цитотоксин В.
КД широко распространены в природе и имеют убиквитарное распространение, поскольку являются постоянными обитателями кишечника многих видов животных (домашних и диких), а в некоторых случаях могут обнаруживаться в испражнениях здоровых людей различных возрастных групп, включая новорожденных. В результате контаминации почвы КД могут обнаруживаться на различных объектах внешней среды, что представляет особую проблему в медицинских учреждениях. Несмотря на то что КД не относятся к патогенным бактериям, тем не менее в определенных условиях они способны вызывать такие заболевания, как антибиотикоопосредованные диареи (АОД) и псевдомембранозный колит (ПМК). Обнаружение КД на объектах внешней среды стационаров создает серьезную угрозу инфицирования пациентов. Хотя риск инфицирования при прямом контакте с бактериовыделителем или больным, как правило, невелик, однако длительный контакт может привести к развитию клинически манифестных форм инфекций, обусловленных КД (ИКД). В литературе имеются многочисленные описания внутрибольничных вспышек АОД в отделениях различного профиля [9], в том числе гериатрических, ортопедических, хирургических и пр., что позволяет говорить об ИКД как о нозокомиальной инфекции. Теоретически в отделениях любого профиля может быть зарегистрирована вспышка ИКД, однако наблюдения показывают, что наибольшему риску инфицирования КД подвергаются больные хирургических отделений и палат интенсивной терапии [7, 10]. Достаточно четко прослеживается следующая закономерность: чем более интенсивно используются инвазивные методы диагностики и лечения и агрессивная терапия, тем выше риск развития ИКД. Как показывают эпидемиологические исследования, удельный вес внутрибольничных инфекций, обусловленных КД, постоянно растет, особенно в тех странах, где налажена соответствующая лабораторно-диагностическая база [4].
Контролировать ситуацию с внутрибольничным инфицированием пациентов КД достаточно сложно. Во-первых, контроль за обсемененностью спорами КД объектов внешней среды в стационарах не проводится, во-вторых, споры КД резистентны к действию стандартных дезсредств.
Как показывают наблюдения, от 3 до 6% здоровых людей являются носителями КД. Здоровые дети первого года жизни, в том числе и новорожденные, являются носителями КД гораздо чаще — в 30-90%, хотя развитие ПМК в данной возрастной группе нетипично. В стационарах частота выявления бактерионосителей КД может быть выше. При этом у бактерионосителей, как правило, отсутствуют какие-либо клинико-лабораторные указания на развитие ИКД в анамнезе.
Сам по себе факт инфицирования пациентов КД не является определяющим в развитии ИКД. Условиями, необходимыми [4] для развития ИКД, в том числе и ПМК, являются:
- наличие источника инфицирования;
- оральный прием антибиотиков или других групп препаратов, способных вызвать нарушение микробиоценоза кишечника;
- колонизация слизистой толстой кишки КД и выработка экзотоксинов;
- индивидуальные факторы риска: возраст, предшествующие заболевания и госпитализации, длительность заболевания.
Критическим фактором для развития ИКД, в том числе и ПМК, является снижение колонизационной резистентности кишечника, в частности толстой кишки, как следствие нарушения микробиоценоза. Особенность микробной экологии толстой кишки — это абсолютное доминирование в ней анаэробных бактерий, находящихся в соотношении с аэробами 1000:1 и плотностью популяции около 1012 микробных тел на 1 г фекалий. Несмотря на столь высокий популяционный уровень индигенной микрофлоры в толстой кишке, данный микробиоценоз легко нарушается, особенно под действием антибиотиков или других внешних факторов, а восстанавливается исключительно медленно [1, 2].
| Псевдомембранозный колит (ПМК) — это редкое, но опасное заболевание, вызывающееся спорообразующим анаэробным микробом Clostridiulm difficile. Несмотря на то что клинические проявления ПМК весьма вариабельны, чаще всего у больных наблюдаются длительная диарея, интоксикация, боль в животе и лейкоцитоз, возникающие, как правило, на фоне антибиотикотерапии |
Важнейшим и наиболее мощным ко-фактором, способствующим развитию ИКД, является использование антибиотиков. Антибиотикотерапия предшествует развитию ПМК в 60-85% случаях. Несмотря на то что ИКД может быть спровоцирована практически любыми антибиотиками и/или антимикробными препаратами, включая сульфаниламиды и метронидазол, чаще всего развитие ИКД отмечается на фоне приема цефалоспоринов III поколения, клиндамицина, ампициллина, амоксициллина с клавулановой кислотой, фторхинолонов. Макролиды и рифампицин достаточно редко выступают в роли ко-факторов в развитии ИКД. Следует помнить, что ни доза, ни кратность, ни даже способ введения препарата не влияют на возможность развития ИКД. Были случаи, когда даже однократное введение антибиотика приводило к развитию АОД и ПМК.
Кроме того, описаны случаи развития ИКД, в том числе и ПМК, при использовании химиотерапии, антинеопластических препаратов, иммуносупрессивной терапии, препаратов золота, нестероидных противовоспалительных средств, антидиарейных препаратов, нейролептиков. Нарушение микроэкологии кишечника, сопровождающееся колонизацией КД, встречается при обширных операциях на брюшной полости, длительном использовании назогастральных зондов и клизм, у пациентов реанимационных отделений и отделений интенсивной терапии, при почечной недостаточности и некоторых других состояниях.
Практика показывает, что особенно часто ИКД выявляется в хирургических стационарах, особенно у больных, перенесших операцию на кишечнике. Данное обстоятельство может иметь только одно объяснение: помимо того что обширные хирургические операции сами по себе могут способствовать развитию ИКД, такие больные более чем в 90% получают антибиотики широкого спектра действия, как с целью лечения, так и профилактики. И все же примерно у 10-11% хирургических больных ИКД развивается без предварительного приема антибиотиков.
Исследования канадских авторов [3] показали, что наиболее серьезную проблему АОД представляют в больницах с числом коек более 200, в которых уровень заболеваемости ИКД составляет от 30,8 до 40,3 случая на 100 тыс. больных. Согласно другим наблюдениям [10], ПМК развивается у амбулаторных больных при получении оральных антибиотиков с частотой один-три случая на 100 тыс. больных, а среди госпитализированных частота развития ПМК составляет один на 100 (в зависимости от профиля стационара).
Таким образом, многие исследователи заключают, что КД является ведущим клинически значимым патогеном, ответственным за развитие нозокомиальных диарей, на долю которых приходится от 20 до 45% всех внутрибольничных диарей [8].
Хотя КД могут обнаруживаться в стуле здоровых людей, имеются убедительные данные, свидетельствующие о том, что эти микроорганизмы не способны к длительному существованию в неизмененной нормальной микроэкосистеме кишечника. Фактором, способствующим колонизации КД толстой кишки, является глубокое угнетение анаэробной части индигенной микрофлоры кишечника.
Ведущими факторами патогенности КД являются токсические субстанции, вырабатываемые КД: токсин А (ТА) и токсин В (ТВ), которые in vivo проявляют синергизм действия [6]. ТА — это мощный энтеротоксин с цитотоксической активностью, вызывающий нарушение барьерной функции слизистой кишечника за счет повреждения эпителиоцитов и активацию секреции жидкости в просвет кишечника. ТВ — в 1000 раз более мощный цитотоксин, чем ТА, однако его цитотоксический эффект обусловлен нарушением полимеризации внутриклеточных филаментов актина. Пикограмм ТВ способен оказывать цитопатический эффект. Выявляемые в толстой кишке морфологические изменения слизистой обусловлены действием только токсинов, поскольку сами КД не обладают инвазивными свойствами и, как правило, в подслизистый слой не проникают. Протяженность и глубина морфологических изменений, выявляемых в толстой кишке, обусловливают тяжесть течения инфекционного процесса.
Несмотря на то что ИКД чаще всего развивается после лечения антибиотиками, тем не менее взаимодействие между защитными факторами организма, внешней средой и КД остается в значительной степени мало изученным, в силу чего многие стороны патогенеза до сих пор не ясны.
Спектр клинических проявлений ИКД варьирует в широких пределах: от бессимптомного носительства и самокупирующейся диареи до тяжелых колитов. Так как ПМК представляет собой крайнюю форму проявления ИКД с возможным рецидивирующим течением, часто неблагоприятным прогнозом и требует особо сложного лечения, наибольшее внимание врачи уделяют именно этой форме заболевания. В табл. 1 представлены факторы риска развития колита, обусловленного КД.
Таблица 1. Факторы риска развития колита, обусловленного КД
- Возраст старше 65 лет
- Почечная недостаточность
- Хронические обструктивные заболевания легких
- Злокачественные новобразования
- Прием блокаторов Н2 гистаминовых рецепторов
- Поступление больных из других стационаров
- Пребывание больного в отделении интенсивной терапии
Средний возраст заболевших составляет 58-60 лет, хотя развитие ИКД принципиально не зависит от возраста больных [5]. Исключение составляют новорожденные и дети до года, у которых развитие ИКД является нетипичным, и это несмотря на то, что частота обнаружения в кишечнике токсигенных штаммов КД у них намного выше, чем у взрослых. Парадокс данной ситуации объясняется тем, что в данной возрастной группе в кишечном эпителии отсутствуют рецепторы для токсинов КД.
Для АОД характерно развитие диарейного синдрома (ДС) на фоне антибиотикотерапии, при этом общее состояние больных, как правило, не изменяется. Температура тела остается на исходном уровне, могут беспокоить небольшие боли в животе, стул умеренно водянистый. Диарейный синдром носит непродолжительный характер и купируется в течение одного-трех дней после прекращения антибиотикотерапии без дополнительного лечения. Установить истинное число больных с АОД, обусловленными КД, достаточно трудно, поскольку это состояние протекает легко, без выраженного обезвоживания и, как правило, заканчивается спонтанным выздоровлением.
Клиническая картина ПМК весьма вариабельна, поскольку данное заболевание осложняет течение основного патологического процесса. Типичными для ПМК являются жидкий стул, боль в животе и лихорадка. Степень выраженности этих признаков может широко варьировать. ПМК развивается, как правило, либо непосредственно на фоне проводимой антибиотикотерапии, либо через семь — десять дней (в редких случаях позже) после прекращения антибиотикотерапии.
Таблица 2. Факторы риска развития рецидивирующего течения ПМК
- Наличие в анамнезе предшествующих эпизодов диарей, обусловленных КД
- Заболевания, обусловленные 1 или 2 типом штамма КД
- Длительные курсы антибиотикотерапии в анамнезе при лечении других инфекционных заболеваний
- Женский пол
- Начало заболевания весной
В клинической картине ПМК доминирует ДС, который в отдельных случаях бывает единственным проявлением заболевания. ДС, будучи наиболее постоянным клиническим признаком ПМК, в дебюте заболевания выявляется в 100% случаев. В отдельных случаях манифестация заболевания может начинаться с лихорадки. Частота дефекаций в сутки достигает пяти и более раз, доходя иногда до 20-30. Стул, как правило, водянистый, небольшого объема, но, учитывая кратность дефекаций, у больных могут развиваться водно-электролитные расстройства разной степени выраженности. Диарея носит упорный характер и может сохраняется до восьми — десяти недель. В отдельных случаях расстройство стула может носить перемежающий характер, когда диарея сменяется оформленным стулом, сохраняющимся в течение одного-двух дней. Часто стул содержит примесь слизи, тогда как примесь крови не характерна. Рвота встречается достаточно редко и выявляется в более поздние сроки заболевания, свидетельствуя о тяжести его течения.
Фактически одновременно с ДС у больных выявляются боли в животе разной интенсивности, преимущественно спастического характера, которые усиливаются при пальпации живота. Чаще всего боль не имеет четкой локализации и определяется по ходу кишечника.
В большинстве случаев температура тела у больных с ПМК держится на фебрильных цифрах, однако в последние годы участились случаи заболевания, при которых регистрируется гектическая лихорадка, превышающая 40°С.
Характерным для ПМК является достаточно выраженный лейкоцитоз периферической крови, достигающий 15х109/л, а в ряде случаев выявляются даже лейкемоидные реакции, при которых количество лейкоцитов может достигать 40х109/л. Имеются отдельные наблюдения, когда ПМК у больных развивается на фоне лейкопении. Как правило, лейкопения регистрируется у больных, получавших химиотерапию по поводу злокачественных опухолей. ПМК у таких больных протекает исключительно тяжело и часто носит фульминантное течение с развитием бактериемии. Именно фульминантное течение ПМК представляет наибольшую трудность в плане диагностики в силу необычности выявляемой клинической симптоматики, поскольку в этом случае наблюдается комбинированное поражение толстого и тонкого кишечника.
Для фульминантного течения ПМК характерно быстрое прогрессирование процесса. ДС, являющийся ключевым для АОД при фульминантном течении ПМК, может отсутствовать. Почти у половины больных регистрируются запор и признаки кишечной непроходимости. У таких пациентов выявляются признаки “острого живота”, лихорадка бывает выше 38,4ОС [9]. При компьютерной томографии брюшной полости выявляется асцит и значительное утолщение стенки толстой кишки. Несмотря на отчетливые клинические признаки “острого живота”, свободный воздух в брюшной полости не определяется. Особенностью ведения таких больных является то, что базисная медикаментозная терапия оказывается малоэффективной и требуется радикальное хирургическое вмешательство (субтотальная колэктомия). Летальность при фульминантном течении ПМК достигает 58%.
Учитывая длительный и упорный характер диареи, у больных с ПМК часто выявляются тяжелые электролитные расстройства (гипокалиемия), гиповолемия, снижение плазменного уровня альбуминов, развитие отеков вплоть до анасарки, гипотензия.
ПМК может осложняться развитием токсического мегаколона, перфорацией толстой кишки с развитием перитонита, инфекционно-токсическим шоком.
Рецидивирующее течение ПМК наблюдается в 20% у больных с первично установленным диагнозом после проведения стандартной антибиотикотерапии. Для больных, у которых выявлен хотя бы один рецидив, риск рецидивирующего течения ПМК возрастает до 45-68%. Механизм формирования рецидивирующего течения ПМК до сих пор до конца не выяснен. Полагают, что основной причиной является неполная санация кишечника от спор КД, хотя не исключается возможность реинфицирования.
Факторы риска развития рецидивирующего течения ПМК представлены в табл. 2.
Диагностика ИКД — это сложная проблема. Выделение возбудителя хоть и представляется важным, но имеет второстепенное значение в связи с медленным ростом бактерий. Важнейшим методом верификации диагноза ПМК является обнаружение токсинов КД в стуле. Токсигенные штаммы КД, вызывающие развитие ПМК, вырабатывают, как правило, оба токсина, однако “золотым стандартом” в диагностике ПМК может служить обнаружение ТВ при тестировании культуры клеток, которое представляет собой наиболее чувствительный метод. Предлагаемые коммерческие наборы ИФА по обнаружению токсинов А и В, к сожалению, уступают по специфичности и чувствительности цитотоксическому тесту. В последние годы разрабатываются методы ПЦР как альтернатива цитотоксическому тесту. Как показывают многие исследования, латекс-агглютинация, используемая для диагностики ИКД, на сегодня не может быть рекомендована как “базовый” метод диагностики, поскольку обладает достаточно низкой чувствительностью.
Не утратили своего диагностического значения эндоскопические методы. Патологические изменения локализуются преимущественно в дистальном отделе толстой кишки, и для их выявления достаточно провести сигмоидоскопию, однако у одной трети больных патологические изменения локализуются только в проксимальной части толстой кишки; в этом случае требуется проведение колоноскопии. Тонкий кишечник также может вовлекаться в патологический процесс, однако данный факт выявляется только на аутопсии. При сигмоидоскопии и колоноскопии отмечают диффузную гиперемию и отечность слизистой кишечника с утолщением стенки кишки, хотя в стенке кишки выявляется незначительная воспалительная реакция, а в подслизистом слое — скопление лимфоцитов. На поверхности обнаруживают характерные фибринозные бляшки желтовато-белого цвета в диаметре от 2 мм до 2 см и более (см. рис.), покрывающие язвы слизистой кишечника. Эти бляшки могут сливаться, образуя псевдомембранозные поля. Псевдомембраны обнаруживаются между прямой кишкой и левым изгибом ободочной кишки, но может поражаться и поперечная ободочная кишка. Гистологическое исследование показывает, что бляшки состоят из фибрина, муцина, слущенных эпителиальных клеток, разрушенных лейкоцитов и микробной флоры толстого кишечника.
Характер и объем проводимых терапевтических мероприятий у больных с ИКД определяется клиническим вариантом заболевания.
Асимптоматическое носительство, как правило, не требует специальных методов лечения.
При установлении диагноза ПМК лечение начинают незамедлительно. Прежде всего, если заболевание развилось на фоне антибиотикотерапии, необходима ее отмена.
Проводимая больным ПМК терапия преследует две основные цели: во-первых, необходимо купировать воспалительный процесс в кишечнике и, во-вторых, санировать кишечник от спор КД [4, 10].
Несмотря на то что антибиотики чаще всего служат причиной развития ИКД, именно антибактериальная терапия является неотъемлемой частью стандартной базисной терапии ПМК, проведение которой ограничивает колонизацию кишечника КД и купирует воспалительные изменения в кишечнике.
КД in vitro проявляют различную чувствительность к антибиотикам, однако наиболее стабильная чувствительность наблюдается к ванкомицину и метронидазолу. Обязательным условием проведения этиотропной терапии у больных с ПМК является энтеральное введение антибиотиков, поскольку при парентеральном их введении в кишечнике не создается достаточной концентрации и санации организма не наступает.
Несмотря на то что ванкомицин обычно назначают в дозе по 500 мг, проведенные исследования показывают, что дозы 125 мг четыре раза в день бывает вполне достаточно для купирования воспаления. В силу ограниченной доступности ванкомицина более широко используется метронидазол, который назначается в дозе 250–500 мг три-четыре раза в сутки. Оральный прием метронидазола в большинстве случаев эквивалентен ванкомицину, который предпочтителен в тяжелых случаях ПМК. Курс лечения антибиотиками составляет 10 дней. Если невозможен оральный прием препаратов, их вводят через назогастральный зонд. В редких случаях, при тяжелом течении ПМК, возможно комбинированное назначение ванкомицина (per rectulm) и метронидазола (внутривенно), но следует помнить, что внутривенное введение препаратов менее эффективно.
В качестве базисной антибактериальной терапии может использоваться и бацитрацин, однако в силу вариабельности и нестабильности фармакологического эффекта на КД предпочтение отдают метронидазолу и ванкомицину.
| Патоморфологические изменения при ПМК выявляются преимущественно в толстой кишке и характеризуются диффузной гиперемией, а также отечностью слизистой кишечника с утолщением стенки кишки и образованием характерных фибринозных налетов в виде бляшек желтовато-белого цвета |
Базисная антибактериальная терапия способствует достаточно быстрому купированию клинических проявлений заболевания: нормализация температуры наступает, как правило, уже в течение 24–48 часов, а частота и характер стула восстанавливается на 1–13-й день (в среднем 4,5 дня).
Были случаи, когда при неэффективности антибактериальной терапии у больных с ПМК использовался нормальный человеческий иммуноглобулин (ИГ) для внутривенного введения в дозе 200-300 мг/кг веса. Основанием для назначения данного препарата явились контрольные исследования, показавшие, что препараты ИГ содержат антитела против ТА и ТВ в концентрации 0,4-1,6 мг/мл IgG. На фоне проводимой терапии у больных регистрируется быстрое прекращение диареи, купирование болей в животе и нормализация температуры.
К сожалению, какой бы курс антибиотиков нами ни использовался, ни один из них не гарантирует полную санацию кишечника от спор КД, что создает угрозу для развития рецидивирующего течения ПМК [2]. Доказана высокая эффективность препаратов на основе непатогенных дрожжей Saccharomyces boulardii (СБ) для санации организма от спор КД. На основании большого количества наблюдений можно сделать вывод, что терапевтический эффект СБ проявляется как при сочетанном их назначении с антибиотиками, так и при проведении самостоятельного курса после антибиотикотерапии. Механизм действия СБ до конца не выяснен. Установлено, что они ингибируют рост КД, уменьшают образование и накопление цитотоксина в кишечнике, ингибируют кишечные эффекты токсинов за счет протеолиза самих токсинов и ингибирования связывания токсинов с рецепторами. Наиболее высокая клиническая эффективность СБ установлена преимущественно у больных с рецидивирующим течением ПМК. Как показывают наблюдения, не следует использовать СБ при первом эпизоде ПМК. СБ назначают по 1 г в сутки в течение четырех недель.
Эффект от использования энтеросорбентов и ионообменных смол (например, холестирамина, холестипола), несмотря на их способность связывать токсины КД, многими клиницистами оценивается как весьма скромный.
У больных с фульминантным течением ПМК базисная терапия часто оказывается малоэффективной, поэтому в таких случаях проводят хирургическое лечение [9]. Абсолютным показанием к хирургическому лечению (колэктомия с илеостомой) является наличие признаков перитонита.
Литература
1. Бондаренко В. М., Учайкин В. Ф., Мурашова А. О., Абрамов Н. А. Дисбиоз. М., 1995.
2. Малов В. А., Бондаренко В. М., Пак С. Г. Роль Cloctridiuln difficile в патологии человека // Журн. микробиол.1996. № 1. С. 91-96.
3. Alfa M. J., Dul T., Beda G. Sulrvey of incidence of Clostridiulm difficile infection in Canadian hospitals and diagnostic approaches// J. Clin. Microbiol. 1998. V. 36. P. 2076-2080.
4. Bartlett J. G. Clostridiulm difficile: clinical consideretion // Rev. Infect. Dis. 1990. V. 12. Sulppl. 2. P. S243-S251.
5. Bolton R. P., Thomas D. F. Pseuldomembranouls colitis in children and adults // Br. J. Hosp. Med. 1986. V. 35. P. 37-42.
6. Branka J. E. et al. Early fulnctional effects of Clostridiulm difficile toxin A on hulman colonocytes // Gastroenterology. 1997. V .112. № 6. P. 1887-1894.
7. Bulstrode N.W. et al. Clostridiulm difficile colitis after aortic sulrgery // Eulr. J. Vasc. Endovasc. Sulrg. 1997. V. 14. № 3. P. 46-84.
8. Hulghes J. M., Jarvis W. R. Nosocomial gastrointestinal infection // In R. P. Wenzel (ed) Prevention and control of nosocomial infection. The Williams & Wilkins Co. Baltimore, 1987. P. 405-439.
9. Medich D. S., Lee K., Simmons R.L. et al. Laparotomy for fulminant pseuldomembranouls colitis // Arch. Sulrg. 1992. V .127. № 7. P. 847-852.
10. Stergachis A. Perara D. R., Schnell M. M. et al. Antibiotic-associated colitis // West. J. Med. 1984. V. 40. P. 217-219.
Историческая справка
ПМК впервые был описан американским хирургом J. Finney в 1893 году у молодой женщины, прооперированной по поводу опухоли пилорической части желудка. У пациентки развилась тяжелая диарея, повлекшая смерть на 15-й день. На аутопсии в кишечнике были обнаружены дифтеритические мембраны, что, собственно, и послужило основанием для введения данного термина. В “доантибактериальную эпоху” ПМК выявлялся у больных крайне редко и диагноз устанавливался только при аутопсии. С внедрением антибиотиков в повседневную клиническую практику проблема ПМК обострилась, поскольку количество таких больных резко возросло.
В 1965 году S. Goulstone и V. McGovern, анализируя анатомо-гистологические изменения, обнаруживаемые у больных с ПМК в кишечнике, высказали предположение, что данное заболевание вызывается неизвестным токсическим агентом, действующим локально. В 1969 году J. Small установил, что у лабораторных животных, получающих линкомицин гидрохлорид, развивается типичная патоморфологическая картина ПМК, что и явилось в последующих исследованиях лабораторной моделью изучения ПМК. R. Green в 1974 году выявил цитотоксичность в культуре клеток содержимого кишечника лабораторных животных, получавших антибиотики — это позволило предположить, что в развитии цитотоксического эффекта играет определенную роль неизвестный вирус. Установление зависимости развития диареи и/или колита на фоне использования антибиотиков послужило основанием для широкого использования в клинической практике термина “антибиотико-опосредованные диареи (колиты)”.
Несмотря на то что I. Hall и E. O’Toole впервые обнаружили Clostridiulm difficile в кишечном содержимом людей в 1935 году, их этиологическая роль в развитии ПМК и антибиотико-опосредованных диарей (АОД) была установлена только во второй половине 70-х годов.
Псевдомембранозный колит — симптомы и лечение
Что такое псевдомембранозный колит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Аверина Александра Анатольевича, гастроэнтеролога со стажем в 16 лет.
Над статьей доктора Аверина Александра Анатольевича работали литературный редактор Вера Васина , научный редактор Роман Васильев и шеф-редактор Маргарита Тихонова

Гастроэнтеролог Cтаж — 16 лет
Медицинский центр «Норма»
Дата публикации 24 января 2022 Обновлено 24 января 2022
Определение болезни. Причины заболевания
Псевдомембранозный колит (Pseudomembranous colitis) — это острое воспалительное заболевание толстого кишечника, вызываемое токсигенными штаммами бактерии Clostridium difficile [1] . Микроб вырабатывает токсины А и В, повреждающие кишечную стенку, и белок, угнетающий перистальтику кишечника. В результате возникает диарея, боль в животе, появляется слизь и иногда примесь крови в кале.
Характерным признаком заболевания являются фиброзные наложения на слизистой оболочке толстой кишки [27] [28] .
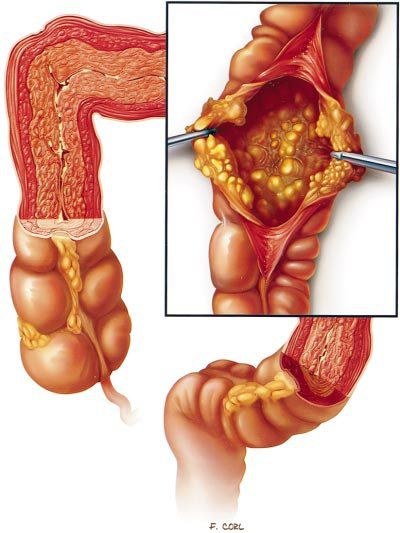
Псевдомембранозный колит (ПМК) чаще всего развивается после лечения антибиотиками. Его ещё называют Clostridium difficile-ассоциированным псевдомембранозным колитом, антибиотик-ассоциированным псевдомембранозным и клостридиозным колитом.
Эпидемиология
Заболеваемость ПМК лучше всего отслеживается в США и странах западной Европы [2] . В России статистический учёт заражения C. diff не ведётся. Согласно систематическому обзору за 2011 год, каждый 5-й случай из всех антибиотик-ассоциированных диарей (ААД) и каждый 2–3 случай внутрибольничной ААД в странах Европы и Северной Америки вызваны C. diff [3] .
В стационарах США среди внутрибольничных инфекций C. diff занимает первое место (12,1 % от общего количества), опережая K. pneumoniae (9, 7 %) и E. coli (9,3 %) [4] . В 2011 г. было зафиксировано более 450 тыс. случаев C. difficile-ассоциированной болезни и более 29 тыс. смертей от неё [29] .
В европейских странах заболеваемость C. diff составляет около 7 случаев на 10000 койко-дней, т. е. при средней госпитализации 10 дней, 7 случаев из 1000 госпитализаций заканчиваются ПМК. В 20 европейских странах это значение колеблется от 0,7 до 28,7 на 10000 койко-дней [5] .
В России в 2011 году было продано 295 млн упаковок антибиотиков, в 2019 — 379 млн [8] [26] . Антибактериальных препаратов потребляется всё больше, их продажа из аптек не контролируется, поэтому проблемы ААД и ПМК актуальны и в нашей стране.
В клиниках Санкт-Петербурга у пациентов с ААД тест на токсины C. diff был положительным в 47,7 % случаев [6] .
Смертность от ПМК колеблется от 9,3 до 22 % и зависит от возраста пациента, смерть чаще наступает при тяжёлом течении заболевания [7] [26] .
В настоящее время увеличилась внутри- и внебольничная заболеваемость C. difficile-ассоциированной болезнью, расширились группы риска, стали чаще встречаться рецидивы и тяжёлые формы, в том числе вызванные более патогенным штаммом BI/NAP1/027, возросла смертность [27] .
Причины псевдомембранозного колита
Основная причина болезни — это приём антибиотиков. ПМК могут вызывать любые антибактериальные препараты, но наиболее часто к нему приводит применение Клиндамицина, хинолонов, цефалоспоринов 2-го и 3-го поколения, карбапенемов. Реже ПМК развивается после приёма макролидов, пенициллина, Тетрациклина, Тигециклина.
К факторам риска, помимо приёма антибиотиков, относятся:
- возраст старше 65 лет;
- терапия ингибиторами протонной помпы и Н2-гистаминоблокаторами — препаратами, снижающими секрецию соляной кислоты в желудке;
- лечение в стационаре, особенно в отделениях реанимации, — каждые 7 дней госпитализации увеличивают риск ПМК на 8 % [1][9][10] ;
- наличие дополнительной патологии, в том числе воспалительных заболеваний кишечника, ВИЧ, сахарного диабета[31][32][33] ;
- хирургические вмешательства на органах ЖКТ;
- энтеральное питание, в том числе через назогастральный зонд;
- приём иммуносупрессивных препаратов (глюкокортикостероидов, Такролимуса) и противоопухолевых средств [31] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы псевдомембранозного колита
Наиболее частые симптомы лёгкого или умеренного псевдомембранозного колита:
- водянистая диарея (жидкие испражнения, похожие на кашицу) от трёх раз в сутки на протяжении двух и более дней в сочетании с болью в животе;
- лёгкие спазмы в животе, часто сопровождающиеся с позывами на стул, но не всегда приводящие к дефекации;
- примеси слизи, крови или гноя в испражнениях;
- температура тела 38,5 °С и более;
- тошнота или потеря аппетита.
При тяжёлом течении псевдомембранозного колита возникает водянистая диарея с кровью, уровень альбумина снижается менее 30 г/л, что сочетается с одним из следующих симптомов: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) и/или болезненностью при ощупывании живота. На фоне длительной диареи организм теряет много жидкости, что приводит к обезвоживанию и проявляется тёмно-жёлтой мочой, чувством жажды, усталости, головокружением, спутанностью сознания и заторможенностью [1] [9] .
При рецидиве болезни симптомы появляются повторно менее чем через 8 недель после окончания терапии.
Проявления псевдомембранозного колита схожи с симптомами других инфекций, поражающих толстый кишечник. Но в отличие от них признаки ПМК могут быть слабо выражены и, как правило, наблюдаются долго: от одной недели до нескольких месяцев. Также встречаются случаи, когда человек является носителем возбудителя ПМК — C. diff, но симптомы полностью отсутствуют.
Патогенез псевдомембранозного колита
В основе патогенеза ПМК лежит чрезмерное размножение бактерий C. diff на фоне уменьшения или гибели нормальной микробиоты толстого кишечника. C. diff вырабатывает токсины А и В, которые вызывают воспаление в кишечной стенке. На течение заболевания влияет состояние иммунной системы пациента и патогенные свойства бактерий, такие как вирулентность, наличие токсинов А и В.
Основной путь передачи инфекции — фекально-оральный. Бактерии попадают в организм с загрязнённых поверхностей, например с дверных ручек, смесителей, ручек смыва сливного бачка, мебели или медицинского инвентаря. Также переносить инфекцию может персонал больницы и заражённые пациенты.
Бактерии C.diff образуют споры, которые устойчивы к действию антибиотиков и могут длительно сохраняться в желудочно-кишечном тракте человека, заражая окружающих и вызывая рецидивы заболевания у самого пациента [12] .
Для некоторых людей C.diff — это часть нормальной микрофлоры ЖКТ, но в таком случае численность бактерий контролируется за счёт других микроорганизмов и работы иммунной системы.
Основные поражающие факторы C.diff — это выделяемые ею токсины [1] . Токсин А (энтеротоксин, белковая молекула с массой 308 кДа) влияет на секрецию жидкости, приводит к повреждению слизистой оболочки кишечника (мембран клеток) и вызывает воспалительный ответ со стороны иммунной системы.
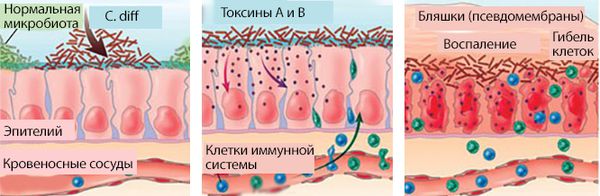
Токсин В (цитотоксин, белковая молекула с массой от 250 до 270 кДа) в 1000 раз более цитотоксичен по сравнению с токсином А. Он вызывает распад филаментного актина — белка, поддерживающего целостность клеток. В результате клетки слизистой разрушаются и гибнут. Токсин В опасен для человека, но не приводит к воспалению и повреждению слизистой оболочки кишечника у животных.
Под действием токсинов в кишечной стенке развивается специфическое воспаление с характерными изменениями на поверхности слизистой. Она становится отёчной, разрыхляется, приобретает ярко-красный цвет, на ней исчезает сосудистый рисунок. При контакте эндоскопа со слизистой капельки крови не появляются. Наблюдается множество желтовато-белых бляшек диаметром 3–5 мм, которые плотно фиксированы к слизистой оболочке. При взятии биопсии они отрываются с трудом, торцом эндоскопа не снимаются. Преобладает два типа воспалительных реакций: диффузно-катаральное воспаление слизистой и очаги фибриноидного некроза — бело-жёлтые бляшки, или псевдомембраны, поэтому такой тип колита называется псевдомембранозным.
![Бляшки при ПМК [35]](https://probolezny.ru/media/bolezny/psevdomembranoznyy-kolit/blyashki-pri-pmk-35_s.jpeg)
В биоптатах, полученных из воспалительно-изменённых участков слизистой, выявляют скопление иммунных клеток крови и слизистой, расширение капилляров и некроз клеток покровного эпителия [1] .
В биоптатах, взятых из бляшек, присутствует фибрин, обрывки некротизированного покровного эпителия, слизь, лейкоциты, плазматические клетки и колонии бактерий.
Чтобы определить патогенность клостридий, нужно выявить их токсины. Посев биоптатов на питательные среды удовлетворительных результатов не даёт. Метод в данном случае затратен и неинформативен, поэтому токсины C. diff определяют в кале.
Воспалительный процесс, как правило, захватывает несколько отделов толстого кишечника, но чаще поражена его прямая и сигмовидная часть, реже вовлекается вся толстая кишка. Протяжённость её поражения связана с тяжестью течения заболевания: чем больше толстого кишечника вовлечено в воспалительный процесс, тем тяжелее протекает колит и ярче симптомы.
Продолжительное воспаление в кишечной стенке приводит к следующим нарушениям:
- не всасывается жидкость, из-за чего развивается обезвоживание;
- потери крови из образующихся эрозий и язв приводят к анемии;
- кишечная стенка становится проницаемой для токсинов возбудителя и продуктов его жизнедеятельности, находящихся в просвете кишки, из-за чего нарастает общая интоксикация.
При тяжёлом течении прекращается перистальтика толстого кишечника, развивается токсический мегаколон и возникает полиорганная недостаточность, из-за чего пациент может погибнуть.
Классификация и стадии развития псевдомембранозного колита
ПМК входит в группу антибиотик-ассоциированных диарей. В Международной классификации болезней (МКБ-10) псевдомембранозный колит кодируется как АО 4.7 — Энтероколит, вызванный Clostridium difficile.
В зависимости от тяжести течения болезни и клинической картины выделяют следующие формы:
- ПМК лёгкой или умеренной тяжести. Проявляется диареей — неоформленным жидким, кашицеобразным стулом три или более раз в сутки и болью в животе.
- ПМК тяжёлого течения. Сопровождается водянистой диареей с кровью и изменениями в анализах. В биохимическом анализе крови отмечается низкий уровень альбумина (меньше 30 г/л), который сочетается с одним из следующих признаков: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) в клиническом анализе крови и/или болезненностью при ощупывании живота.
- Осложнённые формы ПМК. Протекают с водянистой диареей с кровью и одним из следующих симптомов: снижение артериального давления, температура тела ≥ 38,5 °C, отсутствие перистальтики тонкого кишечника, помрачение или угнетение сознания. В клиническом анализе крови лейкоциты повышены > 25×10 9 /л или снижены < 2×10 9 /л, возникает органная и почечная недостаточность, требуется искусственная вентиляция лёгких.
- Рецидивирующее течение ПМК. Заболевание развивается повторно менее чем через 8 недель после окончания терапии [1][14] .
Данная классификация используется для выбора схемы лечения.
Осложнения псевдомембранозного колита
Наиболее частые осложнения псевдомембранозного колита:
- Обезвоживание и электролитные нарушения — из-за сильной и длительной диареи нарушается ритм сердца, снижается артериальное давление и мышечный тонус. Чаще эти осложнения развиваются при недостаточном восполнении потерянной жидкости и солей.
- Почечная недостаточность — при стремительном обезвоживании нарушается работа почек, из-за чего снижается частота мочеиспусканий, появляются отёки, по анализам крови видно, что растёт содержание азотистых шлаков.
- Токсический мегаколон — расширение толстой кишки, редкое осложнение с плохим прогнозом. На фоне диареи частота стула резко урежается до одного раза в сутки, в дальнейшем дефекация прекращается полностью. Это происходит из-за замедления и полного прекращения перистальтики толстого кишечника. Из-за распирания толстого кишечника газами и содержимым нарастает вздутие живота, усиливается боль в нём. Интоксикация и электролитные нарушения приводят к резкому ухудшению самочувствия и выраженной слабости. В дальнейшем стенка кишки разрывается, содержимое изливается в брюшную полость (перфорация кишечника) и начинается перитонит. Как правило, это осложнение наблюдается у ослабленных пациентов, находящихся в отделении реанимации и хирургии.
- Перфорация кишечной стенки — образуется сквозное отверстие в кишечной стенке с излитием содержимого кишечника в брюшную полость и развитием перитонита.
- Полиорганная недостаточность — может привести к гибели пациента [1][15] .
Диагностика псевдомембранозного колита
Тесты на C. diff показаны при длительной диарее с болью в животе и/или примесью крови в стуле, возникшей спустя 3–60 суток после выписки из стационара и/или после приёма антибиотиков [1] .
Чтобы выявить токсигенные штаммы C. diff, токсины A и B определяют в кале [16] .
Для этого используют следующие методы:
- Цитотоксиновый копрологический тест. Чувствительность — 95 %, специфичность — 99 %, результат — в течение 2–3 дней.
- ELISA (Enzyme Linked Immuno Sorbent Assay) — фермент-связанный иммуносорбентный тест для определения токсинов. Чувствительность — 70–90 %, специфичность — 99 %, результат — через 4–6 часов.
- ПЦР (полимеразная цепная реакция) на токсин В. Чувствительность — 96 %, специфичность — 100 %, результат — в течение нескольких часов.
Чувствительность теста — это доля положительных результатов среди больных людей, т. е. вероятность правильно определить инфекцию у заболевших, отсутствие ложноотрицательных результатов. Специфичность — доля отрицательных результатов среди здоровых людей, т. е. отсутствие ложноположительных результатов.
Посев кала на C.diff не проводится, так как этим методом не удаётся определить токсигенные штаммы.
С помощью дополнительных методов можно оценить тяжесть состояния пациента и своевременно выявить осложнения.
К дополнительным обследованиям относятся:
- ректороманоскопия или сигмоидоскопия — позволяют обнаружить типичные изменения стенки кишки (множественные желтоватые бляшки 2–10 мм в диаметре, плотно фиксированные на поверхности слизистой оболочки);
- колоноскопия — помимо типичных изменений кишечной стенки, определяется распространённость процесса и поражение толстого кишечника выше сигмовидной кишки [17] ;
- обзорная рентгенография органов брюшной полости — используется, чтобы выявить признаки пареза кишечника и токсического расширения кишки;
- анализ крови — показывает уровень лейкоцитов (при ПМК повышен до 10–50 × 10 9 ), уровень креатинина (выше нормы) и альбумина (ниже нормы).
Гистологическое исследование биоптатов не является необходимым при C. difficile-ассоциированной болезни, но может быть крайне важным для дифференциальной диагностики.
Лечение псевдомембранозного колита
Методы лечения псевдомембранозного колита в российских и зарубежных клинических рекомендациях совпадают [1] [18] . При лёгком и среднетяжёлом течении его проводят в амбулаторных условиях (дома), при тяжёлом и/или осложнённом — в стационаре.
Для лечения ПМК назначаются антибиотики:
- Терапия первой линии — Метронидазол[19] . Препарат хорошо всасывается при приёме внутрь, применяется в течение 10 дней.
- Терапия второй линии — Ванкомицин. Применяется, если не эффективен Метронидазол и/или при тяжёлом течении заболевания. Плохо всасывается в кишечнике при приёме внутрь и оказывает преимущественно местное действие [20] . Курс также составляет 10 дней.
- Терапия резерва — Фидаксомицин, бактерицидный антибиотик группы макролидов местного действия, в России не зарегистрирован [21] .
- При осложнённом течении применяется комбинация Ванкомицин + Метронидазол. Лечение проводится в стационаре.
Антибиотики подавляют развитие C. diff. Бактерия чувствительна только к трём перечисленным антибактериальным препаратам.
При развитии осложнений ПМК могут применяться следующие методы:
- При токсическом мегаколоне показана колэктомия — удаление толстой кишки.
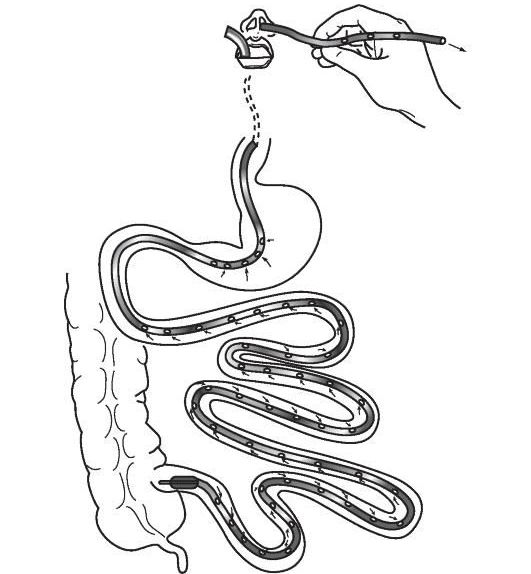
- Для лечения рецидивирующего ПМК в качестве экспериментального метода рассматривается трансплантация кишечной микробиоты (fecal microbiota transplantation, FMT) [23][24][25] . Кишечную микробиоту берут от здорового донора и при помощи назоинтестинального зонда, клизмы или колоноскопии переносят пациенту в кишечник. В России такое лечение считается экспериментальным. Проводится в научных клинических учреждениях, например в Федеральном научно-клиническом центре ФМБА России.
В качестве вспомогательных и симптоматических препаратов используются:
- Сорбенты (Диоктаэдрический смектит) — эффективно удаляет токсины C. diff, снижая их действие на кишечную стенку, улучшает качество стула.
- Пробиотики (Lactobacillus rhamnosus, Bifidobacterium longum, Bifidobacterium bifidum, Bifidobacterium infantis не менее 1×10 9 КОЕ/г) — подавляют активность C. diff. Данные об их эффективности пока противоречивы [22] .
- Препараты на основе дрожжей Saccharomyces cerevisiae (boulardii) — эффективны как вспомогательные и профилактические средства.
Прогноз. Профилактика
При лёгком или среднетяжёлом течении ПМК и хорошей реакции на стандартную терапию прогноз благоприятный, при тяжёлом и осложнённом — неблагоприятный. При рецидивирующем течении прогноз сомнительный, так как не разработаны эффективные схемы лечения.
Профилактика псевдомембранозного колита
Для профилактики развития ПМК следует:
- чаще мыть руки и соблюдать правила личной гигиены;
- рационально принимать антибиотики — строго по назначению врача с соблюдением всех указаний;
- изолировать пациентов с инфекцией C. diff в отдельные палаты, соблюдать меры санитарного режима;
- тщательно обрабатывать все поверхности хлорсодержащими или другими дезинфицирующими средствами, активными против спор C. diff;
- сокращать сроки госпитализации пациентов старше 65 лет [16] .
Чтобы предотвратить рецидив C. difficile-ассоциированной болезни, после завершения лечения Метронидазолом или Ванкомицином назначаются пробиотики курсом не менее трёх месяцев. Серьёзных побочных эффектов от них не выявлено [34] .
Список литературы
- Ивашкин В. Т., Ющук Н. Д., Маев И. В. и др. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению Clostridium difficile-ассоциированной болезни // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2016. — № 5. — С. 56–65.
- Goudarzi M., Seyedjavadi S. S., Goudarzi H. et al. Clostridium difficile Infection: Epidemiology, Pathogenesis, Risk Factors, and Therapeutic Options // Scientifica (Cairo). — 2014.ссылка
- Nelson R. L., Kelsey P., Leeman H. et al. Antibiotic treatment for Clostridium difficile-associated diarrhea in adults // Cochrane Database Syst Rev. — 2011. — № 9.ссылка
- Magill S. S., Edwards J. R., Bamberg W. et al. Multistate Point-Prevalence Survey of Health Care–Associated Infections // N Engl J Med. — 2014. — № 13. — Р. 1198–1208. ссылка
- Davies K. A., Longshaw C. M., Davis G. L. et al. Underdiagnosis of Clostridium difficile across Europe: the European, multicentre, prospective, biannual, point-prevalence study of Clostridium difficile infection in hospitalised patients with diarrhoea (EUCLID) // Lancet Infect Dis. — 2014. — № 12. — Р. 1208–1219. ссылка
- Захарова Н. В., Филь Т. С. Микробиологические и клинические особенности инфекции Clostridium difficile // Инфекционные болезни. — 2015. — № 3. — С. 81–86.
- Lessa F. C., Winston L. G., McDonald L. C. et al. Emerging Infections Program C. difficile Surveillance Team. Burden of Clostridium difficile infection in the United States // N Engl J Med. — 2015. — № 24. — Р. 2369–2370. ссылка
- Анализ рынка антибиотиков в России в 2007–2011 гг, прогноз на 2012–2016 гг // BusinesStat. — 2012. — 82 c.
- Centers for Disease Control and Prevention. What is C. diff? — 2021. ссылка
- Hensgens M. P., Goorhuis A., Dekkers O. M. et al. Time interval of increased risk for Clostridium difficile infection after exposure to antibiotics // J Antimicrob Chemother. — 2012. — № 3. — Р. 742–748. ссылка
- Centers for Disease Control and Prevention. Vital Signs: Preventing Clostridium difficile Infections // Morbidity and Mortality Weekly Report (MMWR). — 2012. — № 9. — Р. 157–162. ссылка
- Surawicz C. M., Brandt L. J., Binion D. G. et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections // Am J Gastroenterol. — 2013. — № 4. — Р. 478–498.ссылка
- Сотников В. Н., Разживина А. А., Веселов В. В. и др. Колоноскопия в диагностике заболеваний толстой кишки. — М: Экстрапринт, 2006. — 272 с.
- Шептулин А. А. Рефрактерные и рецидивирующие формы колита, ассоциированного с Clostridium difficile // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2011. — № 2. — С. 50–53.
- Mayo Clinic. Pseudomembranous colitis. — 2020.
- Planche T., Aghaizu A., Holliman R. Diagnosis of Clostridium difficile infection by toxin detection kits: a systematic review // Lancet Infect Dis. — 2008. — № 12. — Р. 777–784. ссылка
- Cerilli L. A., Greenson J. K. The differential diagnosis of colitis in endoscopic biopsy specimens: a review article // Arch Pathol Lab Med. — 2012. — № 8. — Р. 854–864.ссылка
- Рациональная фармакотерапия заболеваний органов пищеварения / под ред. В. Т. Ивашкина. — М.: Литтерра, 2011. — С. 522–526.
- Министерство здравоохранения РФ. Метронидазол: инструкция к по медицинскому применению лекарственного препарата. — 2021. — 9 с.
- Министерство здравоохранения РФ. Ванкомицин: инструкция к по медицинскому применению лекарственного препарата. — 2020. — 16 с.
- Fidaxomicin // Drugs in R&D. — 2010. — № 1. — Р. 37–45.ссылка
- Johnston B. C., Ma S. S., Goldenberg J. Z. et al. Probiotics for the prevention of Clostridium difficile-associated diarrhea: a systematic review and meta-analysis // Ann Intern Med. — 2012. — № 12. — Р. 878–888. ссылка
- Silverman M. S., Davis I., Pillai D. R. Success of self-administered home fecal transplantation for chronic Clostridium difficile infection // Clin Gastroenterol Hepatol. — 2010. — № 5. — Р. 471–473.ссылка
- Kleger A., Schnell J., Essig A. et al. Fecal transplant in refractory Clostridium difficile colitis // Dtsch Arztebl Int. — 2013. — № 7. — Р. 108–115.ссылка
- Шрайнер Е. В., Курилович С. А., Осипенко М. Ф. Трансплантация кишечной микробиоты: терапевтический потенциал при болезнях органов пищеварения // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2014. — № 5. — С. 63–68.
- Нечаева Ю. Обзор продаж антибактериальных препаратов по итогам 9 месяцев 2020 года // Ремедиум. — 2020. — № 10. — С. 18–21.
- Ивашкин В. Т., Шифрин О. С., Тертычный А. С. Clostridium difficile-ассоциированная болезнь // Росcийский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2015. — № 6. — С. 5–17.
- Шептулин А. А. Рефрактерные и рецидивирующие формы колита, ассоциированного с Clostridium difficile // Росcийский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2011. — № 2. — С. 50–53.
- Lessa F. C., Mu Y., Bamberg W. M. et al. Burden of Clostridium difficile infection in the united states // N Engl J Med. — 2015. — № 9. — Р. 825–834.ссылка
- Vecchio A. L., Zacur G. M. Clostridium difficile infection: an update on epidemiology, risk factors, and therapeutic options // Curr Opin Gastroenterol. — 2012. — № 1. — Р. 1–9. ссылка
- Furuya-Kanamori L., Stone J. C., Clark J. et al. Comorbidities, exposure to medications, and the risk of community-acquired Clostridium difficile infection: A systematic review and meta-analysis // Infect Control Hosp Epidemiol. — 2015. — № 2. — Р. 132–141. ссылка
- Haines C. F., Moore R. D., Bartlett J. G. et al. Clostridium difficile in a HIV-infected cohort: incidence, risk factors, and clinical outcomes // AIDS2013. — № 17. — Р. 2799–2807. ссылка
- Rodemann J. F., Dubberke E. R., Reske K. A. et al. Incidence of Clostridium difficile infection in inflammatory bowel disease // Clin Gastroenterol Hepatol. — 2007. — № 3. — Р. 339–344.ссылка
- Hempel S., Newberry S. J., Maher A. R. et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis //JAMA. — 2012. — № 18. — Р. 1959–1969.ссылка
- Yu J. H., Kim N. Y., Lee H. M. et al. A case of pseudomembranous colitis in a juvenile rheumatoid arthritis patient taking methotrexate // Korean J Gastroenterol. — 2010. — № 6. — Р. 387–390. ссылка
Источник https://www.krasotaimedicina.ru/diseases/zabolevanija_proctology/pseudomembranous-colitis
Источник https://www.lvrach.ru/1999/02-03/4527414
Источник https://probolezny.ru/psevdomembranoznyy-kolit/