Гепатит В у взрослых
Категории МКБ: Острая дельта(супер)-инфекция вирусоносителя гепатита B (B17.0), Острый гепатит b (B16), Хронический вирусный гепатит b без дельта-агента (B18.1), Хронический вирусный гепатит b с дельта-агентом (B18.0)
Разделы медицины: Гастроэнтерология
Общая информация
- Версия для печати
- Скачать или отправить файл
Краткое описание
Клинические рекомендации Российской гастроэнтерологической ассоциации и Российского общества по изучению печени по диагностике и лечению взрослых больных гепатитом В (2014)
Приблизительно у одной трети населения Земли выявляются маркёры перенесенной инфекции вирусом гепатита В (ВГВ) и у 350 млн человек — маркёры текущей хронической инфекции, характеризующейся широким спектром клинических вариантов и исходов заболевания — от неактивного носительства ВГВ с низким уровнем виремии до хронического гепатита В (ХГВ) с выраженной активностью и возможностью формирования неблагоприятных исходов — цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК) [70]. От цирроза и ГЦК ежегодно в мире погибает около 1 млн человек. Конечные стадии прогрессирующего ХГВ являются причиной 5–10% выполняемых ежегодно трансплантаций печени [32].
ХРОНИЧЕСКИЙ ГЕПАТИТ В — заболевание, в основе которого лежит поражение печени вирусом гепатита В, продолжающееся более 6 месяцев, морфологически проявляющееся воспалительными, некротическими и фибротическими изменениями печеночной ткани различной степени тяжести.
Заболеваемость острым гепатитом В (ОГВ) в Российской Федерации в последние годы неуклонно снижается. Реализация комплекса профилактических мер и, в первую очередь, широкомасштабной программы вакцинации, в рамках которой против гепатита В (ГВ) было привито более 80 млн человек, позволила снизить число заболевших ОГВ в период с 2000 по 2012 г. в 30 раз и достичь к началу 2013 г. показателя 1,43 на 100 тыс. населения. Широкий охват профилактическими прививками детей до 14 лет привел к снижению заболеваемости в этой группе за указанный период в 90 раз — с 9,96 до 0,11 на 100 тыс. детей.
Снижение заболеваемости острым гепатитом В сопровождалось также изменением ее возрастной структуры. Если до начала массовой иммунизации наибольшее число заболевших выявлялось среди лиц 15–19 лет (показатель 141,9 на 100 тыс. данной возрастной группы) и 20–29 лет (102,5 на 100 тыс.), то в последние годы доля заболевших в возрасте 15–19 лет значительно уменьшилась, а доля лиц 20–29 и 30–39 лет возросла. Пиковые значения заболеваемости хроническим гепатитом В также сместились с группы 20–29 лет в группу 30–39 лет.
Высокая медицинская и социально-экономическая значимость гепатита В в Российской Федерации в настоящее время определяется ежегодной регистрацией высокого показателя заболеваемости хроническими формами этой инфекции, который в 2012 г. составил 33,7 на 100 тыс. населения. Согласно экспертным оценкам, в стране насчитывается около 3 млн носителей вируса гепатита В и больных хроническим гепатитом В.
О широкой распространенности хронических форм ГВ среди населения свидетельствует регистрация большого числа лиц, у которых по результатам скрининговых исследований выявляется HBsAg. По данным официальной статистики, в 2012 г. HBsAg был выявлен у 5952 доноров крови и других биологических субстратов, 16 513 беременных женщин и 915 детей, рожденных от инфицированных вирусом гепатита В матерей [1, 11, 26].
Выделяют 10 генотипов и большое число субгенотипов ВГВ. В Российской Федерации доминирующими являются генотипы D (около 90% случаев) и А (около 10%), однако на разных территориях частота генотипов может различаться.
Согласно МКБ-10 хронический гепатит В регистрируется под кодами:
B 18.1 — хронический гепатит В без дельта-агента;
B 18.0 — хронический гепатит В с дельта-агентом.
ОСТРЫЙ ГЕПАТИТ B
Согласно МКБ-10 острый гепатит В регистрируется под кодами:
B 16 — острый гепатит В;
B 16.2 — острый гепатит В без дельта-агента с печеночной комой;
B 16.9 — острый гепатит В без дельта-агента без печеночной комы;
B 16.0 — острый гепатит В с дельта-агентом (коинфекция) и печеночной комой;
B 16.1 — острый гепатит В с дельта-агентом (коинфекция) без печеночной комы;
В 17.0 — острая дельта (супер)-инфекция вирусоносителя гепатита В.
Острый гепатит В — заболевание с парентеральным механизмом передачи возбудителя — ВГВ. Характеризуется развитием циклически протекающего паренхиматозного гепатита с наличием или отсутствием желтухи, заканчивающегося у взрослых больных в большинстве случаев (до 90–95%) выздоровлением, а также возможностью развития хронического гепатита В и формирования с течением времени у части пациентов цирроза печени и гепатоцеллюлярной карциномы [8, 10].
ГЕПАТИТ В У БЕРЕМЕННЫХ
Обследование на гепатит В и С беременных в I и II триместрах регламентировано санитарными правилами [21]. Частота выявления гепатита В у беременных в 2–3 раза меньше частоты обнаружения антител к вирусу гепатита С. Тем не менее, в РФ у 0,01–3% беременных (в зависимости от региона) выявляется HBsAg при обследовании во время беременности [2].
Существуют три возможных пути передачи ВГВ от инфицированной матери к ребенку: перинатально (внутриутробно или трансплацентарно), интранатально (во время родов) или постнатально (в период ухода за детьми или через грудное молоко). Общепризнано, что наиболее часто передача вируса от матери к ребенку происходит во время или вблизи от времени родов, именно поэтому своевременно проведенная вакцинация новорожденных предотвращает заражение приблизительно в 80–95% случаев. Риск передачи ВГВ во время родов зависит от наличия HBeAg и уровня ДНК ВГВ в крови беременной женщины перед родами, длительности и выраженности контакта новорожденного с цервикальным секретом и материнской кровью [63].
В отсутствие иммунопрофилактики для новорожденного, у матери которого выявляются HBsAg и HBeAg в крови, риск развития хронической ВГВ-инфекции составляет 70–90%, для рожденных от HBsAg-позитивных/HBeAg-негативных матерей риск вертикальной передачи гораздо меньше — от 10 до 40%. При этом хронический гепатит В при инфицировании в период младенчества развивается в 85–95% случаев.
В соответствии с национальным календарем прививок от 31.01.2011 г. новорожденным от матерей с наличием HBsAg в крови вакцинация проводится по схеме 0–1–2–12 (приказ МЗ РФ № 51 от 31.01.2011 г. «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям»).
Вакцинацию необходимо сочетать с введением специфического иммуноглобулина с высоким уровнем анти-HBs. Новорожденные в течение 12 часов должны получить одну дозу специфического иммуноглобулина против гепатита В и первую дозу вакцины против гепатита В [1, 7, 22].
Беременные с ОГВ подлежат обязательной госпитализации в инфекционные стационары, а роженицы с ХГВ и носители HBsAg — в областные (городские) обсервационные родильные дома (палаты), где обеспечивается строгий противоэпидемический режим.
Рекомендации по диагностике и лечению пациентов с гепатитом В служат руководством для практических врачей, осуществляющих ведение и лечение таких пациентов на разных стадиях заболевания. Рекомендации подлежат регулярному пересмотру в соответствии с новыми данными научных исследований в этой области.
Рекомендации сопровождаются пояснениями об уровне доказательности отдельных положений согласно правилам, которые были использованы в аналогичном документе Европейской ассоциации по изучению печени (табл. 1).
Таблица 1. Уровни доказательности приводимых научных утверждений [32]
Основаны на исследованиях, отражающих различные мнения.
Соответственно рекомендации выглядят как менее четкие и определенные
Диагностика
ДИАГНОСТИКА ОСТРОГО ГЕПАТИТА В
Острый гепатит В диагностируют на основании:
– длительности течения инфекции (менее 6 месяцев);
– данных эпидемиологического анамнеза о событиях, произошедших в течение инкубационного периода (последних 6 месяцев до появления симптомов заболевания) — наличие парентеральных манипуляций медицинского и немедицинского характера, сопровождающихся нарушением целостности кожного покрова и слизистых оболочек (включая внутривенное введение психоактивных препаратов, переливание крови или ее компонентов, случайные половые контакты или частую смену половых партнеров, тесный контакт с носителями HBsAg);
– клинической картины (постепенное начало болезни, наличие преджелтушного периода продолжительностью от 1 до 4–5 недель, сопровождающегося астеновегетативным синдромом, слабостью, повышенной утомляемостью, снижением работоспособности, диспептическим синдромом — снижением аппетита, тошнотой, иногда рвотой, чувством тяжести в правом подреберье, артралгиями, экзантемой типа крапивницы, кратковременным повышением температуры тела, ухудшением самочувствия на фоне появившейся желтухи, увеличением размеров печени;
– лабораторных данных: повышение активности аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ) более чем в 10 раз, общего билирубина за счет связанной фракции при желтушном варианте заболевания, обнаружение маркёров острой ВГВ-инфекции (HBsAg, анти-НВсore IgM) в сыворотке крови.
Одновременное инфицирование вирусами гепатитов В и D может привести к развитию острой ВГВ/ВГD-коинфекции, поражение вирусом гепатита D пациента с хронической ВГВ-инфекцией — к острой дельта (супер) -инфекции.
Острая коинфекция ВГВ/ВГD
По сравнению с острым гепатитом В при острой коинфекции ВГВ/ВГD отмечаются:
– более острое начало заболевания, лихорадка, сохраняющаяся на фоне желтухи, частое появление полиморфной сыпи, суставных болей, увеличение селезенки, двухволновое течение заболевания с клинико-ферментативными обострениями;
– течение заболевания преимущественно в среднетяжелой и тяжелой формах;
– активность АсАТ выше активности АлАТ, коэффициент де Ритиса более 1 (часто);
– наличие в сыворотке крови маркёров гепатитов В и D (HBsAg, анти-HBc IgM в сочетании с анти-ВГD IgM, анти-ВГD IgG);
– при благоприятном течении ВГВ/ВГD коинфекции выздоровление наступает примерно в 75% случаев;
– угроза развития хронического гепатита возникает примерно с той же частотой, что и при остром гепатите В (5–10%);
– в 5–25% случаев развивается фульминантная форма с летальным исходом (при остром гепатите В без дельта-агента фульминантная форма регистрируется в 0,5–1% случаев).
ВГВ/ВГD-суперинфекция
При ВГВ/ВГD-суперинфекции:
– клинически острая дельта (суперинфекция) характеризуется коротким (3–5 дней) преджелтушным периодом с лихорадкой, артралгиями, иногда болями в правом подреберье, выраженной интоксикацией и сохраняющейся на фоне появившейся желтухи высокой температурой тела, гепатоспленомегалией;
– у преобладающего большинства больных заболевание протекает волнообразно с повторными клинико-ферментативными обострениями, сопровождающимися нарастанием желтухи, симптомов интоксикации, развитием отечно-асцитического синдрома, кратковременными (1–2-дневными) волнами лихорадки с познабливанием, появлением эфемерной сыпи на коже (выраженность клинических симптомов у отдельных больных уменьшается при каждой новой волне);
– существенно нарушается белково-синтетическая функция печени, что проявляется диспротеинемией, снижением содержания альбуминов, увеличением содержания γ-глобулиновой фракции в сыворотке крови, повышением тимоловой пробы, снижением протромбинового времени (ПВ);
– в сыворотке крови обнаруживаются соответствующие маркёры инфицирования вирусами гепатитов В и D (HBsAg в сочетании с анти-ВГD IgM и/или анти-ВГD IgG, анти-HВсore IgG);
– часто регистрируются тяжелая и фульминантная формы заболевания;
– отмечается высокая вероятность неблагоприятных исходов — летального исхода (при фульминантной и тяжелой формах с развитием подострой дистрофии печени) или формирования хронического гепатита (примерно у 80% пациентов) с высокой активностью процесса и быстрым переходом в ЦП.
Развитие суперинфекции проявляется обострением до того благоприятно протекающего хронического гепатита В, появлением симптомов интоксикации, желтухи, повышением активности АлАТ и АсАТ, а в последующем прогрессированием в ЦП.
Для оценки тяжести состояния больных острым гепатитом В (с/без дельта-агента) необходимо ориентироваться на степень выраженности синдрома интоксикации, цитолитического синдрома, а также снижение белково-синтетической функции печени, приводящей к развитию геморрагического синдрома. Синдром печеночной интоксикации включает слабость, адинамию, снижение аппетита вплоть до его полного отсутствия, головокружение, диспептические и вегетососудистые расстройства. При нарастании интоксикации слабость усиливается, появляются тахикардия, тошнота и рвота, боли в животе, размеры печени сокращаются, определяются ее мягкая (тестоватая) консистенция, «печеночный» запах, развиваются симптомы печеночной энцефалопатии (сонливость, заторможенность или возбуждение, негативизм, апатия или агрессия, нарушение ритма сна, кошмарные сновидения, чувство «провалов», «хлопающий тремор», мелькание «мушек» перед глазами, эхолалия, сопор, прогрессирующий вплоть до полного отсутствия сознания, арефлексии), возникают кровотечения различной локализации, чаще всего из желудочно-кишечного тракта [3].
Сочетанное действие ВГВ и ВГD может приводить к развитию фульминантной формы ОВГ, характеризующейся острым тяжелым повреждением печени с нарушением ее синтетической функции, коагулопатией (международное нормализованное отношение — МНО >1,5; протромбиновый индекс — ПТИ <40%) и/или энцефалопатией у пациентов с отсутствием указаний на предшествующую патологию печени.
В зависимости от временного интервала от момента появления желтухи до развития названных симптомов выделяют: сверхострый, острый и подострый фульминантный гепатит. Указанные формы ОГ могут иметь клинические особенности и отличаться прогнозом. При сверхостром фульминантном гепатите, развившемся в пределах недели после появления желтухи, отмечается самый высокий, по сравнению с другими формами фульминантного гепатита, средний показатель выживаемости (до 30–40%). При острой печеночной недостаточности с развитием печеночной энцефалопатии в период от 8 дней до 4 недель от появления желтухи выживаемость больных самая низкая и составляет 5–10%. При подострой форме печеночной недостаточности печеночная энцефалопатия развивается в период от 5 до 24 недель после появления желтухи, выживаемость также низкая (10–20%), несмотря на то, что реже отмечается отек мозга и менее выражены признаки нарушения функции печени. В условиях отсутствия ортотопической трансплантации печени (ОТП) летальность при фульминантной форме гепатита любой этиологии достигает 80–90%.
ДИАГНОСТИКА ХРОНИЧЕСКОГО ГЕПАТИТА В
Естественное течение хронической ВГВ-инфекции
Исследования по длительному наблюдению естественного течения хронического гепатита В показали, что после установления диагноза кумулятивная частота развития цирроза печени в ближайшие 5 лет составляет от 8 до 20%, его декомпенсации в последующие 5 лет — 20%, а вероятность выживаемости больного компенсированным циррозом в течение 5 лет — 80–86%. У пациентов с декомпенсированным ЦП прогноз выживаемости в течение 5 лет крайне неблагоприятен и составляет 14–35%. Ежегодная заболеваемость гепатоцеллюлярной карциномой у больных с установленным диагнозом цирроза в исходе ХГВ составляет 2–5% и различается в ряде географических регионов.
Течение и исходы заболевания печени, вызванного инфицированием вирусом гепатита В, во многом определены взаимоотношениями иммунной системы организма человека и вируса. В ходе естественного течения хронической ВГВ-инфекции выделяют несколько фаз, не обязательно последовательно сменяющих друг друга. Фазы заболевания характеризуются присутствием или отсутствием в крови больного антигена вируса гепатита В — HBeAg (HBe-позитивный и HBe- негативный варианты хронического гепатита В), степенью активности АлАТ и уровнем виремии, а также гистологической картиной заболевания, при этом в зависимости от сочетания указанных признаков диагноз может быть сформулирован следующим образом: ХГВ, фаза иммунной толерантности; ХГВ, иммуноактивная фаза; неактивное носительство вируса гепатита В; ХГВ, фаза реактивации.
В течении ХГВ возможно как спонтанное, так и обусловленное лечением прекращение продукции HBeAg и вслед за этим появление в крови антител к нему (анти-HBe), что принято называть «сероконверсией по HBeAg». Спонтанная или обусловленная лечением сероконверсия по HBeAg обычно сопровождается снижением уровня ДНК ВГВ до минимальных значений вплоть до неопределяемого уровня; нормализацией активности АлАТ и АсАТ; значительным гистологическим улучшением — уменьшением степени некровоспалительных изменений (если пациент находился в иммуноактивной фазе HBe-позитивного гепатита В). Спонтанное прекращение активной репликации вируса, сопровождающееся сероконверсией по HBeAg, происходит с частотой 5–20% в год, преимущественно у молодых людей до 30 лет. Снижение вирусной нагрузки ниже 2000 МЕ/мл, а также активности гепатита до минимальной степени позволяет считать пациента неактивным носителем вируса гепатита В. Исчезновение HBsAg и сероконверсия с наличием анти-HBs в крови может происходить спонтанно в 1–3% случаев в год, обычно после нескольких лет постоянно отрицательного теста на наличие в крови ДНК ВГВ.
Фаза иммунной толерантности
Фаза иммунной толерантности регистрируется, как правило, у молодых, инфицированных в детстве людей, продолжается в среднем до 20–30-летнего возраста, характеризуется отсутствием иммунного реагирования на инфекцию ВГВ; как следствие у таких лиц не регистрируется гистологическая активность гепатита, показатели АлАТ и АсАТ в норме, определяется очень высокий уровень виремии — 108 МЕ/мл и выше.
Иммуноактивная фаза, или стадия иммунного клиренса
Иммуноактивная фаза, или стадия иммунного клиренса, характеризуется клинико-лабораторной картиной гепатита различной степени гистологической активности, повышением активности АлАТ и АсАТ, высоким уровнем виремии (106–1010МЕ/мл) на фоне сохраняющегося HBeAg и отсутствием анти-HBe. В основе патогенеза этой стадии болезни лежит иммуноопосредованный лизис гепатоцитов, инфицированных ВГВ. Длительность фазы иммунного клиренса различна (от нескольких лет до десятилетий), что, в свою очередь, определяет риск развития ЦП: он тем выше, чем дольше длится данная фаза болезни. Диагноз формулируется как хронический HBeAg-позитивный гепатит В*.
Спонтанная сероконверсия по HBeAg и переход заболевания в фазу иммунного контроля или неактивного носительства ВГВ** регистрируется у 25–50% пациентов в возрасте до 40 лет.
У 10–30% инфицированных ВГВ после сероконверсии HBeAg сохраняются уровень виремии в диапазоне 103–106 МЕ/мл и повышенная активность АлАТ — развивается хронический HBeAg-негативный гепатит В***.
* Критериями диагноза неактивного носительства ВГВ являются: отсутствие HBeAg и наличие анти-HBe, нормальные показатели АлАТ и АсАТ, а также уровень
ДНК ВГВ в крови, как правило, менее 2000 МЕ/мл.
** Критериями диагноза HBeAg-негативного хронического гепатита B являются: отсутствие HBeAg и наличие антиHBe, повышенные значения АлАТ и АсАТ, уровень ДНК ВГВ более 2000 ME/мл, умеренная или высокая активность гепатита по данным гистологического исследования ткани печени.
*** Критериями диагноза HBeAg-негативного хронического гепатита B являются: отсутствие HBeAg и наличие анти-HBe, повышенные значения АлАТ и АсАТ, уровень ДНК ВГВ более 2000 ME/мл, умеренная или высокая активность гепатита по данным гистологического исследования ткани печени
Фаза реактивации
В условиях иммуносупрессии пациент из статуса неактивного носительства может перейти в фазу реактивации ВГВ-инфекции и в этой ситуации вновь будут выявляться признаки хронического HBeAg-негативного гепатита В с высоким уровнем виремии, повышенной АлАТ и гистологически подтвержденным активным гепатитом. В отдельных случаях возможна реверсия анти-HBe/HBeAg и диагноз больного будет вновь формулироваться как HBeAg-позитивный гепатит В [47].
Существует вариант ВГВ-инфекции, когда HBsAg не обнаруживается, однако в плазме крови и/или ткани печени может выявляться ДНК ВГВ. Такую ВГВ- инфекцию называют латентной. Следует отметить, что об истинно латентной ВГВ-инфекции можно говорить лишь в том случае, если HBsAg не определяется современными высокочувствительными лабораторными методами (с чувствительностью не ниже 0,01 МЕ/мл). Часто при латентной инфекции в крови могут выявляться анти-HBc, а уровень виремии (если вирус обнаруживается в крови), как правило, низкий (менее 200 МЕ/мл). Клиническое значение латентной ВГВ-инфекции пока окончательно не определено, изучаются онкогенный потенциал данного варианта, его роль в прогрессировании заболевания у больных с поражением печени другой этиологии (ВГС, алкоголь и т. д.), а также возможность передачи вируса при переливании крови или органном донорстве, спонтанной или вследствие иммуносупрессии реактивации ВГВ с развитием хронического гепатита В [50].
В настоящее время можно считать установленными следующие факты, имеющие значение для клинической практики:
• роль HBsAg как единственного и основного маркёра скрининга ВГВ-инфекции требует пересмотра [27];
• клиренс HBsAg и наличие анти-HBs в сыворотке крови не являются абсолютным признаком элиминации вируса из организма [48, 50];
• латентная ВГВ-инфекция может быть причиной развития посттрансфузионного гепатита и поражения печени у реципиентов донорских органов, поэтому для скрининга крови и донорских органов на наличие ВГВ одного только теста на HВsAg недостаточно, необходимо также исследование на наличие анти-HBc и использование высокочувствительных методов для выявления ДНК ВГВ [65];
• длительная иммуносупрессивная терапия может привести к активации латентной ВГВ-инфекции с развитием тяжелого поражения печени вплоть до фульминантного гепатита, поэтому перед началом такой терапии требуется тщательное вирусологическое обследование, а при выявлении латентной ВГВ-инфекции необходим постоянный мониторинг в ходе и после лечения уровня виремии (количественное определение ДНК ВГВ в сыворотке крови) и биохимических печеночных тестов — АлАТ, АсАТ, гамма-глутамилтранспептидазы (ГГТП), щелочной фосфатазы (ЩФ) и фракций билирубина [38, 62];
• не исключается онкогенный потенциал латентной ВГВ-инфекции, при ее наличии требуется регулярное наблюдение за больным (динамический УЗ-контроль и определение уровня a-фетопротеина не реже 1–2 раз в год) [55, 61].
В табл. 2 представлены основные лабораторные и морфологические характеристики, позволяющие диагностировать фазу течения хронической ВГВ-инфекции и вариант хронического гепатита В.
Таблица 2. Лабораторные показатели и морфологическая характеристика хронической ВГВ-инфекции в зависимости от фазы течения заболевания и HBeAg-статуса пациента
Фаза хронической ВГВ-инфекции
Гистологическое исследование ткани печени
Уровень ДНК ВГВ, МЕ/мл
Иммунотолерантная фаза
Норма или минимально повышена
Минимальная активность гепатита или ее отсутствие, минимальный фиброз или его отсутствие
Высокий (10 8 –10 11 )
HBeAg-позитивный ХГВ
Степень активности гепатита выше минимальной с различной степенью выраженности фиброза
Высокий (10 6 –10 10 )
HBeAg-негативный ХГВ
Повышена постоянно или носит волнообразный характер
Степень активности гепатита выше минимальной с различной степенью выраженности фиброза
Средний, часто волнообразный
Неактивное носительство ВГВ
Минимальная активность гепатита или ее отсутствие, минимальный фиброз или его отсутствие
Низкий или не определяемый
Скрининг на гепатит В
Кому рекомендуется скрининговое обследование на гепатит В (А-I)
Обследование на гепатит В рекомендуется лицам, имеющим повышенный риск заражения парентеральными вирусными гепатитами (группы риска); лицам, которые могут стать источником инфекции для других (в силу выполнения своих профессиональных обязанностей или нахождения в условиях, способствующих передаче инфекции); лицам, относящимся к категориям, включенным в государственные скрининговые программы. Основным скрининговым маркёром гепатита В является HBsAg, для выявления которого следует использовать высокочувствительные диагностические тест-системы (рекомендуемая аналитическая чувствительность 0,01–0,1 МЕ/мл). Перечисленные группы регламентируются санитарно-эпидемиологическими правилами и другими документами по профилактике и эпидемиологическому надзору за гепатитом В [9, 11, 21, 32]. В эти группы входят:
1. Беременные женщины (в I и III триместрах беременности).
2. Реципиенты крови и ее компонентов, органов и тканей (при подозрении на гепатит В и в течение 6 месяцев с момента трансфузии или трансплантации).
3. Персонал медицинских организаций (при приеме на работу и далее 1 раз в год, дополнительно — по показаниям).
4. Пациенты центров и отделений гемодиализа, пересадки почки, сердечно-сосудистой и легочной хирургии, гематологии (при поступлении и при необходимости по клиническим и эпидемиологическим показаниям).
5. Пациенты перед выполнением плановых хирургических вмешательств, перед проведением химиотерапии (не ранее 30 дней до поступления или начала процедур).
6. Больные с хроническими заболеваниями, в том числе с поражением печени (в процессе первичного клинико-лабораторного обследования, дополнительно — по показаниям).
7. Пациенты наркологических и кожно-венерологических диспансеров, кабинетов, стационаров, исключая больных дерматомикозами и чесоткой (при постановке на учет и далее не реже 1 раза в год, дополнительно — по показаниям).
8. Опекаемые и персонал учреждений с круглосуточным пребыванием детей или взрослых (при поступлении и далее не реже 1 раза в год, дополнительно — по показаниям).
9. Контактные лица в очагах гепатита В (острой и хронических форм) — не реже 1 раза в год; через 6 месяцев после разобщения или выздоровления (смерти) больного.
10. Лица, относящиеся к группам риска по заражению ВГВ (при выявлении факторов риска):
– потребители инъекционных наркотиков и их половые партнеры;
– лица, оказывающие услуги сексуального характера, и их половые партнеры;
– мужчины, практикующие секс с мужчинами;
– лица с большим количеством случайных половых партнеров.
11. Лица, находящиеся в местах лишения свободы (при поступлении в учреждение, дополнительно — по показаниям).
12. Доноры крови (ее компонентов), органов и тканей, спермы (при каждой донации или каждом заборе донорского материала).
13. Дети, рожденные от инфицированных ВГВ матерей (при рождении, в возрасте 3, 6 и 12 месяцев и далее до 3 лет 1 раз в год).
14. Больные с иммунодефицитом (пациенты с онкологическими заболеваниями, лица, получающие лечение иммунодепрессантами и др.).
15. Пациенты с заболеваниями печени неясной этиологии (в процессе первичного клинико-лабораторного обследования).
Лабораторная диагностика гепатита В
С целью выявления лиц, инфицированных вирусом гепатита В, и дальнейшей диагностики заболевания используется ряд лабораторных методов исследования [9, 67].
Иммунохимические методы
Иммунохимические методы (иммуноферментный анализ — ИФА, иммунохемилюминесцентный анализ и др.) позволяют выявлять и в ряде случаев определять концентрацию некоторых антигенов ВГВ (HBsAg, HBeAg) и антител к антигенам ВГВ и ВГD (анти-HBs, анти-HBe, анти-HBc IgG, анти-HBc IgM, анти-ВГD IgG, анти-ВГD IgM) в сыворотке или плазме крови. Методы выявления антител в сыворотке крови иногда называют серологическими.
HBsAg (поверхностный антиген ВГВ) — основной маркёр, используемый для скрининга определенных групп населения с целью выявления лиц, инфицированных ВГВ (см. раздел «Скрининг на гепатит В»). Обнаруживается в сыворотке крови через 4–6 недель от момента инфицирования. Выявление в течение более 6 месяцев свидетельствует о формировании хронической инфекции. HBsAg не выявляется при скрытых (латентных) формах ГВ, однако частота таких форм невелика. Сообщалось о кратковременном (2–3 недели) выявлении HBsAg после вакцинации [42, 49].
Определение концентрации HBsAg
В последние годы стало доступным измерение концентрации HBsAg в сыворотке крови. Было показано, что определение уровня HBsAg может использоваться как дополнительный критерий при дифференциальной диагностике ХГВ и неактивного носительства ВГВ: концентрация HBsAg ниже 1000 МЕ/мл с большей вероятностью свидетельствует в пользу неактивного носительства вируса, хотя иногда может наблюдаться и при ХГВ [24]. Кроме того, этот показатель в ряде
случаев может применяться при мониторинге противовирусной терапии ХГВ с целью прогнозирования ее эффективности (см. раздел «Лечение хронического гепатита В»).
Анти-HBs — антитела к поверхностному антигену ВГВ. Как правило, выявляются у больных, перенесших инфекцию, и у лиц, которым проведена вакцинация от гепатита В. Определение концентрации анти-HBs используется для оценки напряженности поствакцинального иммунитета. Защитным является уровень антител выше 10 мМЕ/л. При концентрации ниже этого значения рекомендуется ревакцинация.
Aнти-HBc — антитела к белку нуклеокапсида ВГВ. Анти-HBc класса IgM являются маркёром ОГВ, однако могут выявляться и при обострении ХГВ, и при реактивации инфекции. Анти-HBс IgG — маркёр как перенесенной, так и хронической инфекции, сохраняются пожизненно и могут быть единственным серологическим маркёром латентной формы инфекции.
HBeAg — неструктурный белок ВГВ, косвенно указывающий на активную репликацию вируса. Является одним из ключевых маркёров при обследовании больных ХГВ, необходим для определения фазы течения инфекции (HBeAg-позитивный или HBeAg-негативный ХГВ) и контроля эффективности ПВТ (см. раздел «Лечение хронического гепатита В»).
Aнти-HBe — антитела к HBeAg, обнаруживаются в сыворотке крови после исчезновения HBeAg и продолжают персистировать многие годы. Сероконверсия по HBeAg является признаком благоприятного течения заболевания и свидетельствует о снижении активности вирусной репликации. Однако необходимо помнить, что встречаются мутантные штаммы ВГВ с нарушенным синтезом HBeAg. У пациентов, инфицированных такими штаммами, несмотря на наличие анти-HBе, может наблюдаться высокий уровень репликации вируса и неблагоприятное течение заболевания.
Анти-ВГD — антитела к дельта-антигену ВГD. Анти-ВГD класса IgM являются маркёром острой инфекции. При коинфекции обнаруживаются отсроченно (через 2–4 недели после появления клинических признаков ОГВ) и циркулируют в крови в течение 3–4 месяцев. При суперинфекции выявляются уже к началу острого периода заболевания и могут циркулировать длительное время. Анти-ВГD IgG — маркёр как перенесенной, так и хронической инфекции ВГD. Наиболее частые варианты сочетания маркёров ВГВ при различных формах ГВ и в разные фазы хронической инфекции представлены в табл. 3.
Таблица 3. Результаты лабораторных исследований при различных вариантах инфекции, вызванной ВГВ
Перенесенный ГВ
Иммунитет после вакцинации
Фаза иммунной толерантности
ХГВ, HBeAg- позитивный
ХГВ, HBeAg- негативный
Носительство ВГВ
ВГВ- инфекция
Aнти-HBc IgG
Aнти-HBc IgM
Молекулярно-биологические методы
Молекулярно-биологические методы (полимеразная цепная реакция — ПЦР, ПЦР в реальном времени, обратная гибридизация с зондами, прямое секвенирование и др.) позволяют выявлять ДНК ВГВ и РНК ВГD (в плазме крови или ткани печени), определять концентрацию ДНК ВГВ и РНК ВГD в плазме крови (вирусную нагрузку) и генотип ВГВ, обнаруживать мутации в геноме ВГВ, связанные с устойчивостью вируса к противовирусным препаратам.
Обнаружение ДНК ВГВ (качественное исследование)
ДНК ВГВ начинает обнаруживаться в крови в среднем через месяц после инфицирования и является первым диагностическим маркёром ГВ, опережая появление HBsAg на 10–20 дней [23]. Исследование на ДНК ВГВ позволяет проводить раннюю диагностику ОГВ, выявлять скрытые (латентные) формы гепатита и мутантные по HBsAg штаммы вируса. Кроме того, качественное исследование на ДНК ВГВ проводится для оценки вирусологического ответа при лечении аналогами нуклеозидов/нуклеотидов (см. табл. 2, 3). Для мониторинга эффективности ПВТ необходимо использовать высокочувствительные (ультрачувствительные) тесты, аналитическая чувствительность которых составляет не менее 20 МЕ/мл [9].
Качественное исследование на ДНК ВГВ проводится:
• контактным лицам в очаге ГВ;
• донорам крови, органов и тканей;
• больным с признаками хронического гепатита неуточненной этиологии;
• больным с подозрением на латентную форму ГВ;
• лицам, у которых выявляются анти-HBc при отсутствии HBsAg, перед проведением и в процессе иммуносупрессивной терапии (каждые 1–3 месяца);
• больным ХГВ во время лечения аналогами нуклеозидов/нуклеотидов.
Количественное определение ДНК ВГВ
Вирусная нагрузка измеряется в международных единицах на мл (МЕ/мл). Соотношение между ранее использовавшимися единицами (копиями) и МЕ в тест-системах разных производителей может быть различным — от 1,5 до 8 (при отсутствии данных о коэффициенте принято использовать усредненное значение 5, т. е. 1 МЕ = 5 копий). Большинство современных тестов для количественного определения ДНК ВГВ основано на ПЦР в реальном времени и имеет широкий линейный диапазон измерений — от 5–200 МЕ/мл до 10 8 –10 9 МЕ/мл [9].
Количественное определение ДНК ВГВ является принципиально важным условием обследования всех больных ХГВ. Этот анализ используется для уточнения фазы течения заболевания (ХГВ, неактивное носительство ВГВ), а также для мониторинга эффективности противовирусного лечения (см. табл. 11).
Определение генотипа вируса гепатита В
Выделяют 10 генотипов ВГВ, которые обозначаются латинскими буквами от A до J. Для каждого генотипа характерны определенные географические и этнические особенности распространенности. В Российской Федерации наиболее часто встречаются генотипы D и А, которые выявляются ориентировочно в 90 и 10% случаев соответственно. В некоторых регионах РФ доля генотипа А может быть значительно выше, например Республике Саха (Якутии) — до 50%, Кабардино-Балкарской Республике — более 30%. Генотип С является эндемичным для коренного населения Чукотского АО, где его доля достигает 25%. В остальных регионах РФ крайне редко регистрируются единичные и, как правило, завозные случаи инфекции, вызванные генотипом С ВГВ [9, 12, 30].
Клиническое течение и исход ХГВ могут зависеть от генотипа ВГВ. ХГВ, вызванный вирусом генотипов С и D, имеет больший риск прогрессирования, чем вызванный генотипом А [46]. Было показано, что частота ремиссии после сероконверсии по HBeAg, а также спонтанной элиминации HBsAg выше у пациентов с генотипом А по сравнению с генотипами C и D [60, 73].
Генотип ВГВ является фактором, от которого может зависеть эффективность противовирусной терапии. При лечении препаратами пегилированного интерферона (ПЭГ-ИФН) HBeAg-позитивных больных ХГВ наблюдается более высокая частота сероконверсии по HBeAg у пациентов с генотипом А, чем у пациентов с генотипами C и D [25, 33, 41, 43]. У HBeAg-негативных пациентов с генотипом D снижение концентрации ДНК ВГВ менее чем в 100 раз при отсутствии какого-либо снижения концентрации HBsAg на 12-й неделе лечения ПЭГ-ИФН свидетельствует о низкой вероятности ответа на ПВТ [58, 59]. Выявлено, что генотип ВГВ не влияет на вирусологический ответ при использовании аналогов нуклеозидов и нуклеотидов [70].
Определение генотипа ВГВ пока не вошло в рутинную практику, однако становится все более доступным. В настоящее время в РФ уже имеются зарегистрированные диагностические тест-системы для генотипирования ВГВ на основе ПЦР в реальном времени. Учитывая имеющиеся данные, определение генотипа ВГВ может быть рекомендовано при планировании противовирусного лечения препаратами ПЭГ-ИФН [9].
Определение мутаций устойчивости ВГВ к противовирусным препаратам
Лекарственная устойчивость (резистентность) — природная или приобретенная способность возбудителя болезни сохранять жизнедеятельность при воздействии на него лекарственных средств. Аналоги нуклеозидов и нуклеотидов ингибируют РНК-зависимую ДНК-полимеразу (обратную транскриптазу) ВГВ, встраиваясь в вирусный геном в процессе обратной транскрипции, и таким образом подавляют вирусную репликацию. При возникновении некоторых точечных мутаций в гене полимеразы ВГВ (мутаций устойчивости) аналоги нуклеозидов/нуклеотидов теряют способность встраиваться в растущую цепь ДНК вследствие конформационного изменения локуса связывания фермента.
Мутации устойчивости обозначаются номером позиции аминокислоты в домене обратной транскриптазы, причем аминокислота дикого типа указывается слева от номера, а вариант мутации устойчивости — справа. Например, M204I — замена метионина (М), аминокислоты дикого типа, в 204 положении домена обратной транскриптазы на аминокислоту изолейцин (I), наличие которой в данной позиции связано с возникновением мутации лекарственной устойчивости [9]. Наиболее хорошо изученные мутации устойчивости и их влияние на чувствительность вируса к противовирусным препаратам приведены в табл. 4.
Риск развития резистентности значительно отличается для разных препаратов (см. раздел «Лечение хронического гепатита В»). Перед началом ПВТ исследование на наличие мутаций резистентности рекомендуется только в случае, если пациент ранее уже получал препараты из группы аналогов нуклеозидов или нуклеотидов и лечение оказалось неэффективным или было прервано по другим причинам. В ходе противовирусного лечения данное исследование рекомендуется, если наблюдаются признаки первичной резистентности или вирусологического прорыва (см. табл. 11).
Таблица 4. Мутации устойчивости и чувствительность ВГВ к противовирусным препаратам [32, 45]
| Вариант мутаций в геноме ВГВ | Степень чувствительности к препарату | ||||
| ламивудин | телбивудин | энтекавир | адефовир | тенофовир | |
| M204I/V | R | R | I | S | S |
| N236T | S | S | S | R | I |
| A181T/V | R | R | S | R | I |
| A181T/V+N236T | R | R | S | R | R |
| L180+M204I/V±I169T±V173L±M250V | R | R | R | S | S |
| L180M+M204I/V±T184G±S202I/G | R | R | R | S | S |
Примечание. S — вирус чувствителен к препарату, R — вирус устойчив к препарату, I — чувствительность вируса к препарату снижена, возможно возникновение устойчивости.
Лечение
ЛЕЧЕНИЕ БОЛЬНЫХ ОСТРЫМ ГЕПАТИТОМ В
Лечение при остром гепатите В проводится в условиях инфекционного стационара, госпитализация больного обязательна [11].
В связи с тем что 90–95% больных острым гепатитом В выздоравливают, необходимость специфического противовирусного лечения у подавляющего большинства из них отсутствует [19]. Однако при тяжелой форме болезни с развитием печеночной комы могут быть использованы аналоги нуклеозидов. Основанием для такой стратегии могут являться имеющиеся, хотя и немногочисленные, данные о применении аналогов нуклеозидов/нуклеотидов. Лечение проводится одним из указанных препаратов в стандартной дозе 1 раз в сутки внутрь ежедневно: ламивудин (100 мг), энтекавир (0,5 мг), телбивудин (600 мг), тенофовир (300 мг) [32, 47].
Длительность курса лечения точно не определена, однако рекомендуется проводить противовирусную терапию (ПВТ) не менее 3 месяцев после сероконверсии к анти-HBs или, по крайней мере, 12 месяцев после HBe-сероконверсии в отсутствие потери HBsAg (B2). Если пациент направляется на трансплантацию печени, то риск инфицирования трансплантата уменьшается при снижении уровня вирусной нагрузки независимо от статуса по HBsAg.
Применение интерферона (ИФН) в случае фульминантного течения ОГВ противопоказано.
При выраженном диспептическом синдроме, нарастании интоксикации, развитии холестатичекого синдрома проводится инфузионная терапия с использованием растворов глюкозы и солевых растворов, объем, кратность введения и длительность применения которых определяются тяжестью состояния больного.
С целью деконтаминации кишечника и профилактики развития бактериальных осложнений назначают антибиотики широкого спектра действия.
В случае обнаружения холестатического синдрома для уменьшения зуда кожи назначают урсодезоксихолевую кислоту (8–10 мг на 1 кг массы тела в сутки), адеметионин (400–800 мг/сут внутривенно или внутримышечно, для поддерживающей терапии внутрь 800–1600 мг/сут), проводится витаминотерапия — витамин А и витамин Е (аевит по 1 капсуле 2 раза в день).
При тяжелом течении болезни с развитием печеночной комы должен рассматриваться вопрос о выполнении неотложной ОТП, поскольку проведение этой операции позволяет увеличить выживаемость больных с 15% (без трансплантации) до 60–80%. Больной должен находиться в отделении интенсивной терапии, показаны постельный режим, предпочтительно (если возможно) энтеральное питание, которое при ухудшении состояния может быть заменено парентеральным. Следует избегать значительного ограничения белков, в ежедневный рацион включается около 60 г белка, вводятся сбалансированные аминокислотные смеси. Важно следить за полноценным опорожнением кишечника, при отсутствии самостоятельного стула рекомендуются очистительные клизмы.
Кроме того, на ранних стадиях печеночной энцефалопатии назначается лактулоза по 30 мл 3–4 раза в день. Вводится витамин К (3,0 мл 1% раствора викасола внутримышечно 1 раз в сутки). Для профилактики генерализации бактериальной или грибковой инфекции, сепсиса назначают антибиотики широкого спектра действия (например, ампициллин по 1,0 г 4 раза в день внутримышечно, цефалоспорины III–IV поколения, фторхинолоны, карбапенемы и др.), противогрибковые препараты. Поддерживающая терапия основывается на мониторинге состояния больного, наблюдении за появлением неврологических симптомов, свидетельствующих о повышении внутричерепного давления, за гемодинамикой, функцией почек, уровнем глюкозы, электролитов, показателями кислотно-щелочного равновесия и пр. При появлении симптомов отека мозга необходимо провести интубацию трахеи для перевода больного в режим искусственной вентиляции легких (ИВЛ), приподнять головной конец кровати на 30°. Для седации используют пропофол.
При нарастании симптомов, указывающих на развитие внутричерепной гипертензии (гипертензия, брадикардия, нарушение дыхания, расширение зрачков и пр.) показано внутривенное введение маннитола из расчета 0,5–1,0 г/кг массы тела, при необходимости повторно. Снижению внутричерепного давления могут способствовать ИВЛ в режиме гипервентиляции (однако этот эффект кратковременен), применение барбитуратов (тиопентал или фенобарбитал), гипотермии.
Для достижения мочегонного эффекта используются антагонисты альдостерона (верошпирон 100–150 мг/сут). Психомоторое возбуждение может быть купировано низкими дозами бензодиазепинов (диазепам внутримышечно 2–5 мл 0,5% раствора), вводится натрия оксибутират в виде 20% раствора внутривенно медленно в дозе 70–120 мг/кг в сутки. Для лечения печеночной энцефалопатии показан L-орнитин-Lаспартат 20 г/сут, который предварительно разводят в 500 мл инфузионного раствора (максимальная скорость инфузии 5 г/ч, возможно повышение дозы до 40 г/сут).
В настоящее время считается, что кортикостероиды, которые часто использовались для предупреждения и лечения внутричерепной гипертензии с развитием отека мозга, не способствуют повышению выживаемости пациентов с острой печеночной недостаточностью.
Поскольку больные с фульминантным течением гепатита имеют высокий риск развития желудочно-кишечных кровотечений, необходимо в комплекс лечебных мероприятий включать блокаторы гистаминовых Н2-рецепторов или ингибиторы протонной помпы.
При наличии глубоких изменений в коагулограмме, развитии выраженного геморрагического синдрома, кровотечений различной локализации показаны трансфузии свежезамороженной плазмы, введение этамзилата натрия (2,0 мл 3 раза в сутки внутривенно), для угнетения фибринолиза назначают ингибиторы протеаз (гордокс, трасилол, контрикал), способствующие также снижению цитолиза гепатоцитов и уменьшению геморрагического синдрома.
Поддержание адекватного внутрисосудистого объема — важный этап в комплексной терапии больных с острой печеночной недостаточностью — осуществляется при помощи инфузий коллоидных и кристаллоидных растворов, трансфузий 20% раствора альбумина. Гемодинамические сдвиги могут быть корректированы введением допамина, адреналина.
Следует поддерживать метаболический гомеостаз, корригируя часто развивающиеся ацидоз, алкалоз, гипогликемию, снижение уровня фосфатов, магния и калия.
Фульминантное течение вирусных гепатитов может приводить к развитию полиорганной недостаточности, нередко — почечной недостаточности, что делает необходимым использование гемодиализа, плазмафереза. Предпринимались попытки использования биоискусственных систем с применением гепатоцитов человека или животных для выполнения экстракорпоральной детоксикации или замещения белково-синтетической функции печени; в небольших рандомизированных исследованиях было зарегистрировано повышение выживаемости пациентов при подострой печеночной недостаточности, однако FDA (Food and Drug Administration) рекомендует проведение дальнейших исследований в этой области. Большие надежды возлагали на проведение альбуминового диализа при помощи системы MARS (Molecular Adsorbent Recycling System), которая позволяет через полупроницаемую мембрану удалить из кровотока токсичные субстанции, в избытке накапливающиеся в организме больного с печеночно-клеточной недостаточностью. Но доказательств того, что имеющиеся в настоящее время искусственные системы поддержки печени надежно снижают летальность, не было получено, в связи с чем они не рекомендуются для использования вне клинических испытаний, их будущее в лечении острой печеночной недостаточности остается неясным [44].
ЛЕЧЕНИЕ ХРОНИЧЕСКОГО ГЕПАТИТА В
Основная цель лечения хронического гепатита В — профилактика прогрессирующего поражения печени с развитием ЦП и ГЦК, что возможно при условии стойкого подавления репликативной активности вируса и означает исчезновение ДНК ВГВ из сыворотки крови. В настоящее время среди суррогатных маркёров эффективности лечения также рассматривают нормализацию АлАТ и АсАТ, улучшение гистологической картины, клиренс или сероконверсию HBeAg (для HBeAg-позитивных больных) — см. табл. 11 [32].
Препараты, которые используются для лечения хронического гепатита В
Интерферон альфа представляет собой семейство различных низкомолекулярных белков, которые синтезируются фибробластами, эпителиальными клетками, гепатоцитами, дендритными клетками, B-лимфоцитами, моноцитами в ответ на вирусную и антигенную стимуляцию. Интерферон альфа связывается со специфическими мембранными рецепторами на поверхности клеток и индуцирует продукцию большого числа белков (фермента 2′5′-олигоаденилатсинтетазы, протеинкиназы, белка Mx и некоторых других), оказывающих непосредственное ингибирующее влияние на репликацию вирусов. Препарат характеризуется широким спектром нежелательных явлений, которые встречаются с различной частотой и, как правило, обратимы после прекращения лечения. Противопоказаниями являются декомпенсированный ЦП (альбумин 35 мкмоль/л, ПТИ <70%), выраженные психические нарушения, тяжелые заболевания сердца, неконтролируемая артериальная гипертензия, беременность.
Стандартный интерферон альфа вводят подкожно в дозе 5 млн ЕД ежедневно или 10 млн ЕД 3 раза в неделю. Рекомендованная продолжительность лечения при HBeAg-позитивном ХГВ 16–24 недели, при HBeAg-негативном — не менее 48 недель [47].
ПЭГ-ИФН альфа2а применяется в дозе 180 мкг, ПЭГ-ИФН альфа2b дозируется по массе тела пациента — 1,5 мг/кг; инъекции выполняются один раз в неделю в течение 48 недель. Основные предикторы ответа на терапию интерфероном альфа — исходно высокая активность АлАТ, низкий уровень виремии, генотип вируса А или В, отсутствие цирроза.
Аналоги нуклеозидов/нуклеотидов. Механизм действия этих препаратов основан главным образом на структурном сходстве с естественными нуклеозидами/нуклеотидами (ложные медиаторы), что позволяет им встраиваться в синтезируемую вирусом при своем размножении цепь РНК или ДНК и блокировать дальнейшее построение молекулы вируса. Препараты назначаются внутрь (1 таблетка в сутки).
Ламивудин (аналог цитидина) применяется в дозе 100 мг/сут. Для реализации противовирусного эффекта требуется внутриклеточное фосфорилирование неактивной формы ламивудина в трифосфат. Препарат быстро всасывается из желудочно-кишечного тракта (максимальная сывороточная концентрация достигается через 0,5–1,5 ч) и обладает хорошей биодоступностью (более 80%). Свыше 70% ламивудина выводится в неизменном виде с мочой в течение суток после приема внутрь, поэтому больным с нарушением функции почек необходима коррекция дозы (табл. 5).
В настоящее время ламивудин не рассматривается в качестве препарата первой линии терапии из-за способности вызывать мутации резистентности вируса к нему с дальнейшим снижением эффективности лечения и необходимости перевода больного на другой препарат.
Таблица 5. Режим дозирования ламивудина у больных с нарушением азотовыделительной функции почек
Клиренс креатинина, мл/мин
Рекомендуемая доза, мг/сут
Энтекавир (нуклеозидный аналог гуанозина) применяют в дозах 0,5 мг/сут (для первичных больных) и 1 мг/сут (для больных с резистентностью к ламивудину и больных с декомпенсированным ЦП). Рекомендуют принимать натощак, особенно пациентам с исходной резистентностью к ламивудину. Выводится из организма преимущественно почками, поэтому у больных с почечной недостаточностью требуется коррекция дозы в зависимости от скорости клубочковой фильтрации, оцениваемой по клиренсу креатинина (табл. 6).
Таблица 6. Дозировка энтекавира в зависимости от клиренса креатинина
Больные с исходной резистентностью к ламивудину
<10, гемодиализ* или длительный амбулаторный перитонеальный диализ
*Энтекавир следует принимать после сеанса гемодиализа.
Телбивудин (нуклеозидный аналог тимидина) применяют в дозе 600 мг/сут. У пациентов с нарушением функции почек необходима коррекция дозы (табл. 7).
Таблица 7. Режим дозирования телбивудина в зависимости от клиренса креатинина
Клиренс креатинина, мл/мин
Рекомендуемая доза, мг/сут
Тенофовир (нуклеотидный аналог аденина) назначают в дозе 300 мг/сут. У больных с нарушением функции почек требуется коррекция дозы (табл. 8), у всех пациентов до начала терапии и, если на то имеются клинические показания, во время ее проведения рекомендуется рассчитывать клиренс креатинина. У больных с риском развития нарушения функции почек следует проводить регулярный мониторинг расчетного клиренса креатинина и концентрации фосфора в сыворотке крови. Тенофовир не следует использовать одновременно с нефротоксическими лекарственными средствами или в случае недавнего использования препаратов подобного рода. Безопасность и эффективность его применения у лиц с клиренсом креатинина от 30 до 49 мл/мин не определены, и поэтому следует оценивать соотношение потенциальной пользы от терапии тенофовиром и возможного риска токсического воздействия на почки. Если все же есть необходимость использования препарата, то требуется коррекция интервалов между приемами. У таких больных следует вести тщательное наблюдение за функцией почек.
Таблица 8. Режим дозирования тенофовира в зависимости от клиренса креатинина
Клиренс креатинина, мл/мин
Препарат назначать не рекомендуется, включая пациентов, которым необходим гемодиализ
Целью противовирусной терапии является стойкое подавление вирусной репликации. Следующие за этим биохимическая ремиссия и гистологическое улучшение предупреждают развитие последствий заболевания (ЦП, ГЦК).
Как для HBeAg-позитивных, так и для HBeAg-негативных пациентов идеальной целью ПВТ служит клиренс HBsAg с/без сероконверсии в анти-HBs, что сопровождается полной ремиссией ХГВ и улучшением долговременного прогноза (А1). Однако следует отметить, что клиренс HBsAg — редко достижимая конечная точка терапии хронического гепатита В. Более реалистичной целью служит стойкая вирусологическая ремиссия.
Индукция устойчивого вирусологического, биохимического и серологического (сероконверсия HBeAg у HBeAg-позитивных пациентов) ответов в результате лечения у HBeAg-негативных пациентов (как HBeAg-позитивных на старте терапии с продолжительной по времени анти-HBe сероконверсией, так и исходно HBeAg-негативных) — основная цель терапии, поскольку ассоциируется с улучшением прогноза (А1).
Продолжительная вирусологическая ремиссия (неопределяемая чувствительной тест-системой ДНК ВГВ в крови) на фоне длительной ПВТ у HBeAg-позитивных пациентов, не достигших анти-НВе-сероконверсии, и у HBeAg-негативных пациентов служит наиболее удовлетворительным результатом лечения (А1).
Обследование пациента перед началом противовирусного лечения
Перед началом противовирусной терапии пациент должен быть обследован с обязательным определением тяжести поражения печени. Более того, все его родственники первой линии и его сексуальные партнеры должны быть обследованы на наличие маркёров ВГВ-инфекции (HBsAg, анти-HBc, анти-HBs) и вакцинированы, если перечисленные маркёры у них не определяются.
Обследование пациента для оценки тяжести повреждения печени должно включать:
– клинический анализ крови с обязательным подсчетом тромбоцитов и лейкоцитарной формулы;
– биохимические тесты: АлАТ, АсАТ, ГГТП, ЩФ, билирубин и его фракции, альбумин и глобулины;
– определение протромбинового времени (ПВ) или МНО;
– определение уровня α-фетопротеина;
– УЗИ брюшной полости.
Надо помнить, что на стадии гепатита активность АлАТ, как правило, выше активности АсАТ, при прогрессировании заболевания в цирроз это соотношение может меняться. Также в пользу развития ЦП обычно свидетельствуют уменьшение числа тромбоцитов, снижение концентрации сывороточного альбумина, повышение уровня гамма-глобулинов, удлинение ПВ или увеличение МНО.
Качественное и количественное определение ДНК ВГВ необходимо для диагностики ХГВ, принятия решения о назначении лечения и его последующего мониторирования (см Диагностика).
Перед началом противовирусной терапии у пациента необходимо устранить другие причины хронического повреждения печени: исследовать маркёры вирусов гепатита С, D, ВИЧ; исключить алкогольное, аутоиммунное повреждение печени, метаболические заболевания (стеатоз, стеатогепатит) и т. д. Целесообразно исследовать антитела к вирусу гепатита А и в случае их отсутствия провести вакцинацию против гепатита А.
Для определения степени некровоспалительной активности и стадии фиброза рекомендуется проведение биопсии печени, что оказывает принципиальное влияние на решение о необходимости противовирусного лечения. Альтернативой биопсии могут служить неинвазивные методы определения фиброза.
Гистологическая (биопсия печени) и неинвазивная диагностика фиброза при хроническом гепатите В
Морфологическая оценка гепатита В проводится по результатам пункционной биопсии печени (ПБП). Этот метод дает возможность установить степень выраженности фибротических и некровоспалительных изменений органа. Полученные данные легко интерпретируются и поддаются полуколичественной оценке. Исследование проводится в динамике с целью определения прогрессирования поражения печени при ХГВ. ПБП позволяет оценить вклад сопутствующих заболеваний (стеатогепатит, гемохроматоз, аутоиммунный гепатит и т. д.) в патологический процесс и их влияние на течение болезни и эффективность лечения [6, 16, 20]. Необходимо помнить ряд ограничений при проведении биопсии, в частности, имеют значение опыт врача, осуществляющего пункцию, и морфолога, оценивающего выявленные изменения, малый объем образцов ткани печени, инвазивность процедуры и дискомфорт для пациентов, риск развития осложнений. ПБП, являясь «золотым стандартом» диагностики ХГВ, требует строгого соблюдения правил ее выполнения в условиях специализированных отделений (требования к проведению процедуры подробно описаны в опубликованных ранее «Рекомендациях по диагностике и лечению взрослых больных гепатитом С» [20].
Морфологическая оценка хронического гепатита В
В этих целях применяются полуколичественные шкалы описания степени некровоспалительных изменений и стадии фиброза в ткани печени — Knodell, Ishak, METAVIR и пр. (табл. 9, 10) [6, 16, 20, 37].
Неинвазивная диагностика фиброза. В исследованиях, проведенных за рубежом и в России, подтверждена диагностическая точность эластографии (эластометрии) и лабораторных тестов крови — ФиброТест и ФиброМетр V в неинвазивной оценке стадий фиброза печени при хроническом гепатите В [6, 13, 14, 15, 20]. Комбинация эластометрии и лабораторных тестов повышает точность оценки стадии фиброза.
Эластометрия (как правило, проводится на аппарате «FibroScan») позволяет судить об изменении эластических свойств печени на основании отраженных вибрационных импульсов и их последующего компьютерного анализа. Применение эластометрии возможно на всех стадиях фиброза (F0–F4).
К преимуществам метода относятся:
• неинвазивность;
• воспроизводимость;
• больший, чем при биопсии (в 100–200 раз), оцениваемый объем ткани печени;
• быстрота и удобство применения (обследование занимает в среднем 5 мин);
• немедленный ответ;
• оценка эффективности терапии;
• возможность обследования детей.
Интерпретация результатов эластометрии затруднена в случаях:
– избыточной массы тела (ИМТ>35 кг/м2);
– выраженного стеатоза печени;
– высокой биохимической активности (АлАТ/АсАТ выше верхнего лимита нормы в 3 и более раз).
Критерии успешного результата исследования:
• интерквартильный коэффициент — не более 30% показателя эластичности;
• не менее 10 достоверных измерений в одной точке исследования;
• не менее 60% успешных измерений.
ФиброТест (компонент диагностической панели Фибро-АктиТест и ФиброМакс) включает 5 не коррелирующих между собой биохимических показателей: альфа-2-макроглобулин, гаптоглобин, аполипо-протеин А1, ГГТП и общий билирубин, которые позволяют оценивать выраженность фиброза посредством дискриминантной функции. С помощью данного теста можно дифференцировать фиброз (Fl–F3) от цирроза печени (F4).
Интерпретация результатов ФиброТеста затруднена в случаях:
– острого гепатита В;
– внепеченочного холестаза (рак поджелудочной железы, холедохолитиаз);
– острого гемолиза;
– доброкачественной гипербилирубинемии;
– острого воспалительного заболевания;
– после трансплантации печени.
ФиброМетр V (компонент диагностической панели ФиброМетр) включает 5 показателей биохимического и клинического анализов крови — альфа-2-макроглобулин, ГГТП, мочевина, ПТИ (%), тромбоциты, дающих возможность оценивать выраженность фиброза с помощью дискриминантной функции. Указанный тест позволяет дифференцировать умеренный фиброз (Fl–F2) от выраженного фиброза (F3) и от цирроза печени (F4).
Интерпретация результатов ФиброМетра V затруднена в случаях:
– детского возраста (до 18 лет);
– острого гепатита любой этиологии;
– почечной недостаточности;
Таблица 9. Морфологическая диагностика степени некровоспалительной активности гепатита
| Гистологический диагноз ХГ | METAVIR | Knodell (IV) | Ishak |
| Минимальная активность | А1 | 0–3 | 0–3 |
| Слабовыраженная активность | А1 | 4–5 | 4–6 |
| Умеренная активность | А2 | 6–9 | 7–9 |
| Выраженная активность | А3 | 10–12 | 10–15 |
| Выраженная активность с мостовидными некрозами | А3 | 13–18 | 16–18 |
Таблица 10. Морфологическая диагностика стадии заболевания печени (выраженности фиброза)
Портальный фиброз:
нескольких портальных трактов
большинства портальных трактов
Примечание. В последние годы для определения стадии заболевания печени чаще применяется шкала METAVIR.
Критерии эффективности лечения
Как уже упоминалось выше, критериями эффективности противовирусной терапии служат различные варианты ответа: биохимический, серологический, вирусологический и гистологический. Они используются в определенных временных промежутках как в период лечения, так после его окончания. Определение вирусологического ответа несколько отличается в зависимости от этапа ПВТ и используемых препаратов (препараты ИФН или аналоги нуклезидов/нуклеотидов) — табл. 11.
Прекращение терапии аналогами нуклеозидов/нуклеотидов в клинической практике встречается не часто, тем не менее это возможно в тех случаях, когда достигается устойчивый вирусологический ответ (УВО): аналогично ответу на ИФН его можно определить как снижение уровня ДНК ВГВ ниже 2000 МЕ/мл, что сохраняется не менее 12 месяцев после прекращения лечения.
Показания к противовирусной терапии
Показания к противовирусному лечению одинаковы как для HBeAg-позитивных, так и для HBeAg-негативных больных ХГВ и основываются на результатах исследования трех основных параметров — уровня вирусной нагрузки, активности АлАТ и тяжести поражения печени.
Лечение рекомендуется при повышении значений АлАТ, уровне виремии >2000 МЕ/мл и индексе гистологической активности или фиброза >1 балла по шкале METAVIR. Если пациент соответствует критериям лечения по уровню вирусной нагрузки и гистологической активности, то оно может быть начато и при нормальных показателях АлАТ. При назначении терапии следует учитывать возраст пациента, его общее состояние, наследственность по ГЦК, внепеченочные проявления ХГВ.
Выполнение биопсии печени и назначение противовирусной терапии необходимо отдельно рассматривать в следующих клинических ситуациях:
1. Иммунотолерантные пациенты.
В этой группе HBeAg-позитивные больные в возрасте до 30 лет с постоянно нормальным уровнем АлАТ и высокой вирусной нагрузкой, без признаков заболевания печени, отягощенной наследственности по циррозу или ГЦК не нуждаются в немедленном выполнении биопсии или проведении ПВТ. По отношению к ним требуется динамическое наблюдение с повторным обследованием каждые 3–6 месяцев. Если возраст таких пациентов выше 30 лет и/или они имеют отягощенный анамнез по циррозу или ГЦК, то должна рассматриваться возможность выполнения биопсии и назначения лечения.
HBeAg-негативные пациенты с постоянно нормальным значением АлАТ (контроль последней выполняется в среднем 1 раз в 3 месяца в течение не менее года), с уровнем ДНК ВГВ выше 2000 МЕ/мл, но ниже 20 000 МЕ/мл, без очевидных признаков заболевания печени не нуждаются в незамедлительном проведении биопсии или лечения (В1). Этим лицам необходимо тщательное динамическое наблюдение с измерением АлАТ каждые 3 месяца и уровня ДНК ВГВ каждые 6–12 месяцев в течение не менее 3 лет (С1). После 3 лет наблюдения в отношении них применяются те же принципы, что и ко всем неактивным хроническим носителям ВГВ.
2. Пациенты с активным течением ХГВ.
В данной группе HBeAg-позитивные и HBeAg-негативные больные с АлАТ выше нормы в 2 раза и уровнем ДНК ВГВ выше 20 000 МЕ/мл могут начинать противовирусное лечение без проведения биопсии печени (В1). Биопсия или исследование печеночной ткани неинвазивными методами у этой категории лиц могут быть полезны для диагностики, но, как правило, полученный результат не влияет на решение о проведении терапии (В1).
Как было указано выше, для лечения ХГВ применяются препараты ИФН и аналоги нуклеозидов/нуклеотидов, эффективность которых показана в табл. 12 и 13.
Таблица 11. Варианты ответа на противовирусную терапию
| Вариант ответа | Определение |
| Биохимический ответ |
Нормализация активности АлАТ. Оценивается каждые 3 месяца в процессе лечения и после его окончания
Нормальный уровень АлАТ в течение не менее 1 года после окончания лечения при исследовании не реже 1 раза в 3 месяца
Устойчивый серологический ответ по HBeAg
Серологический ответ по HBsAg
Отсутствие HBeAg с сероконверсией в анти-HBe в течение не менее 1 года после окончания лечения
Клиренс HBsAg с формированием анти-HBsAg (применим ко всем категориям больных ХГВ)
Вирусологический ответ при лечении препаратами ИФН/ПЭГ-ИФН
Устойчивый вирусологический ответ
Концентрация ДНК ВГВ ниже 2000 МЕ/мл в течение не менее 1 года после окончания лечения
Возрастание концентрации ДНК ВГВ выше 2000 МЕ/мл после окончания терапии (если в процессе лечения был достигнут вирусологический ответ)
Вирусологический ответ при лечении аналогами нуклеозидов/нуклеотидов
Первичная резистентность
Частичный вирусологический ответ
Снижение концентрации ДНК ВГВ менее чем в 10 раз
(на 1 log10) от начального уровня на 3-м месяце лечения
Неопределяемая ДНК ВГВ при исследовании тестом с высокой чувствительностью (не ниже 20 МЕ/мл). Оценивается каждые 3–6 месяцев в зависимости от тяжести поражения печени и используемого препарата*
Определяемая ДНК ВГВ на 6-м месяце лечения при условии, что ее концентрация снизилась более чем в 10 раз (на 1 log10) от начального уровня
Подтвержденное возрастание концентрации ДНК ВГВ более чем в 10 раз (на 1 log10) от минимального уровня, достигнутого в процессе лечения
Устойчивость ВГВ к противовирусным препаратам, подтверж-
денная выявлением мутаций в геноме вируса**
Снижение индекса гистологической активности не менее чем на 2 единицы и отсутствие признаков усугубления фиброза
Элиминация HBsAg при наличии биохимического и вирусологического ответов
Отсутствие HBsAg при сохранении биохимического и вирусологического ответов в течение не менее 1 года после окончания лечения
*При лечении препаратами с высоким генетическим барьером (энтекавир, тенофовир) исследование проводится 1 раз в 6 месяцев, при применении препаратов с низким генетическим барьером (ламивудин, телбивудин) — 1 раз в 3 месяца. Пациентам на стадии цирроза исследование проводится каждые 3 месяца вне зависимости от используемого препарата.
**Необходимо указать, какая именно из мутаций устойчивости выявлена. Показания к назначению исследования см. в разделе «Определение мутаций устойчивости ВГВ к противовирусным препаратам».
Таблица 12. Эффективность различных противовирусных препаратов у больных хроническим HBeAg-позитивным гепатитом В при лечении в течение года и более, %
| Показатель | ПЭГ-ИФН* | Ламивудин | Энтекавир | Телбивудин | Тенофовир | |
| альфа-2а | альфа-2b | |||||
| ДНК ВГВ | 14 | 7 | 36–44 | 67 | 60 | 76 |
| Сероконверсия HBeAg# При длительном лечении (годы) | 32 | |||||
8 (4,5 года наблюдения)
* Для ПЭГ-ИФН результат оценивался через 6 месяцев после окончания лечения.
# В 80–90% случаев вирусологический ответ (авиремия и сероконверсия HBeAg в анти-HBe) сохраняется после завершения лечения.
Таблица 13. Эффективность различных противовирусных препаратов у больных хроническим HBeAg-негативным гепатитом В при лечении в течение года и более, %
ПЭГ-ИФН альфа-2а*
*Для ПЭГ-ИФН результат оценивался через 6 месяцев после окончания лечения.
Предикторы успешного лечения до начала противовирусной терапии
1. Для пациентов, лечение которым проводится ИФН/ПЭГ-ИФН, при HBeAg-позитивном ХГВ предикторами сероконверсии в анти-HBe считаются исходно низкая вирусная нагрузка (ДНК ВГВ ниже 2×108 МЕ/мл), высокий уровень АлАТ (в 2–5 раз выше верхней границы нормы); генотипы А и В ассоциируются с большей частотой сероконверсии в анти-НВе и потерей HBsAg в сравнении с генотипами D и C [25, 33]. При HBeAg-негативном ХГВ четкие прогностические факторы успешного лечения до его инициации отсутствуют.
2. Для пациентов, лечение которым проводится аналогами нуклеозидов/нуклеотидов, при HBeAg-позитивном ХГВ предикторами сероконверсии в анти-НВе служат низкая вирусная нагрузка (ДНК ВГВ ниже 2×108 МЕ/мл), высокий уровень АлАТ, высокая активность патологического процесса по данным биопсии печени (А1). Генотип ВГВ не оказывает значимого влияния на вирусологический ответ.
Предикторы ответа в период противовирусной терапии
1. Для пациентов, лечение которым проводится ИФН/ПЭГ-ИФН, при HBeAg-позитивном ХГВ снижение уровня ДНК ВГВ ниже 20 000 МЕ/мл на 12-й неделе ассоциируется с 50% вероятностью анти-НВе-сероконверсии. Если за этим следует иммунологически опосредованное повышение активности АлАТ, то связь с вероятностью анти-НВе-сероконверсии становится еще более сильной. В недавно проведенных исследованиях было показано, что снижение уровня HBsAg менее 1500 МЕ/мл на 12-й неделе лечения служит четким предиктором анти-НВе-сероконверсии (С2). Напротив, уровень HBsAg более 20 000 МЕ/мл или отсутствие его снижения на 12-й неделе лечения ассоциируется с очень низкой вероятностью последующей анти-НВе-сероконверсии (С2). Показатель HBeAg на 24-й неделе лечения также может иметь предсказательное значение для последующей анти-НВе-сероконверсии (В2).
При HBeAg-негативном ХГВ снижение уровня ДНК ВГВ ниже 20 000 МЕ/мл на 12-й неделе терапии ассоциируется с 50% вероятностью устойчивого ответа после ее окончания. Комбинация отсутствия снижения уровня HBsAg с падением уровня ДНК ВГВ менее 2log10 МЕ/мл — предиктор отсутствия ответа на лечение для HBeAg-негативных европейцев с генотипом D (В2). Несколько недавних исследований доказали, что снижение величины HBsAg является предиктором УВО (по окончании терапии) и клиренса HBsAg. Однако необходимы дальнейшие исследования для оптимизации использования динамики HBsAg в клинической практике [59].
2. Вирусологический ответ (неопределяемый уровень ДНК ВГВ) на 24-й неделе лечения ламивудином или телбивудином ассоциируется с низкой вероятностью развития резистентности, повышением вероятности УВО как у HBeAg-позитивных, так и у HBeAg-негативных больных с более высоким шансом сероконверсии в анти-НВе у HBeAg-позитивных пациентов. Снижение уровня HBsAg во время лечения аналогами нуклеозидов/нуклеотидов у HBeAg-позитивных пациентов может свидетельствовать в пользу последующего клиренса HBeAg или HBsAg (С2).
Терапевтические стратегии
Для лечения ХГВ применяются два класса препаратов: интерферон (стандартный или пегилированный) и аналоги нуклеозидов/нуклеотидов [32].
Преимуществами интерферона-альфа являются отсутствие генотипической резистентности к лечению, недостатками — широкий спектр противопоказаний к лечению (в том числе декомпенсированный ЦП), а также нежелательных явлений.
К преимуществам аналогов нуклеозидов/нуклеотидов относят выраженное противовирусное действие (авиремия наблюдается в течение года в 65–80% случаев), удобный режим дозирования и низкую частоту нежелательных явлений, к недостаткам — быстрый рецидив после отмены терапии (что обычно лежит в основе неопределенно длительного периода лечения), возможность развития резистентности к лечению (минимальный риск при применении энтекавира и тенофовира).
Энтекавир и тенофовир, сильнейшие ингибиторы ВГВ с высоким барьером резистентности, могут с уверенностью использоваться как препараты первой линии (А1). Остальные аналоги нуклеозидов/нуклеотидов применяются, когда энтекавир и тенофовир недоступны либо в особых группах пациентов. Ламивудин из-за высокой частоты развития устойчивых штаммов вируса при длительном применении не относится к препаратам выбора в лечении ХГВ. Телбивудин, мощный ингибитор ВГВ, демонстрирует низкую частоту резистентности в случаях, когда исходная виремия составляет менее 2×108 МЕ/мл для HBeAg-позитивных больных и менее 2×106 МЕ/мл для HBeAg-негативных больных при условии авиремии через 6 месяцев терапии.
Лечение с определенной продолжительностью
Лечение с определенной продолжительностью проводится пегилированным ИФН, который по мере своей доступности заменил стандартный интерферон, поскольку его применение более удобно (вводится 1 раз в неделю). 48-недельный курс лечения ПЭГ-ИФН в основном рекомендуется HBeAg-позитивным пациентам с высокой вероятностью анти-НВе-сероконверсии. Эта форма терапии также может быть назначена HBeAg-негативным пациентам с факторами прогноза успешного лечения и достижения устойчивого вирусологического ответа (см выше).
Комбинация ПЭГ-ИФН с ламивудином не рекомендуется, так как не дает преимуществ в достижении УВО (А1) [41]. Сочетание ПЭГ-ИФН с телбивудином потенцирует противовирусный эффект, но не показано в клинической практике из-за высокого риска развития тяжелой полинейропатии (А1). Информация о комбинации ПЭГ-ИФН с другими аналогами нуклеозидов/нуклеотидов ограничена в связи с тем, что такая форма терапии в настоящее время не рекомендуется.
При назначении аналогов нуклеозидов/нуклеотидов лечение с определенной продолжительностью может быть рекомендовано HBeAg-позитивным пациентам при условии сероконверсии в анти-НВе, которая у них должна наступить в процессе терапии. Именно этот факт делает планирование противовирусного лечения непредсказуемым на его старте, поскольку время наступления сероконверсии в анти-НВе не известно.
Если при лечении аналогами нуклеозидов/нуклеотидов HBeAg-позитивных больных наступает сероконверсия в анти-НВе, то требуется консолидирующая терапия продолжительностью 12 месяцев. У таких пациентов предполагаемый УВО составляет 40–80% (В1).
Долгосрочная терапия аналогами нуклеозидов/нуклеотидов
Указанная стратегия применяется к пациентам с отсутствием прогностических факторов достижения УВО как до, так и во время терапии, например для HBeAg-позитивных больных без сероконверсии в анти-НВе на фоне лечения, а также для HBeAg-негативных больных. Эта же стратегия рекомендуется больным с циррозом печени независимо от их HBeAg-статуса или достижения сероконверсии в анти-НВе на фоне лечения (С1). Таким пациентам в качестве терапии первой линии рекомендуют энтекавир или тенофовир. Независимо от используемого препарата оптимальной целью лечения служит достижение стойкой и продолжительной авиремии.
У подавляющего большинства пациентов на фоне приема энтекавира или тенофовира в течение 3 и более лет поддерживается вирусологическая ремиссия.
Неудачи при проведении противовирусной терапии
Оценка эффективности противовирусной терапии требует четкого понимания формулировок «первичное отсутствие ответа (первичная резистентность)», «частичный вирусологический ответ» и «вирусологический прорыв» [32].
Первичное отсутствие ответа (первичная резистентность) крайне редко встречается при использовании любых аналогов нуклеозидов/нуклеотидов. В такой ситуации в первую очередь необходимо убедиться в том, что пациент следует рекомендациям врача и правильно и регулярно принимает назначенный препарат. Если феномен первичного отсутствия ответа действительно присутствует, необходимо исключить мутации вируса, которые приводят к резистентности, а затем выбрать правильную стратегию.
Частичный вирусологический ответ может встречаться при лечении аналогами нуклеозидов/нуклеотидов. В случае использования ламивудина или телбивудина (препараты с низким барьером резистентности) у пациентов с частичным вирусологическим ответом на 24-й неделе необходимо сменить терапию и назначить энтекавир или тенофовир (А1). Оптимальная лечебная тактика при частичном вирусологическом ответе на энтекавир или тенофовир в настоящее время еще обсуждается. Если у таких больных наблюдается снижение уровня ДНК ВГВ, лечение этими препаратами, имеющими высокий барьер резистентности, можно продолжить, но контроль уровня ДНК ВГВ должен осуществляться чаще (В1). Некоторые эксперты считают, что возможно добавление второго препарата при условии, что пациент правильно выполняет врачебные рекомендации; делается это для предупреждения резистентности в процессе долгосрочного лечения (С2).
Вирусологический прорыв у пациентов, четко следующих рекомендациям врача, означает формирование резистентных штаммов вируса. Наличие резистентности должно быть подтверждено (см. выше). Следует отметить, что вирусологический прорыв при назначении энтекавира и тенофовира встречается очень редко и, как правило, связан с нарушением врачебных рекомендаций.
Риск развития резистентности ассоциируется с высокой вирусной нагрузкой на старте лечения, ее медленным снижением в процессе терапии и субоптимальным выбором препарата. В случае развития резистентности необходимо назначение наиболее эффективного противовирусного препарата, не обладающего перекрестной устойчивостью с ранее используемым, чтобы минимизировать риск множественной резистентности (см.табл. 4).
В случае развития устойчивости к ламивудину, телбивудину или энтекавиру (встречается крайне редко у не леченных ранее больных) следует либо заменить их на тенофовир, либо добавить к ним тенофовир.
Резистентность к тенофовиру не описана, но если она появляется и подтверждается (как правило, в этих ситуациях речь идет о мультирезистентности), к лечению добавляется еще один нуклеоти(зи)дный аналог (энтекавир, телбивудин, ламивудин) либо выполняется замена тенофовира на энтекавир; условие — отсутствие ранее приобретенной устойчивости к ламивудину. Для пациентов с резистентностью к ламивудину в прошлом и развитием резистентности к тенофовиру предпочтительно добавление (а не замена) энтекавира (С2).
Мониторирование пациентов на фоне противовирусного лечения и правила его прекращения
На фоне лечения ИФН/ПЭГ-ИФН форменные элементы крови и уровень сывороточной АлАТ должны исследоваться каждый месяц, уровень тиреотропного гормона — каждые 3 месяца.
У HBeAg-позитивных больных HBeAg, анти-НВе, ДНК ВГВ должны быть исследованы на 6-м и 12-м месяцах лечения, а также через 6 и 12 месяцев после его окончания. Лечение можно считать успешным, если после его завершения сохраняются устойчивая сероконверсия в анти-НВе, нормальные показатели АлАТ и уровень ДНК ВГВ ниже 2000 МЕ/мл (А1). Тем не менее, пациенты с сероконверсией в анти-НВе нуждаются в длительном наблюдении из-за вероятности обратной сероконверсии в HBeAg или развития HBeAg-негативного ХГВ (А1). Через 12 месяцев после анти-НВе-сероконверсии у больных с неопределяемым уровнем ДНК ВГВ необходимо исследовать HBsAg, поскольку у них отмечается отсроченное исчезновение HBsAg. Если пациент становится HBsAg-негативным, то возникает необходимость определения у него анти-HBs. Если на фоне 3–6 месяцев применения ПЭГ-ИФН наблюдается быстрое снижение концентрации ДНК ВГВ и/или HBsAg, то успешность терапии повышается. Напротив, если у HBeAg-позитивных пациентов, получающих ПЭГ-ИФН, уровень HBsAg не снижается менее 20 000 МЕ/мл или вообще не происходит какой-либо динамики к 3-му месяцу лечения, то вероятность достижения анти-НВе-сероконверсии можно считать очень низкой, что дает основания рассматривать вопрос о прекращении терапии с применением ПЭГ-ИФН (С2).
При HBeAg-негативном ХГВ уровень сывороточной ДНК ВГВ необходимо измерять на 6-м и 12-м месяцах лечения, а также через 6 и 12 месяцев после его окончания. Устойчивый вирусологический ответ с уровнем ДНК ВГВ менее 2000 МЕ/мл обычно ассоциируется с ремиссией заболевания. Достижение неопределяемого уровня ДНК ВГВ можно рассматривать как идеальный вариант УВО с высокой вероятностью последующего клиренса HBsAg, определение которого рационально выполнять через 12 месяцев после окончания терапии. У тех больных, которые стали HBsAg-негативными, целесообразно исследовать анти-HBs. Вместе с тем HBeAg-негативные пациенты с устойчивым ответом после лечения с использованием ПЭГ-ИФН (неопределяемый уровень ДНК ВГВ через 12 месяцев после его окончания) все равно должны длительно наблюдаться, поскольку риск реактивации заболевания все-таки остается, хотя и уменьшается с каждым последующим годом (А1). Частота клиренса HBsAg увеличивается после окончания терапии пегилированным интерфероном, но только у лиц с устойчивым вирусологическим ответом (см. табл. 12 и 13).
В тех случаях, когда у HBeAg-негативных пациентов, в частности с генотипом D, на 3-м месяце применения ПЭГ-ИФН не обнаруживается какого-либо снижения уровня сывороточного HBsAg в сочетании с динамикой вирусной нагрузки ДНК ВГВ ≥2log10, вероятность УВО представляется очень низкой, что требует рассмотрения вопроса о прекращении использования ПЭГ-ИФН (В2).
Прекращение лечения аналогами нуклеозидов/нуклеотидов у HBeAg-позитивных пациентов
Обоснование: устойчивая сероконверсия в анти-НВе при уровне ДНК ВГВ менее 2000 МЕ/мл, нормальном значении АлАТ или даже клиренсе HBsAg (A1). Исследование HBeAg и анти-НВе необходимо выполнять каждые 6 месяцев, уровень ДНК ВГВ измерять каждые 3–6 месяцев в период лечения. Супрессия ДНК ВГВ до неопределяемого уровня с последующей сероконверсией HBeAg в анти-НВе ассоциируется с биохимическим и гистологическим ответом. Считается, что лечение аналогами нуклеозидов/нуклеотидов может быть закончено через 12 месяцев после сероконверсии HBeAg в анти-НВе, однако часть таких больных может нуждаться в возобновлении терапии из-за рецидива виремии и/или обратной сероконверсии анти-НВе в HBeAg. В целом, лечение аналогами нуклеозидов/нуклеотидов может продолжаться длительно до клиренса HBsAg с или без последующей сероконверсии в анти-HBs, особенно у пациентов с тяжелым фиброзом или циррозом печени. Требуется контролировать HBsAg с 12-месячным интервалом после сероконверсии HBeAg в анти-НВе.
Длительная терапия аналогами нуклеозидов/нуклеотидов
Для того чтобы избежать резистентности к препаратам, ДНК ВГВ должна подавляться до неопределяемого уровня (10–15 МЕ/мл), следовательно, ее мониторинг — необходимое условие лечения. Измерение ДНК ВГВ должно выполняться через 3 месяца от начала терапии аналогами нуклеозидов/нуклеотидов для оценки вирусологического ответа и далее каждые 3–6 месяцев. В период лечения энтекавиром и тенофовиром интервалы измерений ДНК ВГВ могут быть увеличены при условии эффективности терапии и соблюдении пациентом рекомендаций врача (С1).
Следует отметить, что клиренс HBsAg во время или после окончания лечения аналогами нуклеозидов/нуклеотидов как у HBeAg-позитивных, так и у HBeAg-негативных больных наблюдается редко и только при длительном лечении (см. табл. 12 и 13).
Рекомендуется следующий режим мониторирования почечной функции на фоне лечения: у пациентов без факторов риска повреждения почек в течение первого года — каждые 3 месяца, далее 1 раз в 6 месяцев при стойко хороших показателях; у пациентов с факторами риска повреждения почек — ежемесячно в течение первых 3 месяцев, затем при стабильных показателях — каждые 3 месяца до окончания первого года терапии и далее каждые 6 месяцев в случае отсутствия ухудшения почечной функции. Если на фоне лечения клиренс креатинина снижается до уровня менее 60 мл/мин или уровень фосфатов составляет менее 2 мл/дл, то мониторирование почечной функции должно быть очень тщательным [32].
В процессе лечения препаратами из группы аналогов нуклеозидов (ламивудин, телбивудин, энтекавир) рекомендуется исследование уровня сывороточного креатинина лишь у больных ХГВ, имеющих высокий риск почечных осложнений, и у данной группы пациентов режим мониторирования почечной фуккции должен быть таким же, как приведено выше для пациентов, получающих тенофовир и адефовир (С1) [32].
Лечение пациентов с циррозом печени
У пациентов с циррозом печени применение ИФН/ПЭГ-ИФН может повышать риск развития бактериальных инфекций и декомпенсации функции печени. Тем не менее, эти препараты могут быть назначены пациентам класса А по Чайлду–Пью в режиме, который аналогичен таковому для стадии гепатита.
Среди аналогов нуклеозидов/нуклеотидов предпочтение следует отдавать энтекавиру и тенофовиру, поскольку они обладают высокой противовирусной активностью и к ним редко развивается резистентность (А1). Ламивудин при циррозе назначать не рекомендуется [32].
Мониторирование уровня ДНК ВГВ должно выполняться очень тщательно — не менее 1 раза в 3 месяца как минимум в течение первого года лечения. Как правило, пациенты с ЦП требуют очень длительной терапии, контроль за которой необходим в целях своевременной диагностики лекарственной резистентности и/или обострения патологического процесса.
В клинических исследованиях показано, что длительная и адекватная супрессия ДНК ВГВ может стабилизировать состояние пациентов, предупреждать прогрессирование заболевания и декомпенсацию функции печени (А1), а также приводить к обратному развитию фиброза и даже цирроза. И все же, несмотря на вирусологическую ремиссию на фоне приема аналогов нуклеозидов/нуклеотидов, пациенты с ЦП должны мониторироваться на предмет развития ГЦК (В1).
Прекратить противовирусное лечение в случаях цирроза печени можно только в следующих ситуациях:
– у HBeAg-позитивных пациентов в случае достижения сероконверсии по е-антигену (образование анти-НВе) или клиренса HBsAg и образования анти-HBs (что считается идеальным) и при проведении после этого консолидирующей терапии в течение не менее года;
– у HBeAg-негативных пациентов в случае клиренса HBsAg, образования анти-HBs и проведения после этого консолидирующей терапии в течение не менее года.
Больные с декомпенсированной функцией печени должны наблюдаться и лечиться в специализированных гепатологических подразделениях, поскольку они получают комплексную терапию и, как правило, являются кандидатами для пересадки печени. Противовирусное лечение таким пациентам назначается вне зависимости от уровня ДНК ВГВ. Препараты интерферона им противопоказаны, а среди аналогов нуклеозидов/нуклеотидов предпочтение должно отдаваться энтекавиру и тенофовиру (А1). Больным с декомпенсированной функцией печени энтекавир назначается в дозе 1 мг в сутки в отличие от дозы 0,5 мг в сутки для пациентов с компенсированной функцией печени.
Как показали последние исследования оба препарата (энтекавир и тенофовир) безопасны при декомпенсированном ЦП. Более того, функция печени у этих пациентов может улучшаться через 3–6 месяцев терапии, что позволяет даже избежать трансплантации печени. Лечение нужно проводить пожизненно. Риск развития ГЦК у таких больных остается высоким, что требует регулярного наблюдения.
В отсутствие улучшения функции печени необходима трансплантация. ДНК ВГВ на момент выполнения операции должна быть неопределяемой, лечение аналогами нуклеозидов/нуклеотидов надо продолжать, что снижает риск инфицирования трансплантата [32].
Лечение особых групп пациентов
Больные хроническим гепатитом В с дельта-агентом (ХГD)
ХГВ с дельта-агентом характеризуется, как правило, неуклонно прогрессирующим течением и возможностью быстрого (на протяжении 10 лет) формирования ЦП, в связи с чем большинству пациентов показана противовирусная терапия. Единственным методом лечения с доказанной эффективностью является интерферонотерапия.
Целесообразность назначения ИФН определяется индивидуально для каждого больного только после исследования на наличие репликации как ВГD, так и ВГВ методом ПЦР. Интерферонотерапия предусматривает введение больших доз стандартного интерферона (5–10 млн МЕ в день) трижды в неделю длительным курсом (не меньше 12 месяцев) или применение пегилированного интерферона в стандартных для ХГВ дозах. При плохой переносимости допустимо снижение дозы ИФН или подбор индивидуальной дозы в каждом конкретном случае.
Оценка эффективности лечения проводится не ранее чем через 24–48 недель по наличию или отсутствию РНК ВГD или путем определения ее уровня в крови. Терапию требуется проводить не менее года, имеются данные, что продление ее на более продолжительный срок (2 и более года) увеличивает вероятность получения устойчивого вирусологического ответа, однако оптимальная длительность лечения не установлена. У 25–40% пациентов удается достичь УВО (неопределяемый уровень РНК ВГD) в сочетании с улучшением гистологии печени. Однако до настоящего времени не определено, как долго должно регистрироваться отсутствие РНК ВГD в крови после отмены терапии, чтобы можно было констатировать устойчивый вирусологический ответ. Нуклеози(ти)дные аналоги не воздействуют на вирус гепатита дельта, но лечение этими препаратами может быть назначено пациентам с наличием активной репликации ВГВ — с постоянным или флюктуирующим уровнем вирусной нагрузки ДНК ВГВ выше 2000 ME/мл [32].
Пациенты с реактивацией ВГВ-инфекции на фоне медикаментозной иммуносупрессии
Реактивация ВГВ-инфекции наиболее подробно изучена у больных с онкогематологической патологией, получающих химиотерапию, но описана и на фоне лечения солидных опухолей. Кроме того, реактивация может наблюдаться в процессе посттрансплантационной иммуносупрессии, длительной терапии кортикостероидами и ингибиторами фактора некроза опухолей альфа [32]. В большинстве случаев реактивация ВГВ отмечается у HBsAg-позитивных больных, однако возможна и у HBsAg-негативных/анти-HBc-позитивных лиц. Чаще всего данный феномен регистрируется при применении ритуксимаба (анти-CD20), несколько реже — алемтузумаба (анти-CD-52).
Систематический обзор продемонстрировал, что в отсутствие профилактики аналогами нуклеозидов/нуклеотидов реактивация ВГВ отмечена в 36,8%, манифестация гепатита — в 33,4%, печеночная недостаточность — в 13%; летальность при этом составила 5,5%. Профилактика ламивудином снижала риск реактивации на 79%, при этом не были зафиксированы случаи ВГВ-ассоциированной печеночной недостаточности, что сопровождалось более низким уровнем общей летальности. Вместе с тем применение аналогов нуклеозидов/нуклеотидов при уже развившемся гепатите B менее эффективно и может сопровождаться клинически манифестным повреждением печени в 13–36% случаев.
Реактивация ВГВ — абсолютное показание для временного прекращения химиотерапии и немедленного назначения противовирусных средств. Естественно, что подобное вмешательство в стратегию лечения злокачественного новообразования не улучшает прогноз последнего. Следовательно, профилактическое назначение аналогов нуклеозидов/
нуклеотидов пациентам из групп риска является необходимым условием предотвращения неблагоприятных клинических последствий, что подтверждается рядом ретроспективных исследований. Анализ крови на HВsAg, анти-HBc и анти-HBs позволяет идентифицировать лиц с хронической, латентной и перенесенной ВГВ- инфекцией. HBsAg-позитивным пациентам, независимо от варианта ВГВ-инфекции (носительство или иммуноактивный гепатит), требуется незамедлительное начало противовирусной терапии
перед назначением препаратов моноклональных антител. Представляются обоснованными инициация лечения аналогами нуклеозидов/нуклеотидов перед назначением иммуносупрессоров и ее пролонгация до полного восстановления иммунной системы под контролем сывороточной ДНК ВГВ и уровня АлАТ.
У HBsAg (+) кандидатов на проведение химио- или иммуносупрессивной терапии необходимо определять уровень ДНК ВГВ для последующего динамического контроля. Они должны получать аналоги нуклеозидов/нуклеотидов в качестве упреждающей терапии на всем протяжении курса иммуносупрессии независимо от уровня ДНК ВГВ и в течение 12 месяцев после прекращения лечения. Лицам с высоким уровнем ДНК ВГВ в крови и/или тем, кому планируются длительные и повторные курсы иммунносупрессивной терапии, рекомендуется назначать аналоги нуклеозидов/нуклеотидов с высокой противовирусной активностью и высоким барьером для развития резистентности, т. e. энтекавир — 0,5 мг/сут для первичных пациентов и 1 мг/сут для получавших лечение ламивудином — или тенофовир (300 мг/сут).
HBsAg-негативные пациенты с положительными анти-HBc должны быть протестированы на уровень ДНК ВГВ. HBsAg-отрицательных, анти-HBc положительных больных с определяемой сывороточной ДНК ВГВ следует лечить так же, как и HBsAg-позитивных. У HBsAg-отрицательных, анти-HBc-положительных пациентов с неопределяемым уровнем ДНК ВГВ, независимо от статуса по анти-HBs, получающиххимио- и/или иммуносупрессивную терапию, необходимо мониторировать количественным методом уровень ДНК ВГВ в крови и степень активности АлАТ. Терапия аналогами нуклеозидов/нуклеотидов показана при подтверждении реактивации ХГВ, что означает наличие определяемого уровня ДНК ВГВ еще до повышения активности АлАТ.
Контроль показателей АлАТ в течение первого месяца химио- или иммуносупрессивной терапии осуществляется еженедельно, затем 1 раз в месяц. Тестирование на наличие ДНК ВГВ в крови количественным методом ПЦР необходимо выполнять через 4 и 12 недель от начала лечения, затем — каждые 3 месяца на фоне терапии [32].
Трансплантация печени у больных хроническим гепатитом В и ХГВ с дельта-агентом
Трансплантация печени является единственным радикальным методом лечения больных с терминальными стадиями хронического гепатита В и ХГВ с дельта-агентом. В Лист ожидания трансплантации включают больных, тяжесть цирроза у которых соответствует классам В и С по классификации Чайлда–Пью, пациентов с начальными стадиями ГЦК (обычно в пределах Миланских или Калифорнийских критериев), а также больных с повторными кровотечениями из варикозно-расширенных вен пищевода.
В отсутствие профилактики ортотопическая трансплантация печени у пациентов с ЦП ВГВ-этиологии ассоциирована с высокой частотой потери трансплантата и низким уровнем выживаемости реципиентов при развитии возвратной инфекции ВГВ. Прогрессирование ГВ в трансплантате происходит значительно быстрее, чем в печени реципиента до операции. В связи с этим в 80-е годы прошлого века в большинстве трансплантационных центров мира цирроз ВГВ-этиологии рассматривался как противопоказание к ОТП. Девяностые годы минувшего столетия ознаменовались внедрением в клиническую практику специфического иммуноглобулина против гепатита В человека (HBIG), позволившего значительно снизить частоту возвратной инфекции ВГВ.
Эффективная профилактика инфекции ВГВ после ОТП обусловлена наличием анти-HBs в достаточном для защиты количестве (не менее 500 мМЕ/мл вскоре после ОТП и не менее 100 мМЕ/мл в отдаленные сроки — данные разных авторов отличаются). Наличие анти- HBs может быть обеспечено двумя путями: введением HBIG или активной иммунизацией (вакцинацией) больных. Другой возможностью предотвратить развитие дисфункции трансплантата, связанной с репликацией ВГВ после ОТП, является назначение аналогов нуклеози(ти)дов. Ламивудинотносительно безопасен при длительном применении, но его использование ограничивается быстрым развитием лекарственной резистентности с непредсказуемым течением заболевания, вызванного мутантным штаммом ВГВ.
Применение HBIG является стандартом профилактики возвратной инфекции ВГВ у больных, перенесших ОТП по поводу терминальных стадий хронического гепатита B. Риск возврата ВГВ в течение 3 лет после операции у реципиентов, не получавших или получивших короткий курс HBIG, в 2 раза выше, чем у реципиентов, получавших HBIG более 6 месяцев. При проведении длительной профилактики высокими дозами HBIG у взрослых реципиентов, перенесших ОТП по поводу ЦП в исходе гепатита B, возвратная инфекция ВГВ в течение 5 лет наблюдается в 7–10% случаев.
Для сведения к минимуму риска возвратной инфекции после ОТП необходимо обеспечение уровня анти-HBs более 500 мМЕ/мл на протяжении первой недели, более 250 мМЕ/мл со 2-й по 12-ю неделю и поддержание в дальнейшем уровня более 100 мМЕ/мл.
Сегодня в большинстве центров применяется комбинированная профилактика возвратной инфекции ВГВ, включающая внутривенное введение высоких доз HBIG в сочетании с ламивудином (или другими аналогами нуклеозидов/нуклеотидов). HBIG начинают вводить внутривенно во время беспеченочного периода операции в дозе 10 000 МЕ, продолжают инъекции ежедневно в течение первой недели по 2000 МЕ, затем 1 раз в 2 недели в течение 6–12 месяцев после ОТП в дозах 500–2000 МЕ. Дозу HBIG в эти сроки следует определять индивидуально под контролем содержания анти-HBs в крови.
Комбинированная профилактика (HBIG и ламивудин) позволила снизить риск возвратной инфекции ВГВ до 5% в течение 5 лет после операции.
В практике российских трансплантологов используется препарат HBIG отечественного производства для внутримышечного введения. Рекомендуемая схема: в первые 7 дней после ОТП — по 800 МЕ, в последующем по 400– 800 МЕ 2 раза в месяц. При этом стоимость терапии удается снизить более чем на 50%. Обсуждается возможность отмены HBIG после 2 лет иммунопрофилактики с последующей монопрофилактикой ламивудином. Новые аналоги нуктеози(ти)дов (энтекавир и тенофовир) могут оказаться перспективными в проведении как до-, так и послеоперационной профилактики инфекции ВГВ, но их применение у реципиентов печени нуждается в дальнейшем исследовании [34, 64]. В настоящее время накоплены данные по эффективности энтекавира в предупреждении рецидива ХГВ после трансплантации печени как в комбинации с НBIG, так и в качестве монотерапии (A2) [56].
Привлекательной стратегией, которая могла бы обеспечить анти-HBs в достаточной концентрации, является активная иммунизация пациентов, находившихся в Листе ожидания, сегодня и после ОТП. Коммерчески доступные рекомбинантные вакцины используются для профилактики инфекции ВГВ в различных группах пациентов и имеют хороший профиль безопасности. Содержание анти-HBs более 10 мМЕ/мл считается достаточным для обеспечения защиты от инфекции ВГВ у иммунокомпетентных больных. Для эффективного предотвращения инфекции ВГВ после ОТП рекомендуется поддерживать содержание анти-HBs на уровне более 100 мМЕ/мл.
Вакцинацию против ВГВ после трансплантации печени целесообразно проводить всем реципиентам, не имеющим серологических признаков HBs-системы (HBsAg и анти-HBs). Рекомбинантную вакцину вводят в дозе 40 мкг трехкратно с интервалом в месяц. Возможно повторное введение бустерных доз вакцины. Существующие режимы вакцинации против ВГВ способны обеспечить адекватную защиту не более чем у трети больных. У большинства из них анти-HBs быстро исчезают в раннем посттрансплантационном периоде на фоне иммуносупрессивной терапии.
Для лечения возвратной инфекции ВГВ рекомендовано пожизненное применение аналогов нуктеози(ти)дов с высоким барьером к развитию лекарственной резистентности (энтекавир, тенофовир). Энтекавир назначают в дозе 0,5 мг/сут ежедневно всем пациентам, которые не получали ранее ламивудин и не имеют устойчивых к ламивудину штаммов ВГВ. Больным с опытом применения ламивудина или с доказанной лекарственной устойчивостью к нему целесообразно назначать энтекавир в дозе 1 мг/сут или тенофовира 300 мг/сут. Основной целью лечения возвратной инфекции ВГВ является замедление прогрессирования ХГB трансплантата. Применение аналогов нуктеози(ти)дов в большинстве случаев приводит к эффективному контролю над репликацией ВГВ, но сероконверсия в анти-HBs происходит редко.
Если ОТП проведена по отличным от гепатита B причинам, а в посттрансплантационном периоде у реципиента в крови впервые появились HBsAg и ДНК ВГВ, такой вариант инфекции ВГВ обозначают термином «de novo». Основным источником инфекции ВГВ de novo является печень, полученная от донора, у которого в сыворотке крови определялись анти-HBc, т. е. у перенесшего ранее гепатит B. Риск заражения реципиента без маркёров ВГВ-инфекции через трансплантат, полученный от анти-HBc-положительного донора, при отсутствии профилактики составляет34–86%. При наличии у реципиента анти-HBs и/
или анти-HBc частота развития инфекции ВГВ de novo значительно ниже, чем у реципиентов, не имевших никаких маркёров инфекции в дотрансплантационном периоде.
В лечении ВГВ-инфекции трансплантата de novo препаратами выбора также являются аналоги нуктеози(ти)дов. При их назначении у большинства больных инфекция ВГВ de novo протекает циклически и в течение 2 лет завершается клиренсом HBsAg, а в последующем сероконверсией в анти-HBs.
Пациенты, перенесшие трансплантацию печени по поводу сочетанной инфекции ВГВ/ВГD, должны наблюдаться и получать профилактику HBIG и аналогами нуклеозидов по таким же схемам, как и больные, перенесшие ее по поводу терминальных стадий моноинфекции ВГВ. К основным отличиям, характеризующим данную группу больных, можно отнести более низкий уровень (вплоть до неопределяемого) репликации ВГВ до трансплантации и соответственно более редкое возникновение возвратной инфекции после нее. Однако в случае возобновления репликации ВГВ после трансплантации она нередко сопровождается одновременно репликацией ВГD, что приводит к развитию активного гепатита и быстрой потере трансплантата [51, 52].
ГЕПАТИТ В У БЕРЕМЕННЫХ
Целесообразность и безопасность назначения противовирусных препаратов во время беременности и обоснование применения пассивной и активной иммунизации для снижения риска перинатальной передачи инфекции вирусом гепатита В
Во время беременности у HBsAg-позитивных женщин, как правило, не отмечается обострений ХГВ, уровень активности печеночных ферментов часто нормализуется, если исходно он был повышен. Однако имеется несколько сообщений о развитии обострений ХГВ в период беременности, вплоть до развития фульминантной печеночной недостаточности [72]. У некоторых женщин отмечаются обострения гепатита в первые месяцы после родов. Описаны также случаи фульминантного гепатита у детей, рожденных от женщин, больных ХГВ [28].
Реализация универсальной программы скрининга беременных и пассивно-активная иммунопрофилактика новорожденных позволили сократить передачу ВГВ-инфекции на 5–10% [68]. Тем не менее, до 30% детей, рожденных от матерей-носителей ВГВ с наличием высокого уровня виремии, оказываются резистентными к проводимой иммунопрофилактике. Результаты недавно проведенного крупномасштабного исследования, включавшего 1043 наблюдения, показали, что существует линейная корреляция между уровнем материнской ДНК ВГВ и частотой неудач иммунопрофилактики. Неэффективная иммунопрофилактика чаще регистрируется при уровне виремии у матери более 200 000 МЕ/мл [35].
В таких случаях противовирусная терапия должна быть рекомендована для снижения риска перинатальной передачи ВГВ от матери (см. рисунок). Несмотря на относительно небольшое количество нерандомизированных исследований, посвященных данному вопросу, и низкий уровень доказательности каждого из них в отдельности, в рекомендациях можно опираться на проведенный мета-анализ исследований по результатам сочетания противовирусной терапии (ламивудин или телбивудин) в третьем триместре беременности и пассивно-активной иммунизации новорожденных, который продемонстрировал, что такой подход снижает вероятность передачи вируса гепатита В новорожденному и не наносит ему дополнительного вреда [40].
Получены новые данные по безопасности применения противовирусных препаратов группы нуклеози(ти)дных аналогов в период беременности, которые легли в основу европейских рекомендаций (EASL 2012) по тактике ведения беременных женщин с ХГВ и профилактике инфицирования новорожденных [32, 66].
Неблагоприятные последствия, зарегистрированные при использовании аналогов нуклеози(ти)дов во время беременности, включают лактоацидоз и острую жировую дистрофию печени. О развитии фатального лактоацидоза сообщалось только у грудных детей, чьи матери принимали в период беременности антиретровирусные препараты. Подобных случаев не было отмечено у младенцев, рожденных матерями с ХГВ, принимавшими противовирусную терапию по поводу гепатита В [53].
В соответствии с классификацией лекарственных средств по риску воздействия на плод, предложенной FDA, ламивудин и энтекавир относятся к катергории С, телбивудин и тенофовир — к категории B [32].
Данные проведенных исследований демонстрируют, что доля врожденных дефектов, связанных с приемом ламивудина и тенофовира во время беременности, была сопоставима с таковой в общей популяции [29].
Есть сообщения о безопасности использования телбивудина и ламивудина в 700 случаях беременности в сравнении с отсутствием противовирусной терапии, показавшие, что лишь 0,97% детей родились с врожденными дефектами в группе лечения по сравнению с 1,7% случаев в группе контроля (р>0,05). В отсутствие ПВТ 8% детей родились HBsAg-позитивными с положительной ДНК ВГВ в крови [26, 39, 71]. Безопасность применения энтекавира при беременности изучена недостаточно.
Таким образом, полученные на настоящий момент данные клинических наблюдений позволяют сделать заключение, что применение ламивудина, телбивудина и тенофовира в III триместре беременности безопасно и оправдано в сочетаниис пассивной (иммуноглобулин) и активной вакцинацией новорожденного для предотвращения внутриутробной и перинатальной передачи ВГВ ребенку при наличии высокого уровня виремии на фоне беременности у матери.
Применение препаратов интерферона при беременности противопоказано [32].

Тактика ведения беременных женщин с ВГВ-инфекцией
* Уровень ДНК ВГВ в крови у матери 6–8 log10 МЕ/мл может быть основанием для принятия решения о начале противовирусной терапии, но должен базироваться на совместном решении врача и пациентки [54].
** Тенофовир предпочтителен, если ожидается, что лечение продлится более 12 недель или будет проводиться на фоне грудного вскармливания.
Тактика ведения беременных с наличием высокого уровня виремии ВГВ и не получавших до наступления беременности противовирусную терапию
Согласно положениям, изложенным в EASL (2012), рекомендовано применение противовирусных препаратов для профилактики передачи ВГВ-инфекции от матери ребенку при уровне ДНК ВГВ 106–7 ME/мл в третьем триместре беременности (A), особенно при наличии HBeAg-позитивного ХГВ, поскольку при таком сочетании существует 10% риск передачи инфекции новорожденному несмотря на введение специфического иммуноглобулина и вакцины [32].
Матери с высоким уровнем виремии должны быть информированы о том, что использование аналогов нуклеозидов снижает уровень вирусной нагрузки и может усилить профилактическое действие вакцинации и применения иммуноглобулина. Однако необходимо учитывать, что женщинам-носителям ВГВ с высоким уровнем виремии может понадобиться долгосрочная противовирусная терапия (после родов) в связи с показаниями по лечению активного гепатита, в результате чего выбор препарата должен быть сделан исходя из данных по риску развития лекарственной резистентности.
Риск развития устойчивости к противовирусной терапии наиболее высок для ламивудина, существенно меньше для телбивудина и минимален для тенофовира. В связи с этим в случае, когда планируется долгосрочная терапия, препаратом предпочтения должен быть тенофовир, поскольку теперь доступна информация о безопасности его применения у беременных и высокой противовирусной активности в сочетании с минимальным риском развития резистентности [32].
Показаниями к назначению противовирусной терапии у пациенток в фазе иммунной толерантности ХГВ, которая уже была диагностирована до наступления беременности, являются:
1. Уровень материнской ДНК ВГВ более 6 log10 копий/мл в конце II триместра беременности.
2. Рождение ребенка, инфицированного ВГВ, с предшествующей неэффективной иммунопрофилактикой.
3. Преждевременные роды в анамнезе.
Необходимо учитывать, что в данном случае противовирусная терапия назначается исключительно для профилактики инфицирования новорожденного и будет отменена после родов.
В качестве монотерапии могут быть назначены тенофовир, телбивудин или ламивудин. В идеале ПВТ должна быть начата в конце II — начале III триместра беременности для того, чтобы было достаточно времени для снижения уровня виремии (4–6 недель) к моменту родов.
Лечение может быть прекращено на 4-й неделе послеродового периода или раньше при необходимости грудного вскармливания. Кроме того, требуется контроль активности сывороточных трансаминаз каждые 4–6 недель послеродового периода на протяжении как минимум 12 недель после окончания ПВТ для исключения перехода заболевания в иммуноактивную фазу [32].
Тактика ведения женщин с вновь установленным диагнозом ВГВ-инфекции на фоне беременности
В данной ситуации следует проводить как можно более полное обследование женщины для того, чтобы установить есть ли показания к лечению матери в связи с гепатитом или необходимость проведения терапии обоснована только как мероприятие для профилактики инфицирования новорожденного. Требуется исключить острый гепатит В. Обследование должно включать определение анти-HBcor IgM, HBeAg, анти-HBe, анти-HDV IgG и IgM в крови, уровня виремии ВГВ. Дополнительно назначаются общеклинический и биохимический анализы крови. Выполнение УЗИ молодым женщинам обычно необязательно, но если есть даже незначительные указания на возможность цирроза печени, это исследование должно быть проведено.
Далее рекомендуется установить, показано ли лечение пациентке в данную фазу болезни, и оценить вероятность того, что оно будет продолжено после родов (долгосрочная терапия) в связи с активностью и стадией гепатита. Это важно для выбора препарата, который должен характеризоваться минимальным риском развития резистентности.
Тактика ведения беременных с циррозом печени ВГВ-этиологии
Матери с ЦП ВГВ-этиологии имеют высокий риск перинатальных осложнений. По оценке наблюдений зарубежных исследователей в период с 1993 по 2005 г., риск развития печеночной недостаточности во время беременности у женщин с ЦП достигает в среднем 15%. Материнская смертность и перинатальная гибель плода в подобных случаях составляет 1,8 и 5,2% соответственно. Эти данные являются веским аргументом в пользу более раннего применения ПВТ во время беременности или продолжения лечения, уже начатого до ее наступления, но необходимо пересмотреть применяемый препарат, учитывая факт наступления беременности. Энтекавир должен быть отменен и назначен тенофовир; телбивудин и ламивудин не противопоказаны, но не являются препаратами выбора, поскольку цирроз является показанием к долгосрочной терапии; лечение предпочтительно проводить тенофовиром [32].
Тактика ведения пациенток, у которых беременность диагностирована на фоне лечения ХГВ противовирусными препаратами
Если на фоне противовирусной терапии наступила незапланированная беременность, показания к лечению должны быть пересмотрены. Пациентки с наличием выраженного фиброза печени должны продолжать ПВТ, но используемый препарат должен быть пересмотрен с точки зрения безопасности. Лечение пегилированным интерфероном необходимо прекратить и назначить нуклеози(ти)дные аналоги. Препаратом выбора при этом является тенофовир. Если пациентка уже получала его, терапия может быть продолжена. В ситуации, когда применялся ламивудин или телбивудин, лечение может быть продолжено тем же препаратом, если ДНК ВГВ в крови не определяется. Если репликация ВГВ подавлена не полностью, предпочтителен переход на лечение тенофовиром для предотвращения обострения гепатита во время беременности. Если пациентка получала энтекавир, предпочтительно перейти на тенофовир.
При отсутствии выраженного фиброза печени лечение нуклеози(ти)дными аналогами может быть прервано на первые 2 триместра беременности и назначено далее по показаниям (возврат виремии и ее высокий уровень) в III триместре или прервано до того момента, пока женщина не закончит грудное вскармливание ребенка. Крайне важно проводить ежемесячное мониторирование активности АлАТ и уровня виремии на 1, 3 и 6-м месяцах после прерывания ПВТ, учитывая возможный риск обострения, особенно после родов.
Противовирусная терапия и грудное вскармливание
Несмотря на то, что HBsAg был обнаружен в грудном молоке, грудное вскармливание не увеличивает риск передачи ВГВ-инфекции по сравнению с искусственным. Результаты исследований не продемонстрировали связь между естественным вскармливанием младенцев ВГВ-позитивными матерями и развитием у новорожденных ХГВ. Таким образом, дети, которым введен иммуноглобулин и проведен первый этап вакцинации от гепатита В, могут находиться на естественном вскармливании. В случае необходимости продолжения противовирусной терапии в послеродовом периоде грудное вскармливаниене рекомендовано из-за отсутствия полноценных сведений о безопасности принимаемых препаратов на развитие ребенка [54].
Тактика ведения беременных с вирусным гепатитом В и ВИЧ-инфекцией
Все беременные в соответствии с санитарными правилами 2008 г. двукратно (при постановке на учет в женской консультации в I триместре беременности и в последнем) обследуются на HBsAg, анти-HCV и ВИЧ. В случае подтверждения диагноза ВИЧ-инфекции независимо от степени вирусной нагрузки и уровня СD4+ Т-лимфоцитов женщинам с 16–20-й недели беременности назначаются антиретровирусные препараты (АРВ-препараты) для профилактики ВИЧ у новорожденных.
Необходимо отметить, что вопросы лечения и профилактики перинатальной передачи ВГВ от матери к ребенку связаны с аналогичным путем, и поэтому следует руководствоваться общими принципами назначения антиретровирусной терапии (АРВТ) беременным. При назначении АРВТ проводят консультирование по вопросам возможных проявлений гепатотоксичности АРВ-препаратов и оценивают уровень АлАТ, АсАТ через 2 недели после начала терапии, затем 1 раз в месяц. При выявлении маркёров ВГВ-инфекции дополнительно проводятся клинико-биохимические исследования, количественное определение уровня вирусной нагрузки и решается вопрос о назначении лечения и профилактики передачи ВГВ от матери к ребенку.
В соответствии с Российским клиническим протоколом применения АРВ-препаратов, направленных на профилактику передачи ВИЧ от матери к ребенку, и Российским протоколом диспансерного наблюдения и лечения больных ВИЧ-инфекцией рекомендуется следующая тактика ведения беременных с сочетанной инфекцией ВИЧ/ВГВ.
1. Если у беременной нет показаний для назначения АРВТ с целью лечения ВИЧ-инфекции, а также не требуется лечение ХГВ, следует начать профилактический курс АРВТ как можно раньше после окончания I триместра беременности (с 16–20-й недели независимо от вирусной нагрузки и количества СD4+ лимфоцитов). Не рекомендуется включать в схему тенофовир/эмтрицитабин или тенофовир в сочетании с ламивудином. АРВТ продолжают в течение всей беременности и родов, после чего отменяют.
2. Если беременная нуждается в получении АРВТ для лечения ВИЧ-инфекции и есть показания для лечения ХГВ, АРВТ начинают независимо от срока беременности и продолжаютее на протяжении всей беременности, во время родов и после них. В схему АРВТ включают препараты, подавляющие репликацию вируса гепатита В, — тенофовир и ламивудин или тенофовир/эмтрицитабин в сочетании с лопинавиром/ритонавиром или атазанавиром/ритонавиром. При непереносимости лопинавира или атазанавира можно использовать в порядке приоритетности: саквинавир/ритонавир или невирапин (при количестве СD4+ лимфоцитов менее 250 клеток/мкл и нормальном уровне АлАТ, АсАТ),
эфавиренз (только при сроке беременности более 13 недель и нормальных показателях АлАТ, АсАТ), нелфинавир. Выбор конкретных препаратов для АРВТ у беременных с коинфекцией ВИЧ/гепатит В определяется исходным уровнем ДНК ВГВ у женщины. При высоком уровне ДНК применение комбинированного препарата тенофовир/эмтрицитабин позволяет подавить репликацию ВГВ и снизить до минимума риск формирования устойчивости вируса к противовирусным препаратам. Начиная лечение или меняя его схему, следует избегать назначения ламивудина или эмтрицитабина без тенофовира из-за возможности быстрого развития резистентности. Только при наличии противопоказаний к использованию тенофовира в комплекс АРВТ можно включить ламивудин [18]. В схему терапии первого ряда должен входить усиленный ритонавиром ингибитор протеазы [5].
3. Если беременность наступила на фоне АРВТ, последнюю не рекомендуется отменять на всем протяжении беременности, включая I триместр. Если в числе АРВ-препаратов присутствовали тенофовир и ламивудин, их не следует отменять из-за риска обострения гепатита. Применять эфавиренз не рекомендуют в I триместре беременности, поэтому при его наличии в схеме АРВТ данный препарат следует заменить на другой [4, 17, 31, 32, 57].
Противопоказано проводить лечение ХГВ у беременных препаратами интерферона-альфа (стандартными и пегилированными). Наличие ХГВ у ВИЧ-инфицированной беременной не является дополнительным показанием для выполнения планового кесарева сечения.
ВИЧ-инфицированных беременных при отрицательных результатах обследования на HBsAg, анти-HBs и анти-HBc IgG следует вакцинировать против гепатита В по стандартной схеме.
Новорожденных от матерей с сочетанной инфекцией ВИЧ/ХГВ вакцинируют 4 раза: в 1-й день жизни, в возрасте 1, 2 и 12 месяцев. В течение первых 12 часов после рождения вводится первая доза вакцины и специфический иммуноглобулин с высоким уровнем анти HBs.
Гепатит В (Б) — симптомы и лечение
Что такое гепатит В (Б)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 15 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Инфекционист Cтаж — 15 лет
Медицинский центр «О-Три»
Дата публикации 16 июля 2018 Обновлено 16 мая 2022
Определение болезни. Причины заболевания
Вирусный гепатит В (Б) — острое и хроническое инфекционное заболевание, вызываемое вирусом гепатита В, с гемоконтактным механизмом передачи (через кровь), протекающее в различных клинико-морфологических вариантах, и возможным развитием цирроза печени и гепатоцеллюлярной карциномы. Всего в мире, по самым скромных оценкам, инфицировано более 250 млн человек.
Этиология
вид — вирус гепатита В (частица Дейна)
Развитие вируса гепатита В происходит в гепатоцитах (железистых клетках печени). Он способен к интеграции в ДНК человека. Имеются 9 генотипов вируса с различными подтипами — генетическая изменчивость позволяет вирусу образовывать мутантные формы и ускользать от действия лекарств.
Имеет ряд собственных антигенов:
- поверхностный HbsAg (австралийский). Появляется за 15-30 дней до развития болезни, свидетельствует об инфицировании (не всегда). Антитела к HbsAg выявляются через 2-5 месяцев от начала заболевания, а сам HbsAg исчезает из крови (при благоприятном течении процесса);
- сердцевинный HbcorAg (ядерный, коровский). Появляется в инкубационном периоде и совместно с ним появляются антитела (HbcorAb). Длительное присутствие HbcorAg в крови свидетельствует о вероятной хронизации процесса (неадекватный иммунный ответ);
- антиген инфекциозности и активного размножения вируса (HbeAg). Появляется совместно с HbsAg и отражает степень инфицированности. Его продолжительная циркуляция в крови является свидетельством развития хронизации процесса, а антитела к нему являются благоприятным прогностическим признаком (не всегда, но по меньшей мере указывают на возможность более благоприятного процесса, срок их циркуляции после выздоровления окончательно не определён, но не более пяти лет после благоприятного разрешения процесса);
- HbxAg — регулятор транскрипции, способствует развитию гепатокарциномы.
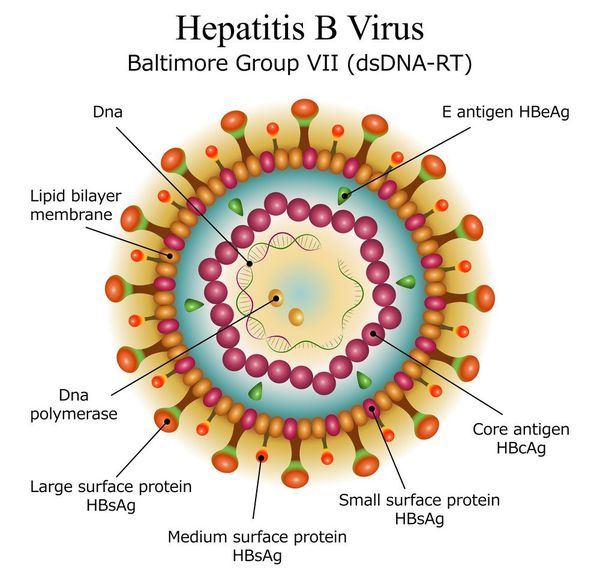
Вирус гепатита В чрезвычайно устойчив к действию всевозможных естественных факторов окружающей среды, инактивируется при 60 °C за 10 часов, при 100 °C за 10 минут, при оптимальной температуре сохраняется до 6 месяцев, при автоклавировании погибает за 5 минут, в сухожаровом шкафу — через 2 часа, 2% раствор хлорамина убивает вирус за 2 часа. [1] [3]
Эпидемиология
Источник инфекции — только человек, больной острой или хронической формой инфекции.
Механизм передачи: гемоконтактный и вертикальный (от матери к ребёнку), не исключается трансмиссивный механизм передачи (например, при укусах комаров в результате раздавливания и втирания инфицированного тела комара в поврежденную ткань человека).
Пути передачи: половой, контактно-бытовой, гемотрансфузионный (например, при переливании крови или медицинских манипуляциях). Восприимчивость всеобщая. Заболеваемость — 30-100 человек на 100 тысяч населения (зависит от страны). Летальность от острых форм — до 2%. После перенесённого острого заболевания при условии выздоровления иммунитет стойкий, пожизненный.
Для заражения характерна малая заражающая доза (невидимые следы крови). [1] [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы гепатита Б
Инкубационный период гепатита В длится от 42 до 180 дней (следует иметь в виду, что наличие клинической симптоматики характеризует лишь незначительную долю всех случаев заболевания).
Начало постепенное. Характерные синдромы:
- общей инфекционной интоксикации (проявляется как астеноневротический синдром);
- холестатический (нарушение секреции желчи);
- артрита;
- нарушения пигментного обмена (появление желтухи при уровне общего билирубина свыше 40 ммоль/л);
- геморрагический (кровоточивость кровеносных сосудов);
- экзантемы;
- отёчно-асцитический (скопление жидкости в брюшной полости);
- гепатолиенальный (увеличение печени и селезёнки).
При первых признаках гепатита B нужно обратиться к доктору.
Первые признаки гепатита B
Начальный (преджелтушный) период продолжается 7-14 дней. Чаще протекает по многообразному типу с болевыми ощущениями в различных суставах по ночам и утром, уртикарными высыпаниями, астеновегетативными проявлениями (снижение аппетита, апатия, нервозность, слабость, разбитость, повышенная утомляемость). Изредка развивается синдром Джанотти-Крости — симметричная, яркая пятнисто-папулёзная сыпь. Не исключены умеренные диспептические явления (расстройства пищеварения). К концу периода происходит потемнение мочи, обесцвечивание кала.
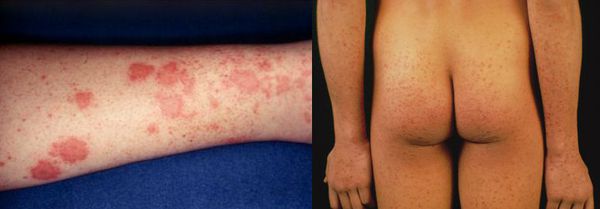
Желтушный период
Этот период продолжительностью около одного месяца характеризуется возникновением желтушного окрашивания кожи (различных оттенков) на фоне продолжающегося или ухудшающегося общего состояния. Характерна длительность и стойкость симптоматики. Появляется тяжесть и болезненность в правом подреберье, горечь во рту, тошнота, выражённый зуд кожи (практически не снимаемый никакими средствами). На фоне усиления астеноневротического компонента появляются геморрагические проявления, урежение пульса, гипотензия, отёки (отражает степень интоксикации и нарушения функций печени).
Выздоровление
Следующим этапом в развитии болезни является нормализации общего состояния, спадение желтухи и реконвалесценция, которая в зависимости от конкретной ситуации и состояния иммунной системы может закончиться как выздоровлением, так и движением развития заболевания в хроническое течение, характеризующееся маловыраженой неусточивой симптоматикой, преимущественно в виде слабости, периодического дискомфорта в правом подреберье, бурно сигнализирующим лишь на стадии цирроза и полиорганных осложнений.
- гепатиты другой этиологии;
- желтухи другой этиологии (например, гемолитическая болезнь, токсическое поражение, опухоли);
- малярия;
- инфекционный мононуклеоз;
- лептоспироз;
- ревматоидный артрит.
В первое десятилетие 21 века произошло возникновение концепции «оккультной» (стёртой) ВГВ-инфекции (далее ОкВГВ), характеризующейся наличием вируса при недетектируемом уровне HbsAg. Механизм данного состояния связывают с мутацией в регионе домена полимеразы, что ведёт к уменьшению вирусной репликации и отсутствию экспрессии HbsАg, также вероятны дефекты гена Pol, что является следствием противовирусной терапии (Рахманова А.Г. и соавторы, 2015). При этом единственными серологическими маркером ВГВ могут быть HBcor антитела (чаще в сочетании с HbeAb), в особенности тогда, когда недоступны высокочувствительные и затратные методы определения HBV ДНК (Цинзерлинг В.А., Лобзин Ю.В., Карев В.Е., 2012). Это обуславливает сохраняющийся риск инфицирования пулов плазмы ВГВ при донорстве крови и трансплантации органов, внутрибольничного инфицирования в роддомах, хирургических стационарах, стоматологии.
Гепатит В у беременных
Острый гепатит характеризуется более тяжёлым течением у беременной, возникновении повышенного риска преждевременных родов, аномалий развития плода на ранних сроках и кровотечений. Вероятность передачи при острой форме зависит от сроков беременности: в первом триместре риск 10% (но более тяжёлые проявления), в третьем триместре — до 75% (чаще бессимптомное течение после родов). У большинства детей при заражении во внутриутробном и постнатальном периодах происходит хронизация инфекции. [1] [3] [6]
Патогенез гепатита Б
Входные ворота — мельчайшие повреждения кожи и слизистых оболочек.
С движением кровяной массы вирус попадает в печеночную ткань, где локализуется в гепатоцитах и теряет свою протеиновую сферу в лизосомах. Происходит выход вирусной ДНК с последующим ресинтезом аномальных протеинов LSP, а параллельно образование новых частиц Дейна.
В процессе эволюции вирусчеловеческого взаимодействия возможно развитие двух вариантов:
- репликативного;
- интегративного.
При репликативном пути происходит следующее: белки LSP совместно с HbcorAg вызывают увеличение продукции гамма-интерферона, что приводит к активации главного комплекса гисотсовместимости (HLA), проистекает преобразование молекул гистосовместимости 1 и 2 классов, в результате чего клетка становиться для организма враждебной в антигенном формате.
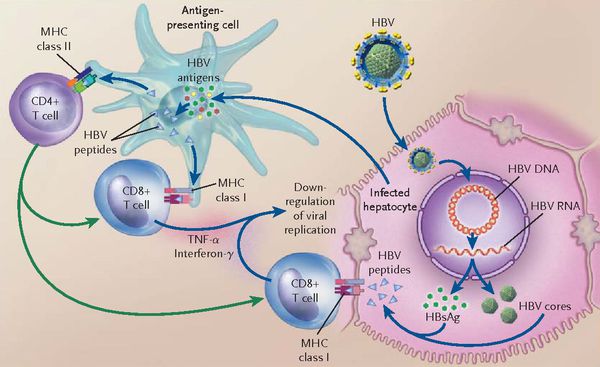
Антигенпрезентирующие макрофаги содействуют изменению В-лимфоцитов в плазматические клетки и экспрессии ими агрессивных белков-антител к посторонним антигенам. В итоге на поверхности печёночных клеток формируются вирусспецифические иммунные комплексы (антиген + антитело + фракция комплемента С3в).
В динамике может реализоваться два сценария:
- в первом варианте запуск каскада комплимента ведёт к появлению в составе иммунных комплексов агрессивной фракции С9 (мембранатакующий комплекс) — наблюдается значительный некроз гепатоцитов без участия лимфоцитов (молниеносная форма гепатита В);
- при альтернативной варианте (наблюдающимся в большинстве случаев) каскад комплемента в силу иммуноиндивидуалистических свойств не активируется — тогда идёт умеренное разрушение Т-киллерами меченых антителами заражённых вирусом гепатоцитов. Образуются ступенчатые некрозы с образованием на месте гибели гепатоцитов соединительной ткани — рубцов (то есть острый гепатит В при плохом иммунном ответе постепенно переходит в хронический).
Непременным атрибутом патогенеза является формирование иммунопатологического процесса. Гибель гепатоцитов, инфицированных вирусом гепатита В, следует за счёт иммунокомпетентных частиц, Т-киллеров и макрофагальных элементов.
Серьёзным значением является нарушение свойств мембраны клеток печени, что сопровождается экскрецией (выделением) лизосомальных ферментов, разрушающих гепатоциты. Сообразно этому, гибель гепатоцитов происходит за счёт иммунокомпетентных клеток, лизосомальных ферментов и противопечёночных гуморальных аутоантител, то есть острая болезнь наступает (и благоприятно заканчивается) только при хорошем иммунитете, а при плохом идёт хронизация.
При тяжёлом цитолитическом синдроме (массивные некрозы гепатоцитов) возникает гипокалиемический алкалоз, острая печёночная недостаточность, печёночная энцефалопатия (ПЭП), церебротоксическое действие, нарушение функции обмена нервной ткани. [2] [3] [6]
Классификация и стадии развития гепатита Б
По цикличности течения:
- острый;
- острый затяжной;
- хронический.
По клиническим проявлениям:
- субклинический (инаппарантный);
- клинически выраженный (желтушный, безжелтушный, холестатический, фульминантный).
По фазам хронического процесса:
- HBeAg-положительная хроническая инфекция HBV (фаза «иммунной толерантности»);
- HBeAg-положительный хронический гепатит B;
- HBeAg-негативная хроническая инфекция HBV;
- HBeAg-отрицательный хронический гепатит B;
- отрицательная HBsAg фаза HBV-инфекции («оккультная фаза»). [1][2]
Группы риска хронического гепатита B
Хроническим гепатитом чаще страдают дети младше шести лет. При заражении в первый год жизни он развивается в 80–90 % случаев, от года до шести лет — в 30–50 %, у взрослых без сопутствующих заболеваний — менее чем в 5 %. [7]
Осложнения гепатита Б
Чем опасен гепатит В
Заболевание может привести к острой печёночной недостаточности (синдрому острой печеночной энцефалопатии).
Выделяют четыре стадии болезни:
- Первая стадия (ОПЭ-1). Предвестники — астения (слабость) и адинамия, инверсивное настроение, эйфория, нарушение сна, «тряска» конечностей, агрессивность, печёночный запах изо-рта, рвота, сонливость, нарастание желтухи, сжатие размеров печени, ухудшение лабораторных данных.
- Вторая стадия (ОПЭ-2). Прекома — моторное возбуждение перетекает в сопор (субкома), появляются судороги, сознание спутано, дезориентация во времени и месте, хлопающая дрожь кистей, тахикардия, повышение кровоточивости, рвота «кофейной гущей», дёгтеобразный стул, уменьшение диуреза (объёма мочи).
- Третья стадия (ОПЭ-3). Кома I — исчезновение словесной связи и адекватной реакции на болевые раздражители, выявление патологических рефлексов (Бабинского). Наблюдается спазм подбородочной мышцы со смещением кожи подбородка кверху при раздражении кожи в области возвышения одного пальца кисти на той же стороне тела. Появляются симптомы орального автоматизма — хоботковый. Дефекация и акт мочеиспускания не контролируются. Глотание сохранено, зрачки узкие со слабой реакцией на яркий свет, усиление желтухи, геморрагических проявлений, размеров печени, кисло-сладкий печёночный запах изо-рта, олиго или анурия.
- Четвёртая стадия (ОПЭ-4). Кома II — абсолютная потеря реакции на все раздражители, арефлексия, симптом плавающих глазных яблок, зрачки расширены и без реакции на свет, нет корнеального рефлекса, исчезает хлопающий тремор, нарушается глотание, дыхание типа Куссмауля или Чейн-Стокса, пульс нитевидный, недержание мочи и кала, резкое увеличение уровня билирубина в крови. [1][5]
Диагностика гепатита Б
Многообразие форм, тесная взаимосвязь с иммунной системой человека и зачастую достаточно высокая стоимость исследований часто затрудняют принятие конкретного решения и диагноза в стационарный отрезок времени, поэтому во избежание роковых (для больного) ошибок следует подходить к диагностике с учётом всех получаемых данных в динамическом наблюдении:
- общеклинический анализ крови с лейкоцитарной формулой (лейкопения, лимфо- и моноцитоз, уменьшение СОЭ, тромбоцитопения);
- общий анализ мочи (появление уробилина);
- биохимический анализ крови (гипербилирубинемия в основном за счёт связанной фракции, повышение уровня АЛТ и АСТ, ГГТП, холестерина, щелочной фосфатазы, снижение протромбинового индекса, фибриногена, положительная тимоловая проба);
- маркеры гепатита В: HbsAg, HbeAg, HbcorAg, HbcorAb IgM и суммарные, HbeAb, anti-Hbs, ПЦР в качественном и количественном измерении);
- УЗИ органов брюшной полости, КТ и МРТ диагностика;
- фиброскан (применяется для оценки степени фиброза). [3][4]
Скрининг при хроническом гепатите
Пациентам с хроническим гепатитом В рекомендуется не реже чем раз в полгода проходить обследование: УЗИ органов брюшной полости, клинический анализ крови, АЛТ, АСТ, тест на альфа-фетопротеин. Скрининг позволяет вовремя заметить обострение болезни и начать специфическую терапию.
Лечение гепатита Б
Лечение острых форм гепатита В должно осуществляться в стационаре (учитывая возможность быстрых и тяжёлых форм болезни), хронических — с учётом проявлений.
Диета и режим при гепатите В
В острый период показан постельный режим, печёночная диета (№ 5 по Певзнеру): достаточное количество жидкости, исключение алкоголя, жирной, жареной, острой пищи, всё в мягком и жидком виде.
Медикаментозная терапия
При лёгкой и средней тяжести острого гепатита этиотропная противовирусная терапия (ПВТ) не показана. При тяжёлой степени и риске развития осложнений назначается специфическая противовирусная терапия на весь период лечения и возможно более длительное время.
В лечении хронических форм гепатита показаниями к назначению ПВТ является наличие уровня DNA HBV более 2000 МЕ/мл (при циррозе печении независимо от уровня), умеренное и высокое повышение АЛТ/АСТ и степени фиброза печёночной ткани не менее F2 по шкале METAVIR, высокая вирусная нагрузка у беременных женщин. В каждом конкретном случае показания определяются индивидуально, в зависимости от выраженности процесса, временной тенденции, пола, планирования беременности и другого.
Существует два пути противовирусного лечения:
- терапия пегилированными интерферонами (имеет ряд существенных противопоказаний и серьёзных побочных эффектов — не менее 12 месяцев);
- нуклеозидно-аналоговой терапии NA (используются препараты с высоким порогом резистентности вируса, длительно — не менее пяти лет, удобство применения, хорошая переносимость).
В отдельных случаях может рассматриваться применение комбинированной терапии.
Из средств патогенетической терапии в острый период используются внутривенно вводимые растворы 5% глюкозы, дезинтоксикантов, антиоксидантов и витамины. Показан приём энтеросорбентов, ферментных препаратов, при выраженном холестазе применяются препараты Урсодезоксихолевой кислоты, при тяжёлом течении — глюкокортикостероиды, методы аппаратного плазмофереза.
В хронической стадии заболевания при наличии соответствующей активности процесса и невозможности назначения ПВТ может быть показан приём групп гепатопротекторов и антиоксидантов. [1] [3]
Прогноз. Профилактика
Основное направление профилактики на сегодняшний день — это проведение профилактической вакцинации против гепатита В в младенческом возрасте (в том числе усиленная вакцинация детей, рождённых от матерей с гепатитом В) и далее периодические ревакцинации раз в 10 лет (или индивидуально по результатам обследования). Достоверно показано, что в странах, где была введена вакцинация, резко сократилось количество вновь выявленных случаев острого гепатита В.
Вызывает некоторые вопросы эффективность вакцинации при заражении «оккультными» формами гепатита В, так как действие вакцины направлено на нейтрализацию HbsAg, которого в данном случае нет, или он видоизменён — окончательного решения пока не определено, ведутся поиски.
Вторая составляющая стратегии профилактики включает обеспечение безопасности крови и её компонентов, использование одноразового или стерилизованного инструментария, ограничение числа половых партнёров и использование барьерной контрацепции. [1] [2]
Список литературы
- Всемирная организация здравоохранения. Гепатит B. — Информационный биллютень, апрель 2017. [Электронный ресурс]. Дата обращения: 14.07.2018.
- ASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. — Journal of Hepatology, 2017. — Vol. 67. — P. 370-398.
- Рахманова А.Г., Александров П.А., Шаройко В.В. Оккультный гепатит В, его роль в распространении инфекции и развитии гепатоцеллюлярной карциномы. — Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях, 2015. — № 3. — С. 78-83.
- Рассел Дж. Гепатит B. — М.: VSD, 2012. — 162 c.
- Романова Е.А. Гепатит. Диагностика, профилактика, эффективные методы лечения: монография. — М.: АСТ, 2017. — 612 c.
- Лабораторная диагностика вирусных гепатитов [Текст] : метод. рек. // Справочник заведующего КДЛ. — 2017. — № 5. — С. 63-79.
- Всемирная организация здравоохранения. Гепатит B // Информационные бюллетени. — 2021.ссылка
Лечение и профилактика гепатита В
Член EAU (Европейская Ассоциация Урологов). Стаж работы +17 лет. Принимает в Университетской клинике. Цена приема — 2000 руб.
- Запись опубликована: 10.06.2020
- Reading time: 5 минут чтения
Специфическое противовирусное лечение острой HBV-инфекции гепатита В отсутствует. При выраженной интоксикации, диспепсическом и холестатическом синдромах проводится инфузионная терапия в условиях стационара.
Цель терапии – добиться стойкого подавления репликации вируса, чтобы остановить/предупредить прогрессирующее поражение ткани печени и не допустить ГЦК.
Предварительное обследование, необходимое для подбора терапии
Любому пациенту, у которого обнаружена хроническая инфекция гепатита В, требуется тщательное обследование и оценка состояния печени и всего организма непосредственно после получения результата лабораторного исследования, поскольку 15%–25% людей с хронической инфекцией HBV находятся в опасности преждевременной смерти от цирроза и рака печени.
При оценке хронической HBV-инфекции, врач должен учитывать уровень репликации HBV и степень поражения печени. Травматизм оценивается с помощью серийных испытаний определения сывороточных аминотрансфераз (АЛТ и АСТ). При необходимости, назначается биопсия печени (оценка гистологической активности и фиброза).
Первичная оценка пациентов с хронической HBV инфекцией должна включать тщательный анамнез и физикальное обследование, с особым акцентом на факторы риска: коинфекции ВИЧ и HCV, употребление алкоголя и семейный анамнез инфекции HBV и рака печени.
- Полный анализ крови и печеночная панель на наличие признаков заболевания печени;
- Анализы на маркеры репликации HBV (ДНК HBeAg, анти-HBe, HBV);
- Анализы на коинфекции с HCV, HDV и ВИЧ;
- Анализ на антитела к гепатиту А вирус (HAV).
Пациентам из эндемичных районов необходимо провериться на шистосомоз ( S. mansoni или S. japonicum ), так как в присутствии инфекции HBV шистосомоз может увеличить прогрессирование до цирроза печени или ГЦК.
Лицам с хроническим HBV – инфекции, которая, как известно, не является иммунной к HAV, следует ввести 2 дозы вакцины против гепатита А с интервалом 6-18 месяцев.
Оценка хронического течения гепатита В включает:
- полный клинический анализ крови;
- полный биохимический анализ крови;
- протромбиновое время или МНО;
- УЗИ брюшной полости;
- определение альфа-фетопротеина.
Альфа-фетопротеиновый анализ (АФП) используется для оценки наличия признаков ГЦК при первичной диагностике HBV-инфекции.
Если начальные лабораторные анализы предполагают повреждение печени, проводится биопсия печени (или, в идеале, неинвазивные маркеры) для оценки воспаления и степени фиброза.
После первичного обследования все пациенты с хронической HBV инфекцией, даже те, кто имеет нормальную аминотрансферазу, должны проходить пожизненный мониторинг для:
- оценки прогрессирования заболевания печени;
- развития ГЦ;,
- необходимости лечения;
- реакции на лечение.
Частота проведения мониторинга зависит от нескольких факторов, в том числе от семейного анамнеза, возраста и состояния пациента.

Медикаментозное лечение гепатита В
Терапия гепатита В – это быстро меняющаяся область клинической практики. Всего в Европе и Америке одобрены для этой цели 7 препаратов. Для лечения хронической HBV инфекции применяются: интерферон альфа-2b, пегинтерферон Альфа-2a, ламивудин, адефовир дипивоксил, энтекавир, телбивудин и Тенофовир дизопроксил фумарат.
Кроме того, два других одобренных FDA пероральных противовирусных препарата для лечения ВИЧ (клевудин и эмтрицитабин) ещё проходят фазу-3 испытания для лечения HBV и могут быть одобрены в ближайшее время.
Пероральные противовирусные препараты утвержденные для терапии хронического гепатита В:
- Тенофовир дизопроксил (Виреад). Таблетки принимаются один раз в день. Препарат отличается небольшими побочными эффектами. Рекомендуемая длительность применения в течение по крайней мере одного года или дольше. Этот препарат считается лечением первой линии с отличным профилем сопротивления. Утвержден в 2008 г.
- Тенофовир алафенамид (Vemlidy) . Представляет собой таблетки в дозировке 25 мг. Принимается один раз в день. Также дает легкие побочные эффекты. Применяется в течение одного года или дольше. Входит в первую линию терапии. С отличным профилем сопротивления. Утвержден в 2016 году.
- Entecavir (Baraclude) . Форма выпуска – таблетки в дозировке энтекавира 500 мкг, 1мг. Прием один раз в день. Отмечается небольшое количество побочных эффектов. Длительность терапии от года. Препарат первой линии. Отличный профиль сопротивления. Утвержден в 2005 г.
- Телбивудин (Tyzeka или Sebivo). Представляет собой таблетки с дозировкой действующего вещества 600 мг. Принимаются один раз в день. С небольшими побочными эффектами. Длительность приема от 1 года. Это вариант лечения второй линии. Утвержден в 2006 г.
- Адефовир дипивоксил (Hepsera) . Таблетки, принимаемые один раз в день. С небольшими побочными эффектами. Длительность приема – от одного года. Является вариантом лечения второй линии. Особенность лечения этим препаратом – пациентам необходимо регулярно контролировать функцию почек. Утвержден в 2002 г.
- Ламивудин (Epivir-HBV, Zeffix или Heptodin) . Представляет собой таблетки. Дозировка действующего вещества ламивудин – 150 мг, прием один раз в день. Побочные эффекты незначительны. Лечение длительное, от года или дольше. Обычно не используется в США и других развитых странах, потому что менее эффективен, чем новые препараты, и у большинства людей лекарственная устойчивость развивается в течение года или двух. Утвержден в 1998 г.
Иммунные модуляторы (интерфероны) для терапии хронической инфекции гепатита В:
- Пегилированный интерферон (пегасис). Вводится инъекционно один раз в неделю. Обычно назначается на срок от 6 месяцев до 1 года. Препарат может вызывать побочные эффекты, такие как симптомы гриппа и депрессия. Утвержден в 2005 г.
- Интерферон альфа (Интрон А). Вводится инъекционно несколько раз в неделю, обычно в течение от 6 месяцев до 1 года, но лечение может быть более длительным. Препарат может вызывать побочные эффекты, такие как симптомы гриппа, депрессия и головные боли. Это более старый препарат. Утвержден в 1991 г.
Решение о назначении препаратов принимаются на основании статуса HBeAg, вирусной нагрузки ДНК HBV, АЛТ, стадии заболевания печени, возраста пациента и других факторов.
Коинфекция с ВИЧ осложняет ведение больных с хроническим гепатитом В. При подборе антиретровирусных препаратов для лечения ВИЧ-инфекции врач должен учитывать состояние HBsAg пациента, чтобы избежать осложнений, связанных с печенью и развитие противовирусной резистентности.
Серологические конечные точки противовирусной терапии:
- потеря HBeAg;
- сероконверсия HBeAg у лиц исходно положительным HBeAg;
- подавление ДНК HBV до неопределимых уровней, определяемых с помощью чувствительных ПЦР-анализов у пациентов, которые являются HBeAg-негативными и анти-HBe положительными;
- потеря HBsAg.
Оптимальная длительность терапии не установлена. Для HBeAg-положительных пациентов, лечение должно быть продолжено в течение не менее 6 месяцев после потери HBeAg и появления анти-HBe. У HBeAg-негативных/анти-HBe-позитивных пациентов частота рецидивов составляет 80-90%, если лечение прекращено через 1 – 2 года.
Вирусная резистентность к ламивудину возникает у до 70% лиц в течение первых 5 лет лечения, поэтому его широкое применение не рекомендуется.
Более низкие показатели резистентности среди пациентов наблюдались при применении адефовира (30% в течение 5 лет), энтекавира (телбивудин (2,3-5% в течение 1 года), но увеличение сопротивления может произойти с более длинным использованием препаратов или среди пациентов которые были ранее резистентны к ламивудину.
Использование комбинированной терапии не продемонстрировало более высокую частоту ответа, чем при использовании одного самого мощного противовирусного препарата в схеме лечения. Однако, необходимы дополнительные исследования с использованием комбинаций различных классов препаратов, активных против HBV, чтобы определить, будет ли комбинированная терапия снижать скорость развития резистентности.

Меры профилактики против гепатита В
- Вакцинация;
- Практика моногамных интимных отношений и защищенного полового контакта с использованием презервативов.
Вакцина против гепатита В
Чтобы защитить себя и своих близких от гепатита В на всю жизнь, требуется всего несколько инъекций. Вакцина против гепатита В также известна как первая «противораковая» вакцина, поскольку она предотвращает гепатит В – ведущую причину рака печени во всем мире.
Вакцина против гепатита В безопасная и эффективная. Рекомендуется всем младенцам при рождении и детям до 18 лет. Вакцина против гепатита В также рекомендуется для взрослых, болеющих диабетом, и людей с высоким риском заражения в связи с их работой, образом жизни, жизненными ситуациями или страной рождения.
Поскольку каждый человек в некоторой степени подвержен риску, всем взрослым следует серьезно подумать о том, чтобы получить вакцину против гепатита В для пожизненной защиты от предотвратимых хронических заболеваний печени.
Получить гепатит B из вакцины невозможно. Все вакцины против гепатита В, которые использовались с 1986 года, сделаны синтетическим путем, то есть вакцины против гепатита В не содержат продуктов крови.
При текущей HBV-инфекции (HBsAg-положительная) или выздоровлении после перенесенной HBV-инфекции, серия вакцин против гепатита В не принесет пользы и не вылечит вирус. Тем не менее, вакцина обеспечит защиту на всю жизнь близких вам людей. Анализы – это единственный способ узнать, есть ли у вас или ваших близких текущая инфекция или вы выздоровели от перенесенной инфекции.
Рекомендации по вакцине против гепатита В
Вакцина против гепатита В рекомендуется для всех младенцев и детей в возрасте до 18 лет Всемирной организацией здравоохранения (ВОЗ) и Центрами США по контролю и профилактике заболеваний.
Каждый человек может быть подвержен некоторому риску заражения гепатитом В в течение своей жизни, поэтому все люди должны рассмотреть вопрос о получении вакцины против гепатита В.
Однако есть группы, которым рекомендуется обязательно сделать прививку против гепатита В:
- Все младенцы, начиная с рождения.
- Все дети в возрасте до 19 лет, которые не были вакцинированы ранее.
- Половые партнеры людей с гепатитом B.
- Сексуально активные лица, не состоящие в длительных взаимно моногамных отношениях (например, > 1 партнер в течение предыдущих 6 месяцев).
- Пациенты, проходящие оценку или лечение венерических заболеваний.
- Мужчины, имеющие половые контакты с мужчинами.
- Люди, использующие инъекционные наркотики.
- Семейное окружение людей с положительным гепатитом В.
- Работники здравоохранения и службы общественной безопасности, которые подвержены риску воздействия крови.
- Лица с терминальной стадией почечной недостаточности, включая планируемый диализ, гемодиализ, перитонеальный диализ.
- Путешественники и семьи, усыновляющие детей из стран, где распространен гепатит В (например, Азия, Африка, Южная Америка, острова Тихого океана, Восточная Европа и Ближний Восток).
- Пациенты с хроническим заболеванием печени, кроме гепатита В (например, цирроз печени, ожирение печени и т. д.).
- Лица, зараженные гепатитом С.
- Лица с ВИЧ-инфекцией.
- Взрослые с диабетом в возрасте от 19 до 59 лет.
Трехдозовый график вакцинации против гепатита В
Вакцина против гепатита В доступна в местном отделе здравоохранения или клинике. Для завершения серии вакцин против гепатита В обычно требуются три дозы, хотя для подростков в возрасте от 11 до 15 лет существует ускоренная серия из двух доз. Важно помнить, что дети, рожденные от инфицированных матерей, должны получить первую дозу вакцины против гепатита В в роддоме в течение первых 12 часов жизни.
- 1-й укол/доза – в любой момент времени, но новорожденные должны получать эту дозу в родильной комнате.
- 2-й укол/доза – через один месяц (или 28 дней) после 1-го.
- 3-й укол/доза – когда прошло не менее 4 месяцев (16 недель) после 1-го (и не менее 2 месяцев после 2-го). Младенцы должны быть не старше 24 недель во время 3-го вакцинирования.
В ноябре 2017 года FDA одобрило новую вакцину для использования в США. Heplisav-B® (Dynavax) – это двухдозная рекомбинантная адъювантная вакцина, одобренная для применения у взрослых в возрасте 18 лет и старше.
Схема введения Heplisav-B против гепатита В для взрослых: вакцина вводится в виде двух доз с интервалом в один месяц.
Безопасность вакцины против гепатита В и побочные эффекты
В мире было сделано более 1 миллиарда доз вакцины против гепатита В, и она считается одной из самых безопасных и эффективных вакцин, когда-либо созданных в мире . Всемирная организация здравоохранения, Центры США по контролю и профилактике заболеваний и многие различные медицинские общества провели многочисленные исследования, посвященные безопасности вакцины.
В результате не было обнаружено никаких доказательств того, что вакцина против гепатита В приводит к внезапной смерти детей (SID), аутизму, рассеянному склерозу или другим неврологическим расстройствам.
Общие побочные эффекты от вакцины против гепатита В могут включать в себя болезненность, отек и покраснение в месте инъекции. Вакцина не может быть рекомендована тем, у кого задокументирована дрожжевая аллергия или в анамнезе неблагоприятная реакция на вакцину.
Продолжение статьи
- Часть 1. Гепатит В – пути передачи, риски заражения;
- Часть 2. Симптомы, диагностика гепатита В;
- Часть 3. Лечение и профилактика гепатита В;
- Часть 4. Важные вопросы про гепатит В.
Источник https://diseases.medelement.com/disease/%D0%B3%D0%B5%D0%BF%D0%B0%D1%82%D0%B8%D1%82-%D0%B2-%D1%83-%D0%B2%D0%B7%D1%80%D0%BE%D1%81%D0%BB%D1%8B%D1%85-%D1%80%D0%B5%D0%BA%D0%BE%D0%BC%D0%B5%D0%BD%D0%B4%D0%B0%D1%86%D0%B8%D0%B8-%D1%80%D1%84/15330
Источник https://probolezny.ru/gepatit-b/
Источник https://unclinic.ru/lechenie-i-profilaktika-gepatita/











