Улучшение функции печени у больных с декомпенсированным циррозом печени после элиминации вируса гепатита С
Изучение показателей белково-синтетической функции печени и портальной гипертензии у больных хроническим гепатитом С (ХГС) с декомпенсированным циррозом печени (ЦП) после успешного лечения препаратами прямого противовирусного действия.
Материалы и методы
В проспективное исследование были включены 50 больных ХГС с декомпенсированным ЦП, получавших препараты прямого противовирусного действия и достигших устойчивого вирусологического ответа (УВО). Оценивали параметры функции печени, портальной гипертензии, в том числе индексы модели терминальной стадии заболевания печени (MELD) и Чайлд-Пью, до и каждые 3-6 месяцев после противовирусной терапии (ПВТ). Медиана продолжительности наблюдения после окончания ПВТ составила 18 (6–42) месяцев.
К концу наблюдения снижение индексов MELD и Чайлд-Пью отмечено у 72% и 74% больных, соответственно. У 52% больных наблюдалась компенсация ЦП (переход в класс А по Чайлд-Пью), у 89% больных с ЦП класса С – уменьшение выраженности декомпенсации (переход в класс B), у 7,3% – ухудшение состояния (переход в класс С). Активность аланинаминотрансферазы (АЛТ) нормализовалась у 90% пациентов, у половины из них активность аспартатаминтрансферазы (АСТ) оставалась повышенной. Число тромбоцитов достоверно увеличилось (р=0,016). Асцит был купирован или уменьшился у 57% больных. По результатам многофакторного регрессионного анализа Кокса мужской пол (отношение шансов [ОШ] 5,19, p=0,003) и исходный уровень альбумина менее 32 г/л (ОШ 2,97, р=0,022) оказались независимыми факторами риска, ассоциировавшимися с отсутствием компенсации ЦП к концу наблюдения.
Эрадикация вируса гепатита С приводит к снижению индексов MELD и ЧайлдПью у большинства больных с декомпенсированным ЦП и компенсации заболевания у половины из них.
Метки статьи
Вирус гепатита С (ВГС) является одной из основных причин цирроза печени (ЦП), гепатоцеллюлярной карциномы (ГЦК) и трансплантации печени в мире. Ежегодный риск декомпенсации ЦП (кровотечение из варикозно расширенных вен пищевода и желудка, асцит, печеночная недостаточность, печеночная энцефалопатия) и развития ГЦК составляет около 3–6% [1,2]. Смертность у таких пациентов достигает 60% в течение 5 лет [3,4]. Ранее было показано, что у больных с компенсированным ЦП эрадикация ВГС в результате лечения препаратами интерферона-альфа и рибавирина приводит к снижению риска прогрессирования заболевания и улучшению выживаемости [5-7].
Препараты с прямым противовирусным действием значительно увеличили эффективность и безопасность лечения ХГС, в том числе у больных с декомпенсированным ЦП, которым ранее лечение не проводилось из-за низкой эффективности и высокой частоты развития серьезных нежелательных явлений, обусловленных интерферономальфа [8-10]. Наряду с высокой частотой устойчивого вирусологического ответа (УВО; 80-90% случаев), у значительной части больных с декомпенсированным ЦП, в том числе находящихся в листе ожидания трансплантации печени, отмечается улучшение функции печени, включая снижение баллов по шкале Чайлд-Пью и индекса модели терминальной стадии заболевания печени (MELD) [11-14]. Тем не менее, данных о долгосрочном влиянии элиминации ВГС на течение и прогноз при декомпенсированном ЦП недостаточно.
Целью исследования было изучение основных показателей белково-синтетической функции печени и портальной гипертензии, в том числе динамики индексов MELD и Чайлд-Пью, у пациентов с декомпенсированным ЦП после эрадикации ВГС.
Материал и методы
В исследование включали больных ХГС с декомпенсированным ЦП (класс В и С по Чайлд-Пью), получавших препараты прямого противовирусного действия с сентября 2014 г. по июль 2018 г. и достигших УВО (неопределяемый уровень РНК ВГС в сыворотке крови методом полимеразной цепной реакции через 12 недель после окончания терапии).
Критериями исключения были следующие: класс А по Чайлд-Пью, другие сопутствующие причины поражения печени, наличие ГЦК или рака другого типа и локализации на момент начала ПВТ, перенесенная трансплантация печени. Демографические, клинико-лабораторные и ин стру ментальные характеристики изучали у каждого пациента не более чем за 3 месяца до начала ПВТ. У каждого пациента определяли генотип ВГС и вирусную нагрузку, показатели общего анализа крови, активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глутамилтрансферазы (ГГТ), щелочной фосфатазы (ЩФ), уровень альбумина, общего и прямого билирубина сыворотки, протромбиновый индекс (ПТИ), международное нормализованное отношение (МНО), альфа-фетопротеин. Всем больным выполняли эзофагогастродуоденоскопию, ультразвуковое исследование органов брюшной полости и/или контрастные методы визуализации (КТ, МРТ печени с контрастным усилением).
После достижения УВО у пациентов каждые 3-6 месяцев изучали параметры функции печени, портальной гипертензии и динамику баллов по шкале Чайлд-Пью и MELD. Результаты представлены в трех временных интервалах: до лечения, на момент достижения УВО и последнего обследования.
Статистический анализ выполнен с помощью программ IBM SPSS Statistics (version 21) и GraphPad Prism 8. Количественные переменные представлены в виде медианы (диапазона), категориальные – в виде числа и процента. Изучение динамики показателей проведено с помощью tкритерия Стьюдента, критериев Вилкоксона и МакНемара. Сравнительный анализ двух независимых групп проводился при помощи t-критерия Стьюдента для количественных показателей, U-критерия Манна-Уитни – для категориальных. Для сравнения качественных признаков использовали критерий c2. Регрессионный анализ Кокса применяли для выявления независимых факторов риска наступления событий. Достоверным считали уровень значимости р
Результаты
В исследование были включены 50 больных ХГС с декомпенсированным ЦП (табл. 1). Тридцать (60%) пациентов получали софосбувир + даклатасвир, 5 (10%) – даклатасвир + асунапревир, 5 (10%) – софосбувир/ ледипасвир, 5 (10%) – софосбувир/велпатасвир, 2 (4%) – паритапревир/ритонавир/омбитасвир + дасабувир, 1 (2%) – софосбувир + симепревир, 2 (4%) – софосбувир + рибавирин, 24 (48%) – дополнительно рибавирин. Продолжительность лечения составила от 12 до 24 недель, медиана продолжительности наблюдения после окончания ПВТ – 18 (6–42) месяцев.
| Параметр | Значение |
|---|---|
| Мужчины, n (%) | 29 (58) |
| Возраст, лет (диапазон) | 53,5 (33–79) |
| Индекс массы тела, кг/м 2 (диапазон) | 27,3 (19,0–39,2) |
| Сахарный диабет, n (%) | 7 (14) |
| Злоупотребление алкоголем, n (%) | 10 (20) |
| 1 генотип вируса, n (%) | 36 (72) |
| РНК ВГС, МЕ/мл (диапазон) | 2,7×104 [5600-6,8×106] |
| Не получали ранее ПВТ, n (%) | 38 (76) |
| Софосбувир-содержащие схемы, n (%) | 43 (86) |
| Рибавирин, n (%) | 24 (48) |
| Класс по Чайлд-Пью, n (%) | |
| В | 41 (82) |
| С | 9 (18) |
| Эластометрия печени, кПа, (диапазон), | 28,7 (14,6-70,0) |
| n=20 |
Биохимический ответ. Нормализация активности АЛТ и АСТ на момент последнего осмотра отмечена у 90% и 51% больных, соответственно (табл. 2). Медиана снижения активности АЛТ и АСТ к окончанию наблюдения составила 53 Ед/л и 43 Ед/л, соответственно.
| Показатели | Исходно | УВО | В конце наблюдения | р* | p** |
|---|---|---|---|---|---|
| Примечание: *достоверность различий показателей на момент УВО по сравнению с исходным, ** достоверность различий показателей в конце наблюдения по сравнению с исходными. ВРПВ — варикозное расширение вен пищевода | |||||
| Класс по Чайлд-Пью, n (%) | |||||
| A | 0 | 18 (36) | 26 (52) | ||
| B | 41 (80) | 24 (48) | 20 (40) | ||
| C | 9 (18) | 8 (16) | 4 (8) | ||
| Сумма баллов Чайлд-Пью (диапазон) | 8 (7-11) | 7 (5-11) | 6 (5-11) | ||
| Индекс MELD (диапазон) | 15 (8-21) | 14 (6-21) | 13 (8-19) | 0,001 | |
| Тромбоциты, ×10 9 /л (диапазон) | 69 (30-190) | 70 (34-187) | 74 (32-172) | 0,262 | 0,016 |
| Тромбоциты ≤90 ×10 9 /л, n (%) | 40 (80) | 37 (74) | 33 (66) | 0,072 | 0,024 |
| Альбумин, г/л (диапазон) | 32 (21-40) | 34 (24-43) | 36,8 (23-47) | ||
| Альбумин ≤35 г/л, n (%) | 44 (88) | 35 (70) | 18 (36) | ||
| Общий билирубин, мкмоль/л (диапазон) | 33,5 (12,5-70,6) | 29,8 (7,5-70,0) | 25,2 (7,1-70,0) | 0,005 | 0,004 |
| Общий билирубин ≥21мкмоль/л, n (%) | 40 (80) | 34 (68) | 31 (62) | 0,018 | 0,007 |
| Холинэстераза, ед/л (диапазон) | 3553,5 (1014-6031) | 4117 (1240-6513) | 4477 (1274-8486) | 0,001 | |
| Холинэстераза ≤3650 Ед/л, n (%) | 25 (50) | 19 (38) | 13 (26) | ||
| ПТИ, % (диапазон) | 59 (40-105) | 62 (43-105) | 66 (50-92) | 0,493 | 0,008 |
| ПТИ ≤70%, n (%) | 38 (76) | 33 (66) | 30 (60) | 0,083 | 0,020 |
| АЛТ, МЕ/л (диапазон) | 64 (24-266) | 28 (10-78) | 24 (7-78) | ||
| АЛТ ≥49 Ед/л, n (%) | 32 (64) | 11 (22) | 4 (8) | ||
| АСТ, МЕ/л (диапазон) | 75 (22-255) | 35 (20-104) | 33 (14-92) | ||
| АСТ ≥34 Ед/л, n (%) | 47 (94) | 28 (56) | 24 (48) | ||
| Асцит, n (%) | 35 (70) | 21 (42) | 21 (42) | ||
| Энцефалопатия, n (%) | 18 (35) | 17 (33) | 14 (28) | 0,218 | 0,139 |
| ВРВП, степень 2/3, n (%) | 33 (66) | 33 (66) | 35 (70) | 0,411 | 0,248 |
Уровень общего билирубина снизился с 33,5 [12,570,6] до 25,2 [7,1-70,0] мкмоль/л (p=0,004), медиана снижения составила 7,9 мкмоль/л. Уровень общего билирубина на момент последнего осмотра нормализовался 9 (22,5%) из 40 больных.
ПТИ увеличился с 59% [40-105] до 66% [50-92] (р=0,008), медиана изменения составила +10%. ПТИ нормализовался в 10 (26,3%) из 38 случаев.
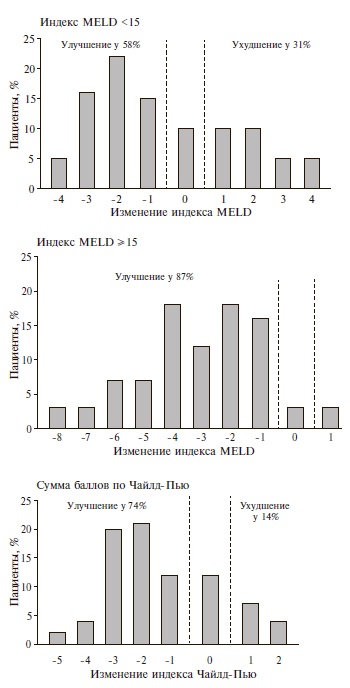
Изменения индекса MELD и Чайлд-Пью. Индекс MELD снизился у 39 (72%) пациентов, в среднем на 3 балла (от 1 до 7), увеличился – у 7 (16%), в среднем на 1,5 балла (от 1 до 6), и не изменился у 4 (12%). У 25 (80,6%) из 31 больного с исходным индексом MELD>15 баллов отмечено улучшение и у 3 (9,7%) – ухудшение показателя MELD (рис. 1).
У 26 (52%) больных отмечена компенсация заболевания (переход в класс А), у 8 (89%) больных с ЦП класса С по Чайлд-Пью – уменьшение выраженности декомпенсации (переход в класс B), у 3 (7,3%) больных – ухудшение состояния (переход в класс С). В целом, у 37 (74%) больных отмечено снижение суммы баллов по Чайлд-Пью, у 6 (12%) – увеличение, еще у 7 (14%) сумма баллов не изменилась (рис. 1).
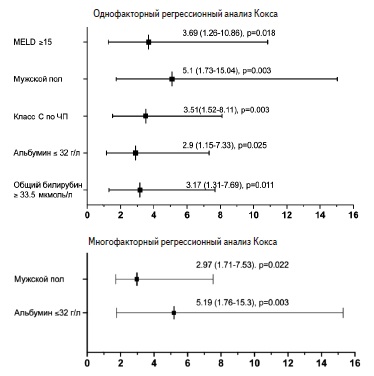
По данным однофакторного регрессионного анализа Кокса, мужской пол (отношение шансов [ОШ] 5,1, р=0,003), класс С по Чайлд-Пью (ОШ 3,51, р=0,003), индекс MELD ≥15 (ОШ 3,69, р=0,018), уровень альбумина ≤32 г/л (ОШ 2,9, р=0,025), общего билирубина ≥33,5 мкмоль/л (ОШ 3,17, р=0,011) достоверно ассоциировались с отсутствием компенсации ЦП при последнем осмотре (рис. 2). По данным многофакторного регрессионного анализа Кокса, мужской пол (ОШ 5,19, р=0,003) и уровень альбумина ≤32 г/л (ОШ 2,97, р=0,022) оказались независимыми факторами риска отсутствия компенсации ЦП (рис. 2).
Обсуждение
Заключение
В нашем исследовании активность АЛТ нормализовалась у 90% больных, однако у половины из них активность АСТ оставалась повышенной, что, вероятно, связано с нарушением функции синусоидальных клеток печени при ЦП и, как следствие, снижением захвата АСТ, а также наличием у этих больных более тяжелого повреждения гепатоцитов и высвобождением в кровоток, наряду с цитоплазматической, митохондриальной фракции АСТ [20-22]. Аналогичные результаты получены в другом исследовании, в котором среди 80 Эрадикация ВГС привела к снижению индексов MELD и Чайлд-Пью у большинства больных с декомпенсированным ЦП и компенсации заболевания (переход в класс А по Чайлд-Пью) у половины из них. Несмотря на нормализацию АЛТ у большинства больных, примерно в половине случаев АСТ оставалась повышенной. Установлено достоверное улучшение ряда параметров портальной гипертензии у большинства пациентов к концу наблюдения (повышение количества тромбоцитов, купирование или уменьшение асцита). Мужской пол и исходный уровень альбумина менее 32 г/л оказались независимыми факторами риска отсутствия компенсации ЦП. Таким образом, наше исследование демонстрирует эффективность и безопасность ПВТ у больных ХГС и декомпенсированным ЦП. Однако, требуется дальнейшее изучение влияния эрадикации вируса на прогноз и выживаемость у данной группы пациентов в рамках более крупных и длительных исследований.
Используемые источники
- Sangiovanni A, Prati GM, Fasani P, et al. The natural history of compensated cirrhosis due to hepatitis C virus: a 17-year cohort study of 214 patients. Hepa to logy 2006;43(6):1303-10.
- Toshikuni N, Izumi A, Nishino K, et al. Comparison of outcomes between patients with alcoholic cirrhosis and those with hepatitis C virus-related cirrhosis. J Gastroenterol Hepatol 2009;24:1276–83.
- McDonald SA, Innes HA, Aspinall E, et al. Prognosis of 1169 hepatitis C chronically infected patients with decompensated cirrhosis in the predirect-acting antiviral era. J Viral Hepat 2017;24(4):295-30.
- Planas R, Balleste B, Alvarez M, et al. Natural history of decompensated hepatitis C virus related cirrhosis: a study of 200 patients. J Hepatol 2004;40:823–30.
- Shiratori Y, Ito Y, Yokosuka O, et al. Antiviral therapy for cirrhotic hepatitis C: association with reduced hepatocellular carcinoma development and improved survival. Ann Int Med 2005;142(2):105-14.
- Bruno S, Stroffolini T, Colombo M etal. Sustained virological response to interferon-alpha is associated with improved outcome in HCV related cirrhosis: a retrospective study. Hepatology 2007;45:579–87.
- Aleman S, Rahbin N, Weiland O, et al. A risk for hepatocellular carcinoma persists long-term after sustained virologic response in patients with hepatitis C – associated liver cirrhosis. Clin Infect Dis 2013;57:230-6.
- Charlton M, Everson GT, Flamm SL, et al. Ledipasvir and sofosbuvir plus ribavirin for treatment of HCV infection in patients with advanced liver disease. Gastroenterology 2015;149:649–59.
- Manns M, Samuel D, Gane EJ, et al. Ledipasvir and sofosbuvir plus ribavirin in patients with genotype 1 or 4 hepatitis C virus infection and advanced liver disease: a multicentre, open-label, randomised, phase 2 trial. Lancet Infect Dis 2016;16:685–97.
- Poordad F, Schi ER, Vierling JM, et al. Daclatasvir with sofosbuvir and ribavirin for hepatitis C virus infection with advanced cirrhosis or post-liver transplantation recurrence. Hepatology 2016;63:1493–505.
- Curry MP, O’Leary JG, Bzowej N, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med 2015;373:2618–28.
- Deterding K, Honer zu Siederdissen C, Port K, et al. Improvement of liver function parameters in advanced HCV – associated liver cirrhosis by IFN-free antiviral therapies. Aliment Pharmacol Ther 2015;42:889–901.
- Foster GR, Irving WL, Cheung MC, et al. Impact of direct acting antiviral therapy in patients with chronic hepatitis C and decompensated cirrhosis. J Hepatol 2016;64:1224–31.
- Pascasio JM, Vinaixa C, Ferrer MT, et al. Clinical outcomes of patients undergoing antiviral therapy while awaiting liver transplantation. J Hepatol 2017;67(6): 1168-76.
- Kozbial K, Moser S., Al-Zoairy R, et al. Follow-up of sustained virologic responders with hepatitis C and advanced liver disease after interferon/ribavirin-free treatment. Liver Int 2018;38(6):1028-35.
- Mazzarelli C, Carey I, Childs K, et al. Predictors of clinical improvement among HCV patients with advanced liver disease treated with DAA: a single center experience. J Hepatol 2018;68(1):S537.
- Sabry A, Abdelsameea E, Tharwa E, et al. Impact of new direct-acting antiviral drugs on hepatitis C virus-related decompensated liver cirrhosis. Eur J Gastro ente rol Hepatol 2019;31(1):53-8.
- Gentile I, Scotto R, Coppola C, et al. Treatment with direct-acting antivirals improves the clinical outcome in patients with HCV-related decompensated cirrhosis: results from an Italian real-life cohort (Liver Network Activity-LINA cohort). Hepatol Int 2019;13(1):66-74.
- El-Sherif O, Gordon Jiang Z, Tapper EB, et al. Baseline factors associated with improvements in decompensated cirrhosis after direct-acting antiviral therapy for hepatitis C virus infection. Gastroenterol 2018;154:2111-21.
- Giannini E, Botta F, Fasoli A, et al. Progressive liver functional impairment is associated with an increase in AST/ALT ratio. Dig Dis Sci 1999;44(6):1249-53.
- Sheth SG, Flamm SL, Gordon FD, et al. AST/ALT ratio predicts cirrhosis in patients with chronic hepatitis C virus infection. Am J Gastroenterol 1998;93: 44–8.
- Park GJ, Lin BP, Ngu MC, et al. Aspartate aminotransferase: alanine aminotransferase ratio in chronic hepatitis C infection: is it a useful predictor of cirrhosis? J Gastroenterol Hepatol 2000;15:386–90.
- Romano J, Sims OT, Richman J, et al. Resolution of ascites and hepatic encephalopathy and absence of variceal bleeding in decompensated hepatitis C virus cirrhosis patients. JGH Open 2018;2(6):317-21.
Вирусный гепатит с и цирроз печени лечение
В статье представлен клинический случай пациента с диагнозом «цирроз печени, класс В по Чайлд — Пью» в исходе хронического гепатита С, пролеченного препаратами интерферона и рибавирина в течение 18 мес. На фоне противовирусной терапии РНК вируса гепатита С стала отрицательной через 8 нед. и оставалась стойко отрицательной на протяжении 2-х лет. В последующем на фоне стресса, через 3 мес. после окончания лечения возник рецидив хронического гепатита С с умеренной биохимической и вирусологической активностью. Через 6 мес. после рецидива при ультразвуковом исследовании был заподозрен рак печени, было получено гистологическое подтверждение. Через несколько месяцев у пациента развилось кровотечение из варикозно расширенных вен пищевода (ВРВП), а еще через 1 мес. возникло повторное кровотечение из ВРВП. Пациент наблюдался и лечился в реанимационном отделении. Появились асцит, двусторонняя пневмония, лихорадка, лейкоцитоз. Состояние больного прогрессивно ухудшалось, и при нарастающем психомоторном возбуждении, прогрессирующей дыхательной и сердечно-сосудистой недостаточности была зафиксирована биологическая смерть.
Имело место расхождение диагнозов, категория II. Причиной летального исхода стала гнойная интоксикация в результате перфорации язв пищевода, гнойного медиастинита с эмпиемой плевры слева.
Ключевые слова: хронический гепатит С, цирроз печени, гепатоцеллюлярная карцинома.
V.V. Makashova 1,2 , H.G. Omarova 1 , O.N. Hohlova 1 , T.N. Lukashenko 3
1 Central Research Institute of Epidemiology, Moscow
2 Clinical Hospital for the Infectious Diseases, Moscow
3 Outpatient Clinic № 5, Moscow
The article presents a clinical case of a patient with a diagnosis of liver cirrhosis of Child-Pugh class B in the outcome of chronic hepatitis C, treated with interferon and ribavirin for 18 months. In the course of antiviral therapy, RNA of the hepatitis C virus became negative after 8 weeks and remained steadily negative for 2 years. Subsequently, on the background of stress, 3 months after the end of treatment, a relapse of chronic hepatitis C appeared with moderate biochemical and virological activity. 6 months after the relapse, a liver cancer was suspected during an ultrasound examination and histological confirmation was obtained. After a few months, hemorrhage from esophageal varicose veins dilatation (EVVD) occurred in the patient, and after another 1 month, there was repeated hemorrhage from EVVD. The patient was monitored and treated in the intensive care department. Ascites, bilateral pneumonia, fever, leukocytosis appeared. The patient’s condition progressively worsened and with increasing psychomotor agitation, progressive respiratory and cardiovascular insufficiency, biological death was recorded.
There was a divergence of diagnoses, category II. The cause of the fatal outcome was purulent intoxication, as a result of ulcers perforation of the esophagus, purulent mediastinitis with pleural empyema on the left.
Key words: chronic hepatitis C, cirrhosis, hepatocellular carcinoma.
For citation: Makashova V.V., Omarova H.G., Hohlova O.N., Lukashenko T.N. Chronic hepatitis C virus with the outcome of cirrhosis and hepatocellular carcinoma (clinical observation) // RMJ. Medical Review. 2018. № 8(II). P. 92–96.
Ключевые слова:
В статье представлен клинический случай пациента с диагнозом «цирроз печени, класс В по Чайлд — Пью» в исходе хронического гепатита С с развитием гепатоцеллюлярной карциномы
Актуальность
Вирусные гепатиты до настоящего времени остаются одной из самых актуальных проблем мирового здравоохранения, занимая 7-е место среди причин летальности от всех заболеваний. По последним оценкам ВОЗ, число больных хроническим гепатитом С (ХГС) в мире в 2015 г. составило 71 млн (1% населения Земли) [1].
ВОЗ назвала гепатит «вирусной бомбой замедленного действия», тем самым привлекая внимание к огромным человеческим, социальным и экономическим затратам, связанным с этим заболеванием [2].
Более 350 тыс. человек умирают ежегодно от болезней, связанных с гепатитом С. В России средний уровень обнаружения антител к вирусу гепатита С в популяции колеблется от 0,3% до 0,7% и увеличивается с возрастом, достигая максимума среди лиц старше 40 лет — 2,5–4% [3].
Значимость проблемы ХГС определяется не только самой болезнью, но и увеличением риска формирования отдаленных неблагоприятных последствий — цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК). Вирусные ЦП (в исходе хронических гепатитов В, С, В+D) составляют от 10% до 23,5% всех ЦП. В США вирусный гепатит С в качестве причины ЦП вышел на 1-е место и является причиной формирования ЦП в 26% случаев. В последние годы структура вирусных ЦП изменилась в сторону увеличения доли ЦП до 30,3% в исходе ХГС. В России в этиологической структуре ЦП (кроме алкогольного) вирусные гепатиты В и С составляют 73,3%, из которых ХГС — 58,2% [4].
Согласно результатам метаанализа, через 20 лет после инфицирования ЦП формируется в среднем у 16% больных [5]. Вероятность развития ЦП значительно выше у пациентов, коинфицированных вирусом иммунодефицита человека, вирусом гепатита В или употребляющих алкоголь [6, 7]. При этом установлено, что употребление алкоголя при сочетанном инфицировании вирусами гепатита B и С у женщин приводит к более быстрому развитию ЦП по сравнению с мужчинами [8].
По данным EASL, ГЦК, составляющая 70–90% случаев первичного рака печени, стоит на 5-м месте среди причин рака в Европе: 1–13 новых случаев и 1–10 смертей на 100 тыс. жителей в год [3]. ГЦК после возникновения ЦП, связанного с инфицированием вирусным гепатитом С (HCV), развивается со скоростью до 8% в год (в среднем 1–4%) [9]. Кроме этого, ГЦК может возникать на ранних стадиях фиброза или даже без него [10].
В связи с вышеизложенным представляется интересным и крайне поучительным наблюдение из клинической практики.
Клиническое наблюдение
Пациент Т., 1948 г. р., 22.01.2009 г. обратился в поликлинику к инфекционисту в связи с лейкопенией (до 3,2×10 9 /л), тромбоцитопенией (60–120×10 9 ). Со слов пациента, антитела к HCV впервые выявлены в 1998 г. Не обследовался, не лечился. Впервые обследовался в поликлинике ФСБ № 5 в 2009 г., выявлена РНК HCV+, 1в генотип, вирусная нагрузка — 1,3×10 6 коп/мл.
Жалобы на периодически возникающую слабость и утомляемость.
Перенесенные заболевания: 1972 г. — аппендэктомия, 1992 г. — острый вирусный гепатит А, 1995 г. — оперирован по поводу синдрома Меллори — Вейса. В это же время были гемотрансфузии. 1996 г. — грыжесечение, 1997 г. — повторное грыжесечение, 2004 г. — язвенная болезнь 12-перстной кишки, 2005 г. — правостороннее воспаление легких, хронический бронхит, 2007 г. — повторная пневмония, 2007 г. — сильное кровотечение при удалении зубов, гипертоническая болезнь, сахарный диабет 2-го типа.
Аллергоанамнез — не отягощен.
Наследственность: у отца — цирроз печени алкогольного генеза, у матери — инсульт, у брата — хронический вирусный гепатит В.
Вредные привычки: не курит, алкоголь употреблял часто, но немного (со слов), крепкие напитки (виски, коньяк).
Объективно при осмотре: сосудистые звездочки в области грудной клетки, умеренная пальмарная эритема, иктеричность склер. Печень пальпаторно и перкуторно увеличена — выступает на 4–5 см ниже реберной дуги, селезенка не пальпируется.
Рост — 173 см, вес — 80 кг.
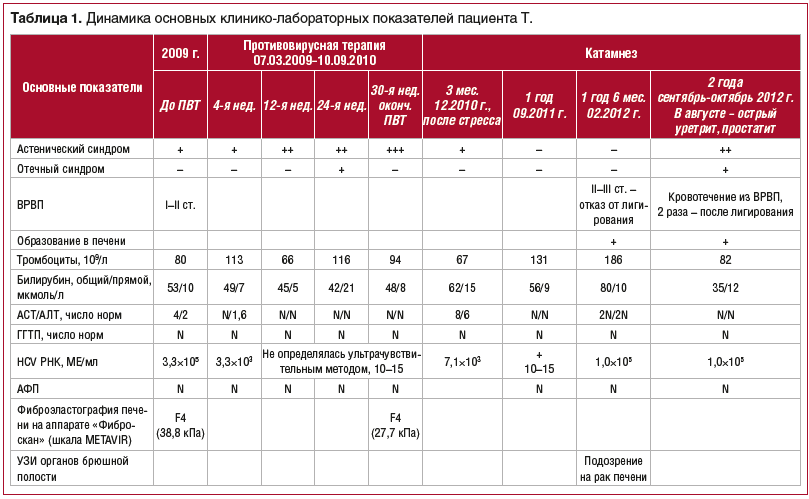
Динамика основных показателей общего и биохимического анализов крови, данные ПЦР-диагностики представлены в таблице 1.
02.02.2009 г. проведено ультразвуковое исследование (УЗИ), выявлены диффузные изменения в печени, увеличение левой доли печени (8,4 см, норма — до 7,0 см), хронический бескаменный холецистит, желчный пузырь деформирован с перегибом в теле; умеренное увеличение селезенки (13,8×6,9 см), киста правой почки.
11.03.2009 г. Фиброэластография печени: F4 по шкале METAVIR (кПа — 38,8).
Эзофагогастродуоденоскопия (ЭГДС) 20.03.2009 г. — варикозно расширенные вены пищевода (ВРВП) 1–2 ст., эрозивный бульбит.
С 07.03.2009 г. по 10.09.2010 г. проводилось противовирусное лечение препаратами интерферон альфа-2b 1 млн через день и рибавирин 800 мг/сут (по весу); постоянно получал урсодезоксихолевую кислоту 750 мг/сут.
Через 8 нед. противовирусной терапии РНК HCV не определялась (менее 500 МЕ/мл), аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (ACT) — в норме, билирубин общий — до 42 мкм/л.
Через 6 мес. после начала противовирусной терапии состояние ухудшилось, в связи с чем был госпитализирован в ГБУЗ ИКБ № 2 ДЗМ, где находился с 08.09.2009 г. по 27.09.2009 г. Впервые выявлен асцит, по данным УЗИ увеличены печень (15 см — правая доля), селезенка (143×67 мм), Vena portae — 15 мм, селезеночная вена — 10 мм. Проведено лечение: альбумин 100 мл № 3, адеметионин, мочегонные препараты (спиронолактон, фуросемид), пропранолол 20 мг. Самочувствие и состояние значительно улучшились. В последующий период наблюдения асцит не отмечался.
Через 1,5 года стандартной противовирусной терапии (интерферон короткого действия и рибавирин) пациент жалоб не предъявлял, достигнута положительная динамика по данным УЗИ, фиброэластографии печени (эластичность печени снизилась с 38,8 до 27,7 кПа), печеночные трансаминазы и количество тромбоцитов нормализовались. РНК HCV стойко не определялась.
У пациента через 2 мес. после окончания противовирусной терапии был стресс, а через 3 мес. однократно была обнаружена РНК HCV (7,1×10 3 МЕ/мл) от 02.12.2010 г., повысилась активность ферментов (8 N).
Назначен гепатопротектор (расторопши пятнистой плодов экстракт 140 мг/сут). Через 1 мес. активность трансаминаз стала нормальной, РНК HCV не определялась ультрачувствительным методом в течение 1 года 3 мес. В марте 2012 г. при повышении активности ферментов в 2,5 раза вновь была обнаружена РНК вируса гепатита С — 1,0×10 5 МЕ/мл.
Были проанализированы показатели иммунного статуса в динамике — на фоне противовирусного лечения при декомпенсации ЦП, при окончании противовирусной терапии и в катамнезе. Выявлено, что на фоне противовирусной терапии в период декомпенсации ЦП отмечалось увеличение Т-хелперной активности при снижении цитотоксических Т-лимфоцитов, при этом иммунорегуляторный индекс оставался выше нормы. Одновременно отмечалось снижение показателей В-лимфоцитов, натуральных киллеров (NK-клеток) и TNK-клеток (Т-клетки с функциями NK-клеток), что говорит о нарушении не только гуморального, но и клеточного звена иммунного ответа и может свидетельствовать о формировании иммунодефицита. На фоне длительной противовирусной терапии пациент был обследован повторно через 1 год 3 мес. Обнаружено, что показатели всех субпопуляций Т-лимфоцитов нормализовались. Кроме этого, отмечалось выраженное увеличение показателей В-лимфоцитов (до 30%) и антител класса IgG (увеличены в 2 раза по сравнению с показателями после 6-месячного лечения). Однако клеточное (NK-клетки) звено иммунитета оставалось несостоятельным. Показатели катамнестического третьего иммунологического статуса не отличались от таковых при предыдущем исследовании. Такое медленное восстановление иммунной системы можно объяснить вновь обнаруженной репликацией HCV и ухудшением биохимических показателей.
Планировался курс повторной противовирусной терапии ХГС.
Однако 28.02.2011 г. возникла клиническая картина кровотечения из ВРВП (на фоне астенических явлений: резкое снижение уровня гемоглобина — до 92 г/л, эритроцитов — до 3,6×10 12 /л). Пациент отказался от консультации и госпитализации в отделение портальной гипертензии, необходимой для склерозирования ВРВП.
При ЭГДС от 04.03.2011 г. — ВРВП 2–3 ст., на момент осмотра — без признаков состоявшегося кровотечения или картины нестабильного местного гемостаза. Поверхностный гастродуоденит, очаговый эрозивный гастрит выходного отдела без геморрагического компонента.
Пациент постоянно получал урсодезоксихолевую кислоту 750 мг, карведилол 125 мг.
На УЗИ от 10.04.2012 г. (предыдущее — от 06.09.2011 г.)
впервые выявлено образование в правой доле печени до 3 см, смешанной эхогенности, с нечеткими контурами.
13.04.2012 г. Компьютерная томография (КТ): при и после в/в болюсного контрастирования: в артериальную фазу контрастирования на границе 7–8 сегмента и в 6 сегменте печени определяются 3 округлой формы зоны активного и равномерного накопления контрастного препарата: 1,2×0,9 см, 1,9×1,7 см и 0,8×0,7 см соответственно. Заключение: основное заболевание — ЦП в исходе ХГС. КТ-признаки 3 образований правой доли печени на фоне жирового гепатоза (дифференцировать между узлами регенерации и бластоматозным процессом); умеренно выраженная портальная гипертензия (спленомегалия, умеренное расширение воротной вены (1,4 см), вен желудка и селезенки), аномалия развития почек (подковообразная почка), псевдокисты поджелудочной железы.
24.04.2012 г. Магнитно-резонансная томография органов брюшной полости. Контрастное усиление: гадобутрол. Заключение: косвенные признаки ЦП, портальная гипертензия, спленомегалия. Зоны измененного MP-сигнала в правой доле печени, вероятно, узлы-регенераты. Образование тела поджелудочной железы, вероятно, серозная цистаденома.
В период обследования пациент жалоб не предъявлял, осмотр — без динамики.
Для исключения бластоматозных образований печени на фоне ЦП в исходе ХГС (стадия репликации вируса) и решения вопроса о возможности продолжения противовирусной терапии пациент был направлен на биопсию печени.
С 23.05.2012 г. по 28.05.2012 г. находился в хирургическом отделении ГКБ им. С.П. Боткина для проведения биопсии образования печени под УЗ-наведением.
Макроскопическое описание материала от 24.05.2012 г.:
дифференциальный диагноз между гепатоцеллюлярной аденомой и высокодифференцированным гепатоцеллюлярным раком (ГЦР). Микроскопическое описание материала от 07.06.2012 г.: фрагмент ткани печени с признаками цирротической трансформации и микроскопическая фрагментированная частица, крайне подозрительная по высокодифференцированной ГЦК с очагами некроза (проконсультировано профессором Г.А. Франком).
Для определения тактики дальнейшего ведения пациент направлен на консультацию в НИИ скорой помощи им. Склифосовского.
В июле пациент уехал в отпуск, в Крым. 18.07.2012 г. отметил подъем температуры до 39 °С, озноб, боли и увеличение правого яичка, рези и боли при мочеиспускании, кровь в конце акта мочеиспускания. Обратился к урологу. Диагноз: острый уретрит, острый простатит. Получал амоксициллин и клавулановую кислоту в течение 5 дней. Состояние улучшилось — уменьшились боли при мочеиспускании и отек яичка.
При возвращении госпитализирован в урологическое отделение ЦВКГ, где находился с 14.08.2012 г. по 31.08.2012 г. с диагнозом «острый простатит, уретрит». В урологическом отделении было кровотечение из ВРВП, остановленное консервативно. После выписки кровотечение из ВРВП повторилось. Был повторно госпитализирован в хирургическое отделение ЦКВГ, где находился с 31.08.2012 г. по 17.09.2012 г. В отделении состояние стабильное, проводилась консервативная терапия: гемостатики (этамзилат, менадиона натрия бисульфит), октреотид, противоязвенная терапия, гепатопротекторы, препараты железа. Рецидива кровотечения не отмечалось. Состояние улучшилось, стул — без признаков мелены, сохранялась анемия, уровень гемоглобина — в пределах 83–92 г/л.
Больной выписан на амбулаторное наблюдение с диагнозом «ЦП, класс В по Чайлд — Пью в исходе ХГС. Портальная гипертензия: ВРВП 4 ст., гепатомегалия. Подозрение на ГЦК в 5 сегменте печени. Состоявшееся кровотечение из ВРВП от 31.08.2012 г. Хроническая анемия смешанного генеза. Гастропатия. Доброкачественная гиперплазия предстательной железы. Аномалия развития верхних мочевых путей: подковообразная почка, без нарушения уродинамики ВМП».
В начале октября 2012 г. в ГКБ № 57 проведено эндоскопическое лигирование вен пищевода по поводу ВРВП.
12.10.2012 г. у больного появилась клиническая картина желудочно-кишечного кровотечения, в связи с чем в экстренном порядке был госпитализирован в ЦКВГ ФСБ РФ.
При поступлении — состояние средней тяжести. Кожные покровы бледные, сухие, теплые. Тошноты, рвоты нет. Температура — 36,5 °С. В сознании, адекватен, ориентирован в пространстве и времени. ЧСС — 90 уд/мин. АД — 120/70 мм рт. ст. ЧДД — 17/мин. Дыхание проводится во все отделы. Язык влажный, обложен белым налетом. Живот мягкий, не вздут, не увеличен, симметричный, участвует в акте дыхания. При пальпации — безболезненный во всех отделах. Перистальтика ослаблена. Дизурии нет. Газы отходят.
Вечером этого же дня пациент отметил рвоту кровью, установлен зонд Блэкмора. В связи с тяжестью состояния больной был переведен в реанимационное отделение. Проводилась инфузионная, спазмолитическая, гемостатическая, антисекреторная терапия. После стабилизации состояния больной переведен в хирургическое отделение. Зонд Блэкмора удален. Состояние пациента оставалось стабильным. Но 19.10.2012 г. появились боли в животе. Проведено УЗИ органов брюшной полости, отмечалось расширение общего печеночного протока, панкреатического протока. При рентгенографии органов брюшной полости патологии не выявлено. На фоне проводимой инфузионно-спазмолитической терапии боли в животе были купированы. Однако 21.10.2012 г. у пациента возник рецидив кровотечения из ВРВП. Переведен повторно в реанимационное отделение, установлен зонд Блэкмора. При динамическом УЗИ органов брюшной полости выявлено большое количество свободной жидкости. Выполнена КТ органов брюшной полости: Заключение: асцит, киста поджелудочной железы, гемангиома 4 сегмента правой доли печени. Двусторонний гидроторакс. Нижнедолевая пневмония. Инфильтрации парапанкреатической клетчатки поджелудочной железы не выявлено. Отмечалось большое количество свободной жидкости в брюшной полости.
В анализе крови — лейкоцитоз до 27×10 9 /л. Для исключения острого панкреатита с ферментативным перитонитом, воспалительных заболеваний органов брюшной полости, пареза кишечника 23.10.2012 г. проведена диагностическая лапароскопия. Интраоперационно выявлен асцит. Другой патологии не выявлено. Выполнены санация и дренирование брюшной полости. На фоне проводимого лечения у пациента отмечались эпизоды рецидива кровотечения из ВРВП. Проводились плазмо- и гемотрансфузии. Несмотря на последующую интенсивную терапию, направленную на коррекцию волемических нарушений, состояние больного прогрессивно ухудшалось. Отмечались психомоторное возбуждение, прогрессирующая дыхательная недостаточность, гипотония. 26.10.2012 г. в 18:30 пациент переведен на ИВЛ, к лечению добавлены вазопрессоры. На фоне прогрессирующей сердечно-сосудистой недостаточности в 19:00 зафиксирована асистолия. Начаты реанимационные мероприятия в полном объеме, интенсивная терапия. Все мероприятия в течение 45 мин были неэффек-
тивны. В 19:45 зафиксирована биологическая смерть.
В отделении причиной смерти указана острая сердечно-сосудистая недостаточность, развившаяся на фоне прогрессирующей полиорганной, сердечно-сосудистой недостаточности.
Основной диагноз: ЦП, класс С по Чайлд — Пью.
Осложнение основного диагноза: портальная гипертензия: ВРВП 4 ст., гепатомегалия. Состоявшееся кровотечение из варикозно расширенных вен пищевода от 12.10.2012 г., 21.10.2012 г., 25.10.2012 г. Постгеморрагическая анемия тяжелой степени. Гастропатия. Асцит. Печеночная недостаточность.
Сопутствующие заболевания: двусторонняя нижнедолевая пневмония. Двусторонний гидроторакс. ИБС: атеросклеротический кардиосклероз, гипертоническая болезнь 2 ст. Язвенная болезнь 12-перстной кишки. Киста поджелудочной железы. Гемангиома 4 сегмента печени.
Патологоанатомический диагноз (после гистологического исследования).
Основное комбинированное заболевание:
Мелкоузловой ЦП.
Операция диагностической лапароскопии 23.10.2012 г.
по поводу подозрения на острый панкреатит с санацией и дренированием брюшной полости.
Фоновые заболевания:
Сахарный диабет (по клиническим данным).
ХГС (по клиническим данным).
Осложнения: варикозное изменение вен пищевода. Эрозивно-язвенный эзофагит нижней трети пищевода с перфорацией в ткани заднего средостения. Гнойный
медиастинит заднего средостения. Эмпиема плевры слева — 3,3 л гнойного экссудата (по данным посмертного бактериологического исследования от 31.10.2012 г.). — Klebsiella pneumoniae, Enterococcus faecalis, Staphylococcus epidermidis. Ателектаз левого легкого. Правосторонний гидроторакс — 0,5 л. Мелкоочаговая бронхопневмония в нижней доле правого легкого. Малокровие оболочек головного мозга и внутренних органов. Асцит (0,4 л). Гепато- и спленомегалия (1375 и 355 г). Мелкоочаговые инфаркты в печени и предстательной железе. Отек правого легкого. Отек головного мозга. Паренхиматозная дистрофия миокарда, почек.
Сопутствующие заболевания: атеросклероз аорты (IV стадия, 3 степень). Мелкоочаговый кардиосклероз миокарда стенок левого желудочка, атеросклероз венечных артерий (IV стадия, 3 степень). Гипертоническая болезнь: эксцентрическая гипертрофия миокарда, стенок левого желудочка (стенка левого желудочка — 1,3 см, масса сердца — 395 г), артерио-артериоло-нефросклероз. Мелкоузловая гиперплазия коркового слоя надпочечников. Железистый тип нодозной гиперплазии предстательной железы. Киста поджелудочной железы. Сахарный диабет 2-го типа (по клиническим данным). Давние операции: аппендэктомия (1972 г.), верхнесрединная лапаротомия (по поводу синдрома Меллори — Вейса, 1995 г.).
Таким образом, при аутопсийном исследовании подтвердился диагноз ЦП и обнаружены: гнойный медиастинит, левосторонняя эмпиема плевры, развившиеся в исходе эрозивно-язвенного эзофагита на фоне сахарного диабета.
Непосредственной причиной смерти больного явилась гнойная интоксикация.
Сличение диагнозов: расхождение диагнозов. Категория II. Причина субъективная — не учтена роль сахарного диабета в развитии гнойных осложнений. Не диагностированы смертельные осложнения: перфорация язв пищевода, гнойный медиастинит с эмпиемой плевры слева. Эндоскопическое исследование проводилось однократно в день поступления, рентгенологически не выявлены тяжелые гнойно-деструктивные изменения в левой плевральной полости и заднем средостении. Причина объективная — тяжесть состояния больного.
Заключение
Подводя итог всей истории болезни пациента Т., 63 лет, можно констатировать, что имел место ЦП, класс В по Чайлд — Пью в исходе ХГС, пролеченного препаратами интерферона и рибавирина в течение 18 мес. На фоне противовирусной терапии РНК HCV стала отрицательной через 8 нед. и оставалась стойко отрицательной на протяжении 2 лет. В последующем на фоне стресса — через 3 мес. после окончания лечения возник рецидив ХГС с умеренной биохимической и вирусологической активностью. С февраля по май 2012 г. проводилось обследование по поводу подозрения на рак печени. Было получено гистологическое подтверждение в институте им. Герцена — развитие ГЦК в 5–6 сегментах печени. В августе 2012 г., после поездки в Крым у больного возникли острый простатит, уретрит, по поводу чего получал антибактериальную терапию. В конце августа — кровотечение из ВРВП с последующим их лигированием в ГКБ № 57. Повторное кровотечение из ВРВП возникло в октябре с дальнейшей госпитализацией в ЦКВГ, где дважды повторилось, несмотря на проводимую терапию. Пациент наблюдался и лечился в реанимационном отделении. Появились асцит, двусторонняя пневмония, лихорадка, лейкоцитоз. Для исключения острого панкреатита была выполнена диагностическая лапароскопия, при которой патологии выявлено не было. Состояние больного прогрессивно ухудшалось, и при нарастающем психомоторном возбуждении, прогрессирующей дыхательной и сердечно-сосудистой недостаточности 26.10.2012 г. была зафиксирована биологическая смерть.
Имело место расхождение диагнозов, категория II.
Проанализировав историю болезни, считаем справедливым заметить, что пациент по записи в истории болезни поступил в состоянии средней тяжести. Скорее всего, тяжесть состояния была недооценена: не учитывался длительный анамнез заболевания, повторные кровотечения из ВРВП, наличие ГЦР. В госпитале не было проведено лигирование вен пищевода, и мы считаем, что больного в первые же дни после поступления необходимо было переводить в специализированное отделение для проведения этой манипуляции и, возможно, пересадки печени.
Трудно оценить адекватность терапии, т. к. в посмертном эпикризе не указано лечение.
В клиническом посмертном эпикризе даже нет упоминания о наличии ГЦР, только упомянута гемангиома 4 сегмента печени, несмотря на то, что пациент предоставил все выписки предыдущих исследований.
При патологоанатомическом вскрытии отсутствуют данные о послойном исследовании ткани печени и наличии ГЦР, а также гистологическом исследовании на наличие опухоли.
Очень важно и крайне необходимо обсуждать все эти вопросы для исключения дальнейших ошибок в ведении и лечении таких сложных пациентов.
Список литературы Свернуть Развернуть
1. Global hepatitis report, 2017: World Health Organization. (Электронный ресурс). URL: http://www.who.int/hepatitis/publications/global-hepatitis-report2017/en (дата обращения: 15.04.2017).
2. Csete J., Elliott R., Fisher B. Viral Time Bomb: Health and Human Rights Challenges in Adressing Hepatitis C in Canada. Toronto: Canadian HIV/AIDS Legal Network, Centre for Additions Research of BC and Centre for Applied Research in Mental Health and Addiction. (Электронный ресурс). URL: http://www.aidslaw.ca/site/wp-content/uploads/2013/11/ViralTime Bomb-ENG.PDF (дата обращения: 15.04.2017).
3. Гепатит С. Информационные бюллетени № 164 и № 204. ВОЗ, 2013 [Gepatit С. Informatsionnyye byulleteni № 164 i № 204. VOZ, 2013 (in Russian)]. (Электронный ресурс). URL: http://www.who.int/mediacentre/factsheets/fs164/ru/;http://www.euro.who.int/__data/assets/pdf_file/0. (дата обращения: 15.04.2017).
4. Хазанов А.И., Плющин С.В., Васильев А.П. и др. Алкогольные и вирусные циррозы печени у стационарных больных (1996–2005 гг.): распространенность и исходы // Рос. журн. гастроэнтерол., гепатол., колопроктол. 2007. Т. 17. № 2. С. 19–27 [Khazanov A.I., Plyusnin S.V., Vasil’yev A.P. i dr. Alkogol’nye i virusnye tsirrozy pecheni u statsionarnykh bol’nykh (1996–2005 gg.): rasprostranennost’ i iskhody. // Rossiyskiy zhurnal gastroenterologii, gepatologii, koloproktologii. 2007. Т. 17. № 2. S. 19–27 (in Russian)].
5. Thein H., Yi Q., Dore G.J., Krahn M.D. Estimation of stage-specific fibrosis progression rates in chronic hepatitis C virus infection: a meta-analysis and meta-regression // Hepatology. 2008. Vol. 48. P. 418–431.
6. Pol S., Haour G., Fontaine H. et al. The negative impact of HBV/HCV coinfection on cirrhosis and its consequences // Aliment Pharmacol Ther. 2017. Vol. 46. P. 1054–1060.
7. Sulkowski M.S., Mehta S.H., Torbenson M.S. et al. Rapid fibrosis progression among HIV/hepatitis C virus-co-infected adults // AIDS. 2007. Vol. 21(16). P. 2209–2216.
8. Stroffolini T., Sagnelli E., Andriulli A. et al. Sex difference in the interaction of alcohol intake, hepatitis B virus, and hepatitis C virus on the risk of cirrhosis // PLoS One. 2017. Vol. 12. P. 185–190.
9. El-Serag H.B. Epidemiology of viral hepatitis and hepatocellular carcinoma // Gastroenterology. 2012. Vol. 14(2). P. 1264–1273.
10. Mittal S., El-Serag H.B., Sada Y.H. et al. Hepatocellular Carcinoma in the Absence of Cirrhosis in United States Veterans is Associated With Nonalcoholic Fatty Liver Disease // Clin Gastroenterol Hepatol. 2016. Vol. 14. P. 124–131.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Цирроз печени: лечение и симптомы
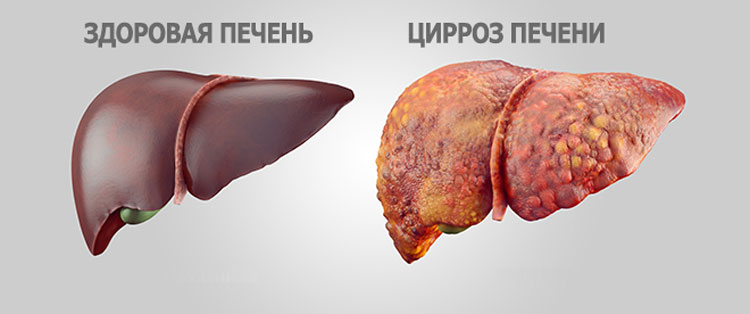
Цирроз печени – хроническое прогрессирующее заболевание печени, характеризующееся перестройкой структуры печеночной ткани и сосудистого русла, уменьшением количества функционирующих печеночных клеток (гепатоцитов), разрастанием соединительной ткани, появлением узлов регенерации и развитием в последующем печеночной недостаточности и портальной гипертензии.
В экономически развитых странах цирроз печени входит в одну из основных причин смерти в возрасте от 35 до 60 лет.
Как проявляется цирроз?
Длительное время цирроз печени протекает бессимптомно или с минимальными нетипичными проявлениями. Появляется слабость, повышенная утомляемость, снижение работоспособности, раздражительность, слезливость, обидчивость, склонность к истерическим реакциям.
Часто возникают расстройства пищеварения: тошнота, рвота, горечь во рту, непереносимость жирной пищи и алкоголя.
Характерными признаками цирроза являются тяжесть и боли в животе, преимущественно в правом подреберье, сосудистые «звездочки» в верхней половине туловища, покраснение ладоней, кровоизлияния в кожу, кровоточивость слизистых оболочек. Нередки жалобы на кожный зуд и боли в суставах.
Тяжелые формы заболевания протекают с грубыми нарушениями функции печени и угрожающими жизни осложнениями, в первую очередь портальной гипертензией (повышение давления в портальной вене), приводящей к кровотечению из расширенных вен пищевода, асциту, печеночно-клеточной недостаточности.
Каковы причины вызывающие цирроз печени?
Наиболее частыми причинами цирроза печени являются:
- хронический вирусный гепатит В (и D),
- гепатит С ,
- хронический алкоголизм (алкогольная болезнь печени) ,
- метаболические нарушения,
из которых основным является метаболический синдром , сопровождающийся жировым гепатозом – неалкогольная жировая болезнь печени (НАЖБП) . Кроме того, цирроз вызывают наследственные заболевания: гемохроматоз, болезнь Вильсона-Коновалова, дефицит альфа-1-антитрипсина и др. , а также аутоиммунные заболевания печени, в том числе первичный билиарный цирроз и токсическое поражение печени промышленными ядами и лекарственными средствами.
Диагностика цирроза печени

1. Оценка состояния печени
Диагноз на ранних стадиях цирроза печени устанавливается с трудом, так как выраженных изменений в печени часто нет. В первую очередь проводится ультразвуковое обследование печени ( УЗИ-диагностика ), которая позволяет выявить диффузные изменения ткани печени, увеличение ее размеров (правда, это происходит не всегда). Желательно проводить допплерографию сосудов брюшной полости с определением ширины просвета сосудов и скорости кровотока. Это позволяет установить наличие признаков портальной гипертензии.
Важным для характеристики структурного и функционально состояния печеночных клеток является биохимический анализ крови ( АЛТ, АСТ, ГГТ, билирубин, щелочная фосфатаза, белковые фракции ), а также клинический анализ крови и коагуллограмма – свертывание крови.
Для точной диагностики степени фиброза используются современные неинвазивные (заменяющие биопсию) методы обследования: эластометрия (эластография) печени на аппарате Фиброскан, Фибротес, ФиброМакс. Поражение печени характеризуется степенями от 0 до 4; 0 – здоровая печень, 4 – цирроз.
2. Установление причины цирроза печени
В первую очередь необходимо сделать анализы на вирусы гепатитов В и С, так как вирусы являются самой частой причиной цирроза, в особенности в сочетании с алкоголем. Если вирусы не выявлены, то поиски причины заключаются в исключении наследственных заболеваний печени, аутоиммунных показателей, а также алкогольной болезни печени, НАЖБП и токсического поражения печени.
- с 9:00 до 17:30 по будням
- с 9:00 до 15:00 в субботу
Запишитесь по телефону
+7 (495) 255-10-60
Без выходных с 9:00 до 21:00
Степень тяжести цирроза определяется по шкале Чайлда-Пью с учетом выраженности клинико-лабораторных данных, основными из которых являются содержание в крови билирубина, альбумина, протромбина, а также выраженности энцефалопатии и асцита. Выделяют активный и неактивный цирроз, компенсированный и декомпенсированный. Для декомпенсированного цирроза характерно развитие портальной гипертензии, появление асцита, возникновение желудочно-кишечных кровотечений.
Стоимость диагностики цирроза печени
Общая стоимость обследования в нашем центре около 30 000 руб. Однако, стоимость обследования может быть существенно снижена при наличии у пациента результатов уже сделанных анализов и обследований из другого профильного медучреждения. Запишитесь на бесплатную консультацию для назначения индивидуального обследования.
Лечение цирроза печени
Лечение цирроза печени проводится с целью прекращения или замедления процессов прогрессирования заболевания и улучшения качества жизни.
Лечебная программа включает: лечебный режим и питание, медикаментозное лечение, профилактику и лечение осложнений.
Результаты лечения и прогнозы зависят от степени тяжести заболевания.
При компенсированном циррозе сохраняется функциональное состояние гепатоцитов, нет признаков портальной гипертензии и нарушения белково-синтетической функции печени. Лечение цирроза на этой стадии заболевания определяется причиной заболевания, в зависимости от которой назначается специфическая терапия. Кроме того необходимо ограничить психические и физические нагрузки.
Если причиной цирроза являются вирусный гепатит В или гепатит С , то назначается противовирусная терапия, которая, как показали исследования последних лет, не только подавляет активность вируса, но и обладает противофиброзным и противоциррозным действием.
При алкогольном циррозе ( алкогольная болезнь печени ) назначаются гепатопротекторы, которые при условии полного отказа от алкоголя дают возможность не только остановить процесс прогрессирования цирроза, но и способствуют снижению степени фиброза.
При метаболическом синдроме и неалкогольной жировой болезни печени (НАЖБ) соблюдение режима и правил питания в сочетании с медикаментозным лечением, в том числе гормональных нарушений, вызывающих поражение печени, дает хорошие результаты. Возможно обратное развитие фиброза и восстановление функционального и структурного состояния печени.
Пациент с циррозом печени в стадии декомпенсации и развития осложнений нуждается в диетическом, медикаментозном, а в ряде случаев – эндоскопическом и хирургическом лечении.
Декомпенсированный цирроз характеризуется развитием тяжелых осложнений, основное из которых – портальная гипертензия, т.е. стойкое повышение давления в портальной системе. Это проявляется спленомегалией (увеличение селезенки), варикозным расширением вен пищевода и желудка и кровотечением из расширенных вен, накоплением жидкости в брюшной полости – асцитом.
Для лечения портальной гипертензии применяются различные группы лекарственных препаратов: вазоконстрикторы и вазодилататоры.
При развитии асцита 50% больных живут около 2 лет, и только 25-50% больных, не ответивших на медикаментозную терапию, переживает 6 месяцев. Цель консервативной терапии при асците – выведение из организма накопившейся жидкости. Для этого назначают специальную бессолевую диету и диуретики.
В терминальной стадии цирроза печени только операция по пересадке печени может сохранить жизнь пациента.
Рекомендации по питанию при циррозе печени
При циррозе готовят блюда без соли, уменьшают количество свободной жидкости и вводят продукты, богатые калием.
Основные части пищи – белки, жиры, углеводы, вода, минеральные вещества и витамины, которые должны быть строго сбалансированы. Соотношение между белками, жирами и углеводами должно быть 1:1:4.
Белки животного происхождения должны составлять около 60 % от общего количества белков. Из общего количества жиров 20-25 % должны составлять растительные масла как источник полиненасыщенных жирных кислот.
Сбалансированность углеводов выражается в соотношении крахмала, сахара, клетчатки и пектинов. Сахара должны быть представлены фруктами, ягодами, молочными продуктами питания, медом. Крайне важно соблюдать сбалансированность витаминов и минеральных веществ, которые должны поступать в организм ежедневно в соответствии с суточной потребностью.
Это количество приемов пищи и интервал между ними а течение дня. Для здоровых людей 3-4 раза в день с 4-5 часовыми промежутками. При некоторых заболеваниях, например ожирении, необходимо принимать пищу 5-6 раз в день
Профилактика цирроза печени
Для профилактики необходимо предупреждение и своевременное лечение заболеваний, приводящих к циррозу (в первую очередь вирусных гепатитов и алкоголизма).
Цирроз печени – это результат длительного патологического процесса. Его можно остановить и даже вылечить. Главное – вовремя обратиться к врачу.
Источник https://clinpharm-journal.ru/articles/2019-2/uluchshenie-funktsii-pecheni-u-bolnyh-s-dekompensirovannym-tsirrozom-pecheni-posle-eliminatsii-virusa-gepatita-s/
Источник https://www.rmj.ru/articles/infektsionnye_bolezni/Hronicheskiy_virusnyy_gepatit_S_s_ishodom_v_cirroz_i_gepatocellyulyarnuyu_karcinomu_klinicheskoe_nablyudenie/
Источник https://www.gepatit.ru/cirrhosi/