Современная инсулинотерапия сахарного диабета 1 типа у детей и подростков

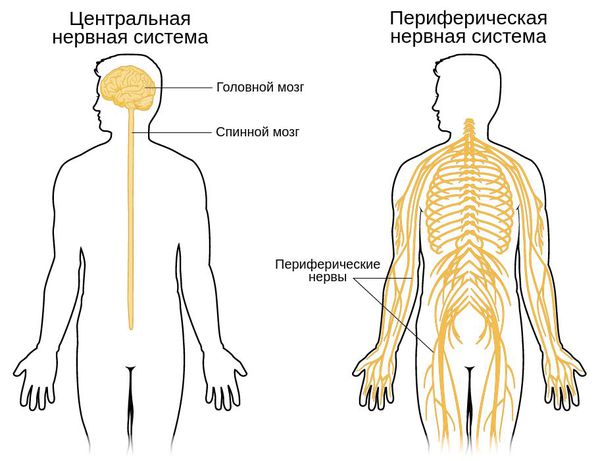
Сахарный диабет 1 типа (СД 1 типа), называвшийся до недавнего времени инсулинозависимым, а еще раньше — ювенильным сахарным диабетом, поражает в основном людей молодого возраста и детей. В последние годы наблюдается
#10/03 Ключевые слова / keywords: Педиатрия, Страничка педиатра, pediatric
2003-12-19 00:00
123725 прочтений
Сахарный диабет 1 типа (СД 1 типа), называвшийся до недавнего времени инсулинозависимым, а еще раньше — ювенильным сахарным диабетом, поражает в основном людей молодого возраста и детей. В последние годы наблюдается всплеск заболеваемости сахарным диабетом 1 типа, наиболее выраженный у детей и подростков. За 25 лет заболеваемость СД 1 типа среди детей московской популяции выросла в два раза. В настоящее время в Москве насчитывается около 1200 детей с СД в возрасте до 15 лет.
СД 1 типа относится к аутоиммунным заболеваниям, при которых в результате процессов аутоагрессии против β-клеток островков поджелудочной железы происходит их разрушение. После гибели более 85% β-клеток развивается абсолютная инсулиновая недостаточность, в результате которой появляются гипергликемия и другие метаболические нарушения. С начала промышленного выпуска препаратов инсулина после успешных опытов Бантинга и Беста на панкреатэктомированных собаках и по настоящее время инсулин — основное и единственное средство лечения СД 1 типа. Прошло более 80 лет с начала клинического применения инсулина. Инсулинотерапия за это время претерпела большие изменения, связанные с улучшением качества инсулина и совершенствованием схем введения препарата.
Лечение СД 1 типа состоит из нескольких компонентов:
- диета;
- инсулинотерапия;
- адекватные физические нагрузки;
- обучение больного самоконтролю;
- профилактика и лечение поздних осложнений СД.
Основная цель современной инсулинотерапии — поддержание состояния углеводного обмена, близкого к тому, которое имеется у здорового человека. Постоянная гипергликемия вызывает развитие и прогрессирование специфических осложнений: диабетической нефро-, ретино- и нейропатии, что приводит к повышенной инвалидизации и преждевременной смертности пациентов. В связи с этим, учитывая важную роль адекватной инсулинотерапии в профилактике сосудистых осложнений, при разработке новых препаратов и схем лечения СД необходимо стремиться к сохранению углеводного обмена и поддержанию его в пределах показателей, соответствующих нормальным, в течение длительного времени.
| Рисунок 1. Физиологическая секреция инсулина в норме. |
В физиологических условиях секреция инсулина происходит в два этапа (см. рисунок 1): поджелудочная железа секретирует инсулин постоянно (базальная инсулинемия), а в ответ на соответствующие стимулы (посталиментарная гипергликемия, или гипергликемия, вызванная действием контринсулярных гормонов) повышает секрецию инсулина. При этом нормогликемия в здоровом организме обеспечивается быстрой адекватной секрецией инсулина, а также коротким периодом полужизни (около 4 мин) циркулирующего в крови инсулина. Печень принимает активное участие в поддержании гомеостаза глюкозы, депонируя ее в виде гликогена после еды и выделяя вновь в кровь из депо путем активизации процесса гликогенолиза в перерывах между приемами пищи. При этом очень важно, что инсулин из поджелудочной железы поступает в систему воротной вены и далее — в печень — главный орган-мишень, где он наполовину инактивируется, участвуя в превращении глюкозы в гликоген. Остающиеся 50% инсулина через большой круг кровообращения попадают к периферическим органам и тканям. Именно более высокий уровень инсулина в портальной системе, по сравнению с периферической циркуляцией, обеспечивает активное депонирование глюкозы в печени на фоне других инсулинзависимых органов.
У больных диабетом введенный экзогенный инсулин из подкожного депо медленно всасывается в общий кровоток, где концентрация его длительно остается нефизиологично высокой. В результате у пациентов с сахарным диабетом наблюдаются более высокая, чем у здоровых, посталиментарная гипергликемия и склонность к гипогликемии в более поздние часы. Поэтому больные сахарным диабетом должны приспосабливать свой режим жизни к профилю действия вводимого инсулина. Неизбежное возникновение стрессовых ситуаций требует дополнительной коррекции дозы экзогенного инсулина. Кроме того, из общего кровотока инсулин одновременно поступает в печень и другие органы-мишени. В результате гликоген депонируется в первую очередь в мышечной ткани, а запасы в печени его постепенно снижаются. Это является одной из причин развития гипогликемий, так как мышечный гликоген не участвует в поддержании нормогликемии. Добиться физиологического соотношения концентрации гормона в портальной системе и на периферии при современных методах введения экзогенного инсулина невозможно, и это одна из наиболее сложных проблем заместительной инсулинотерапии.
Тем не менее с совершенствованием методов инсулинотерапии появилась возможность максимально приблизить показатели углеводного обмена к таковым у здоровых людей у ряда больных СД 1 типа. И процент таких больных постепенно увеличивается по мере совершенствования методов компенсации заболевания. В последнее время убедительно доказано, что только хорошая компенсация сахарного диабета может служить надежным средством профилактики специфических осложнений. В связи с этим Всемирной организацией здравоохранения были разработаны новые целевые уровни показателей углеводного обмена, к которым врачи-практики вместе со своими больными должны стремиться. Оценка степени компенсации СД 1 типа основывается на клинических (нормальное физическое и половое развитие, отсутствие осложнений) и лабораторных показателях углеводного (гликемия, глюкозурия, гликированный гемоглобин) и жирового (холестерин, триглицериды, липопротеины) обмена. Соглашение по основным принципам лечения детей и подростков с СД 1 типа (ISPAD Consensus for the Management of Type 1 Diabetes Mellitus in Children and Adolescens, 2000) рекомендует следующие критерии эффективности инсулинотерапии:
- уровень глюкозы в крови натощак или перед едой — 4,0-7,0 ммоль/л;
- уровень глюкозы после приема пищи — 5,0-11,0 ммоль/л;
- отсутствие тяжелых гипогликемий. допускается наличие отдельных легких гипогликемий.
- содержание HbA1c менее 7,6%.
У детей в возрасте до шести лет с учетом отрицательного влияния гипогликемий на развитие мозга эти показатели должны быть на верхней границе или несколько выше. В отношении гликированного гемоглобина рекомендуется, чтобы концентрация его была приближена к норме насколько это возможно, однако риск развития тяжелых гипогликемий при этом должен быть сведен к абсолютному минимуму.
Инсулины, применяемые в детской практике
Современные препараты инсулина в зависимости от происхождения разделяют на две группы — животные и человеческие (полусинтетический и биосинтетический инсулины). На протяжении 80 лет для лечения СД применяли говяжий и свиной инсулины, которые по составу отличаются от человеческого на три и одну аминокислоты соответственно. При этом иммуногенность максимально выражена у говяжьих инсулинов, минимальная, естественно, — у человеческих. Человеческие инсулины стали применяться два последних десятилетия и буквально произвели революцию в методах лечения больных диабетом.
При получении человеческого инсулина полусинтетическим методом производится замена аминокислоты аланина в 30-й позиции В-цепи свиного инсулина на треонин, находящийся в этом положении в человеческом инсулине. В полусинтетическом инсулине присутствуют в небольшом количестве примеси соматостатина, глюкагона, панкреатических полипептидов, имевшиеся в свином инсулине, который является субстратом для производства данного вида человеческого инсулина. Биосинтетический инсулин не имеет этих примесей и обладает меньшей иммуногенностью. При его производстве в клетку пекарских дрожжей или E.coli генно-инженерным способом вводится рекомбинантная ДНК, содержащая ген человеческого инсулина. В результате дрожжи либо бактерии начинают синтезировать человеческий инсулин. Человеческие генно-инженерные инсулины представляют собой более прогрессивную форму и должны рассматриваться как препараты первого ряда при выборе способа лечения. В России у детей и подростков в последние годы рекомендованы к применению только человеческие генно-инженерные инсулины.
Современные генно-инженерные инсулины различаются по длительности действия:
- инсулины ультракороткого действия;
- инсулины короткого действия («короткий» инсулин);
- инсулины средней продолжительности действия («продленный» инсулин);
- смешанные инсулины.
Их фармакокинетические характеристики представлены в таблице 1.
Последнее десятилетие открыло новую эру в инсулинотерапии: речь идет о получении аналогов человеческих инсулинов с новыми фармакокинетическими свойствами. К ним относятся инсулины ультракороткого действия (хумалог и новоРапид) и продленные беспиковые аналоги человеческого инсулина (детемир и лантус).
Особое место в лечении сахарного диабета в детском и подростковом возрасте занимают инсулины ультракороткого действия — хумалог и новоРапид. Получают беспиковые аналоги инсулина путем замены аминокислот, отвечающих за процессы самоассоциации молекул инсулина, что приводит к ускорению процессов их всасывания из подкожного депо. Так, хумалог был получен путем взаимного изменения положения аминокислот пролин и лизин в 28-й и 29-й положениях в В-цепи, новоРапид — путем замены аминокислоты пролин в том же 28-м положении на аспарагин. Это не изменило биологической активности инсулинов, но привело к полезному изменению его фармакокинетических свойств. При подкожном введении хумалог и новоРапид имеют более быстрое начало и пик действия, параллельные уровню посталиментарной гипергликемии, и меньшую продолжительность, что дает возможность вводить эти препараты непосредственно перед приемом пищи, избегая (при желании) частых перекусов. При использовании аналогов человеческих инсулинов повышаются возможности в компенсации углеводного обмена, что выражается в уменьшении показателей гликированного гемоглобина, и снижается частота тяжелых гипогликемий.
Самым последним достижением в области инсулинотерапии стало введение в клиническую практику инсулина лантус, который является первым беспиковым аналогом человеческого инсулина 24-часового действия. Получен путем замены аминокислоты аспарагин на глицин в 21-м положении А-цепи и добавления двух аминокислот аргинина к концевой аминокислоте в Б-цепи. Результатом явилось изменение рН раствора инсулина после введения его в подкожно-жировую клетчатку с 4,0 до 7,4, что вызывает образование микропреципитатов, замедляющих скорость всасывания инсулина и обеспечивающих его постоянный и стабильный уровень в крови в течение 24 ч.
Лантус может вводиться в любое время суток, у подростков — предпочтительнее в вечерние часы. Начальная его доза составляет 80% от суммарной суточной дозы пролонгированного инсулина. Дальнейшая титровка дозы проводится по показателям сахара крови натощак и в ночные часы. Уровень гликемии после завтрака, в дневные и вечерние часы регулируется инсулином короткого или ультракороткого действия. Назначение лантуса позволяет избежать дополнительных инъекций короткого инсулина в ранние утренние часы у большинства подростков с феноменом «утренней зари», вызывает достоверное снижение утренней гликемии, а также уменьшает лабильность углеводного обмена у многих больных.
Инсулин детемир также является беспиковым аналогом продленного действия, пролонгирующий эффект которого был достигнут благодаря присоединению цепочки из 14 остатков жирных кислот в 29-й позиции В-цепи. Детемир вводится дважды в сутки.
В состав смешанных инсулинов входит инсулин средней продолжительности и короткого действия в различных соотношениях — от 90 к 10 до 50 к 50. Смешанные инсулины более удобны, поскольку их применение позволяет уменьшить количество инъекций, проводимых с помощью шприц-ручек. Однако в детской практике они не нашли широкого применения в связи с необходимостью у многих больных достаточно часто изменять дозу короткого инсулина в зависимости от показателей гликемии. Тем не менее при стабильном течении сахарного диабета (особенно в первые годы заболевания) с помощью смешанного инсулина возможно достижение хорошей компенсации.
Режимы инсулинотерапии
Имеющиеся общие рекомендации по режиму инсулинотерапии являются только основой для разработки индивидуального режима, который должен учитывать физиологические потребности и сложившийся образ жизни каждого ребенка.
Наибольшее распространение в настоящее время получила интенсифицированная (или базисно-болюсная) схема, которая заключается во введении короткого инсулина перед каждым основным приемом пищи и пролонгированного инсулина от одного до трех раз в сутки (см. рисунок 2). Наиболее часто пролонгированный инсулин вводится дважды — в вечерние и утренние часы. При этом предпринимаются попытки имитировать с помощью продленного инсулина базальную секрецию, а с помощью инсулина короткого действия посталиментарную секрецию.
| Рисунок 2. Графическое обоснование базисно-болюсного принципа инсулинотерапии. |
Введение третьей инъекции пролонгированного инсулина получило название оптимизации базальной инсулинотерапии. Вопрос о необходимости и времени введения третьей инъекции решается на основании показаний гликемического профиля. Если гликемия повышается перед ужином при ее нормальных показателях через 1,5-2 ч после обеда, вводится дополнительная инъекция продленного инсулина перед обедом (см. рисунки 3, 4). Как правило, такая ситуация возникает при позднем (в 19.00-20.00) ужине. При раннем ужине (в 18.00) и введении второй инъекции пролонгированного инсулина перед сном гипергликемия нередко наблюдается в 23.00. В этой ситуации хороший эффект дает назначение дополнительной инъекции продленного инсулина перед ужином.
| Рисунок 3. Интенсифицированная инсулинотерапия. |
Такая схема позволяет в какой-то степени приблизиться к физиологической секреции инсулина у здоровых людей. Кроме того, она дает возможность расширить режим жизни и питания больного сахарным диабетом. Психологическим недостатком ее является необходимость частых инъекций и частого контроля гликемии, однако это нивелируется в настоящее время благодаря современным технологическим достижениям (удобные шприц-ручки с атравматичными иглами и глюкометры с автоматами для безболезненного прокалывания пальца). Учащение эпизодов гипогликемических реакций, которое вменяют иногда «в вину» интенсифицированной инсулинотерапии, является не столько следствием применяемой схемы, сколько результатом стремления врачей достичь нормогликемии. При решении данного вопроса всегда следует искать компромисс, стремясь поддержать тот минимальный уровень гликемии, который не вызывает частых гипогликемических реакций. Этот уровень гликемии для каждого ребенка достаточно индивидуален.
| Рисунок 4. Оптимизация интенсифицированной инсулинотерапии. |
У детей первых двух лет жизни интенсифицированная схема применяется реже.
Традиционная схема инсулинотерапии заключается во введении инсулина короткого и пролонгированного действия два раза в сутки — перед завтраком и ужином. Применение ее возможно у ряда детей в первые один-два года заболевания, редко при большей длительности сахарного диабета (см. рисунок 5).
| Рисунок 5. Традиционная схема инсулинотерапии. |
Если небольшая доза короткого инсулина вводится перед обедом, такая схема может быть искусственно продлена на некоторое время путем увеличения дозы продленного инсулина перед завтраком и небольшого перераспределения в питании (перенос одной-двух хлебных единиц с обеда на второй завтрак).
| Рисунок 6. Нетрадиционные схемы инсулинотерапии. |
Кроме того, существует ряд нетрадиционных схем (см. рисунок 6):
- только пролонгированный инсулин утром и вечером;
- один пролонгированный инсулин только утром;
- пролонгированный и короткий инсулин — утром и только короткий инсулин — вечером;
- только короткий инсулин перед завтраком, обедом и ужином и др.
Эти схемы иногда используются у больных с небольшим сроком заболевания сахарным диабетом при частичной сохранности функции β-клеток.
В любом случае выбор схемы инсулинотерапии определяется не столько желанием врача или семьи больного, сколько оптимальным профилем введения инсулина, который обеспечивает компенсацию углеводного обмена.
Доза инсулина
В детском возрасте потребность в инсулине, рассчитанная на 1 кг веса, нередко выше, чем у взрослых, что обусловлено большей скоростью аутоиммунных процессов, а также активным ростом ребенка и высоким уровнем контринсулярных гормонов в период полового созревания. Доза инсулина изменяется в зависимости от возраста и длительности заболевания.
В первые один-два года с момента начала заболевания потребность в инсулине составляет в среднем 0,5-0,6 ЕД/кг массы тела. В 40–50% в первые месяцы наблюдается частичная ремиссия заболевания, когда после достижения компенсации углеводного обмена потребность в инсулине снижается до минимальной — 0,1-0,2 ЕД/кг массы, а у некоторых детей даже при полной отмене инсулина при соблюдении диеты удается поддерживать нормогликемию. (Наступление ремиссии тем более вероятно, чем раньше установлен диагноз диабета и начата инсулинотерапия, чем выше качество вводимого инсулина и чем лучшей компенсации углеводного обмена удается достичь.)
Через пять лет от момента заболевания диабетом у большинства больных β-клетки полностью прекращают функционировать. При этом потребность в инсулине обычно повышается до 1 ЕД/кг массы. В период полового созревания она вырастает еще больше, достигая у многих подростков 1,5, иногда 2 ЕД/кг. В последующем доза инсулина снижается в среднем до 1 ЕД/кг. После длительной декомпенсации сахарного диабета потребность в инсулине может достигать 2-2,5, иногда 3 ЕД/кг с последующем снижением дозы, в отдельных случаях вплоть до исходной.
Соотношение пролонгированного и короткого инсулина сдвигается: от преобладания пролонгированного инсулина у детей первых лет жизни к преобладанию короткого инсулина у подростков (см. таблицу 2).
Как и у взрослых, у детей на одну хлебную единицу в утренние часы требуется несколько больше инсулина, чем в обед и в ужин.
Следует подчеркнуть, что это лишь общие закономерности, у каждого ребенка потребность в инсулине и соотношение инсулинов различной длительности имеют свои индивидуальные особенности.
Осложнения инсулинотерапии
- Гипогликемия — состояние, обусловленное низкой гликемией в крови. Наиболее частые причины развития гипогликемических состояний: передозировка инсулина, чрезмерная физическая нагрузка, пропуск или недостаточный прием пищи, употребление алкоголя. При подборе дозы инсулина следует искать компромисс между стремлением достичь показателей углеводного обмена, близких к нормогликемии, и риском развития гипогликемических реакций.
- Хроническая передозировка инсулина (синдром Сомоджи). Избыток инсулина и гипогликемия стимулируют секрецию контринсулярных гормонов, которые и вызывают постгипогликемическую гипергликемию. Последняя характеризуется высокой степенью гипергликемии (обычно выше 16 ммоль/л) и длительно сохраняющейся инсулинорезистентностью, продолжающейся от нескольких часов до двух суток.
- Аллергия к инсулину. Различают местные аллергические реакции на инсулин (отечность кожи, гипиремия, уплотнение, зуд, иногда боли в месте инъекции) и общую генерализованную аллергию (аллергическая кожная сыпь, сосудистый отек и бронхоспазм, острый анафилактический шок). В последние годы с улучшением качества инсулинов аллергия к этим препаратам встречается крайне редко.
- Липодистрофиями называют изменение подкожно-жировой клетчатки в местах инъекций инсулина в виде ее атрофии (атрофическая форма) либо гипертрофии (гипертрофическая форма). С внедрением в клиническую практику человеческих инсулинов частота развития липодистрофий значительно снизилась.
Перспективы совершенствования инсулинотерапии в России
Внедрение аналогов человеческих инсулинов расширяет возможности достижения компенсации, улучшения течения заболевания у детей и подростков с сахарным диабетом.
Инсулиновые помпы, в течение ряда лет применяемые за рубежом, сегодня появились и на отечественном рынке, однако применение их ограничено из-за высокой стоимости.
В настоящее время за рубежом ведутся исследования, посвященные эффективности и безопасности применения ингаляционных видов инсулина, с которыми связана надежда на возможность отказа от постоянных введений короткого инсулина перед приемами пищи.
Вопрос о клиническом использовании трансплантации островковых клеток останется открытым до тех пор, пока не будут найдены средства защиты пересаженных клеток от того же аутоиммунного процесса, который поражает собственные β-клетки. В настоящее время трансплантация β-клеток за рубежом осуществляется только у больных с развившейся хронической почечной недостаточностью, одновременно с трансплантацией почки и назначением иммунодепрессантов. Все остальные работы по трансплантации носят исследовательский характер и производятся на добровольцах. Однако канадским исследователям удалось получить первые обнадеживающие результаты.
В. А. Петеркова, доктор медицинских наук, профессор
Т. Л. Кураева, доктор медицинских наук
Е. В. Титович, кандидат медицинских наук
Институт детской эндокринологии ГУ ЭНЦ РАМН, Москва
Сахарный диабет у детей — симптомы и лечение
Что такое сахарный диабет у детей? Причины возникновения, диагностику и методы лечения разберем в статье доктора Бабинцевой Марины Юрьевны, эндокринолога со стажем в 29 лет.
Над статьей доктора Бабинцевой Марины Юрьевны работали литературный редактор Маргарита Тихонова , научный редактор Юлия Зотова и шеф-редактор Лада Родчанина

Эндокринолог Cтаж — 29 лет
Клиника «Династия» на Академика Шварца
Клиника «Династия» на Мамина-Сибиряка
Дата публикации 29 декабря 2020 Обновлено 7 июля 2022
Определение болезни. Причины заболевания
Сахарный диабет , или «сахарная болезнь» — это заболевание, которое вызывает сложные нарушения углеводного, жирового и белкового обменов. Оно связано с нарушением выработки инсулина, нарушением его воздействия на органы-мишени (сетчатку глаза, артерии, почки, сердце, головной мозг) либо с сочетанием этих факторов.
Основным симптомом является гипергликемия, т. е. высокий уровень глюкозы в крови, и её проявления в виде чрезмерного употребления воды, увеличения объёма мочи и токсического воздействия на органы-мишени.

Количество детей с диабетом возрастает с каждым годом, а диагностика этой серьёзной болезни не всегда адекватна.
Опасность сахарного диабета у детей и подростков заключается в развитии тяжёлых поздних осложнений, таких как диабетическая ретинопатия , нефропатия, полинейропатия и др. При этом течение сахарного диабета, особенно 1-го типа, в юном возрасте очень неустойчиво: эпизодически уровень глюкозы снижается и повышается. Это связано воздействием внутренних и внешних факторов:
- снижением чувствительности к инсулину — инсулинорезистентностью;
- увеличением уровня гормона роста и половых гормонов;
- депрессией ;
- погрешностями в питании;
- пропуском необходимых инъекций инсулина и т. д.
Поэтому детям и подросткам с сахарным диабетом важно поддерживать нормальный уровень глюкозы в крови и компенсировать его при необходимости. Чтобы помочь ребёнку, родители и врачи-эндокринологи должны объединить усилия .
Сахарный диабет 1-го типа , связанный с нарушением выработки инсулина, является наиболее распространённым среди детей и подростков, однако диабет 2-го типа начинает встречаться всё чаще [1] . По данным Федерального регистра больных сахарным диабетом, распространённость болезни в России составляет 91,4 на 100 тысяч детей и 209,5 на 100 тысяч подростков. При этом 1-й тип заболевания встречается у 95 % детей и подростков с диабетом, а 2-й тип — у 5 % [3] .
Пик дебюта сахарного диабета 1-го типа приходится на 10-2 0 лет. Продолжительность жизни при этой болезни зависит от того, как часто нарушается уровень глюкозы в крови [22] .
Сахарный диабет у детей развивается под влиянием множества факторов. Все они связаны с поражением поджелудочной железы или её β-клеток, которые вырабатывают инсулин.
К причинам развития сахарного диабета у детей относят:
- Аутоиммунные нарушения : болезнь Бехтерева , ревматоидный артрит , системная красная волчанка , склеродермия , синдром Рейтера и др. Воздействие аутоантител приводит к абсолютной недостаточности инсулина и вызывают у детей развитие сахарного диабета 1-го типа.
- Влияние вирусов Коксаки, краснухи , гепатита, кори , эпидемического паротита и др. Они разрушают β-клетки и вызывают иммунное воспаление. Так, 20 % новорождённых, внутриутробно перенёсших краснуху, рождаются с сахарным диабетом [9] .
- Острое и хроническое воспаление поджелудочной железы — являются причиной диабета в 30 % случаев [9] .
- Физические и химические факторы , которые приводят к разрушению β-клеток: радиация, физическое повреждение поджелудочной железы, её сдавление опухолью, воздействие этанола, цитостатиков и др.
- Повышенный уровень антагонистов инсулина в крови — инсулиназы, глюкокортикоидов, гормона роста и др. Наблюдается при опухолях эндокринных желёз или хроническом стрессе. Вызывает относительную инсулиновую недостаточность.
- Инсулинорезистентность из-за блокады эффектов инсулина в клетках-мишенях или блокады, деструкции или снижения чувствительности инсулиновых рецепторов.
- Моногенетические повреждения , при которых нарушается кодирование синтеза нормальной молекулы инсулина (MODY-диабет) или рецепторов инсулина (инсулинорезистентность типа А).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы сахарного диабета у детей
Симптомы сахарного диабета у детей могут быть самыми разными, особенно в начале болезни.
Диабет 1-го типа сразу может начаться с серьёзных проявлений декомпенсированного кетоацидоза — слабости, неутолимой жажды, частого мочеиспускания, тошноты с приступами рвоты и потери сознания. Перед появлением этих симптомов больной обычно теряет вес. Если своевременно не начать лечение, ребёнок может впасть в кому.
Диабет 2-го типа у детей чаще начинается с метаболических нарушений и ожирения . Однако при юношеском диабете 2-го типа ожирение, как правило, не наблюдается, за исключением случаев, когда подростки изначально страдают ожирением [6] .
На начальной стадии диабет 2-го типа нередко не проявляет себя. Иногда ребёнок жалуется на снижение зрения или на прыщи и фурункулы, которые в период полового созревания могут маскироваться под угревую болезнь .
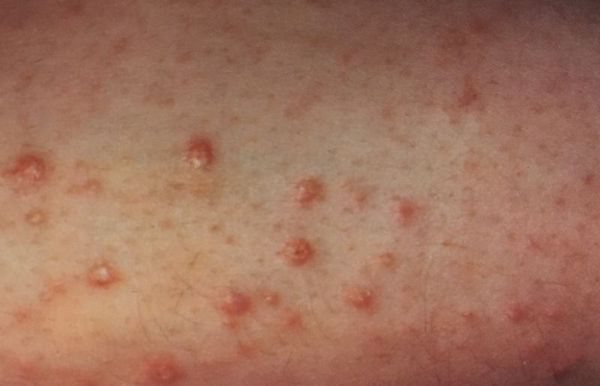
Иногда р одители могут заметить у ребёнка, приученного к туалету, энурез . У девочек, особенно до начала полового созревания, часто возникает бактериальный вагиноз, который сопровождается обильными жидкими выделениями с неприятным запахом из половых путей .
Также родителей должен насторожить кожный зуд, рецидивирующие бактериальные и грибковые кожные инфекции. Грибковые инфекции у детей встречаются значительно реже, чем у взрослых. Они могут появиться у тучных или ослабленных детей. Бактериальные инфекции в виде фурункулов, карбункулов, панарициев, пиодермий или рожистого воспаления возникают гораздо чаще.
К признакам кожной инфекции могут присоединяться другие нарушения: снижение школьной успеваемости, повышенная утомляемость, потеря веса или недостаточное увеличение массы тела относительно роста ребёнка.
Иногда манифестация сахарного диабета 2-го типа происходит остро — с признаков гиперосмолярной гипергликемии. При этом ребёнок может жаловаться на острую боль в животе, тошноту, частую рвоту, учащённое мочеиспускание и затруднённое дыхание — оно становится частым и неглубоким. У ребёнка краснеют щёки, появляется запах ацетона изо рта, возможна потеря сознания.
К классическим симптомам диабета любого типа относят полиурию и полидипсию — увеличение объёма мочи и неутолимую жажду. Из-за повышенного уровня глюкозы в крови организм вынужден усиленно выводить её излишки вместе с мочой. У детей младшего возраста это проявляется недержанием мочи. Повышенное мочеотделение в свою очередь приводит к усилению жажды и сухости кожи, активное выведение глюкозы с мочой — к постоянному желанию есть, а при сахарном диабете 1-го типа — к снижению веса.
Симптомы генетических форм сахарного диабета обычно возникают в первый месяц жизни или даже в период внутриутробного развития. В таких случаях наблюдается задержка роста и внутриутробного развития.
Патогенез сахарного диабета у детей
Патогенез сахарного диабета 1-го и 2-го типов различен.
Причиной диабета 1-го типа является абсолютная инсулиновая недостаточность . Она развивается из-за генетической предрасположенности, связанной с главным комплексом гистосовместимости (HLA) — важной частью иммунной системы.
При наличии предрасположенности и воздействии негативных факторов, например вирусов, возникает аутоагрессивный иммунный процесс, направленный на собственный организм. В ходе этого процесса развивается хронический иммунный инсулит, т. е. преддиабет.
При инсулите большое количество β-клеток поджелудочной железы подвергается разрушению. Вначале это приводит к снижению инсулинового ответа на введение глюкозы, при этом уровень инсулина натощак остаётся в пределах нормы. В дальнейшем при гибели 70-80 % клеток формируется абсолютная инсулиновая недостаточность.
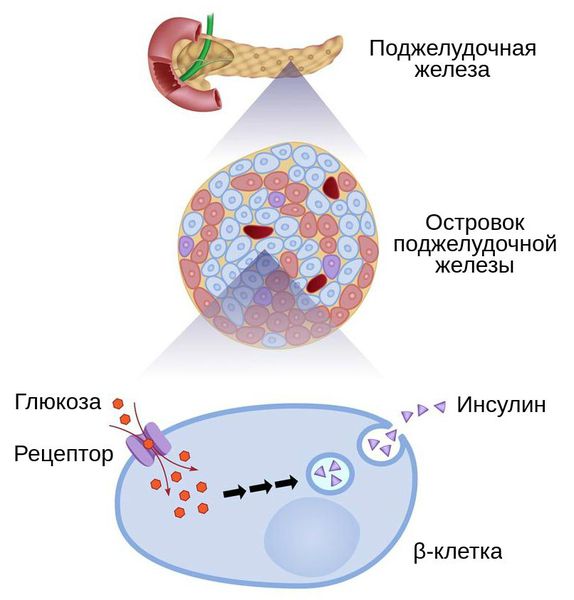
Сахарный диабет 2-го типа вызывает относительная инсулиновая недостаточность . Гипергликемия при этом может возникать на фоне нормального или даже повышенного уровня инсулина. Причинами относительной нехватки инсулина являются либо избыточное количество контринсулярных факторов, подавляющих действие инсулина, либо инсулинорезистентность — снижение чувствительности к инсулину.
К контринсулярным факторам относятcя:
- инсулиназа — становится более активной при дефиците цинка и меди [9] . Её концентрация увеличивается при повышенном уровне соматотропного гормона или глюкокортикостероидов, например при акромегалии или болезни Иценко — Кушинга . Кроме того, в период полового созревания клетки печени вырабатывают больше инсулиназы. Это объясняет частое появление первых признаков диабета в этом возрасте.
- протеиназа — разрушает инсулин, может поступать в большом количестве из очагов воспаления;
- вещества, связывающие молекулы инсулина, например плазменные ингибиторы инсулина белковой природы;
- β-липопротеины — образуют с инсулином неактивные комплексы, их концентрация увеличивается при высоком уровне соматотропного гормона;
- контринсулярные гормоны — катехоламины, глюкокортикостероиды, тиреоидные гормоны, соматотропный гормон, глюкагон.
Инсулинорезистентность может возникать из-за нарушения рецепторных или пострецепторных механизмов, которые позволяют реализовать эффект инсулина в клетках-мишенях.
К причинам поражения рецепторов относят:
- блокирование иммуноглобулинами;
- нарушение способности связываться с инсулином и прочности такой связи при длительной гипергликемии;
- разрушение или нарушение состояния молекул рецепторов;
- образование большого количества свободных радикалов при длительной гипоксии.
Пострецепторные механизмы развития инсулинорезистентности связаны либо с нарушением метаболизма в клетках-мишенях инсулина, либо с недостаточностью трансмембранных переносчиков инсулина, что характерно для детей с ожирением [9] .
И абсолютная, и относительная инсулиновая недостаточность приводят к гипергликемии. Из-за превышения порога глюкозы и замедления её перехода через почечные канальцы обратно в кровоток возникает глюкозурия — появление глюкозы в моче.
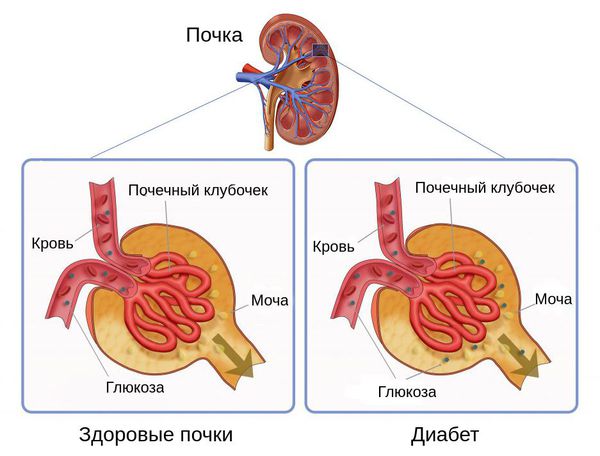
Глюкозурия и гипергликемия объясняют основные симптомы сахарного диабета — увеличение объёма мочи и неутолимую жажду. Эти симптомы в свою очередь приводят к нарушению водно-электролитного баланса и появлению признаков обезвоживания.
Помимо водно-электролитного баланса, при сахарном диабете нарушается белковый и жировой обмен. Расщепление белков и жиров усиливается, из-за чего повышается уровень остаточного азота и кетоновых тел в крови и моче, а также уровень липидов в крови.
Классификация и стадии развития сахарного диабета у детей
В течении сахарного диабета условно выделяют две стадии:
- Преддиабет — доклиническая стадия, при которой в зависимости от типа болезни могут быть выявлены антитела к β-клеткам поджелудочной железы или инсулинорезистентность.
- Клиническая стадия — начинается с появления первых симптомов диабета. Подразделяется на три фазы: компенсации, субкоменсации и декомпенсации углеводного обмена.
Чаще используется классификация по причине развития диабета. Выделяют:
1. Сахарный диабет 1-го типа — чаще выявляется в детском и юношеском возрасте. Связан с деструкцией β-клеток поджелудочной железы. Приводит к абсолютному дефициту инсулина. Различают две формы:
- аутоиммунную — когда деструкция β-клеток вызвана аутоиммунным воздействием;
- идиопатическую — когда деструкция β-клеток не связана с аутоиммунным процессом.
2. Сахарный диабет 2-го типа — встречается в детском возрасте намного реже. В основном связан с сочетанием инсулинорезистентности и недостаточной выработкой инсулина.
3. Специфические типы диабета :
- генетические дефекты β-клеточной функции — неонатальный, митохондриальный и MODY-диабет;
- генетические дефекты действия инсулина — инсулинорезистентность типа А, лепречаунизм, синдром Рабсона — Менденхолла, липоатрофический диабет и др.;
- сахарный диабет, вызванный нарушением экзокринной функции поджелудочной железы — травма или удаление органа, панкреатит, гемохроматоз и др.;
- сахарный диабет как проявление эндокринопатии — возникает при синдроме Иценко — Кушинга, акромегалии, альдостероме и др.;
- сахарный диабет, вызванный приёмом лекарств — глюкокортикоидов, никотиновой кислоты, тиреоидных гормонов, тиазидов, интерферона альфа и др.;
- сахарный диабет как осложнение инфекционных заболеваний — врождённой краснухи, цитомегаловируса , энтеровируса и др.;
- редкие формы иммунного сахарного диабета — синдром мышечной скованности, диабет, вызванный выработкой антител к рецепторам инсулина, синдром полиэндокринной аутоиммунной недостаточности I и II типа и др.;
- генетические заболевания, не всегда связанные с сахарным диабетом — синдром Дауна, синдром Клайнфельтера , синдром Тёрнера, порфирия и др. [1][2][7] .
Отдельно стоит сказать о трёх специфических типах диабета, связанных с генетическим дефектов β-клеток:
- MODY-диабет — диабет взрослого типа у молодых. Включает в себя несколько форм сахарного диабета, связанных с определённой генетической мутацией. Диагностируется у 1-5 % детей [1] . Обычно протекает в лёгкой форме с быстрой компенсацией углеводного обмена на фоне лечения [1][8] .
- Неонатальный диабет — выявляется в первые 6 месяцев жизни ребёнка. Отличается высоким уровнем гликемии — до 70-100 ммоль/л, замедлением внутриутробного развития и симптомами обезвоживания. Бывает транзисторным и перманентным. При транзисторной форме после 1,5-2 лет наступает период независимости от инсулина, который обычно продолжается до полового созревания. При перманентной форме такого периода нет — пациент всегда остаётся инсулинозависимым.
- Митохондриальный диабет — точечная мутация, которая наследуется исключительно по материнской линии. Часто имеет сопутствующую тугоухость , неврологические нарушения и миопатии.
Осложнения сахарного диабета у детей
Осложнения сахарного диабета у детей делятся на острые и отсроченные.
Острые осложнения связаны с нестабильным течением сахарного диабета и резкой декомпенсацией углеводного обмена. Это может произойти на любом сроке болезни из-за стрессов, нарушения диеты или тактики лечения, острых, хронических инфекций или иных сопутствующих заболеваний.
Дело в том, что дети и подростки, особенно с диабетом 1-го типа, часто сталкиваются с психологическими проблемами по поводу своей болезни. Например, у них может развиться расстройство адаптации, как в данном случае. Кроме того, из-за усиливающихся комплексов и стресса они могут преднамеренно нарушать диету или прекращать инсулинотерапию, не подозревая о других серьёзных проблемах, которые могут случиться. В результате возникает либо гипогликемия с возможным развитием гипогликемической комы, либо значительная гипергликемия с диабетическим кетоацидозом или гипергликемическим гиперосмолярным статусом.
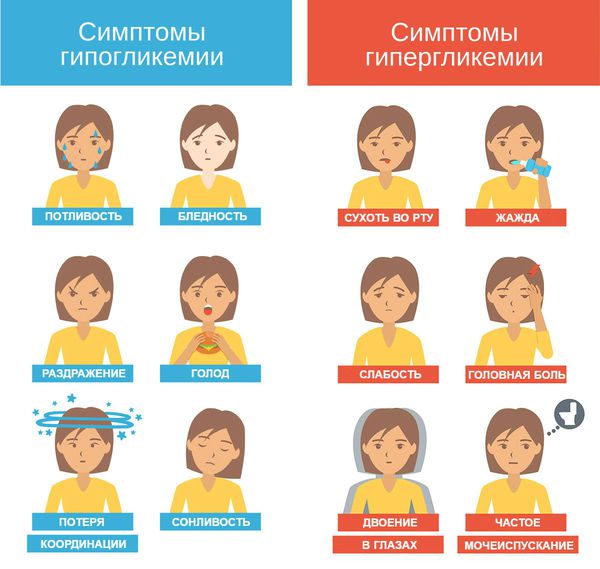
Гипогликемия — самое частое осложнение диабета 1-го типа. В случае диабета 2-го типа она может возникнуть при необходимости инсулинотерапии или лечении производными сульфонилмочевины.
Дети, особенно в раннем возрасте, более чувствительны к снижению уровня глюкозы в крови, чем взрослые, поэтому риск развития гипогликемии у них выше. При этом симптомы проявляются на фоне более высокого уровня глюкозы по сравнению со взрослыми, а скорость развития тяжёлой гипогликемии, требующей срочного вмешательства, выше [1] .
Гипогликемия у детей может проявляться дрожью, тахикардией , повышенным потоотделением. Иногда на первый план выходят симптомы нейрогликопении: головная боль, сонливость и нарушение концентрации. У маленьких детей с гипогликемией можно заметить изменения поведения, такие как вспышки гнева, беспокойство, раздражительность или апатия.
Диабетический кетоацидоз возникает на фоне гипергликемии из-за нехватки инсулина или повышенной концентрации контринсулиновых гормонов. Часто сахарный диабет впервые диагностируется именно в этом состоянии: у 88 % детей с диабетом 1-го типа и у 10 % детей с диабетом 2-го типа [1] [12] .
Начинается осложнение по-разному: от мягкого течения с незначительным обезвоживанием до тяжёлого течения с серьёзным обезвоживанием и потерей сознания.
К симптомам диабетического кетоацидоза относят сухость кожи, повышенную жажду, тахикардию, учащённое дыхание или дыхание Куссмауля — редкое, глубокое, с шумным вдохом и резким выдохом, запах ацетона изо рта, тошноту, рвоту, боль в животе, спутанность или потерю сознания.
К лабораторным признакам относят:
- уровень глюкозы в крови больше 11 ммоль/л;
- повышенная концентрация кетоновых тел в крови и моче;
- уровень pH меньше 7,3;
- уровень бикарбоната меньше 15 ммоль/л [1][2][7] .
Гипергликемический гиперосмолярный статус может возникать при сахарном диабете новорождённых, диабете 1-го и 2-го типа. Проявляется судорогами, агрессией, потерей сознания.
К лабораторным признакам относят:
- уровень глюкозы в крови от 33 ммоль/л и выше;
- незначительное увеличение концентрации кетоновых тел в крови и моче;
- уровень pH ниже 7,3;
- уровень бикарбоната ниже 15 ммоль/л [1][2][7] .
Отсроченные осложнения диабета начинают формироваться в детстве, но могут проявиться позже, уже во взрослом возрасте. К таким осложнениям относят диабетическую полинейропатию, ретинопатию и нефропатию.
Диабетическая полинейропатия связана с поражением периферических и автономных нервов [14] . Она возникает из-за метаболических нарушений и поражения мелких сосудов — микроангиопатии.
Нейропатия является н аиболее частым отсроченным осложнением у детей с диабетом. В этом возрасте оно, как правило, находится в доклинической или первичной клинической стадии.
При периферической нейропатии чаще страдают нижние конечности. При этом может возникать онемение, покалывание, жжение в пальцах рук и ног и кратковременные судороги. Даже лёгкие прикосновения могут приносить дискомфорт или боль.
Поражение автономных нервов нарушает работу внутренних органов: сердца, желудочно-кишечного тракта, урогенитальной системы и др. Поэтому симптомы автономной полинейропатии многочисленны и разнообразны. Они зависят от того, за иннервацию какого органа отвечают поражённые нервные волокна. Ребёнка может беспокоить тахикардия в покое, снижение артериального давления при изменении положения тела, изжога, боль в желудке, нарушение мочеиспускания и т. д.
Диабетическая ретинопатия связана с поражением сосудов сетчатки. Она может проявиться у детей в течение года после начала заболевания, а иногда только при инсулинорезистентности.
На начальных стадиях осложнение никак себя не проявляет. По мере прогрессирования болезни у ребёнка могут появиться жалобы на ухудшение зрения, появление «мушек», точек или пелены перед глазами, трудность при чтении, иногда боль в глазах после зрительной нагрузки.

У 4 % детей диабетическая ретинопатия приводит к слепоте в течение 3-5 лет [22] . У подростков тяжёлая ретинопатия с потерей зрения развивается чаще, чем у взрослых [1] .
Диабетическая нефропатия , возникшая в детском или подростковом возрасте, является основной причиной инвалидности и смерти взрослых пациентов с диабетом. У детей это осложнение, как правило, находится в доклинической стадии, поэтому врачи часто недооценивают наличие этой проблемы.
Выявить доклиническую диабетическую нефропатию можно при регулярной проверке лабораторных показателей, которые могут указывать на диабетическое поражение почек. К таким показателям относят уровень альбумина и креатинина, скорость клубочковой фильтрации и др. Например, начинающаяся нефропатия у детей и подростков проявляется микроальбуминурией — когда уровень альбумина в утренней моче равен 30-300 мг/л.
Кроме полинейропатии, ретинопатии и нефропатии, связанных с поражением мелких сосудов, у детей развиваются начальные проявления макроангиопатий , например атеросклероз коронарных артерий. Чаще всего подобные осложнения связаны с плохим контролем уровня глюкозы в крови.
Несмотря на то, что симптомы отсроченных осложнений редко проявляются в детском возрасте, функциональные нарушения начинаются именно в это время. Риск развития осложнений увеличивается на фоне полового созревания . В этот период у ребёнка происходят эндокринные изменения, увеличивается уровень гормона роста и половых гормонов. В результате чувствительность к инсулину снижается, возникает инсулинорезистентность. Кроме того, гормон роста — это контринсулярный гормон, поэтому потребность в инсулине у подростков значительно возрастает и может доходить до 2 Ед/кг [23] .
Диагностика сахарного диабета у детей
Диагностировать сахарный диабет у детей, особенно младшего возраста, не так просто. Боли в животе, тошноту и рвоту можно ошибочно принять за признаки острого или хронического энтероколита. Полиурия, недержание мочи и энурез маскируются под инфекции мочевыводящих путей. Слабость, быстрая утомляемость, фурункулы, снижение или увеличение массы тела у подростков часто объясняют гормональными изменениями.
Основным методом диагностики сахарного диабета по-прежнему остаётся определение уровня прандиальной и постпрандиальной глюкозы в крови, а также уровня гликированного гемоглобина. Прандиальную глюкозу измеряют во время приёма пищи, постпрандиальную — через два часа после еды, гликированный гемоглобин — независимо от приёма пищи и времени суток.

Диагностические критерии диабета у детей аналогичны критериям болезни у взрослых. Это:
- симптомы диабета со случайно выявленным уровнем глюкозы в крови ≥ 11 ммоль/л;
- уровень глюкозы в крови натощак ≥ 7 ммоль/л;
- уровень глюкозы в крови при глюкозотолерантном тесте ≥ 11 ммоль/л;
- уровень гликированного гемоглобина > 6,5 % [1][2][5][6][7] .
Важно помнить, что повышение уровня глюкозы может носить временный характер, особенно на фоне инфекции или иного стресса [1] [7] .
Маленьким детям с подозрением на сахарный диабет необходимо определить уровень глюкозы в моче: у здоровых людей глюкоза не обнаруживается. Кроме того, важно оценить уровень кетонов в моче (ацетоацетат) и крови (β-оксибутират).
После подтверждения диагноза необходимо определить тип диабета . От него зависит лечение и прогноз болезни.
Сахарный диабет 1-го типа у детей чаще связан с аномалиями в генах комплекса гистосовместимости — HLA. У 90 % пациентов с таким типом диабета выявляются аутоантитела к антигенам β-клеток [10] . Анализ на аутоантитела необходимо проводить, даже если есть все предпосылки для постановки диагноза «сахарный диабет 2-го типа» [1] .
Важным критерием диабета 1-го типа является уровень инсулина и С-пептида. Их низкие цифры и отсутствие повышения в ответ на нагрузку глюкозой говорят в пользу диабета 1-го типа. Однако в период появления первых явных симптомов болезни может возникнуть эффект «наложения». Хроническая гипергликемия у детей с диабетом 2-го типа может снизить уровень инсулина, тогда как у детей с диабетом 1-го типа «резервы» инсулина могут сохраняться довольно долго .
При возникновении симптомов сахарного диабета у новорождённых необходимо провести генетическую диагностику, особенно при наличии сахарного диабета у близких родственников ребёнка.
Лечение сахарного диабета у детей
Основная цель лечения — достичь целевого уровня глюкозы в крови и гликированного гемоглобина. При этом важно не допустить экстремальных состояний: кетоацидоза, гиперосмолярности или гипогликемии. Как показывают исследования, только 38 % детей с диабетом 1-го типа достигают целевых уровней гликированного гемоглобина [11] .
Питание при сахарном диабете
Обязательным и важным условием лечения диабета у детей является соблюдение диеты. Она разрабатывается эндокринологом-диабетологом индивидуально, в зависимости от возраста ребёнка, его физической активности, семейных привычек питания и режима дня [14] [26] .
Сейчас предпочтение отдаётся физиологически сбалансированной диете, хотя всё чаще обсуждаются возможности низкоуглеводной диеты [14] . При диабете 1-го типа с поражением почек рекомендуется низкобелковая диета.
Физиологическая диета сбалансирована по суточному содержанию белков (16-20 %), жиров (24-30 %), углеводов (50-60 %), макро- и микроэлементов [14] [26] . Она практически не отличается от питания сверстников без диабета. Рацион при такой диете обязательно должен включать в себя завтрак, обед, ужин и три дополнительных приёма пищи: второй завтрак, полдник и второй лёгкий ужин.
Особое внимание при диабете 1-го типа нужно уделять углеводам. Предпочтение отдаётся сложным углеводам, которые трудно усваиваются и слабо влияют на уровень глюкозы в крови. Полезные углеводы содержатся в овощах, фруктах, крупах, бобовых, молоке и сыре; полезные жиры — в авокадо, орехах, оливковом и арахисовом масле.
Важно ограничить употребление продуктов, содержащих транс-жиры. В этот список входит спред, маргарин, выпечка, белый хлеб, макароны, конфеты, колбаса и бекон. Они быстро повышают уровень глюкозы в крови [24] [25] .
Для приблизительного подсчёта углеводов, содержащихся в том или ином продукте, используют систему хлебных единиц (ХЕ) . Суточная норма ХЕ зависит от возраста, пола, веса и физической активности. Например, детям 1-3 лет следует ежедневно употреблять 10-11 ХЕ, мальчикам 11-14 лет — 18-20 ХЕ, а девочкам 11-14 лет — 16-17 ХЕ [7] .
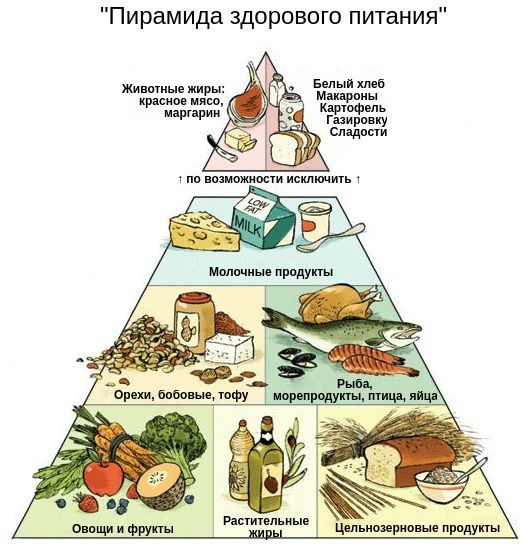
Составлять рацион, правильно оценивать углеводы для подбора дозы инсулина перед едой, грамотно заменять одни продукты на другие и соблюдать режим питания могут научить в любой школе диабета [7] . Заполнить холодильник полезной едой поможет «пирамида здорового питания», а быстро и без подсчёта калорий спланировать приём пищи можно по «правилу тарелки». Соблюдение этих правил в питании и рациональная инсулинотерапия обеспечат стабильный уровень глюкозы в крови без значительных колебаний.

Диетотерапия помогает справиться с лёгкой гипогликемией и не допустить развития диабетической комы . Если уровень глюкозы опускается ниже 3,9-3,0 ммоль/л, нужно съесть 1-2 ХЕ быстро усваиваемых углеводов, например:
- 2-4 куска сахара по 5 г, лучше растворить;
- или 1-1,5 столовых ложки мёда или варенья;
- или 100-200 мл фруктового сока или лимонада на сахаре;
- или 4-5 больших таблеток глюкозы по 3-4 г;
- или 1-2 тубы с углеводным сиропом по 10 г [7] .
Если через 15 минут уровень глюкозы остался низким, нужно повторить лечение.
После нормализации гликемии, особенно в ночное время и при снижении уровня глюкозы из-за пролонгированного инсулина, нужно дополнительно съесть 1-2 ХЕ медленно усваиваемых углеводов, например хлеб [7] .
Инсулинотерапия
Диабет 1-го типа, а также другие виды инсулинзависимого диабета связаны с абсолютной недостаточностью инсулина. В таких случаях лечение болезни основано на заместительной терапии препаратами инсулина .
В России детям назначают только человеческий генно-инженерный инсулин и аналоги человеческого инсулина. Смешанные инсулины — короткие или ультракороткие в сочетании с инсулинами среднего или пролонгированного действия — у детей не используются [7] .
На каждого ребёнка инсулин действует по-своему, в зависимости от возраста, веса и роста. Поэтому потребность в инсулине и соотношение инсулинов разного действия всегда индивидуальны.
Общие закономерности инсулинотерапии у детей :
- В первые 1-2 года от начала болезни потребность в инсулине составляет 0,5-0,6 Ед/кг массы тела.
- С возрастом ребёнка и сроком диабета потребность в инсулине увеличивается: через 5 лет от начала болезни доза инсулина в среднем составляет 1 Ед/кг массы тела, а в период полового созревания — 1,25 Ед/кг массы тела.
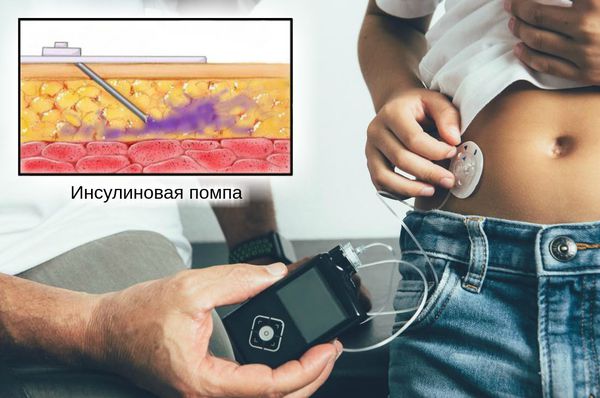
- Предпочтительно вводить инсулин под кожу постоянно с использованием инсулиновой помпы. Это позволяет восполнять недостаток инсулина максимально физиологично.
- Если использование инсулиновой помпы невозможно, применяется базисно-болюсный режим введения инсулина. При этом режиме 1-2 раза в день подкожно вводятся безпиковые аналоги инсулина среднего или пролонгированного действия, а перед основными приёмами пищи — инсулины короткого действия.
- Уровень глюкозы в крови ребёнка нужно постоянно контролировать. Самоконтроль проводится перед основными приёмами пищи, после еды, перед сном и физическими нагрузками, а также после перенесённой гипогликемии.
- Желательно использовать систему длительного мониторирования гликемии.
Ребёнку с диабетом 2-го типа инсулин показан при появлении первых признаков или декомпенсации болезни с развитием кетоацидоза. Он помогает нормализовать уровень глюкозы и снизить концентрацию кетонов в крови.
Когда состояние ребёнка будет компенсировано, необходимо перейти на немедикаментозную терапию : соблюдать диету и увеличивать физические нагрузки. В большинстве случаев это позволяет достичь оптимального уровня гликемии [14] .
Снижать калорийность нужно за счёт жиров и легкоусваиваемых углеводов. Физическая активность должна включать ежедневную ходьбу до 3-4 км и интенсивные занятия по 3-4 раза в неделю.
Проблема состоит в том, что ребёнка до определённого возраста трудно мотивировать на длительное соблюдение диеты и высокую физическую активность. Здесь важную роль играет поддержка семьи . Убедить ребёнка изменить характер питания, если вся семья питается по-прежнему, невозможно. Поэтому психологическое консультирование для всех членов семьи порой становится обязательным компонентом терапии ребёнка с диабетом 2-го типа.
Если достичь нормального уровня глюкозы с помощью немедикаментозных способов не удаётся, приходится использовать сахароснижающие препараты в форме таблеток. Из всех современных средств такого типа для детей разрешён только метформин . Этот препарат снижает резистентность клеток к инсулину.
Прогноз. Профилактика
Сахарный диабет у ребёнка — это серьёзная болезнь, которая может привести к слепоте, почечной недостаточности и ранней смерти от нелеченных осложнений.
Первичная профилактика диабета 1-го типа включает выявление генетической предрасположенности [19] . Для этого детям с семейным анамнезом диабета рекомендуется пройти медико-генетическое консультирование. При выявлении генетической предрасположенности показана профилактика факторов, провоцирующих аутоиммунный процесс: предупреждение инфекций, в том числе с помощью специфической иммунизации, вскармливание детей до 1 года грудным молоком и др.
Первичная профилактика диабета 2-го типа у детей, предрасположенных к этой форме болезни, сводится к изменению образа жизни, снижению массы тела и повышению физической активности. При инсулинорезистентности или нарушении толерантности к глюкозе важно строго контролировать уровень гликемии.
Вторичная профилактика сахарного диабета состоит в достижении постоянной нормогликемии. Это возможно как при диабете 2-го, так и 1-го типа. Использование инсулиновых помп и аппаратов для мониторирования гликемии позволяет избежать острых осложнений болезни: кетоацидоза, гиперосмолярности и гипогликемии.
Профилактика отсроченных осложнений является третичной. Для предупреждения диабетической полинейропатии показан неврологический осмотр с определением чувствительности всех периферических нервов, ахиллова и коленного рефлексов, а также скрининговая электронейромиография. Для раннего выявления кардиоваскулярной формы автономной нейропатии показана скриннговая кардиоинтервалография.
Оптимальный возраст для проведения скрининга , по мнению Американской эндокринологической ассоциации — достижение полового созревания, а при 5-летнем течении диабета — 10 лет или младше [13] .
Список литературы
- Сахарный диабет у детей и подростков: консенсус ISPAD по клинической практике: 2014 / пер. с англ. под ред. В. А. Петерковой. — М.: ГЭОТАР-Медиа, 2016. — 656 с.
- Федеральные клинические рекомендации (протоколы) по ведению детей с эндокрин-ными заболеваниями / под ред. И. И. Дедова и В. А. Петерковой. — М.: Практика, 2014. — 442 с.
- Дедов И. И., Шестакова М. В., Петеркова В. А., Викулова О. К. и др. Сахарный диа-бет у детей и подростков по данным Федерального регистра Российской Федерации: динамика основных эпидемиологических характеристик за 2013-2016 гг. // Сахарный диабет. — 2017. — № 6 (20). — С. 392-402.
- Руководство по детской эндокринологии / под ред. Чарльза Г. Д. Брука, Розалинд С. Браун: пер. с англ. под ред. В. А. Петерковой. — М.: ГЭОТАР-Медиа, 2009. — 352 с.
- Дедов И. И., Малиевский О. А., Петеркова В. А. Детская эндокринология: учебник. — М.: ГЭОТАР-Медиа, 2019. — 256 с.
- Навменова Я. Л., Русаленко М. Г., Васюхина И. А., Жмайлик М. В., Савастеева И. Г. Сахарный диабет у детей: особенности диагностики и ведения. — Гомель: ГУ «РНПЦ РМ и ЭЧ», 2017. — 58 с.
- Алгоритмы специализированной медицинской помощи больным сахарным диабетом / под ред. И. И. Дедова, М. В. Шестаковой, А. Ю. Майоровой. — 9-й выпуск (дополненный). — М., 2019. — 216 с.
- Кураева Т. Л., Зильберман Л. И., Титович Е. В., Петеркова В. А. Генетика моногенных форм сахарного диабета // Сахарный диабет. — 2011. — № 1 (16). — С. 20-27.
- Литвицкий П. Ф., Мальцева Л. Д. Расстройство углеводного обмена у детей: сахар-ный диабет // Вопросы современной педиатрии. — 2017. — № 6 (16). — С. 468-480.
- Кураева Т. Л., Дубинина И. А. Клиника и дифференциальная диагностика сахарного диабета 2 типа в детском возрасте // Сахарный диабет. — 2009. — № 3. — С. 16-20.
- Петеркова В. А., Емельянов А. О., Лаптев Д. Н., Самойлова Ю. Г. и др. Оценка эф-фективности амбулаторного наблюдения детей и подростков с сахарным диабетом 1-го типа при регулярном использовании профессионального непрерывного мониторинга уровня глюкозы // Проблемы эндокринологии. — 2020. — № 1 (66). — С. 14-22.
- Мартынова М. И., Родионова М. Е., Пилютик В. Ф. Диабетический кетоацидоз у детей // Сахарный диабет. — 2000. — № 3. — С. 33-36.
- Алимова И. Л. Диабетическая полинейропатия у детей и подростков: нерешенные проблемы и новые возможности // Российский вестник перинатологии и педиатрии. — 2016. — № 3 (61). — С. 114-123.
- Киселева Е. В., Латышев О. Ю., Окминян Г. Ф., Самсонова Л. Н. Рациональное пита-ние при сахарном диабете 1 типа у детей и подростков // ConsiliumMedicum. Педиат-рия. — 2018. — № 2. — С. 74-77.
- Ресненко А. Б. Сахарный диабет 2-го типа у детей и подростков: от патогенеза к ле-чению // Педиатрическая фармакология. — 2011. — № 8. — С. 125-129.
- Касаткина Э. П., Сивоус Г. И., Очирова Э. А., Сичинава И. Г. Профилактика хрониче-ских осложнений сахарного диабета у детей и подростков // Сахарный диабет. — 2003. — № 4. — С. 9-12.
- Дедов И. И., Ремизов О. В., Петеркова В. А. Сахарный диабет 2 типа у детей и под-ростков // Сахарный диабет. — 2001. — № 4. — С. 26-31.
- Титович Е. В. Молекулярно-генетические, иммунологические основы и перспективы профилактики сахарного диабета у детей // Проблемы эндокринологии. — 2011. — № 1. — С. 9-18.
- Смирнова О. М. Перспектива лечения и профилактики сахарного диабета 1 типа // Сахарный диабет. — 2000. — № 2. — С. 13-16.
- Алимова И. Л. Достижения и проблемы клинической практики детской диабетологии // Российский вестник перинатологии и педиатрии. — 2013. — № 2. — С. 4-11.
- Лимаренко М. П. Кожные проявления сахарного диабета у детей // Российский вест-ник перинатологии и педиатрии. — 2017. — № 2 (62). — С. 17-21.
- Малышева Н. А., Потемина Т. Е. Патогенез, диагностика и лечение диабетической ре-тинопатии у детей, больных сахарным диабетом 1-го типа // Медицинский альманах. — 2009. — № 4 (9). — С. 171-175.
- Башнина Е. Б., Царгасова И. М. Проблемы поддержания метаболической компенса-ции сахарного диабета 1 типа у подростков // Лечащий врач. — 2018. — № 3. — С. 19-21.
- Mayo clinic. Diabetes diet: Create your healthy-eating plan. — 2019.
- Renee A. A. Meal Planning for Children With Type 1 Diabetes // WebMD. — 2019.
- Министерство здравоохранения. Стандарты лечебного питания. — М., 2017. — 313 с.
СД 1-го типа у детей: новая стратегия диагностики и лечения
На начало 2022 года в Беларуси на диспансерном учете состояло более 2 800 детей с сахарным диабетом (СД) 1-го типа. Ежегодно эта цифра увеличивается примерно на 200 вновь выявленных юных пациентов. Такая тенденция характерна для большинства развитых стран мира, где ежегодно впервые выявляется 3–4 % детей с СД.
Сегодня отмечается омоложение случаев детского СД 1-го типа, и если раньше мы выделяли пик заболеваемости в подростковом возрасте, то в прошлом году в республике количество впервые выявленных 5–9-летних детей с СД 1-го типа практически совпадало с подростками (от 36 % до 42 % в зависимости от пола). В других странах такая же тенденция. Предполагается, что к 2025 году число дошкольников с СД 1-го типа в мире удвоится.
Начало и стадии заболевания

Важно понимать причины развития СД 1-го типа, чтобы своевременно применять профилактические меры. Прежде всего необходимо подчеркнуть, что большинство случаев детского СД имеет аутоиммунный генез.
Аутоиммунный сахарный диабет — хроническое многофакторное заболевание, при котором факторы окружающей среды и генетическая предрасположенность взаимодействуют, способствуя запуску иммунного ответа в β-клетках поджелудочной железы.
Несмотря на то что конкретные события, инициирующие этот процесс, до сих пор полностью не изучены, некоторые генетические и средовые факторы описаны как пусковые для развития СД 1-го типа. Заболевание начинается с периода «инкубации» (0 стадия), когда воздействие определенных триггеров создает условия для возникновения островкового аутоиммунитета.
Развитие СД 1-го типа можно разделить на три основные стадии

Наследственный компонент
СД 1-го типа имеет наследственный компонент, подтверждаемый коэффициентом конкордантности у близнецов до 70 % и 8–10 % риском для братьев и сестер пациента. Большая часть риска объясняется различием в нескольких тесно связанных локусах, включающих область комплекса гистосовместимости (HLA): HLA класса II, локусы DQ и DR и область HLA класса I, на долю которых приходится до 50 % семейных случаев СД 1-го типа.
Использование метода полногеномного секвенирования и ассоциаций генов-кандидатов предоставило доказательства в отношении других генов и локусов не-HLA, которые защищают или обеспечивают риск развития СД 1-го типа. Так, полиморфизмы гена инсулина представляют около 10 % генетической предрасположенности к СД 1-го типа у детей. Такая значительная генетическая наследуемость создает возможности для эффективного диагностического поиска аутоиммунного СД у детей.
Риски развития этого аутоиммунного заболевания повышает наличие диабет-ассоциированных антител и генетических маркеров, положительные результаты внутривенного и/или перорального глюкозотолерантного теста. Разработаны шкалы генетического риска, которые можно использовать в сочетании с другими предикторами, такими как возраст пациента, аутоантитела или клинические признаки (индекс массы тела), для оценки вероятности развития СД 1-го типа у конкретного ребенка. Чувствительность и специфичность этих шкал превышает 80 %.
Возможные пусковые факторы
Генетическая предрасположенность реализовывается под влиянием провоцирующих факторов внешней среды, пренатальных (материнское ожирение и высокая прибавка массы тела во время беременности, возраст матери, кесарево сечение) и постнатальных (большая масса тела при рождении, искусственное вскармливание, изменение кишечной микрофлоры, раннее введение прикорма, который содержит злаковые (глютен), недостаток витамина Д, респираторные инфекции). Парадоксально, но в группе риска и те дети, которые не сталкивались с энтеровирусной инфекцией.
Совсем недавно появились данные о том, что детское ожирение –– фактор риска развития диабета уже не только 2-го типа, но и ускоряющий фактор развития СД 1-го типа у детей, т. е. более ранняя манифестация.
Тесная связь иммунной и эндокринной систем очевидна. Тимус обеспечивает формирование нейроэндокринных структур на самых ранних этапах эмбриогенеза, а пептидные нейроэндокринные гормоны, в свою очередь, оказывают модулирующее воздействие на иммунную систему, синтез и реализацию функций биологических продуктов тимуса.
Многие медиаторы, синтезируемые иммунокомпетентными клетками (лимфокины, интерфероны, интерлейкины), обладают свойствами гормонов, а гипоталамо-гипофизарно-адреналовая система контролирует продукцию антител и выход зрелых лимфоцитов из костного мозга. Кроме того, обнаружено влияние отдельных нейропептидов на развитие иммунного ответа, рецепторы к ним выявлены на мембране клеток иммунной системы. Нет сомнений и в том, что всякие нарушения иммунной системы неизбежно влекут за собой изменения функций эндокринной системы и наоборот. Большинство аутоиммунных болезней, как и болезней эндокринной системы, — полигенны.
Теории аутоиммунного генеза детского диабета
Существует достаточно много теорий, которые могли бы лечь в основу понимания механизмов формирования иммунного ответа при детском СД. Например, теория фетального микрохимеризма, которая обсуждается в качестве основы для аутоиммунного поражения поджелудочной железы. Выявлена способность фетальных клеток приобретать характеристики определенных клеточных линий организма-хозяина с экспрессией специфических тканевых маркеров.
Ряд исследований патогенеза аутоиммунных заболеваний касается и возможной роли микроРНК, которые могут «нацеливаться» на некоторые гены, участвующие в иммунном ответе или функции иммунных клеток.
Измененная экспрессия miRNAs может нарушить нормальную функцию иммунных клеток, иммунный гомеостаз и привести к иммунным атакам на поджелудочную железу, вплоть до возникновения и прогрессирования островкового аутоиммунитета. Реакция при СД 1-го типа напоминает эффективный противоопухолевый иммунитет, в дополнение к которому могут быть запущены другие иммунные и аутоиммунные реакции, в том числе против островков поджелудочной железы.
Способы влияния на аутоиммунный процесс
На сегодняшний день необходимы дополнительные клинические и молекулярные исследования, чтобы лучше понять аутоиммунный процесс, который происходит в островках Лангерганса на разных стадиях развития СД 1-го типа, и улучшить терапевтические подходы, направленные на предотвращение и обращение вспять разрушения β-клеточной массы.
Наиболее практичный подход — это остановить развитие дисфункции β-клеток, вмешавшись в процесс в самом начале заболевания. Выделяют «оптимальное окно» для целенаправленного иммунного вмешательства на основе выявления индивидуализированных иммунных характеристик, связанных с быстрым снижением, как до постановки диагноза (профилактическая терапия), так и после постановки диагноза (терапевтическое вмешательство). Оно может стать хорошей контрольной точкой для назначения будущих иммунотерапевтических препаратов. Понимание этого периода и определение периферических биомаркеров, которые являются признаками иммунорегуляции или регенерации островков, может способствовать выявлению пациентов с лучшим гликемическим прогнозом и более низким риском хронических осложнений.
Перспективна в этом отношении фаза «медового месяца». Полный иммунный фенотип этой стадии не идентифицирован, но новые данные указывают на интересные изменения: начало СД 1-го типа вызвано преобладанием Т-эффекторных лимфоцитов над Т-регуляторными. Эти данные предполагают, что стадия «медового месяца» является следствием генетической предрасположенности и иммунологических изменений субпопуляций Т-клеток и цитокинов.
Обсуждается возможность стадийно-специфического терапевтического вмешательства при СД 1-го типа. Пациенты со стадией 0 без аутоантител, но с риском развития СД 1-го типа из-за генетических и/или экологических триггеров являются кандидатами на иммунотерапию, направленную на профилактику заболевания и сохранение интактной массы β-клеток.
У пациентов с 1-й и 2-й стадиями заболевания, характеризующимися наличием одного или нескольких антител и прогрессирующей дисгликемией, терапия направлена на подавление деструкции β-клеток и аутоиммунного процесса. Терапевтическое вмешательство, направленное на замену эндогенных β-клеток путем трансплантации островков поджелудочной железы или дифференцированных in vitro β-клеток, вместе с препаратами, повышающими толерантность, должно быть зарезервировано для пациентов с 3-й стадией с клинически явным СД 1-го типа и выраженным снижением количества и функции β-клеток.
Новые подходы к лечению СД 1-го типа
- Экзогенная замена инсулина включает аналоги инсулина; интегрированные системы замкнутого цикла, сочетающие устройства для доставки инсулина и технологию определения уровня глюкозы; персонализированные устройства (искусственная поджелудочная железа, искусственный интеллект) для адаптации замены инсулина.
- Варианты клеточной доставки инсулина включают трансплантацию островковых клеток или клеток, продуцирующих инсулин (полученных из стволовых клеток); стратегии стимуляции пролиферации или регенерации β-клеток поджелудочной железы и подходы, которые стимулируют дифференцировку стволовых клеток в клетки, продуцирующие инсулин.
- Защитные стратегии включают иммуномодуляцию для блокирования воспалительных цитокинов или патогенных иммунных клеток и предотвращения повреждения или потери β-клеток поджелудочной железы.
Источник https://www.lvrach.ru/2003/10/4530836
Источник https://probolezny.ru/saharnyj-diabet-u-detej/
Источник https://medvestnik.by/konspektvracha/sd-1-go-tipa-u-detej-novaya-strategiya-diagnostiki-i-lecheniya
