Ювенильный ревматоидный артрит лечение препараты
С.О. Салугина, Е.С. Федоров
ФГБУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой» РАМН, Москва
Ювенильный артрит (ЮА) – хроническое воспалительное заболевание суставов, в отсутствие адекватного рано начатого лечения приводящее к тяжелым деструктивным изменениям, серьезным функциональным нарушениям, инвалидизации, а в некоторых случаях – к фатальному исходу. Современные методы лечения ЮА основываются на применении наиболее эффективных средств, позволяющих добиваться развития стойкой ремиссии и обнадеживающих отдаленных исходов заболевания. Комплексный подход с рациональным использованием традиционной терапии, включающей симптом модифицирующие и болезнь-модифицирующие базисные противовоспалительные препараты, а также своевременное использование принципиально новых генно-инженерных биологических препаратов (особенно пациентами, рефрактерными к традиционной терапии) являются ключом к улучшению прогноза и качества жизни больных ЮА.
Ювенильный артрит (ЮА) – наиболее распространенное ревматическое заболевание у детей. ЮА – хронический воспалительный процесс в суставах неустановленной природы длительностью более 6 недель, начавшийся у пациента до 16-летнего возраста при исключении других известных нозологических групп, проявляющихся артритом. Термин ЮА объединяет гетерогенную группу заболеваний, имеющих различный этиопатогенез и иммуногенетическое происхождение, различную нозологическую принадлежность и неоднозначный прогноз. Частота встречаемости точно неизвестна. По различным данным, заболеваемость ЮА в год варьируется от 1 до 20 случаев на 100 тыс. (Япония–Норвегия), распространенность колеблется в зависимости от популяций, например от 10 : 100 тыс. во Франции до 400 : 100 тыс. детского населения в Австралии [1].
В Российской Федерации распространенность ЮА составляет 62,3 на 100 тыс., первичная заболеваемость – 16,2 на 100 тыс. [2]. Среди всех взрослых пациентов, страдающих ревматоидным артритом (РА), 2,7–5,2 % имеют начало в детском возрасте.
В соответствии с ILAR-клас-сификацией (The International League Against Rheumatism) ЮА (ювенильный идиопатический артрит – ЮИА по терминологии Международной лиги ревматологических ассоциаций) подразделяется на 7 различных категорий, имеющих свои определения и критерии исключения [3, 4]. В основе данной классификации, как и всех имеющихся ранее, лежат такие признаки, как число вовлеченных в процесс суставов, наличие экстраартикулярных, в т. ч. системных, проявлений, наличие или отсутствие ревматоидного фактора (РФ), HLA (Human Leukocyte Antigen)-B27 антигена и семейного анамнеза [1]. В табл. 1 представлены основные категории ЮИА, распознавание которых имеет существенное значение для дифференцированного подхода к терапии. Создание такой субклассификации было проведено с целью описания наиболее гомогенных групп пациентов для лучшего понимания патогенеза.
Выбор терапии для пациентов с ЮА базируется на взаимоотношениях риска, связанного с заболеванием (тяжесть болезни, развитие деструкций суставов и функциональной недостаточности, инвалидизирующих осложнений; прогностические факторы, определяющие жизненный прогноз и качество жизни), пользы и риска самой терапии.
В своей практике врач руководствуется следующими принципами:
- Выбор лечебного комплекса, позволяющего обеспечивать контроль над активностью, предотвращать прогрессирование.
- Главными ориентирами являются возраст, вариант артрита, тяжесть артрита, прогноз течения и оценка вероятности инвалидизирующего исхода.
- Если прогноз неблагоприятный, терапия должна быть опережающей и агрессивной; но риск, связанный с лечением, должен быть ниже, чем риск прогрессирования заболевания.
- Лечение должно быть комплексным, этапным и длительным.
К основным задачам лечения ЮА относятся купирование боли и других симптомов воспаления; предупреждение или замедление деструкции суставов, отдаленных повреждений, ведущих к инвалидизации; индукция длительной и стойкой ремиссии, повышение качества жизни, минимизация побочных эффектов терапии [5].
До середины 1980-х гг. терапия детей с артритами (наиболее часто называемыми ювенильными РА в США и ювенильными хроническими артритами в странах Европы) включала ограниченное количество противовоспалительных средств и кортикостероиды. Лишь небольшое число детей отвечали на монотерапию нестероидными противовоспалительными средствами (НПВС), почти все отвечали на лечение глюкокортикоидами (ГК), однако цена была слишком высокой из-за множества осложнений [6]. К настоящему времени современные ревматологи располагают достаточно большим арсеналом средств, позволяющих контролировать патологический процесс у детей с ЮА.
Составляющими лечебного комплекса, применяемого пациентами с ЮА, являются симптом-модифицирующие средства, к которым относятся НПВС и ГК, и болезнь-модифицирующие средства – базисные противовоспалительные препараты (БПВП) и генно-инженерные биологические препараты (ГИБП).

Терапия НПВС является симптоматической для уменьшения воспаления и связанной с ним боли. Основные эффекты НПВС связаны с влиянием их на простагландины (ПГ), которые играют центральную роль в развитии воспаления. По селективности своего влияния на циклооксигеназы (ЦОГ-1 и ЦОГ-2) они подразделяются на традиционные ЦОГ-1- и ЦОГ-2-ингибиторы (диклофенак натрия, индометацин, напроксен, пироксикам, ибупрофен и др.) и селективные ЦОГ-1-ингибиторы (ацетилсалициловая кислота, которая в настоящее время при ЮА не используется) и ЦОГ-2-ингибиторы (мелоксикам, нимесулид и др.) [2]. В педиатрии применение НПВС ограниченно. В реальной практике используются диклофенак натрия (разрешен с 6 лет) в дозе 2,5–3,0 мг/кг/сут, ибупрофен (с 6 месяцев) – 20–40 мг/кг/сут, нимесулид (с 2 лет) – 3–5 мг/кг/сут; напроксен (с 12 лет) – 15–20 мг/кг/сут, мелоксикам (с 12 лет) – 0,15–0,2 мг/кг/сут. Применение индометацина ограничено в последние годы использованием преимущественно при ЮА HLA-B27, ассоциированном или с высоким риском развития одного из вариантов спондилоартрита. Прием НПВС должен быть достаточно длительным в зависимости от варианта ЮА. Установлено, что примерно у трети детей артрит контролируется изолированным приемом НПВС, чаще – у пациентов с олигоартритом [6].
ГК-терапия наиболее часто применяется для лечения экстраартикулярных проявлений при системном ЮА.
К ним относятся фебрильная лихорадка, не отвечающая на прием НПВС, тяжелая анемия, миокардит или перикардит, синдром активации макрофагов [7]. До эры биологических препаратов использование ГК считалось, пожалуй, терапевтической доктриной больных с жизнеугрожающими состояниями. Многогранный, в т. ч. мощный противовоспалительный, эффект ГК обеспечивает быстрое подавление активности патологического процесса и системного воспалительного ответа, с тем чтобы, являясь «bridge»-терапией, обеспечить переход на длительно действующие БПВП [1].
Высокодозовая пульс-терапия метилпреднизолоном в дозе 10–30 мг/кг внутривенно, но не более 1 г на одно введение в течение 1–3 последовательных дней служит эффективным средством быстрого подавления воспаления. Однако эффект непродолжительный и быстро исчезает, поэтому часто необходимо продолжение системного приема ГК внутрь в дозе 0,5–1,0 мг/кг/сут преднизолона в течение 3–4 недель. Препарат вводят преимущественно в утренние часы. Дальнейшее снижение дозы осуществляется постепенно, в низких дозах по альтернирующей схеме [2, 5]. Нередко пациенты с тяжелым полиартритом, рефрактерным к другой терапии, также нуждаются в применении ГК в дозе, не превышающей 0,5 мг/кг, для уменьшения воспаления, купирования боли и облегчения восстановительной реабилитации. Но наличие большого числа побочных эффектов от применения ГК-терапии позволяет рассматривать ее лишь как терапию отчаяния и промежуточного этапа.
Внутрисуставное введение ГК было и по-прежнему остается одним из самых эффективных методов местного и отчасти системного воздействия на патологический процесс у детей с ЮА. Целью служат быстрое подавление локального воспаления, уменьшение боли и восстановление функции сустава. Нередко этого бывает достаточно для развития ремиссии у больных олигоартикулярным ЮА и значительного облегчения ситуации при полиартрите, а также эффективным средством предотвращения формирования контрактур в суставах, вальгусной деформации, разницы в длине конечностей, особенно у маленьких детей. Внутрисуставные инъекции (ВСИ), осуществляемые одновременно с применение БПВП или ГИБП, позволяют наиболее быстро и эффективно использовать лечебный потенциал последних. Такой подход может быть альтернативой использованию системной ГК-терапии, в свою очередь также обеспечивающей т. н. bridge-эффект. К наиболее часто применяемым препаратам для внутрисуставных введений в США и странах Евросоюза относятся триамцинолона гексацетонид и его аналоги. В РФ данный препарат для применения к детям не зарегистрирован и отсутствует в продаже.
В зависимости от пораженных суставов применяют триамцинолона ацетонид для крупных суставов, бетаметазон для средних и мелких суставов. Другие препараты (метилпреднизолон и др.) используются в настоящее время крайне редко [5, 7]. Несмотря на то что нет четких и окончательно принятых рекомендаций к частоте использования ВСИ, нежелательно проводить повторные введения чаще чем с интервалом в 3 месяца [7]. Согласно данным различных исследований, наибольший риск развития рецидива артрита после ВСИ имеют пациенты, страдающие системным ЮА, чем больные олиго- или полиартритом, а также больные с высоким уровнем С-реактивного белка, негативные по антинуклеарному фактору, и те, кому проводились инъекции в голеностопные суставы [7, 8]. Наиболее частыми побочными эффектами остаются подкожные атрофии и депигментация в месте введения, особенно при инъекциях в лучезапястные, голеностопные и мелкие суставы кистей. Со временем субатрофия кожи исчезает у большинства больных. Риск развития осложнений минимизируется при технически правильно выполненной процедуре. Не описано какого-либо влияния ВСИ на внутрисуставной хрящ и зоны роста [7, 9]. Известно также еще об одном местном осложнении ВСИ – это образование периартикулярных кальцинатов.
В большинстве случаев они асимптомны и распознаются случайно – при лучевом исследовании. Кроме того, перед выполнением внутрисуставных инъекций, особенно при моноартрите, в обязательном порядке должен быть исключен туберкулезный процесс.
Таким образом, ГК являются важным компонентом терапии ЮА у детей. Применение ГК позволяет обеспечивать быстрый и эффективный контроль над системным воспалительным процессом и помогает предотвращать серьезные органные нарушения. Однако не следует забывать о побочных эффектах, связанных с применением ГК, особенно пролонгированным.
К ним относятся развитие медикаментозного синдрома Иценко–Кушинга, стойкая артериальная гипертензия, тяжелый системный остеопороз, ожирение, образование стрий, эрозий и язв на коже и верхних отделах желудочно-кишечного тракта, стероидная миопатия, заднекапсулярная катаракта, стероидный диабет и др. [2].
Современный подход к терапии ЮА основывается на как можно более раннем применении БПВП, поскольку быстродействующая противоревматическая терапия (НПВС, ГК) способствует лишь быстрому уменьшению боли и воспаления в суставах, улучшению их функции, но не предотвращает развития в них деструкции и в глобальном смысле не влияет на отдаленный прогноз [4]. Группа БПВП включает метотрексат (МТХ), антималярийные препараты, сульфасалазин, лефлуномид. Препараты золота, пеницилламин, широко используемые в прошлые годы, в настоящее время при лечении ЮА не применяются. Антималярийные препараты занимают небольшую нишу в лечении хронических артритов и находят свое применение при моно- и олигоартритах без выраженной воспалительной активности и существенного прогрессирования процесса – преимущественно у детей раннего возраста. Доза составляет 6–8 мг/кг/сут.
Среди БПВП, используемых в лечении ревматических заболеваний у детей, МТХ является наиболее часто назначаемым препаратом и по праву заслуживает название «золотого» стандарта базисной терапии [10].
В большой серии контролируемых рандомизированных исследований были установлены оптимальные дозы, способы введения МТХ, пути повышения эффективности и безопасности. Согласно литературным данным и опыту многих исследователей, МТХ находится на первом месте среди всех БПВП. Частота его использования у детей с суставным вариантом ЮА, по данным Института ревматологии им. В.А. Насоновой, составила 82 %, а при системном – 70 % [10]. Для детей с ЮА доза рассчитывается на площадь поверхности тела. Эффективными считаются дозы 10–15 мг/м² в неделю внутрь или парентерально (подкожно или внутримышечно) [4, 10]. Пероральный прием осуществляется 2 раза в сутки с интервалом 12 часов 1 раз в неделю. Считается, что парентеральное введение МТХ может быть более эффективным и лучше переносится пациентами. Однако имеются сведения, будто достоверной разницы ни в плане эффективности, ни в плане переносимости между этими способами введения МТХ не определяется [1]. У пациентов с полиартритом, резистентных к проведению терапии МТХ в стандартных дозах, эффективным может оказаться использование комбинированной пульс-терапии ГК с высокими дозами МТХ (30 мг/м² в неделю, максимально – 40 мг) с переходом на еженедельное введение в дозе 15 мг/м². Как было показано в рандомизированных контролируемых исследованиях, ежедневное применение взрослыми фолиевой кислоты через 24 часа после приема МТХ снижает риск побочных эффектов [1]. Интересен факт определенной протективности МТХ в плане развития у детей с ЮА такого экстраартикулярного проявления, как увеит. В одном итальянском исследовании было показано, что у детей, получавших МТХ, значительно реже развивался увеит, чем у тех, кто его не получал (10,5–20,2 %). Наблюдение итальянских коллег подтверждает генеральный вывод: рано начатое лечение МТХ у детей с ЮА снижает риск развития увеита с 30 до 10 % [11].
Сульфасалазин (ССЗ) как препарат первой линии применяется в дозе 30–50 мг/кг/сут в 2–3 приема пациентами с олигоартритом с риском формирования одного из вариантов спондилоартрита, особенно при HLA-B27, ассоциированном ЮА у мальчиков. Применение возможно детьми старше 6-летнего возраста, осуществляется постепенно, начиная с 10–15 мг/кг и еженедельно увеличивая дозу. Эффект от его лечения можно оценить не ранее чем через 6 месяцев, а иногда и через год непрерывного приема. Категорически не рекомендуется использовать ССЗ для лечения системного артрита.
В тех случаях, когда монотерапия БПВП оказывается неэффективной, возможно применение комбинации БПВП (МТХ + ЦСА – циклоспорин А, МТХ + Леф, МТХ + ССЗ, МТХ + АХП), однако в последние годы в связи с существенным расширением спектра противоревматических средств за счет различных видов ГИБП комбинации стандартных БПВП используются все реже и реже.
По своей природе ЮА являются типичными иммуновоспалительными заболеваниями, и, как следует из названия, основа их развития – это хроническое воспаление, обусловленное дисфункцией иммунной системы [12].
В развитии воспалительной реакции принимают участие клеточные (моноциты/макрофаги, гранулоциты, дендритные клетки, Т- и В-лимфоциты, клетки сосудистого эндотелия) и многочисленные гуморальные факторы: цитокины, гормоны, антитела, гистамин, серотонин, компоненты калликреин-кининовой и гемокоагуляционной систем, система комплемента, белки острой фазы и многие др.) [12]. Среди вышеперечисленных гуморальных регуляторов воспаления существует своя иерархия, при которой одни медиаторы верхнего уровня регулируют действие медиаторов нижележащего уровня. К «верхнему этажу» системы регуляции воспаления относятся цитокины, воздействие на которые и лежит в основе использования ГИБП при ЮА. Цитокины – белковые продукты преимущественно активированных клеток иммунной системы, лишенные специфичности в отношении антигенов, обусловливающие межклеточные коммуникации при гемопоэзе, воспалении, иммунном ответе и межсистемных взаимодействиях. Цитокины составляют систему (цитокиновую сеть), характеризующуюся сильным взаимодействием компонентов и избыточностью (одна и та же функция обеспечивается разными цитокинами). Цитокины по своей роли в организме являются как бы «дирижерами» сложного «оркестра» воспаления. Примером регулирования процесса воспаления служит наличие про- и противовоспалительных цитокинов [13, 14]. К числу основных провоспалительных цитокинов относится семейство фактора некроза опухоли (ФНО), включающее на сегодняшний день 18 представителей, среди которых важнейшие – это ФНО-α и ФНО-β. ФНО является «ранним» цитокином, появляющимся в дебюте развития воспалительной реакции. К другому семейству провоспалительных цитокинов относятся представители семейства интерлейкина-1 – ИЛ-1 (не менее 11), важнейшие из которых – ИЛ-1α, ИЛ-1β, ИЛ-18 и растворимые антагонисты рецепторов ИЛ-1 (ИЛ-1ра). Последний крайне важен и является антивоспалительным цитокином, способным связываться с рецептором для ИЛ-1 без его активации и тем препятствовать его взаимодействию с молекулой ИЛ-1β с развитием всех его провоспалительных эффектов [14]. Важнейшим «поздним» цитокином является ИЛ-6. Для него характерно в значительной степени «дистантное» действие, т. е. он присутствует в кровотоке и работает подобно истинному гормону. Среди важнейших функций ИЛ-6 следует отметить его участие в индукции образования иммуноглобулинов, острофазовых белков, в т. ч. С-реактивного и сывороточного амилоидного белка А (что приводит к развитию амилоидоза), гепсидина (способствующего развитию анемии); участие в разрушении хряща, замедлении линейного роста и развитии остеопороза. Блокада функции ИЛ-6 возможна путем нарушения связывания лиганда с растворимым рецептором.
Роль и значение того или иного цитокина различны при разных заболеваниях [15]. Соответственно, при той или иной нозологии можно выделить ведущий цитокин или небольшую группу цитокинов, блокада которых приведет к подавлению всей цепи патологических реакций. Так, для системного ЮА, который представляет, по сути, обособленное заболевание, ведущую роль в патогенезе играют ИЛ-6 и ИЛ-1β. Уже в работах A.M. Prieur и соавт. [16,17] продемонстрировано, что температурные пики при системном ЮА связаны с повышением уровня ИЛ-6 и ИЛ-1ра, которые предшествуют подъему температуры. По сути, многие проявления данного заболевания (лихорадка, задержка линейного роста, остеопороз, анемия, тромбоцитоз) и развитие осложнений служат следствием действия ИЛ-6 [17]. Другой важнейший цитокин, участвующий в патогенезе системной формы ЮА, – это ИЛ-1β. Интересно отметить, что для системного ЮА характерно также нарастание уровня ИЛ-1ра в сыворотке крови, на что указывают множество работ и наши собственные данные [15, 18]. Но главным доказательством значения этих цитокинов в патогенезе системного ЮА явился успешный терапевтический опыт с блокадой указанных молекул. Следует отметить, что у одних пациентов с системным ЮА более эффективно применение ингибиторов ИЛ-6, у других – ингибиторов ИЛ-1. Возможно, в перспективе будут выделены субтипы ИЛ-6-зависимого ЮА и ИЛ-1-зависимого ЮА. Роль ФНО в генезе системного ЮА значительно скромнее, что подтверждается частым (но не тотальным) неуспехом применения ФНО-ингибиторов со стороны данных пациентов. Несомненно, ФНО занимает в генезе системного ЮА подчиненную роль, тем не менее значимую и, возможно, в первую очередь связанную с активацией эндотелия [14, 19–23]. Говоря о серопозитивном полиартикулярном варианте ЮА, можно считать, что это состояние является аналогом серопозитивного РА взрослых и все, что известно в отношении РА взрослых, применимо и к подобным пациентам детского возраста. Для этой формы заболевания ведущими медиаторами являются ФНО-α и ИЛ-6, а ИЛ-1β играет важную, но подчиненную роль, с чем и связана недостаточная эффективность ИЛ-1-ингибиторов для подобных пациентов [14, 24].
В отношении разнородной группы олигоартикулярного ЮА хочется отметить, что в их развитии имеют значение те же провоспалительные цитокины, что и при других вариантах, т. е. ФНО, ИЛ-1, ИЛ-6, но уровни этих молекул в крови и синовиальной жидкости, по данным большинства исследователей, ниже, чем при системном и полиартикулярном вариантах, и в то же время уровень антивоспалительных цитокинов выше. Соответственно, соотношение провоспалительные/антивоспалительные цитокины у этих пациентов ниже, что клинически отражается лимитированным поражением суставов [22, 23, 25–27].
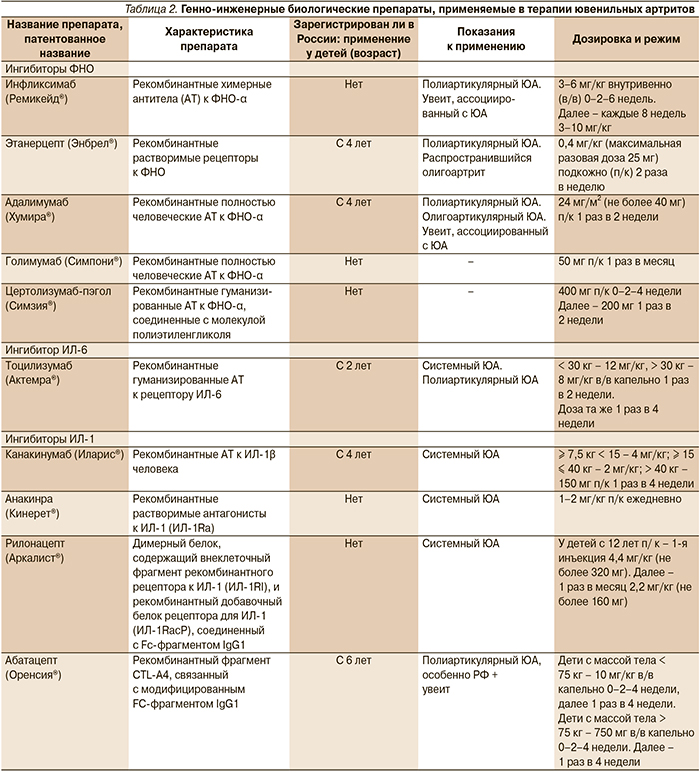
Использование биологических препаратов, действие которых направлено на подавление эффектов цитокинов, а также других факторов, участвующих в воспалении, служит основой современного лечения ЮА. Многие из препаратов достаточно хорошо изучены в рандомизированных контролируемых исследованиях и широко используются на практике [28–36]. Некоторые характеристики ГИБП и их использование при различных вариантах ЮА представлены в табл. 2.
К сожалению, до настоящего времени точно не установлено, как рано следует назначать ГИБП. Тем не менее своевременное назначение биологической терапии во многих случаях помогает избегать риска развития серьезных побочных проявлений стероидной терапии.
ЮА-ассоциированный увеит – довольно частая экстраартикулярная манифестация ЮА, нередко сопровождается развитием серьезных осложнений, таких как катаракта (20 %), глаукома (19 %), лентовидная дистрофия роговицы (16 %), у 15–30 % развивается слепота [4, 11, 37]. Тяжелые осложнения увеита, приводящие к слепоте, возникают у 1–12 % заболевших. Активное лечение увеита должно быть начато безотлагательно. При тяжелом течении воспалительного процесса развитие серьезных осложнений возможно в течение нескольких дней. Поэтому лечение детей с офтальмологическими проявлениями необходимо начинать рано и достаточно агрессивно.
Основой лечения увеита в первую очередь служит максимальное использование методов локальной терапии, осуществляемой офтальмологами. Применяются инстилляции ГК, периокулярные инъекции, интравитреальное введение. При легком течении для купирования увеита часто достаточно только местного лечения. Системную терапию назначают и корректируют ревматологи и офтальмологи, которые должны находиться в тесном контакте. При недостаточной эффективности локальной терапии увеита используются системные ГК, оказывающие быстрое и выраженное противовоспалительное действие.
Показания к назначению иммуносупрессивной терапии: недостаточная эффективность ГК-терапии, ее плохая переносимость с развитием побочных эффектов, необходимость применения высоких доз ГК для поддержания ремиссии увеита, опасных в плане возникновения осложнений. Из БПВП для лечения увеита, резистентного к локальной терапии и ГК, используются МТХ в стандартных дозировках, азатиоприн (1,5–3,0 мг/кг/сут), микофенолата мофетил (CellСept) до 1 г (600 мг/м2) 2 раза в сутки. В редких случаях – циклофосфамид внутрь 1–2 мг/кг/сут, внутривенно – 15–20 мг/кг 1 раз в 3–4 недели, хлорамбуцил внутрь 0,1–0,2 мг/кг/сут. В последние годы при увеитах, ассоциированных с ЮА, с успехом используются ГИБП, в первую очередь ФНО-ингибиторы (инфликсимаб, адалимумаб), а также абатацепт (табл. 2).
На рисунке схематично представлены варианты лечения ЮА в зависимости от его субтипа.
Таким образом, выбор начальной терапии при ЮА основывается на клинических проявлениях, активности болезни и возможностях, связанных с регистрацией того или иного препарата. В эру до использования биологической терапии ЮА чаще всего ассоциировался с тяжелым течением, деструктивными изменениями в суставах, приводящими к серьезным функциональным нарушениям, задержкой роста и физического развития, с глазными нарушениями и неблагоприятным жизненным прогнозом. За последнее десятилетие достигнут значительный прогресс в лечении ЮА, основанном на применении современных эффективных средств, позволяющем добиваться развития стойкой ремиссии и обнадеживающих отдаленных исходов заболевания.
Литература
- Horneff G. Treatment options with biologics for juvenile idiopathic arthritis // Int. J. Clin. Rheum. — 2011. — Vol. 6(3). — P. 1—19.
- Клинические рекомендации для педиатров. Детская ревматология. Ювенильный артрит / Под ред. А.А. Баранова, Е.И. Алексеевой. М., 2013. — 117 с.
- Petty R.E., Southwood T.R., Manners P., et al. International League of Associations for Rheumatology classification of juvenile idiopathic arthritis: second revision, Edmonton 2001 // J. Rheumatol. — 2004. — Vol. 31. — P. 390—92.
- Cassidy J.T., Petty R.E., Laxer R.M., et al. Textbook of pediatric rheumatology. 6th ed. Philadelphia: Elsevier Saunders, 2011. — P. 71—126.
- Клинические рекомендации. Ревматология. 2-е изд. / Под ред. Е.Л. Насонова. М., 2010.— С. 231–70.
- Haines K.A. Juvenile idiopathic arthritis. Therapies in the 21st Century // Bulletin of the NYU Hospital for Joint Diseases. — 2007. — Vol. 65(3). — P. 205—11.
- Ravelli A., Lattanzi B., Consolaro A., et al. Glucocorticoids in paediatric rheumatology // Clin. Exp. Rheumatol. — 2011. — Vol. 29(68). — P. 148—52.
- Lanni S., Bertamino M., Consolaro A., et al. Outcome and predicting factors of single and multiple intra-articular corticosteroid injections in children with juvenile idiopathic arthritis // Rheumatology. — 2011. — Vol. 50. — P. 1627—34.
- Huppertz H.I., Tschammler A., Horwitz A.E., et al. Intraarticular corticosteroids for chronic arthritis in children: efficacy and effects on cartilage and growth // J. Pediatr. — 1995. — Vol. 127. — P. 317—21.
- Никишина И.П., Родионовская С.Р. Метотрексат в терапии ювенильного артрита. Пособие для врачей. М., 2006. 36 с.
- Carvounis P.E., Herman D.C., Cha S., et al. Incidence and outcomes of uveitis in juvenile rheumatoid arthritis. A synthesis of the literature // Graefes. Arch. Clin. Exp. Ophthalmol. — 2006. — Vol. 244. — P. 281—90.
- Литвицкий П.Ф. Патофизиология. Учебник для вузов. М., 2003. — С. 142—201.
- Насонов Е.Л. Новые направления фармако-терапии ревматических заболеваний – ингибиция интерлейкина 6 и интерлейкина 17 // Современная ревматология. — 2013. — № 3. — С. 5—14.
- Федоров Е.С., Салугина С.О., Кузьмина Н.Н. Роль цитокиновой сети в регуляции воспаления при различных вариантах ювенильного артрита // Научно-практическая ревматология. — 2009. — № 3. — С. 74—89.
- Prieur A.M., Kaufmann M.T., Griscelli C., et al. Specific interleukin-1 inhibitor in serum and urine of children with systemic juvenile chronic arthritis // Lancet. — 1987. — Vol. 2. — P. 1240—42.
- Prieur A.M., Roux Lombard P., Dayer J.M. Dynamics of fever and the cytokine network in systemic juvenile arthritis // Rev. Rheum. Engl. Ed. — 1996. — Vol. 63. — P. 163—70.
- De Benedetti F., Martini A. Is systemic juvenile rheumatoid arthritis an interleukin-6 mediated disease? // J. Rheumatol. — 1998. — Vol. 25. — P. 203–07.
- Rooney M., David J., Symons J., et al. Inflammatory cytokine response in juvenile chronic arthritis // Br. J. Rheumatol. — 1995. — Vol. 34. — P. 454—60.
- De Benedetti F. Inflammatory cytokines in the pathogenesis and treatment of systemic juvenile idiopathic arthritis // Pediatric Rheumatology Online J. — 2005. — Vol. 3. — P. 122—36.
- Pascual V., Allantaz F., Arce E., et al. Role of interleukin-1 (IL-1) in the patogenesis of systemic onset juvenile idiopathic arthritis and clinical response to IL-1 blockade // J. Experimental Medicine. — 2005. — Vol. 201. — P. 1479—86.
- Muller K., Herner E.B., Stagg A., et al. Inflammatory cytokines and cytokine antagonists in whole blood cultures of patients with systemic juvenile chronic arthritis // Br. J. Rheumatol. — 1998. — Vol. 37(5). — P. 562—69.
- Roony M., Varsani K., Martin P., et al. Tumor necrosis factor alpha and it soluble receptor in juvenile chronic arthritis // Rheumatology. — 2000. — Vol. 39. — P. 432—38.
- Mangge H., Kenzian H., Gallistl S., et al. Serum cytokines in Juvenile Rheumatoid Arthritis. Correlation with Convential Inflammatiom Parametrs and Clinical Subtypes // Arthritis & Rheumatism. — 1995. — Vol. 3(2). — P. 211—20.
- Александрова Е.Н., Насонов Е.Л. Иммуно-патология ревматоидного артрита. В кн. Генно-инженерные биологические препараты в лечении ревматоидного артрита / Под ред. Е.Л. Насонова. М., 2013. — С. 19–46.
- Muzzaffer M.A., Dayer J.M., Feldman B.M., et al. Differences in the profiles of circulating levels of soluble tumor necrosis factor receptors and interleukin-1 receptor antagonist reflect heterogeneity of the subgroup of juvenile rheumatiod arthritis // J. Rheumatol. — 2002. — Vol. 29. — P. 1071—78.
- Ozen S., Saatci N., Bakkaroglu A., et al. Interleukin-1,-6,-8 Levels In Juvenile Chronic Arthrititis // Clinical Rheumatology. — 1997. — Vol. 16(2). — P. 173—78.
- Просвиров Е.Ю., Кельцев В.А., Рязанов В.В. и др. Морфофункциональные особенности иммунной системы при хронических артритах у детей // Научно-практическая ревматология. 2003. — № 2. — Прил. — С. 86.
- Wallace C.A. Developing standards of care for patients with juvenile idiopathic arthritis // J. Rheumatology. — 2010. — Vol. 49. — P. 1213—14.
- Davies K., Cleary G., Foster H., et al. BSPAR Standards of care for children with juvenile idiopathic arthritis // J. Rheumatology. — 2010. — Vol. 49. — P. 1406—408.
- Ringold S., Weiss P.F., Beukelman T., et al. 2013 Update of the 2011 American College of Rheumatology Recomendations for the Treatment of juvenile idiopathic arthritis. Recomendations for the medical therapy of children with juvenile idiopathic arthritis and tuberculosis screening among children receiving biologic medications // Arthritis Rheum. — 2013. — Vol. 65(10). — P. 2499—512.
- Beukelman T., Patkar N.M., Saag K.G., et al. 2011 American College of Rheumatology Recomendations for the Treatment of juvenile idiopathic arthritis: initiation and safety monitoring of therapeutic agents for the treatment of arthritis and systemic features // Arthritis Care Res. (Hoboken). — 2011. — Vol. 63. — P. 465—82.
- Yokota S., Imagawa T., Mori M., et al. Efficacy and safety of tocilizumab in patient with systemic-onset juvenile rheumatoid arthritis: a randomized, double-blind. placebo-controlled in juvenile rheumatoid arthritis // Lancet. — 2008. — Vol. 371. — P. 998—1006.
- De Benedetti F., Brunner H.I., Ruperto N., et al. Randomized Trial of Tocilizumab in Systemic Juvenile Idiopathic Arthritis // N. Engl. J. Med. — 2012. — Vol. 367. — P. 2385—95.
- Ruperto N., Lovell D.J., Quartier P., et al. Abatacept in children with juvenile idiopathic arthritis: a randomised, double-blind, placebo-controlled withdrawal trial // Lancet. — 2008. — Vol. 372. — P. 383—91.
- Lovell D.J., Giannini E.H., Reiff A., et a Etanercept in children with polyarticular juvenile rheumatoid arthritis. Pediatric Rheumatology Collaborative Study Group // N. Engl. J. Med. — 2000. — Vol. 342. — P. 763—69.
- Lovell D.J., Giannini E.H., Reiff A., et al. Long-term efficacy and safety of etanercept in children with polyarticular-course juvenile rheumatoid arthritis: interim results from an ongoing multicenter, open-label, extended-treatment trial // Arthritis Rheum. — 2003. — Vol. 48. — P. 218—26.
- Lovell D.J. Update on treatment of arthritis in children. New Treatments, new Goals // Bulletin of the NYU Hospital for Joint Diseases. — 2006. — Vol. 64(1). — P. 72—6.
Об авторах / Для корреспонденции
Салугина Светлана Олеговна – ведущий научный сотрудник лаборатории ревматических заболеваний у детей ФГБУ «НИИР им. В.А.НАСОНОВОЙ» РАМН, доктор мед.наук. E-mail: pafon1@yandex.ru
Федоров Евгений Станиславович – научный сотрудник лаборатории ревматических заболеваний у детей ФГБУ «НИИР им. В.А.НАСОНОВОЙ» РАМН, кандидат мед.наук. E-mail: evg2103@mail.ru
Похожие статьи
- Современное лечение ревматоидного артрита: рекомендации и реальная практика
- Перспективы анти-В-клеточной терапии системной красной волчанки
- Ритуксимаб в современной терапии ревматоидного артрита
- Применение ибупрофена при лечении воспалительных заболеваний суставов у детей
- Рациональное лечение ревматоидного артрита
Ревматоидный артрит у детей
Ювенильный ревматоидный артрит — это системное заболевание соединительной ткани, клинически проявляющееся прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу эрозивно- деструктивного полиартрита и сочетающееся у ряда больных выраженными внесуставными проявлениями.
Код протокола: H-P-015 «Ревматоидный артрит у детей»
Профиль: педиатрический
Этап: стационар
Код (коды) по МКБ-10:
М05 Серопозитивный ревматоидный артрит
М06 Другие ревматоидные артриты
М08 Юношеский (ювенильный) артрит
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
+7 938 489 4483 / +7 707 707 0716 / + 375 29 602 2356 / office@medelement.com
Мне интересно! Свяжитесь со мной
Классификация
Клинико-анатомическая характеристика:
1. Преимущественно суставная форма (с поражением или без поражения глаз):
— моноартрит;
— олигоартрит (2-3 сустава);
— полиартрит.
2. Суставно-висцеральная форма:
— с ограниченными висцеритами (поражение ретикулоэндотелиальной системы, сердца, сосудов, почек, легких, серозных оболочек, кожи, глаз, амилоидоз внутренних органов);
— синдром Стилла;
— аллергосептический синдром (Висслера-Фанкони).
3. Ревматоидный артрит в сочетании с:
— ревматизмом;
— диффузными заболеваниями соединительной ткани.
Клинико-иммунологическая характеристика:
1. Серопозитивный (ревматоидный фактор — положительный).
2. Серонегативный (ревматоидный фактор — отрицательный).
Течение болезни:
1. Быстро прогрессирующее.
2. Медленно прогрессирующее.
3. Без заметного прогрессирования.
Степень активности процесса:
— активность I, II, III степени;
Рентгенологическая стадия артрита:
I – околосуставной остеопороз, признаки выпота в полость сустава, уплотнение периартикулярных тканей, ускорение роста эпифиза пораженных суставов;
II – те же изменения, сужение суставной щели, единичные костные узуры;
III – распространенный остеопороз, выраженная костно-хрящевая деструкция, вывихи, подвывихи, системное нарушение роста костей;
IV- изменения, присущие 1-3 стадиям, и анкилозы.
Функциональная способность больного:
I – способность к самообслуживанию сохранена;
II — способность к самообслуживанию утрачена по состоянию опорно-двигательного аппарата:
а) сохранена;
б) частично утрачена;
в) полностью утрачена;
III – способность к самообслуживанию нарушена по состоянию глаз или внутренних органов.
Диагностика
Физикальное обследование:
1. Артрит продолжительностью 3 мес. и более.
2. Артрит второго сустава, возникший через 3 мес. и позже.
3. Симметричность поражения мелких суставов.
4. Контрактура.
5. Тендосиновит или бурсит.
6. Мышечная атрофия.
7. Утренняя скованность.
8. Ревматоидное поражение глаз.
9. Ревматоидные узелки.
10. Выпот в полости сустава.
Лабораторные исследования:
1. Положительный ревматоидный фактор.
2. Положительные данные биопсии синовиальной оболочки.
3. Общее количество положительных признаков при классическом ЮРА – 8 признаков, определенном ЮРА — 4 признака, при вероятном ЮРА – 3 признака.
Инструментальные исследования
Рентгенологические признаки:
— остеопороз, мелкокистозная перестройка костной структуры эпифиза;
— сужение суставных щелей, косные эрозии, анкилоз суставов;
— нарушение роста костей;
— поражение шейного отдела позвоночника.
Показания для консультации специалистов: по показаниям.
Перечень основных диагностических мероприятий:
1. Электрокардиография.
2. Эхокардиография.
3. Рентгенография грудной клетки (одна проекция).
4. Рентгенография пораженных суставов (если не проведено перед госпитализацией).
5. УЗИ органов брюшной полости.
6. Иммунограмма.
7. Определение С-реактивного белка.
8. Определение ревматоидного фактора.
9. Определение LE –клеток.
10. Определение общего белка и белковых фракций.
11. Общий анализ мочи.
12. Определение сиаловой пробы.
13. Определение тимоловой пробы.
14. Определение АЛТ.
15. Определение АСТ.
16. Определение билирубина.
17. Определение глюкозы.
18. Определение мочевины.
19. Определение креатинина.
20. Консультация офтальмолога.
Перечень дополнительных диагностических мероприятий:
1. Эзофагогастроскопия.
2. УЗИ суставов.
3. Суточное мониторирование ЭКГ по Холтеру.
4. Определение антител к нативной ДНК.
5. Коагулограмма.
6. Кровь на стерильность.
7. Анализ мочи по Аддису-Каковскому.
8. Анализ мочи по Зимницкому.
9. Суточная экскреция белка с мочой.
10. Суточная экскреция солей с мочой.
11. ПЦР исследование суставной жидкости.
12. Цитологическое исследование суставной жидкости, экссудатов и транссудатов.
13. Посев биологических жидкостей с отбором колоний.
14. Анализ чувствительности микробов к антибиотикам.
15. ИФА на вирусы, хламидии, микоплазмы.
16. ИФА на зоонозы.
17. ИФА на маркеры гепатита.
18. Миелограмма.
19. Биопсия на амилоидоз.
20. Магниторезонансная томография суставов.
21. Артроскопия с биопсией синовиальной оболочки.
22. Определение электролитов — калий,натрий.
23. Адгезия и агрегация тромбоцитов.
24. Определение лактатдегидрогеназы, креатинфосфокиназы.
25. Определение диастазы.
26. Определение холестерина.
27. Туберкулиновая проба.
28. Консультация хирурга – ортопеда.
29. Консультация фтизиатра (фтизиоостеолога).
Необходимый объем обследования перед плановой госпитализацией:
1. Общий анализ крови.
2. Консультация кардиоревматолога.
3. Рентгенография пораженных суставов.
Дифференциальный диагноз
Возраст к началу заболевания
Особенности телосложения
Утренняя скованность
Преимущественно в области пораженного сустава
Характер воспалительного процесса в дебюте
Преобладают экссудативные явления
Преобладают пролиферативные явления
Характер воспалительного процесса
Подкожные ревматоидные
Рентгенологические данные
Остеопороз, эрозии, остеолиз и
РФ в сыворотке крови и синовиальной жидкости
Биопсия синовии
Пролиферация кроющих клеток,
плазмоклеточная инфильтрация,
гиперплазия
Фиброзная или жировая дистрофия синовиальной оболочки
Синовиальная жидкость
Невоспалительного
Лечение
Цели лечения:
— снижение (купирование) активности процесса;
— нормализация температуры тела;
— регрессия островоспалительных изменений суставов, висцеральных изменений;
— снижение СОЭ;
— уменьшение утренней скованности;
— улучшение функциональной активности суставов.
Немедикаментозное лечение: создание лечебно-двигательного режима, полноценная диета.
Медикаментозное лечение:
1. Нестероидные противовоспалительные препараты:
— диклофенак калия* по 0,015-0,025- 0,05 г — 2 -3 раза в сутки;
— индометацин 2- 2,5-3 мг/кг/сут.;
— нимесулид 5 г/кг/сут.;
— ибупрофен* 30 — 40 мг/кг/сут.;
— напроксен 10-20 мг/кг/сут.
2. Глюкокортикостероиды:
— преднизолон* назначают в суточной дозе 1-2 мг на кг (20 — 30- 60 мг) до достижения терапевтического эффекта, как правило, в течение 2 -3 нед., с последующим снижением дозы (1,22- 2,5 мг каждые 5 – 7 дней) до поддерживающей дозы 12,5-15 мг в сутки — длительно.
3. Иммуносупрессивные препараты:
— при суставной нетяжелой форме назначается аминохинолиновые производные: хингамин* (хлорохин) 4 мг/кг/сут. (но не более 250 мг в сутки) – 1 раз в сутки (на ночь); гидроксихлорохин (плаквенил) в дозе 8 мг/кг/сут. (но не более 400 мг в сутки) – 1 раз в сутки (на ночь), курсом не менее 6 – 8 месяцев;
— при тяжелом течении суставно-висцеральной формы назначается иммуносупрессивная терапия: метотрексат* — препарат выбора- 2,5-5-7,5-10-15 мг в неделю, в зависимости от поверхности тела; азатиоприн* 1,5-2,0 мг/кг/сут., в 1-2 приема, циклоспорин А* 2,5-4 мг/кг/сут., в 2 приема, внутривенный человеческий иммуноглобулин — 0,4-0,5 г/кг на курс (трехкратное введение через день), циклофосфамид* 1,0-2,5 мг/кг/сутки.
4. При очень высокой активности суставно-висцеральной формы, аллергосептических вариантах прибегают к методам интенсивной терапии: экстракорпоральные методы лечения — гемосорбция, плазмоферез, пульс-терапия – метилпреднизолон* из расчета 20- 30 мг/кг однократно (1000 мг), циклофосфамид* по 1,0 гр. в/в 1 раз в сутки, в течение 3-х дней.
5. Локальная терапия:
— внутрисуставное введение бетаметазона дипропионат или водная суспензия триамцинолона ацетонида в мелкие суставы по 0,1-0,2 мл препараты, в более крупные — до 0,5-1,0 мл 1 раз в неделю, не более 2-3 пункций;
— аппликации (диметилсульфоксид 50% р-р, мази, содержащие нестероидные противовоспалительные препараты);
— при снижении активности процесса назначается физиолечение — электрофорез с преднизолоном* и диметилсульфоксидом, массаж, ЛФК.
6. Лечение и профилактика остеопороза:
— препараты кальция в сочетании с витамином Д3 – 0,5 — 2,0 гр. в сутки;
— оссеино-гидроксиапатитный комплекс 1-2 таб., 2 раза в день, ретаболил 5-20 мг в/м 1 раз в 2-3 недели.
7. Посиндромная терапия висцеритов (по показаниям):
— кардиотрофические препараты — рибоксин 0,4-0,8 г в сутки, кокарбоксилазы гидрохлорид 0,025 -0,05 -0,1 г в/м или в/в — 1 раз в день, карнитина хлорид 20% р-р, по 10-40 капель – 3 раза в день, милдронат по 0,25 г — 2 — 4 раза в день;
— диуретики — фуросемид* 1-3 мг/кг в день, спиронолактон* 3,3 мг/кг/сут., в 2-3 приема;
— гепатопротекторы — урсодезоксихолевая кислота* 10 мг/кг в сутки, эссенциале по 1- 2 капс. 3 раза в день.
8. Микроэлементы, витамины и препараты других групп:
— препараты калия (панангин, аспаркам) — 1-3 таблетки в сутки;
— аскорбиновая кислота* 0,05-0,250 г/сут.;
— токоферола ацетат* 50-100 мг/сут.;
— фолиевая кислота* по 0,001 г, 2-3 раза в день;
— комбинированный препарат, содержащий гидроокись алюминия и окись магния* — 2,0 — 5 мл, 4 раза в день;
— препараты для стимуляции функции надпочечников: этимизол по 0,1 г, 2-3 раза в день, глицирам 0,025-0,05 г, 2-3 раза в день.
9. Антикоагулянты, дезагреганты и препараты, улучшающие микроциркуляцию (по показаниям):
— гепарин натрия* 40 000-80 000 ЕД в сутки, 4 раза в день, в/в или п/к;
— дипиридамол 1,5-5 мг/кг/сут., в 2-3 приема;
— декстран* 10-15 мл/кг.
10. При обнаружении персистенции вирусов, хламидий, микоплазмы, при бактериальных и грибковых осложнениях — противовирусная и антибактериальная терапия по чувствительности:
— ацикловир* 0,1-0,2 г, 5 раз в день;
— индуктор эндогенного интерферона – циклоферон – 12,5% по 6-10 мг/кг/сут., в/м, через день;
— эритромицин* 0,4-1,0 г в сутки, в 4 приема;
— азитромицин*10 мг/кг, 1 раз в день, курсом 3 дня;
— спирамицин* 1,5-9,0 млн. МЕ в сутки;
— рокситоромицин 5 мг/кг/сут., в 2 приема — 10 дней;
— кларитромицин* 15/мг/кг/сут. в 2 приема — 10 дней;
— доксициклин* по 0,1 г/сут.;
— сульфаметоксазол + триметоприм* 30 мг/кг/сут. по сульфаметоксазону;
— ципрофлоксацин* 0,125-0,25 г – 2 раза в день;
— амоксициллин+клавулановая кислота* по 0,125-0,5 г — 3 раза в день;
— цефазолин* 20-50-100 мг/кг/сут.;
— цефтриаксон* 50-100 мг/кг/сут.;
— цефуроксим* 40 мг/кг/в сутки, дробно в 2 приема;
— цефтазидим* 1-6 г/сутки — 10 дней;
— метронидазол* 250-500 мг в сутки;
— флуконазол* 6-12 мг/кг/сут.
Профилактические мероприятия: систематическое обследование суставов.
Дальнейшее ведение: диспансерное наблюдение, в некоторых случаях направление на МСЭК.
Перечень основных медикаментов:
1. *Диклофенак калия 12,5 мг, 25 мг, 100 мг, 150 мг табл.; 75 мг/3 мл раствор для инъекций; 50 мг суппозитории ректальные, 100 мг мазь
2. *Ибупрофен 200 мг, 400 мг табл.
3. *Преднизолон 30 мг/мл раствор для инъекций; 5 мг табл.
4. *Хлорохин 100 мг, 150 мг табл.
5. *Азатиоприн 50 мг табл.
6. *Циклоспорин А 25 мг, 100 мг капс.
7. *Метилпреднизолон 4 мг таблетки; 40 мг, 125 мг, 250 мг, 500 мг порошок для приготовления инъекционного раствора
8. *Бетаметазона дипропионат 1 мл амп.
9. *Фуросемид 40 мг, табл.; 20 мг/2 мл, амп.
10. *Урсодезоксихолевая кислота 250 мг табл.
11. *Аскорбиновая кислота 50 мг, 100 мг, 500 мг табл.; 5%, 10% в ампуле 2 мл, 5 мл раствор для инъекций
12. *Токоферола ацетат 1 мл 5%, 10%, 30% масляный раствор в амп.; 50% 1 мл масляный раствор в капс.
13. *Декстран-60 200 мл, 400 мл во флаконе, раствор для инфузий
14. Ацикловир 200 мг, 800 мг табл.
15. *Эритромицин 250 мг, 500 мг, табл.; 250 мг/5 мл пероральная суспензия
16. *Азитромицин 125 мг, 500 мг табл.; 250 мг капс.; 200 мг/100 мл во флаконе, раствор для инфузий
17. *Сульфаметоксазол+ триметоприм 480 мг/5 мл амп.; 120 мг, 480 мг табл.
18. *Ципрофлоксацин 250 мг, 500 мг табл.
19. *Амоксициллин+клавулановая кислота таблетки, покрытые оболочкой 250 мг/125 мг, 500 мг/125 мг, порошок для приготовления суспензии для приема внутрь 125 мг/31,25 мг/5 мл, 200 мг/28,5 мг/5 мл, 400 мг/57 мг/5 мл
20. *Цефазолин 1000 мг порошок для приготовления инъекционного раствора
21. *Цефтриаксон 250 мг, 500 мг, 1 000 мг, во флаконе, порошок для приготовления инъекционного раствора
22. *Цефуроксим порошок для приготовления раствора для инъекций во флаконе 750 мг, 1.5 гр.
23. *Цефтазидим порошок для приготовления раствора для инъекций во флаконе 500 мг, 1 гр, 2 гр.
Перечень дополнительных медикаментов:
1. Индометацин 25 мг табл.
2. Напроксен мг, табл.
3. *Метотрексат 2,5 мг табл.
4. *Циклофосфамид драже 50 мг; 200 мг, 500 мг во флаконе, порошок для приготовления инъекционного раствора
5. Витамин Д3 10 мл раствор масляный; 10 мл раствор водный
6. Кокарбоксилазы гидрохлорид 50 мг, амп.
7. *Спиронолактон 25 мг; капсула 50 мг табл.
8. *Фолиевая кислота 1 мг табл.
9. *Гепарин натрия 5 000, 25 000 МЕ раствор натриевая соль для инъекций
10. Циклоферон – 12,5% 1000 мгамп.
11. *Спирамицин 1,5 млн ЕД, 375 тыс ЕД, 750 тыс ЕД гранулы для суспензии; 1,5 млн ЕД порошок для инфузий
12. *Кларитромицин 250 мг, 500 мг табл.
13. *Доксициклин 100 мг капс.
14. *Метронидазол 250 мг табл.; 0,5 мг/100 мл во флаконе раствор для инфузий
15. *Флуконазол 50 мг, 150 мг капс.; 100 мл раствор во флаконе для в/в введения
Индикаторы эффективности лечения: снижение активации воспалительного процесса.
Ювенильный ревматоидный артрит — симптомы и лечение
Что такое ювенильный ревматоидный артрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чуриловой Веры Олеговны, детского ревматолога со стажем в 17 лет.
Над статьей доктора Чуриловой Веры Олеговны работали литературный редактор Вера Васина , научный редактор Елена Беляева и шеф-редактор Маргарита Тихонова

Детский ревматолог Cтаж — 17 лет Кандидат наук
Медицинский центр «Здоровая Семья»
Городская поликлиника №1 на Серебренниковской
Дата публикации 22 января 2023 Обновлено 28 февраля 2023
Определение болезни. Причины заболевания
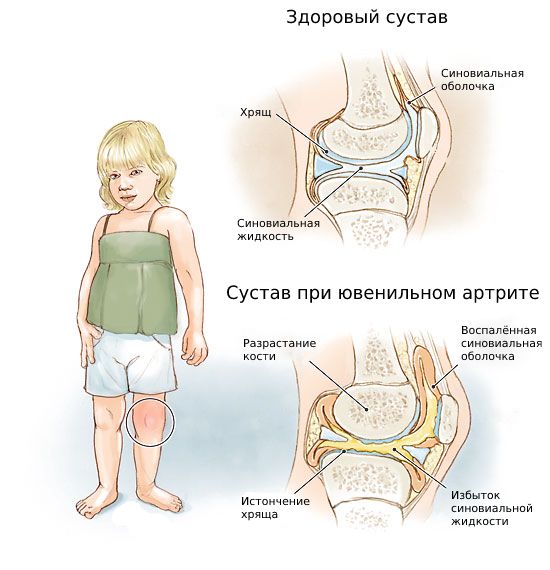
Ювенильный артрит (Juvenile arthritis) — это поражение одного или нескольких суставов, которое развивается у детей до 16 лет по неустановленной причине и длится больше 6 недель [1] .
Заболевание проявляется припухлостью, болью, ограничением подвижности и увеличением окружности сустава. C возрастом болезнь прогрессирует, приводит к разрушению сустава и формированию контрактур (ограничению пассивных движений в суставе, из-за чего руку или ногу не получается полностью согнуть или разогнуть) [2] [4] .
Некоторые врачи ещё используют такие термины, как «ювенильный ревматоидный артрит» и «ювенильный хронический артрит», но эти формулировки постепенно отходят на второй план и считаются устаревшими. Согласно общепринятой классификации Международной лиги антиревматических ассоциаций (ILAR), с 2007 года принято название «Ювенильный идиопатический артрит (ЮИА)» [11] .
Распространённость ювенильного артрита
Ювенильный идиопатический артрит — одно из самых частых и инвалидизирующих ревматических заболеваний, встречающихся у детей. Его выявляют у 16–150 детей на 100 тыс., чаще у девочек. Смертность от ЮИА составляет 0,5–1 % [1] [2] .
По сути ювенильный идиопатический артрит — это группа заболеваний весьма разнородных по причинам развития и клинической картине.
Выделяют семь подтипов ЮИА:
- системный артрит;
- олигоартрит;
- RF-отрицательный полиартрит;
- RF-положительный полиартрит;
- псориатический артрит;
- энтезит-ассоциированный артрит;
- недифференцированный артрит.
Олигоартрит является самым распространённым подтипом, на него приходится примерно половина всех случаев, на полиартрит — 30–35 %, на системный артрит — 10–20 %, на псориатический артрит — 2–15 %, на энтезит-ассоциированный артрит — 1–7 % [21] .
Причины ювенильного артрита
Причины ювенильного идиопатического артрита до конца не известны, единой теории его происхождения не существует. За более 100 лет исследований учёными были выявлены многочисленные этиологические факторы, разработаны теории происхождения заболевания, однако ни одна из них полностью не доказана.
Известно, что ЮИА возникает под влиянием факторов внешней среды на генетически восприимчивых детей, что приводит к нарушению взаимодействия врождённой и приобретённой иммунной системы [22] .
Предрасполагающими факторами являются:
- Семейная предрасположенность — генетические нарушения, причём как связанные, так и не связанные с системой HLA (важной частью иммунной системы).
- Факторы внешней среды — вирусные (вирус Эпштейна — Барр, краснухи, гепатита В, парвовирус В) и бактериальные инфекции (S. pyogenes, B. henselae, M. pneumoniae, C. pneumonia, а также перенесённая стрептококковая инфекция), травма, вакцинация, чаще «живыми» вакцинами, постоянное воздействие прямых солнечных лучей, острая кишечная инфекция, например сальмонеллёз и дизентерия[13] .
Когда предрасположенность связана с системой HLA, то речь идёт о нарушении в комплексе генов, контролирующих иммунный ответ и взаимодействие клеток, которые его реализуют. Существуют HLA-аллели, ассоциированные с различными подтипами ЮИА, например выявлена предрасположенность к развитию в раннем детстве:
- олигоартрита у носителей генов HLA-A2, DRB108, DRB111, HLA-DR5, HLA-DR8;
- полиартрита — HLA-DW4, HLA-DR1, HLADR4;
- спондилоартрита — HLA-B27.
Также выявлена связь ЮИА с 33 генами за пределами области HLA [21] . Такая генетическая предрасположенность играет ключевую роль в появлении воспалительной реакции, которая приводит к повреждению тканей. Она связана с генами, кодирующими такие звенья иммунной системы, как цитокины TNF, ИЛ-2, ИЛ-10, ИЛ-6, фактор ингибирования миграции макрофагов (MIF), протеин-тирозинфосфатаза (PTPN22), преобразователь сигнала и активатор транскрипции-4 (STAT4) [12] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы ювенильного ревматоидного артрита
В зависимости от формы заболевания в начале болезни может возникать поражение от одного до нескольких суставов, ограничение движений в них, припухлость и боль. При поражении мелких суставов кистей и стоп часто возникает скованность по утрам — ребёнку сложно выполнять элементарные бытовые действия, например есть ложкой, чистить зубы, застёгивать пуговицы и завязывать шнурки.
Общие симптомы ювениального артрита:
- боль и припухлость в области поражённого сустава или суставов;
- увеличение сустава в объёме;
- ограничение подвижности в суставах;
- формирование вынужденного согнутого или разогнутого положения сустава — сгибательной или разгибательной контрактуры;
- при некоторых вариантах течения может повышаться температура тела — так, системный артрит протекает со стойкой фебрильной лихорадкой (38–39 °С), а RF-положительный полиартрит — с субфебрильной температурой (37,1—38,0 °C);
- снижение массы тела;
- хромота из-за поражения суставов ног.
![Припухлость и увеличение сустава в объеме при ЮИА [23]](https://probolezny.ru/media/bolezny/yuvenilnyy-revmatoidnyy-artrit/pripuhlost-i-uvelichenie-sustava-v-obeme-pri-yuia-23_s.jpeg)
Варианты клинических проявлений разнообразны и варьируются от лёгкого поражения одного сустава до тяжёлого артрита с поражением многих суставов, из-за чего ребёнок может стать инвалидом.
Симптомы ЮИА и ревматоидного артрита у взрослых существенно отличаются. Боль при ЮИА, как правило, возникает исключительно в крайних положениях сустава и при активных, и при пассивных движениях; в покое дети на боль в суставах не жалуются. Также для ЮИА не характерно сильное ограничение движений в суставах в начале заболевания. Классическим проявлением хронического воспаления при ЮИА является утренняя скованность — кратковременная хромота с онемением и болезненностью в одном или нескольких суставах [22] .
Патогенез ювенильного ревматоидного артрита
Механизм развития ювенильного идиопатического артрита сложен и многогранен.
Основные этапы развития болезни:
- Чужеродный агент перерабатывается специальными клетками, далее происходит презентация антигена на Т-лимфоциты, т. е. антигенпрезентирующие клетки как бы разоблачают чужеродное вещество и передают его защитным клеткам организма — Т-лимфоцитам.
- Антигенпрезентирующая клетка взаимодействует с CD4+-лимфоцитами. В результате эти клетки вырабатывают цитокины, которые направляют иммунитет бороться с обнаруженным чужеродным агентом. Интерлейкин-2 (ИЛ-2), вырабатывающийся при активации цитокинов Th1, взаимодействует со специфическими ИЛ-2 рецепторами на иммунных клетках, что повышает количество Т-лимфоцитов и стимулирует рост В-лимфоцитов. В-лимфоциты запускают выработку антител — иммуноглобулинов (Ig) — и запоминают антиген. За счёт этого при следующем контакте с чужеродным агентом организм быстрее запускает иммунный ответ.
- Массовый синтез IgG активирует натуральных киллеров (NК), уничтожающих поражённые клетки и макрофаги, которые захватывают и перерабатывают остатки погибших клеток и других чужеродных, токсичных для организма частиц.
- Синтезируются провоспалительные цитокины ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-17, фактор некроза опухоли α (ФНО-α) и др. Они запускают и поддерживают системное аутоиммунное воспаление.
- Запускается избыточная выработка разрушительных ферментов (металлопротеиназ, коллагеназ и аггреканаз), что способствует повреждению синовиальной оболочки и хряща и формированию эрозивно-деструктивных изменений в суставе [8] .
Активность В-лимфоцитов, описанная во втором пункте, может стать аномальной и спровоцировать развитие аутоиммунной реакции, при которой организм будет принимать свои клетки, в данном случае клетки суставов, за чужеродные и атаковать их.
В патогенезе всех вариантов ЮИА центральную роль играет активация иммунной системы, продукция провоспалительных цитокинов активированными Т-лимфоцитами и макрофагами и развитие хронического воспаления. Но механизмы активации иммунного ответа при разных субтипах ЮИА будут отличаться.
Так, системный ювенильный идиопатический артрит (сЮИА) сейчас рассматривают в большей степени не как аутоиммунное, а как аутовоспалительное заболевание. В развитии сЮИА ведущую роль играет активация врождённого иммунитета. При этом не выявляются аутоантитела и эффекторные клетки (макрофаги и нейтрофилы). Эффекторными клетками, в отличие от регуляторных, называют клетки, непосредственно выполняющие задачи иммунитета: обнаружение, распознавание и уничтожение патогенов.
Внесуставные проявления, такие как лихорадка, сыпь, увеличение количества тромбоцитов , анемия, остеопороз, а также синтез острофазовых белков (СРБ и амилоида), при системном артрите связывают с избыточной выработкой интерлейкинов ИЛ-6 и ИЛ-1.
При других вариантах ЮИА активируется приобретённый иммунитет. Ведущую роль в развитии клинических симптомов при ЮИА без системных проявлений (синовита, разрушения хрящевой и костной ткани) играет фактор некроза опухоли и синтез аутоантител. Аутоантитела наиболее часто выявляют при олигоартикулярном ЮИА (антинуклеарный фактор, АНФ) и полиартикулярном RF-позитивном ЮИА (ревматоидный фактор класса IgM, антитела к циклическому цитруллиновому пептиду). Это свидетельствует о том, что активация гуморального иммунитета является центральным звеном в патогенезе этих форм заболевания.
При энтезит-ассоциированном и псориатическом артрите выработка аутоантител не выражена, но наблюдается сильная ассоциация с HLA [14] .
Классификация и стадии развития ювенильного ревматоидного артрита
Согласно классификации ILAR 2007 года, выделяют семь форм ЮИА:
- олигоартрит;
- RF-отрицательный полиартрит;
- RF-положительный полиартрит;
- псориатический артрит;
- энтезит-ассоциированный артрит;
- системный артрит;
- недифференцированный артрит.
Олигоартикулярный артрит
Олигоартикулярный артрит (олигоартрит, пауциартикулярный ювенильный артрит) — артрит с поражением 1–4 суставов. На его долю приходится 50 % всех случаев ЮИА. Развивается в основном у детей 1–5 лет, чаще в 3 года. Как правило, начинается остро. Чаще, в 85 % случаев, болеют девочки [14] .
Особенностью олигоартикулярного артрита является поражение коленных, тазобедренных и голеностопных суставов, которое развивается в первые шесть месяцев болезни. У половины пациентов в дебюте заболевания поражается коленный сустав. За несколько лет до этого может развиться передний увеит, чаще у девочек. Поначалу он протекает бессимптомно. Его обнаруживают только при снижении зрения и образовании катаракты [14] .
Основные жалобы ребёнка при олигоартикулярном артрите:
- Боль, припухлость и ограничение движения в поражённом суставе.
- Болезненная скованность по утрам, из-за которой ребёнок не может выполнить простые бытовые действия, например встать с кровати — ему нужно время, чтобы расходиться. В редких случаях становится сложно чистить зубы, пользоваться столовыми приборами. Такая скованность может длиться несколько минут или часов и сильно мешает ребёнку.
- Изменение походки — быстрый перенос веса с больной ноги на здоровую из-за поражения основных суставов ног. Ребёнок встаёт сразу на всю стопу или носок либо ходит «утиной», переваливающейся походкой.
RF-отрицательный полиартрит
При RF-отрицательном полиартрите в крови не повышен уровень ревматоидного фактора. Ревматоидный фактор (ревмофактор, РФ) — это антитела IgM, т. е. белки иммунной системы. Они атакуют собственные ткани организма, принимая их за чужеродные. Ревматоидный фактор может повышаться не только при аутоиммунном заболевании, но и при других патологических процессах в организме, например инфекциях, сепсисе и некоторых онкологических заболеваниях [12] .
RF-отрицательный полиартрит составляет меньше 20–30 % всех случаев ЮИА. Развивается у детей в возрасте от года до 15 лет. В 90 % случаев болеют девочки [14] .
Болезнь может начаться остро, но в основном протекает постепенно, с поражением всё новых суставов. Они опухают, иногда становятся тёплыми на ощупь, но цвет кожи над ними не меняется. Мелкие суставы рук и ног могут поражаться как на ранних, так и на поздних стадиях болезни. Также в начале заболевания может развиться увеит.
При серонегативном полиартрите дети жалуются:
- на боль и ограничение движения в поражённых суставах;
- скованность по утрам или в течение всего дня.
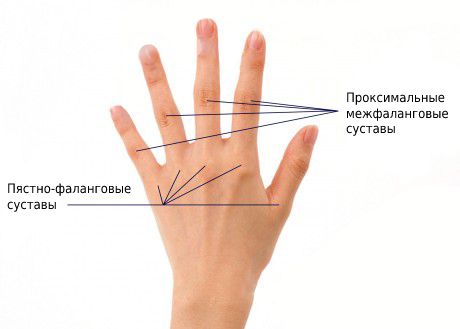
Наиболее часто при RF-отрицательном полиартрите ассиметрично поражаются коленные, лучезапястные, голеностопные и мелкие суставы кистей и стоп. Чаще всего поражаются 2 и 3-й пястно-фаланговые и проксимальные межфаланговые суставы. У 20 % пациентов в начале болезни развивается коксит, при котором нарушается подвижность тазобедренного сустава [14] .
Также может развиться поражение височно-нижнечелюстного сустава, при этом формируется «птичья челюсть». Ребёнку при этом трудно широко открыть рот, возникает боль в проекции сустава, а при ощупывании чувствуется припухлость.
Также при этой форме ЮИА могут ослабляться и уменьшаться мышцы, возникать задержка роста (особенно при раннем начале и выраженной болезни), увеличиваться лимфоузлы и повышаться температура до 37,1–38,0 °C.
У некоторых пациентов болезнь проявляется только скованностью в движениях и лабораторными признаками воспаления. Такое состояние называют сухим синовитом.
RF-положительный полиартрит
При RF-положительном полиартрите повышен уровень ревматоидного фактора. На долю такого артрита приходится 3–10 % всех случаев ЮИА. Он развивается в возрасте от 8 до 15 лет, в 80 % случаев болеют девочки [14] .
Заболевание может начаться остро, но, как правило, развивается постепенно, с поражением новых суставов.
Основные симптомы RF-положительного полиартрита :
- Поражаются крупные и мелкие суставы рук и ног, суставы челюсти и шеи. Как правило, поражение симметричное.
- В области поражённых суставов возникает боль, припухлость и ограничение движения.
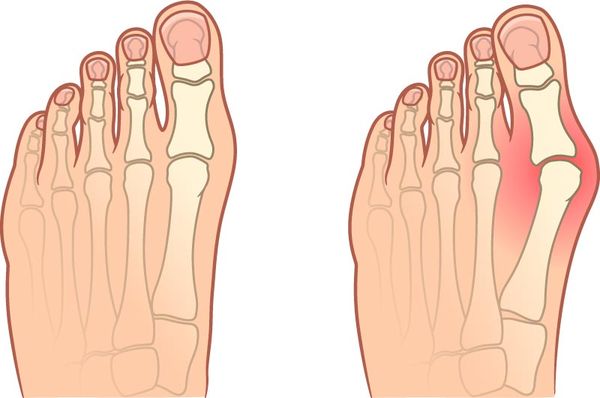
- Быстро нарушается форма и структура сустава, например деформируются пальцы рук по типу «шеи лебедя» и «бутоньерки», окружающие ткани отекают, появляется выпот.
![Деформация по типу «шеи лебедя» [26]](https://probolezny.ru/media/bolezny/yuvenilnyy-revmatoidnyy-artrit/deformaciya-po-tipu-_shei-lebedya_-26_s_ehWpKOO.jpeg)
- Могут деформироваться стопы и пальцы ног, например развивается вальгусная деформация большого пальца или молотообразное искривление пальцев.
При таком артрите может возникать слабость, потеря веса и повышение температуры тела до 38 °C [1] [5] . Наиболее частыми внесуставными проявлениями являются ревматоидные узелки, которые могут возникать, например, на локтях. Узелки плотные, подвижные и безболезненные, но надавливание может вызвать боль. В первый год болезни они появляются у 30 % пациентов.
В редких случаях развивается васкулит и синдром Фелти, что проявляется пониженным уровнем нейтрофилов и увеличенной селезёнкой . Также может возникать недостаточность аортального клапана. Симптомы обычно появляются через 4–17 лет после начала болезни.
Также может развиться поражение лёгких. Симптомы обычно появляются через 10–20 лет после начала заболевания и включают: учащённое поверхностное дыхание, одышку, кашель без мокроты и лихорадку.
Псориатический артрит
Ювениальный псориатрический артрит (ЮПсА) — это хроническое системное прогрессирующее заболевание.
Оно протекает с артритом и псориазом или артритом в сочетании хотя бы с двумя из следующих симптомов:
- Дактилитом — воспаление одного или нескольких пальцев, которое сопровождается болью, посинением кожи и плотным отёком, но может протекать и бессимптомно. Дактилит развивается у 20–40 % детей с ЮПсА.
- Изменением ногтей — вдавлением, отслоением ногтя, горизонтальными выступами и изменением цвета. По изменениям ногтей ЮПсА можно отличить от псориаза без поражения суставов.
- Псориазом у родителей, братьев или сестёр.
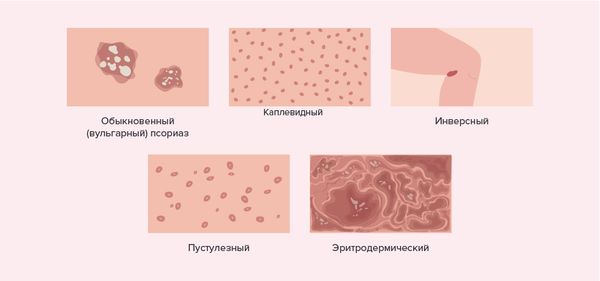
У большинства пациентов с ЮПсА наблюдается классический псориаз, у 40–60 % из них он выраженный, реже — каплевидный, редко — пустулёзный и эритродермальный.
Псориаз у детей трудно диагностировать: он проявляется тонкими мягкими бляшками, которые периодически появляются и исчезают. Поражение кожи может быть ограничено волосистой частью головы, областью пупка, заушными областями или межъягодичной складкой.
Также заболевание может проявляться энтезитом — воспалением участка сухожилия, крепящегося к костям. У пациентов с дебютом ЮПсА в старшем возрасте энтезиты развиваются чаще, чем у детей помладше.
К внесуставным проявлениям относятся анорексия, анемия и отставание в росте. Также может воспаляться тонкий и толстый кишечник (энтерит и колит). У 10–15 % детей с ЮПсА развивается хронический увеит.
Приблизительно у 80 % детей заболевание начинается как олигоартрит (воспаление 2–3 суставов). В дебюте часто развивается поражение одного сустава, чаще коленного и голеностопного. Полиартрит в начале болезни возникает только у 20 % детей, но без лечения со временем он развивается у большинства пациентов.
У 10–30 % пациентов с ЮпсА, преимущественно с дебютом заболевания в старшем возрасте, развивается поражение позвоночника — сакроилеит [14] .
Энтезит-ассоциированный артрит
На энтезит-ассоциированный артрит приходится 1–7 % случаев ЮИА. При этой форме артрита возникает асимметричное поражение суставов ног и воспаляются места прикрепления связок, сухожилий и фасций к костям.
Воспаление проявляется сильной болью и выраженным нарушением работы суставов. При первых симптомах дети плохо понимают, где именно болит, и могут жаловаться на боль в ягодицах, бёдрах, пятках, области паха и вокруг плечевых суставов. Боль может спонтанно проходить, поэтому на ранних стадиях трудно поставить диагноз.
Для энтезит-ассоциированного артрита характерно воспаление одного или обоих коленных суставов, голеностопных суставов, мелких суставов стоп и пальцев ног, например сустава большого пальца с вальгусной деформацией. Может развиваться тарзит, что сопровождается болью, скованностью и нарушением походки.
Также часто поражены и болят плечевые, челюстно-височные и грудинно-ключичные суставы, редко — тазобедренные, крайне редко — мелкие суставы кистей рук. Примерно у каждого четвёртого ребёнка возникает боль, скованность или ограничение движений в районе поясницы, крестца и нижних боковых частей живота (подвздошной области).
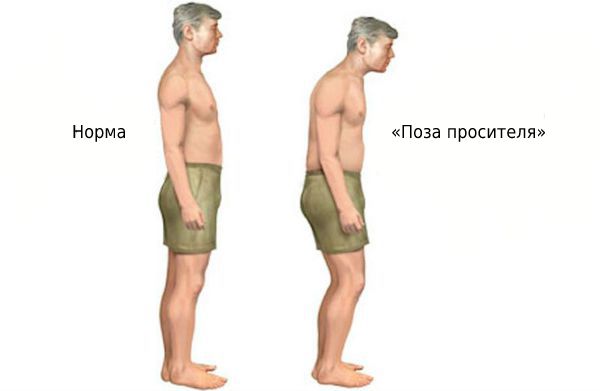
В зрелом возрасте может поражаться осевой скелет. На поздних стадиях болезни развивается «поза просителя».
К внесуставным проявлениям относится увеит, обычно односторонний, острый, с рецидивами. Он проявляется покраснением глаз, болью, светобоязнью и слезотечением.
Поражения сердца, сосудов, лёгких, почек и нервной системы у детей с энтезит-ассоциированным артритом встречаются редко. Большинство из этих проявлений развиваются после многих лет болезни. Общие проявления, как правило, минимальны и включают слабость, нарушение сна, температуру 37,1–38 °С.
Системный артрит
Системный артрит (сЮИА) составляет 10–20 % от всех ЮИА [14] .
- развивается в любом возрасте;
- мальчики и девочки болеют одинаково часто;
- начинается остро или подостро;
- протекает с температурой 38–39 °С; температура поднимается в основном по утрам и сопровождается ознобом, а её снижение — проливным потом;
- возникает сыпь, которая быстро появляется и исчезает, усиливается на пике лихорадки, возникает в основном в области суставов, на лице, боках, ягодицах, руках и ногах.
При сЮИА может возникать множественное поражение суставов, боль и слабость в мышцах, потеря мышечной массы, контрактуры. Также могут развиваться нарушения и других органов: сердца, лёгких, воспаление сосудов и серозных оболочек (например, перикардит и плеврит). Могут увеличиться лимфоузлы, печень и селезёнка.
Основными осложнениями сЮИА являются сердечно-лёгочная недостаточность и синдром активации макрофагов — опасное для жизни состояние, проявляющееся нарушениями крови, работы печени и нервной системы.
Недифференцированный артрит
Недифференцированный артрит — это воспаление суставов, которое полностью не соответствует ни одному из описанных видов или, наоборот, похоже одновременно на несколько из них [6] .
Осложнения ювенильного ревматоидного артрита
К возможным осложнениям ювенильного артрита относятся:
- Ревматоидные узелки — встречаются у 5–12 % пациентов, чаще при RF-положительный полиартрит. Наличие таких узелков говорит о неблагоприятном прогнозе [16] .
- Поражение глаз — встречается у 8–10 % детей, чаще сопровождает олигоартрит , более распространено у девочек [17] . В некоторых случаях поражение суставов несколько запаздывает и сперва возникает поражение глаз. Специфическим проявлением ЮИА является развитие у детей младшего возраста иридоциклита, лентовидной дистрофии роговицы и катаракты.
- Поражение сердца — при суставной форме, как правило, протекает в форме бради-, тахикардии и систолического шума на верхушке. Если суставная форма сочетается с поражением внутренних органов, чаще при системном ювенильном артрите, может развиваться миокардит и перикардит, утяжеляющие течение болезни.
- Поражение почек — грозное осложнение ювенильного ревматоидного артрита. Проявляется отёками, в том числе отёком век по утрам, в некоторых случаях повышением артериального давления. Может возникать гломерулонефрит, межуточный нефрит и амилоидоз — накопление нерастворимого белка-амилоида, наиболее грозное осложнение ЮИА, так как оно затрагивает практически весь организм и сказывается на работе внутренних органов.
- Задержка роста (наиболее выражена, если ребёнок заболел до 5 лет).
- Ревматоидная сыпь — умеренно выраженное воспаление сосудов с немногочисленными воспалительными клетками, окружающими мелкие сосуды в тканях под эпителием .
- Асептический некроз. Осложнение может привести к эрозии костной ткани, сужению суставного пространства, разрушению и сращиванию костей, деформациям, подвывихам или ограничению подвижности в суставах. Чаще всего поражается тазобедренный сустав, что проявляется болью и выраженными нарушениями ходьбы, и может потребовать эндопротезирования даже в детском возрасте. Применение Метотрексата и других препаратов улучшило прогноз заболевания, но разрушение суставов, в первую очередь тазобедренных, всё же встречается [18] .
- Костно-суставные осложнения — формирование контрактур, ограничение активности в суставах [3] (при серопозитивном полиартипулярном варианте — это скорее симптом, а при моноартикулярном серонегативном варианте — осложнение), вторичный коксартроз и гонартроз [7] . Ювенильный остеопороз может возникнуть как следствие основного заболевания, так и в результате терапии — как побочный эффект приёма глюкокортикостероидов и иммуносупрессивных препаратов.
Диагностика ювенильного ревматоидного артрита
Диагноз «ювенильный идиопатический артрит» является диагнозом исключения. Ребёнка сперва обследует педиатр, и если суставной синдром длится больше 6 недель, то его направляют на консультацию к врачу-ревматологу, желательно детскому.
Опрос и осмотр
При опросе врач спросит о ревматологических заболеваниях в семье, перенесённых ребёнком инфекционных болезнях и вакцинации. Если есть документы о диагностированных заболеваниях и других результатах обследований, можно показать их врачу напрямую или открыть доступ к своей электронной медкарте .
Осмотр включает ощупывание 28 суставов, периферических лимфоузлов и живота, выслушивание лёгких и сердца.
Лабораторная диагностика
- Общий анализ крови — позволяет выявить анемию, которая часто встречается при ювениальном артрите.
- Биохимический анализ крови — позволяет определить активность воспаления.
- Коагулограмма при активном воспалении — повышен уровень общего фибриногена. Развёрнутая коагулограмма рекомендована при системном ювенильном артрите.
- Иммунологический и иммуногенетический анализ крови — показан всем пациентам, чтобы установить диагноз, определить подтип ювениального артрита и исключить другие ревматические болезни. Определяют уровень IgG и IgM, С-реактивный белок, антинуклеарный (количественный) и ревматоидный фактор.
- Анализ крови на АЦЦП (антитела к циклическому цитруллинсодержащему пептиду) — выявляют только у пациентов с полиартритом в дебюте заболевания. АЦЦП обнаруживаются у 57–90 % пациентов с RF-позитивным полиартритом и у 17 % с RF-негативным полиартритом [1] . Как и у взрослых, АЦЦП ассоциируются с HLA-DR4 антигеном и развитием эрозий.
- Анализ крови на антитела к двуспиральной ДНК, ANCA, SLc70; HLA-B27 — при ювениальном артрите эти анализы отрицательные.
- Общий анализ мочи — позволяет оценить работу почек.
- Проба Манту илиДиаскинтест — тест для исключения туберкулёзной инфекции [1][4] .
Инструментальная диагностика
- Комплексное ультразвуковое исследование (УЗИ) внутренних органов — показано всем пациентам.
- Эхокардиография (ЭхоКГ) и электрокардиография (ЭКГ).
- УЗИ поражённых суставов.
- Рентген или компьютерная томография (КТ) поражённых суставов. Рентген необходим, чтобы уточнить диагноз при первом обращении с жалобами на боль и припухлость в области суставов. Также его проводят при диспансерном наблюдении детей с ювенильным артритом. КТ позволяет определить, где именно поражён сустав.
Консультации других специалистов
Могут потребоваться консультации:
- офтальмолога;
- гематолога и онколога;
- травматолога-ортопеда — для исключения ортопедической патологии;
- ЛОРа — для исключения и лечения очагов хронической инфекции;
- фтизиатра — при положительных туберкулиновых пробах, очаговых, инфильтративных изменениях в лёгких и деструктивных изменениях в костях, чтобы исключить туберкулёз лёгких, костей и суставов [1][4] .
Дифференциальная диагностика
Ювениальный идиопатический артрит следует отличать:
- от реактивного и септического артрита;
- поражения суставов при туберкулёзе;
- остеохондропатии;
- острой ревматической лихорадки;
- хронического мультифокального остеомиелита;
- травмы;
- болезни Пертеса;
- доброкачественных опухолей мягких тканей;
- злокачественных новообразований;
- лейкозов;
- диффузных заболеваний соединительной ткани (ювенильного дерматомиозита, ювенильного полимиозита, системной красной волчанки);
- геморрагического васкулита;
- болезни Лайма;
- болезни Кавасаки[1] .
Лечение ювенильного ревматоидного артрита
Основные цели лечения: достичь ремиссии, уменьшить побочные эффекты терапии, предотвратить или замедлить разрушение суставов, улучшить качество жизни ребёнка и его семьи.
Немедикаментозное лечение
В период обострения нужно ограничить движение в поражённых суставах, но категорически противопоказана полная неподвижность суставов, так как она приводит к атрофии мышц и формированию контрактур [4] [10] . Поэтому важно, чтобы ребёнок двигался и делал это правильно. Чтобы помочь ему сформировать правильные стереотипы движений, нужно проводить лечебную физкультуру (ЛФК) и соблюдать все рекомендации специалистов.
Лечебная физкультура — это важнейший элемент лечения ювенильного идиопатического артрита. Необходимо ежедневно выполнять упражнения, чтобы увеличить объём движения в суставах. Регулярные занятия ЛФК не дают сформироваться контрактурам, помогают сохранить и увеличить мышечную массу, предупреждают развитие вторичного остеопороза. Лечебную физкультуру проводят с учётом индивидуальных возможностей пациента на каждом этапе развития заболевания.
При формировании у ребёнка асептического некроза головки бедренной кости и в период активного воспаления тазобедренного сустава (коксита) нельзя передвигаться без костылей [1] .
Также важно, чтобы ребёнку было удобно спать — матрас должен быть не слишком мягким и не слишком жёстким. Если ЮИА затронул ноги, то обязательно нужно носить ортопедическую обувь с жёстким задником [24] .
Медикаментозное лечение
В период уточнения диагноза и при болевом синдроме всем пациентам рекомендован приём нестероидных противовоспалительных препаратов (НПВС).
На любом этапе болезни при наличии показаний в качестве сопутствующей терапии может быть назначено внутрисуставное введение глюкокортикостероидов (ГКС). В период обострения не рекомендуется применять препараты чаще одного раза в четыре месяца.
При подтверждении диагноза рекомендован приём иммуносупрессивной терапии: Метотрексата, Лефлуномида.
При неэффективности лечения этими лекарствами показана терапия генно-инженерными биологическими препаратами (ГИБП):
- ингибиторами фактора некроза опухоли альфа (Адалимумабом, Голимумабом, Этанерцептом);
- ингибиторами интелейкина-6 (Тоцилизумабом);
- блокатором ко-стимуляции Т-лимфоцитов (Абатацептом);
- таргетными синтетическими препаратами — ингибитором JAK-киназ (Тофацитинибом) [1][2] ; в инструкции указано, что препарат нельзя применять до 18 лет, но в 2019 году были опубликованы результаты клинических исследований о возможности применения Тофацитиниба у пациентов с ЮИА [25] .
Прогноз. Профилактика
У каждой формы ЮИА свой прогноз и факторы риска, которые могут на него повлиять.
Олигоартикулярный артрит иногда приводит к полиартирту, но в 40 % случаев лечение заканчивается ремиссией. При длительной болезни после ремиссии может развиться остеоартрит — повреждение хрящей и окружающих тканей . Также может развиться увеит, который приводит к слепоте у 10 % пациентов [14] .
Признаки неблагоприятного прогноза:
- поражение тазобедренных, голеностопных, лучезапястных суставов и суставов шеи;
- выраженная или длительная активность болезни по анализам;
- эрозии суставов или сужение межсуставных щелей.
RF-отрицательный полиартрит протекает относительно благоприятно, но если болезнь началась рано, то пациенты могут стать инвалидами из-за серьёзного поражения тазобедренных суставов. Тяжёлое поражение суставов, в основном в тазобедренных и челюстно-височных, развивается у 10 % детей [14] .
RF-положительный полиартрит часто приводит к тяжёлому деструктивному артриту, ребёнок может стать инвалидом по состоянию опорно-двигательного аппарата. Ремиссии возникают реже, чем при других вариантах ЮИА, но при своевременной адекватной терапии их частота составляет до 65 % [14] .
Признаки неблагоприятного прогноза:
- наличие ревматоидных узелков;
- поражение тазобедренных суставов;
- положительный РФ или наличие АЦЦП.
Псориатический артрит. Через 5 лет наблюдения у 70 % больных сохраняется активность болезни, у 30 % нарушается подвижность суставов. Со временем она ухудшается сильнее, чем у детей с олиго- и полиартритом. Примерно каждый третий пациент нуждается в лечении иммунодепрессантами [14] .
Признаки неблагоприятного прогноза такие же, как при олигоартикулярном артрите, но достаточно хотя бы одного критерия.
Ювенильный артрит с энтезитом. При начале заболевания в возрасте до 5 лет часто возникают ремиссии, у половины из этих пациентов поражено четыре и менее суставов. Ограничение подвижности в суставах и позвоночнике, как правило, не прогрессирует. Плохими прогностическими признаками являются поражение тазобедренных суставов, эрозии суставных поверхностей или сужение межсуставных щелей.
Профилактика ювениального артрита
Специфическая и первичная профилактика не разработаны, так как точные причины заболевания неизвестны. Вторичная профилактика включает диспансерное наблюдение и профилактику обострений:
- врача-ревматолога нужно посещать раз в три месяца, врача-офтальмолога при отсутствии увеита — раз в шесть месяцев, при неактивном увеите — раз в три месяца;
- длительно принимать поддерживающую терапию;
- контролировать безопасность иммуносупрессивной терапии — делать рентген грудной клетки, анализ на ВГВ и ВГС, Диаскинтест раз в полгода; при необходимости показана консультация фтизиатра;
- поддерживать приверженность к терапии пациентов и членов их семей: детям сложно самим следовать назначенному лечению, поэтому им нужна помощь и поддержка родителей (например, можно вместе заниматься лечебной физкультурой и напоминать о приёме лекарств);
- своевременно корректировать лечение — на необходимость этого могут указывать частые обострения и формирование осложнений;
- оберегать ребёнка от психоэмоционального стресса, вместе с учителем помочь ему влиться в коллектив учеников, участвовать во всех школьных мероприятиях, при необходимости учиться по индивидуальному плану;
- избегать постоянного воздействия прямых солнечных лучей;
- вакцинироваться по индивидуальному календарю, который предоставит врач после подтверждения диагноза [1] .
В 1966 году выдающийся детский ревматолог Эрик Джордж Лэпторн Байуотерс сформулировал основную черту ювенильного артрита: «Каждый ребёнок страдает собственной болезнью» [9] . Ювенильный артрит многогранен и сложен для лечения. Для достижения стойкой ремиссии и предотвращения осложнений необходимо наблюдаться у врача-ревматолога.
Список литературы
- Союз педиатров России. Юношеский артрит: национальные рекомендации. — М., 2017.
- Валиева С. И., Глазырина А. А., Кулешов Н. Н. и др. Возможна ли ремиссия при ювенильном идиопатическом артрите без применения генно-инженерных биологических препаратов? // Современная ревматология. — 2019. — № 3. — С. 45–50.
- Макарова Т. П., Сенек С. А. Ювенильный ревматоидный артрит: современные аспекты // Казанский медицинский журнал. — 2004. — № 4. — С. 291.
- Petty R. E., Laxer R. M., Lindsley C., Wedderburn L. R. Textbook of pediatric rheumatology. — 8th еdition. — Philadelphia: Saunders, 2020. — 768 р.
- Courtney С. B., Beukelman Т. Juvenile Idiopathic Arthritis: Oligoarthritis and Polyarthritis // Pediatr Clin North Am. — 2018. — № 4. — Р. 657–674. ссылка
- Barut K., Adrovic A., Şahin S., Kasapçopur Ö. Juvenile Idiopathic Arthritis // Balkan Med J. — 2017. — № 2. — Р. 90–101. ссылка
- Mitrogiannis L., Barbouti A., Theodorou E. et al. Surgical Treatment of Juvenile Idiopathic Arthritis A Review // Bull Hosp Jt Dis (2013). — 2019. — № 2. — Р. 99–114. ссылка
- Nigrovic Р. А., Martínez-Bonet М., Thompson S. D. Implications of juvenile idiopathic arthritis genetic risk variants for disease pathogenesis and classification // Curr Opin Rheumatol. — 2019. — № 5. — Р. 401–410. ссылка
- Bywaters E. G. Heberden oration, 1966. Categorization in medicine: a survey of Still disease // Ann Rheum Dis. — 1967. — № 3. — Р. 186–193. ссылка
- Ross E., Petty R. E., Cassidy J. T. Juvenile Ankilosing Spondilitis. Textbook of Pediatric Rheumatology. — Toronto: W. B. Saunders Company, 2002. — 819 р.
- Beukelman T., Patkar N. M., Saag K. G. et al. 2011 American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis: initiation and safety monitoring of therapeutic agents for the treatment of arthritis and systemic features // Arthritis Care Res (Hoboken). — 2011. — № 4. — Р. 465–482. ссылка
- Zaripova L. N., Midgley A., Christmas S. E. et al. Juvenile idiopathic arthritis: from aetiopathogenesis to therapeutic approaches // Pediatric Rheumatology. — 2021. — № 1. — Р. 135.ссылка
- Rigante D., Bosco A., Esposito S. The Etiology of Juvenile Idiopathic Arthritis // Clin Rev Allergy Immunol. — 2015. — № 2. — Р. 253–261.ссылка
- Алексеева Е. И. Ювенильный идиопатический артрит: клиническая картина, диагностика, лечение // Вопросы современной педиатрии. — 2015. — № 1. — С. 78–94.
- Коровина Н. А., Творогова Т. М., Гаврюшова Л. П. и др. Остеопороз у детей: учебное пособие. — М.: Кафедра педиатрии Российской медицинской академии последипломного образования МЗ РФ, 2002.
- Chua-Aguilera С. J., Möller B., Yawalkar N. Skin Manifestations of Rheumatoid Arthritis, Juvenile Idiopathic Arthritis, and Spondyloarthritides // Clin Rev Allergy Immunol. — 2017. — № 3. — Р. 371–393. ссылка
- Chang M. H., Shantha J. G., Fondriest J. J. et al. Uveitis in Children and Adolescents // Rheum Dis Clin North Am. — 2021. — № 4. — Р. 619–641. ссылка
- Sorokina L. S., Avrusin I. S., Raupov R. K. et al. Hip Involvement in Juvenile Idiopathic Arthritis: A Roadmap From Arthritis to Total Hip Arthroplasty or How Can We Prevent Hip Damage? // Front Pediatr. — 2021. ссылка
- Алексеева Е. И., Бзарова Т. М. Алгоритм диагностики и лечения ювенильного артрита // Вопросы современной педиатрии. — 2010. — № 6. — С. 78–104.
- Gattorno M., Piccini A., Lasigliè D. et al. The pattern of response to anti-interleukin-1 treatment distinguishes two subsets of patients with systemic-onset juvenile idiopathic arthritis // Arthritis Rheum. — 2008. — № 5. — Р. 1505–1515.ссылка
- Хальчицкий С. Е., Согоян М. В., Ли А. О. и др. Современные представления о генетике ювениального идиопатического артрита // Современные проблемы науки и образования. — 2022. — № 2.
- Кожевников А. Н., Поздеева Н. А., Конев М. А. и др. Ювениальный артрит: клинико-инструментальная картина и дифференциальная диагностика // Ортопедия, травматология и восстановительная хирургия детского возраста. — 2014. — № 4. — С. 66–73.
- Wiers-Shamir К. Juvenile Idiopathic Arthritis // Joe DiMaggio Children’s Hospital. — 2021.
- Мелешкина А. В., Бунин А. В., Геппе Н. А., Чебышева С. Н. Место физической реабилитации в терапии ювенильных артритов // Лечащий врач. — 2016.
- Efficacy Study Of Tofacitinib In Pediatric JIA Population // ICH GCP. — 2019.
- Steinberg D. R. Swan-Neck Deformity // MSD Manual. — 2022.
Источник https://pharmateca.ru/ru/archive/article/12811
Источник https://diseases.medelement.com/disease/%D1%80%D0%B5%D0%B2%D0%BC%D0%B0%D1%82%D0%BE%D0%B8%D0%B4%D0%BD%D1%8B%D0%B9-%D0%B0%D1%80%D1%82%D1%80%D0%B8%D1%82-%D1%83-%D0%B4%D0%B5%D1%82%D0%B5%D0%B9/12766
Источник https://probolezny.ru/yuvenilnyy-revmatoidnyy-artrit/