Что такое популярная и нетрадиционная медицина
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
- Издательство «Медиа Сфера»
- (бесплатный номер по вопросам подписки)
пн-пт с 10 до 18
- Издательство «Медиа Сфера»
а/я 54, Москва, Россия, 127238 - info@mediasphera.ru
- вКонтакте
- Telegram
- Издательство
- «Медиа Сфера»
Результаты поиска: 0
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России
- ORCID: 0000-0001-9894-0671
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России;
ФГБУ «Центральная клиническая больница с поликлиникой» Управления делами Президента Российской Федерации

Что такое доказательная медицина?
Подробнее об авторах
Скачать PDF
Связаться с автором
Оглавление
Эттингер А.П., Жарова М.Е. Что такое доказательная медицина? Доказательная гастроэнтерология. 2021;10(1):38‑48.
Oettinger AP, Zharova ME. What is evidence-based medicine? Russian Journal of Evidence-Based Gastroenterology. 2021;10(1):38‑48. (In Russ.)
https://doi.org/10.17116/dokgastro20211001138

Читать метаданные
Эта публикация открывает собой систематический цикл об основах доказательной медицины, который планируется регулярно публиковать в нашем журнале. Мы надеемся, что он вместе с последующими циклами публикаций на сходные актуальные темы окажет практическую помощь коллегам. Цикл статей мы начинаем с истории становления и развития доказательной медицины, разъяснения основных терминов и понятий, таких как пирамида доказательности, система GRADE и система PICO(T).
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России
- ORCID: 0000-0001-9894-0671
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России;
ФГБУ «Центральная клиническая больница с поликлиникой» Управления делами Президента Российской Федерации
Дата принятия в печать:
- Mikulic M. Top 20 Countries by Number of Clinical Trial Participants in 2015—2016. 2021. Accessed January 01, 2021. https://www.statista.com/statistics/830020/top-participant-countries-for-clinical-trials-worldwide-by-number/
- Luckmann R. Evidence-Based Medicine: How to Practice and Teach EBM. 2nd Edition. Churchill Livingstone; 2000.
- Авксентьева М.В. Контролируемый эксперимент в медицине. Медицинские технологии. Оценка и выбор. 2011;5(3):88-93.
- Group E-BMW. Evidence-based medicine. A new approach to teaching the practice of medicine. JAMA. 1992;268(17):2420-2425. https://doi.org/10.1001/jama.1992.03490170092032
- Milestones in U.S. Food and Drug Law History. FDA. 2019. Accessed January 01, 2021. https://www.fda.gov/about-fda/fdas-evolving-regulatory-powers/milestones-us-food-and-drug-law-history
- Sur RL, Dahm P. History of evidence-based medicine. Indian Journal of Urology. 2011;27(4):487-489. https://doi.org/10.4103/0970-1591.91438
- How to read clinical journals: I. why to read them and how to start reading them critically. Canadian Medical Association Journal. 1981;124(5):555-558.
- Thoma A, Eaves FF, III. A Brief History of Evidence-Based Medicine (EBM) and the Contributions of Dr David Sackett. Aesthetic Surgery Journal. 2015;35(8):NP261-NP263. https://doi.org/10.1093/asj/sjv130
- Guyatt GH, Rennie D. Users’ Guides to the Medical Literature: A Manual of Evidence-Based Clinical Practice. 3rd ed. New York: McGraw-Hill; 2015.
- Smith R, Rennie D. Evidence based medicine — an oral history. BMJ. 2014;348:g371. https://doi.org/10.1136/bmj.g371
- Howick J, Chalmers I, Glasziou P, Greenhalgh T, Heneghan C, Liberati A. The 2011 Oxford CEBM Evidence Levels of Evidence (Introductory Document). Oxford Centre for Evidence-Based Medicine; 2011. Accessed January 1, 2021. https://www.cebm.net/index.aspx?o=5653
- Gerber JS, Offit PA. Vaccines and autism: a tale of shifting hypotheses. Clinical Infectious Diseases. 2009;48(4):456-461. https://doi.org/10.1086/596476
- Britannica. The Editors of Encyclopaedia. «Sir Cyril Burt». Encyclopedia Britannica. Oct. 6, 2020. Accessed January 1, 2021. https://www.britannica.com/biography/Cyril-Burt
- Fedak KM, Bernal A, Capshaw ZA, Gross S. Applying the Bradford Hill criteria in the 21st century: how data integration has changed causal inference in molecular epidemiology. Emerging Themes in Epidemiology. 2015;12:14. https://doi.org/10.1186/s12982-015-0037-4
Обращение к читателю. Зачем нужна доказательная медицина?
Длительный опыт работы в диссертационных советах, в редакционных коллегиях отечественных и зарубежных медицинских изданий, систематическое участие в международных съездах и конференциях позволяют утверждать, что на сегодняшний день у отечественных коллег существуют значительные резервы для понимания и использования принципов и положений, составляющих понятие доказательная медицина. На наш взгляд, главная причина в том, что отстает, в первую очередь, подготовка профессионального сообщества всех уровней к изучению, освоению и, в конечном итоге, восприятие принципов доказательной медицины в качестве полезного набора рабочих инструментов и их свободного использования в повседневной практике.
Причины появления интереса к доказательности в медицине, особенно в нашей стране, кроются в появлении новых требований и в смещении ориентиров оценки деятельности практически любого работника медицинской отрасли. Медицина была и остается научной областью деятельности. Из деклараций это переходит в повседневную жизнь. Отсюда появление повышенного интереса к публикационной активности и связанной с этим понятием потребности изменить собственный подход к планированию и выполнению в первую очередь регулярной исследовательской работы, включая диссертационные работы, клинические исследования и все, что можно отнести к научной деятельности в любом разделе медицины, причем во всех звеньях лечебно-профилактической работы.
Почему в общем виде этим следует интересоваться и почему нужно популяризировать доказательную медицину? Практика руководства отраслью, внезапное появление требований к исполнителям без подготовки мнения профессионального сообщества приводит к неправильным реакциям и замедлению внедрения новшества, поскольку врачи не видят очевидных выгод для себя и расценивают новшества как очередную нагрузку, которая не помогает им, а отвлекает от выполнения основных и понятных обязанностей. Активное или пассивное сопротивление контрпродуктивно. Оценка самого явления как очередной бюрократической причуды только замедляет прогресс. А описанная реакция закономерна в основном по одной простой и давно известной причине — появление новшества, даже самого полезного, никто не готовит. Сначала появляется распоряжение, затем чаще всего командно-нажимным способом заставляют выполнять его и наказывают за несвоевременное и ненадлежащее исполнение.
Публикаций, посвященных доказательной медицине немало, однако ощущается дефицит именно практически направленных руководств и установок, представлено незначительное количество докладов.
Данная публикация открывает собой систематический цикл, который планируется регулярно публиковать в нашем журнале. Мы надеемся, что вместе с последующими циклами публикаций на сходные актуальные темы он окажет практическую помощь коллегам.
История доказательной медицины, основные вехи
В мировой статистике клинических исследований, по данным Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA), наша страна занимает устойчивое второе место по абсолютному количеству участников (6875) и по процентному отношению к мировым цифрам участников клинических исследований (5,22%) [1]. Такая статистика, с одной стороны, радует, а с другой стороны, выдвигает требование к повышению общего уровня овладения предметом не только в относительно немногочисленных передовых крупных учреждениях, но и в целом по стране. В принципе упорядочение любой медицинской, особенно врачебной, деятельности имеет в основе доказательность, начиная с доказывания самому себе правильности выбора диагностических, лечебных или профилактических мероприятий в каждодневной практической работе с конкретными пациентами. Это не открытие, пытливость и стремление к прогрессу отличали врачебное сословие со дня его появления. Особенность современного момента состоит в невиданном ранее повышении темпов жизни вообще и сокращении сроков принятия решений в частности, нарастании потоков информации, повсеместном диктате финансов и финансирующих и в спорном по целесообразности, но императивном внесении приемов производственного и торгового менеджмента в отрасль. Все это по современным определениям — вызовы. И противостоять им можно только одним продуктивным способом — осваивая новые технологии, в первую очередь те, которые помогают врачу эффективно, а значит с пользой для пациента и без постоянного стресса и ущерба для себя радостно и с энтузиазмом работать. Освоение принципов доказательной медицины не является панацеей от всех проблем, но опыт отечественных и зарубежных коллег, которые их используют, говорит о том, что это весьма полезный и необходимый навык, реально повышающий квалификацию и самооценку любого коллеги. Хотя в основе самого понятия и совершенствования лежал и лежит исключительно практический замысел.
Терминология — основа успешного освоения любой новой информации, а в случае доказательной медицины это особенно важно. Единая или единообразная, по крайней мере, терминология — необходимый элемент. Наличие значительного, то есть больше двух, количества терминов, обозначающих одно и то же (субъект или явление) приводит к негативному эффекту — практик просто отвергает саму систему, их использующую. Для того чтобы разобраться, что же представляет собой доказательная медицина, следует дать этому термину определение.
Доказательная медицина — это точное и осмысленное использование лучших результатов клинических исследований для принятия решений в оказании помощи конкретному пациенту [2].
Истоки доказательной медицины можно найти и в древней Греции, и в Библии: Книга Давида, Глава 1:1-16. Когда дети Израиля были пленниками в Вавилоне, они должны были есть вавилонскую пищу. Дети Израиля спросили, могут ли они вместо этого придерживаться вегетарианской диеты. Сравнение детей Израиля с вавилонской молодежью показало, что вегетарианская диета была более здоровой [3].
Первое опубликованное контролируемое исследование проведено в 1747 г. Джеймсом Линдом (James Lind) (рис. 1). Будучи корабельным врачом, Дж. Линд столкнулся с распространенным заболеванием среди мореплавателей того времени — цингой. Разделив моряков на шесть групп по 2 человека, он назначил им разное лечение. Первая группа получала кварту сидра ежедневно, другая — двадцать пять капель купороса, третья — шесть ложек уксуса в день, четвертая — половину пинты морской воды, пятая — два апельсина и лимон, шестая — пряную пасту или напиток из ячменной воды. Лечение пятой группы закончилось через шесть дней, когда кончились фрукты, но к этому времени моряки почти полностью выздоровели [3].

Рис. 1. Основные вехи развития доказательной медицины.
Еще один из основоположников экспериментального метода в медицине — Пьер-Шарль Александр Луи (Pierre-Charles Alexandre Louis) (1787—1872), — французский врач, сравнивший эффективность различных видов кровопускания. В его исследовании присутствовали группы сравнения и даже элементы количественного анализа. Подобных исследований было значительно больше, но публикационная активность в те времена была весьма низкой, и об этих исследованиях знало очень небольшое количество людей.
В России в этот период также проводились клинические исследования, например, в 1829—1830 гг. в Санкт-Петербурге М.Е. Дином, который, выявляя лечебную эффективность гомеопатических средств, применял плацебо и слепой метод. В результате доказана несостоятельность гомеопатической концепции и такой вид лечения даже был запрещен в России [3].
Сам термин «доказательная медицина» или evidence-based medicine (EBM) в научных публикациях впервые появился в 1992 г. Гордон Гайят (Gordon Guyatt) использовал этот термин в своей статье для описания нового подхода к обучению медицинской практике, чуть ранее в 1990 г. он упоминал его в своих лекциях в Университете Макмастера (McMaster University, Торонто, Канада) [4].
Однако сама концепция медицины, основанная не на экспертном мнении, а на доказательствах, появилась еще в 1960 г. Все больше врачей и ученых обращали внимание медицинского сообщества на недостатки распространенного в то время способа принятия клинических решений, что подтверждалось, например, «талидомидной трагедией», получившей огромную огласку в средствах массовой информации. В США под влиянием этого трагического события сенатор Эстес Кефовер в 1959 г. начал проводить в Конгрессе слушания об опасениях по поводу практик фармацевтической промышленности, таких как предполагаемая высокая стоимость и неопределенная эффективность многих лекарств, продвигаемых производителями. Только в 1962 г. внесены поправки в закон, по которому все заявки на новые лекарственные препараты должны были продемонстрировать «существенные доказательства» эффективности лекарственного средства, и это помимо демонстрации безопасности, что ознаменовало начало процесса утверждения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA) в его современной форме [5].
В начале 60-х годов XX века Сюзанна Флетчер (Suzanne Fletcher) и Роберт Флетчер (Robert Fletcher) активно поддерживали концепцию принятия клинических решений на основе доказательств. Результатом их работы стал учебник «Клиническая эпидемиология: основы» (Clinical Epidemiology: The Essentials), опубликованный в 1982 г. и описывающий научные основы клинической помощи [6].
Элван Файнштейн (Alvan Feinstein), эпидемиолог, математик и ревматолог в серии публикаций в журнале Annals of Internal Medicine (1967 г.) уделил большое внимание роли клинических рассуждений и выявленных предубеждений (bias), а также ввел термин клиническая эпидемиология. Свои принципы он подтвердил на практике. Работая в Нью-Йорке ревматологом, Э. Файнштейн доказал, что установление диагноза ревматическая лихорадка и отличия доброкачественных шумов от патологических основаны больше на клиническом авторитете, а не научных критериях. Позже Э. Файнштейн создал классификацию болезни, что помогло более эффективно лечить пациентов [6].
В 1967 г. под руководством декана университета Джона Эванса (John Evans) и профессора Фрейзера Мастарда (Fraser Mustard) клиническая эпидемиология стала официальным курсом обучения в медицинской школе Университета Макмастера. Возглавил новый курс 32-летний Дэвид Сакетт (David Sackett), который позже многими будет признан одним из основоположников доказательной медицины. На курсе преподавались способы внедрения эпидемиологических и биометрических методов для изучения диагностического и терапевтического процесса с целью улучшения состояния здоровья пациента. В 1981 г., после нескольких лет работы курса клинической эпидемиологии, Д. Сакетт и его коллеги решили поделиться своими разработками и опубликовали серию статей в журнале Canadian Medical Association Journal о «критической оценке» («critical appraisal») — правилах чтения научной литературы [7]. В 1985 г. авторы начали работу над «библией» доказательной медицины — книгой «Клиническая эпидемиология: научная основа для клинической медицины» (Clinical Epidemiology: a Basic Science for Clinical Medicine) [8].
Позже директором курса стал уже известный нам Гордон Гайятт, который вместе со своими коллегами продолжил работу, начатую его предшественниками. Гайятт и его коллеги начали сотрудничать с американскими учеными, сформировав международную рабочую группу по доказательной медицине в 1992 г. В период с 1993 по 2000 г. рабочая группа из Университета Макмастера опубликовала в JAMA методы для широкой аудитории врачей в серии из 25 статей, которые позже были объединены в «Руководство по использованию медицинской литературы» («Users’ Guides to the Medical Literature») [9].
Рассказ о зарождении доказательной медицины будет неполным без упоминания Арчибальда Лемана Кокрана (Archibald Leman Cochrane) — шотланского врача и эпидемиолога. На протяжении всей своей карьеры он боролся с субъективностью (bias) в медицине и являлся ярым сторонником проведения рандомизированных контролируемых исследований (РКИ). Ярким примером его идеологии является тот факт, что даже находясь в тюрьме во время Второй мировой войны, А.Л. Кокрейн провел свое первое испытание на других военнопленных, сравнивая влияние дрожжевого экстракта на гиповитаминоз. Его сострадание к испытуемым, которые были его товарищами и сокамерниками, повлияло на его будущую работу. Позже А.Л. Кокрейн организовал крупное исследование, пытаясь определить влияние туберкулеза и пыли на развитие прогрессирующего легочного фиброза — исследование Rhondda Fach (1948 г.). Некоторые из наиболее ценных уроков, которые он извлек из исследования Rhondda Fach, включали ценность эпидемиологических исследований и угрозу предвзятости (bias) исследования. Позже Арчибальд Кокрейн организовал первое рандомизированное исследование роли аспирина в профилактике сердечно-сосудистых заболеваний. В 1972 г. он выполнил один из первых систематических обзоров. На основании своего опыта в 1972 г. А.Л. Кокрейн опубликовал книгу «Действенность и эффективность: случайные размышления о медицинской службе» («Effectiveness and Efficiency: Random Reflections on Health Services»), в которой обосновывал целесообразность использования РКИ для улучшения качества медицинской помощи. Эта книга также является одной из важнейших для становления доказательной медицины. Дело Арчи Кокрейна продолжили Том Чалмерс, Ян Чалмерс и Мюррей Энкин, организовавшие в 1992 г. «Кокрановское сотрудничество» (Cochrane Collaboration) в Оксфорде при поддержке Национальной службы здравоохранения Великобритании (NHS) [6, 10].
Том Чалмерс расширил работу А.Л. Кокрейна. Он утверждал, что РКИ являются основой иерархии доказательств, кульминацией которой становятся объединенные данные нескольких испытаний. Он добавил, что при обобщении доказательств необходимо учитывать предвзятость публикации, то есть тот факт, что исследования с положительными результатами с большей вероятностью будут опубликованы, чем исследования с отрицательными результатами. Ему приписывают введение метаанализа. Акушер Ян Чалмерс, работая в лагерях палестинских беженцев в 60-х годах XX века, на собственном опыте убедился в опасности подчинения медицинским догмам и в том, что поиск достоверной информации имеет жизненно важное значение. Ян Чалмерс объединился с акушером Мюрреем Энкиным для создания обширной базы данных опубликованных, неопубликованных, текущих и запланированных исследований и метаанализов [6].
Объединив усилия, трое ученых по аналогии Оксфордской базы данных перинатальных исследований в 1993 г. создали сообщество, целью которого является формирование систематических обзоров эффективности различных медицинских вмешательств, важных и полезных для принятия врачебных решений. Назвали сообщество в честь одного из отцов доказательной медицины — Арчибальда Кокрейна, а эмблемой стало схематическое изображение результатов одного из первых систематических обзоров об эффективности короткого курса кортикостероидов, который назначали беременным с высоким риском преждевременных родов; тогда удалось доказать, что таким образом риск смерти новорожденных можно снизить на 30—50% [10].
Процесс совершенствования всех элементов системы доказательной медицины ведется непрерывно, особенно интенсивно с конца 90-х годов прошлого века и по сей день в разных странах мира. Лидирующие позиции в развитии доказательной медицины занял созданный в Университете Оксфорда Центр доказательной медицины (Centre for Evidence-Based Medicine, CEBM). CEBM является частью Департамента первичной медицинской помощи в отделении Оксфордского университета в Наффилде, позиционирует себя как некоммерческая организация, занимающаяся практикой, обучением и распространением высококачественной доказательной медицины для улучшения здравоохранения в повседневной клинической практике. Исследовательский отдел Центра издает руководства по доказательной медицине. В настоящее время изданы два руководства — в 2009 и 2011 г. Это и выдвинуло этот центр на первые позиции в мире по разработке проблем доказательной медицины [11].
Основные термины доказательной медицины
Для лучшего понимания доказательной медицины необходимо разбираться в основных терминах, которые разъяснены ниже.
Зависимая и независимая переменная
Математические инструменты, используемые для количественного контроля любого научного эксперимента, называются зависимыми и независимыми переменными. Для приближения к рассматриваемым проблемам целесообразно адаптировать точные, но общие определения к рассматриваемым типам исследований.
Зависимые переменные — это получаемые в завершенном исследовании результаты.
Независимые переменные — это те новые условия и параметры в количественном выражении, которые вносятся в ходе экспериментального исследования (изменение доз, способов операции, параметров обследования и т.д.).
В общем виде в экспериментальном исследовании для более точного определения величины зависимой переменной, то есть для максимального приближения результатов исследования к истинному положению вещей, исследователи стремятся применять оптимальные сочетания независимых переменных, то есть строить исследование рационально и адекватно поставленным целям.
Независимые переменные — это переменные, значениями которых можно управлять, а зависимые переменные — это переменные, которые можно только измерять или регистрировать.
Зависимая переменная, или переменная ответа, зависит от независимой переменной. Любое изменение в независимой переменной влияет на зависимую переменную. В действительности зависимые переменные — это те значения, которые фактически измеряются исследователем без предположений и сомнений. И это как бы данность.
Разберем на примере, чем же отличаются зависимая и независимая переменные. В эксперименте исследователь изучает влияние дозы препарата А на уровень ферментов печени, в данном случае концентрация препарата А — это независимая переменная, а уровень ферментов печени — зависимая. Или, например, мы хотим узнать, какая из операций, А или Б, имеет меньше осложнений в виде послеоперационного кровотечения, в данном случае тип операции — независимая переменная, а частота развития осложнений — зависимая.
В большинстве научных исследований делается попытка показать связь между двумя переменными — зависимой и независимой, то есть как одна переменная (независимая переменная) влияет на другую (зависимую переменную). Если исследователь может утверждать, что независимая переменная вызывает зависимую переменную, то он сделал самое сильное утверждение в исследовании:
Когда есть большая вероятность того, что другие переменные могут повлиять на результат, исследование имеет низкую внутреннюю достоверность. Хорошие исследования всегда разрабатываются таким образом, чтобы минимизировать вероятность того, что любые переменные, кроме независимой переменной, влияли на зависимую переменную.
Независимая переменная — все то, что применено нами в процессе работы с пациентом или тест-системой. Зависимые переменные — это те результаты, которые получены в ходе работы. Все результаты медицинских и прикладных медико-биологических исследований конкретны.
Экспериментальное и обсервационное исследование
Достаточно давно в науке, и не только биомедицинской, осуществлено разделение на экспериментальные и обсервационные исследования. Их основное отличие состоит в том, что в экспериментальных исследованиях исследователь контролирует большинство переменных, то есть вмешивается в ход исследования. В обсервационном исследовании исследователь только наблюдает и не изменяет ни одну из переменных (табл. 1, 2).
Таблица 1. Сравнение экспериментального и обсервационного исследований
Рандомизированное контролируемое исследование.
Экспериментальное исследование с использованием лабораторных животных
Старые друзья — ключ к аутоиммунным заболеваниям
Статья на конкурс «био/мол/текст»: Всю свою историю человечество страдало от различных инфекционных заболеваний и боролось с ними. Эпидемии чумы и холеры тысячелетиями наводили ужас на цивилизованный мир. Благодаря современным достижениям гигиены и медицины эти враги побеждены. Но не потеряли ли мы что-то важное на этом пути?

Конкурс «био/мол/текст»-2017
Эта Статья заслужила приз зрительских симпатий.
Работа участвовала в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

Человеческий организм — штука несовершенная. Мы стареем, болеем и умираем. Если в каменном веке ведущей причиной смерти были травмы, голод и дикие животные, в Средние века — чума и холера, то сейчас, по данным Всемирной организации здравоохранения, это онкологические и сердечно-сосудистые заболевания. И если посмотреть на научные бюджеты и распределение грантов в биомедицине, мы увидим, что слово «рак» в заявке в разы повышает ваши шансы получить финансирование.
Однако есть заболевания, возможно, не столь смертельные, но куда сильнее бьющие по нам экономически. Это аутоиммунные заболевания, такие, как рассеянный склероз, системная красная волчанка или диабет 1-го типа. Если рак и инсульты чаще всего встречаются у пожилых людей, то аутоиммунные состояния обычно манифестируют (проявляются в виде симптомов) у молодых людей трудоспособного возраста и либо ложатся тяжким бременем на бюджет страны или больного (россияне, больные диабетом, если не получают инсулин от государства, тратят на поддержание собственной жизни от 1 до 5–6 тысяч рублей в месяц), либо, как в случае рассеянного склероза, просто ставят крест на карьере и жизни пациента.
Особенность аутоиммунных заболеваний состоит в том, что практически ни для одного из них мы за долгие годы исследований и экспериментов не научились достигать стойкой ремиссии. Текущие решения сводятся либо к поддерживающей терапии (как в случае с инсулинозависимым диабетом), либо к попыткам отсрочить терминальную стадию заболевания, на что нацелены препараты от рассеянного склероза. До недавнего времени ситуация выглядела довольно плачевно. Дополнительно усугубляет ее тот факт, что количество людей с аутоиммунными заболеваниями растет каждый год, и мы находимся на пороге настоящей эпидемии.
Однако там, где фармацевтическая отрасль терпит одну неудачу за другой, внезапно сама природа показала, куда смотреть исследователям и откуда брать по-настоящему работающее лекарство.
История вопроса
Чтобы понять, откуда возникла проблема с аутоиммунными заболеваниями, придется заглянуть далеко в прошлое.
Весь прогресс человечества с определенной долей приближения можно считать гонкой со смертью. Палеолитические охотники страдали от болезней или голода и погибали в лапах хищников. Ответом стало приручение огня, разработка более эффективных орудий и переход от непредсказуемых и опасных охоты и собирательства к оседлости и сельскому хозяйству. В эпидемиологии этот процесс принято называть «первым эпидемиологическим переходом» (англ. First epidemiologic transition, FET).
Цель перехода в целом была достигнута. Жизнь в деревянных, а затем в каменных домах позволила более не бояться хищников. Сельское хозяйство, пусть и не со стопроцентной вероятностью, но защищало от голодной смерти. Качество и продолжительность жизни ощутимо выросли. Но на смену старым убийцам пришли новые. Дело в том, что одним из наиболее значительных следствий «перехода» стали эпидемии, которых человечество раньше не знало.
Дело в изменившемся в ходе FET образе жизни человека. До этого мы жили небольшими группами, состоявшими не более чем из 50 особей, занимавшими довольно обширные пространства. К тому же мы постоянно меняли место жительства, нигде не оставались надолго. Культура гигиены была довольно низкой — зачем следить за чистотой убежища, если ты уже съел всех мамонтов вокруг и завтра надо искать новое место?
В ходе FET люди начали надолго оставаться на одном месте, формировать более крупные группы для защиты от набегов соплеменников. Скученность и загрязнение места обитания создали оптимальные условия для развития у нас инфекций. Начались эпидемии, которые были тем свирепее, чем больше был город и чем плотнее жили в нем люди.
Новый набор «убийц» человека очень хорошо метафорически отражен в «Откровении» Иоанна Богослова (рис. 1). Силы человеческие велики, но у Бога остаются непреодолимые орудия для уничтожения рода человеческого — мор, голод и война, за которыми всегда следует смерть. И если войну можно избежать политическими мерами, к голоду можно подготовиться, то от мора можно лишь бежать со всех ног.

Довольно долгое время, около 5000 лет, понадобилось человечеству, чтобы научиться справляться с инфекциями. Где-то раньше, где-то позже люди осознали важность гигиены для жизни и здоровья. Были эмпирически найдены лекарства от многих болезней. Можно сказать, весь прогресс медицины и человечества в целом происходил под постоянно довлеющим страхом новых эпидемий.
Все это не могло не отразиться на нашей культуре. Во многие мировые религии с самого начала исторического периода включались гигиенические требования. Чего стоят одни только египетские жрецы, ежедневно брившие все тело и постоянно очищавшие его от любой грязи. Слово «нечистый» во многих культурах синонимично слову «плохой», «тот, кого надо избегать». Неотделимость смерти от мора научила нас панически бояться любой нечистоты, любых признаков болезни и бежать со всех ног (рис. 2).

В настоящее время мы настолько чисты, насколько не были никогда в истории. Особенно хорошо это видно в развитых странах. Мы привыкли к тому, что во все дома подведена вода и всегда есть возможность принять ванную или душ. Мы пользуемся мылом, влажными салфетками, асептическими гелями. Мы даже моем наши дороги шампунем!
Казалось бы, ну чистые и чистые, что тут такого? При чем тут аутоиммунные заболевания? Оказывается, связь самая прямая.
Гигиеническая гипотеза
Первые наметки того, что ученые сегодня называют «гигиенической гипотезой» или «гипотезой старых друзей» появились в научной литературе еще в конце 19-го века. Этот период в истории иммунологии называют «вторым эпидемиологическим переходом» (англ. Second epidemiologic transition, SET). Он характеризуется сильным снижением заболеваемости различными инфекционными заболеваниями (бактериальными и гельминтными), а также намного более редким переходом этих заболеваний в эпидемии. Возьмем, например, чуму. Все мы из школы знаем, как сильно она влияла на судьбы Европы Средних веков. Но многие ли знают, что она отнюдь не побеждена полностью? По данным ВОЗ, в 2015 году чумой по всему миру заболели 320 человек, 77 из которых умерли. Заметьте, никакой эпидемии. Очаги оперативно локализуются, заболевшие получают адекватное лечение, почти все выздоравливают. «Черная смерть» никого больше не пугает.
Этот переход стал возможен благодаря появлению антибиотиков и других высокоэффективных противопаразитических лекарств. В развитых странах он завершился к концу 20-го века. Если в середине века в Европе каждый третий житель был поражен гельминтами [1], то в настоящий момент обнаружение носителя этих паразитов скорее редкость. Россия в этом отношении практически не отстает от развитого мира благодаря нашим сильным гигиеническим традициям. Дополнительный вклад вносит городской образ жизни, централизованное снабжение очищенной водой, контроль качества пищи и так далее.
Однако еще с 19-го века начали появляться данные, что современный городской образ жизни и общее благополучие (как правило, сопровождающееся повышенной «чистотой» жизни) приводят к определенным заболеваниям (рис. 3). Типовой аристократ викторианской эпохи обязательно имел несколько «светских» заболеваний, таких, как «сенная лихорадка» или, как мы зовем ее сейчас, аллергия на пыльцу. Более серьезным «заболеванием богатых» стал диабет первого типа [2], который был бичом «благополучного общества» до открытия целебных свойств инсулина.
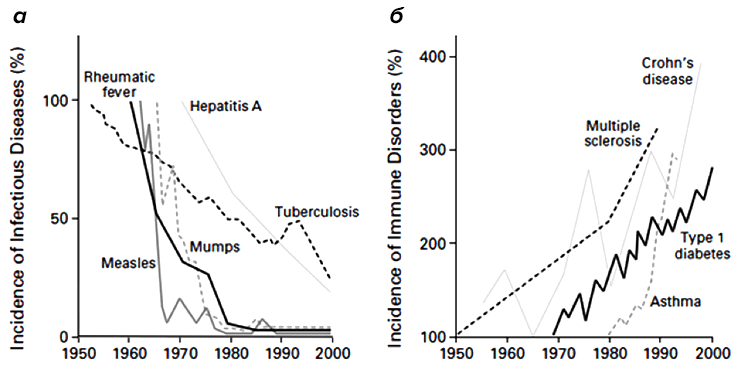
Заболевания эти возникли в истории человечества внезапно и довольно-таки недавно — 200 лет назад они либо отсутствовали, либо были столь редки, что не оставили следа в медицинской литературе. Наличие связи между возникновением этих заболеваний и условиями жизни больных впервые свел воедино Дэвид Стракан в 1989 году в короткой заметке, где он постулировал «гигиеническую гипотезу» [3]. Он отметил, что сенной лихорадке больше подвержены те люди, у которых было меньше братьев и сестер в детстве. Стракан предположил, что устойчивость к сенной лихорадке передается с детскими инфекциями от сиблинга к сиблингу и является следствием сниженной гигиены.
Впоследствии многие исследователи показали то же самое на примере других аллергий и аутоиммунных реакций. К примеру, если детям из неблагополучных по гигиене регионов вроде Чили или Тайланда провести европейскую программу дегельминтизации, у них букетом высыпают аллергии [4].
Наверное, самым интересным примером тут является история с рассеянным склерозом [5–8]. Ученые решили посмотреть, что происходит, когда больной этим страшным заболеванием заражается гельминтами, и начали искать инфицированных червями пациентов с РС. Результаты были ошеломляющи. У пациентов, которые заражались определенными гельминтами (например, власоглавом Trichuris trichiura) течение заболевания практически останавливалось [6]. Во время инфекции у них на 95% снижалось количество новых бляшек в мозге (рис. 4). Результат, недостижимый ни одним современным методом терапии! Если же по каким-то причинам гельминтов требовалось удалить (например, развивалось острое воспалительное поражение кишечника), болезнь возобновлялась с той стадии, на которой остановилась при инфекции.
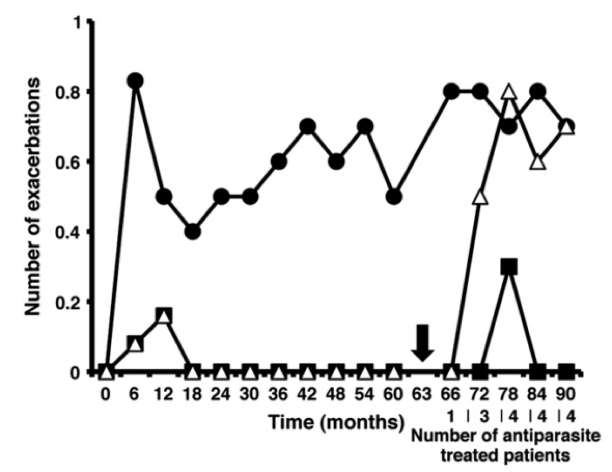
Можно сказать, власоглав поддерживал здоровье этих людей, позволяя им вести нормальный образ жизни, пока они позволяют ему жить внутри себя. Так что же происходит? Как черви справляются с задачей, с которой не способна справиться современная медицина? Для ответа на этот вопрос нам придется разобраться, как же работает наш иммунитет.
Иммунный ответ
Иммунная система призвана защищать организм от внутренних и внешних врагов. Внешними врагами являются вирусы, бактерии, простейшие и черви, которые постоянно попадают в наш организм и уничтожаются на дальних рубежах. Внутренними врагами являются раковые клетки, а также клетки, зараженные вирусами или внутриклеточными бактериями.
Ключевые для иммунитета понятия — «антиген» и «воспаление». Антиген — это какая-либо молекула, которую способна узнать и атаковать иммунная система. Практически что угодно может быть антигеном. Воспаление же — это реакция ткани на повреждение или опасность такого повреждения. Молекулы, запускающие воспаление, называются провоспалительными, а блокирующие его — противовоспалительными.
Когда паразит попадает в организм, первым делом его встречает врожденный иммунитет, клетки которого (макрофаги) есть во всех тканях. Антигеном в данном случае служат нехарактерные для нашего организма молекулы — клеточная стенка бактерий, двухцепочечная РНК некоторых вирусов, свободно плавающая в межклеточном пространстве наша ДНК и так далее. При обнаружении пришельцев, клетки врожденного иммунитета пытаются их уничтожить, параллельно выделяя провоспалительные молекулы (рис. 5). Воспаленная ткань блокирует выход паразита из места проникновения в остальной организм и привлекает новые клетки иммунитета к месту повреждения.
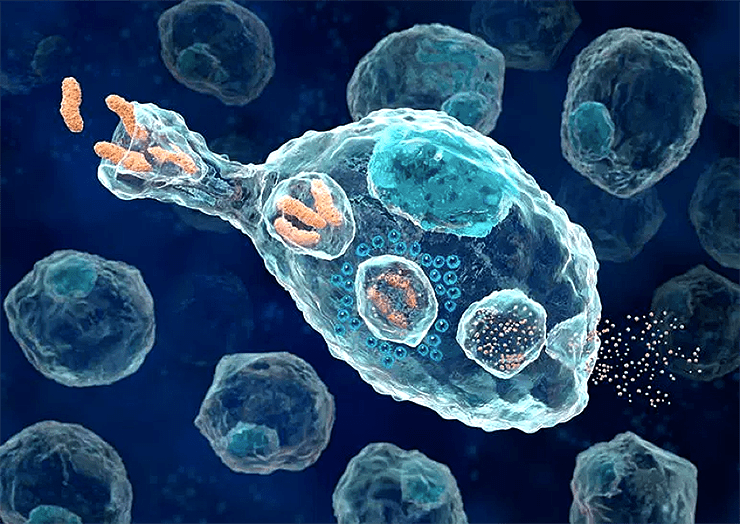
Если врожденному иммунитету не удается уничтожить захватчиков, в дело вступает адаптивный иммунитет. Происходит это отнюдь не сразу: активации адаптивного ответа предшествуют 3–4 дня подготовки в лимфоузлах (при этом лимфоузлы увеличиваются в размерах, что является признаком инфекционного заболевания). Начинается все с того, что некоторые из клеток врожденного иммунитета прибывают в лимфоузел, неся на себе антигены из места поражения. Антигенами в данном случае выступают короткие (от 8 до 20 аминокислот) пептиды из белков инфекционного агента и окружающих тканей. По сути, макрофаг (или специализированный активатор адаптивного иммунитета — дендритная клетка) просто захватывает из места воспаления образцы растворенных белков, ошмётков паразита и погибших клеток и приносит в лимфоузел.
В лимфоузле его встречают наивные (неактивированные) клетки адаптивного иммунитета — Т-лимфоциты. Каждый лимфоцит, выйдя из места своего формирования, несет на себе уникальный рецептор, который формируется путем направленного внесения мутаций в геном. Заранее неизвестно, может ли этот рецептор распознать какой-либо антиген, но его вариантов так много (по некоторым оценкам, у нас может быть до 10 48 разных типов этого рецептора, но большая часть их будет нефункциональна), что в течение нескольких часов в лимфоузле обнаруживается как минимум несколько клеток, способных распознать антигены паразита. Затем эти клетки делятся, активируются и отправляются в поврежденную ткань, где отыскивают свои антигены и уничтожают как самих захватчиков, так и зараженные клетки, если мы говорим о вирусе или внутриклеточной бактерии (рис. 6).
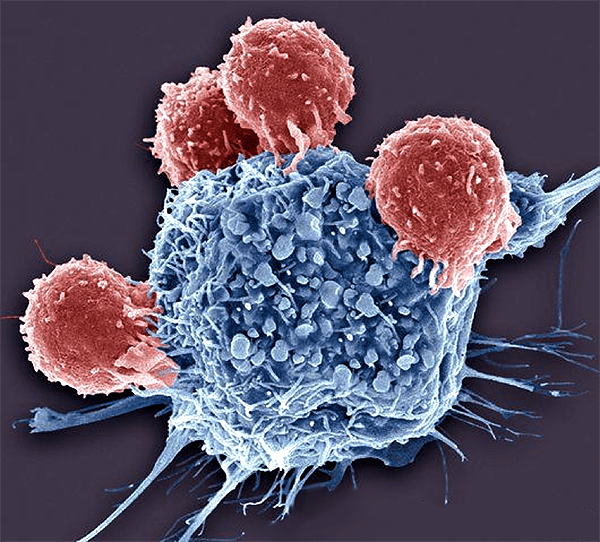
Иммунологическая толерантность
Иммунная система — единственная из систем организма, в чью задачу входит уничтожение других живых существ — отдельных клеток или многоклеточных организмов. Причем наши собственные клетки тоже часто должны уничтожаться, если они заражены вирусом, бактерией или превратились в раковые. При этом необходимо избегать иммунного ответа на нормальные клетки. Если такой ответ развивается — возникает аутоиммунное заболевание.
Чтобы этого избежать, в нашем организме есть система создания иммунологической толерантности — защиты «своего» от иммунитета. Центральная толерантность заключается в уничтожении в процессе развития тех Т-лимфоцитов, которые мутировали свои рецепторы так, что они могут узнать и атаковать свои антигены. Часть таких лимфоцитов из убийц превращается в защитников (так называемые регуляторные Т-лимфоциты) — они узнают заведомо «свой» антиген и подавляют любой иммунный ответ против него.
Периферическая толерантность возникает, когда Т-лимфоцит распознает антиген в лимфоузлах, но никакого воспаления в месте, откуда этот антиген попал в лимфоузел, нет. Напротив, высока концентрация противовоспалительных молекул. Такой лимфоцит опять-таки или уничтожается, или превращается в регуляторный.
Паразиты и симбионты
Миллиарды лет эволюции крупные многоклеточные организмы были домом и едой для более мелких одноклеточных и многоклеточных. Человек тут не исключение — ведь мы являемся как хорошим источником пищи, так и отличным защитником для всего, что сумеет поселиться внутри нас или на нас.
Эволюция поделила этих сожителей на 2 большие группы — паразиты и симбионты. Паразиты делают ставку на быстрое размножение. У них есть возможность подавления врожденного иммунитета, а пока адаптивный активируется, они уже успевают размножиться за счет наших ресурсов и передать инфекцию дальше. Так действует, например, вирус гриппа или бактериальная пневмония.
Симбионты же научились подавлять как врожденный, так и адаптивный иммунитеты. Для этого им пришлось умерить свои аппетиты — если клетки организма постоянно повреждаются, то никакие уловки не смогут предотвратить активацию иммунитета. Потому они поселились на поверхностях нашего тела, прежде всего на поверхности ЖКТ, где они получают лишь часть нашей пищи, но не покушаются на сам организм.
Помимо этого, они научились подавлять воспаление, выделяя вещества, которые похожи на наши противовоспалительные молекулы. Макрофаги врожденного иммунитета, столкнувшись с такими бактериями, могут почувствовать антигены клеточной стенки, но не активируются, так как подавлены противовоспалительным фоном вокруг.
Третьим механизмом защиты стала антигенная мимикрия. Для адаптивного иммунитета основным антигеном являются пептиды из белков. И многие наши симбионты в ходе эволюции поменяли свой белковый состав так, чтобы в нем был максимум пептидов, похожих на наши. Таким образом они встают под защиту регуляторных лимфоцитов. Этот механизм характерен для всех видов наших сожителей — бактерий, червей (рис. 7), вирусов и так далее.
В течение миллионов лет каждая особь нашего вида, рождаясь, сразу же вступала в контакт с симбионтами, населявшими кожу, слизистые и кишечники своих собратьев. Со временем организм научился извлекать выгоду из такого постоянного неустранимого сосуществования. В частности, способность бактерий и червей создавать сильный противовоспалительный фон в месте своего обитания стала за это время ключевым фактором создания периферической толерантности. Она распространилась как на антигены самих сожителей, так и на сопутствующие им — антигены пищи (в кишечнике), пыли и пыльцы (в легких) и собственного организма (те самые антигены, которые сожители развили в ходе антигенной мимикрии).
И снова гигиеническая гипотеза
Внимательный читатель уже смог уловить, где тут связь. Особенность второго эпидемиологического перехода состоит в том, что мы с вами чисты, как никогда прежде, лишены практически всех червей и многих патогенов. Ребенок видит свою первую грязь или лужу отнюдь не в первые дни жизни, как раньше. Антибиотики и правила гигиены, центральное водоснабжение и мытье асфальта шампунем несомненно сделали нашу жизнь лучше. Но незаметно для себя вместе с «грязью» мы также начали устранять из своей жизни и часть тех самых симбионтов, червей и бактерий (а по мнению некоторых ученых — и некоторых вирусов), которые помогали нам создавать толерантность к собственному организму и аллергенам окружающей среды.
Уже сейчас мы имеем доказательства того, что заражение некоторыми видами симбиотической флоры ведет к снижению частоты многих аутоиммунных заболеваний [9], [10]. Это как раз та самая флора, которая широко представлена в странах третьего мира и почти не представлена в развитых странах. Пример с «остановкой» рассеянного склероза лишь самый яркий, но таких примеров намного больше. Показано, что у пациентов, зараженных таким ныне изгнанным «паразитом», повышается количество регуляторных Т-клеток, возрастает концентрация противовоспалительных молекул [9]. Изгнание симбионта возвращает все вспять. У некоторых симбионтов выявлена сильная связь с диабетом, у других — с рассеянным склерозом и так далее.
Особенно сильно на риск развития таких заболеваний влияет первый год жизни. Если в этот период ребенок оказывается в деревне, проводит некоторое время в больших группах сверстников (в больнице или в детском саду) и вообще чаще встречается с инфекциями — риск развития аутоиммунных заболеваний серьезно снижается [11], [12].
Разумеется, не только микробиом (совокупность всех симбиотических микроорганизмов конкретного человека) [13] и гельминты влияют на риск развития аутоиммунных и аллергических реакций. Есть и генетическая предрасположенность, и условия, в которых человек впервые встречается с тем или иным внешним антигеном. Есть некоторые микроорганизмы, которые не защищают, а, напротив, провоцируют аутоиммунные заболевания. Например, стрептококк способен вызывать ревматизм, а некоторые стафилококки производят суперантиген, который неспецифически запускает все клоны Т-лимфоцитов с любым рецептором — это тоже может привести к аутоиммунным заболеваниям.
Но исключения лишь подтверждают правило. Способность симбионтов и паразитов влиять, позитивно или негативно, на развитие аутоиммунных заболеваний — уже доказанный факт. Что делать с этой информацией, врачи и ученые пока не знают. Мы пробовали получать гомогенаты червей и использовать их в качестве лекарства [14]. Это не сработало. Иммунологи выясняют механизмы, с помощью которых черви достигают того, что недоступно всем врачам мира, а врачи и фармацевтические компании разрабатывают инновационные методы терапии. По состоянию на 2015 год во всем мире проводилось свыше 20 клинических испытаний «гельминтной терапии», в ходе которой пациенты принимают дозированную, полученную в стерильных условиях лучших фармпроизводств суспензию живых яиц глистов (табл.) [15]. Несмотря на неплохие результаты [16], проблемы все же остаются [4]. Например, часто гельминтов приходится удалять из-за развивающегося воспалительного заболевания кишечника. Но лучшего варианта у нас пока нет.
| Заболевание | Количество исследований | Общее количество пациентов | Результаты |
|---|---|---|---|
| Болезнь Крона | 6 | 543 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Неспецифический язвенный колит | 3 | 192 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Рассеянный склероз | 6 | 156 | Показана безопасность, статистически значимые улучшения у части пациентов. |
| Непереносимость глютена (целиакия) | 2 | 35 | Исследования только начались |
| Расстройства аутического спектра | 3 | 90 | Пилотное исследование показало эффективность, подтверждающие только начаты |
| Псориаз | 3 | 55 | Исследования только начались |
| Аллергия на арахис | 1 | 18 | Исследования только начались |
| Бронхиальная астма | 1 | 32 | Зафиксированы статистически недостоверные улучшения |
| Аллергический риноконъюнктивит | 2 | 130 | Эффективность не показана |
| Ревматоидный артрит | 1 | 50 | Исследование только началось |
О ревматоидном артрите рассказано в статье «Ревматоидный артрит: изменить состав суставов» [17], а псориазу на «Биомолекуле» посвящен целый спецпроект — «Псориаз». — Ред.
Что же делать нам, простым смертным, пока ученые по кусочкам разбирают эту тайну и ищут решение? Начать стóит со снижения маниакального стремления к чистоте во всем. Я не предлагаю не мыть руки перед едой. Но довольно часто в последнее время мы перегибаем палку. Антибиотики при каждом чихе, асептические спиртосодержащие гели каждые 10 минут, антибактериальное мыло вместо обычного в ванной. Все эти меры способны спасти вас от эпидемии. Но каждодневное их применение, особенно детьми, способно нанести куда больший урон, чем грипп или пищевое отравление.
Литература
- D.A.P. Bundy. (1988). This wormy world. Parasitology Today. 4, 234;
- Сахарный диабет I типа, или Охота на поджелудочную железу;
- D. P. Strachan. (1989). Hay fever, hygiene, and household size.. BMJ. 299, 1259-1260;
- J.O. Fleming. (2013). Helminth therapy and multiple sclerosis. International Journal for Parasitology. 43, 259-274;
- Jorge Correale, Mauricio F. Farez. (2011). The impact of parasite infections on the course of multiple sclerosis. Journal of Neuroimmunology. 233, 6-11;
- Jorge Correale, Mauricio Farez. (2007). Association between parasite infection and immune responses in multiple sclerosis. Ann Neurol.. 61, 97-108;
- Cameron S. Carter, Jeffrey W. Dalley Brain Imaging in Behavioral Neuroscience — Springer Berlin Heidelberg, 2012;
- Рассеянный склероз: иммунная система против мозга;
- A. Kramer, S. Bekeschus, B.M. Bröker, H. Schleibinger, B. Razavi, O. Assadian. (2013). Maintaining health by balancing microbial exposure and prevention of infection: the hygiene hypothesis versus the hypothesis of early immune challenge. Journal of Hospital Infection. 83, S29-S34;
- Graham A. W. Rook. (2012). Hygiene Hypothesis and Autoimmune Diseases. Clinic Rev Allerg Immunol. 42, 5-15;
- Anita Kondrashova, Tapio Seiskari, Jorma Ilonen, Mikael Knip, Heikki Hyöty. (2013). The ‘Hygiene hypothesis’ and the sharp gradient in the incidence of autoimmune and allergic diseases between Russian Karelia and Finland. APMIS. 121, 478-493;
- Okada H., Kuhn C., Feillet H., Bach J.F. (2010). The ’hygiene hypothesis’ for autoimmune and allergic diseases: an update. Clin. Exp. Immunol.160, 1–9;
- Микробиом кишечника: мир внутри нас;
- Helena Helmby. (2015). Human helminth therapy to treat inflammatory disorders- where do we stand?. BMC Immunol. 16, 12;
- J. O. Fleming, J. V. Weinstock. (2015). Clinical trials of helminth therapy in autoimmune diseases: rationale and findings. Parasite Immunol. 37, 277-292;
- Leslie M. (2016). Parasitic worms may prevent Crohn’s disease by altering bacterial balance. Science News;
- Ревматоидный артрит: изменить состав суставов;
- Jean-François Bach. (2002). The Effect of Infections on Susceptibility to Autoimmune and Allergic Diseases. N Engl J Med. 347, 911-920.
От медицины для всех — к медицине для каждого!
Статья на конкурс «био/мол/текст»: Преимущества персонализированного подхода к ведению больных очевидны. Более того, философия персонализированной медицины как взаимодействия между двумя людьми — пациентом и доктором — не нова. Именно в этой форме медицина существовала с момента зарождения врачевания как одного из типов деятельности человека. Персонализированная медицина не заменяет собой привычную нам доказательную медицину, а является надстройкой над современным зданием, построенным с помощью совместных усилий ученых и клиницистов, в результате кропотливых исследований достигших понимания функциональной регуляции организма человека и молекулярных основ патогенеза его основных заболеваний. Расскажем об основных принципах 4П-медицины.
Первоначальная версия этой статьи была опубликована на проекте atlasmed.ru. Это онлайн-журнал о персонализированной медицине, а также образовательные программы для врачей
Цель этого проекта — информировать врачей о последних достижениях в области применения геномных и постгеномных технологий в клинической практике. Для этого был создан портал, объединяющий первое в России интернет-издание по теме персонализированной медицины и образовательный видеокурс для врачей. Любой специалист, который интересуется современными направлениями в здравоохранении, может совершенно бесплатно в формате дистанционного обучения прослушать лекции известных ученых в области персонализированной медицины.
В интернет-журнале «Персонализированная медицина» можно найти авторские статьи и новостные обзоры самых важных исследований, событий и технологий в этой области, которые уже вошли в практику или в перспективе сильно изменят подходы к лечению пациентов.
Обратите внимание!
Эта работа опубликована в номинации «лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Клиническая наука нового поколения — яркие открытия и ежедневные разочарования
В результате двух последних научных прорывов — геномного и постгеномного — сначала была определена полная последовательность генома человека [1], а потом описаны генные варианты, различающиеся по своей частоте у народов мира. Развитие методов секвенирования нового поколения (Next Generation Sequencing — NGS) [2–4] и других постгеномных технологий, в том числе полногеномного исследования ассоциаций (GWAS) [5–7], позволило выявить редкие генные варианты, вносящие значительный вклад в риск развития многих хронических заболеваний человека. Дорогие методы исследования, ранее применявшиеся лишь отдельными коллективами, занимающимися фундаментальной наукой, подешевели и стали доступными для внедрения в клинику. Например, онкологи получили возможность узнать об онкогенных мутациях в опухоли конкретного больного по результатам анализа внеклеточной фракции ДНК, выделенной из плазмы, а врачи-генетики — направить больного на анализ всех кодирующих участков (экзонов) его генома. Казалось, что череда научных прорывов должна привести к немедленному результату, который мы сможем почувствовать, посетив кабинет обычного участкового врача. К сожалению, этого пока не произошло по целому ряду причин, главная из которых — это колоссальный разрыв между наукой и практической медициной.
Разрыв заключается вовсе не в невозможности масштабного применения персонализированных медицинских технологий и не в высокой стоимости сложного оборудования, а в том, что наука и медицина работают в принципиально разных системах координат. Ученые выявляют общие закономерности патогенеза, объединяющие больных со сходными картинами заболевания в одну группу. Практикующий врач работает с индивидуальными случаями этого же заболевания. «Традиционная» логика взаимодействия между врачами и учеными отражена в концепции доказательной медицины, в основе которой лежит оценка эффективности и безопасности методик диагностики, профилактики и лечения в клинических исследованиях [8]. В рамках доказательной медицины качественность доказательности оценивают по достоверности исследования. Относительная силы доказательств убывает в следующем порядке:
- Мета-анализ или систематический обзор рандомизированных клинических испытаний;
- Рандомизированное контролируемое испытание;
- Нерандомизированное испытание с одновременным контролем;
- Нерандомизированное испытание с историческим контролем;
- Когортное исследование;
- Исследование типа «случай-контроль»;
- Перекрестное испытание;
- Результаты наблюдений над когортами больных;
- Описание отдельных случаев.
Восемь наиболее весомых уровней доказательства опираются на одновременную работу с большой, однородной группой больных с одинаковой патологией, что позволяет получить статистически неоспоримые доказательств, что у большинства больных в данной группе определенный способ терапии привел к успеху. Сила данного подхода очевидна — доказательная медицина выявляет наиболее эффективные способы лечения для данной нозологии. В течение последних двадцати лет методы доказательной медицины принесли ощутимые плоды, заметно подняв общий процент успеха в лечении многих острых и хронических патологий человека.
Однако, в основной особенности доказательной медицины — работе с однородными группами больных — кроется ключевое ограничение. Врач, следуя методологии доказательной медицины, по сути занимается лечением среднестатистической популяции и надеется, что случай его пациента окажется типичным. Расчет делается на то, что особенности конкретного больного, подвергающегося лечению, будут иметь меньшее значение, чем общие сходства клинической картины с течением заболевания у пациентов, принимавших участие в том или ином рандомизированном клиническом исследовании. Только принимая эти допущения, можно надеяться, что эффект от назначенного лечения будет сходен с эффектом, отмеченным в ходе клинического испытания. С этих позиций многие эксперты обозначают доказательную медицину как медицину, основанную на надеждах.
Итак, доказательная медицина работает с группами людей, в то время как врачу приходится лечить конкретного больного. Организм человека — это сложная система, состоящая из многих миллионов типов органических молекул, организованных в клеточные структуры с многоуровневым контролем регуляции. Доказательная медицина предполагает наличие достаточно простой типологии этих живых систем, различающихся по типу отклонения системы от ее начального, равновесного (или здорового) состояния. Такая типология известна врачам как систематическое описание нозологий, действительно помогающее ориентироваться в многообразии возможных патологических состояний. Это означает, что система нозологий — это не что иное, как сетка координат. Как один больной отличается от другого с таким же заболеванием, так и здоровые люди несходны между собой. Различия накапливаются из-за разницы в стиле жизни, которая накладывается на большое количество полиморфных вариантов, обусловливающих разнообразие наших геномов. Совокупности молекулярных различий между индивидуумами, хорошо знакомые каждому врачу, учтены в рамках персонализированной медицины. В отличие от медицины доказательной, основанной на надежде, на (математическом) ожидании в как можно более крупных выборках больных, персонализированная медицина основана на доказательствах, полученных в значительно более узких выборках людей — выборках со сходными генотипами, или другими четко определенными критериями включения и исключения.
Таким образом, развитие современной медицины проделало полный круг, подчеркивая значение индивидуальных особенностей конкретного пациента на новом, более высоком уровне. Эти особенности на интуитивном уровне всегда принимались во внимание врачами, относящимися к клинической практике как к «врачебному искусству».
Персонализированная медицина не подменяет собой доказательную медицину путем отказа от объединения пациентов в однородные группы. Персонализированная медицина предполагает дальнейшее дробление (стратификацию) этих групп, а соответственно, и нозологических координат в соответствии с основными особенностями генома, биохимических анализов или образа жизни (биомаркерами). При этом из большого числа возможных особенностей выбирают только те, что имеют прямое, функционально-увязанное отношение к течению патологии или основного лекарственного препарата. Как и в доказательной медицине, в персонализированной медицине решения о применении профилактических, диагностических и лечебных мероприятий принимаются на основе имеющихся доказательств их эффективности и безопасности, но относительный вес этих доказательств рассчитывается для конкретного пациента с учетом совокупности его индивидуальных особенностей. Таким образом, персонализированная медицина не заменяет собой доказательную медицину, а является надстройкой над современным зданием, построенным с помощью совместных усилий ученых и клиницистов, в результате кропотливых исследований достигших понимания функциональной регуляции организма человека и молекулярных основ патогенеза его основных заболеваний.
Плодотворность взаимодействия персонализированной и доказательной медицины
Давайте рассмотрим на нескольких гипотетических примерах, как эффективно работают вместе доказательная и персонализированная медицина.
Первый пример: разработка нового лекарства, излечивающего рак прямой кишки
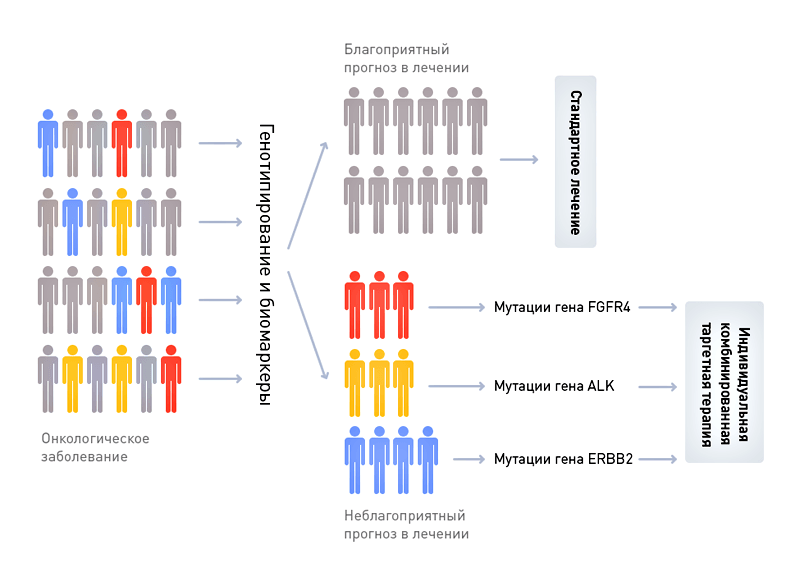
Фармацевтическая компания «Ягодка» в рамках доказательной медицины работает над созданием нового препарата «Мираклин», убивающего клетки рака прямой кишки. Потратив 200 млн долларов (поверьте, это весьма скромная цифра), компания «Ягодка» завершила доклиническую (50 млн долларов) и первую (150 млн долларов) фазы клинических испытаний и доказала относительную безопасность «Мираклина», который не вызвал опасных для жизни осложнений ни у одного из 30 больных с метастазами рака прямой кишки. Потратив еще 200 млн долларов, компания «Ягодка» начала вторую фазу испытаний «Мираклина», призванную доказать его более высокую эффективность по сравнению с общепринятым методом лечения.
В ходе второй фазы препарат был испытан с участием 150 больных метастатическим раком прямой кишки, в то время как другие 150 больных получили стандартное лечение. В результате в группе больных, получивших «Мираклин», средняя продолжительность жизни с начала курса терапии составила 155 ± 89 дней, в то время как в группе, получившей стандартное лечение, средняя продолжительность жизни составила 151 ± 20 дней. Статистически достоверных различий в эффективности «Мираклина» по сравнению со стандартным лечением выявлено не было. Более того, оказалось, что в группе, получившей «Мираклин», восемь больных умерли в первый месяц после начала лечения, в то время как при стандартном лечении в первый месяц погиб только один больной (p
Фармацевтическая компания «Буревестник» в рамках персонализированной медицины работает над созданием нового препарата «Милагрол», убивающего клетки рака прямой кишки. Обратите внимание — химическая структура препарата схожа со структурой препарата, который исследовался компанией «Ягодка». Компания «Буревестник» начала с более подробных доклинических исследований метаболизма «Милагрола» и мишени его действия, в том числе влияния вариантов генов, участвующих в метаболизме препарата, на его эффективную дозу, а также подробного ретроспективного анализа активности мишени в 500 образцах карциномы прямой кишки (поэтому доклиническая фаза стоила компании «Буревестник» не 50, а 100 млн долларов). В результате доклинических исследований «Милагрола» стало понятно, что примерно 15% людей обладают так называемым «медленным» вариантом гена фермента, метаболизирующего новое лекарство. Эти люди накапливают «Милагрол» в здоровых тканях, что может привести к развитию токсического действия и к еще большему ослаблению организма, уже страдающего от опухолевой интоксикации. Именно люди с таким генным вариантом, без всякого отбора записанные в исследование «Ягодки» и пострадали от побочных эффектов препарата.
С другой стороны, оказалось, что примерно в 10% опухолей функционирование мишени для «Милагрола» критически необходимо для поддержания жизни злокачественных клеток, в то время как в 90% опухолей того же типа активированы другие, дополнительные сигнальные пути, способные поддержать опухоль в случае отключения мишени «Милагрола». Таким образом, в случае большинства больных карциномой прямой кишки лечение «Милагролом» приведет к примерно такому же терапевтическому эффекту, как и в случае стандартной схемы химиотерапии, а у 10% будет достигнуто полное излечение опухоли.
Поэтому компания «Буревестник» построила первую фазу клинических испытаний следующим образом. По протоколу клинических испытаний первой фазы было проведено генотипирование всех потенциальных участников, и допущены были только обладатели стандартного генотипа, в то время как больные с «медленным» вариантом гена были сразу направлены на стандартную терапию, менее опасную для их здоровья. Как и в случае препарата компании «Ягодка», первая фаза испытаний «Милагрола» не выявила опасных для жизни побочных эффектов. Однако разница все же была. «Мираклин» от «Ягодки» проскочил первый этап клинических испытаний случайно, лишь потому, что группа больных, принимавших препарат, была относительно невелика (30 человек). Другими словами, компании «Ягодка» повезло, что у 4–5 больных с «медленным» вариантом метаболизирующего фермента токсические эффекты препарата не привели к печальному исходу и досрочному прекращению испытаний. «Буревестник» же исключил больных с «медленным» вариантом фермента, метаболизирующего «Милагрол», из группы испытуемых, и поэтому прошел первую фазу испытаний «твердо», без скидки на случай.
В ходе второй фазы «Милагрол» был для начала испытан лишь в специальной группе больных — а именно лишь тех, чьи опухоли критически зависели от мишени для «Милагрола». Да, таких больных было мало — лишь 10% от всех случаев карциномы кишечника, поэтому компания «Буревестник» не могла рассчитывать на сверхприбыли. Однако вторая фаза испытаний оказалась весьма успешной: средняя продолжительность жизни больных, пролеченных «Милагролом», составила 415 ± 57 дней, в то время как в контрольной группе, получавшей стандартную терапию, она составила 162 ± 23 дня. Различия были не просто достоверны статистически, а прямо-таки видны невооруженным глазом, поэтому прохождение препарата через дальнейшие фазы исследования было ускорено — ведь он продлевал жизнь больных с метастазами почти в три раза! Препарат «Милагрол» также успешно преодолел и третью фазу испытаний, а затем был одобрен, но только для весьма специфической группы больных — только для тех, чьи опухоли зависят от функционирования мишени для «Милагрола», а геномы не содержат «медленного» варианта гена, метаболизирующего препарат. Продавая «Милагрол» в течении двух следующих лет, компания «Буревестник» смогла заработать достаточно для проведения еще одной серии испытаний, которая доказала, что добавление «низкой», более безопасной дозировки препарата «Милагрол» к стандартной схеме химиотерапии позволяет достичь продления жизни больных в среднем на 90 дней, что было достаточно для расширения показаний для препарата. Препарат «Милагрол» стал блокбастером, компания «Буревестник» — источником радости для ее акционеров, а главное — путем персонализированной стратификации больных был достигнут значительный успех в терапии метастатической карциномы прямой кишки.
Этот вымышленный пример не так уж далек от истины. Таргетные препараты уже одобрены для лечения многих злокачественных опухолей, в том числе рака молочной железы, кишечника, многих типов лимфом и лейкозов. Однако в своей повседневной практике врач общего профиля практически не сталкивается с таргетными препаратами для терапии опухолей. Работа с данными лекарственными средствами является уделом узких специалистов, наблюдающих только одну группу больных, например, пациентов с карциномой молочной железы. Поэтому мы перейдем к другому примеру, более близкому для практикующего врача.
Второй пример: выбор стратегии для терапии гепатита C
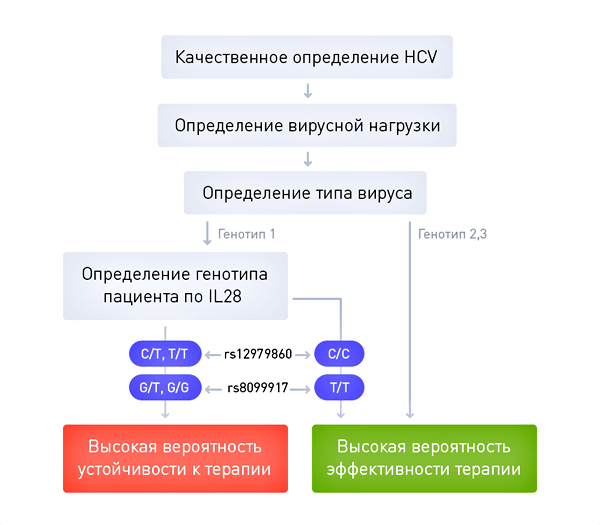
Текущим стандартом лечения гепатита С в России является сочетание пегилированного интерферона и рибавирина. К сожалению, данный вид терапии, сопровождающийся частым развитием неблагоприятных побочных явлений, излечивает лишь примерно 50% больных, зараженных вирусом с генотипом 1, составляющим большинство инфекций в России. На практике это означает, что каждый второй больной проходит длительный курс тяжелой терапии лишь для того, чтобы выяснить, что усилия, время и деньги были потрачены зря.
В рекомендациях есть раздел, посвященный так называемой тройной терапии вирусного гепатита С: пегилированные интерфероны + рибавирин + третий препарат (ингибитор протеазы). Такая комбинация способна помочь примерно 90% больных, зараженных вирусом с генотипом 1, то есть является намного более эффективной. Ингибиторы протеазы — это препараты, напрямую воздействующие на вирус гепатита С. Некоторые из этих препаратов уже зарегистрированы в России, но не входят в «Перечень жизненно необходимых и важнейших лекарственных препаратов» и в «Постановление о финансировании закупок препаратов для лечения ВИЧ и гепатитов B и C». Соответственно, цена на них не регулируется, а их доступность для пациентов крайне ограничена. По данным портала государственных закупок, их стоимость за курс лечения может достигать 2 млн рублей, что недоступно для большинства больных.
К счастью, во многих случаях проблему можно решить с помощью персонализированного подхода. Оказалось, что эффект от лечения «простой» комбинацией пегилированного интерферона и рибавирина зависит от генотипа больного. Успех лечения во многом зависит от генетического полиморфизма в гене IL28B, определяющем активность близлежащего гена, кодирующего интерферон лямбда 4. Пациенты, имеющие обычные аллели гена IL28B, с гораздо большей вероятностью достигают излечения с помощью двухкомпонентной (стандартной) терапии, чем лица с достаточно часто встречающимся активным вариантом этого гена (17% европейской популяции). Таким образом, генотип больного является важнейшим фактором для принятия решения — больные с обычными копиями гена IL28B могут начать с «простой» комбинации лекарственных средств, субсидируемой государством, а пациентам с дополнительной активностью этого генного локуса придется искать средства на оплату дорогого препарата нового поколения. Важно отметить, что определение вариантов гена IL28B проводится в России уже сейчас, стоит в пределах тысячи рублей, а значит, является вполне доступным. Это означает, что применение подходов персонализированной медицины уже сейчас позволяет врачу и больному принять совместное, взвешенное решение о стратегии лечения заболевания.
Концепция медицины будущего — 4П
Разобранный выше пример хорошо иллюстрирует концепцию медицины будущего, в 2008 году предложенную известным ученым, президентом Института системной биологии в Сиэттле Лероем Худом (Leroy Hood). Эта концепция основана на принципах 4П, наиболее ярко отображающих изменения в подходах к ведению пациентов, произошедшие за последние несколько лет.
Заложенные в концепции 4П принципы означают, что медицина должна стать: предиктивной (то есть, предсказательной); профилактической; партисипативной (требующей активного участия пациента), и, наконец персонализированной. Эта концепция уже сейчас претворяется в жизнь, в значительной степени благодаря заметному повышению интереса людей к мониторингу собственного здоровья, которое и является основным движителем постепенного изменения существующей клинической практики.
- Предиктивная (предсказательная) медицина: означает, что врач сможет определить вероятности развития тех или иных заболеваний и грамотно объяснить пациенту, что именно эти вероятности означают для него лично, а также помочь скорректировать его образ жизни, чтобы отложить начало серьезных заболеваний, ослабить их проявления и подобрать оптимальное лечение. В примере с гепатитом C врач предсказывает вероятность успеха применения «стандартной» комбинации пегилированного интерферона и рибавирина у конкретного больного в зависимости от его генотипа.
- Профилактическая медицина: означает, что основной объем действий врача будет направлен не на лечение заболевания, а на предупреждение начала его развития. Очевидно, что данный подход подразумевает, что пациент установит тесный контакт с врачом задолго до начала развития заболевания, а врач разработает персонализированную программу для выявления ранних признаков надвигающихся заболеваний, и, если нужно, к применению соответствующих вмешательств. Стоит отметить, что врач «будет готов» только в том случае, если у него будет возможность провести серию измерений, которая поможет отследить реакцию организма на различные изменения его состояния, происходящие в ходе естественного течения жизни: стрессы, излишества, перегрузки. В этом случае различные стрессовые ситуации служат суррогатом эксперимента, а наблюдения за ответом организма на эти стрессы позволят выявить границы индивидуальной нормы реакции.
- Партисипативная медицина (требующая активного участия пациента): эта особенность медицины будущего подразумевает активное участие пациента в процессе принятия как конкретных медицинских решений, так и в определении общей стратегии мониторинга состояния здоровья. Конечно же, принимаемые решения должны быть информированными, а значит, врачам и ученым нужно вести совместную работу над повышением общего уровня понимания основ работы человеческого организма у неспециалистов.
- Персонализированная медицина (работающая с конкретным пациентом): мы снова вернулись к понятию «персонализированная медицина», в рамках которой учитывается вся совокупность индивидуальных особенностей больного, прежде всего его генотип. Опираясь на базу данных доказательной медицины, подробно описанную в клинических руководствах, протоколах и стандартах, в рамках персонализированной медицины врач также использует базу знаний, в том числе накопленный опыт, описывающий разнообразие форм течения известных заболеваний. База знаний позволяет делить описанные нозологии в соответствии с отличительными особенностями организма больного, таким образом уходя от принципа «одно лекарство для всех». Подбирая индивидуальные схемы лечения, врач способен улучшить результаты лечения, обеспечить его безопасность и рентабельность.
Первые успехи персонализированной медицины: фармакогеномика
Конечно, нельзя ожидать, что вся медицина вдруг станет персонализированной. Однако уже сейчас можно привести ряд успешных примеров, демонстрирующих явную пользу для больных и врачей. Большинство примеров персонализированного подхода, уже воплощенных в клиническую реальность, находятся в области фармакогеномики — науки, исследующей влияние полиморфизмов, редких генных вариантов и других компонентов генетической основы ответа организма на лекарственные препараты.
Эффективность лекарственных средств и неблагоприятные побочные реакции при применении зависят от индивидуальных особенностей фармакокинетики (всасывание, распределение, метаболизм, выведение) и фармакодинамики (чувствительности молекул-мишеней рецепторов, ферментов, ионных каналов и т. д.). Указанные особенности могут меняться в зависимости от клеточной и тканевой физиологии, которая, в свою очередь, определяется сочетанием генных аллелей пациента, то есть его генотипом. Доказательства влияния генов на различные процессы, опосредующие эффекты лекарственных средств, получены почти для всех терапевтических агентов.
Аллельные варианты генов, кодирующих ферменты метаболизма лекарственных веществ, известны давно. Для их выявления не обязательно знание нуклеотидной последовательности генома больного: наличие того или иного генного варианта можно распознать с помощью измерения уровня активной формы лекарственного вещества или его метаболита в крови, то есть лабораторного теста, который проводят после принятия препарата (так называемое «фенотипирование», терапевтический лекарственный мониторинг). При таком подходе персонализация лечения происходит уже после начала лечения. Для больных с аномально высокими или аномально низкими концентрациями мониторируемого в крови лекарственного средства будет проведена корректировка дозировки.
Персонализированная медицина будущего предполагает проведение «упреждающих» фармакогеномных тестов до начала лечения или даже до начала развития заболевания. В идеале такой тест должен быть однократным. Генотипирование позволяет заранее выявить все фармакологически значимые генные варианты, и затем занести их в карту больного — на случай, если потребуется экстренное назначение какого-то лекарственного препарата из фармакогеномного списка.
Классическим примером лекарственных средств с вариабельным ответом, зависящим от генотипа больного, являются непрямые антикоагулянты, снижающие риск тромботических осложнений, в том числе варфарин. Эффективность этих препаратов доказана во множестве клинических исследований и не подлежит сомнению, однако их применение может привести к серьезным осложнениям в виде кровотечений. У носителей аллельных вариантов CYP2C9*2 и CYP2C9*3 и генотипа АА по полиморфному маркеру G3673A в гене VCORC1 антикоагулянтный эффект варфарина нестабилен, а его применение часто сопровождается кровотечениями. Следовательно, выбор антикоагулянтного препарата должен быть персонализирован, то есть должен опираться на результаты фармакогенетического тестирования. Для расчета начальной дозы варфарина можно воспользоваться калькулятором на сайте WarfarinDosing.org. Более того, результаты фармакогенетического тестирования по генам CYP2C9 и VKORC1 помогут также спрогнозировать диапазон колебаний поддерживающей суточной дозы варфарина. Таким образом, персонализированный подбор дозировки варфарина помогает снизить риск кровотечений, а также ускорить время подбора оптимальной дозы препарата. В ряде случаев результаты фармакогенетического тестирования могут стать основанием для назначения альтернативных препаратов — а именно пероральных антикоагулянтов нового поколения, не требующих коагулогического контроля и подбора дозы, например, ингибиторов фактора IIa или Xa.
Другой препарат, требующий персонализированного подхода к его назначению — клопидогрел, антиагрегант из группы блокаторов тромбоцитарных рецепторов P2Y12. Печень больных, являющихся носителями аллельных вариантов CYP2C19*2 и CYP2C19*3, генетически не способна к биотрансформации клопидогрела в его фармакологически-активный метаболит. Другими словами, носители таких генных вариантов резистентны к терапевтическому действию клопидогрела, а значит его назначение бессмысленно. При выявлении носительства CYP2C19*2 или CYP2C19*3 (в гетерозиготном или гомозиготном состоянии) рекомендуется использовать иные терапевтические схемы.
И наконец, антидепрессанты [9], которых в арсенале врача имеется целый набор. Согласно современным клиническим рекомендациям, разработанным в рамках доказательной медицины, выбор того или иного антидепрессанта определяется формой депрессии и наличием сопутствующих заболеваний пациента. Однако, по данным разных авторов, антидепрессанты оказываются неэффективными у 40% больных, причем частота нежелательных лекарственных реакций, в том числе серьезных, может достигать 24%. Очевидно, что оптимальное терапевтическое решение может быть принято лишь с учетом особенностей фармакокинетики антидепрессантов у конкретного пациента. Так, эффективность антидепрессантов из группы трициклических в основном определяется активностью цитохрома CYP2D6. При низкой активности CYP2D6 возможно повышение концентрации антидепрессанта, метаболизирующегося данным изоферментом, и вследствие этого — развитие нежелательных лекарственных реакций. В России число лиц с генотипами «медленного» метаболизма (генные варианты CYP2D6*3–10, CYP2D6*41) достигает 20–25%. При высокой активности CYP2D6 (генные варианты CYP2D6*1 и CYP2D6*2) применение стандартных доз антидепрессанта является малоэффективным из-за быстрой биотрансформации и последующего выведения этих препаратов. Понимая, каким изоферментом цитохрома Р450 метаболизируется тот или иной антидепрессант, а также зная факторы, вызывающие изменение активности того или иного изофермента цитохрома Р450 у конкретного больного, можно осуществить персонализированный выбор препарата, который, как ожидается, будет максимально эффективным и максимально безопасным. Так, при выявлении у пациентов генотипов «медленного» или «быстрого» метаболизма необходимо либо правильно подобрать дозу антидепрессанта с помощью специально разработанного алгоритма, либо выбрать антидепрессант, не метаболизирующийся CYP2D6.
Ключи к внедрению персонализированной медицины
Ключом к внедрению персонализированной медицины в клиническую практику являются информационные технологии, в частности, специально разработанные системы поддержки принятия решений о назначении лекарств. Подобные системы предупреждают врачей о возможных неблагоприятных побочных реакциях у пациентов с определенными особенностями генотипа, указывая на необходимость или, по крайней мере, желательность проведения фармакогеномного теста, а после получения результатов теста — способствуют их адекватной клинической интерпретации. В мире уже проводят масштабные проекты и по «упреждающей» фармакогеномике. Опыт проекта «1200 пациентов» Чикагского университета показал, что внедрение «упреждающих» тестов такого рода вовремя напоминает врачу о необходимости учитывать генные варианты при применении лекарственных средств, тем самым повышая эффективность и безопасность лечения [10].
Партисипативная медицина основывается на желании пациента самостоятельно исследовать информацию о своем заболевании. Современная ИТ-среда предоставляет для этого неограниченные возможности. Форумы, дискуссии, чаты, сети профессионального и тематического общения, мобильные приложения, в том числе электронные дневники самонаблюдения, устройства для лонгитюдной оценки показателей жизнедеятельности, а также «напоминатели» о приеме лекарств — это действующие элементы партисипативной медицины, способствующие повышению общего уровня понимания функционирования организма человека среди врачей и больных, а также оповещению о новых диагностических и терапевтических возможностях, становящихся доступными. Таким образом, как среди врачей, так и среди пациентов будет проходить взаимообогащение знаниями, в данном случае понимаемое как кумулятивный обмен информацией, направленный как от врача к пациенту, так и от пациента к врачу. В перспективе развитие ИТ-технологий в области персонализированной медицины должно привести к постепенному переходу от классического определения времен 17–20 веков, когда врач «пользовалъ пациента», к концепции пациента нового поколения, активно «пользующего» врача.
Партисипативная медицина подразумевает не только новый подход к взаимодействию между пациентом и врачом, но и новую систему отношений между организаторами здравоохранения и врачом, построенную с упором на эффективность внедрения технологий персонализированной медицины в клиническую практику. Широкое внедрение фармакогеномного тестирования должно ускорить наступление эры 4П. Первыми элементами партисипативной медицины станут системы поддержки принятия решений, инкорпорированные в электронные лекарственные назначения и позволяющие «на лету», при прописывании лекарства, информировать больного о возможности пройти фармакогеномный тест (и объясняющих, что именно этот тест покажет) или предупреждать о наличии у пациента тех или иных генетических особенностей, способных повлиять на фармакологический ответ (неблагоприятные реакции, резистентность к лечению), с выдачей рекомендаций по изменению тактики лечения. Подобные информационные технологии будут способствовать не только увеличению частоты обращений за геномными и постгеномными тестами, но и формированию у врачей компетенций по применению достижений персонализированной медицины на «рабочем месте».
Новое понятие нормы
Важнейшая особенность персонализированной медицины — это пересмотр понятия «норма». В настоящее время под физиологической нормой понимается среднее значение какого-либо параметра, например, концентрации глюкозы в крови, собранной от достаточно большой группы условно здоровых людей. Значения каждого из этих параметров связаны со значениями многих других биохимических показателей и постоянно меняются даже на коротких измеряемых отрезках, например, в течение суток. Поэтому вместо одной цифры, означающей точное среднее значение в популяции, врачи-лаборанты используют две: верхнюю и нижнюю границы нормы. Интуитивно понятно, что точное значение каждого биохимического показателя, находящегося «в пределах нормы», имеет значение не меньшее, чем значение показателей, находящегося за ее пределами.
К примеру, верхняя граница нормы содержания глюкозы в крови составляет 5,5 ммоль/литр. Представим себе пациента с показателем ровно по верхней границе нормы — является ли он диабетиком? Вспомним, что показатели каждого параметра постоянно меняются — получается, что один и тот же больной может быть диабетиком сегодня и вернуться в границы нормы завтра? А если он отложит визит к врачу до конца недели, да еще и на всякий случай поголодает перед посещением кабинета, преддиабетическое состояние (нарушенная толерантность к глюкозе, нарушенная гликемия натощак) или сахарный диабет будет пропущены. На этом примере видно, что мониторинг биохимических показателей крови должен проводиться гораздо чаще, чем один раз в год, и по возможности одним и тем же врачом (или врачебной киберсистемой) — только такая стратегия позволит предупредить развитие хронических заболеваний или начать их своевременное лечение.
Биомаркерные тесты как одна из основ персонализированной медицины
Небольшие сдвиги уровня того или иного измеряемого параметра сами по себе не могут служить надёжным основанием для дифференциальной диагностики заболевания. Это особенно хорошо видно на примере онкомаркеров — веществ, обычно белков или их фрагментов, вырабатываемых самой опухолью или организмом человека в ответ на развитие злокачественного процесса [11]. Для многих онкомаркеров «нормальный» уровень экспрессии сильно зависит от конкретных генных вариантов. К примеру, уровень ПСА в сыворотке здоровых людей зависит от A/G–полиморфизма в элементе ARE1 (от англ. androgen responsive element 1) гена KLK3 и/или числе повторов CAG в первом экзоне гена рецептора андрогена (AR) [12, 13]. Более того, уровень ПСА повышается не только при онкологических, но и при доброкачественных воспалительных заболеваниях простаты (ACS 2002), поэтому диагностическим критерием обычно служат концентрация опухолевого маркера, а не простое наличие его молекул в крови. Поскольку воздействие воспалительного фона стимулирует деление покоящихся предраковых клеток, граница между злокачественными и нормальными состояниями ткани оказывается размытой [14] и зависит от общего состояния организма больного, например, от наличия хронических воспалительных заболеваний, таких как плевриты и асциты [15], простатит [16], панкреатит [17], урогенитальные инфекции [18, 19] и даже хронический бронхит [20]. В связи с этим увеличение чувствительности и специфичности опухолевой диагностики за счёт обнаружения отдельного «идеального» маркера или за счёт углубленного понимания биологии уже существующих опухолевых биомаркеров представляется маловероятным. По всей видимости, будущее за диагностическими панелями, включающими десятки и сотни маркерных молекул.
В целом все тесты, количественно измеряющие уровни биологических молекул и по этому уровню позволяющие судить о состоянии организма, называют биомаркерными тестами. По принципу их практического использования биомаркеры подразделяют на антецендентные (определяющие риск развития заболеваний), скрининговые (использующиеся для выявления субклинических стадий заболевания при общем осмотре), диагностические (подтверждающие наличие заболевания), так называемые биомаркеры состояния, характеризующие относительную тяжесть заболевания, и прогностические биомаркеры (отражающие динамику течения заболевания, в том числе позволяющие оценивать эффективность лечения). Биомаркеры можно классифицировать и по-другому, а именно по степени их связи с основным патофизиологическим или терапевтическим процессом. Так называемые биомаркеры типа 0 отражают естественную эволюцию заболевания и напрямую связаны с определенными клиническими характеристиками. Примерами биомаркеров типа 0 являются концентрация альбумина в моче, уровень глюкозы натощак, маркеры дисфункции эндотелия. Биомаркеры типа 1 отражают эффект той или иной терапевтической интервенции, а биомаркеры типа 2 являются суррогатами (surrogat endpoint biomarker) — они отражают вероятность успеха выбранной стратегии лечения или предсказательный потенциал диагностической процедуры на основе экстраполяции доказательств, полученных в ходе клинических исследований, проведенных в небольшой группе пациентов на общую выборку всех больных. В качестве примера суррогатных биомаркеров можно привести активность аспартатаминотрансферазы (АсАТ) и аланинаминотрансферазы (АлАТ) при заболеваниях печени, а также концентрацию глюкозы у пациента с уже диагностированным сахарным диабетом [21].
В рамках так называемого SMART-определения биомеркера каждый внедряемый в клиническую практику биомаркер должен быть:
- S — specific and sensitive — чувствительным и специфичным;
- M — measurable — измеряемым;
- A — available and affordable — доступным и недорогим;
- R — responsive and reproductive — воспроизводимым;
- T — timely — своевременным.
И тестирование биохимических показателей крови, и измерение онкомаркеров является примером использования биомаркеров. Инженеры постоянно совершенствуют чувствительность оборудования для измерения уровня индивидуальных биомаркеров. Ученые и клиницисты работают над выявлением и валидацией новых биомаркерных молекул, для многих из которых связь с патогенезом неочевидна. За последние 15 лет количество зарегистрированных для клинического применения биомаркеров, а также число опубликованных сообщений о нахождении новых биомаркеров росло экспоненциально, что привело к отсутствию практической пользы от постгеномных данных для врача.
Как же разобраться в море биомаркерных тестов и научиться правильно применять эти тесты?
Правильная интерпретация результатов биомаркерного теста возможна при использовании подходов персонализированной медицины, которая в качестве объекта наблюдения рассматривает конкретного человека, не сравнивая его с другими. Персонализированная медицина не отказывается от основного метода доказательной медицины — работы с множеством измерений и наблюдений и достижением информированного вывода путем применения статистических процедур, а развивает этот метод, используя сравнение множества единичных измерений биологических параметров, в том числе биомаркеров, собранных в течение жизни пациента. Заключения о важности измеренного значения уровня того или иного биомаркера принимаются с учетом общей (долгосрочной) динамики молекулярного профиля индивида и статистической значимости выявленных трендов, отражающих постепенное изменение состояния его организма. Такая концепция ведения больного «на плечах» доказательной медицины продвигается еще на шаг вперед, сопоставляя не уровни отдельных биомаркеров в группах больных и здоровых людей, а цельные, непрерывные профили изменений этих уровней с течением времени и в зависимости от событий в жизни человека, то есть выявляет границы ситуационной изменчивости.
В рамках доказательной медицины изменения, связанные с циркадным ритмом, нарушения в образе жизни, диете и среде обитания вследствие возросшей мобильности, взаимодействие человека с быстро эволюционирующей техногенной средой на порядок усложняют задачу поиска надежных молекулярных «предвестников» ранних стадий заболевания. В рамках персонализированной медицины те же самые переменные факторы помогают выявить «ключевые точки» патогенеза. Это произошло в лонгитюдном эксперименте по мониторингу состояния индивида, позволившему «подопытному» ученому Майку Снайдеру «перехватить» начало развития диабета после регистрации неожиданного скачка в уровнях некоторых, ранее никак не связанных с диабетом молекул при постоянном их измерении [22].
В рамках этого весьма дорогостоящего эксперимента, проведенного с помощью постгеномных технологий, профессор Снайдер получил точное описание своего «Интегративного многокомпонентного персонального профиля» (integrative personal omics profile, iPOP), включающего информацию о последовательности генома и результаты многократного количественного измерения стандартных биохимических параметров, уровней всех мРНК, а также белков и многих других биологических молекул на протяжении 14 месяцев эксперимента. За это время каждый анализ был проведен 20 раз, что привело к созданию трех миллиардов индивидуальных записей о результатах индивидуального анализа. Все эти записи подвергались непрерывному анализу, и, когда на 299 день эксперимента профессор Снайдер заболел простудой, а точнее, был инфицирован респираторно-синцитиальным вирусом, его лонгитюдный iPOP-профиль значительно изменился. Примерно 10% от общего числа генов изменили свою активность, что свидетельствовало о серьезности переносимого стресса. Действительно, вскоре после выздоровления, анализ того же iPOP-профиля показал увеличение уровней глюкозы и гликозилированного гемоглобина HbA1c, то есть нарастания толерантности к действию инсулина. Важно отметить, что Снайдер выступал в этот исследовании и как научный монитор своего собственного профиля, и как пациент. Получив биомаркерный сигнал о неблагополучии в своем организме, профессор Снайдер снизил гликемическую составляющую диеты и увеличил физические нагрузки, что позволило вернуть уровень глюкозы к норме [23].
Полномасштабное iPOP-профилирование пока недоступно подавляющему большинству пациентов. Да это и не нужно. Лонгитюдное профилирование представляет важную информацию и в случаях, когда многократно измеряют не сотни тысяч, а всего лишь десятки наиболее информативных молекул. В случае профессора Снайдера диагноз начинающегося диабета можно было поставить по результатам многократного измерения всего лишь трех важных маркерных молекул, находящихся в арсенале любого врача, а именно глюкозы, инсулина и гликированного гемоглобина HbA1c. Тем не менее, значение результатов, полученных в исследовании профессора Снайдера, нельзя переоценить. Его работа проложила путь к новому видению роли врача как активного наблюдателя за состоянием гомеостаза организма — наблюдателя, в случае необходимости готового к терапевтическому вмешательству.
Таким образом, в персонализированной медицине метод пассивного наблюдения, со времен Гиппократа поддерживаемый важнейшим для врача принципом «не навреди», впервые получает возможность приблизиться к значительно более сильному, но невозможному для практикующего врача экспериментальному методу исследования. В качестве суррогата эксперимента выступают надлежащим образом задокументированные и отслеженные с помощью биомаркеров «нагрузочные тесты», неизбежно случающиеся в жизни каждого человека. Типичным примером такого теста может быть смена часовых и климатических поясов при поездке в отпуск или в командировку. Реакция на физические нагрузки (человек занимается триатлоном), на пиковое эмоциональное напряжение документируется; при этом вся совокупность наблюдений формирует лонгитудинальный молекулярный профиль, который, вместе с генетическим паспортом, становится основой для персонализированного лечения.
Конечно, до повсеместного внедрения многоразового профилирования множества биомаркеров у одного и того же пациента пока далеко. Однако уже сейчас можно предсказать, что развитие персонализированной медицины приведет к полному изменению структуры «пирамиды внимания» практикующего врача. В настоящее время чем сложнее и тяжелее болезнь пациента, тем глубже его взаимодействие с врачом — чаще назначаются визиты, расширяется спектр назначаемых инструментальных исследований, в результате множества последовательных измерений уточняются параметры лабораторных тестов. Адекватное выстраивание системы персонализированной медицины подразумевает, что врачи будут контактировать с клинически здоровыми людьми существенно чаще, чем с заболевшими.
В области персонализированной медицины фундаментальные исследовательские вопросы, а также вопросы практической помощи здоровым и заболевшим тесно переплетены с техническими и даже с организационными моментами. Так, проведение долгосрочных исследований требует постоянного мониторинга пациента. Нереалистично предполагать, что здоровые люди будут регулярно наблюдаться в стационаре, где они смогут каждый час ходить в лабораторию и сдавать кровь. Тем более нереалистично, что каждый собранный образец крови или другого биологического материала будет подвергнут детальному анализу в исследовательской лаборатории. Поэтому развитие персонализированной медицины предусматривает усовершенствование методов исследования биологических образцов, а также их удешевление — например, путем перехода от дорогих и «штучных» протеомных исследований к анализу профилей метаболитов. Протеомный анализ требует от 30 до 200 минут на измерение, тогда как метаболомный профиль можно определить за 30 секунд. За счет разработки системно-биологических моделей, которые позволят по метаболомному профилю экстраполировать концентрации диагностически значимых белков, можно будет сократить как время, так и себестоимость анализа.
Контуры будущего
Итак, попробуем набросать контуры будущей эры персонализированной медицины — ведь мы установили, что основы необходимых технологий уже разработаны, осталось лишь масштабировать их практическое использование, сделать их доступными каждому больному. Опыт говорит, что услуги представителей других «персонализированных» профессий, например, телохранителя или личного водителя, являются эксклюзивными, а значит, доступны далеко не каждому. А ведь общение с врачом необходимо каждому человеку. Более того, если какой-либо врач станет лечить одного-единственного пациента и, кроме этого пациента, не будет имеет дополнительной практики, это значительно снизит его квалификацию. В этом случае персонализированное поддержание здоровья одной ВИП-персоны закроет врачу дорогу к лучшему средству повышения квалификации — увеличению личного опыта, который может быть набран только в результате наблюдений за множеством больных. Разница между трудом врача и трудом личного водителя, у которого нет необходимости для расширения круга клиентов с целью повышения профессиональных навыков, — огромна.
Мир, в котором мы живем, представляет собой систему, включающую ограниченное количество очень состоятельных людей, для которых медицина в полной мере персонализирована, значительные слои населения стран, входящие в так называемый «золотой миллиард», и огромные популяции, для которых ограничен полноценный доступ не только к персонализированной, но и к обычной медицине, осуществляемой в соответствии с принятыми стандартами. Распространение методов персонализированной медицины является одним из способов автобалансировки в настоящее время очень неравномерно доступной системы медицинских услуг. Увеличение затрат на диагностику и лечение пациентов из популяций, ранее получавших лишь рудиментарное медицинское обслуживание, напрямую «выгодно» и тем, кто не может пожаловаться на качество базовой врачебной помощи, но желает ее дальнейшей персонализации. Это связано с тем, что работа с огромными массивами индивидуальных случаев, обеспечиваемая накоплением массивов данных в электронных картах, развитием коллекций биологических образцов, проведением эпидемиологических исследований, включающих сотни тысяч наблюдений, является необходимым залогом развития персонализированной медицины, которая невозможна без постоянного расширения базы знаний о полном спектре возможностей человеческого организма и репертуаре его ответов на различные физиологические и патофизиологические факторы. Хорошим примером коллективных общечеловеческих усилий является добровольное внесение индивидуальных траекторий «здоровья», ставшее возможным в связи с развитием информационно-телекоммуникационных технологий (Reality Mining) в общедоступные базы данных. Анализ этих данных способен не только способствует развитию одного из основных направлений персонализированной медицины — лонгитюдного мониторинга — но и существенно расширить наши представления о пределах нормы реакции и механизмах обеспечения гомеостаза.
Поскольку персонализированная медицина опирается на интернет-технологии, она демократична по своей сути. С одной стороны, мы можем представить себе успешного бизнесмена А, готового выделить средства на мониторинг многих миллионов людей в надежде, что полученная сумма знаний или какая-то конкретная траектория окажется полезной для него лично. С другой стороны, ничто не мешает обмену информацией о накопленных траекториях «здоровья» между слесарем Б и учителем В. Заметьте, что случаи Б и В для бизнесмена А полезны лишь в той степени, в какой они являются отдельными страницами энциклопедии, состоящей из миллиона томов. В рамках этой концепции наибольшую «пользу» приносит лишь сравнительный мониторинг здоровья всего населения, а не углубленное изучение одного единственного, пусть даже постгеномного профиля богатого больного.
Развитие постгеномных технологий неразрывно связано с развитием ИТ сферы. Именно ИТ-прорывы делаю возможной работу секвенаторов и масс-спектрометрометров — эти приборы «читают» структуры молекул благодаря возросшей частоте работы кристаллов находящихся в них микросхем и недавно преодоленных порогового объема и скорости записи на различные, в том числе, «облачные» накопители данных. Следует ожидать, что и постгеномная персонализированная медицина будет развиваться по сходному сценарию.
В настоящее время контроль за состоянием здоровья населения осуществляется с помощью механизмов, которые можно сравнить с большими электронно-счетными машинами (БЭСМ), разработанными в СССР в 1950–1970-х годах прошлого века. БЭСМ выпускались ограниченными штучными партиями под жестким контролем использования со стороны государства — что напоминает современную систему стандартов в здравоохранении. Персонализированное использование БЭСМ было невозможно, как невозможна и персонализация врачебной помощи в рамках сегодняшних медицинских стандартов. Однако в конце XX века мир изменился, и вместо БЭСМ мы сегодня имеем персональные устройства (планшеты, смартфоны, ноутбуки, персональные компьютеры), находящиеся в личном распоряжении каждого. Заметьте, что широкое распространение персональных БЭСМ не отменяет существования государственных супер-БЭСМ, в настоящее время реализованных в виде как распределенных, так и централизованных вычислительных мощностей, используемых для мониторинга общего состояния государственной системы.
Исходя из уже реализовавшегося сценария развития вычислительных технологий можно представить себе следующий сценарий развития медицины будущего. В следующем десятилетии постгеномные технологии будут актуальными для персонализированной медицины в той степени, в которой они позволят редуцировать сложный молекулярный анализ до формата еще одного приложения в смартфоне, которое позволит врачу увереннее и быстрее принять клиническое решение для конкретного пациента. Нетрудно представить, что на следующем этапе своего развития приложения для персонализированной медицины с экрана смартфона врача перейдут к пациенту, превратившись в «ответственную» самодиагностику и самолечение. Где пройдут границы такой «ответственности», пока определить невозможно, но, к сожалению, без широкомасштабных законодательных запретов этот шаг неизбежен. По-видимому, обществу придется методом проб и ошибок отыскать оптимальное решение для преодоления этой проблемы. Несомненно одно — даже при полной доступности персонализированных медицинских справочников, центральной фигурой, ответственной за здоровье человека, останется, как и в течение тысяч предыдущих лет, врач.
Заключение
Итак, мы разобрали концепцию персонализированной медицины и значение геномных и постгеномных технологий для ежедневной клинической практики. Вкратце напомним, что постгеномные технологии позволяют, образно говоря, «вглядеться» в организм отдельного человека и увидеть в нем индивидуальные молекулы, то есть составить индивидуальный «молекулярный» портрет. Однако клиническая интерпретация огромных объемов молекулярных данных — это сложнейшая задача, реализация которой запаздывает по сравнению с развитием технологий высокопроизводительного профилирования биологических молекул. Поэтому, за исключением некоторых специальностей, прежде всего онкологии, постгеномные технологии до сих пор остаются невостребованными в клинике. Этим и определяется разрыв между надеждами, возлагавшимися на постгеномные технологии в течение последних 10 лет, и фактическим подспорьем, которые эти технологии предоставляют для практической деятельности врача: оказалось, что широкое использование этих технологий в практической медицине невозможно. На настоящий момент масштабы внедрения постгеномных технологий в клиническую практику невелики, а их применение ограничено рядом конкретных клинических задач.
Преимущества персонализированного подхода к ведению больных очевидны. В онкологической практике персонализированное ведение больных уже внедрено в рамках таргетной терапии, когда те или иные лекарственные препараты назначаются после детального молекулярно-генетического исследования опухоли. Следующим шагом на пути персонализации является молекулярно-генетическое исследование организма пациента, которое по возможности должно быть выполнено на этапе, когда его организм достаточно здоров. Фармакогенетические тесты являются первым серьезным инструментом персонализированной медицины, доступным лечащим врачам неонкологических специальностей.
Философия персонализированной медицины как взаимодействия между двумя людьми — пациентом и доктором — не нова. Именно в этой форме медицина существовала с момента зарождения врачевания как одного из типов деятельности человека. Новые технологии персонализированной медицины, описанные в этой статье, например, индивидуализации применения антитромботических средств и антидепрессантов, являются дополнительным инструментом, позволяющим повысить качество оказания медицинской помощи. Как рандомизированные клинические исследования, так и мета-анализы показывают, что в определенных случаях этот инструмент весьма эффективен, а значит достижения персонализированной медицины высоко оценены и с позиций хорошо зарекомендовавшей себя доказательной медицины. Именно поэтому у многих врачей возникает проблема смыслового наполнения термина «персонализированная медицина»: ведь фактически врач и так работает с каждым пациентом в отдельности, стремясь при этом индивидуализировать свои вмешательства, а следовательно, нам стоит ожидать, что технологии персонализированной медицины будут внедряться естественным образом по мере того, как в рандомизированных исследованиях, проводимых с позиций доказательной медицины, будет наглядно продемонстрирована их польза.
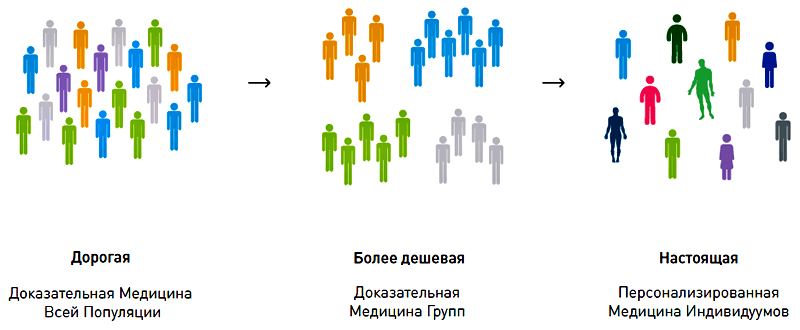
Статья написана в соавторстве с членами редакции онлайн-журнала AltasMed Дмитрием Сычевым и Марианной Ивановой, а также д.б.н. Андреем Лисицей. Исходная версия называлась «Персонализированная и постгеномная медицина».
Литература
- Геном человека: как это было и как это будет;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Код жизни: прочесть не значит понять;
- Огурцы-убийцы, или Как встретились Джим Уотсон и Гордон Мур;
- Код жизни: прочесть не значит понять;
- Перевалило за тысячу: третья фаза геномики человека;
- Загадочная генетика «загадочной болезни кожи» — витилиго;
- Evidence-Based Medicine Working Group. (1992). Evidence-based medicine. A new approach to teaching the practice of medicine. JAMA. 268, 2420–2425;
- Краткая история антидепрессантов;
- O’Donnell P.H., Danahey K., Jacobs M., Wadhwa N.R., Yuen S., Bush A. et al. (2014). Adoption of a clinical pharmacogenomics implementation program during outpatient care — initial results of the University of Chicago «1,200 Patients Project». Am. J. Med. Genet. C. Semin. Med. Genet.166C, 68–75;
- Как распознать рак при помощи биомаркеров?;
- Время обезьяньих исследований: расшифрован геном макаки резуса;
- Xu J., Meyers D.A., Sterling D.A., Zheng S.L., Catalona W.J., Cramer S.D. et al. (2002). Association studies of serum prostate-specific antigen levels and the genetic polymorphisms at the androgen receptor and prostate-specific antigen genes. Cancer Epidemiol. Biomarkers Prev.11, 664–669;
- Okada F. (2002). Inflammation and free radicals in tumor development and progression. Redox Rep.7, 357–368;
- Kalantri Y., Naik G., Joshi S.P., Jain A., Phatak S., Chavan R. et al. (2007). Role of cancer antigen-125 from pleural & ascitic fluid samples in non malignant conditions. Indian J. Med. Res.125, 25–30;
- Sandhu J.S. (2009). Management of elevated prostate-specific antigen in men with nonbacterial chronic prostatitis. Curr. Urol. Rep.10, 302–306;
- Halm U., Rohde N., Klapdor R., Reith H.B., Thiede A., Etzrodt G. et al. (2000). Improved sensitivity of fuzzy logic based tumor marker profiles for diagnosis of pancreatic carcinoma versus benign pancreatic disease. Anticancer Res.20, 4957–4960;
- Sarandakou A., Phocas I., Sikiotis K., Rizos D., Botsis D., Kalambokis K. et al. (1997). Cytokines in gynecological cancer. Anticancer Res.17, 3835–3839;
- Konety B.R. and Getzenberg R.H. (2001). Urine based markers of urological malignancy. J. Urol.165, 600–611;
- Oremek G.M., Sauer-Eppel H., Bruzdziak T.H. (2007). Value of tumour and inflammatory markers in lung cancer. Anticancer Res.27, 1911–1915;
- Kumar M. and Sarin S.K. (2010). Biomarkers of diseases in medicine. Curr. Trends Sci.15, 403–417;
- Упреки в нарциссомике;
- Snyder M. (2014). iPOP and its role in participatory medicine. Genome Med.6, 6..
Источник https://www.mediasphera.ru/issues/dokazatelnaya-gastroenterologiya/2021/1/1230522602021011038
Источник https://biomolecula.ru/articles/starye-druzia-kliuch-k-autoimmunnym-zabolevaniiam
Источник https://biomolecula.ru/articles/ot-meditsiny-dlia-vsekh-k-meditsine-dlia-kazhdogo