Мужское бесплодие: новые достижения медицины

В наши дни такая проблема, как мужское бесплодие постепенно приобретает глобальные масштабы. Статистика, которая строится на многочисленных исследованиях, гласит, что чуть ли не в 45% случаях виновником трудностей супружеской пары с зачатием оказывается именно мужчина, тогда как женщина – в 40% случаев. Остальные 15% приходятся на несовместимость пары.
К счастью, в данной сфере медицина сумела достичь впечатляющих успехов, предлагаются все новые и новые эффективные методики устранения мужского бесплодия.
Лечение лазером
Сейчас крайне трудно встретить медицинскую сферу, в которой не используются возможности лазера для лечения больных, хорошие результаты данное средство показывает и при терапии мужского бесплодия. Действие лазера производит на сперматозоиды активизирующее влияние, стимулируются энергетические процессы в организме пациента. Лазеротерапия обеспечивает повышение концентрации половых гормонов в кровяной сыворотке, ее часто используют при сокращении числа и подвижности сперматозоидов.
Самой эффективной, демонстрирующей наилучшие результаты методикой лазерной терапии в настоящий момент считается ВЛОК – технология, при которой осуществляется лазерное облучение крови внутривенно. В данном случае лазер оказывает влияние непосредственно на кровь, что приводит улучшению состояния иммунной системы, системы кровоснабжения, повышению тонуса организма в целом.
Магнитотерапия
С помощью данной технологии производится лечение воспалительных болезней мужской мочеполовой системы, которые могут являться причиной бесплодия. Лечебное действие строится на противоотечным, противовоспалительном, анальгезирующем влиянии бегущего магнитного поля, секрет успеха магнитотерапии заключается в комбинации прогрева с местной лекарственной терапией. Если у пациента с бесплодием присутствует уретрит или простатит, врачи применяют специальные ректальные и уретральные нагреватели-катетеры.
Гормональная терапия
Гормональное лечение – современная и высокоэффективная методика борьбы с мужским бесплодием. Терапия может быть стимулирующей, заместительной или подавляющей, оптимальный вид определяется лечащим врачом.
- Заместительная гормонотерапия. В данном случае лечение подразумевает введение мужчине гормона, с помощью которого восполняется нехватка внутреннего гормона. Чаще всего заместительная форма выбирается специалистами при низкой концентрации мужских половых гормонов в организме пациента, скажем, сбоях роста и развития сперматозоидов, понижении сексуальной функции, недоразвитии половых желез и так далее.
- Подавляющая гормональная терапия. Суть данного лечения состоит во введении гормональных средств (высокая концентрация), которое производится на протяжении конкретного временного отрезка, как правило, три или четыре месяца. Задача такого лечения – прекращение выработки организмом половых гормонов, остановка развития сперматозоидов. Как только введение гормонов прекращается, выработка собственных половых гормонов приобретает гораздо более интенсивный характер, становится более активной.
- Стимулирующая гормональная терапия. Используются небольшие дозы гормонов, целью является воздействие на воспалительные, иммунные и обменные процессы в организме.
Средняя продолжительность гормонотерапии составляет 12-15 недель.
Самолечением мужского бесплодия заниматься бесполезно, найти и устранить истинную причину или причины сможет только профессиональный врач-уролог. После обследования специалист назначит действительно эффективное лечение.
ЗАПИСАТЬСЯ НА ПРИЕМ К УРОЛОГУ
Уролог-андролог, врач высшей категории

Мужское бесплодие: кто виноват и что теперь делать
Как бы печально ни было это осознавать, но каждая десятая пара сталкивается с проблемами при зачатии ребёнка. В нашей стране, как и в целом по всему миру, женщины чаще склонны искать проблему именно в себе, хотя статистика показывает, что это обоснованно лишь в 40% случаев. Индивидуальная несовместимость партнёров становится причиной бездетности примерно в 15% случаев. Остальные же 45% прецедентов приходится на неспособность к оплодотворению именно со стороны мужчины.
Формы мужского бесплодия
Общеизвестен факт, что репродуктивная функция мужского организма заключается в производстве здоровых сперматозоидов, необходимых для зачатия, однако мало кто представляет, насколько сложный путь проходит эта клетка от рождения до гибели или желанного слияния с яйцеклеткой. Этот путь в медицине называют сперматогенезом. Нарушения на всех этапах этого сложнейшего процесса могут привести к бесплодию у мужчин.
Врачи выделяют две наиболее распространенные формы мужского бесплодия: секреторная и обтурационная. При секреторном виде бесплодия причина кроется в нарушении самой выработки сперматозоидов, а в случае с обтурационной формой успешно созревшие и секретирующиеся клетки по какой-либо причине не способны пройти к мочеиспускательному каналу. Эти формы настолько неоднородны по своим причинам и следствиями, что требуют более детального рассмотрения.
Причины секреторного бесплодия у мужчин
При секреторной форме бесплодия яички по той или иной причине производят малоподвижные или дефективные сперматозоиды, или же клетки здоровы, но их количество недостаточно велико для возможности оплодотворения. Виной таких нарушений всегда становится определённое воздействие на яички. Рассмотрим возможные причины секреторного бесплодия.
Варикоцеле или расширение вен яичка по варикозному типу. Это заболевание считается наиболее распространенной причиной невозможности зачатия у мужчин. Суть проблемы заключается в том, что расширенные яичковые вены приводят к застою крови и нарушению кровообращения и питания ткани яичка. Это нарушает нормальный сперматогенез, что в первую очередь влияет на количество сперматозоидов. Застой чаще всего возникает сначала в левом яичке, но заболевание может распространиться и на здоровый орган.
Водянка яичка. При этом заболевании в мошонке скапливается жидкость, которая приводит к сдавливанию яичка. Дальнейшие процессы идентичны тем, что происходят при варикоцеле. Такой же эффект может преподнести и тазовая грыжа.
Неопущение яичек в мошонку или крипторхизм. К 7 годам яички должны полностью опуститься в мошонку, и если этого не произошло, то стоит немедленно обратиться к врачу с целью устранения причин заболевания, иначе невозможно будет избежать нарушения продукции сперматозоидов.
Эпидемический паротит (свинка). Данное заболевание поражает железы организма, начиная с лицевых, но нередко доходит и до яичек у мальчиков. Если воспаление достаточно сильное и бесконтрольное со стороны врачей, нарушения функций яичек вполне вероятны.
Негативное влияние на сперматогенную функцию яичек оказывает воздействие радиации и электромагнитного излучения. Длительное влияние высоких температур также может негативно отразиться на способности мужчины к зачатию. Причинами секреторного бесплодия могут стать гормональные нарушения, сифилис, тиф, длительный приём противоопухолевых препаратов, стресс и многое другое.
Своевременное обращение к врачу может в буквальном смысле спасти мужчину от бесплодия. Кроме спермограммы, для диагностики часто необходимо сделать биопсию яичка, чтобы точно выявить заболевание. Врач-уролог после выяснения причин назначит комплекс мер по их устранению. Кроме медикаментозного лечения, обязательно используют витаминотерапию, нормализацию питания и образа жизни пациента.
Гормональное бесплодие – помогут только гормоны?
Женское бесплодие – это неспособность женщины к зачатию в репродуктивном возрасте, при этом до 15% причин связаны с редкими или вовсе отсутствующими овуляциями. О бесплодии говорят в том случае, если в течение 1 года регулярной половой жизни беременность не наступает. Это правило справедливо для женщин моложе 35 лет. Если партнерша старше 35 лет, то на самостоятельные попытки зачатия отводится не более полугода. Затем надо искать причины и действовать, т.к. с каждым годом овариальный резерв (количество фолликулов в яичниках) неуклонно снижается. Обследоваться начинает как женщина, так и мужчина.

Признаки гормонального бесплодия у женщин
Отсутствие овуляции не всегда имеет какие-то специфические проявления. У одних женщин эта форма гормонального бесплодия приводит к задержкам менструации или их длительному отсутствию, а у других – никак не отражается на менструальном цикле, то есть клинические симптомы отсутствуют.
Поставить правильный диагноз помогает ультразвуковая фолликулометрия, когда во второй фазе не определяется желтое тело, и гормональные тесты (низкий уровень прогестерона на 19-21-й день цикла). Это типичные признаки гормональных сбоев.
Помимо этого заподозрить эндокринную проблему бесплодия стоит в следующих случаях:
- избыточная масса тела и ожирение или, наоборот, дефицит веса;
- нерегулярный менструальный цикл;
- рост волос в нетипичных местах;
- чрезмерное выпадение волос, их ломкость и сухость кожи (могут быть признаками гипотиреоза);
- ранее (до 45 лет) прекращение менструаций у матери, бабушки или старшей сестры (может указывать на генетически предопределенный низкий овариальный резерв у женщин близкой степени родства).
Однако лечение проводится только после установки диагноза гормонального бесплодия и выявления конкретной причины, вызвавшей сбой в женском организме.
Причины гормонального бесплодия
Механизм овуляции у женщины достаточно сложный и состоит из нескольких фаз:
- Процесс выбора доминантного фолликула. Так, в начале менструального цикла в яичниках начинают активно развиваться около 10-20 примордиальных фолликулов. Вскоре основная их часть подвергнется обратному развитию, и только 1 (реже 2-3) продолжат развиваться дальше. Именно этот фолликул (ы) и называется доминантным.
- Процесс роста и созревания доминантного фолликула. Постепенно этот «пузырек» с яйцеклеткой внутри увеличивается в размерах. Обычно когда он достигает 18-20 мм, это расценивается как приближение овуляции.
- Выпячивание фолликула над поверхностью яичника, при этом к нему должны приблизиться фимбрии маточных труб.
- Отделение яйценосного бугорка от стенки фолликула, растворение мембраны фолликула и ее разрыв. Приблизившиеся маточные трубы должны «споймать» яйцеклетку и направить ее в маточную трубу, где в дальнейшем при благоприятном стечении обстоятельств она встретиться со сперматозоидом.
Если менструальный цикл у женщины является ановуляторным, то имеются сбои на любом из этих этапов – либо нарушен процесс выбора доминантного фолликула, либо страдает процесс роста и развития, либо нарушено отделение яйценосного бугорка и т.д.. В результате в яичнике сохраняется множество маленьких фолликулов, которые выделяют мужские половые гормоны и при этом практически не синтезирует женские, в первую очередь эстрадиол. Зачастую эти патологические изменения происходят на клеточном уровне и связаны с разбалансировкой систем регуляции. На этапе обследования важно выяснить, какой механизм страдает, и какова наиболее вероятная причина, чтобы проводить целенаправленное лечение гормонального бесплодия.
Предрасполагают к сбою овуляции следующие факторы:
- недостаточная масса тела;
- психо-эмоциональные стрессы и потрясения;
- чрезмерные физические нагрузки;
- малая продолжительность ночного сна (менее 8 часов);
- воспалительные заболевания;
- травматические повреждения головного мозга;
- инфекции, которые могут поражать высшие центры регуляции менструального цикла;
- повышенный уровень пролактина функционального или органического происхождения;
- заболевания надпочечников и щитовидной железы;
- синдром поликистоза яичников;
- искусственные прерывания беременности;
- послеродовые осложнения, в первую очередь обильные кровотечения;
- истощение фолликулярного аппарата, которое развивается с возрастом;
- хронические заболевания внутренних органов;
- эндометриоз с нарушением процесса овуляции;
- прием нестероидных противовоспалительных препаратов в повышенных дозах.
У некоторых женщин может быть сочетание нескольких причин. Такие формы гормонального бесплодия требуют более сложного лечения.
Лечение гормонального бесплодия у женщин
Цель терапии гормонального (ановуляторного) бесплодия состоит в том, чтобы индуцировать рост фолликула и подобрать оптимальные сроки для зачатия. Целенаправленно действующий препарат подбирает гинеколог на основании установленного диагноза, уровня эстрогенов в крови и причины выявленных расстройств.

Гормональная терапия при бесплодии
Стимуляционная терапия может приводить к росту большого числа фолликулов и тем самым повышать вероятность многоплодной беременности, особенно в первые 1-2 цикла ее приема. Иногда, даже несмотря на правильное применение схем стимуляции овуляции с использованием самых современных препаратов, так и не удается добиться желаемого результата. Это еще раз доказывает, что механизм овуляции достаточно сложный и многогранный, и зачастую нарушения развиваются на уровне клетки или ее рецепторного аппарата, что практически невозможно выявить объективными методами диагностики, даже самыми передовыми. В результате для женщины остается единственный шанс лечения гормонального бесплодия – программа ЭКО. Но и здесь бывают неудачи, скорее всего, связанные с отсутствием коррекции исходного состояния фолликулов и продолжающимся действием невыявленных функциональных причин.
Тонкие клеточные и молекулярные механизмы регуляции менструального цикла могут легко выйти из строя под влиянием стресса, вредных привычек, несбалансированного питания, плохой экологической обстановки, малоподвижного образа жизни, недосыпания и еще ряда причинных факторов, которые практически постоянно присутствуют в жизни современной женщины. Да, и возраст вносит свои коррективы, снижая с каждым годом шансы на успешное зачатие.
Методы аллопатической медицины широко применяются в лечении эндокринного бесплодия у женщин. С помощью фармакологических препаратов гинекологи «пытаются» заставить яйцеклетку созреть, выйти из фолликула и оплодотвориться. Но не всегда эти процессы могут быть осуществлены так, как задумано. Даже при комплексной поэтапной терапии и правильно поставленном диагнозе эффективность стимуляции овуляции составляет 60-70%. Все это в очередной раз подчеркивает, что до сих пор неизвестны детали всех этапов успешного фолликуло- и овогенеза.
Препараты при гормональном бесплодии
Многие нарушения начинают развиваться на уровне молекул и клеточного взаимодействия. Поэтому парадигма лечения гормонального бесплодия может быть дополнена нутрицевтической медициной, в рамках которой отдельно выделяется система биорегуляции. Это научное направление, которое изучает молекулярные и клеточные механизмы, позволяющие восстанавливать физиологические функции организма с помощью введения комплексов органоспецифичных белков (при гормональном бесплодии они должны действовать на уровне яичников).
Наш организм на 20% состоит из белков, многие из которых специфичны для определенных органов и отвечают за определенные функции. Оказывается, белки-биорегуляторы делают наш организм единой системой. Когда развивается белковый дефицит, происходит разбалансировка в работе всех систем организма (где-то более явная, где-то менее явная), и репродуктивная – не исключение. Со временем этом может стать причиной гормонального бесплодия.
Еще больший толчок к изучению механизмов биорегуляции дало открытие Нобелевского призера Гюнтера Блобела. Ученый в 1999 году сделал сенсационное научно-обоснованное заявление о том, что белки имеют собственные сигналы, управляющие транспортом и собственной локализацией в клетке. Этот транспортный код зашифрован непосредственно в белковой молекуле. Когда нарушается процесс саморегуляции, клетки становятся особенно уязвимыми перед воздействием неблагоприятных факторов, которые с легкостью их повреждают. В сочетании с расстроенными процессами самовосстановления это создает фон для развития сначала функциональных расстройств, а затем органических. Поэтому чтобы защитить органы от повреждения естественным образом, важно восстановить систему собственной биорегуляции и тем самым убрать невидимую невооруженным глазом причину гормонального бесплодия.
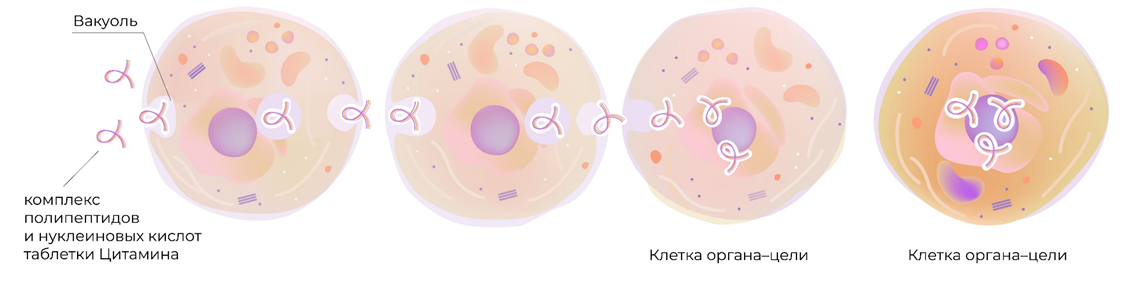
Все развитые страны мира занимаются разработкой биорегуляторных пептидов (цитаминов), которые представляют собой оптимальное белковое «меню» для определенных органов. Российские ученые разработали уникальное средство для поддержания сбалансированной работы яичников на должном уровне. Это Овариамин, который содержит пептиды, нуклеиновые кислоты, витамины и минералы. Такая терапия помогает в устранении причин гормональных расстройств.
Овариамин проявляет «адресность» воздействия, действуя точно в цель. Благодаря процессам трансцитоза, таблетки, принятые внутрь, достигают яичников в неизменном виде. Трансцитоз состоит из 2 этапов. При эндоцитозе клеточная мембрана углубляется внутрь клетки с образованием пузырька, в котором и содержится комплекс биорегуляторных пептидов. Не изменяя своей химической формулы и пространственной ориентации, вещество достигает противоположного полюса клетки. Пузырек сливается с мембраной и комплекс полезных соединений поступает во внеклеточное пространство, то есть реализуется процесс экзоцитоза. Так один механизм поэтапно сменяет другой, пока поступившие биорегуляторы в составе Овариамина не достигнут цели – яичников.

Средство рекомендуется в рамках комплексной терапии гормонального бесплодия у женщин для повышения шансов успешного зачатия, как в программах ЭКО, так и в естественном цикле.
- натуральный состав, представленный комплексами природного происхождения, содержащими пептиды, нуклеиновые кислоты, микроэлементы и витамины;
- высокая безопасность – отсутствие вреда для организма подтверждено серией исследований и выданы соответствующие свидетельства о регистрации;
- результативность – эффективность в восстановлении работы яичников подтверждена Решением Экспертов Института Питания РАМН.
Овариамин помогает защитить яичники от повреждения и позволяет улучшить процессы выбора, роста и созревания фолликулов, создавая оптимальные условия для овуляции. Рекомендуется применять как на этапе подготовки к ЭКО, так и для повышения шансов естественного зачатия. Применяется в составе комплексного лечения гормонального бесплодия.
— Вернуться в оглавление раздела «Гинекология»
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Женское бесплодие: традиционные методы лечения и экстракорпоральное оплодотворение у пациенток с эндокринными нарушениями

Врач акушер-гинеколог женской консультации, к которому впервые обращается супружеская пара с жалобами на отсутствие беременности, должен четко знать базовый алгоритм обследования, врачебную тактику, консервативные методы лечения у пациенток с эндокринными
2020-03-04 13:01
25924 прочтения
Female infertility: Traditional methods of treatment and IVF in patients with endocrine disorders E. B. Rudakova, T. V. Strizhova, E. A. Fedorova, L. Yu. Zamakhovskaya
An obstetrician-gynecologist of the women’s clinic to whom a married couple with complaints about the absence of pregnancy addresses for the first time, must clearly know the basic algorithm of the examination, medical tactics, and conservative methods of treatment in patients with endocrine disorders. The primary care specialist must also know the indications for surgical treatment and send the patient to the surgical hospital in a timely manner. When conducting examinations and traditional treatment of the detected pathology together with an endocrinologist, the obstetrician-gynecologist should always think and remember the terms of traditional treatment, in order not to miss the «Golden period» for in vitro fertilization.
Супружеские пары, страдающие бесплодием, впервые обращаются со своей проблемой к врачам акушерам-гинекологам амбулаторного приема и женских консультаций. Именно от этих специалистов зависит выстраивание наиболее оптимального алгоритма обследования и ведения таких супружеских пар. Специалист амбулаторного звена обследует на первом этапе супружескую пару, выявляет причины бесплодия в браке, определяет необходимость консультаций смежных специалистов, наличие показаний для оперативного лечения. При необходимости – направляет на хирургическое лечение, а также в клинику экстракорпорального оплодотворения (ЭКО) на консультацию к репродуктологам или для лечения с использованием вспомогательных репродуктивных технологий (ВРТ). Такая модель ведения супружеских пар, страдающих бесплодием, внедрена в Московской области. Врачи женских консультаций или специалисты кабинета бесплодия районных перинатальных центров проводят обследование, выявление причин бесплодия, консультации смежных специалистов, традиционные методы лечения. По показаниям направляют на оперативное лечение, а также на консультацию для выбора оптимальной тактики ведения либо на лечение с использованием ВРТ в ГБУЗ МО МОПЦ или ГБУЗ МО МОНИИАГ. В зависимости от клинической ситуации, вопрос о показаниях, методике оперативного лечения, а также само хирургическое лечение может проводиться в ГБУЗ МО МОПЦ или ГБУЗ МО МОНИИАГ. Такая тесная взаимосвязь врачей первичного звена, смежных специалистов, гинекологов-хирургов, репродуктологов позволяет оптимизировать ведение пациентов и повышать результаты исходов лечения.
Сегодня врачам акушерам-гинекологам хорошо известна структура бесплодия в браке, а также основные причины женского и мужского бесплодия. Основные признаки эндокринного бесплодия связаны с овариальным и менструальным циклом: аменорея, олигоменорея, ановуляция, недостаточность лютеиновой фазы. Если выявляется хотя бы один признак возможного эндокринного бесплодия, следует провести тщательное обследование, чтобы понять причины сложившейся ситуации. На долю эндокринных форм бесплодия по нашим данным приходится 18–26,9% [1], по другим данным 30–40% [2]. ЭКО на сегодняшний день считается ведущим методом преодоления бесплодия в браке. Однако эффективность программ ЭКО, несмотря на все достижения репродуктивных технологий, далеко не 100%. ЭКО нельзя считать альтернативой существующим традиционным методам лечения, которые могут быть достаточно эффективными, если применяются своевременно и по показаниям. С целью оптимизации ведения супружеских пар с бесплодием у пациенток с эндокринными нарушениями, в Московской области мы придерживаемся следующих организационных аспектов (рис.).
Ведущим признаком эндокринного бесплодия является хроническая ановуляция (реже недостаточность лютеиновой фазы — НЛФ) на фоне тех или иных гормональных нарушений, которые могут быть как причиной нарушенного фолликулогенеза, так и его следствием. С учетом патогенетических механизмов, провоцирующих нарушение овуляторной функции, всех пациенток, с целью оптимизации определения тактики ведения, рекомендуется разделить на 4 группы [2].
1-я группа: в данную группу следует относить пациенток с наличием ановуляции на фоне эндокринных нарушений, лабораторно подтверждаемых (гиперпролактинемии, гипо- и гипертиреоза, надпочечниковой гиперандрогении, метаболического синдрома, гипо- и гиперкортицизма и др.).
2-ю группу составляют инфертильные женщины с гипоталамо-гипофизарной дисфункцией (ГГД). В основном это женщины, имеющие различные нарушения менструального цикла и нормальные базальные уровни гонадотропинов (ГТ). Эту группу составляют пациентки с синдромом поликистозных яичников (СПКЯ).
В 3-ю группу с эндокринным бесплодием следует отнести пациенток с гипоталамо-гипофизарной недостаточностью (ГГН). У женщин с ГГН на фоне аменореи определяются низкие уровни фолликулостимулирующего гормона — ФСГ (менее 3 МЕ/л), лютеинизирующего гормона — ЛГ (менее 4 МЕ/л) и эстрадиола (менее 100 пмоль/л).
К 4-й группе эндокринных форм бесплодия авторы рекомендуют относить пациенток с яичниковой недостаточностью. У этой группы пациенток на фоне аменореи определяются высокие уровни ГТ (ФСГ > 30 МЕ/л, ЛГ > 50 МЕ/мл) и низкие значения эстрадиола.
Принципы и сроки традиционного лечения эндокринных нарушений при бесплодии
Коррекция выявленных гормональных нарушений в зависимости от патологии (после консультаций с эндокринологом) осуществляется в течение 3–9 месяцев с лабораторным контролем показателей.
- При нормализации гормональных показателейна фоне терапии и отсутствия беременности в течение 3 месяцев рекомендуем проводить овариальную стимуляцию (ОС)с поддержкой лютеиновой фазы на фоне продолжающейся терапии основной патологии с применением кломифена цитрата (КЦ) и/или низких доз ГТ. Внедрение в клиническую практику стимуляторов овуляции позволили достаточно успешно решать проблему достижения беременности у больных с эндокринным бесплодием (эффективность достигает 50–90%) [3].
- Направление в клинику ЭКО осуществляется (рис.):
- при отсутствии эффекта от лечения в течение не более 2 лет у пациенток до 35 лет и не более 1 года — у пациенток в возрасте 35 лет и старше;
- при сочетании эндокринных форм бесплодия с мужским и/или трубным фактором бесплодия;
- при бесплодии, вероятность преодоления которого с применением ВРТ выше, чем другими методами;
- при яичниковой недостаточности.
Врачебная тактика при наиболее часто встречающейся эндокринной патологии при бесплодии
Гиперпролактинемия
Гиперпролактинемия — состояние, характеризующееся повышенным содержанием пролактина, что является серьезным показателем неблагополучия репродуктивной системы. Частота гиперпролактиновых состояний при обследовании гинекологических больных составляет 11–47%, при скрининговом обследовании пациентов, обратившихся по поводу бесплодия, гиперпролактинемия выявляется в 18,9%, а при эндокринных нарушениях менструального цикла — в 40% [4].
Диагностика при гиперпролактинемии
- Анамнестические и клинические данные (нарушение менструального цикла по типу олигоменореи, вторичной аменореи и реже — первичной аменореи на фоне хронической ановуляции; галактореи различной степени, бесплодие, гирсутизм диагностируются у каждой четвертой пациентки).
- Гормональный скрининг: диагноз ставится после определения уровня пролактина в плазме крови при получении повышенного уровня гормона в двух образцах крови с интервалом в 1 месяц.
- Консультация эндокринолога.
- Рентгенологические методы исследования черепа и турецкого седла (назначаются по показаниям) позволяют исключить опухоли гипофиза (компьютерная томография — КТ, магниторезонансная томография — МРТ).
- Исследование глазного дна и полей зрения проводят с целью уточнения состояния оптико-хиазмальной области (по показаниям).
- Консультация нейрохирурга с целью определения показаний к оперативному лечению и обсуждения вопроса о возможности медикаментозного лечения.
Врачебная тактика при гиперпролактинемии
Для регуляции менструального цикла и овуляции назначается каберголин 0,5 мг/неделю либо бромокриптин 2,5–10 мг/сут (при условии исключения аденомы гипофиза, требующей оперативного лечения, и гипотиреоза с повышением уровня тиреотропного гормона — ТТГ) под контролем уровня пролактина крови. Критерием эффективности терапии является нормализация менструального цикла, овуляция при ультразвуковом (УЗ) мониторинге. При ановуляции рекомендуется ОС. В репродуктивном цикле, а также при проведении ОС продолжается прием препаратов каберголина (либо бромокриптина).
Гипотиреоз
2,5 мкМЕ/мл [6]. Тем более что ОС в сочетании с хорионическим гонадотропином человека (ХГЧ) в виде триггера, применяемые для лечения бесплодия, приводят к увеличению ТТГ и снижению Т4 [7]. Повышенный уровень ТТГ при ОС и в естественном цикле негативно влияет на оплодотворение ооцитов [8]. Установлено, что рецепторы к трийодтиронину (Т3) и Т4 в яичниках совместно с рецепторами к ЛГ/ХГЧ посредством влияния ФСГ воздействуют на гранулезные клетки и дифференцировку трофобласта [9, 10].
- Выявление клинических симптомов: отечность, сухость кожи (особенно на локтях), отпечатки зубов на языке, снижение памяти, замедленность реакции, выпадение волос, нерегулярный цикл, увеличение веса, выкидыши в анамнезе и т. д.).
- Ультразвуковое исследование (УЗИ) щитовидной железы.
- Определение ТТГ, Т3, Т4, антител к тканям щитовидной железе.
- Консультация эндокринолога.
Врачебная тактика при гипотиреозе
Ведение осуществляется совместно с эндокринологом. Коррекция сниженной функции щитовидной железы при необходимости (левотироксин натрия — Эутирокс 25–150 мкг/сут и др.) с поддержанием уровня ТТГ до 2,5 мкг МЕ/мл постоянно, включая репродуктивный цикл. Пациенткам с АИТ и уровнем ТТГ > 2,5 мкгМЕ/мл также показана заместительная терапия [11].
Врожденная дисфункция коры надпочечников (ВДКН) или адреногенитальный синдром (АГС)
Подтвержденный на молекулярно-генетическом уровне ВДКН (АГС) — нечасто встречаемая патология, но оказывающая при неклассических своих формах негативное влияние на реализацию репродуктивной функции. Выделяют классическую (врожденную, вирильную, или сольтеряющую) и неклассическую (пубертатную и постпубертатную) формы. Классическая форма ВДКН диагностируется при рождении. Такие больные наблюдаются у эндокринолога. В основе неклассической формы заболевания лежит рецессивно наследуемый дефицит фермента 21-гидроксилазы — мутация в одной паре 6-й аутосомы, приводящая к гиперфункции коры надпочечников и гиперпродукции андрогенов. Обычно к врачам акушерам-гинекологам обращаются больные с неклассической формой ВДКН.
Диагностика (неклассическая форма ВДКН)
- Анамнестические и клинические данные (позднее менархе, олигоменорея, выкидыши на ранних сроках, гипертрихоз).
- Определение в крови уровня тестостерона, 17-гидроксипрогестерона (17-ОНП), дегидроэпиандростерон-сульфата (ДГЭАС) (преимущественно отмечается повышение последних двух).
- УЗ-маркеры — мультифолликулярные яичники.
- Молекулярно-генетическое исследование (определение полиморфизма гена CYP21-OHB, кодирующего 21-гидроксилазу).
- Консультация эндокринолога.
Врачебная тактика при ВДКН
Для регуляции менструального цикла и овуляции назначается глюкокортикоиды — дексаметазон в дозе 2,5–5 мг/сутки,
длительность лечения 4–6 месяцев под контролем уровня андрогенов в крови. Критерием эффективности терапии является нормализация менструального цикла, овуляция при УЗ-мониторинге. При ановуляции рекомендуется ОС. В репродуктивном цикле, а также во время ОС продолжается прием дексаметазона. При наступлении беременности, во избежание ее прерывания, продолжается прием глюкокортикоидов до 16–18 недель [12]. По мнению других авторов, если плод женского пола, то с целью профилактики у него возможных гиперплазии и гиперфункции коры надпочечников лечение дексаметазоном продолжают до 36 недель [13].
Синдром поликистозных яичников (СПКЯ)
СПКЯ приводит к стойкому бесплодию и встречается у 30% пациенток, обращающихся к гинекологам, на его долю приходится 75% случаев эндокринного бесплодия. По результатам УЗИ и эндоскопии выделяют два типа поликистозных яичников, которые определяют подход к выбору методики оперативного лечения при наличии показаний:
- тип 1 — диффузное расположение фолликулов по отношению к гиперплазированной строме;
- тип 2 — периферическое расположение фолликулов по отношению к гиперплазированной строме.
Диагностика при СПКЯ
Диагноз СПКЯ принято устанавливать на основании критериев Роттердамской согласительной конференции (2003 г.) при наличии двух из трех признаков:
- олиго- или аменорея;
- клинические и/или биохимические признаки гиперандрогении;
- мультифолликулярные яичники по УЗИ, предварительно исключив гипертекоз, болезнь и синдром Иценко–Кушинга, ВДКН, метаболический синдром.
Дополнительно определяют наличие или отсутствие инсулинорезистентности.
Врачебная тактика при СПКЯ
На современном этапе успех лечения больных с СПКЯ определяется восстановлением овуляции и достижением беременности, а не излечением этой патологии, которая является хронической. Она включает в себя:
- консервативное лечение, а при отсутствии эффекта —
- хирургическое лечение (клиновидная резекция или каутеризация и др.), особенно при высоких значениях ЛГ и выраженном увеличении яичников, с последующим наблюдением или ОС (3 мес), при отсутствии наступления беременности — ЭКО;
- ЭКО.
Консервативное лечение бесплодия при СПКЯ
Врачебная тактика определяется наличием или отсутствием ожирения. При СПКЯ, осложненном ожирением, лечение проводят в два этапа, при наличии СПКЯ без ожирения — один этап (этап 2) [14–16]. На этапе 1 добиваются снижения массы тела путем соблюдения низкокалорийной диеты (до 2000 калорий/сут). При неэффективности — медикаментозная терапия: бигуаниды (метформин (Глюкофаж, Сиофор)) 1000–2000 мг/сут — 3–6 мес, ингибиторы желудочно-кишечных липаз (орлистат (Ксеникал)) по 120 мг 3 раза в день — 6–12 мес, анорексигенные препараты (сибутрамин (Меридиа, Редуксин)) 10–20 мг/сут — 3–6 мес. На этапе 2 проводится овариальная стимуляция (при исключении трубного и мужского факторов бесплодия!). Овариальную стимуляцию обычно начинают с КЦ по 50–100 мг с 5-го по 9-й дни цикла. При отсутствии реакции яичников на введение КЦ (нет доминантного фолликула) в течение 3 циклов выбранный индуктор следует расценивать как неэффективный, а пациентку считать кломифенрезистентной. В этом случае назначают в течение 3 месяцев ОС с ГТ (рекомбинантного ФСГ (рФСГ) или человеческого менопаузального гонадотропина (чМГ)), используя один из «мягких» протоколов. При наличии инсулинорезистентности — в сочетании с метформином 1500–2000 мг/сут [2, 14, 17]. Перспективным в настоящее время при СПКЯ и инсулинорезистентности считается микронутриент мио-инозитол, который восстанавливает чувствительность тканей яичника к инсулину и опосредованно играет существенную роль на заключительных стадиях созревания яйцеклетки, в период ее подготовки к оплодотворению [18].
Хирургическое лечение при СПКЯ
- Оперативное лечение СПКЯ выполняется при наличии показаний.
- Визуально неизмененные и мультифолликулярные яичники рекомендуется не подвергать какой-либо травматизации, включая воздействие моно- и биполярной коагуляции [19].
- Больным, которым планируется лечение с применением ВРТ, оперативное лечение рекомендуется не проводить [19].
Клиновидная резекция яичников показана пациенткам со значительным увеличением объема яичников независимо от типа. При типе 1 CПКЯ с незначительным увеличением объема показана каутеризация, при типе 2 без значительного увеличения стромы более показана эндокоагуляция стромы по типу демедуляции. При этом стараются не использовать монополярные электроды, отрицательно влияющие на овариальный резерв яичников [17]. Однако двустороннее вмешательство на яичниках может быть чревато вероятностью снижения овариального резерва. В качестве альтернативы предлагаются операции на одном яичнике.
Метаболический синдром
Метаболический синдром (МС) ранее был известен как нейрообменно-эндокринный синдром, протекающий по типу легкой формы болезни Иценко–Кушинга. Чаще встречаясь у женщин, чем у мужчин, МС нередко сочетается с ановуляторным бесплодием, дисфункциональными маточными нарушениями, формированием поликистозных яичников, гиперпластическими процессами в эндометрии. Метаболический синдром — сочетание ожирения и метаболических нарушений, являющихся факторами риска раннего развития атеросклероза и его сердечно-сосудистых осложнений.
Критерии диагностики МС
- Абдоминальное (висцеральное) ожирение (индекс массы тела (ИМТ) > 30 кг/м²).
- Окружность талии/окружность бедер (ОТ/ОБ) > 0,88.
- Уровень триглицеридов > 1,7 ммоль/л.
- Липопротеины высокой плотности (ЛПВП) < 1,9 ммоль/л.
- Артериальное давление (АД) — выше 130/85 мм рт. ст.
- Глюкоза крови > 6,1 ммоль/л.
- Инсулинорезистентность (индекс НОМА-IR).
- Негроидный акантоз.
- Анамнез у родстенников.
Алгоритм восстановления фертильности при МС [16].
Лечение осуществляется совместно с эндокринологом.
- Модификация образа жизни: диета, снижение массы тела, физические нагрузки.
- Планирование беременности: фолиевая кислота 400–800 мкг/сут.
- При неэффективности модификации образа жизни показан прием метформина (Глюкофаж, Сиофор) 500–1000 мг/сут, и/или сибутрамина 10–15 мг/сут, или комбинированного препарата Редуксин Мет (метформин 850 мг + сибутрамин 10/15 мг + микрокристаллическая целлюлоза).
- При восстановлении овуляции продолжается прием метформина 12 мес. В отсутствие эффекта — прием комбинированных оральных контрацептивов (КОК) на 6 месяцев с последующей овариальной стимуляцией. В случае наступления беременности прием метформина прекращается.
- При неэффективности овариальной стимуляции Клостилбегитом, гонадотропинами показано ЭКО.
Гипоталамо-гипофизарная недостаточность (ГГН)
У женщин с ГГН на фоне аменореи определяются низкие уровни ФСГ (менее 3 МЕ/л), ЛГ (менее 4 МЕ/л) и эстрадиола (менее 100 пмоль/л). По уровню поражения различают гипоталамическую и гипофизарную формы ГГН [2].
Гипоталамическая форма ГГН ассоциируется с перенесением сильного и длительного стресса, а также с истощающими физическими (в том числе спортивными) нагрузками. Гипофизарный гипогонадизм может быть спровоцирован деструктивной опухолью и другими заболеваниями, которые обуславливают формирование «пустого» турецкого седла [2].
- Анамнестические и клинические данные (нарушение менструального цикла по типу вторичной аменореи при гипоталамической форме ГГН, при гипофизарной форме — первичной аменорее, задержка полового развития, диспропорция телосложения, слабая выраженность вторичных половых признаков, гипоплазия молочных желез, матки, яичников).
- Гормональный скрининг: снижение уровня ФСГ, ЛГ, эстрадиола, прогестерона, уровень пролактина — в норме.
- Консультация эндокринолога.
- Рентгенологические методы исследования черепа и турецкого седла позволяют исключить опухоли гипофиза (КТ, МРТ).
- Консультация нейрохирурга с целью определения показаний к оперативному лечению и обсуждения вопроса о возможности медикаментозного лечения.
- Генетическое исследование: как правило, выявляется женский кариотип и половой хроматин. У 14,5% пациенток имеется высокая частота хромосомных аберраций, что следует учитывать при определении дальнейшей тактики перед принятием решения о проведении овариальной стимуляции [4].
- УЗИ малого таза — гипотрофия эндометрия, наличие фолликулярного аппарата (в отличие от яичниковой недостаточности).
Врачебная тактика при ГГН
- Перед началом овариальной стимуляции следует проводить подготовительную циклическую заместительную гормональную терапию не менее 3–4 циклов. Критерием подготовленности пациенток к циклам стимуляции овуляции является позитивная динамика изменения толщины эндометрия по УЗИ (10–12 мм) [2].
- Следующим этапом является контролируемая ОС (КОС) препаратами ГТ, которые содержат комбинацию ФСГ и ЛГ (например, чМГ).
- При отсутствии наступления беременности в течение 4–6 месяцев следует направлять пациентку в клинику ВРТ.
Яичниковая недостаточность
У пациенток с яичниковой недостаточностью на фоне аменореи определяются высокие уровни ГТ (ФСГ > 30 МЕ/л, ЛГ > 50 МЕ/мл) и низкие значения эстрадиола. Аменорея чаще носит вторичный характер, реже — первичный, что связано с разнообразием причин и факторов, вызывающих подавление функции яичников в периоде после становления менархе. Яичниковая недостаточность может быть проявлением:
- дисгенезии гонад;
- синдрома преждевременной недостаточности яичников (ПНЯ);
- синдрома резистентных яичников;
- возрастных (менопаузальных) изменений яичников;
- хирургической менопаузы (при удалении или субтотальной резекции обоих яичников).
Врачебная тактика при яичниковой недостаточности
Традиционно у таких пациенток, с учетом бесперспективности стимуляции овуляции, для достижения беременности рекомендовано использование программ экстракорпорального оплодотворения с использованием донорских ооцитов — ЭКО-ДО. Пациентки к этой категории направляются в клинику ВРТ. Программы такого рода выполняются только с согласия пациентки-реципиента и ее супруга при наличии полноценной матки, способной выносить беременность, и фертильной спермы мужа.
Настоящим прорывом в репродуктивных технологиях стала методика IVA (In Vitro Activation), разработанная профессором Казухиро Кавамура (Kazuhiro Rawamura) в 2010 г., основанная на активации «спящих» яйцеклеток в яичнике. Методика направлена на лечение больных с ПНЯ. Найдены сложные генетические механизмы, сдерживающие переход преантральных фолликулов в антральные. Преантральные фолликулы нечувствительны к препаратам ГТ, которые используются в программах ВРТ. Однако антральные фолликулы уже отвечают на воздействие (стимуляцию) ГТ ростом и созреванием в них яйцеклеток. Методика, разработанная профессором Кавамуро, представлена двумя этапами. Технология активации происходит вне человеческого тела, в лаборатории ЭКО. Абсолютно необходимым этапом является лапароскопическая операция на яичниках пациентки и высокотехнологичное получение ткани яичника. Вторым этапом методики является возвращение активированной ткани яичника в тело пациентки, также во время лапароскопии. После процедуры ткань самостоятельно развивается, продуцируя фолликулы. У женщины появляются собственные менструации. При проведении овариальной стимуляции можно получить яйцеклетки, пригодные к оплодотворению. Метод профессора Кавамуры привел к рождению детей. В России впервые такая процедура была проведена на базе ФГБУ НМИЦ акушерства, гинекологии и перинатологии им В. И. Кулакова 6.03.2019 г. профессором Л. В. Адамян. Оперативное вмешательство было выполнено по японскому протоколу с модификацией. Состояло из иссечения участка коркового слоя яичника, последующей его фрагментации и одноэтапной реимплантации в толщу яичника лапароскопическим доступом. На базе Центра проведено 29 подобных операций, 14 стимуляций у пациенток после методики IVA, получено суммарно 16 ооцитов, перенос — 2 бластоцист 2АВ, криоконсервировано 8 бластоцист. Проведение подобной операции дает возможность женщинам с ПНЯ иметь генетически родных детей, единственным способом достижения беременности у которых до недавнего времени было использование вспомогательных репродуктивных технологий с использованием донорских ооцитов, от чего пациенты часто отказывались [20, 21].
Заключение
Несмотря на все достижения и внедрение передовых репродуктивных технологий, эффективность методики ВРТ далека от 100%. ЭКО не стоит считать «волшебной палочкой», при взмахе которой супружеская пара, страдающая бесплодием, тут же получит долгожданную беременность. ЭКО нельзя считать альтернативой существующим традиционным методам лечения, которые могут быть достаточно эффективными, если применяются своевременно и по показаниям. Врач акушер-гинеколог, к которому впервые обращается супружеская пара с жалобами на отсутствие беременности, должен четко знать базовый алгоритм обследования, врачебную тактику, консервативные методы лечения у пациенток с эндокринными нарушениями, своевременно направить на консультацию к эндокринологу. Специалист первичного звена также должен знать показания к хирургическому лечению, своевременно направить пациентку на хирургическое лечение. Проводя обследования и традиционное лечение выявленной патологии, врач акушер-гинеколог всегда должен думать и помнить о сроках традиционного лечения, чтобы не пропустить «золотой период» для проведения ЭКО. Если супружеская пара попадает в клинику ЭКО (ВРТ), то, при необходимости, она углубленно обследуется, проводится коррекция всех выявленных отклонений и ей подбирается индивидуальная программа для реализации репродуктивной функции. В нашем отделении ВРТ на базе ГБУЗ МО МОПЦ широко внедрен и используется персонифицированный подход к каждой супружеской паре, проводится углубленное обследование перед планируемой программой ВРТ с учетом анамнестических и клинических данных пары. Подбирается индивидуальная подготовка, с учетом выявленных отклонений. Такой многолетний опыт работы нашего отделения позволяет нам повысить эффективность программ ЭКО до 38%.
Литература
- Рудакова Е. Б. Очерки экстракорпорального оплодотворения. М., 2019. 432 с.
- Краснопольская К. В., Назаренко Т. А. Клинические аспекты лечения бесплодия в браке. М.: ГЭОТАР-Медиа, 2014. 376 с.
- Прилепская В. Н. Поликлиническая гинекология. 2-е изд. М.: МЕДпресс-информ, 2005. 640 с.
- Сидорова И. С., Овсянникова Т. В., Макаров И. О. Амбулаторно-поликлиническая помощь в акушерстве и гинекологии: практическое руководство. М.: МЕДпресс-информ, 2009. 720 с.
- Перминова С. Г. и др. Репродуктивная функция женщин с патологией щитовидной железы (обзор литературы) // Проблемы репродукции. 2006. Т. 12, № 1. С. 70–71.
- Грон Е. А., Лукошина И. Н., Губанова М. А. Особенности лечения методом ЭКО у пациенток с аутоиммунным тиреоидитом / Материалы ХХV Международной конференции Российской ассоциации репродукции человека «Репродуктивные технологии сегодня и завтра». Сочи, 2015. С. 207–214.
- Fleischer К., Muller A. F., Hohmann F. P. et al. Impact of controlled ovarian hyperstimulation on thuroid function // Reprod. Biol. Insights. 2014. 7. P. 9–16.
- Cramer D. W., Sluss P. M., Powers R. D. et al. Serum prolactin and TSH in an in vitro fertilization and thyroid function? // J. Assist. Reprod. Genet. 2003. 20 (60). P. 210–215.
- Maruo T., Matsuo H., Katayama K. et al. Growth factors in the biology of human trophoblast and clinical relevances in early pregnancy maintenance // Placenta. 1993. 14. P. 251–263.
- Wakim A. N., Paljug W. R., Jasnosz K. M. et al. Thyroid hormone receptor messenger ribonucleic acid in human granulosa and ovarian stromal cells // Fertil. Steril. 1994. 62 (3). P. 531–534.
- Перминова С. Г. Женское бесплодие и нарушение функции щитовидной железы. В кн.: Бесплодный брак. Современные подходы к диагностике и лечению: руководство / Под ред. Г. Т. Сухих, Т. А. Назаренко. 2-е изд. М.: ГЭОТАР-Медиа, 2010. С. 237–273.
- Манухин И. Б., Тумилович Л. Г., Геворкян М. А., Манухина Е. И. Гинекологическая эндокринология. Клинические лекции. М.: ГЭОТАР-Медиа, 2019. 304 с.
- Сидельникова В. М. Подготовка и ведение беременности у женщин с привычным невынашиванием: метод пособия и клин. протоколы. 3-е изд. М.: МЕДпресс-информ, 2013. 224 с.
- МакВэй Э., Джиллбоуд Д., Хамбэг Р. Репродуктивная медицина и планирование семьи: Практическое руководство / Под ред. проф. В. Н. Прилепской, акад. Г. Т. Сухих; пер. с англ. М.: МЕДпресс-информ, 2016. 368 с.
- Андреева Е. Н., Карпова Е. А. Репродуктивная функция женщин и ожирение. В кн.: Ожирение: этиология, патогенез, клинические аспекты / Под ред. И. И. Дедова, Г. А. Мельниченко. М.: Медицинское информационное агентство, 2004. С. 159–184.
- Чеботникова Т. В., Мельниченко Г. А., Семичева Т. В. Принципы восстановления фертильности у больных с СПКЯ // Вестник репродуктивного здоровья. 2008. № 1. С. 155–156.
- Геворкян М. А. и др. Клиника, диагностика и лечение СПКЯ // Журнал Российского общества акушеров-гинекологов. 2008. № 4. С. 35–39.
- Калинина Е.А. и др. Современные методы прогнозирования и профилактики получения незрелых ооцитов в программе ЭКО / Материалы XXVI Международной конференции Российской ассоциации репродукции человека «репродуктивные технологии сегодня и завтра». М., 2016. С. 113–114.
- Женское бесплодие. Современные подходы к диагностике и лечению. Клинические рекомендации (протокол лечения), 2018.
- Адамян Л. В., Дементьева В. О., Асатурова А. В. Новое в репродуктивной хирургии: одноэтапный хирургический метод активации функции яичников // Акушерство и гинекология. 2019. № 3. С. 147–151.
- Адамян Л. В. Комплексный подход к лечению бесплодия у пациенток с «бедным ответом» на стимуляцию яичников и ПНЯ с использованием новых хирургических технологий / XIV Международный конгресс по репродуктивной медицине. 2020.
Е. Б. Рудакова¹, доктор медицинских наук, профессор
Т. В. Стрижова, кандидат медицинских наук
Е. А. Федорова
Л. Ю. Замаховская
ГБУЗ МО МОПЦ, Балашиха
Женское бесплодие: традиционные методы лечения и экстракорпоральное оплодотворение у пациенток с эндокринными нарушениями/ Е. Б. Рудакова, Т. В. Стрижова, Е. А. Федорова, Л. Ю. Замаховская
Для цитирования: Лечащий врач № 3/2020; Номера страниц в выпуске: 37-42
Теги: женщины, экстракорпоральное оплодотворение, врачебная тактика
Источник https://radugaclinic.ru/articles/muzhskoe-besplodie-novye-dostizheniya-medicziny/
Источник https://meduniver.com/Medical/Ginecologia/gormonalnoe_besplodie_genchin.html
Источник https://www.lvrach.ru/2020/03/15437519