Болезнь Вильсона-Коновалова
Болезнь Вильсона-Коновалова – редкое наследственное заболевание, проявляющееся различными печеночными, неврологическими, психиатрическими, костно-мышечными нарушениями вследствие чрезмерного отложения меди в органах и тканях. Из-за длительного течения и многообразия клинических симптомов относится к числу труднодиагностируемых заболеваний.
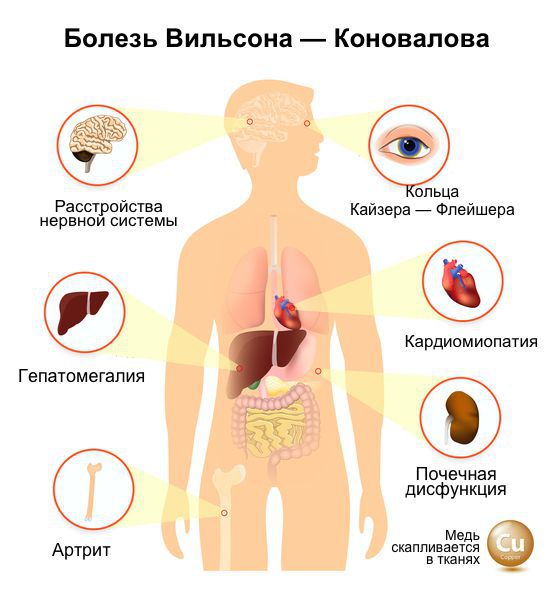
Заболевание связано с нарушением метаболизма меди и избыточным ее накоплением в различных органах и тканях. Из-за преимущественно накопления меди в печени и в отделах центральной нервной системы оно проявляется в большей степени симптоматикой поражения печени и центральной нервной системы (ЦНС). Из-за токсического влияния свободной меди приданном заболевании нарушается функция органов зрения (роговицы), почек, желез внутренней секреции, сердца, костной ткани.
Первые описания болезни дали C. Westphal в 1883 г. и в A. Strumpell в 1898 г. Они изучали заболевание, при котором регистрировались признаки многоочагового поражения центральной нервной системы на фоне поражения печени. Патология была названа псевдосклерозом. В 1902-1903 г.г. у данных пациентов по периметру роговицы были обнаружены зеленовато-бурые отложения, которые были названные в честь описавших их авторов — кольца Кайзера–Флейшера.
Однако, целостное и подробное описание патологии было дано английским неврологом Самуэлем Вильсоном в 1912 году. Врач описал морфологические отклонения, которые происходят в организме при данном заболевании – двусторонние изменения чечевицеобразных ядер в головном мозге (лентикулярных ядер в подкорковом веществе головного мозга) в сочетании с циррозом печени. В клинической картине он выделил наличие признаков поражения экстрапирамидной системы, бульбарного синдрома и психических расстройств. Заболевание начинало проявлять себя в молодом возрасте и затем неуклонного прогрессировало. Это позволило Вильсону назвать данную патологию прогрессирующей лентикулярной дегенерацией.
Почти через 40 лет J.N. Cumings (1948) и H.G. Kunkel (1952) выявили у данных больных нарушение обмена меди — накоплением ее в мозговой ткани и гиперсекрециию с мочой из-за дефицита медьсодержащего белка церулоплазмина в плазме крови.
В России изучение болезни связано с именем Н.В.Коновалова. Ему принадлежат заслуги описания в 1960 году основных клинических форм данной патологии и создания подробной классификации заболевания.
Распространенность заболевания среди мужчин и женщин одинаковая. Данная патология редко выявляется до достижения 5-летнего возраста. По данным медицинской статистики, частота встречаемости болезни составляет 1 на 7 000 -10 000 человек. На территории Российской Федерации за 2014 и 2015 гг. болезнь Вильсона-Коновалова была выявлена у 572 и 602 человек соответственно.

Уход за кожей: скрабы для тела и гели для душа
Эффективные продукты для поверхностного и глубокого очищения кожи тела.
Симптомы
Симптомы болезни Вильсона-Коновалова складываются из признаков поражения печени, неврологических и психических расстройств. Первыми у 42% пациентов появляются поражения печени, в четверти всех случаев – уже в детском возрасте. Неврологическая симптоматика болезни Вильсона проявляется, как правило, позже — на втором-третьем десятилетиях жизни.
В большинстве случаев поражение печени имеет длительное течение и без лечения приводит к развитию цирроза. Клинически поражение печени первоначально проявляется диспептическими проявлениями, повышенной утомляемостью, недомоганием, потерей аппетита вплоть до развития анорексии, снижением массы тела, суставными болями, увеличением печени, болью в правом подреберье, развитием желтухи, появлением темной мочи. Иногда заболевание может дебютировать снижением уровня лейкоцитов и тромбоцитов в крови. Клинически это проявляется кровотечениями из десен и повторяющимися носовыми кровотечениями.
Постепенно нарастают признаки функциональной недостаточности печени, формируется ее цирротическое поражение, появляются признаки портальной гипертензии, развиваются асцит и печеночная энцефалопатия. В этот период отмечаются нарастание желтухи, боли в животе, диспепсических расстройств. В биохимическом анализе крови выявляются повышение содержания аминотрансфераз (АСТ, АЛТ), снижение содержания альбумина, повышение содержания гаммаглобулинов, нарушение свертываемости крови. Часто заболевание впервые выявляется уже на стадии декомпенсированного цирроза печени с развитием отечно-асцитического синдрома на фоне варикозно расширенных вен пищевода. В ряде случаев больные погибают от печеночной недостаточности еще до развития неврологической симптоматики.
Концентрация меди в головном мозге и спинномозговой жидкости у пациентов с болезнью Вильсона-Коновалова по сравнению со здоровыми увеличивается в 10 раз. Неврологические признаки могут до поры до времени развиваться постепенно, а затем внезапно выйти на первое место в клинической картине заболевания. Определяются экстрапирамидные нарушения – размашистый тремор конечностей, изменение почерка, тремор головы, нарушение речи и ухудшение памяти. Нарастание неврологических симптомов характеризуется появлением насильственных движений – гиперкинезов в виде непроизвольных стереотипных, ритмических, вычурных движений небольшого объема (атетоз), насильственно плача или смеха. Поражение нервной системы может проявиться дрожанием рук, нарастанием тонуса мускулатуры, переходящим в ее ригидность. Затем развиваются клонические и тонические судороги. Дальнейшее прогрессирование болезни приводит к смене ригидности мышц на миогенные контрактуры и обездвиженность.
Нередки экстрапеченочные и экстраневрологические симптомы болезни Вильсона-Коновалова.
У 1% пациентов болезнь проявляется поражением почек из-за отложения меди в почечных канальцах. Это проявляется выведение с мочой аминокислот, продуктов из распада, глюкозы, мочевой кислоты, кальция, а также снижением почечного кровотока и фильтрации. В редких случаях развиваются пиелонефрит, гломерулонефрит и мочекаменная болезнь. Из-за потери кальция и фосфора при нарушении функции почек развиваются остеопороз, рахит, остеомаляция.
Отложение меди в суставах приводит к развитию остеоартрита.
Нарушения со стороны эндокринной системы могут проявляться в отставании полового развития, появлении гинекомастии у юношей, амeнореи или дисменореи у девушек, развитии ожирения, акромегалии, появлении striae gravidarum — полос на коже живота, как при беременности. В 33% случаев у женщин отмечались гипоплазия эндометрия по смешанному типу и кистозная атрезия фолликулов яичников.
Более, чем у половины пациентов с болезнью Вильсона-Коновалова при ультразвуковом исследовании были выявлены фиброзные изменения клапанов сердца и обнаружены признаки обратного тока крови из-за нарушения функции этих клапанов. В ряде исследований выявлена высокая распространенность гипертрофии левого желудочка.
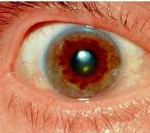
Со стороны органов зрения обнаруживаются кольца Кайзера-Флейшера и помутнение хрусталика.
Формы
Формы болезни Вильсона-Коновалова с 1983 выделяют бессимптомную, печеночную, церебральную и смешанную форма.
Однако, в нашей стране широко распространена классификация Н.В.Коновалова (1960 г), который выделил 5 форм заболевания.
Брюшная (абдоминальная) форма – преневрологическая стадия болезни, развивается обычно в возрасте 5-17 лет, сопровождается быстрым нарастанием поражения печени в нескольких вариантах, без лечения заканчивающееся летально.
Ригидно-аритмогиперкинетическая (ранняя форма) — развивается в возрасте 7-15 лет, отличается быстрым течением. Клиническая картина характеризуется аритмичными гиперкинезами, мышечной ригидностью, развитием контрактур. Гиперкинезы охватывают различные мышечные группы (конечности, туловище, а также мышцы, ответственные за артикуляцию и глотание) и приводят к изменению позы тела, положения конечностей, дизартрии и дисфагии. Выявляется нарушение интеллекта, появляется нарушение речи, нарушение глотания, судорожный смех и плач. Без лечения заканчивается летально через 2-3 года.
Дрожательно-ригидная форма встречается чаще других в более позднем возрасте (17-25 лет) и имеет более доброкачественное течение. Для этого варианта характерно одновременное развитие ригидности и дрожания с варьированием их соотношения. В ряде случаев регистрируются атетоидные насильственные движения (гиперкинезы в виде непроизвольных стереотипных, ритмических, вычурных движения небольшого объема). Часто отмечаются дисфагия и дизартрия. Без лечения срок жизни таких пациентов составляет 5-6 лет.
Дрожательная форма считается наиболее доброкачественной. Она начинается в возрасте 20-30 лет и протекает довольно медленно в течение10-15 лет и более. Основным клиническим проявлением является дрожание. Мышечный тонус не изменен или снижен. По мере прогрессирования болезни дрожание резко усиливается, становится крупноамплитудным. Ригидность появляется только в конце болезни. Интеллектуальные способности длительное время сохраняются, но по мере прогрессирования болезни, наряду с повышением мышечного тонуса, возникают изменения психики, отличающиеся развитием аффективных расстройств.
Экстрапирамидно-корковая форма встречается реже других форм. Характеризуется присоединением к имеющимся типичным нарушениям остро развивающихся пирамидных парезов и эпилептических припадков, чаще очагового характера, и быстрым прогрессом психических нарушений. Эта форма длится в среднем 6-8 лет и заканчивается летально.
Причины
Основной причиной развития болезни Вильсона-Коновалова является нарушение обмена меди и ее отложение в различных органах и тканях. Токсическое действие меди приводит к нарушению функций органов. Причина нарушения обмена меди — дефект в гене, регулирующем ее обмен (АТР7В). В результате нарушаются два основных процесса — синтез медьсодержащего белка церулоплазмина и выведение меди с желчью. Все это ведет к повышению концентрации меди и ее отложению в органах.
В норме поступающая с пищей медь после усвоения в желудочно-кишечном тракте в комплексе с белками переносится в печень, где соединяется со специальным белком, синтезируемым в печени — церулоплазмином. Церулоплазмин необходим для нормального обмена железа, его всасывания и утилизации, поскольку этот белок участвует в мобилизации железа из клеток ретикулоэндотелиальной системы и переводит железо в трехвалентную форму. Медь также входит в состав супероксиддисмутазы – фермента, участвующего в защите клеток от оксидативного стресса при активации перекисного окисления липидов вследствие повышения уровня токсичных форм кислорода. Медь присутствует в ферменте цитохром С-оксидазе, осуществляющей транспорт электронов. Она необходима для работы V и VIII факторов свертывания крови, содержится в активном центре фермента дофамин-бета-гидроксилазы, которая катализирует реакцию перехода дофамина в норадреналин. Важным медьсодержащим белком является фермент лизилоксидаза, участвующая в образовании поперечных связей коллагена – основного белка, из которого строится костная ткань. Медь участвует в реакциях превращения аскорбиновой кислоты (витамина С).
Ген, ответственный за развитие заболевание был идентифицирован в 1993 г. двумя исследовательскими группами из США и Канады. Установлено, что этот ген кодирует синтез медьтранспортирующей аденозинтрифосфатазы Р-типа (медьтранспортирующую АТФ-азу 7В), и именно мутации в этом гене обусловливают нарушение обмена меди в организме.
В сыворотке крови 95 % меди находится в связанном состоянии с белком церулоплазмином. Включение меди в церулоплазмин происходит в аппарате Гольджи при участии медьтранспортирующей АРФ7В. Эта АТФ-аза 7В играет двоякую функциональную роль в клетках печени: одна из них – участие в биосинтезе путем доставки меди к апоцерулоплазмину внутри аппарата Гольджи, другая – транспорт избытка меди из клетки. В настоящее время известно несколько сотен мутаций в гене АТР7В, из которых более 70 идентифицированы в патогенезе заболевания. Такой широкий спектр повреждений в гене АТР7В и разнообразие их комбинаций находит отражение в полиморфизме клинических проявлений и тяжести течения патологии. Однако, пока убедительных данных о корреляциях «генотип-фенотип» получить не удается.
Наиболее распространенной мутацией в гене АТР7В среди европеоидной расы является мутация 3207C>A (H1069Q), при которой в положении 1069 происходит замена (мутация) аминокислоты гистидина на глутаминовую кислоту с образованием «патологического» фермента. Исследователи обнаруживают эту мутацию у 22-38% больных славян.
Генетически детерминируемое снижение функции медь-транспортирующей АТФ-азы в результате молекулярных дефектов в гене АТР7В приводит к снижению удалению меди из организма и нарушению встраивания меди в церулоплазмин, в результате экскретируется и циркулирует апоцерулоплазмин (белок ненагруженный медью, срок полувыведения которого сокращается вдвое, что и объясняет гипоцерулоплазминемию), а медь накапливается в различных органах и тканях, преимущественно в печени, головном мозге, роговице глаза, почках, обеспечивая полиморфизм клинических появлений болезни Вильсона-Коновалова. Перегруженные медью гепатоциты разрушаются и это приводит к формированию стойкого синдрома цитолиза (гибели клеток).
Тип наследования заболевания аутосомно-рецессивный. Это значит, что для клинического проявления болезни нужно, чтобы ребенок унаследовал измененный ген сразу об обоих родителей. Если же измененный ген будет унаследован только от одного из родителей, то ребенок будет «здоровым носителем» болезни.
В патогенезе болезни ведущая роль принадлежит нарушению баланса между объемом поступившей с пищей меди и ее экскрецией. При болезни Вильсона-Коновалова этот баланс нарушается, содержание свободной (токсичной) меди в крови и тканях возрастает, и ее выделение с мочой увеличивается.
Генетическая гетерогенность (большое количество возможных мутаций) может обусловливать и разнообразие механизмов дефекта экскреции меди: в одних случаях он может возникать из-за аномалии экпрессии гена на разных уровнях регуляции синтеза церулоплазмина, в других – из-за препятствия всасываемости меди в тонком кишечнике, в третьих – из-за нарушения выведения меди с желчью, в четвертых – из-за появления в печени патологически измененного металлотионейона (белок, связывающий медь и другие тяжелые металлы). Это приводит к накоплению в гепатоците так называемой регуляторной фракции меди. Избыточная концентрация последней провоцирует генерацию свободных радикалов, нарушение проницаемости плазматической мембраны и мембран митохондрий, истощение клеточных запасов и, как следствие, повреждение структур гепатоцита. При нарушении выведения меди с желчью при болезни Вильсона-Коновалова она долгое время депонируется в гепатоцитах. Избыток меди ведет к возникновению каскада патобиохимических реакций, вызывая развитие вильсоновского гепатита (гепатоза) с последующим переходом в атрофический нодулярный цирроз печени.
Хотя патогенез болезни еще недостаточно изучен, существует несколько его гипотез, две из которых считаются ведущими.
- Теория генетического дефекта синтеза церулоплазмина, который сопровождается нарушением поступления меди в печень. В результате возврат меди в кровь обеспечивает поступление ее с током крови к органам-мишеням (мозг, сердце, роговица, почки и др.).
- Существуют мнения, что дефект гена, ответственного за синтез церулоплазмина, по-видимому, не является ведущим фактором развития болезни Вильсона-Коновалова, а играет вторичную роль. Первичным звеном развития болезни следует считать изменение метаболизма меди в печени из-за нарушения ее выделения из аппарата Гольджи в желчь. Ионы меди, поступающие в избытке в ткани, очень токсичны и способны окислять белки и липиды клеточных мембран, связывать белки и нуклеиновые кислоты и усиливать синтез свободных радикалов. Эти радикалы окисляют липиды, ферменты и белки цитоскелета. Вследствие повышения внутриклеточной концентрации меди повреждается множество внутриклеточных систем.
Методы диагностики
Диагностика болезни Вильсона-Коновалова проводится обычно врачами гастроэнтерологом, неврологом, офтальмологом, генетиком на основании жалоб, данных анамнеза, клинического осмотра, обязательного применения лабораторных (включая генетические) и инструментальных методов обследования. Диагностика направлена на определение клинической формы заболевания, тяжести состояния и возникающих осложнений.
Из анамнеза можно выяснить наличие эпизодов желтухи, неврологических отклонений, заболеваний печени.
При объективном обследовании могут определяться умеренное увеличение печени и селезенки, признаки желтухи (желтушные склеры), наличие колец Кайзера-Флейшера на роговице.
Как правило наличие болезни не вызывает сомнений при обнаружении снижения в крови белка церулоплазмина, увеличения выведения меди с мочой и наличия колец Кайзера-Флейшера.
При размытых клинических симптомах может потребоваться проведение биопсии печени для определения содержания меди в ее клетках и проведение генетического обследования для обнаружения мутаций в гене АТР7В.
При определении меди в крови следует выделять два понятия – «общая медь» и «свободная медь». Для определения общей меди обычными рутинными методами ее содержание определяют по определения церулоплазмина, белка, который включает 90-95% меди. Поэтому количество общей меди, из-за падения содержания церулоплазмина при болезни Вильсона-Коновалова тоже уменьшается. Для точного подтверждения диагноза в качестве диагностического теста проводят определение несвязанной с церулоплазмином меди (свободной – токсичной) в моче методом масс-спектрометрии. Для установления факта усиления экскреции меди с мочой проводят пробу с пеницилламином. После его введения многократное увеличение меди в моче подтверждает диагноз.
В сыворотке крови также определяется повышение свободной (несвязанной) меди и снижение содержания церулоплазмина. Следует учитывать, что нормальной содержание церулоплазмина не всегда исключает диагноз болезни Вильсона-Коновалова, т.к. в 20% случаев у детей при подтвержденном диагнозе содержание этого белка оставалось в пределах нормы.
В ткани печени (биопсийный материал) определяется повышение содержания меди. У гетерозиготных носителей гена АТР7В (получивших от родителей один мутированный ген) концентрация меди в печени тоже повышена, но в меньшей степени.
При остром течении болезни в крови выявляется увеличение активности трансаминаз (АЛТ и АСТ), увеличение содержания билирубина и повышение содержания уробилина в моче.
При нарушении свойств печени синтезировать белки (синтетической функции) происходят нарушения в свертывающей системы крови, что проявляется снижением протромбинового индекса.
В клиническом анализе крови выявляются признаки анемии, ретикулоцитоз, ускорение СОЭ.
В общем анализе мочи при поражении почек — протеинурия, глюкозурия (наличие глюкозы), увеличение количества аминокислот и их продуктов (аминоацидурия).
Типичным признаком болезни являются кольца Кайзера-Флейшера на роговице глаза, определяющиеся у 55-70% взрослых пациентов. При вовлечении ЦНС это кольцо определяется практически у всех пациентов.
Генетическое исследование подразумевает выявление мутаций в гене АТР7В.
Проводится дородовая (пренатальная) диагностика болезни Вильсона-Коновалова на плодном материале. Следует иметь в виду, что если мутация обнаруживается только на одной из гомологичных хромосом, то достоверно диагноз поставить о наличии болезни нельзя. Диагноз является 100%, если мутация обнаружена в гомозиготном состоянии (в 2-х одинаковых генах в гомологичных хромосомах – ребенок унаследовал 2 мутированных гена).
Инструментальные исследования назначаются для оценки состояния печени (УЗИ печени и желчных протоков, селезенки). При клинических признаках нарушения ЦНС проводят МРТ и КТ головного мозга — обнаруживается атрофия коры и ствола мозга, увеличенные желудочки. При наличии судорожного синдрома и других неврологических признаках показано проведение электроэнцефалографии (ЭЭГ).
Обследование органов зрения, с целью выявления колец Кайзера-Флейшера проводится врачом-офтальмологом при помощи щелевой лампы.
При поражении сердца, почек, костей, эндокринных органов назначаются соответствующие инструментальные обследования (УЗИ почек, ЭКО-КГ и др.).
В пользу правильности диагноза будет свидетельствовать высокий терапевтический эффект при применении медьвыводящих препаратов.
Дифференциальная диагностики проводится в гепатитами неясной этиологии, циррозом печени. При развитии неврологических симптомов с паркинсонизмом.
Основные используемые лабораторные исследования.
- Клинический анализ крови.
- Общий анализ мочи.
- Биохимический анализ крови (включая АСТ, АЛТ, билирубин).
- Исследование свертывания крови.
- Определение меди в суточной моче (Масс-спектрометрия c источником ионов в виде индуктивно связанной плазмы/ИСП-МС).
- Определение меди в крови (колориметрический метод).
- Определение меди в ткани печени (биопсийный материал).
- Поиск 12 наиболее вероятных мутаций в гене АТР7В.
- Пренатальная диагностика болезни Вильсона. (выявление носительства мутаций в гене АТР7В).
Основные используемые инструментальные исследования.
- УЗИ органов брюшной полости (печень, поджелудочная железы, селезенка, почки).
- МРТ и КТ печени, поджелудочной железы, селезенки.
- Эластометрия печени.
- МРТ/КТ головного мозга.
- ЭХО-КГ сердца.
Лечение
Часто болезнь Вильсона-Коновалова диагностируют уже на тяжелой стадии с необратимыми изменениями, и лечение в этом случае уже не ведет к выздоровлению, а лишь к стабилизации патологического процесса.
Патогенетическое лечение направлено на выведение избытка меди и лечение сопутствующих осложнений.
Прогресс в лечении произошел в 1956 году, когда J.M. Walshe синтезировал из пенициллина препарат D-пеницилламин, обладающий медьвыводящим действием. Он представляет собой тиоловый препарат, содержащий сульфгидрильные группы, образующие комплексы с медь
Альтернативным методом является применение препаратов цинка (сульфат цинка, ацетат цинка). Цинк обладает минимальной токсичностью, связываясь с металлотионином кишечника, способствует экскреции меди с желчью и выведению ее с калом (а не с мочой, как при лечении тиоловыми препаратами).
Большое значение на всех стадиях болезни имеет диетотерапия, заключающаяся в ограничении продуктов с высоким содержанием меди – бобовые, баранина, куриное мясо, колбаса, рыба, шампиньоны, шоколад, кофе, орехи, редис, лук-порей и др.
При фульминантном (быстро развивающемся) гепатите прогноз крайне неблагоприятен. Патология приобретает стремительно прогрессирующее течение и обычно завершается летальным исходом. Единственно эффективным способом лечения таких больных становится трансплантация печени.
Осложнения
К основным осложнениям болезни Вильсона-Коновалова можно отнести – цирроз печени, анемию, поражение почек, нейропсихические расстройства, артриты, кардиомиопатию.
Профилактика
Профилактика возможного развития болезни Вильсона-Коновалова основана на выявлении носительства «патологического» гена у будущих родителей перед принятием решения о деторождении (при планировании беременности).
Другой способ определить возможность развития болезни — уже в период беременности — пренатальная диагностика, т.е. выявление мутаций у плода путем взятия ворсин хориона (часть плаценты забирается через шейку матки или через брюшную стенку) или при проведении амниоцентеза. Последняя методика заключается в исследовании клеток плода, находящихся в околоплодной жидкости, получаемых после прокола зародышевой оболочки.
Какие вопросы следует задать врачу
Следует ли всем лица, планирующим беременность (мужчинам и женщинам) проводить расширенный генетический тест на возможные наследственные заболевания?
Советы пациенту
Проведение генетического консультирования перед вступлением в брак – это нормальная практика во всех развитых странах.
Болезнь Вильсона ( Болезнь Вестфаля-Вильсона-Коновалова , Болезнь Вильсона-Коновалова , Гепатолентикулярная дистрофия , Гепатоцеребральная дистрофия , Лентикулярная прогрессирующая дегенерация )
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФазы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Болезнь Вильсона может протекать в брюшной, ригидно-аритмогиперкинетической, дрожательной или экстрапирамидно-корковой форме. Диагностика болезни Вильсона включает офтальмологическое обследование, биохимические анализы мочи и крови, МРТ или КТ головного мозга. Основу патогенетической терапии составляют тиоловые препараты, которые могут приниматься в течении нескольких лет и даже пожизненно.
МКБ-10
E83.0 Нарушения обмена меди
- Причины
- Классификация
- Симптомы
- Диагностика
- Лечение болезни Вильсона
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФ-азы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Первооткрыватель заболевания — А.К. Вильсон, описавший заболевание в 1912 году, в отечественной медицине — Н.А. Коновалов. Патогенез болезни Вильсона был выявлен в 1993 году. Понятию «болезнь Вильсона» соответствуют также: болезнь Вильсона-Коновалова, болезнь Вестфаля-Вильсона-Коновалова, дистрофия гепатоцеребральная, дистрофия гепатолентикулярная, дегенерация лентикулярная прогрессирующая.

Болезнь Вильсона
Причины
Ген АТР7В картирован на длинном плече хромосомы 13 (13q14.3-q21.1). Организм человека содержит около 50-100 мг меди. Суточная потребность меди для человека — 1-2 мг. 95% абсорбированной в кишечнике меди, транспортируется в форме комплекса с церулоплазмином (один из глобулинов сыворотки, синтезируемых печенью) и только 5% в форме комплекса с альбумином. Кроме того, ион меди входит в состав важнейших метаболических ферментов (лизилоксидаза, супероксиддисмутаза, цитохром-С-оксидаза и др.). При болезни Вильсона происходит нарушение двух процессов обмена меди в печени — биосинтез главного медьсвязывающего белка (церулоплазмина) и выведение меди с желчью, следствием чего становится повышение уровня несвязанной меди в крови. Концентрация меди в различных органах (чаще всего в печени, почках, роговице и головном мозге) увеличивается, что приводит к их токсическому поражению.
Классификация
Согласно классификации Н.В. Коновалова различают пять форм болезни Вильсона:
- брюшная
- ригидно-аритмогиперкинетическая
- дрожательно-ригидная
- дрожательная
- экстрапирамидно-корковая
Симптомы
Для болезни Вильсона характерен клинический полиморфизм. Первые проявления заболевания могут появиться в детстве, юношестве, в зрелом возрасте и гораздо реже в зрелом возрасте. В 40-50% случаев Болезнь Вильсона манифестирует с поражения печени, в остальных — с психических и неврологических расстройств. С вовлечением в патологический процесс нервной системы обнаруживается кольцо Кайзера-Флейшера.
Брюшная форма развивается преимущественно до 40 лет. Характерный признак — тяжелое поражение печени по типу цирроза печени, хронического гепатита, фульминантного гепатита.
Ригидно-аритмогиперкинетическая форма манифестирует в детском возрасте. Начальные проявления — мышечная ригидность, амимия, смазанность речи, трудности при выполнении мелких движений, умеренное снижение интеллекта. Для этой формы заболевания характерно прогрессирующее течение, с наличием эпизодов обострения и ремиссии.
Дрожательная форма возникает в возрасте от 10 до 30 лет. Преобладающим симптомом является тремор. Кроме того, могут наблюдаться брадикинезия, брадилалия, тяжелый психоорганический синдром, эпилептические приступы.
Экстрапирамидно-корковая форма встречается весьма редко. Ее начало схоже с началом какой-либо из вышеперечисленных форм. Для нее характерны эпилептические припадки, экстрапирамидные и пирамидные нарушения и выраженный интеллектуальный дефицит.
Диагностика
Офтальмологическое исследование с помощью щелевой лампы выявляет кольцо Кайзера-Флейшера. Биохимические исследования мочи обнаруживают повышенную экскрецию меди в суточной моче, а также снижение концентрации церулоплазмина в крови. С помощью визуализационных методов (КТ и МРТ головного мозга) обнаруживают атрофию полушарий большого мозга и мозжечка, а также базальных ядер.
При диагностике болезни Вильсона неврологу необходимо дифференцировать ее от паркинсонизма, гепатоцеребрального синдрома, болезни Геллервордена-Шпатца. Основным дифференциально-диагностическим признаком этих заболеваний является отсутствие характерных для болезни Вильсона кольца Кайзера-Флейшера и расстройств обмена меди. Для подтверждения болезни Вильсона проводится генодиагностика.
Лечение болезни Вильсона
Основой патогенетического лечения является назначение тиоловых препаратов, в первую очередь — D-пеницилламина либо унитиола. Главное преимущество купренила — низкая токсичность и возможность длительного приема при отсутствии побочных эффектов. Его назначают по 0,15 г (1 капсула) в сутки (только после еды), в дальнейшем, в течение 2,5-3 месяцев дозу увеличивают до 6-10 капсул/сутки (оптимальная доза). Лечение D-пеницилламином проводится годами и даже пожизненно с небольшими перерывами (на 2-3 недели) в случае появления побочных эффектов (тромбоцитопения, лейкопения, обострения язвенной болезни желудка и т. д.).
Унитиол назначают в случае непереносимости (плохой переносимости) D-пеницилламина. Длительность одного курса лечения — 1 месяц, после чего лечение приостанавливают на 2,5-3 месяца. В большинстве случаев наступает улучшение общего состояния пациента, а также регресс неврологических симптомов (скованности, гиперкинезов). В случае доминирования гиперкинезов рекомендовано назначение небольших курсов нейролептиков, при ригидности — леводопы, карбидопы, тригексифенидила.
В случае тяжелого течения болезни Вильсона, при неэффективности консервативного лечения за рубежом прибегают к трансплантации печени. При положительном исходе операции состояние пациента улучшается, восстанавливается обмен меди в организме. В дальнейшем лечение пациента составляет иммуносупрессивная терапия. В России на сегодня постепенно внедряется в клиническую практику метод биогемоперфузии с изолированными живыми клетками селезенки и печени (т. н. аппарат «вспомогательная печень). Немедикаментозное лечение состоит в назначении диеты (стол №5) в целях исключения продуктов богатых медью (кофе, шоколад, бобовые, орехи и т. д.).
Прогноз и профилактика
В случае своевременного диагностирования болезни Вильсона и проведения адекватной медьснижающей терапии возможна нормализация общего состояние пациента и обмена меди в организме. Постоянный прием тиоловых препаратов по схеме, назначенной врачом-специалистом, позволяет поддерживать профессиональную и социальную активность пациента.
Для предотвращения рецидивов болезни Вильсона рекомендовано проведение лабораторных исследований крови и мочи пациента несколько раз в год. Необходим контроль следующих показателей: концентрация меди, церулоплазмина и цинка. Кроме того, рекомендовано проведение биохимического анализа крови, общего анализа крови, а также регулярные консультации у терапевта и невролога.
Болезнь Вильсона — Коновалова — симптомы и лечение
Что такое болезнь Вильсона — Коновалова? Причины возникновения, диагностику и методы лечения разберем в статье доктора Толмачева Алексея Юрьевича, невролога со стажем в 21 год.
Над статьей доктора Толмачева Алексея Юрьевича работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Невролог Cтаж — 21 год
Медицинский центр «Саквояж здоровья»
Дата публикации 29 февраля 2020 Обновлено 15 мая 2023
Определение болезни. Причины заболевания
Болезнь Вильсона — Коновалова — редкое наследственное дистрофическое заболевание, которое развивается из-за избыточного накопления меди в организме. Больше всего металла скапливается в головном мозге, глазах (с образованием характерной пигментации), печени и почках. При этом в органах нарушается обмен веществ и прогрессируют дистрофические изменения [4] .
Заболевание впервые описано в 1912 году английским неврологом Семюэлем Вильсоном. В своём печатном труде он описал симптомы и особенности изменения внутренних органов при этом заболевании. Обычно первые проявления становились заметными в молодом возрасте, позже прогрессировала ригидность, сложности при глотании, снижение двигательной способности мягкого нёба, языка, губ (причина расстройства речи — дизартрии). Развиваются непроизвольные движения, расстройства психики — пониженное или необоснованно повышенное настроение, немотивированная агрессия, которая на поздних стадиях сменяется безучастностью, бредовые идеи, галлюцинации.
Российский невролог Николай Васильевич Коновалов изучал болезнь Вильсона на протяжении многих лет. Это позволило ему создать оригинальную полноценную классификацию различных форм заболевания. За огромный вклад Коновалова в исследование проблемы фамилия учёного навсегда дополнила название болезни.
Частота встречаемости — от 1 до 9 случаев на 100000 населения.
Основная причина возникновения болезни — мутация гена с названием ATP7B, который ответственен за встраивание ионов меди в белок церулоплазмин [14] . Всего описано более 300 мутаций этого гена. База данных мутаций постоянно расширяется новыми вариантами [6] . По международным оценкам, носителем аномального гена является примерно 1 человек из 100. При данном виде наследования заболевание проявляется симптоматикой только в том случае, если патологический ген был унаследован от обоих родителей. Мальчики и девочки болеют с одинаковой частотой [1] [2] [3] [8] [15] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы болезни Вильсона — Коновалова
Симптомы при заболевании подразделяют на четыре группы:
- проявления заболевания, связанные с поражением печени;
- неврологическая симптоматика;
- психическая симптоматика;
- изменения со стороны остальных внутренних органов.
Наиболее значимые проявления заболевания — поражения печени, неврологические и психические симптомы, изменения со стороны глаз.
Симптомы поражения внутренних органов при болезни Вильсона — Коновалова [3] :
Изменения со стороны печени выделяют среди первых симптомов заболевания (часто они проявляются в возрасте 4-5 лет). Иногда болезнь Вильсона — Коновалова проявляется острым или хроническим гепатитом, который можно принять за воспалительное бактериальное или вирусное поражение печени. Патологический процесс начинается с быстрого развития желтухи: кожные покровы и видимые слизистые, белок глаз приобретают жёлтый оттенок. К изменению цвета кожных покровов могут присоединиться симптомы интоксикации и астении (общей слабости, повышенной утомляемости, неустойчивости настроения). Также возможна анорексия — потеря аппетита и отказ отвращение к пище.
Неврологические симптоматика и проявления психических заболеваний при болезни Вильсона — Коновалова встречаются в 35 и 10 % случаев, обычно в возрасте с 10 до 35 лет, хотя встречаются и поздние случаи начала в 55 лет. Неврологические проявления включают нарушение координации с дрожанием конечностей при удержании позы, также возможен тремор в состоянии покоя. Развиваются синдром мышечной дистонии — непроизвольного сокращения мышц с изменением нормального положения тела. Изменения тонуса мышц приводит к нарушению ходьбы. Также из-за уже указанных нарушений работы мышц изменяется речь. Возникает повышенное слюноотделение.
Психиатрическая симптоматика примерно у трети пациентов предшествует всем остальным симптомам. Так как проявления неспецифичны, их обычно не связывают с болезнью Вильсона — Коновалова. У детей отмечается задержка или остановка умственного развития, снижение успеваемости в школе и способности концентрировать внимание. Наблюдается резкая смена настроения — неадекватное чувство счастья и восторга сменяется мимолетным чувством страха и необоснованной тревоги. Возможно вспышки агрессии или сексуальные отклонения. Острые психиатрические нарушения (психозы) случаются редко.
У взрослых пациентов снижается скорость мыслительных процессов при сохранной памяти на прошлые события. По мере развития слабоумия агрессию и депрессию сменяет беспричинная эйфория, а затем эмоциональная тупость и безучастность. Нарастают такие симптомы как беспричинный смех и плач, болезненные рефлексы ротовой мускулатуры, хватательные автоматизмы [10] .
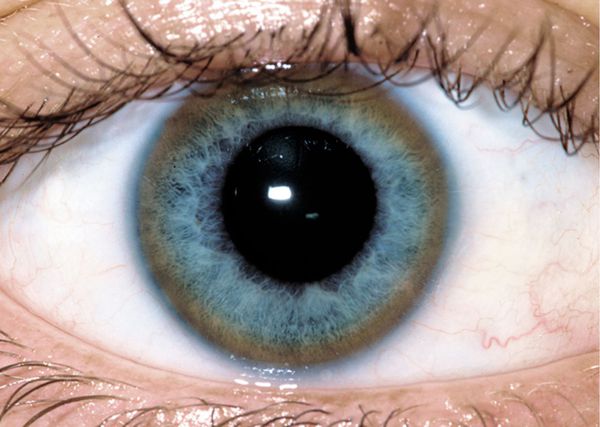
К поражениям глаз при болезни Вильсона относят кольца Кайзера-Флейшера и медную катаракту по типу «подсолнух». Но правильно трактовать эти симптомы может только специалист, так как они встречаются также при отравлении медью. Кольца Кайзера-Флейшера не всегда видны невооруженным глазом, иногда они обнаруживаются только при офтальмологическом осмотре при помощи щелевой лампы [1] [2] [3] [8] [15] .
Патогенез болезни Вильсона — Коновалова
Основной механизм развития болезни Вильсона — Коновалова — это нарушение обменных процессов в организме, в результате которых медь накапливается в различных органах и тканях с прогрессирующим нарушением их функций. Кроме того, за различные симптомы отвечает разнообразие мутаций гена ATP7B, определяющего, как именно проявится заболевание [12] .
Ген ATP7B кодирует белки, ускоряющие химические реакции меди у человека: АТФ-азу 7А и АТФ-азу 7В. Первый фермент способствуют всасыванию меди в кишечнике и её проникновению в головной мозг. Фермент мРНК АТФ-аза 7В обнаружен в клетках печени и сосудах капиллярах мозга. Он способствует выведению меди из головного мозга в кровь и из крови в желчь. Дефицит этого биологически активного вещества вызывает болезнь Вильсона — Коновалова.
Накопление меди в организме вызывает хроническое отравление (интоксикацию). Накапливаясь в печени и мозге, медь способствует гибели клеток этих органов. Это вызывает воспалительную реакцию и разрастание соединительной ткани в печени — фиброз печеночных протоков с нарушением их функций, из-за чего позже формируется цирроз. Гибель нервных клеток и их растворение (лизис) в головном мозге образует полости (кисты). Изменения других органов и тканей, как правило, незначительны.
При выбросе меди из разрушенных клеток в кровь под воздействием внешних факторов (инфекции, интоксикации, реакции на медикаменты) концентрация меди в плазме крови может повыситься в несколько раз. Это вызывает массированный распад эритроцитов, что приводит к тяжелому, чаще смертельному осложнению — фульминантной ( от лат. fulmino — молниеносный, мгновенно и быстро развивающийся) печеночной несостоятельности.
Всё многообразие симптомов болезни Вильсона — Коновалова вызывает не только накопление меди, но и отравление продуктами распада собственных клеток (аутоинтоксикация) [1] [2] [3] [7] [8] [15] .
Классификация и стадии развития болезни Вильсона — Коновалова
В России чаще всего применяется классификация, которая построена на клинических особенностях болезни, сочетания поражения печени и центральной нервной системы. Течение болезни Вилсона — Коновалова подразделяют на:
- бессимптомную форму;
- печеночную форму;
- церебральную форму;
- смешанную форму.
Также применяется классификация Коновалова, которая включает пять форм гепато-церебральной дистрофии:
- Брюшная (абдоминальная) форма — тяжёлое поражение печени, которое проявляется гепатопатией, вильсоновским гепатитом, циррозом печени и фульминарной печёночной несостоятельностью. Может привести к смерти до появления симптомов со стороны нервной системы. Продолжительность от нескольких месяцев до 3-5 лет;.
- Ригидно-аритмогиперкинетическая (ранняя) форма — характеризуется быстрым течением и начинается в детском возрасте. Среди симптомов преобладает мышечная скованность, приводящая к изменениям суставов и их тугоподвижности. Движения замедляются, руки и ноги могут непроизвольно двигаться спирально и червеобразно в сочетании с быстрыми непроизвольными сокращениями мышц. Характерны нарушения речи (дизартрия) и глотания (дисфагия), насильственный, непроизвольный смех и плач, нарушения эмоционального состояния, умеренное снижение интеллекта. Заболевание продолжается 2-3 года, заканчивается смертельным исходом.
- Дрожательно-ригидная форма встречается чаще остальных; начинается в юношеском возрасте, протекает медленно, иногда с периодами полного или неполного восстановления и внезапными ухудшениями, сопровождающиеся повышением температуры тела до 37–38 °C ; характерно одновременное развитие тяжёлой скованности мышц и ритмичного дрожания частотой 2-8 подёргиваний в секунду. Эти симптомы резко усиливаются при движениях и волнении, но исчезают в покое и во сне. Иногда наблюдаются дисфагия и дизартрия. Средняя продолжительность жизни около 6 лет.
- Дрожательная форма проявляется с возраста 20-30 лет, течёт относительно медленно (10-15 лет и более); преобладает дрожание, ригидность появляется лишь в конце болезни, иногда наблюдается пониженный тонус мышц; отмечается отсутствие мимики, медленная монотонная речь, тяжёлые изменения психики, частые эмоциональные вспышки, судорожные припадки.
- Экстрапирамидно-корковая форма встречается реже других. Типичные для гепато-церебральной дистрофии нарушения в дальнейшем осложняются внезапно развивающимися двигательными расстройствами по типу параличей (пирамидными парезами), судорожными (эпилептиформными) припадками и слабоумием тяжёлой степени. Длится 6-8 лет, заканчивается летально.
По течению заболевание можно разделить на две сменяющиеся стадии:
- латентная — характеризуется отсутствием внешних проявлений болезни, характерные изменения определяются только при лабораторном исследовании;
- стадия клинических проявлений — появляются специфические симптомы болезни гепато-церебеллярной дегенерации.
Во время лечения выделяют также стадию отрицательного баланса меди, при которой наблюдается регресс клинической симптоматики и характерных лабораторных изменений [4] .
Осложнения болезни Вильсона — Коновалова
Фульминантная форма гепатита (Вильсоновский криз) — одно из самых опасных осложнений (смертность около 60-95 %). Провоцирующим фактором становятся инфекции или интоксикации. Характерен массовый некроз клеток печени. В дальнейшем медь из поврежденных гепатоцитов обильно выделяется в кровь, что приводит к быстрому разрушению эритроцитов. Свободный гемоглобин из разрушенных эритроцитов дополнительно повреждают печень, замыкая патологический круг тяжелейшей интоксикации и оказывая токсическое действие на почки и другие органы. Характерный симптом — «тающая печень» (печень быстро уменьшается в размерах).
Цирроз — замещение нормальной ткани печени фиброзной (соединительной). Долгое время может прогрессировать без симптоматики, но при неврологических проявлениях болезни Вилсона — Коновалова присутствует у всех пациентов в той или иной степени. Цирроз печени приводит к постепенному нарушению её функций — особенно дезинтоксикации.
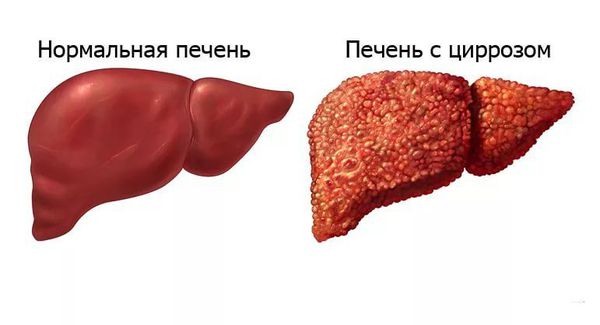
Гемолиз — повышенное разрушение красных телец крови (эритроцитов). Приводит к снижению количества эритроцитов и гемоглобина в крови — анемии. Основная функция эритроцитов — это доставка кислорода органам и тканям, поэтому снижение их количества приводит к недостаточному поступление кислорода. Это влечёт за собой нарушение метаболизма, внутренние органы начинают работать неправильно. Данное осложнение может протекать в острой, хронической и рекуррентной форме.
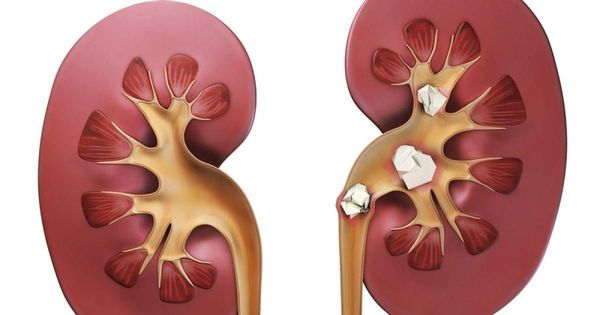
Образование камней в почках происходит из-за нарушения функционирования канальцев почек из-за накопления в почках меди. Камни мешают нормальной работе почек, ухудшают процесс фильтрации и усложняют процесс выделения мочи.
Параноидный бред — психотическое нарушение, чаще выражается в виде идей преследования, уничтожения, обвинения, ущерба или отравления [10] . Бред может быть как преходящим, так и затяжным. Возможно появление галлюцинаций.
Диагностика болезни Вильсона — Коновалова
Диагноз основывается на сочетании клинических симптомов, лабораторных данных и молекулярно-генетического тестирования. Ни один лабораторный тест, за исключением определения болезнетворного гена АТР7В на молекулярном уровне, не обеспечивает 100 % гарантию диагностики заболевания.
Основные диагностические показатели болезни Вильсона — Коновалова:
Суммарные баллы:
- 4 и более — высокая вероятность болезни;
- 2-3 — болезнь вероятна, но требуется дальнейшее обследование пациента;
- 0-1 — болезнь сомнительна.
Для уточнения степени поражения и формы заболевания используются МРТ головного мозга, хотя только на основании МРТ диагноз поставить нельзя. При МРТ исследовании сразу видны характерные очаги и уменьшение объёма головного мозга. Специфичным, но более редко встречающимся симптомом при данном заболевании на МРТ снимке является картина, напоминающая «лицо гигантской панды». КТ- и МРТ-проявления могут опережать клиническую симптоматику.
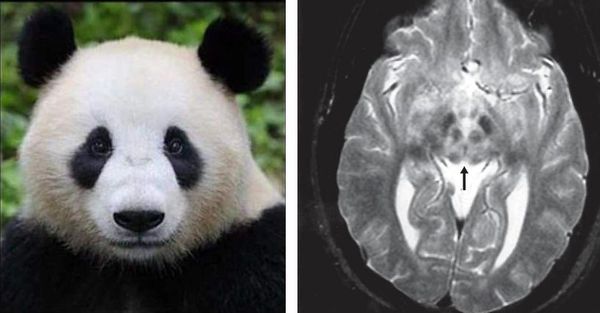
Компьютерная томография (КТ) головного мозга при наличии болезни выявляет увеличение желудочков, атрофию коры и ствола мозга. Однако более важным диагностическим методом при церебральной форме заболевания является именно МРТ.
Для определения очагов скопления меди и нехирургической оценки метаболизма мозга может потребоваться магнитно-резонансная спектроскопия (МРС). Это метод, позволяющий оценить изменения биохимической концентрации веществ при различных заболеваниях в тканях организма.
Также используется позитронно-эмиссионная томография (ПЭТ), позволяющая определить степень обмена и транспорта веществ в организме.
Перспективным методом ранней диагностики является транскраниальное УЗИ головного мозга.
Изменения, определяемые при УЗИ, КТ и МРТ печени и почек определяются и при других болезненных состояниях, поэтому не являются строго специфичными для болезни Вильсона — Коновалова и могут быть использованы только для оценки эффективности лечения.
Новым методом диагностики степени выраженности цирроза (фиброза) печени является эластометрия печени. Исследование использует способность ультразвука проходить с различной скоростью через ткани разной плотности, что позволяет определить изменение нормальной плотности органа [1] [2] [3] [8] [16] .
Лечение болезни Вильсона — Коновалова
Целью лечения при бессимптомной стадии болезни является предотвращение проявления симптомов и нормализация лабораторных показателей. Цель на стадии клинических проявлений — стабилизация и максимально возможная регрессия основных симптомов заболевания, а также нормализация лабораторных показателей. Лечение болезни Вилсона — Коновалова можно разделить на несколько направлений.
Медикаментозное лечение. Включает в себя использование препаратов, выводящих медь из организма (медьэлиминирующая или хелатная терапия), а также использование препаратов, снижающих усвоение меди. Данное лечение назначается пожизненно.
Мировая практика предусматривает применение следующих комплексообразующих препаратов: пеницилламин, триентин, тетратиомолибдат и унитиол. Из таблетированных лекарственных средств в Российской Федерации зарегистрированы препараты d-пеницилламина.
Также при болезни Вилсона — Коновалова используются медикаменты, замедляющие и уменьшающих степень поражения органов мишеней при интоксикации медью (патогенетическая терапия). Кроме того, проводится симптоматическая терапия. Для лечения симптомов заболевания и восстановление поражённых органов используются витамины группы B, С и Е, нейропротективные и нейрометаболические средства, антиконвульсанты для лечения судорожного синдрома, препараты для коррекции психических симптомов заболевания.
Лечение препаратами, содержащими витамины группы В, способно улучшить функционирование нервной ткани, процессы её восстановления и обмен веществ. Наиболее известными комбинированными препаратами этой группы являются мильгамма и комбилипен. Витамин С (аскорбиновая кислота) способствует удалению меди из организма.
Витамин Е (альфа-токоферола-ацетат) является антиоксидантом, способным замедлять процессы окисления в организме и защищать клетки от повреждающего действия и разрушения [5] [7] .
При поражении печени оправдано применение L-орнитина-L-аспартата и других гепатопротекторов. При периферических отёках и осците назначают мочегонные. Также при выраженных отёках возможно использование фуросемида (лазикса). В случае тремора рук и насильственных движениях назначают лоразепам или клоназепам. В случае невротических проявлений (тревожности, депрессии) назначают различные антидепрессаны и анксиолитики [14] .
Диетотерапия. Полное удаление меди из рациона невозможно, так как она содержится во всех продуктах. Однако необходимо исключить из пищи продукты, в которых содержание меди превышает 0,5 мг/100 г: субпродукты, моллюски, орехи, какао-продукты, грибы, бобовые, гречневая и овсяная крупа. Следует сократить потребление сахара, рафинированных углеводов и трансжиров. В целом диету при данном заболевании можно охарактеризовать как молочно-растительную, с достаточным содержанием белка.
Хирургическое лечение. Трансплантация печени при заболевании проводится в следующих случаях:
- при развитии фульминантной (молниеносной) печеночной несостоятельности;
- при безрезультатном лечении препаратами, связывающими медь в течение 3 месяцев;
- пациентам с декомпенсированным циррозом печени – нарастающей симптоматики печёночной недостаточности.
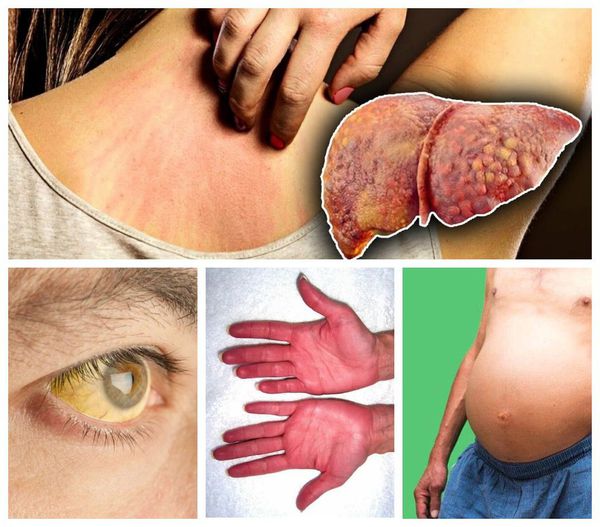
Декомпенированный цирроз печени — это нарушение нормальной работы печени, проявляющееся симптомами грубого нарушения пищеварительной функции. Проявляется следующим образом:
- Желтушность кожных покровов, склер глаз и слизистой рта;.
- Покраснение ладоней (печёночные ладони).
- Зуд кожи из-за накопления токсинов.
- Сосудистые звездочки, а также склонность к кровотечениям и гематомам при малейших повреждениях кожного покрова.
- Потеря аппетита, потеря веса вплоть до истощения;.
- Боли в области правого подреберья, иногда боли в животе без чёткой локализации.
- Накопление жидкости в брюшной полости (асцит).
- Печеночная энцефалопатия — прогрессирующее нарушение функций мозга (памяти, внимания мышления), изменение личности с неадекватным поведением различной выраженности, нарушение сознания (вплоть до комы). При несвоевременном лечении болезнь может привести к летальному исходу.
При трансплантации используется донорская пересадка печени — печень пересаживают целиком или частично. Трансплантация печени обеспечивает улучшение неврологической симптоматики более чем в 50 % случаев. При пересадке печени на стадии декомпенсированного цирроза печени выживание в течение первого года составляет 95 %, через 5 лет – 83 %, через 10 лет – 80%.
Плазмофильтрация и гемосорбция. Для удаления меди из организма также применяются фильтрация крови и плазмы: (плазмофильтрация и гемосорбция). При первой процедуре больного подключают к аппаратуре, благодаря которой кровь из одной руки, пройдя через аппарат, возвращается в другую. Клетки крови возвращаются в кровеносное русло сразу, а плазма проходит сквозь поры особого высокотехнологичного фильтра, где избавляется от продуктов распада и в очищенном виде возвращается в организм. При гемосорюбции цельная кровь пациента пропускается через ёмкость заполненную веществами – сорбентами.
В целом весь период лечения болезнь Вилсона — Коновалова можно разделить на 2 фазы: начальную фазу и фазу поддерживающей терапии. Критерием перехода на поддерживающую терапию является нормализация показателей обмена меди при 2-х последовательных исследованиях, выполненных с интервалом в 3 месяца [1] [2] [3] [8] [17] .
Прогноз. Профилактика
Болезнь Вильсона — Коновалова — это прогрессирующие заболевание, поэтому при отсутствии своевременного лечения больные умирают от цирроза печени или от инфекционно-токсических осложнений (редко). На фоне прогрессирующей неврологической симптоматики пациент может находиться в обездвиженном состоянии. При лечении выводящими медь препаратами и трансплантации печени длительная выживаемость пациентов является нормой.
Факторы, повышающие смертность при болезни Вильсона — Коновалова :
- Поздно установленнй диагноз.
- Самовольный отказ от лечения.
- Связанные с неврологической симптоматикой несчастные случаи.
- Невозможность подобрать эффективное лечение [5] .
Годовая выживаемость после трансплантации печени из-за фульминантной недостаточности достигает 70 %. Без трансплантации — единичные случаи. При декомпенсированном циррозе печени после трансплантации выживаемость пациентов в течение года — 95 %, через 5 лет — 83 %, через 10 лет — 80 %. Обратное развитие неврологической симптоматики после трансплантации отмечается более чем в 50 % случаев.
Восстановление функций печени происходит на 1-2 году лечения и не прогрессирует при полном выполнении всех рекомендаций. При фульминантном течении заболевания эффективно только оперативное лечение.
Специфической профилактики (вакцин, сывороток) для заболевания не существует в связи с его генетической природой.
Пациенты с болезнью Вильсона — Коновалова, которые узнают о диагнозе в результате плановых обследований и не имеют заметных симптомов, не воспринимают медикаментозное лечение как обязательное. В таком случае стоит говорить не о истинной профилактике заболевания, а скорее о профилактике внешних проявлений (клиники) болезни Вильсона — Коновалова и просветительской работе [9] .
Профилактика заболевания включает:
- медико-генетическое консультирование;
- пренатальную (предродовую) диагностику;
- преимплантационную генетическую диагностику.
Скрининг у пациентов, имеющих необъяснимое повышение сывороточных аминотрансфераз, хронический гепатит, цирроз печени и неврологические нарушения неизвестного происхождения должен проводиться в возрасте от 2 до 18 лет. Все родственники по прямой линии больного с диагностированной болезнью должны проходить плановое обследование на наличие у них заболевания.
При беременности, когда имеется риск рождения пациента с болезнью Вильсона — Коновалова, проводится молекулярно-генетический анализ фетальных клеток на 15-18 неделе беременности или ворсинок хориона на 10-12 неделе.
Преимплантационная генетическая диагностика болезни Вильсона — Коновалова заключается в проведении ЭКО, возможности диагностики заболеваний до самого оплодотворения и последующей имплантации оплодотворенного эмбриона в организм женщины. Это может предотвратить зачатие ребенка с генетическими болезнями. Такой метод профилактики может быть выбором в ситуации, когда в семье уже определены мутантные гены, способные вызвать болезнь [1] [2] [3] [15] [17] .
Список литературы
- Аснов А.Ю., Соколов А.А. Федеральные клинические рекомендации по диагностике и лечению болезни Вильсона-Коновалова (гепатолентикулярная дегенерация) С-Пб.: Литография СПб. 2015. 60 с.
- Профессиональные ассоциации: Союз педиатров России. Нарушения обмена меди (болезнь Вильсона) у детей. Год утверждения (частота пересмотра): 2016
- Профессиональные ассоциации: Союз педиатров России. Федеральные клинические рекомендации по оказанию медицинской помощи детям с болезнью Вилсона — Коновалова, 2013 год
- Н. В. Коновалов. Гепатоцеребральная дистрофия. М. Медгиз 1960
- J. M. Walshe Brain The conquest of Wilson’s disease, Volume 132, Issue 8, August 2009, Pages 2289–2295
- Davies LP, Macintyre G, Cox DW. New mutations in the Wilson disease gene, ATP7B: implications for molecular testing. Genet Test. 2008 Mar;12 (1) ссылка
- W. Cox Disorders of copper transport Volume 55, Issue 3, 1999, Pages 544–555
- Ronald F. Pfeiffer, M.D. Wilsons Disease 2007 April;27(2):123-132)ссылка
- Prevention of Wilson’s Disease in Asymptomatic Patients List of authors. Irmin Sternlieb, M.D., and I. Herbert Scheinberg, M.D.ссылка
- Вялова Н.В., Проскокова Т.Н. Психические расстройства при гепатолентикулярной дегенерации //Дальневосточный медицинский журнал, 2013.-N 4.-С.88-91.
- Вялова Н.В. Проскокова Т.Н., Хелимский А.М. Гепатолентикулярная дегенерация: клиника, диагностика, лечение // Дальневосточный медицинский журнал, 2012.-N 4.-С.130-134.
- Тулузановская И.Г., Жученко Н.А. Болезнь Вильсона-Коновалова: внутрисемейный клинический полиморфизм // Педиатрия —2017.-N 6.-С.215-216.
- Подзолков В.И., Покровская А.Е.,Трудности диагностики и лечения болезни Вильсона — Коновалова =// Клиническая медицина. 2017.-N 5.-С.465-470.
- Циммерман Я.С. Болезнь вильсона — гепатоцеребральная дистрофия // Клиническая медицина. 2017.-N 4.-С.310-315.
- Корой П.В. Болезнь Вильсона. Часть I. Этиология, патогенез, клинические проявления и скрининг // Вестник молодого ученого 2014.-N 3.-С.56-63
- Корой П.В. Болезнь Вильсона. Часть II. Этиология, патогенез, клинические проявления и скрининг // Вестник молодого ученого 2015. -N 1
- Корой П.В. Болезнь Вильсона. часть III. Общие принципы терапии, лечение в специальных ситуациях, мониторинг терапии и прогноз // Вестник молодого ученого 2015.-N 2.-С.35-44.
Источник https://medaboutme.ru/zdorove/spravochnik/bolezni/bolezn_vilsona_konovalova/
Источник https://www.krasotaimedicina.ru/diseases/zabolevanija_neurology/wilsons
Источник https://probolezny.ru/bolezn-vilsona-konovalova/