Болезни крови в хирургии
Советы хирургам по защите от инфекций передающихся через кровь
1. Какие заболевания, передающиеся с кровью, имеют наибольшее значение для хирурга?
Обычно среди возбудителей, передающихся при контакте с зараженной кровыо, основное внимание уделялось вирусу иммунодефицита человека (ВИЧ), однако рост заболеваемости гепатитом С в Северной Америке привел к тому, что именно гепатит сейчас является наиболее частым среди заболеваний, передающихся таким путем.
В настоящее время инфицирование вирусом гепатита В, который уже почти 50 лет считается профессиональной патологией хирургов, реже приводит к развитию заболевания, что связано с распространением прививок и разработкой сравнительно эффективной схемы лечения в случае контакта с вирусом.
2. Каков сравнительный риск заражения ВИЧ, HBV и HCV?
а) ВИЧ. На данный момент приблизительно 1 миллион жителей США инфицированы ВИЧ. Последние наблюдения показывают, что передача ВИЧ в больничных условиях происходит редко. Медработники составляют только 5% от всех больных СПИДом, и у большинства из них есть другие факторы, помимо профессиональных, вероятно, и вызвавшие заболевание. Наибольший профессиональный риск отмечен у медицинских сестер и работников лабораторий.
С 1 января 1998 года не отмечено ни одного документированного случая передачи ВИЧ от больного к врачу в результате профессионального контакта.
б) HBV. Нет сомнений, что все хирурги за время нормальной трудовой карьеры контактируют с HBV. Считается, что 1,25 миллиона жителей США болеют хроническим гепатитом В. Чрескожная инъекция инфицированной иглой приблизительно в 30% случаев приводит к развитию острого заболевания. В 75% гепатит В протекает клинически скрыто, а 10% инфицированных на всю жизнь остаются носителями вируса.
У многих носителей, потенциально заразных для окружающих, заболевание протекает бессимптомно, с минимальным прогрессированием или без прогрессирования. Примерно в 40% болезнь постоянно прогрессирует, приводя к циррозу, печеночной недостаточности или даже к генатоцеллюлярному раку.
в) HCV. Гепатит С стал для хирургов самой главной проблемой. Считается, что хроническим гепатитом С страдают приблизительно 4 миллиона жителей США. Риск сероконверсии при чрескожной инъекции инфицированной иглой составляет около 10%, однако в 50% острое заболевание приводит к хроническому носительству инфекции. О течении гепатита С до сих пор существуют различные мнения, однако почти у 40% больных хроническая HCV-инфекция приводит к развитию цирроза.
В последнем случае высок риск развития рака печени, вероятность которого достигает 50% в течение 15 лет.
3. Обеспечивает ли вакцинация против гепатита В полную защиту от заболевания?
В настоящее время для всех хирургов и лиц, работающих в операционной, доступна эффективная вакцинация против гепатита В. Вакцину против гепатита В получают с помощью рекомбинантной технологии; она не является разрушенными частицами вируса, полученными от инфицированных людей. Вводят три дозы вакцины, после чего следует определить титр поверхностных антител, чтобы убедиться в успешности вакцинации.
Приблизительно у 5% вакцинированных людей выработки антител не происходит и требуется повторная вакцинация. Некоторые люди остаются рефрактерными к вакцинации, для них сохраняется риск острого гепатита В. Вакцинация не гарантирует иммунизацию.
Согласно некоторым исследованиям, 50% практикующих хирургов не обладают достаточным иммунитетом к HBV из-за различных причин: отсутствия вакинации у старых хирургов, более чем 5-летнего срока после вакцинации, недостаточного количества рекомбинантной вакцины или неправильной вакцинации и, наконец, неспособности выработать соответствующий иммунный ответ.
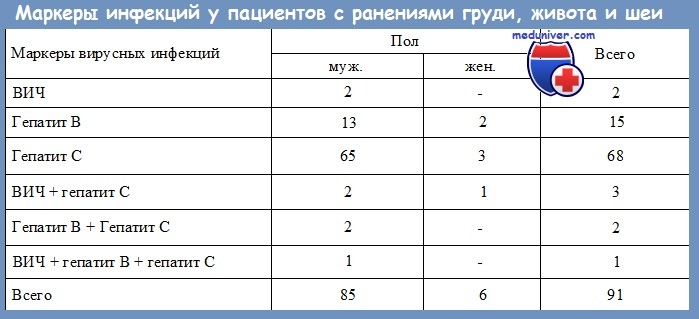
4. Существует ли риск заражения больных от хирургов, инфицированных HBV?
Передача вируса гепатита В от хирурга к больному документирована. Анализ крови хирургов, которые могут заразить больных, как правило, положителен на е-антиген вируса гепатита В. Е-антиген является продуктом распада вирусного нуклеокапсида и говорит об активной репликации вируса в печени. Обнаружение е-антигена свидетельствует о высоких титрах вируса и сравнительно высокой заразности больного.
Большое количество документированных случаев передачи гепатита В больным от лиц, занятых в хирургии, может вызвать особенные проблемы и ограничение клинической деятельности для клиницистов, передавших эту инфекцию. В одном из последних отчетов из Англии сообщается о передаче вируса гепатита В больному даже от хирурга с отрицательным анализом па е-антиген HBV.
В последнее время одна национальная организация призывает ограничить деятельность е-антиген-положительных хирургов. Вопрос, можно ли хирургу с хроническим гепатитом В продолжать практику, будет обсуждаться в будущем.
5. Какова правильная тактика при чрескожном контакте с кровью больного, у которого есть гепатит В?
Тактика зависит от вакцинированности медработника. Если он вакцинирован и имеет положительный титр антител, то ничего предпринимать не надо. Если медработник не вакцинирован и не имеет антител к HBV, то ему или ей следует ввести дозу анти-HBV иммуноглобулина и начать серию вакцинации против гепатита В.
Медработникам, которые ранее были успешно вакцинированы от гепатита В, однако не имеют или имеют незначительный титр антител, следует ввести дозу анти-HBV иммуноглобулина и повторную дозу вакцины против гепатита В. Поскольку в большинстве случаев таких контактов с больным неизвестно, инфицирован он или нет, то, в общем, хирургам необходимо знать, есть ли у них антитела, и периодически повторять иммунизацию против гепатита В через каждые 7 лет.
6. Чем HCV отличается от HBV? Кто из них опаснее?
а) Заболеваемость в США:
— HBV: примерно 1,25 миллиона больных.
— HCV: примерно 4 миллиона больных.
б) Путь и последствия заражения:
— HBV: ДНК-вирус, передающийся с кровью; острая форма переходит в хроническую в 10% случаев.
— HCV: РНК-вирус, передающийся с кровью; острая форма переходит в хроническую в 50% случаев.
в) Профилактика:
— HBV: эффективная рекомбинантная вакцина.
— HCV: в настоящее время вакцины не существует.
г) Защита после контакта:
— HBV: людям, которые не были вакцинированы и не имеют антител к HBV, целесообразно введение анти-HBV иммуноглобулина.
— HCV: клиническая эффективность анти-HCV иммуноглобулина не доказана. Среди больных, с которыми имеют дело хирурги в США, больше лиц с хроническим гепатитом С, чем с хроническим гепатитом В, а вакцины против HCV-инфекции нет. Риск сероконверсии для гепатита С составляет 10% против 30% для гепатита В, однако HCV-инфекция гораздо чаще переходит в хроническую форму (50% против 10%). Поэтому HCV-инфекция представляет для хирургов гораздо большую угрозу.
7. Насколько высок риск для медработника заразиться ВИЧ?
Первый случай заражения ВИЧ медработника отмечен в 1984 году. К декабрю 1997 года эпидемиологические центры получили около 200 сообщений о профессиональном заражении. Изучение этих случаев показало, что 132 медработника имели факторы риска, не связанные с профессией, и только у 54 человек произошла документированная передача инфекции.
Передача инфекции подтверждалось, если был зафиксирован контакт медработника с кровью или биологическими жидкостями инфицированного больного, после чего была отмечена сероконверсия ВИЧ. Профессиональный риск безусловно выше у медицинских сестер и работников лабораторий. Общее число заражений несравнимо с большим количеством контактов с вирусом, которые, по всей видимости, имели место с начала эпидемии (начало 1980-х годов).
8. Меньше ли риск заражения ВИЧ при выполнении операций лапароскопическим способом?
В последнее время лапароскопическую хирургию у ВИЧ-инфицированных больных считают хорошей заменой открытым вмешательствам. Данный метод уменьшает вероятность контакта с кровью и острыми инструментами, однако за счет некоторых его особенностей возможно заражение хирургов иными путями, чем при обычной операции. При десуфляции пневмонеритонеума во время лапароскопических вмешательств происходит разбрызгивание капелек ВИЧ-инфицированной крови в операционной. Риск заражения можно уменьшить, направляя воздух в закрытую систему и принимая соответствующие меры предосторожности при смене инструментов.
9. Является ли эффективным методом защиты использование двойных перчаток?
Вследствие возможности контакта поврежденной кожи с кровыо риск заражения людей, работающих в операционной, вирусом гепатита или ВИЧ повышен. Хотя двойные перчатки могут не предотвратить повреждения кожи, показано, что они явно уменьшают вероятность контакта с кровыо. Исследования, посвященные контакту с кровыо в операционной, показали, что в 90% такой контакт происходит па коже рук хирурга дистальнее локтя, включая область, защищенную перчатками. Согласно одному исследованию, если хирург надевает две пары перчаток, то вероятность контакта его кожи с кровыо уменьшается па 70%. Прокол наружной пары перчаток наблюдали в 25% случаев, в то время как прокол внутренней пары — только в 10% (в 8,7% у хирургов и в 3,7% у ассистентов). Прокол внутренней пары перчаток отмечался при операциях, длившихся более 3 часов; он всегда сопровождался проколом наружной пары. Наибольшее повреждение происходило па указательном пальце неведущей руки.
10. Представляет ли большую угрозу для хирургов попадание капелек в глаза?
Исследование эпидемиологических центров показало, что приблизительно в 13% случаев документированной передачи ВИЧ имел место контакт со слизистой и кожей. Попадание капелек в глаза часто недооценивают, хотя этот вид контакта легче всего предотвратить. В недавно проведенном исследовании изучали 160 пар защитных экранов для глаз, используемых хирургами и ассистентами. Все операции длились 30 минут и более. На экранах подсчитывали количество капелек, вначале макроскопических, потом микроскопических. Кровь была обнаружена на 44% из исследуемых экранов. Хирурги замечали брызги всего в 8% случаев. Лишь 16% капелек были видны макроскопически. Риск попадания капелек в глаза был выше для хирурга, чем для ассистента, и увеличивался с увеличением времени операции. Доказано, что важным является также тип вмешательства: риск выше при сосудистых и ортопедических операциях. Защита глаз должна быть обязательной для всех работающих в операционной, особенно для непосредственно оперирующих лиц.
11. Как часто кровь хирурга контактирует с кровью и биологическими жидкостями больного?
Контакт с кровью возможен при повреждениях кожи (уколы, порезы) и соприкосновении с кожей и слизистыми (прокол перчатки, царапины на коже, попадание капелек в глаза). Контакт вследствие повреждения кожи наблюдают в 1,2-5,6% хирургических процедур, а контакт вследствие соприкосновения с кожей и слизистыми — в 6,4-50,4%. Разница в приводимых цифрах обусловлена различиями в сборе данных, выполняемых процедурах, хирургической технике и мерах предосторожности. Например, хирурги в San Francisco General Hospital принимают крайние меры предосторожности, надевая водонепроницаемую форму и две пары перчаток. Случаев передачи инфекции какому-нибудь медработнику при контакте его неповрежденной кожи с инфицированными кровью и биологическими жидкостями не отмечено. Однако сообщалось о заражении ВИЧ медработников, не имеющие других факторов риска, вследствие контакта с их слизистыми и кожей ВИЧ-инфицированной крови. Вероятность передачи инфекции при таком контакте остается неизвестной, поскольку в проспективных исследованиях у медработников после контакта их слизистой и кожи с ВИЧ-инфицированной кровью сероконверсии отмечено не было.
Риск заражения существует для всех работающих в операционной, однако он намного выше для хирургов и первых ассистентов, поскольку 80% случаев загрязнения кожи и 65% случаев повреждений приходится именно на них.
12. Только ли хирургической техникой объясняется загрязнение кожи?
Кожа с царапинами может контактировать с кровью или биологическими жидкостями даже при соблюдении всех мер предосторожности. К сожалению, далеко не вся защитная одежда защищает в равной степени. В одном исследовании отмечены дефекты у 2% стерильных хирургических перчаток сразу после их распаковки.
13. Какова вероятность сероконверсии после контакта крови медработника с кровью больного для ВИЧ и HBV?
Вероятность сероконверсии после укола иглой составляет 0,3% для ВИЧ и 30% для HBV.
14. Какова вероятность для хирурга заразиться ВИЧ на рабочем месте за все время его карьеры?
Риск передачи ВИЧ хирургу можно вычислить, зная частоту обнаружения ВИЧ у хирургических больных (0,32-50%), вероятность повреждения кожи (1,2-6%) и вероятность сероконверсии (0,29-0,50%). Таким образом, риск заразиться ВИЧ от конкретного больного находится в интервале от 0,11 на миллион до 66 на миллион. Если хирург выполняет 350 операций в год в течение 30 лет, то риск заражения на протяжении всей карьеры для него составляет от 0,12% до 50,0%, в зависимости от переменных величии. В этом подсчете допущено несколько предположений:
а) Мы допустили, что заболеваемость ВИЧ является величиной постоянной, однако считается, что в Соединенных Штатах за год она увеличивается на 4,0-8,6%.
б) Учитывается только контакт с зараженной кровью при повреждении кожи; возможность контакта со слизистыми и кожей (без ее повреждения) не принимается во внимание.
в) Риск считается одинаковым для всех операций, однако известно, что он зависит от длительности и срочности операции, а также от объема кровопотери.
Очевидно, что эти предположения не способствуют точности вычислений, поэтому подсчитанная вероятность — всего лишь грубая оценка на основании имеющихся данных.
15. Знают ли хирурги о своем профессиональном риске?
16. Есть ли эффективные методы уменьшить риск заражения хирургов инфекциями, передающимися с кровью?
Профилактике заражения HBV, помимо общих мер предосторожности, способствует высокоэффективная вакцина, которая, однако, не используется так часто, как следовало бы. Большинство хирургов в возрасте 45 лет и старше не вакцинированы. Также отработан протокол лечения после контакта. Наиболее прагматичный подход для профилактики передачи HCV и ВИЧ — уменьшить вероятность повреждения кожи и контакта с кожей и слизистыми за счет применения оптимальных методик и мер предосторожнсти.
Наконец, при попадании крови необходимо быстро ее удалить. При загрязнении кистей или рук следует их немедленно обработать. Если это невыполнимо, то область контакта надо смочить раствором повидон-йода, а когда это будет возможно — обработать.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Советы при раке предстательной железы
- Советы при нарушении мочеиспускания
- Советы детским урологам
- Что надо знать хирургам об организации современной медицины в США?
- Советы хирургам по защите от инфекций передающихся через кровь
- Советы по этике в отделении интенсивной терапии
- Общие требования к хирургическим вмешательствам (операциям)
- Как правильно держать и использовать скальпель?
- Как правильно держать, использовать зажим и иглодержатель?
- Техника перевязывания и перевязывания с прошиванием в хирургии
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Сепсис
Сепсис — общая гнойная инфекция, развивающаяся вследствие проникновения и циркуляции в крови различных возбудителей и их токсинов. Клиническая картина сепсиса складывается из интоксикационного синдрома (лихорадки, ознобов, бледно-землистой окраски кожных покровов), тромбогеморрагического синдрома (кровоизлияний в кожу, слизистые, конъюнктиву), метастатического поражения тканей и органов (абсцессов различных локализаций, артритов, остеомиелитов и др.). Подтверждением сепсиса служит выделение возбудителя из культуры крови и локальных очагов инфекции. При сепсисе показано проведение массивной дезинтоксикационной, антибактериальной терапии, иммунотерапии; по показаниям – хирургическое удаление источника инфекции.


- Причины сепсиса
- Патогенез
- Классификация
- Симптомы сепсиса
- Осложнения сепсиса
- Диагностика сепсиса
- Лечение сепсиса
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Сепсис (заражение крови) – вторичное инфекционное заболевание, вызванное попаданием патогенной флоры из первичного локального инфекционного очага в кровяное русло. Сегодня ежегодно в мире диагностируется от 750 до 1,5 млн. случаев сепсиса. По статистике, чаще всего сепсисом осложняются абдоминальные, легочные и урогенитальные инфекции, поэтому данная проблема наиболее актуальная для общей хирургии, пульмонологии, урологии, гинекологии. В рамках педиатрии изучаются проблемы, связанные с сепсисом новорожденных. Несмотря на использование современных антибактериальных и химиотерапевтических препаратов, летальность от сепсиса остается на стабильно высоком уровне – 30-50%.
Причины сепсиса
Важнейшими факторами, приводящими к срыву противоинфекционной резистентности и развитию сепсиса, выступают:
- со стороны макроорганизма — наличие септического очага, периодически или постоянно связанного с кровяным или лимфатическим руслом; нарушенная реактивность организма
- со стороны инфекционного возбудителя – качественные и количественные свойства (массивность, вирулентность, генерализация по крови или лимфе)
Ведущая этиологическая роль в развитии большинства случаев сепсиса принадлежит стафилококкам, стрептококкам, энтерококкам, менингококкам, грамотрицательной флоре (синегнойной палочке, кишечной палочке, протею, клебсиелле, энтеробактер), в меньшей степени — грибковым возбудителям (кандидам, аспергиллам, актиномицетам).
Выявление в крови полимикробных ассоциаций в 2,5 раза увеличивает уровень летальности больных сепсисом. Возбудители могут попадать в кровь из окружающей среды или заноситься из очагов первичной гнойной инфекции.
Велико значение внутрибольничной инфекции: ее росту способствует широкое применение инвазивных диагностических процедур, иммуносупрессивных лекарственных препаратов (глюкокортикоидов, цитостатиков). В условиях иммунодефицита, на фоне травмы, операционного стресса или острой кровопотери инфекция из хронических очагов беспрепятственно распространяется по организму, вызывая сепсис. Развитию сепсиса более подвержены недоношенные дети, больные, длительно находящиеся на ИВЛ, гемодиализе; онкологические, гематологические пациенты; больные сахарным диабетом, ВИЧ-инфекцией, первичными и вторичными иммунодефицитами.
Патогенез
Механизм развития сепсиса многоступенчатый и очень сложный. Из первичного инфекционного очага патогены и их токсины проникают в кровь или лимфу, обуславливая развитие бактериемии. Это вызывает активацию иммунной системы, которая реагирует выбросом эндогенных веществ (интерлейкинов, фактора некроза опухолей, простагландинов, фактора активации тромбоцитов, эндотелинов и др.), вызывающих повреждение эндотелия сосудистой стенки. В свою очередь, под воздействием медиаторов воспаления активизируется каскад коагуляции, что в конечном итоге приводит к возникновению ДВС-синдрома. Кроме этого, под влиянием высвобождающихся токсических кислородсодержащих продуктов (оксида азота, перекиси водорода, супероксидов) снижается перфузия, а также утилизация кислорода органами. Закономерным итогом при сепсисе является тканевая гипоксия и органная недостаточность.

Классификация
Формы сепсиса классифицируются в зависимости от локализации первичного инфекционного очага. На основании этого признака различают первичный (криптогенный, эссенциальный, идиопатический) и вторичный сепсис. При первичном сепсисе входные ворота обнаружить не удается. Вторичный септический процесс подразделяется на:
- хирургический – развивается при заносе инфекции в кровь из послеоперационной раны
- акушерско-гинекологический – возникает после осложненных абортов и родов
- уросепсис – характеризуется наличием входных ворот в отделах мочеполового аппарата (пиелонефрит, цистит, простатит)
- кожный – источником инфекции служат гнойные заболевания кожи и поврежденные кожные покровы (фурункулы, абсцессы, ожоги, инфицированные раны и др.)
- перитонеальный (в т. ч. билиарный, кишечный) – с локализацией первичных очагов в брюшной полости
- плевро-легочный – развивается на фоне гнойных заболеваний легких (абсцедирующей пневмонии, эмпиемы плевры и др.)
- одонтогенный– обусловлен заболеваниями зубочелюстной системы (кариесом, корневыми гранулемами, апикальным периодонтитом, периоститом, околочелюстными флегмонами, остеомиелитом челюстей)
- тонзиллогенный – возникает на фоне тяжелых ангин, вызванных стрептококками или стафилококками
- риногенный – развивается вследствие распространения инфекции из полости носа и придаточных пазух, обычно при синуситах
- отогенный — связан с воспалительными заболеваниями уха, чаще гнойным средним отитом.
- пупочный– встречается при омфалите новорожденных
По времени возникновения сепсис подразделяется на ранний (возникает в течение 2-х недель с момента появления первичного септического очага) и поздний (возникает позднее двухнедельного срока). По темпам развития сепсис может быть молниеносным (с быстрым развитием септического шока и наступлением летального исхода в течение 1-2 суток), острым (длительностью 4 недели), подострым (3-4 месяца), рецидивирующим (продолжительностью до 6 месяцев с чередованием затуханий и обострений) и хроническим (продолжительностью более года).
Сепсис в своем развитии проходит три фазы: токсемии, септицемии и септикопиемии. Фаза токсемии характеризуется развитием системного воспалительного ответа вследствие начала распространения микробных экзотоксинов из первичного очага инфекции; в этой фазе бактериемия отсутствует. Септицемия знаменуется диссеминацией возбудителей, развитием множественных вторичных септических очагов в виде микротромбов в микроциркуляторном русле; наблюдается стойкая бактериемия. Для фазы септикопиемии характерно образование вторичных метастатических гнойных очагов в органах и костной системе.
Симптомы сепсиса
Симптоматика сепсиса крайне полиморфна, зависит от этиологической формы и течения заболевания. Основные проявления обусловлены общей интоксикацией, полиорганными нарушениями и локализацией метастазов.
В большинстве случаев начало сепсиса острое, однако у четверти больных наблюдается так называемый предсепсис, характеризующийся лихорадочными волнами, чередующимися с периодами апирексии. Состояние предсепсиса может не перейти в развернутую картину заболевания в том случае, если организму удается справиться с инфекцией. В остальных случаях лихорадка принимает интермиттирующую форму с выраженными ознобами, сменяющимися жаром и потливостью. Иногда развивается гипертермия постоянного типа.
Состояние больного сепсисом быстро утяжеляется. Кожные покровы приобретают бледновато-серый (иногда желтушный) цвет, черты лица заостряются. Могут возникать герпетические высыпания на губах, гнойнички или геморрагические высыпания на коже, кровоизлияния в конъюнктиву и слизистые оболочки. При остром течении сепсиса у больных быстро возникают пролежни, нарастает обезвоживание и истощение.
В условиях интоксикации и тканевой гипоксии при сепсисе развиваются полиорганные изменения различной степени тяжести. На фоне лихорадки отчетливо выражены признаки нарушения функций ЦНС, характеризующиеся заторможенностью или возбуждением, сонливостью или бессонницей, головными болями, инфекционными психозами и комой. Сердечно-сосудистые нарушения представлены артериальной гипотонией, ослаблением пульса, тахикардией, глухостью сердечных тонов. На этом этапе сепсис может осложниться токсическим миокардитом, кардиомиопатией, острой сердечно-сосудистой недостаточностью.
На происходящие в организме патологические процессы дыхательная система реагирует развитием тахипноэ, инфаркта легкого, респираторного дистресс-синдрома, дыхательной недостаточности. Со стороны органов ЖКТ отмечается анорексия, возникновение «септических поносов», чередующихся с запорами, гепатомегалии, токсического гепатита. Нарушение функции мочевыделительной системы при сепсисе выражается в развитии олигурии, азотемии, токсического нефрита, ОПН.
В первичном очаге инфекции при сепсисе также происходят характерные изменения. Заживление ран замедляется; грануляции становятся вялыми, бледными, кровоточащими. Дно раны покрывается грязно-сероватым налетом и участками некрозов. Отделяемое приобретает мутный цвет и зловонный запах.
Метастатические очаги при сепсисе могут выявляться в различных органах и тканях, что обусловливает наслоение дополнительной симптоматики, свойственной гнойно-септическому процессу данной локализации. Следствием заноса инфекции в легкие служит развитие пневмонии, гнойного плеврита, абсцессов и гангрены легкого. При метастазах в почки возникают пиелиты, паранефриты. Появление вторичных гнойных очагов в опорно-двигательной системе сопровождается явлениями остеомиелита и артрита. При поражении головного мозга отмечается возникновение церебральных абсцессов и гнойного менингита. Возможно наличие метастазов гнойной инфекции в сердце (перикардит, эндокардит), мышцах или подкожной жировой клетчатке (абсцессы мягких тканей), органах брюшной полости (абсцессы печени и др.).
Осложнения сепсиса
Основные осложнения сепсиса связаны с полиорганной недостаточностью (почечной, надпочечниковой, дыхательной, сердечно-сосудистой) и ДВС-синдромом (кровотечения, тромбоэмболии).
Тяжелейшей специфической формой сепсиса является септический (инфекционно-токсический, эндотоксический) шок. Он чаще развивается при сепсисе, вызванном стафилококком и грамотрицательной флорой. Предвестниками септического шока служат дезориентация больного, видимая одышка и нарушение сознания. Быстро нарастают расстройства кровообращения и тканевого обмена. Характерны акроцианоз на фоне бледных кожных покровов, тахипноэ, гипертермия, критическое падение АД, олигурия, учащение пульса до 120-160 уд. в минуту, аритмия. Летальность при развитии септического шока достигает 90%.

Диагностика сепсиса
Распознавание сепсиса основывается на клинических критериях (инфекционно-токсической симптоматике, наличии известного первичного очага и вторичных гнойных метастазов), а также лабораторных показателях (посев крови на стерильность).
Вместе с тем, следует учитывать, что кратковременная бактериемия возможна и при других инфекционных заболеваниях, а посевы крови при сепсисе (особенно на фоне проводимой антибиотикотерапии) в 20-30% случаев бывают отрицательными. Поэтому посев крови на аэробные и анаэробные бактерии необходимо проводить минимум трехкратно и желательно на высоте лихорадочного приступа. Также производится бакпосев содержимого гнойного очага. В качестве экспресс-метода выделения ДНК возбудителя сепсиса используется ПЦР. В периферической крови отмечается нарастание гипохромной анемии, ускорение СОЭ, лейкоцитоз со сдвигом влево.
Дифференцировать сепсис необходимо от лимфогранулематоза, лейкемии, брюшного тифа, паратифов А и В, бруцеллеза, туберкулеза, малярии и других заболеваний, сопровождающихся длительной лихорадкой.
Лечение сепсиса
Пациенты с сепсисом госпитализируются в отделение интенсивной терапии. Комплекс лечебных мероприятий включает в себя антибактериальную, дезинтоксикационную, симптоматическую терапию, иммунотерапию, устранение белковых и водно-электролитных нарушений, восстановление функций органов.
С целью устранения источника инфекции, поддерживающего течение сепсиса, проводится хирургическое лечение. Оно может заключаться во вскрытии и дренировании гнойного очага, выполнении некрэктомии, вскрытии гнойных карманов и внутрикостных гнойников, санации полостей (при абсцессе мягких тканей, флегмоне, остеомиелите, перитоните и др.). В некоторых случаях может потребоваться резекция или удаление органа вместе с гнойником (например, при абсцессе легкого или селезенки, карбункуле почки, пиосальпинксе, гнойном эндометрите и др.).
Борьба с микробной флорой предполагает назначение интенсивного курса антибиотикотерапии, проточное промывание дренажей, местное введение антисептиков и антибиотиков. До получения посева с антибиотикочувствительностью терапию начинают эмпирически; после верификации возбудителя при необходимости производится смена противомикробного препарата. При сепсисе для проведения эмпирической терапии обычно используются цефалоспорины, фторхинолоны, карбапенемы, различные комбинации препаратов. При кандидосепсисе этиотропное лечение проводится амфотерицином В, флуконазолом, каспофунгином. Антибиотикотерапия продолжается в течение 1-2 недель после нормализации температуры и двух отрицательных бакпосевов крови.
Дезинтоксикационная терапия при сепсисе проводится по общим принципам с использованием солевых и полиионных растворов, форсированного диуреза. С целью коррекции КОС используются электролитные инфузионные растворы; для восстановления белкового баланса вводятся аминокислотные смеси, альбумин, донорская плазма. Для борьбы с бактериемией при сепсисе широко используются процедуры экстракорпоральной детоксикации: плазмаферез, гемосорбция, гемофильтрация. При развитии почечной недостаточности применяется гемодиализ.
Иммунотерапия предполагает использование антистафилококковой плазмы и гамма-глобулина, переливание лейкоцитарной массы, назначение иммуностимуляторов. В качестве симптоматических средств используются сердечно-сосудистые препараты, анальгетики, антикоагулянты и др. Интенсивная медикаментозная терапия при сепсисе проводится до стойкого улучшения состояния больного и нормализации показателей гомеостаза.
Прогноз и профилактика
Исход сепсиса определяется вирулентностью микрофлоры, общим состоянием организма, своевременностью и адекватностью проводимой терапии. К развитию осложнений и неблагоприятному прогнозу предрасположены больные пожилого возраста, с сопутствующими общими заболеваниями, иммунодефицитами. При различных видах сепсиса летальность составляет 15-50%. При развитии септического шока вероятность летального исхода крайне высока.
Профилактические меры в отношении сепсиса состоят в устранении очагов гнойной инфекции; правильном ведении ожогов, ран, локальных инфекционно-воспалительных процессов; соблюдении асептики и антисептики при выполнении лечебно-диагностических манипуляций и операций; предупреждении госпитальной инфекции; проведении вакцинации (против пневмококковой, менингококковой инфекции и др.).
Экстракорпоральная гемокоррекция при лечении аутоиммунных заболеваний

Термином «аутоиммунные заболевания» обозначена группа патологий, спровоцированных повышенной продукцией аутоиммунных антител, вызывающих воспаление или деструкцию здоровых тканей. В перечень входят такие заболевания, как гранулематоз, псориаз, проявления лучевой болезни, различные дерматозы, поражающие отдельные органы либо их системы. Лечение, прежде всего, назначается медикаментозное, включающее противовоспалительные, гормональные, обезболивающие препараты. Усилить действие лекарств, снизить их негативное побочное действие и вывести токсины из организма поможет экстракорпоральная гемокоррекция. Как показали практика и многочисленные клинические исследования, очищение крови аппаратным методом способствует нормализации иммунного статуса, быстрому исчезновению внешних проявлений болезни.
Что такое аутоиммунные заболевания и их гемокоррекция
Гиперпродукция аутоиммунных антител провоцирует ненормальную реакцию иммунитета на здоровые ткани собственного организма. В этом случае поражаются отдельные органы – кожа, глаза, суставы либо возникает системная патология (СКВ, АФС и другие). Диагностика системной красной волчанки, псориаза, аутоиммунных заболеваний желез внутренней секреции и т. д. является компетенцией многих профильных специалистов – ревматологов, гастроэнтерологов, неврологов, дерматологов.
В основе лечения патологий данного типа лежит медикаментозная терапия, призванная устранить причины и симптоматику. В качестве дополнительных способов могут использоваться физиотерапевтические и другие методики. В их число входит гравитационная хирургия крови – высокоэффективный современный метод очищения плазмы и обработки форменных элементов во внешнем контуре кровообращения.
При аутоиммунных поражениях организма в нашей клинике применяются:
- криоаферез – под воздействием низких температур из плазмы выделяются и удаляются кристаллы мочевой кислоты;
- плазмаферез – после разделения крови на фракции, плазма замещается донорской или стерильными растворами;
- каскадная фильтрация плазмы – многоступенчатая очистка крови от вредных примесей;
- инкубация клеточной массы лекарственными препаратами – насыщение клеток крови малыми дозами лекарств.
Результатом лечебного курса является полная детоксикация организма, причем улучшение самочувствия наступает уже после первой процедуры.
Показания и противопоказания
Гемокоррекция назначается при следующих аутоиммунных заболеваниях:
- болезнь Бехтерева;
- аутоиммунный тиреоидит (АИТ) и другие аутоиммунные заболевания щитовидной железы;
- псориаз, псориатический артрит;
- системная красная волчанка;
- гранулематоз Вегенера;
- проявления лучевой болезни – это поражения кожи, кишечника, крови;
- антифосфолипидный синдром;
- ревматоидный артрит.
Помимо перечисленных, аутоагрессия иммунных клеток по отношению к тканям собственного организма может поражать сердце, органы зрения, вызывать воспаление и язвенную болезнь желудка, а также прочие многочисленные заболевания.
Подготовка к гемокоррекции
Все процедуры очищения крови в нашей клинике выполняются на основании направления профильного специалиста. Потребуются также анализ мочи, исследования крови на свертываемость, инфекции (сифилис, ВИЧ), группу и резус-фактор.
Экстракорпоральная гемокоррекция на базе нашей клиники выполняется опытным врачом-трансфузиологом с применением современного оборудования. Мы гарантируем безопасное, эффективное и комфортное лечение. Запись на прием осуществляется по указанному телефону, а также через заполнение формы обратной связи на сайте.
Источник https://meduniver.com/Medical/Xirurgia/infekcii_peredaiuchiesia_cherez_krov.html
Источник https://www.krasotaimedicina.ru/diseases/hematologic/sepsis
Источник https://stomed.ru/therapies/gravitacionnaya-xirurgiya-krovi-ekstrakorporalnaya-gemokorrekciya/1803-ekstrakorporalnaya-gemokrrekciya-pri-lecenii-autoimmunnyx-zabolevanii