Сахарный диабет с поражением почек
Категории МКБ: Другие уточненные формы сахарного диабета с множественными осложнениями (E13.7), Другие уточненные формы сахарного диабета с поражением почек (E13.2), Инсулиннеозависимый сахарный диабет с множественными осложнениями (E11.7), Инсулиннеозависимый сахарный диабет с поражением почек (E11.2), Инсулинозависимый сахарный диабет с множественными осложнениями (E10.7), Инсулинозависимый сахарный диабет с поражением почек (E10.2), Сахарный диабет неуточненный с множественными осложнениями (E14.7), Сахарный диабет неуточненный с поражением почек (E14.2)
Разделы медицины: Эндокринология
Общая информация
- Версия для печати
- Скачать или отправить файл
Краткое описание
Российская ассоциация эндокринологов
Клинические рекомендации
Сахарный диабет с поражением почек
Возрастная категория: взрослые, дети
Год утверждения: 2016 (пересмотр каждые 3 года)
ID: КР89
Определение
Хроническая болезнь почек (ХБП) – наднозологическое понятие, обобщающее повреждения почек или снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2, персистирующие в течение более трех месяцев, вне зависимости от первичного диагноза. Термин ХБП особенно актуален для больных сахарным диабетом (СД), учитывая важность и необходимость унификации подходов к диагностике, лечению и профилактике почечной патологии, особенно в случаях минимальной выраженности и трудно устанавливаемой природы заболевания. Варианты почечной патологии при СД (собственно диабетический гломерулосклероз, инфекция мочевых путей, хронический гломерулонефрит, лекарственный нефрит, атеросклеротический стеноз почечных артерий, тубулоинтерстициальный фиброз и др.), имея различные механизмы развития, динамику прогрессирования, методы лечения, представляют особую проблему для больных диабетом, поскольку их частое сочетание носит взаимно отягощающий характер.
Кодирование по МКБ-10:
Е10.2 — Инсулинзависимый сахарный диабет с поражением почек
Е11.2 — Инсулиннезависимый сахарный диабет с поражением почек
Е10.7 — Инсулинзависимый сахарный диабет с множественными осложнениями
Е11.7 — Инсулиннезависимый сахарный диабет с множественными осложнениями
Е13.2 — Другие уточненные формы сахарного диабета с поражением почек
Е13.7 — Другие уточненные формы сахарного диабета с множественными осложнениями
Е14.2 — Сахарный диабет неуточненный с поражением глаз
Е14.7 — Сахарный диабет неуточненный с множественными осложнениями
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
+7 938 489 4483 / +7 707 707 0716 / + 375 29 602 2356 / office@medelement.com
Мне интересно! Свяжитесь со мной
Классификация
Классификация
Согласно концепции ХБП, оценка стадии почечной патологии осуществляется по величине СКФ, признанной как наиболее полно отражающей количество и суммарный объем работы нефронов, в том числе связанной с выполнением неэкскреторных функций (таблица 1).
Таблица 1. Стадии ХБП по уровню СКФ 

Уровень экскреции альбумина с мочой, отражающий системную эндотелиальную дисфункцию, состояние проницаемости гломерулярного барьера и реабсорбционную ёмкость проксимальных канальцев, является другим важным показателем почечной функции. Для количественного определения экскреции альбумина с мочой используются радиоиммунные, иммуноферментные и иммунотурбодимитрические методы. Альтернативным методом количественной оценки альбуминурии, не подверженным влиянию гидратации, служит измерение отношения альбумин/креатинин (А/Кр) в нефиксированном по времени произвольном образце мочи. Предпочтительна первая утренняя порция мочи, наилучшим образом коррелирующая с 24-часовой экскрецией белка. Выделяют три категории альбуминурии (таблица 2).

Таблица 2. Классификация ХБП по уровню альбуминурии
#включая нефротический синдром (СЭА >2200 мг/24 час [А/Кр>2200 мг/г; >220 мг/ммоль])
Традиционные градации альбуминурии: нормо- (
Этиология и патогенез
Этиология и патогенез
Диабетическая нефропатия (или диабетическая болезнь почек) (ДН) — результат воздействия метаболических и гемодинамических факторов на почечную микроциркуляцию, модулируемый генетическими факторами [1].
• Гипергликемия — основной инициирующий метаболический фактор развития диабетической нефропатии, реализующийся через следующие механизмы:
— неферментативное гликозилирование белков почечных мембран, нарушающее их структуру и функцию;
— прямое глюкотоксическое воздействие, связанное с активацией фермента протеинкиназы С, которая регулирует сосудистую проницаемость, контрактильность, процессы пролиферации клеток, активность тканевых факторов роста;
— активация образования свободных радикалов, обладающих цитотоксическим действием;
— нарушенный синтез важнейшего структурного гликозаминогликана мембраны клубочка почки — гепарансульфата. Снижение содержания гепарансульфата приводит к потере базальной мембраной важнейшей функции — зарядоселективности, что сопровождается появлением микроальбуминурии, а в дальнейшем, при прогрессировании процесса, и протеинурии.
• Гиперлипидемия — другой мощный нефротоксический фактор. Согласно современным представлениям, процесс развития нефросклероза в условиях гиперлипидемии аналогичен механизму формирования атеросклероза сосудов (структурное сходство мезангиальных клеток и гладкомышечных клеток артерий, богатый рецепторный аппарат ЛПНП, окисленных ЛПНП в том и другом случае).
• Протеинурия – важнейший негемодинамический фактор прогрессирвоания ДН. При нарушении структуры почечного фильтра крупномолекулярные белки приходят в соприкосновение с мезангием и клетками почечных канальцев, что приводит к токсическому повреждению мезангиальных клеток, ускоренному склерозированию клубочков, развитию воспалительного процесса в интерстициальной ткани. Нарушение тубулярной реабсорбции – основной компонент прогрессирования альбуминурии.
• Артериальная гипертония (АГ) у больных СД1 развивается вторично вследствие диабетического поражения почек. У больных СД2 эссенциальная АГ в 80% случаев предшествует развитию диабета. Однако и в том, и в другом случае она становится наиболее мощным фактором прогрессирования почечной патологии, превосходя по силе своей значимости метаболические факторы. Патофизиологические особенности течения СД — нарушение циркадного ритма АД с ослаблением его физиологического снижения в ночные часы и ортостатическая гипотония.
• Внутриклубочковая гипертензия — ведущий гемодинамический фактор развития и прогрессирования диабетической нефропатии, проявлением которой на её ранних стадиях служит гиперфильтрация. Открытие этого феномена стало «прорывным» моментом в понимании патогенеза ДН. Механизм активируется хронической гипергликемией, вызывая вначале функциональные, а затем структурные изменения в почках, приводящие к появлению альбуминурии. Длительное воздействие мощного гидравлического пресса инициирует механическое раздражение прилежащих структур клубочка, способствующее гиперпродукции коллагена и накоплению его в области мезангиума (начальный склеротический процесс). Другим важным открытием было определение сверхвысокой активности локальной ренин-ангиотензин-альдостероной системы (РААС) при СД. Локальная почечная концентрация ангиотензина II (АII) в 1000 раз превышает его содержание в плазме. Механизмы патогенного действия АII при СД обусловлены не только мощным вазоконстрикторным действием, но и пролиферативной, прооксидантной и протромботической активностью. В почках АII вызывает внутриклубочковую гипертензию, способствует склерозированию и фиброзированию почечной ткани посредством выброса цитокинов и факторов роста.
• Анемия – важный фактор прогрессирования ДН, ведет к почечной гипоксии, усливающей интерстициальный фиброз, тесно коррелириующий со снижением почечной функции. С другой стороны, выраженная ДН приводит к развитию анемии.
• Курение в качестве независимого фактора риска развития и прогрессирования ДН при остром воздействии ведет к активации симпатической нервной системы, влияя на АД и почечную гемодинамику. Хроническое воздействие никотина приводит к дисфункции эндотелия, а также к гиперплазии клеток интимы сосудов.
Риск развития ДН определенно детерминирован генетическими факторами. Только у 30–45% больных СД1 и СД2 развивается это осложнение. Генетические факторы могут действовать непосредственно и/или совместно с генами, влияющими на кардиоваскулярные заболевания, определяя степень восприимчивости органа-мишени к воздействию метаболических и гемодинамических факторов. Поиск ведется в направлении определения генетических дефектов, обусловливающих структурные особенности почек в целом, а также изучения генов, кодирующих активность различных ферментов, рецепторов, структурных белков, участвующих в развитии ДН. Генетические исследования (геномный скрининг и поиск генов-кандидатов) диабета и его осложнений сложны даже в гомогенных популяциях.
Результаты исследований ACCOMPLISH, ADVANCE, ROADMAP и некоторых других позволили признать ХБП независимым фактором риска развития сердечно-сосудистых заболеваний (ССЗ) и эквивалентом ишемической болезни сердца (ИБС) по риску осложнений. В классификации кардиоренальных взаимоотношений выделен 4 тип (хронический нефрокардиальный синдром), отражающий инициирующую роль хронической почечной патологии в снижении коронарной функции, развитии гипертрофии миокарда левого желудочка и повышении риска серьезных кардиоваскулярных событий посредством общих гемодинамических, нейрогормональных и иммунно-биохимических обратных связей. Эти взаимоотношения очень ярко проявляются при ДН [2-6].
Популяционные данные свидетельствуют о высочайшем риске сердечно-сосудистой смертности у больных на ГД независимо от возраста, приравненном к риску сердечно-сосудистой смертности у больных в возрасте 80 лет и более. До 50% этих пациентов имеют асимптоматическую значимую ишемию миокарда. Факт снижения почечной функции вследствие развития ДН ускоряет развитие сердечно-сосудистой патологии, поскольку обеспечивает действие дополнительных нетрадиционных факторов риска атерогенеза: альбуминурии, системного воспаления, анемии, гиперпаратиреоза, гиперфосфатемии, дефицита витамина D и др.
Эпидемиология
Эпидемиология
СД и ХБП – две серьезные медицинские и социально-экономические проблемы последних лет, с которыми столкнулось мировое сообщество в рамках пандемий хронических болезней. Частота развития ДН тесно зависит от длительности заболевания, с максимальным пиком в сроки от 15 до 20 лет течения СД. Согласно данным Государственного регистра СД распространенность ДН в среднем около 30% при СД1типа (СД1) и СД2 типа (СД2). В России, по данным регистра Российского диализного общества на 2011 г., больные СД обеспечены диализными местами лишь на 12,2% хотя реальная потребность такая же, как в развитых странах (30-40%) [7]. Менее учтенной и исследованной остается когорта больных СД с начальной и умеренной почечной недостаточностью, что затрудняет прогнозирование динамики распространенности ТПН и потребности в ЗПТ. Пятилетняя выживаемость больных СД, начавших лечение ГД наиболее низкая по сравнению с другими нозологическими группами, что свидетельствует о центральной роли гипергликемии в ускоренном формировании системных метаболических сдвигов, характерных для почечной недостаточности. Более высокие показатели выживаемости пациентам с СД обеспечивает трансплантация почки (особенно живой родственной), что позволяет рассматривать этот метод ЗПТ как оптимальный для данной категории больных.
Наличие ДН – важный независимый фактор риска развития сердечно-сосудистой патологии. Популяционное исследование в штате Альберта (Канада), включавшее 1,3 млн, госпитализированных пациентов и в дальнейшем наблюдаемых в течение 48 месяцев, продемонстрировало значимость ХБП в сочетании с СД для развития инфаркта миокарда (ИМ), сопоставимую с предшествующим ИМ. Риск общей смертности, включая в первые 30 дней после ИМ, оказался наиболее высоким в группе пациентов, имевших СД и ХБП [8]. По данным USRDS имеются значимые различия в частоте сердечно-сосудистой патологии у пациентов с ХБП и без ХБП независимо от возраста [9].
Диагностика
Диагностика
Жалобы и анамнез
Специфические симптомы ДН на стадии ХБП С1-3а А1-2 отсутствуют у больных СД2 и у большинства больных СД1 (редко отмечают эпизоды повышения АД). На стадии ХБП С4-5 отмечают слабость, сонливость, быструю утомляемость, выраженные стойкие отеки, стабильно повышенное АД, тошноту, иногда рвоту без облегчения состояния.
Физикальное обследование
На стадии ХБП С3-5 А3 отмечают отеки стоп, голеней, иногда бедер, лица, нарастание и постоянно повышенное АД у 80-90% больных.
Лабораторная диагностика
- Всем пациентам с сахарным диабетом 2 типа и пациентам с сахарным диабетом 1 типа при длительности заболевания более 5 лет как минимум один раз в год рекомендовано проводить исследование на наличие белка в моче (общий анализ мочи, анализ утренней порции мочи на соотношение альбумин/креатинин) (см. Алгоритм ведения пациентов) (приложение Б))
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
- Всем пациентам с сахарным диабетом рекомендовано определение уровня креатинина сыворотки и расчет СКФ по формуле CKD-EPI, а также определение в случайной порции мочи отношения альбумин/креатинин [1,13].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: в ходе первого обследования пациентов СД определяется уровень креатинина сыворотки и рассчитывается СКФ по формуле CKD-EPI. Если СКФ 30 мг/г (>3 мг/ммоль), повторить исследование через 3 месяца или ранее. Если значения СКФ 30 мг/г (>3 мг/ммоль) сохраняются, по крайней мере, 3 месяца диагностируется ХБП и проводится лечение. Если оба исследования соответствуют нормальным значениям, то их следует повторять ежегодно.
Группы риска развития ДН, которым необходимо проводить ежегодное мониторирование альбуминурии и СКФ представлены в таблице 3.
Таблица 3. Группы риска развития ДН, нуждающиеся в проведении ежегодного скрининга альбуминурии и СКФ 

Иная диагностика
- В случае затруднений этиологической диагностики почечной патологии и/или ее стремительного прогрессирования рекомендовано проведение консультации нефролога [7]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: В то время, как классические гистологические изменения диабетического гломерулосклероза наиболее часто определяются у больных СД1 с ДН, у больных СД2 с почечной дисфункцией морфологические изменения более гетерогенны. В серии биопсий почек у больных СД2 даже при протеинурии почти в 30% случаев определяются атипичные структурные изменения. Стереотипное представление о ДН может маскировать у них различные заболевания почек при СД: одно- или двусторонний атеросклеротический стеноз почечных артерий, тубулоинтерстициальный фиброз, инфекцию мочевых путей, интерстициальный нефрит, лекарственный нефрит и др. В связи с чем в спорных ситуациях показан консультация нефролога.
- При необходимости наряду с обязательными методами исследования для диагностики почечной патологии при СД (альбуминурия, осадок мочи, креатинин, калий сыворотки, расчет СКФ) проводятся дополнительные (дуплексное ультразвуковое исследование почек и почечных сосудов; ангиография почечных сосудов для диагностики стенозирующего процесса, эмболии сосудов и др.) [1]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
- Рекомендовано осуществлять скрининг кардиоваскулярной патологии у всех больных СД и ДН [8].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Категории СКФ и альбуминурии позволяют стратифицировать больных СД и ХБП по риску сердечно-сосудистых событий и терминальной почечной недостаточности (табл. 4). В качестве обязательных методов обследования можно отметить ЭКГ, ЭхоКГ, дополнительных: Пробы с физической нагрузкой: тредмил тест, велоэр-
гометрия), однофотонная эмиссионная компьютерная томография (сцинтиграфия) миокарда с нагрузкой, стресс-эхокардиография (с нагрузкой, с добутамином), МСКТ, Коронарография

Таблица 4. Комбинированный риск сердечно-сосудистых событий и терминальной почечной недостаточности у больных ХБП в зависимости от категории СКФ и альбуминурии
Примечание: #низкий риск – как в общей популяции, в отсутствии признаков повреждения почек категории СКФ С1 или С2 не удовлетворяют критериям ХБП.
##Альбуминурия – определяется отношение альбумин/креатинин в разовой (предпочтительно утренней) порции мочи, СКФ – рассчитывается по формуле CKD-EPI.
Лечение
Лечение
Консервативное лечение
- Рекомендовано достижение компенсации углеводного обмена для профилактики развития и замедления прогрессирования ХБП у больных СД [15]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Роль достижения компенсации углеводного обмена для профилактики развития и прогрессирования ДН убедительно показана в крупнейших исследованиях: DCCT (Diabetes Control and Complications Trial), UKPDS (UK Prospective Diabetes Study), ADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation) [10,11].
Контроль гликемии становится проблематичным на выраженных стадиях ХБП в силу ряда причин. Это, прежде всего, риск гипогликемии вследствие снижения ренального глюконеогенеза и кумуляции инсулина и антигликемических агентов и их метаболитов. Риск гипогликемий может превысить преимущества гликемического контроля (вплоть до развития жизнеугрожающих аритмий).
Кроме того, достоверность гликированного гемоглобина (HbA1c) как показателя компенсации углеводного обмена на этих стадиях ХБП, часто сопровождающихся анемией, ограничена из-за уменьшения периода полужизни эритроцитов, изменения их свойств под действием метаболических и механических факторов, влияния терапии. Ситуация усложняется тем, что выраженная гипергликемия, изменяя функциональные свойства мембраны эритроцитов и гемоглобина, и, соответственно, приводя к гипоксии, ускоренной деструкции красных кровяных клеток, их повышенной адгезии к эндотелию, сама по себе может способствовать уменьшению периоду полужизни эритроцитов. Тем не менее, необходимость контроля гликемии на всех стадиях ХБП, очевидна при большой осторожности при его интенсификации с учетом повышенного риска кардиоваскулярной смертности в соответствии с выраженностью почечной дисфункции [12]. Особенно сложно контролировать гликемию пациентам с СД, получающим диализную терапию. Это пациенты с развернутой клиникой микро-и макрососудистых осложнений, нарушенной функцией автономной нервной системы, проявляющейся в том числе неспособностью распознавать гипогликемию, высочайшим риском общей и кардиоваскулярной смертности. В такой сложной клинической ситуации целесообразным представляется максимально индивидуальный подход для определения целевых показателей гликемического контроля и выбора сахароснижающих препаратов при СД2 с учетом имеющихся ограничений.
Последние рекомендации KDIGO рассматривают гликемический контроль как часть мультифакторной интервенц ионной стратегии, направленной на контроль АД и кардиоваскулярного риска [13]. В рекомендациях Национального почечного фонда США (NKF KDOQI) определены целевые уровни HbA1c у лиц с СД и ХБП с учетом имеющихся рисков [14]:
Согласно Алгоритмам специализированной медицинской помощи, больным сахарным диабетом для пациентов с выраженными осложнениями, сопутствующей патологией, небольшой ожидаемой продолжительностью жизни, риском гипогликемий целевое значение HbA1c
- Рекомендована коррекция дозы сахароснижающих препаратов/инсулина при ХБП С3-С5 с учетом повышения риска гипогликемий [11].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Инсулинотерапия как наиболее эффективная обеспечивает наибольшее снижение HbA1с. На 4-5 стадиях ХБП потребность в инсулине может снижаться в силу замедления его деградации, снижения уровня катехоламинов, ренального глюконеогенеза, изменения нутритивного статуса с гипопротеинемией, что требует соответствующей редукции дозы. Важно отметить частоту автономной нейропатии у пациентов с ХБП, проявляющуюся, в том числе, нераспознаванием «гипо». Следует отметить предпочтительность аналогов инсулина для этой группы пациентов с учетом их преимуществ по минимизации риска гипогликемий и необходимость мониторирования гликемии. Меньше внимания уделяется вопросам возможности развития инсулинорезистентности с соответствующим повышением потребности в инсулине на выраженных стадиях ХБП под влиянием уремических токсинов, гипепаратиреоза, дефицита витамина D, ожирения, содержания глюкозы в диализных растворах.
Препараты сульфонилмочевины имеют такую же длительную историю применения, как и метформин ** – более 50 лет. Эта группа с выраженным гипогликемическим эффектом, усиливающимся на фоне снижения СКФ из-за аккумуляции активных метаболитов. Другие факторы могут вносить свой вклад в повышение риска гипогликемий – высокие дозы, пропуск приема углеводов, недостаток питания, сниженный аппетит, чрезмерный прием алкоголя, печеночная дисфункция, сердечная недостаточность, пожилой возраст, взаимодействие с другими препаратами (аспирин**, сульфониламиды, гемифиброзил, варфарин ** и др.), которые способны вытеснять сульфонилмочевинные препараты в плазме из их связи с белками. При развитии почечной патологии (включая ХБП 4 ст) возможно применение гликлазида **, глимепирида, гликвидона в редуцированной дозе при условии адекватного контроля гликемии.
Представитель группы глинидов, обладающих стимулирующим влиянием на секрецию инсулина (менее выраженную, чем сульфонилмочевинные препараты и, соответственно, меньшим риском гипогликемий), – репаглинид **, метаболизируется, в основном, в печени. Применение этого препарата не противопоказано у лиц с ХБП, включая диализных.
Глитазоны обладают не только сахароснижающим эффектом, благодаря повышению чувствительности к инсулину, но и прямым подоцитопротективным влиянием, независимым от гликемии, подтвержденным в экспериментальных и клинических исследованиях при недиабетических почечных повреждениях, что делает их весьма привлекательными для больных с СД и ХБП. Но установленные ассоциации при применении этих препаратов с задержкой жидкости, прибавкой массы тела, ухудшением сердечной недостаточности (часто сочетающейся с почечной патологией в рамках нефрокардиального синдрома), остеопорозом, особенно у менопаузальных женщин, раком мочевого пузыря, сужают показания по их применению. Несмотря на низкий риск гипогликемий и особенности фармакокинетики, не требующей альтерации дозы, глитазоны требуют очень большой осторожности при применении у лиц с СКФ менее 60 мл/мин/1,73 м2.
Ингибиторы альфа-глюкозидазы имеют ограниченный гипогликемический эффект при побочных явлениях (газообразование, диарея), ограничивающих их применение. Эти препараты не рекомендуются при снижении почечной функции.
Поиск средств контроля углеводного обмена, соответствующих современным требованиям эффективности и безопасности у лиц с ХБП, определяет повышенный интерес к возможностям инновационных препаратов инкретинового ряда. Они дополняют терапевтический арсенал клинициста благодаря улучшению функции бета-клеток, усиления глюкозозависимой секреции инсулина с низким риском гипогликемии, подавлению повышенной секреции глюкагона, благоприятным сердечно-сосудистым эффектам, способности контролировать массу тела. Это перспективные и многообещающие средства метаболического контроля в комплексной терапии сложнейшей группы пациентов с СД2 и ХБП. Особого внимания при применении агонистов рецепторов глюкагоноподобного пептида -1 (αГПП-1) у пациентов с ХБП заслуживают гастроинтерстинальные проблемы (гастропарез, энтеропатия и др., чаще развивающиеся при применении эксенатида), снижающие качество жизни, осложняющие контроль гликемии, влияющие на нутритивный статус. Применение αГПП-1 может усугубить эти проблемы ввиду потенциальной способности снижать моторику желудка и всасывания не только глюкозы, но и препаратов, требующих точного контроля концентрации (иммуносупрессантов у лиц с трансплантированной почкой). Комбинация ингибиторов ангиотензинпревращающего фермента и диуретиков – необходимая нефропротективная терапия при ХБП у больных СД2 – требует особой бдительности при назначении эксенатида ввиду возможного усугубления почечной дисфункции при развитии побочных эффектов. У пациентов со СКФ 30-50 мл/мин/1,73м2 требуется осторожное назначение препарата под контролем функции почек. Лицам со СКФ менее 30 мл/мин/1,73м2 эксенатид противопоказан. Другой препарат группы αГПП-1 – лираглутид, обладающий 97% гомологичностью с человеческим ГПП-1 демонстрирует близкие с эксенатидом эффекты при меньшей выраженности побочных эффектов и большим периодом полувыведения, позволяющим вводить препарат 1 раз в день. Применение лираглутида у лиц с ХБП и ТПН (на перитонеальном диализе) не продемонстрировало значимого повышения его экспозиции и риска развития побочных эффектов. Требуют особого внимания пациенты с гипоальбуминемией, поскольку 98% препарата связывается с белками крови. Опыт применения лираглутида у пациентов с умеренной почечной недостаточностью пока ограничен. В настоящее время применение препарата у пациентов с тяжелыми нарушениями функции почек, в т.м. числе с ТПН, противопоказано.
Исследование LEADER (Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results), показало наряду со снижением частоты сердечно-сосудистых событий, снижение развития и персистирования макроальбуминурии у пациентов с сахарным диабетом 2 типа и высоким риском кардиоваскулярных заболеваний на фоне терапии лираглутидом [19].
Ингибиторы дипептидилпептидазы -4 (ИДПП-4) заняли достойное место в международных и отечественных рекомендациях по лечению больных СД2. Определена эффективность и безопасность этих средств для лиц с нормальной функцией почек. В сравнении с другими гипогликемизирующими средствами ИДПП-4 демонстрируют при монотерапии меньший риск гипогликемий и возможных побочных гастроинтерстинальных эффектов, что делает их весьма привлекательными для контроля гликемии в условиях развивающейся почечной патологии. Применение этих препаратов при нарушении функции почек зависит от стадии ХБП. Следует особо отметить, что субстратами ДПП-4, помимо инкретинов, является ряд пептидов с известными кардиоваскулярными эффектами — BNP, NPY, PYY, SDF-1альфа, что открывает новые перспективы, помимо влияния на гликемический контроль, связанные с кардио-и нефропротективными свойствами.
Опубликованные результаты исследований свидетельствуют об эффективности и безопасности применяемых сегодня ИДПП-4 (ситаглиптин**, вилдаглптин**, саксаглиптин**, линаглиптин**) при монотерапии и присоединении к текущей сахароснижающей терапии у лиц со сниженной СКФ (включая лиц на диализе), сопоставимой с плацебо частотой нежелательных явлений, имеющих потенциальное отношение к самим препаратам, а также к функции почек, сердечно-сосудистой системы и частоте гипогликемий [20].
В ряду новых препаратов, активно разрабатываемых фармацевтическими компаниями, — селективные ингибиторы канальцевой реабсорбции глюкозы (глифлозины). Применение этих препаратов позиционируется с усилением натрийуреза с последующим умеренным снижением артериального давления посредством влияния на ренин-ангиотензин-альдостероновую систему (вероятно, повышая эффективность блокады этой системы) и снижением массы тела при усилении глюкозурии. Наряду с выраженным сахароснижающим действием, по результатам исследований они демонстрируют ряд побочных эффектов, осложняющих их применение, прежде всего частота мочевой и генитальной инфекции, крайне нежелательных у лиц с диабетом и поражением почек. В то же время, исследование EMPA-REG OUTCOME, включавшее пациентов с высоким риском ССЗ, показало преимущество терапии эмпаглифлозином в сравнении с плацебо по достижению конечной комбинированной точки (сердечно-сосудистая смерть, нефаталдьный инфаркт миокарда, нефатальный инсульт). Важно, что эти эффекты не зависели от функции почек – 25% участников имели СКФ менее 60 мл/мин, а 28% и 11% соответственно МАУ и протеинурию. Наряду с позитивным влиянием на ССС, пациенты группы эмпаглифлозина, продемонстрировали снижение альбуминурии [21].
Рекомендации по применению сахароснижающих препаратов в зависимости от стадии ХБП представлены в табл. 9. [15].

Таблица 9.Сахароснижающие препараты, допустимые к применению на различных стадиях ХБП.
# При ХБП С4 и С5 необходима коррекция дозы препарата.
- Рекомендована отмена метформина** при СКФ менее 45 мл/мин/1,73 м2 (ХБП C3б) [18]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Совместный Консенсус ADA (American Diabetes Association) и EASD (European Association for the Study of Diabetes) по лечению больных СД2 от 2006 и 2009 гг. и новая версия этого документа от апреля 2012 г. [16] предлагают использовать метформин** как препарат выбора при лечении СД2, поскольку его применение ассоциировано со снижением риска кардиоваскулярной патологии, общей смертности, инсулинорезистентности, низким риском гипогликемий и прибавки массы тела. До недавнего времени применение препарата было ограничено при снижении СКФ менее 60 мл/мин/1,73 м2 в связи с риском лактоацидоза. Однако, как показали последние исследования, риск развития этого осложнения завышен и в основном связан с гипоксическими состояниями. Авторы, проводившие анализ 347 исследований с участием больных СД2, не обнаружили свидетельств повышения риска развития лактатацидоза при приеме метформина** в сравнении с другими гипогликемическими препаратами [17]. Неоправданная и преждевременная отмена метформина ** может ухудшить контроль гликемии и привести к необходимости назначения других сахароснижающих агентов, имеющих свои проблемы безопасности. Руководящие принципы для использования метформина ** в США начали обновляться в 2011 году и были согласованы с такового Национального Института Здоровья Великобритании, Канадской Диабетической Ассоциацией и Австралийским Обществом Диабета. Поэтому современные рекомендации расширили возможности применения метформина **, включая лиц с ХБП 3 стадии с учетом других ограничений (анемия, сердечная, легочная недостаточность, дисфункция печени, дегидратация, контрастные процедуры) и соответствующей редукцией дозы, а также мониторированием функции почек. Важно отметить, что не рекомендуется инициировать терапию метформином ** на стадии ХБП 3в [18].
- Рекомендовано достижение целевого уровня АД менее или равно 140/85 мм рт ст при умеренной альбуминурии и менее или равно 130/85 мм рт ст при значительной альбуминурии с использованием комбинированной антигипертензивной терапии [22]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: артериальная гипертония (АГ) играет ключевую роль в развитии и прогрессировании ДН, также, как и в развитии макроваскулярной патологии, что требует оптимизации контроля АД. По мере прогрессирования ДН роль метаболических факторов снижается, и возрастает роль гемодинамических (АГ, внутриклубочковая гипертензия).
В международных рекомендациях ESH/ESC 2013 г. по АГ сформулированы целевые уровни АД у больных с ХБП (таблица 10) [22].
Таблица 10. Целевые уровни АД и терапевтические стратегии у больных ХБП 

Согласно Алгоритмам специализированной медицинской помощи, больным сахарным диабетом целевое значение АД при СД, включая больных с ХБП, на фоне антигипертензивной терапии 120-140/70-85 мм.рт.ст. [15]
Последние рекомендации KDIGO предлагают индивидуализировать целевой уровень АД в зависимости от возраста, имеющейся сердечно-сосудистой патологии, сопутствующих заболеваний, риска прогрессирования ХБП, наличия или отсутствия ретинопатии (у больных с СД и ХБП) и толерантности проводимой терапии [13].
При СД 1 генез АГ на 80-90% связан с развитием ДН. Она наблюдается у 35-40% больных СД 1. АГ при СД 1носит Na-зависимый и объемзависимый характер. В отличие от больных СД 1, у больных СД 2 АД уже повышено до развития ДН. У 80% больных СД 2 в момент диагностики заболевания амбулаторный контроль выявляет повышенное АД или нарушенный циркадный профиль АД (
- задержка натрия;
- чрезмерная активация РААС, по крайней мере, локальной в почках;
- симпатическая гиперактивация;
- замедление эндотелийзависимой вазодилатации.
Эти механизмы определяют выбор антигипертензивных средств –ИАПФ, БРА, петлевые диуретики, блокаторы симпатической системы.
Немаловажной особенностью АГ у больных СД является высокая частота ортостатической гипотонии, определяющая индивидуальные целевые уровни АД –наименьший уровень АД, при котором пациент не испытывает эффекты этого состояния.
АГ при СД, являясь симптомом формирующейся почечной патологии, в то же время представляет собой мощный фактор прогрессирования ДН, определяющий нарастание альбуминурии, темпы снижения СКФ, выраженность склеротических изменений почечной ткани, повышенную смертностью пациентов от уремии.
- Рекомендовано назначение препаратов из группы иАПФ или БРА для лечения небеременных пациентов с умеренной или значительной альбуминурией с мониторированием калия и креатинина даже при нормальном АД
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Блокада ренин-ангиотензин-альдостероновой системы (РААС) является наиважнейшей в терапии почечной патологии у больных СД, обеспечивая основной рено – и кардиопротективный эффект. ИАПФ стали первыми препаратами, внедренными в клиническую практику для блокирования активности РААС с целью профилактики развития и прогрессирования ДН и недиабетических хронических заболеваний почек. Комплексное воздействие ИАПФ и БРА включает антигипертензивное, антипротеинурическое действие, отсроченные негемодинамические эффекты, опосредованные снижением почечной экспрессии трансформирующего фактора-бета, и других цитокинов, а также антиатерогенные эффекты путем редукции концентрации циркулирующих молекул адгезии.
Наряду с явными преимуществами терапии ИАПФ, опыт их длительного применения показал ряд недостатков, которые ограничивают их использование. ИАПФ нередко вызывают сухой кашель, ангионевротический отек, обусловленные уменьшением распада брадикинина и подобных ему сосудорасширяющих метаболитов. Длительное (более 25 лет) применение ИАПФ показало, что в реальной клинической практике нефропротективный эффект от применения ИАПФ развивается только у 50% больных с ДН. У части пациентов с ДН, несмотря на использовании ИАПФ, продолжает прогрессивно снижаться почечная функция даже при удовлетворительном уровне контроля АД. Причинами недостаточной эффективности ИАПФ (феномен ускользания) могут быть активность альтернативных путей образования ангиотензина II, (контролируемые химазой, катепсином G, тонином и др.), злоупотребление солью, а также генетические факторы. Причины, механизмы, время развития феномена, а также его клиническое значение остаются пока предположительными и мало освещенными в литературе [23].
Более полную и селективную блокаду системы могут обеспечить БРА, которые действуют как антагонисты ангиотензина II (AII) в отношении АТ 1-рецепторов, опосредующих основные сердечно-сосудистые и почечные эффекты активации РААС при сохранении функции АТ 2-рецепторов, обеспечивающих дополнительное органопротективное действие. Заслуживает особого внимания тот факт, что ренопротективный эффект длительной терапии БРА в отличие от ИАПФ у больных СД не зависит от полиморфизма гена АПФ (DD или II). БРА реже вызывают гиперкалиемию за счет уменьшения канальцевой реабсорбции калия [24].
В лечении больных СД с нормальным уровнем АД и альбуминурией уровней А2 и А3 также должны применяться ИАПФ или БРА. В этой ситуации снижение степени альбуминурии может считаться целью лечения диабетического поражения почек. Регулярный контроль экскреции альбумина позволит оценить эффективность терапии и прогрессирование патологии (IIС) [25].
- [s1] Применение иАПФ и БРА требует регулярного мониторирования уровня калия и креатинина.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Комментарии: Почечная недостаточность не является противопоказанием для проведения терапии ИАПФ и БРА. Следует помнить, что их нефропротективные свойства находятся в прямой зависимости от длительности лечения, что снижает их эффективность при назначении на поздних стадиях почечной недостаточности и повышает риск побочных эффектов (нарастание гиперкреатининемии и уровня калия). Целесообразность назначения ИАПФ и БРА на стадии почечной недостаточности должна решаться в индивидуальном порядке. В этой ситуации обязателен контроль калия и креатинина перед назначением этих препаратов, через 10 дней лечения и в последующем ежемесячно. Стойкое повышение уровня креатинина на 30-50% после снижения дозы препарата или его повышение более чем на 50% сразу после назначения препаратов может свидетельствовать о дестабилизации почечной гемодинамики и необходимости немедленной отмены блокаторов РААС.
Комбинация ИАПФ+БРА наиболее дискутабельна. В проведенных клинических исследованиях не удалось подтвердить безопасность и эффективность сочетанного применения ИАПФ и БРА у больных СД.
Достижения антигипертензивной терапии последних двух десятилетий связаны с широким применением ИАПФ и БРА, имеющих особое значение для больных со стенозом почечных артерий. При монолатеральном стенозе прием этих препаратов необходим, прежде всего, для максимальной нефропротекции контралатеральной почки, благодаря предотвращению вторичной клубочковой гипертензии в неишемизированных нефронах и подавлению продукции молекулярных медиаторов фиброгенеза, а также для известных положительных эффектов в отношении сердечно-сосудистой системы. Даже в случае поражения контралатеральной почки без стеноза почечных артерий (гипертонический нефросклероз) начальное снижение СКФ может стабилизироваться. В случае же тотальной ишемии они могут вызвать резкое снижение СКФ за счет критического снижения клубочкового давления. В первых двух случаях терапию целесообразно продолжить с учетом положительных антипролиферативных, противовоспалительных клеточных эффектов блокады РААС, наблюдая за функциональным состоянием почек.
После успешной реваскуляризации почек блокаторы РААС необходимы для длительной нефропротекции вне зависимости от АД.
ИАПФ и БРА подавляют альдостерон (конечный продукт системы, подтвердивший свою роль как важного фактора прогрессирования кардиоваскулярных и почечных заболеваний), однако у части больных после начального периода эффективного подавления его уровень вновь может повыситься. Развивается феномен «ускользания ингибиции альдостерона» (по аналогии с АII). Этот феномен развивается приблизительно у 20% пациентов с сердечной недостаточностью и приблизительно у 40% с ДН. Его развитие связывают с неполной блокадой РААС, недостаточной комплаентностью, вариантностью употребления натрия и гомеостаза калия, фармакогенетикой, различиями в продукции AII в тканях и чувствительностью надпочечников к AII. Проблемой блокады альдостерона остается неселективность широко применяемого для этой цели препарата спиронолактона**, позволяющая связываться с прогестероновыми и андрогенными рецепторами (гинекомастия у мужчин и менструальные дисфункции у женщин). Эти побочные эффекты преодолеваются применением селективных антагонистов рецепторов альдостерона (эплеренон).
При длительном применении ИАПФ или БРА неизбежно происходит увеличение активности ренина плазмы вследствие снижения ативности AII и активации отрицательной обратной связи. Для нейтрализации высокой активности ренина плазмы ведутся исследования по применению прямых блокаторов ренина (алискирен). Они показали новые возможности усиления нефропротекции у больных СД, однако отдаленный прогноз при использовании этих препаратов сегодня требует изучения [26].
Целевой уровень АД у большинства больных СД с ДН не удается достичь без антигипертензивных препаратов других групп. Как правило, это многокомпонентная терапия с обязательным участием диуретиков.
- Рекомендовано назначение статинов при наличии дислипидемии [15,27]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Лечебные мероприятия, направленные на нормализацию липидного обмена, способствуют улучшению функции почек. Терапия ингибиторами редуктазы 3-гидрокси-3метилглютарового-кофермента А — статинами — для поддержания целевых показателей липидного обмена наиболее эквивалента для профилактики сердечно-сосудистой патологии и прогрессирования ДН. Наряду с эффективной коррекцией липидного обмена эти препараты обладают умеренным антипротеинурическим действием, подавляют выработку профиброгенных факторов. Согласно рекомендациям NKF-KDOQI применение статинов или комбинированной терапии статинами/эзитимибом снижает риск серьезных атеросклеротических событий у пациентов с СД и ХБП, включая лиц с трансплантированной почкой.
- Не рекомендовано инициировать терапию статинами у больных СД, находящихся на лечении ГД при отсутствии специфических сердечно-сосудистых показаний для их применения, что является крайне редкой клинической ситуацией.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
- Рекомендовано достижение целевого уровеня ЛПНП у больных СД на выраженных стадиях ХБП — менее 70 мг/дл (1,8 ммоль/л) [27].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
- Рекомендовано назначение антиагрегантов при отсутствии противопоказаний [2,31].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Дополнительно к основным нефропротективным средствам при ведении больных СД с почечной патологией применяют и антиагреганты, прежде всего, с целью кардиопротекции. Стандарты мультифакторной терапии включают аспирин для больных СД с почечной патологией для первичной и вторичной кардиоваскулярной профилактики. Рекомендации ESH/ESC 2013 подтвердили их особую значимость для пациентов с СКФ
- Рекомендовано назначение препаратов железа и эритропоэтина при возникновении почечной анемии у больных СД с ХБП С3-С5
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Комментарии: Анемия – модифицируемый фактор риска прогрессирования ДН и сердечно-сосудистых заболеваний. Коррекцию почечной анемии следует проводить эритропоэз-стимулирующими средствами (ЭСС), в сочетании с препаратами железа на додиализном этапе с целью уменьшения сердечно-сосудистой смертности, замедления прогрессирования ДН повышения выживаемости, и качества жизни. Для пациентов с ХБП и анемией (независимо от возраста и стадии ХБП) при первичном обследовании включаются клинический анализ крови, включающий концентрацию гемоглобина, индексы эритроцитов, количество и дифференциальный подсчет лейкоцитов, количество тромбоцитов, абсолютное число ретикулоцитов; оценка уровня ферритина сыворотки, насыщения трансферрина сыворотки (НТС), уровней витамина В12 и фолатов в сыворотке. Анемия диагностируется у взрослых и детей старше 15 лет с ХБП, если концентрация гемоглобина ниже 130 г/л у мужчин и ниже 120 г/л у женщин. Тяжесть анемии оценивается по гемоглобину, а не по гематокриту, поскольку последний относительно нестабилен, его измерения не стандартизованы и зависят от оборудования. Определение уровня эритропоэтина рутинно не используется для определения его недостаточности как причины анемии у пациентов с ХБП в большинстве клинических ситуаций. Эритропоэтическую активность можно оценить по абсолютному числу ретикулоцитов [28].
Коррекция дефицита железа пероральными или внутривенными препаратами может снизить выраженность анемии у пациентов с ХБП. Нескорректированный дефицит железа – важная причина пониженной чувствительности к терапии ЭСС. Важно выявлять дефицит железа, поскольку его коррекция может быстро компенсировать связанную с ним анемию, а исследование причин дефицита железа, которое должно последовать за его выявлением, может привести к установке диагноза. В отсутствие менструальных кровопотерь, истощение запасов железа и его дефицит могут быть связаны с кровопотерями через желудочно-кишечный тракт, вследствие задержки крови в диализаторе и магистралях, при хирургических процедурах (таких как создание сосудистого доступа), частым забором крови, влиянием на абсорбцию железа противоязвенных и фосфат-связывающих препаратов, сниженной абсорбцией железа вследствие воспаления.
У пациентов с ХБП (додиализные стадии) и анемией, не получающих терапию железом или ЭСС, следует провести пробную терапию внутривенными препаратами железа или 1-3 месячный курс пероральных препаратов железа. Желательно добиться увеличения концентрации гемоглобина без начала терапии ЭСС, НТС ≤30% и ферритина ≤500 нг/мл (мкг/л).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
- У пациентов с ХБП 5 на диализе рекомендована терапия ЭСС для предотвращения падения гемоглобина ниже 90 г/л при концентрации гемоглобина 90 и 100 г/л.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: У некоторых пациентов обоснована инициация терапии ЭСС при гемоглобине выше 100 г/л для улучшения качества жизни.
- У взрослых пациентов с ХБП не рекомендуется использовать ЭСС для поддержания концентрации гемоглобина выше 115 г/л.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Комментарии: При дальнейшем его повышении до полной нормализации может увеличиться риск развития острого инфаркта миокарда, инсульта, гипертензии, повыситься частота тромбозов хронической артериовенозной фистулы. В процессе лечения необходим постоянный контроль функции почек (динамика СКФ и креатинина крови), АД, гидратации, кардиодинамики, скорости прироста гемоглобина, гематокрита, содержания железа в организме, электролитных показателей, факторов свертывания крови. У некоторых пациентов возможна индивидуализация терапии для поддержания концентрации гемоглобина выше 115 г/л для улучшения качества жизни.
- У всех взрослых пациентов, получающих ЭСС не рекомендовано намеренное увеличение концентрации гемоглобина выше 130 г/л
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: При выборе ЭСС необходимо основываться на информации по фармакодинамике, безопасности, данных по клиническим исходам, стоимости и доступности. Следует использовать только ЭСС, одобренные независимым регуляторными органами. Среди «копийных» образцов ЭСС следует использовать только истинные биоаналоги.
- Не рекомендуется использование в качестве дополнительной терапии анемии андрогенов [28]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
- Не рекомендуется использование в качестве дополнительной терапии анемии витамина C**, витамина D, витамина E, фолиевой кислоты**, L-карнитина и пентоксифиллина**.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
- При лечении хронической анемии рекомендовано избегать, где возможно, переливания эритроцитов для минимизации общих рисков, связанных с их использованием. [28]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
- Объектом активной терапии должна оставаться гиперкалиемия. При уровне калия более 5,5 ммоль/л наряду с диетическими ограничениями рекомендуется применение ионообменных смол (полистиролсульфонат натрия внутрь 15 г 4 раза в день — не зарегистрированы в РФ), петлевых диуретиков. При более значимом повышении уровня калия, угрожающим остановкой сердца (на ЭКГ – удлинение интервала PQ, расширение комплекса QRS, сглаженность волн P) решается вопрос о проведении ГД. [13] (Not graded)
- Рекомендовано достижение целевых уровней показателей фосфорно-кальциевого обмена при ХБП С3-С5
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Комментарии: нарушения фосфорно-кальциевого гомеостаза ответственны за развитие остеодистрофии, кальцификацию сосудов и мягких тканей, повышения кардиоваскулярной заболеваемости и смертности. Существенные достижения в расшифровке механизмов их развития, включая открытие фосфатурических гормонов, подходах в коррекции с использованием принципиально новых фармакологических препаратов (активаторы рецепторов витамина D (паракальцитол**), не содержащие кальций фосфатбиндеры (севеламер**, лантата карбонат), кальциймиметики (цинакальцет**)) сформировали новую концепцию – «минеральные и костные нарушения при хронической болезни почек – МКН-ХБП». Снижение массы функционирующей почечной ткани ведет к уменьшению продукции кальцитриола, гипокальциемии, гиперфосфатемии, повышению уровня паратгормона (ПГ), развитию вторичного гиперпаратиреоза. Коррекция этого состояния требует соблюдения гипофосфатной диеты, применения фосфатсвязывающих препаратов, метаболитов витамина D и их аналогов, кальцимиметиков. При СД1 ситуация осложняется высокой частотой низкообменной формы ренальной остеодистрофии, проявляющейся остеомаляцией и адинамическим заболеванием скелета, главная роль в развитии которой принадлежит дефициту инсулина.
- Рекомендовано проводить ежегодно измерение уровня кальция, фосфора, ПГ, щелочной фосфатазы у взрослых при СКФ
Уровень убедительности рекомендаций С (уровень достоверности доказательств –1).
У лиц со СКФ
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: показания к проведению экстракорпоральных методов лечения ТПН при ДН определяются раньше, чем у больных с иной почечной патологией, поскольку при СД задержка жидкости, нарушение азотистого и электролитного баланса развивается при более высоких значениях СКФ. При снижении СКФ менее 15 мл/мин/1,73м2, тяжелой гипергидратации с риском развития отека легких, серозите, выраженном зуде, метаболическом ацидозе, нарастании белково-энергетической недостаточности, электролитных нарушений, неконтролируемом АД, изменении ментального статуса на фоне уремической интоксикации необходимо оценить показания и противопоказания к применению методов заместительной терапии: ГД, перитонеального диализа и трансплантации почки [29].
Выбор диализной терапии должен быть индивидуальным. При этом следует учитывать как социальные, так и медицинские аспекты предстоящей диализной терапии. При отсутствии противопоказаний необходимо ориентировать пациентов на перспективу пересадки почки, рассматривая ГД или перитонеальный диализ как временный этап при подготовке к трансплантации. Согласно рекомендациям KDIGO имеются преимущества при трансплантации почки от живого донора лицам со СКФ
- Рекомендовано лечение пациентов с ДН и ИБС, сердечной недостаточностью по поводу кардиальной патологии в полном объеме в соответствии с национальными и международными рекомендациями, если нет противопоказаний
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Стратегия терапии у больных ХБП и ССЗ представлена в таблице 8 [31].

Таблица 8. Стратегия терапии у больных ХБП и ССЗ
#необходима коррекция дозы препаратов с учетом СКФ
Основные принципы лечения ДН в зависимости от стадии осложнения представлены в Приложении Г – 2.
Дополнительная информация, влияющая на течение и исход заболевания
Применение лекарственных препаратов при ХБП
Последние рекомендации KDIGO обращают особое внимание на меры предосторожности при применении различных лекарственных средств у лиц с ХБП. При расчете доз лекарственных препаратов у пациентов с ХБП необходимо учитывать СКФ (IA). При использовании препаратов потенциально токсичных или имеющих узкий терапевтический диапазон, а также в случае неприменимости расчетных формул (например, дефицит мышечной массы) рекомендуется для расчета СКФ использовать клиренсовые методы или методы, основанные на определении концентрации цистатина С (IС). У лиц со СКФ
Не рекомендуется пользоваться средствами из трав лицам с ХБП (IВ). Обязательна предварительная консультация врача при приеме каких-либо препаратов, в том числе и биологических добавок у лиц с ХБП (IВ). Всем пациентам, принимающим потенциально нефротоксичные препараты, такие как литий, ингибиторы кальцийневрина, независимо от уровня СКФ, необходим мониторинг электролитов и концентрации препарата (IА). Пациентам с ХБП не должны отказывать в терапии при развитии других заболеваний, прежде всего онкологических, при условии коррекции доз цитотоксических препаратов соответственно уровню СКФ.
Визуализирующие исследования при ХБП
Проведение визуализирующих исследований с применением рентгенконтрастных препаратов предполагает оценку диагностической и терапевтической ценности ожидаемых результатов, а также риск развития острого почечного повреждения. При проведении исследований с внутривенным введением йодсодержащих рентгенконтрастных препаратов у пациентов со СКФ
- Избегать применения высокоосмолярных препаратов (IВ)
- Использовать минимально возможную дозу рентгенконтрастного препарата
- Отмена потенциально нефротоксичных препаратов до и после исследования (IС)
- Адекватная гидратация пациента с использованием физиологического раствора до, вовремя и после проведения исследования (IА)
- Оценка СКФ через 48-96 часов после исследования (IС)
Возможно применение гадолиниевых препаратов на основе макроциклических хелатных комплексов для пациентов со СКФ
Диабетическая нефропатия — симптомы и лечение
Что такое диабетическая нефропатия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Абдуллиной Гузель Альбертовны, эндокринолога со стажем в 8 лет.
Над статьей доктора Абдуллиной Гузель Альбертовны работали литературный редактор Вера Васина , научный редактор Елена Застело и шеф-редактор Маргарита Тихонова

Эндокринолог Cтаж — 8 лет
Медицинский центр «Мэди»
«Многоклиника»
Дата публикации 24 ноября 2022 Обновлено 12 декабря 2022
Определение болезни. Причины заболевания
Диабетическая нефропатия (Diabetic nephropathy) — это осложнение сахарного диабета, при котором повреждаются почки. На ранних стадиях заболевание никак не проявляется, но постепенно развивается гипертония, ухудшается работа почек, в моче появляется белок, человек быстрее устаёт, у него отекают разные части тела, особенно ноги [1] .
Диабетическая нефропатия — это серьёзная болезнь, которая может привести к смерти. Заболевание нельзя полностью вылечить, но можно предотвратить или замедлить его развитие.
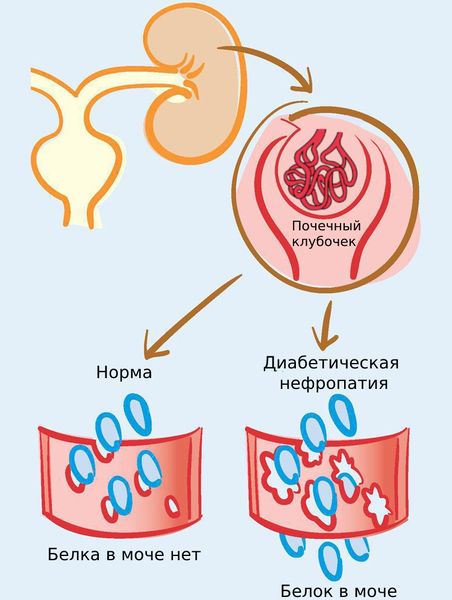
Диабетическая нефропатия может развиться при сахарном диабете как 1-го, так и 2-го типа. Обычно заболевание возникает через 10–15 лет от начала сахарного диабета 2-го типа и через 20–40 лет (по другим данным, через 15 – 20 лет) от начала диабета 1-го типа [11] [12] . Возможно, это связано с тем, что диабет 2-го типа часто не сразу диагностируют [13] .
Эпидемиология
Диабетическая нефропатия чаще развивается у мужчин, чем у женщин [12] . В США болезни более подвержены афроамериканцы, коренные жители Америки и мексиканцы [18] . Предположительно, это связано с генами ангиотензинпревращающего фермента (АПФ) и рецептора ангиотензина, которые сейчас изучаются.
Факторы риска диабетической нефропатии
- продолжительный сахарный диабет;
- высокий уровень глюкозы в крови;
- неконтролируемая гипертония (предположительно, высокое давление является и фактором риска, и следствием диабетической нефропатии) [12] ;
- ожирение;
- курение;
- высокий уровень холестерина и дислипидемия;
- гипертония и сердечно-сосудистые заболевания у близких родственников.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы диабетической нефропатии
На ранних стадиях диабетическая нефропатия никак не проявляется: специфических симптомов может не быть десятилетиями. В этот период присутствуют только проявления сахарного диабета и хронической болезни почек (ХБП):
- белок в моче;
- гипертония;
- анемия;
- электролитные нарушения, которые могут проявляться подёргиваниями мышц [19] ;
- ацидоз (повышение кислотности в организме);
- нарушения фосфорно-кальциевого обмена (кости становятся менее прочными, увеличивается уровень кальция в сосудах и тканях [20] ).
С развитием болезни начинают отекать разные части тела, особенно ноги, а из-за повышенного уровня белка в моче появляется пена. Человек также начинает быстрее утомляться [12] .
Патогенез диабетической нефропатии
Существует несколько теорий развития диабетической нефропатии:
- метаболическая;
- гемодинамическая;
- генетическая.
Болезнь начинается с поражения мелких сосудов почек, которое вызвано избытком глюкозы в крови. Кровоток в клубочках нарушается, они начинают быстрее фильтровать кровь — это ранний признак ухудшения работы почек и предвестник развития ХБП. На какое-то время скорость фильтрации нормализуется за счёт повреждения почек и умеренной гипертонии. Но при этом развивается склероз почечных клубочков: их базальные мембраны разрастаются и уплотняются, иногда образуются узелки Киммельстила — Уилсона.
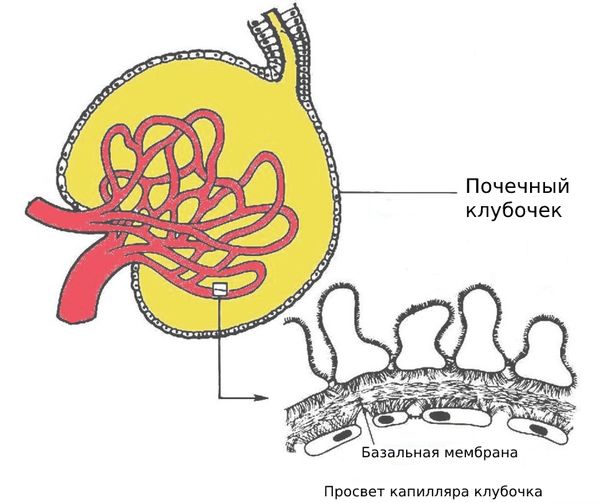
Cо временем скорость фильтрации снижается, и в мочу попадает больше белка альбумина. Постепенно, обычно в течение многих лет, его количество увеличивается (от 30 до 300 мг/день). Почки работают всё хуже, и развивается нефротический синдром, при котором уровень альбумина превышает 3 г/день. Этот синдром длится примерно 3–5 лет (но срок очень индивидуален), а затем развивается терминальная стадия ХБП. Ускорить её развитие могут инфекции дыхательных и мочевых путей, папиллярный некроз (разрушение сосочков почек), почечный тубулярный ацидоз IV типа (повышение кислотности и электролитные нарушения, вызванные нарушением чувствительности к альдостерону) [13] .
Классификация и стадии развития диабетической нефропатии
Диабетическую нефропатию классифицируют по стадиям клиренса креатинина (скорости клубочковой фильтрации, СКФ) и степени альбуминурии [4] . Клиренс креатинина показывает, сколько крови почки могут очистить от креатинина за минуту.
Стадии клиренса креатинина (мл/мин):
- высокая и оптимальная (С1) — более 90;
- незначительно снижена (С2) — 60–89;
- умеренно снижена (С3а) — 45–59;
- существенно снижена (С3б) — 30–44;
- резко снижена (С4) — 15–29;
- терминальная почечная недостаточность (С5) — менее 15.
По уровню альбуминурии:
- норма или уровень альбумина незначительно повышен (А1) — соотношение альбумин/креатинин в моче меньше 30 мг/г;
- умеренно повышен (А2) — 30–300 мг/г;
- значительно повышен (А3) — более 300 мг/г.
Примеры формулировки диагноза: Диабетическая нефропатия ХБП С1А2; Диабетическая нефропатия ХБП С5 (лечение заместительной почечной терапией). При терминальной стадии ХБП уровень альбуминурии не указывается.
Раньше степень поражения почек у больных сахарным диабетом оценивали совсем по-другому: классическим маркером диабетической нефропатии был только изолированный уровень альбуминурии/протеинурии (АУ/ПУ). Сейчас стадия нефропатии в первую очередь зависит от уровня СКФ, но его обязательно дополняют индексом АУ/ПУ.
Согласно современной классификации, выделяют три стадии диабетической нефропатии:
- Микроальбуминурия — отношение альбумина к креатинину в пределах 30–300 мг/г, т. е. с мочой выделяется 30–300 мг альбумина в день.
- Протеинурия с сохранённой азотовыделительной функцией почек — с мочой выделяется больше 300 мг альбумина в день.
- Хроническая болезнь почек.
Осложнения диабетической нефропатии
Заболевание может осложниться терминальной стадией ХБП, при которой пациентам требуется серьёзное лечение: диализ или трансплантация почки [21] .
ХБП может сопровождаться почечной анемией и опасными для жизни состояниями, такими как:
- отёк лёгких;
- гиперкалиемия;
- гипертония и сердечно-сосудистые заболевания, которые могут привести к инсульту;
- минеральные, костные нарушения;
- декомпенсация метаболического ацидоза [21][22] .
Анемия развивается из-за того, что в почках вырабатывается недостаточно эритропоэтина — гормона, необходимого для нормального кроветворения, образования эритроцитов и гемоглобина. Нередко анемия сопровождается дефицитом железа (у мужчин меньше 130 г/л, у женщин меньше 120 г/л).
При диабетической нефропатии анемия развивается чаще, быстрее и протекает тяжелее, чем при других причинах ХБП. Пациент становится вялым, плохо переносит нагрузки, возникает одышка, головокружение, ухудшается аппетит. Также анемия может привести к обострению ишемической болезни сердца [23] .
Гиперкалиемия. Из-за высокого уровня калия в крови может замедлиться сердцебиение, что приведёт к сердечному приступу и полной остановке сердца.
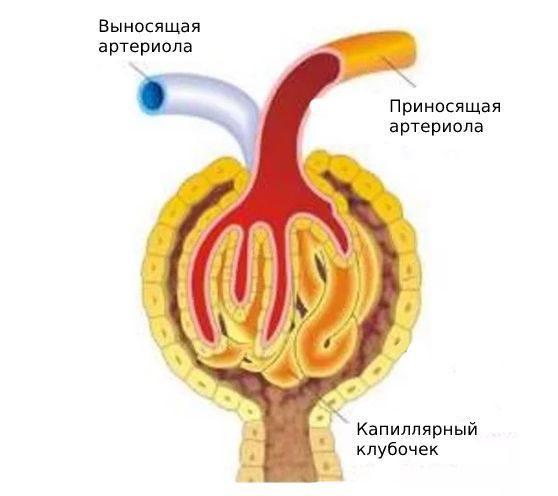
Артериальная гипертония развивается из-за спазма выносящих артериол клубочков, вызванного повышением гормона ангиотензина II типа. Она может возникнуть на любой стадии ХБП, но при терминальной стадии становится неконтролируемой и со временем сменяется гипотонией.
Минеральные и костные нарушения. Почки перестают поддерживать баланс кальция и фосфора в крови, что приводит к избытку этих элементов [22] . В результате нарушается образование и минерализация костной ткани, могут возникнуть переломы, боли и деформации костей. Кальций откладывается в сосудах и мягких тканях, что повышает риск развития сердечно-сосудистых заболеваний: стенокардии, инфаркта миокарда и ишемического инсульта [12] .
В тяжёлых случаях может развиться уремия — накопление в крови токсичных продуктов обмена, которые в норме выводятся почками. При снижении скорости клубочковой фильтрации до 10 мл/мин появляются признаки уремической интоксикации азотистыми шлаками: тошнота, рвота, зуд, метаболический ацидоз с дыханием Куссмауля (глубоким, редким и шумным) и почечной анемией. Нередко слышен шум трения перикарда — «похоронный звон уремии». Но эти признаки больше относятся к предагонии, а не к терминальной стадии ХБП. Явно выраженных симптомов при уремии может не быть [21] .
Предупредить развитие уремии и её негативное воздействие на организм можно только с помощью диализа или трансплантации почки. Если при терминальной стадии ХБП не провести диализ или трансплантацию, то больной погибнет от уремии [4] .
Диагностика диабетической нефропатии
На приёме врач спрашивает, на что жалуется пациент, как давно болеет сахарным диабетом и есть ли другие осложнения, например ретинопатия, диабетическая стопа и полинейропатия.
Если есть документы о диагностированных заболеваниях и других результатах обследований, можно показать их врачу напрямую или открыть доступ к своей электронной медкарте .
Также доктор спросит, болели ли сахарным диабетом близкие родственники и как заболевание протекало у них. Риск развития диабета и нефропатии повышается при наследственной предрасположенности, и эти болезни у родственников часто протекают похоже.
При осмотре врач оценивает цвет кожи: бледность, синюшность или сероватый оттенок могут указывать на анемию. Также признаками диабетической нефропатии будут отёки рук и ног, шум трения перикарда при выслушивании лёгких, глубокое, редкое и шумное дыхание.
К обязательным обследованиям при диабетической нефропатии относятся:
- Определение соотношения альбумин/креатинин в утренней порции мочи. Перед исследованием необходимо исключить интенсивные физические нагрузки и богатую белком пищу. Анализ нельзя делать при высокой температуре, повышенном давлении и менструации. Исследование проводят минимум дважды — для постановки диагноза нужно, чтобы оба результата были положительными. Если один из них не подтверждает снижение СКФ, то анализ нужно сделать повторно. Интервал между ними должен быть не меньше трёх месяцев [12] .
- Общий клинический анализ мочи с определением её осадка.
- Суточный анализ мочи на белок (суточная протеинурия). Для этого исследования нужно как обычно сходить в туалет, но обязательно записать время мочеиспускания и после этого не принимать никакие лекарства в течение суток. Последующие порции мочи за день, ночь и первую утреннюю порцию следующего дня нужно собрать в одну ёмкость. После завершения сбора мочи нужно точно измерить её объём, обязательно перемешать и сразу отлить 100 мл в контейнер для анализа с завинчивающейся крышкой. На нём нужно указать собранный объём мочи (суточный диурез) в миллилитрах, например «Суточный диурез: 1250 мл».
- Анализ на креатинин, мочевину, калий, натрий и хлор в сыворотке крови.
- УЗИ почек. Почки при диабетической нефропатии, как правило, нормального размера или увеличены (от 10 до 12 см в длину).
- Сонографическое исследование почечных артерий.
Чтобы уточнить диагноз в сложных случаях, может потребоваться биопсия почек [12] .
Основные маркеры диабетической нефропатии — это альбумин в моче и скорость клубочковой фильтрации (СКФ). Диагноз ставится только при стойкой альбуминурии (когда уровень альбумина больше 300 мг/сутки или 200 мкг/минуту) и прогрессирующем снижении СКФ [12] . Для расчёта СКФ у взрослых используют формулы Кокрофта — Голта (1976), MDRD (1999) и CKD–EPI (2011). Наиболее точным методом считается CKD–EPI.
Но в некоторых ситуациях применять расчётные методы не совсем корректно:
- при нестандартных размерах тела (например, у бодибилдеров или людей с ампутированной ногой или рукой);
- выраженном истощении и ожирении (индекс массы тела < 15 и >40 кг/м 2 );
- беременности;
- заболеваниях скелетной мускулатуры (миодистрофии);
- параплегии и квадриплегии (параличах рук и ног);
- вегетарианской диете;
- быстром ухудшении работы почек (при остром и быстропрогрессирующем нефритическом синдроме);
- приёме токсичных для почек препаратов;
- показаниях к началу диализной терапии;
- наличии пересаженной почки.
В таких случаях СКФ определяют клиренсовыми методами (пробой Реберга — Тареева). Калькуляторы, основанные на данной пробе и формуле CKD–EPI, легко найти в интернете.
Диабетическую нефропатию следует отличать от других заболеваний с поражением почек. К таким болезням относятся системная красная волчанка, нефритический синдром, пиелонефрит, подагра, мочекаменная болезнь, множественная миелома, стеноз почечной артерии.
Если в моче присутствует альбумин, очень важно сделать общий анализ мочи: так можно исключить инфекцию мочевыводящих путей [12] .
Лечение диабетической нефропатии
Основные цели лечения:
- предупредить и замедлить развитие хронической почечной недостаточности;
- уменьшить риск развития болезней сердца и инсульта.
Для этого применяют комплексную терапию: важно нормализовать уровень сахара в крови, артериальное давление, нормализовать вес, снизить уровень липидов и калий, устранить анемию и нарушения фосфорно-кальциевого обмена.
Питание при диабетической нефропатии
При заболевании необходимо есть меньше соли и белка [8] . Согласно результатам исследования, почечная недостаточность развивалась на 19 % медленнее у больных, которые ограничили белок до 0,28 г/кг в день и принимали смеси незаменимых аминокислот и их кетоаналогов [9] . Малобелковые диеты с добавлением соевого белка уменьшают склерозирование в почках, т. е. не дают разрастаться плотной соединительной ткани.
Соль при нефропатии нужно ограничить до 1,5–2,3 г в день, что позволит снизить артериальное давление [10] .
Также важно сократить потребление насыщенных жиров до 7 % от суточной калорийности. Такие жиры содержатся в маргарине, сливочном масле, сыре, жировой прослойке мяса, включая куриную кожицу, пальмовом и кокосовом масле.
Контроль сахара
Целевой уровень глюкозы такой же, как и у остальных людей с диабетом: 3,9–10,0 ммоль/л (при сахарном диабете во время беременности — 3,5–7,8 ммоль/л) [24] . Чтобы нормализовать уровень сахара, рекомендуется принимать Метформин и ингибиторы SGLT2.
Коррекция гипертонии
При любой стадии хронической болезни почек нужно ежедневно измерять артериальное давление: оно не должно превышать 130/80 мм рт. ст. Снижать давление предпочтительнее препаратами, которые помогают сохранить работу почек, например ингибиторами АПФ и блокаторами ангиотензина II.
Коррекция дислипидемии
Дислипидемия — это фактор риска развития нефропатии и сердечно-сосудистых осложнений, поэтому важно следить за содержанием липидов и при необходимости по назначению врача принимать статины. Уровень холестерина липопротеинов низкой плотности (ЛПНП) должен быть меньше 2,6 ммоль/л, триацилглицеридов (ТАГ) — меньше 1,7 ммоль/л.
Лечение почечной анемии
Анемия при болезнях почек развивается из-за недостаточного образования в почках гормона эритропоэтина, необходимого для нормального кроветворения. Лечение препаратами эритропоэтина нередко дополняют препаратами железа, так как из-за ухудшения его всасывания в кишечнике может развиться железодефицитное состояние.
Коррекция гиперкалиемии, фосфорно-кальциевого и белкового обмена
При уровне калия в крови больше 5,5 ммоль/л назначаются петлевые диуретики (Фуросемид, Торасемид). При концентрации больше 7 ммоль/л рекомендуется вводить 10%-й Глюконат кальция и Бикарбонат натрия.
Чтобы скорректировать нарушения фосфорно-кальциевого обмена, нужно есть меньше продуктов, богатых фосфором: рыбы, гречки, твёрдых и плавленых сыров. Если диета не помогает, применяют препараты кальция и метаболиты витамина Д.
Гемодиализ
Если развилась ХБП, назначают заместительную терапию: диализ или трансплантацию почки [21] . При почечной недостаточности почки перестают справляться со своей главной задачей — выводить из организма продукты метаболизма: креатинин и мочевину. Вместо них это делает аппарат: кровь больного проходит через особые синтетические мембраны, благодаря чему очищается от токсинов и лишней жидкости.
Кроме креатинина и мочевины, гемодиализатор очищает кровь от электролитов, спирта, лекарств, т. е. работает как почки. Частота и продолжительность этой процедуры индивидуальна, но в среднем её нужно проходить трижды в неделю по 2–4 часа.
Перитонеальный диализ
При перитонеальном диализе брюшная полость и брюшина играют роль мембраны, через которую жидкость и растворённые вещества обмениваются с кровью. Во время процедуры удаляется избыток жидкости, токсины и электролиты.
Трансплантация почки
Трансплантация почки, изолированная или с одновременной или последующей пересадкой поджелудочной железы, — это основной метод лечения терминальной стадии ХБП. Пятилетняя выживаемость при сахарном диабете 2-го типа после трансплантации почки составляет почти 60 %, а на диализной терапии без трансплантации — 2 % (но возможно, эти результаты получены на неоднородных группах пациентов). Пересаженная почка нормально работает в течение двух лет более чем в 85 % случаев [13] .
Прогноз. Профилактика
При правильном лечении прогноз относительно благоприятный. Чем раньше начата терапия, тем выше шанс замедлить развитие болезни и предотвратить осложнения [12] . Но на практике многие пациенты обращаются к врачу слишком поздно, поэтому смертность при диабетической нефропатии достаточно высокая [12] [13] .
Повреждение почек развивается быстрее при артериальном давлении свыше 120–139/80–89 мм рт. ст. Инсульт, инфаркта миокарда, заболевания периферических сосудов также повышают риск гибели пациентов [13] .
Профилактика диабетической нефропатии заключается в контроле за артериальным давлением, уровнем сахара и холестерина в крови. При сахарном диабете нужно не реже, чем раз в три месяца, сдавать анализы на глюкозу, креатинин, холестерин и его фракции, а также регулярно контролировать артериальное давление [13] [15] .
Ежегодно оценивать соотношение альбумин/креатинин в разовой порции мочи и рассчитывать СКФ необходимо:
- при сахарном диабете 1-го типа с длительностью заболевания более 5 лет;
- всем пациентам с сахарным диабетом 2-го типа;
- детям старше 11 лет, если сахарный диабет длится дольше двух лет;
- всем пациентам с сопутствующей гипертонией[17] .
При диабетической нефропатии может развиться острая болезнь почек, поэтому нужно быть осторожными при приёме НПВП и внутривенном контрасте, так как эти вещества токсичны для почек [12] .
Список литературы
- Смирнов А. В., Добронравов В. А., Кисина А. А. и др. Клинические рекомендации по диагностике и лечению диабетической нефропатии // Нефрология. — 2015. — № 1. — С. 67.
- Дедов И. И., Шестакова М. В., Галстян Г. Р. Распространённость сахарного диабета 2 типа у взрослого населения России (исследование NATION) // Сахарный диабет. — 2016. — № 2. — С. 104–112.
- Lerma E., Batuman V. Diabetes and Kidney Disease. — New York: Springer, 2014. — Р. 9–239.
- Ворохобина Н. В. Эндокринология: учебник для студентов медицинских вузов. — СПб.: СпецЛит, 2019. — С. 406–420.
- Мкртумян А. М., Маркова Т. Н., Мищенко Н. К. Роль почек в гомеостазе глюкозы // Проблемы эндокринологии. — 2017. — № 6. — С. 385–339.
- Кобалава Ж. Д., Виллевальде С. В., Багманова Н. Х. и др. Распространённость маркеров хронической болезни почек у пациентов с артериальной гипертонией в зависимости от наличия сахарного диабета: результаты эпидемиологического исследования хронограф // Российский кардиологический журнал. — 2018. — № 2. — С. 91–101.
- Капланян М. В., Ворохобина Н. В., Ряснянский Ю. В. Предикторы диабетической нефропатии у больных сахарным диабетом // Вестник Северо-западного медицинского университета им. И. И. Мечникова. — 2016. — № 2. — С. 38–44.
- Шарафетдинов Х. Х., Шехетов А. А., Плотникова О. А. Современные подходы к лечебному питанию больных с диабетической нефропатией // Вопросы диетологии. — 2020. — № 2. — С. 16–22.
- Suckling R. J., He F. J., Macgregor G. A. Altered dietary salt intake for preventing and treating diabetic kidney disease // Cochrane Database Syst Rev. — 2010. — № 12. ссылка
- Ермоленко В. М., Козлова Т. А., Михайлова Н. А. Значение малобелковой диеты в замедлении прогрессирования хронической почечной недостаточности (обзор литературы) // Нефрология и диализ. — 2006. — № 4. — С. 310–319.
- Багрий А. Э., Хоменко М. В., Шверова О. И. Диабетическая нефропатия: вопросы эпидемиологии, терминологии, патогенеза, клинической картины и лечебной тактики (обзор литературы) // Крымский терапевтический журнал. — 2022. — № 1. — С. 15–22.
- Varghese R. T., Jialal I. Diabetic Nephropathy // StatPearls Publishing. — 2022. ссылка
- O’Brien F. Диабетическая нефропатия // Справочник MSD. — 2021.
- Стаценко М. Е., Косицына А. Ф., Туркина С. В. Сахарный диабет: учебно-методическое пособие. Этиология, патогенез, клиника, дифференциальный диагноз, принципы лечения. — Волгоград: ВолГУ, 2002. — 64 с.
- Клинические практические рекомендации KDIGO 2020 по тактике ведения диабета при хронической болезни почек / перевод на русский язык А. Ю. Денисова, под ред. Е. В. Захаровой // Нефрология и диализ. — 2021. — № 2. — С. 9–121.
- Милованов Ю. С., Фомин В. В., Милованова Л. Ю. Трудности коррекции гиперфосфатемии у больных хронической почечной недостаточностью. Место не содержащих кальций фосфорсвязывающих препаратов // Терапевтический архив. — 2016. — № 6. — С. 95–100.
- Российская ассоциация эндокринологов. Алгоритмы специализированной медицинской помощи больным сахарным диабетом: клинические рекомендации / под ред. И. И. Дедова, М. В. Шестаковой, А. Ю. Майорова. — М., 2021. — 221 с.
- Race, Ethnicity, & Kidney Disease // National Institutes of Diabetes and Digestive and Kidney Diseases. — 2014.
- Никольская И. Г., Новикова С. В., Баринова И. В. и др. Хроническая болезнь почек и беременность: этиология, патогенез, классификация, клиническая картина, перинатальные осложнения // Российский вестник акушера-гинеколога. — 2012. — № 5. — С. 21–30.
- Бирагова М. С., Грачева С. А., Мартынов С. А. Нарушения фосфорно-кальциевого обмена у пациентов с сахарным диабетом и хронической болезнью почек // Сахарный диабет. — 2012. — № 4. — С. 74–80.
- Ассоциация нефрологов. Хроническая болезнь почек (ХБП): клинические рекомендации. — М., 2021. — 233 с.
- Diabetic nephropathy (kidney disease) // Mayo Clinic. — 2021.
- Милованов Ю. С., Милованова С. Ю. Анемия при диабетической нефропатии // Лечащий врач. — 2008.
- Суплотова Л. А., Судницына А. С., Романова Н. В., Шестакова М. В. Время нахождения в целевом диапазоне гликемии – инструмент оценки качества гликемического контроля при сахарном диабете // Сахарный диабет. — 2021. — № 3. — С. 282–290.
Диабетическая нефропатия: симптомы, лечение, классификация по стадиям
Диабетической нефропатией называют любые поражения со стороны почечного аппарата, которые развиваются в результате нарушения метаболизма углеводов и липидов в организме. Патологические изменения могут касаться почечных клубочков, канальцев, артериол и артерий. Диабетическая нефропатия возникает у 70-75% людей, страдающих диабетом.

Чаще проявляется в виде следующих состояний:
- Склероз почечной артерий и ее веток.
- Склероз артериол.
- Гломерулосклероз диффузного, узелкового и экссудативного типа.
- Пиелонефрит.
- Некроз почечных сосочков.
- Некротический нефроз.
- Отложение в почечных канальцах мукополисахаридов, липидов и гликогена.
Механизм развития
Патогенез диабетической нефропатии связан с рядом метаболических и гемодинамических факторов. К первой группе относят гипергликемию (высокий уровень сахара в крови) и гиперлипидемию (высокие показатели липидов и/или липопротеинов в кровеносном русле). Гемодинамические факторы представлены артериальной гипертензией и повышенным давлением внутри почечных клубочков.
Важно! Существует еще фактор генетической предрасположенности, который нельзя сбрасывать со счетов.
Метаболические изменения
Гипергликемия – основное звено в цепочке развития патологии почек на фоне диабета. На фоне высокого уровня глюкозы происходит ее присоединение к белкам и жирам почечных мембран, что изменяет их анатомо-физиологические особенности. Также большое количество моносахаридов токсическим образом действуют на ткань органа, что стимулирует выработку протеинкиназы С и способствует повышению проницаемости сосудистых стенок.

Гипергликемия – основной этиологический фактор развития осложнений сахарного диабета
Активация реакций окисления становится причиной высвобождения свободных радикалов, способных оказывать негативное и даже токсическое влияние на клетки органа.
Высокие показатели липидов и липопротеинов в крови – следующий фактор развития нефропатии. Откладываясь на внутреннем слое артерий и артериол, глюкоза способствует его повреждению и повышению проницаемости. Липопротеины низкой плотности, которые подверглись окислению, способны проникать через поврежденный внутренний слой сосудов. Происходит их захват специальными клетками, вокруг которых начинают образовываться соединительно-тканные элементы.
Факторы гемодинамики
Высокий уровень давления в клубочках почек – фактор, который способствует прогрессированию патологии. Причиной такой гипертензии является активация ренин-ангиотензиновой системы (гормонально активного вещества ангиотензин-II).
Повышение уровня артериального давления в организме человека, возникающее в ответ на все вышеперечисленные факторы, становится механизмом, который превышает по своей патологической силе метаболические изменения в дальнейшем развитии почечной патологии.
Основные данные
Диабетическая нефропатия (код по МКБ-10 – N08.3 либо Е10-Е14 с .2) чаще возникает на фоне инсулинозависимого сахарного диабета. Именно при 1 типе заболевания патология почек находится на первом месте среди всех причин смертности больных. При 2 типе нефропатия занимает второе место (на первом находятся осложнения со стороны сердца и сосудов).
Почки являются фильтром, очищающим кровь от токсических веществ, продуктов метаболизма, ядов. Все это выводится из организма с мочой. Фильтрами считаются клубочки почек, в которых и происходят изменения при диабете. Результат – нарушение природных процессов и баланса электролитов, попадание белков в мочу, что не наблюдается у здоровых людей.

Клубочки почек – основной механизм фильтрации крови
Это происходит по такой схеме:
- Ранние стадии – проникают самые маленькие белки.
- Прогрессирование – попадают молекулы больших размеров.
- Повышается артериальное давление, которое еще больше нарушает функции почек.
- Большее повреждение органа еще выше поднимает АД.
- Недостаток белка в организме приводит к значительным отекам и формированию ХБП, которая проявляется почечной недостаточностью.
Таким образом, речь идет о замкнутом круге, итогом которого становится необходимость проведения гемодиализа, а в тяжелых случаях – трансплантации почек.
Если присутствует диабетическая нефропатия, в истории болезни такое состояние указывается, как «Хроническая болезнь почек», а рядом уточняется стадия патологии.
Классификация
Существует несколько разделений заболевания у детей и взрослых: клиническая, морфологическая классификация и классификация по стадиям.
Клиническая
При наличии белка в моче определяют показатели креатинина в крови. Далее по формулам рассчитывается скорость клубочковой фильтрации, согласно показателям которой определяют наличие ХБП и ее стадию.
Формула для оценки скорости фильтрации у взрослых:
140 – возраст (кол-во лет) х массу тела (в кг) х коэф. (муж – 1,23, жен – 1,05) / креатинин (мкмоль/л) = СКФ (мл/мин)
Формула для оценки СКФ детям:
коэф. (в зависимости от возраста) х рост (см) / креатинин (мкмоль/л) = СКФ (мл/мин)
| Стадия ХБП | Название | Показатели СКФ (мл/мин) |
| I | Наличие патологии, определяющейся другими методами диагностики, с нормальными или повышенными показателями скорости фильтрации | 90 и выше |
| II | Патология почек с умеренными цифрами клубочковой фильтрации | 60-89 |
| III | Снижение скорости фильтрации средней степени | 30-59 |
| IV | Выраженное снижение скорости клубочковой фильтрации | 15-29 |
| V | Недостаточность почек | 14 и ниже |
Морфологическая
Существует четыре основных класса, в соответствии с которыми уточняются анатомо-физиологические изменения в организме больного.
- Утолщение мембраны почечных канальцев изолированного характера.
- Расширение межсосудистых клеток клубочков незначительного (а) или выраженного (b) типа.
- Образование узелков в межсосудистых клетках (гломерулосклероз).
- Склероз выраженного характера.
Классификация по стадиям
Первая стадия характеризуется гиперфункцией системы фильтрации. Развивается в самом начале сахарного диабета. Почки стараются как можно скорее вывести глюкозу из организма, включая компенсаторные механизмы. Протеинурия (белок в моче) отсутствует, как и признаки патологии.
Вторая стадия – начальные проявления. Развивается через несколько лет с момента диагностики диабета. Стенки артерий и артериол утолщаются, но белка в моче пока нет, как и клинических симптомов.
Третья стадия – стадия микроальбуминурии. При лабораторном обследовании определяется наличие белка в количестве от 30 до 300 мг/сут. Поражение сосудов проявляется периодическими повышениями артериального давления без других проявлений.

Анализ мочи – основа диагностики диабетической нефропатии
Четвертая стадия – выраженные симптомы диабетической нефропатии. С мочой выделяется значительное количество белка, снижаются показатели протеинов в крови, появляется отечность. Если уровень протеинурии в средних пределах, отеки появляются на лице и ногах. В случае выведения из организма большого количества белка, патологический экссудат накапливается в брюшной, плевральной, перикардиальной полости.
Пятая стадия – критическое состояние, характеризующееся полным склерозом почечных сосудов, СКФ менее 10 мл/мин. Помощь заключается в проведении гемодиализа или трансплантации органа, поскольку другие методы лечения эффективностью уже не обладают.
Симптомы и клинические проявления диабетической нефропатии
Стадии диабетической нефропатии имеют взаимосвязь с визуальными и лабораторными проявлениями. Первые три стадии считаются доклиническими, поскольку визуальные проявления патологии отсутствуют. Изменения могут определяться только с помощью лабораторной диагностики или во время гистологического исследования почечной ткани.
Выраженные симптомы появляются на четвертой стадии, когда больные начинаются жаловаться на следующие проявления:
- отечность лица и нижних конечностей;
- повышение артериального давления;
- снижение массы тела;
- слабость, снижение работоспособности;
- тошнота, рвота;
- отсутствие аппетита;
- патологическая жажда;
- цефалгия;
- одышка;
- боль за грудиной.
В уремической стадии клиническая картина аналогична, только с усугубленными проявлениями. В плевральной, перикардиальной, брюшной полости скапливается патологическая жидкость, которая требует проведения пункции.
Показания для госпитализации
Стационарное лечение в плановом порядке проводится больным с нефропатией и резистентным нефротическим синдромом при скорости фильтрации выше 65 мл/мин, при почечной патологии в сочетании с хронической болезнью почек 3 и 4 стадии.
Экстренная госпитализация требуется при следующих состояниях:
- олигурия – патологическое малое количество выделяемой мочи;
- азотемия – повышенное количество азотистых веществ в крови;
- гипергидратация – патология водно-солевого обмена, характеризующееся образованием отеков;
- метаболический ацидоз – увеличение кислотности крови;
- гиперкалиемия – повышенное количество калия в кровеносном русле.

Тактика ведения пациента и определение необходимости госпитализации – прерогатива лечащего врача
Диагностика патологии
Специалист уточняет наличие диагноза сахарного диабета у пациента, уровень артериального давления и его перепады, развитие отечности. Визуально оценивает состояние кожных покровов, массу тела больного, наличие отеков и степень их выраженности, соотношение между поступаемой и выделяемой за сутки мочой.
Обязательно проводят общий анализ крови (количество форменных элементов, состояние свертываемости, лейкоцитарная формула, СОЭ), биохимию (общий белок, альбумин, С-реактивный белок). Оценивают показатели мочи (общий анализ, микроскопия осадка, ИФА белков, бакпосев).
Читайте также: Ангиопатия при сахарном диабете
Определяются уровень СКФ, креатинина, мочевины, холестерина, глюкозы, микроэлементов. Дополнительные методы диагностики:
- УЗИ почек и брюшной полости;
- биопсия почечной ткани;
- ЭКГ, ЭхоКГ;
- допплерография почечных сосудов;
- рентген грудной клетки, брюшной полости;
- показатели гормонов щитовидной и паращитовидной железы.
При необходимости врач направляет больного на консультацию к окулисту (для исключения диабетической ретинопатии), кардиологу (в случае признаков сердечной недостаточности и аритмии), эндокринологу (для контроля основного заболевания), ангиохирургу (чтоб создать АВ-фистулу в качестве доступа для гемодиализа).
Дифференциация диагноза
Диабетическую нефропатию необходимо отличить от нефротического синдрома и хронического нефритического синдрома.
| Клиническое проявление | Нефротический синдром | Нефритический синдром хронического течения | Нефропатия на фоне сахарного диабета |
| Начальные стадии | Появляется отечность на ногах и лице | Кровь или белок в моче, отеки, повышение артериального давления | Данные о наличии диабета, незначительное повышение давления |
| Отечность и состояние кожи | Значительные отеки | Незначительные отеки | С нарастанием количества белка в моче усиливаются отеки, могут быть трофические язвы |
| АД | Нормальное или сниженное | Чаще в пределах нормы | Повышение разной степени |
| Кровь в моче | Отсутствует, появляется при сочетании с нефритическим синдромом | Постоянная | Отсутствует |
| Белок в моче | Выше 3,5 г/сут | Ниже 3 г/сут | От незначительных до огромных показателей |
| Наличие азотистых продуктов в крови | Увеличивается по мере прогрессирования патологии | Отсутствует или прогрессирует очень медленно | В зависимости от длительности болезни |
| Другие проявления | Скопление экссудата во внутренних полостях | Системность при геморрагических синдромах | Поражение зрительного анализатора, диабетическая стопа, гипертрофия левого желудочка |
Тактика ведения пациента
При развитии ХБП 1 и 2 стадии, а также при повышении артериального давления требуется сбалансированное питание, поступление достаточного количества белка в организм. Суточный калораж рассчитывается индивидуально эндокринологом или диетологом. Диета включает обязательное уменьшение количества поступаемой соли в организм (не более 5 г в день).

Ограничение количества соли в рационе питания – возможность уменьшения развития отечности
Режим физической активности устанавливается по полчаса до 5 раз в неделю. Отказ от вредных привычек (табакокурения и употребления спиртного). Раз в 3 месяца необходимо определять наличие белка в моче, ежедневно измерять показатели АД.
Эндокринолог пересматривает схему инсулинотерапии или применения сахароснижающих средств, при необходимости проводит коррекцию, отменяя или добавляя определенный препарат. Это важно, поскольку гипергликемия является пусковым механизмом в развитии нефропатии диабетического характера.
- Ангиопатия нижних конечностей при сахарном диабете
- Что такое диабетическая невропатия и почему она опасна
Лечение додиализной стадии
Терапия заключается в соблюдении диеты, коррекции углеводного метаболизма, снижении артериального давления, восстановлении обмена жиров. Важным моментом является достижение компенсации сахарного диабета посредством инсулинотерапии или применения сахароснижающих препаратов.

Нефролог – специалист, который занимается проблемами почек у больных сахарным диабетом
Немедикаментозная терапия основывается на следующих моментах:
- увеличение физической активности, но в разумных пределах;
- отказ от табакокурения и употребления спиртных напитков;
- ограничение влияния стрессовых ситуаций;
- улучшение психоэмоционального фона.
Диетотерапия
Коррекция питания заключается не только в отказе от быстроусваиваемых углеводов, что характерно для сахарного диабета, но и в соблюдении принципов стола №7. Рекомендуется сбалансированная низкоуглеводная диета, которая может насытить организм больного необходимыми питательными веществами, витаминами, микроэлементами.
Количество поступаемого белка в организм не должно превышать 1 г на килограмм массы тела в сутки, необходимо снизить и уровень липидов, чтобы улучшить состояние сосудов, выводя «плохой» холестерин. Нужно ограничить следующие продукты:
- хлеб и макаронные изделия;
- консервы;
- маринады;
- копчености;
- соль;
- жидкость (до 1 л в сутки);
- соусы;
- мясо, яйца, сало.

Соблюдение низкобелковой диеты – основа лечения нефропатии
Такая диета противопоказана в период вынашивания ребенка, при острых патологиях инфекционного характера, в детском возрасте.
Коррекция уровня сахара в крови
Поскольку именно высокая гликемия считается пусковым механизмом в развитии диабетической нефропатии, необходимо приложить максимум усилий, чтобы показатели сахара находились в позволенных пределах.
Клинические исследования показали, что длительное удержание показателей гликированного гемоглобина менее 6,9% способно предотвратить развитие патологии почек.
Показатель выше 7% допускается для тех пациентов, у которых наблюдается высокий риск развития гипогликемических состояний, а также для тех больных, которые имеют патологию сердца и продолжительность их жизни ожидаемо ограничена.
При инсулинотерапии коррекцию состояния проводят пересмотром используемых препаратов, схемы их введения и дозировки. Лучшей схемой считается инъекция пролонгированного инсулина 1-2 раза в день и «короткого» препарата перед каждым поступлением пищи в организм.
Сахароснижающие препараты для лечения диабетической нефропатии также имеют особенности использования. При подборе необходимо учитывать пути выведения активных веществ из организма больного и фармакодинамику лекарственных средств.
Читайте также: Ангиопатия при сахарном диабете
Важные моменты
Современные рекомендации специалистов:
- Бигуаниды не используются при недостаточности почек из-за риска возникновения лактатацидотической комы.
- Тиазолиндионы не назначают из-за того, что они вызывают задержку жидкости в организме.
- Глибенкламид может вызвать критическое снижение сахара в крови на фоне патологии почек.
- При нормальном ответе организма позволены Репаглинид, Гликлазид. При отсутствии эффективности показана инсулинотерапия.
Коррекция показателей артериального давления
Оптимальные показатели – меньше 140/85 мм рт. ст., однако цифр менее 120/70 мм рт. ст. также следует избегать. В первую очередь для лечения используются следующие группы препаратов и их представители:
- ингибиторы АПФ – Лизиноприл, Эналаприл;
- блокаторы рецепторов ангиотензина – Лозартан, Олмесартан;
- салуретики – Фуросемид, Индапамид;
- блокаторы кальциевых каналов – Верапамил.

Коррекция показателей артериального давления – этап эффективной терапии
Важно! Первые две группы могут заменять друг друга при наличии индивидуальной гиперчувствительности к активным компонентам.
Коррекция нарушений жирового обмена
Для пациентов, имеющих сахарный диабет, хроническую болезнь почек и дислипидемию, характерен высокий риск возникновения патологий со стороны сердца и сосудов. Именно поэтому специалисты рекомендуют проводить коррекцию показателей жиров в крови при «сладкой» болезни.
- для холестерина – меньше 4,6 ммоль/л;
- для триглицеридов – меньше 2,6 ммоль/л, а при условии заболеваний сердца и сосудов – меньше 1,7 ммоль/л.
В лечении используются две основные группы лекарственных препаратов: статины и фибраты. Лечение статинами начинают уже тогда, когда показатели холестерина достигают 3,6 ммоль/л (при условии, что со стороны сердечно-сосудистой системы заболевания отсутствуют). Если есть сопутствующие патологии, терапия должна начинаться при любых значениях холестерина.
Статины
Включают несколько поколений лекарственных средств (Ловастатин, Флувастатин, Аторвастатин, Розувастатин). Препараты способны выводить лишний холестерин из организма, уменьшать уровень ЛПНП.

Аторвастатин – представитель гиполипидемических препаратов
Статины угнетают действие специфического фермента, отвечающего за выработку холестерина в печени. Также медикаменты увеличивают в клетках число рецепторов липопротеинов низкой плотности, что приводит к массивному выведению последних из организма.
Фибраты
Эта группа препаратов обладает иным механизмом действия. Активное вещество способно изменить процесс транспортировки холестерина на генном уровне. Представители:
- Фенофибрат;
- Клофибрат;
- Ципрофибрат.
Одновременное применение этой группы медикаментов со статинами запрещено, поскольку может привести к повреждению скелетных мышц.
Коррекция проницаемости фильтра почек
Клинические данные говорят о том, что коррекция показателей сахара в крови и интенсивная терапия не всегда могут предотвратить развитие альбуминурии (состояние, при котором белковые вещества появляются в моче, чего не должно быть).
Как правило, назначается нефропротектор Сулодексид. Это лекарственное средство используется с целью восстановления проницаемости почечных клубочков, результатом чего становится уменьшение выведения белка из организма. Терапия Сулодексидом показана раз в 6 месяцев.
Восстановление электролитного баланса
Используется следующая схема лечения:
- Борьба с высокими показателями калия в крови. Используют раствор кальция глюконата, инсулин с глюкозой, раствор бикарбоната натрия. Неэффективность лекарственных средств является показанием для проведения гемодиализа.
- Устранение азотемии (повышенного содержания азотистых веществ в крови). Назначаются энтеросорбенты (активированный уголь, Повидон, Энтеродез).
- Коррекция высокого уровня фосфатов и низких цифр кальция. Вводят раствор кальция карбоната, железа сульфата, Эпоэтин-бета.

Инфузионная терапия – один из этапов лечения нефропатии диабетического характера
Лечение терминальной стадии нефропатии
Современная медицина предлагает 3 основных метода лечения в последней стадии хронической почечной недостаточности, которые позволяют продлить жизнь пациенту. К ним относят проведение гемодиализа, перитонеального диализа и пересадку почки.
Диализ
Метод заключается в проведении аппаратной очистки крови. Для этого врач подготавливает венозный доступ, через который происходит забор крови. Далее она попадает в аппарат «искусственная почка», где происходит очищение, обогащение полезными веществами, а также обратный возврат в организм.
Преимуществами способа считается отсутствие необходимости ежедневного проведения (как правило, 2-3 раза в неделю), больной находится постоянно под медицинским наблюдением. Этот способ доступен даже тем пациентам, которые не могут себя обслуживать самостоятельно.
- трудно обеспечить венозный доступ, поскольку сосуды очень хрупкие;
- сложно управлять показателями артериального давления;
- поражение сердца и сосудов быстрее прогрессирует;
- трудно контролировать показатели сахара в крови;
- пациент постоянно прикреплен к лечебному учреждению.
Перитонеальный диализ
Этот тип процедуры может выполняться самим пациентом. В малый таз через переднюю брюшную стенку вводят катетер, который оставляют на длительный период времени. Через этот катетер проводят вливание и слив определенного раствора, который схож по своему составу с плазмой крови.
Процедура может проводиться в условиях дома, позволяет вводить препараты инсулина через катетер. Кроме того, перитонеальный диализ в несколько раз дешевле аппаратной очистки крови.
Недостатками считается необходимость ежедневного проведения манипуляций, невозможность выполнения при резком снижении остроты зрения, а также риск развития осложнения в виде воспаления брюшины.
Пересадка почки
Трансплантация считается дорогостоящим способом лечения, но наиболее эффективным. В период работы трансплантата возможно полное избавление от почечной недостаточности, снижается риск развития других осложнений сахарного диабета (например, ретинопатии).

Трансплантация – эффективный вариант борьбы с терминальной стадией осложнения
Пациенты достаточно быстро восстанавливаются после операционного вмешательства. Выживаемость в первый год составляет выше 93%.
Недостатками трансплантации считаются:
- риск того, что организм отторгнет пересаженный орган;
- на фоне применения стероидных медикаментов тяжело регулировать обменные процессы в организме;
- значительный риск развития осложнений инфекционного характера.
Через определенный период времени диабетическая нефропатия может затронуть и трансплантат.
Прогноз
Проведение инсулинотерапии или использование сахароснижающих препаратов позволяет снизить риск возникновения нефропатии диабетического характера на 55%. Это же позволяет достичь компенсации сахарного диабета, что затормаживает развитие иных осложнений болезни. Количество летальных исходов значительно уменьшает ранняя терапия ингибиторами АПФ.
Возможности современной медицины позволяют улучшить качество жизни больных, имеющих проблемы с почками. При проведении аппаратной очистки крови выживаемость достигает 55% за 5 лет, а после пересадки печени – около 80% за этот же период.
Читайте также: Диабетическая микроангиопатия при сахарном диабете
Источник https://diseases.medelement.com/disease/%D1%81%D0%B0%D1%85%D0%B0%D1%80%D0%BD%D1%8B%D0%B9-%D0%B4%D0%B8%D0%B0%D0%B1%D0%B5%D1%82-%D1%81-%D0%BF%D0%BE%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5%D0%BC-%D0%BF%D0%BE%D1%87%D0%B5%D0%BA-%D0%BA%D1%80-%D1%80%D1%84-2016/16692
Источник https://probolezny.ru/diabeticheskaya-nefropatiya/
Источник https://karpov-clinic.ru/articles/endokrinologiya/9034-diabeticheskaya-nefropatiya-simptomy-lechenie-klassifikatsiya-po-stadiyam.html