Ихтиоз кожи у детей
Для профилактики ихтиоза, и других кожных заболеваний, придерживайтесь следующих рекомендаций:
- По возможности, смените место проживания на теплый влажный климат;
- В жилом помещении увлажняйте воздух, для чего можно использовать увлажнитель воздуха;
- В пище отдавайте предпочтение продуктам, богатые на витамины и микроэлементы;
- Когда готовите пищу, отдавайте предпочтение приготовлению продуктов на пару. Овощи и фрукты старайтесь кушать в сыром виде, т.к. при термической обработке продуктов, большинство витаминов уничтожается;
- Исключите из своей жизни курение и алкоголь, а также минимизируйте употребление вредных продуктов питания;
- Избегайте стрессов;
- Старайтесь хотя бы раз в году отдыхать на специализированных курортах.
Профилактика
Основной метод профилактики ихтиоза — медико-генетическое консультирование. Подробное изучение родословной позволит врачу определить тип наследования дефектного гена и вероятность рождения больного ребёнка у таких родителей. Современные методы диагностики, в частности ультразвук, позволяют выявить признаки ихтиоза плода на этапе его развития в материнской утробе.
Ихтиоз на современном этапе развития медицины далеко не всегда является болезнью с плачевным прогнозом. Во многих случаях специалистам удаётся добиться сглаживания признаков заболевания и повысить качество жизни пациента.
Профилактика Ихтиозов и ихтиозоподобных заболеваний:
К сожалению, предотвратить развитие заболевания у человека невозможно. Но возможно предотвратить рождение больного ребенка с тяжелой формой патологии. С этой целью в нашей стране создано очень большое количество центров, занимающихся генетической консультацией молодых семей. Особенно актуальны данные вопросы в отношении семей, где имелись больные со сходными наследственными заболеваниями кожи.
Основными вопросами, решаемыми при желании иметь ребенка, являются следующие:
- По какому заболеванию имеется риск у будущего ребенка?
- Каковы показатели этого риска?
- По какому механизму передается заболевание?
- Какова тяжесть патологии?
- Каковы шансы жизнеспособности будущего ребенка?
В ряде случаев при отягощенной наследственности отца и матери им крайне противопоказано заводить детей. Однако функция медицинского работника в данном случае состоит в том, чтобы разъяснить сложившуюся ситуацию обратившейся за консультацией паре. Окончательное решение принимается только будущими родителями, поэтому наибольшая ответственность лежит именно на их плечах.
Что собой представляет ихтиоз?
В переводе с греческого языка термин «ихтис» означает «рыба». В русском языке все, что связано с рыбами и рыбными производными, имеет приставку «ихтио». Исходя из этого, несложно догадаться, что такое ихтиоз. Данное заболевание обусловлено наличием мутантного гена, который приводит к гиперкератозу кожи. Это означает, что в эпителии образуется роговое вещество с кератином измененной структуры, который приводит к чрезмерному загрубению кожи. Внешне это напоминает рыбьи чешуйки. Ихтиоз начинает свое проявление уже на первых годах жизни человека, чаще всего, это промежуток от года до трех. Данному заболеванию характерно чрезмерное шелушение кожи. В зависимости от степени прогрессирования, ихтиоз проявляется по-разному:
- пациенты переносят его в легкой форме и спокойно могут сосуществовать с данной болезнью всю свою жизнь;
- в более тяжелых ситуациях – ареал поражения распространяется на все тельце ребенка и может привести к летальному исходу (ихтиоз плода).
Вместе со стремительным прогрессом жизни заболевание также не стоит на месте и постоянно мутирует, из-за этого возникает все больше и больше новых форм, которые специалистами до конца еще не изучены. Насчитывают около 30 разновидностей ихтиоза. Все больше врачей склоняются во мнении к тому, что причины генной мутации спровоцированы:
- недостатком в организме витамина А;
- или же когда нарушается работа эндокринной системы.
Главным критерием патологии ихтиоза выявлено:
- чрезмерное количество вырабатываемого кератина, он же белок кожи;
- кровь переполнена аминокислотами;
- избыток холестерина приводит к нарушению жирового обмена.
Данное заболевание носит врожденный характер, очень редко его можно обозначить, как приобретенное. Характерные особенности ихтиоза кожи:
- во время течения заболевания у пациента отмечается нарушение в питании клеток волос, ногтевых платин и зубов: внешне они меняются и уже не напоминают здоровые;
- наряду с ихтиозом у пациента выявляют другие заболевания, относящиеся к группе инфекционных;
- ихтиоз может поражать глазную сетчатку;
- самым частым видом заболевания называют вульгарный ихтиоз, в 90% случаев у больных выявляют именно его;
- самый критический возрастной промежуток начинается с 12 недели рождения и длится до 50 лет: статистика показывает, что именно в это время появляются первые кинические симптомы;
- на каждые четыре тысячи населения планеты Земля констатируют одного больного ихтиозом и происхождение недуга пока остается неизвестным.
Существует теория, что причиной ихтиоза может быть дефицит витамина А
Что собой представляет ихтиоз?
В переводе с греческого языка термин «ихтис» означает «рыба». В русском языке все, что связано с рыбами и рыбными производными, имеет приставку «ихтио». Исходя из этого, несложно догадаться, что такое ихтиоз. Данное заболевание обусловлено наличием мутантного гена, который приводит к гиперкератозу кожи. Это означает, что в эпителии образуется роговое вещество с кератином измененной структуры, который приводит к чрезмерному загрубению кожи. Внешне это напоминает рыбьи чешуйки. Ихтиоз начинает свое проявление уже на первых годах жизни человека, чаще всего, это промежуток от года до трех. Данному заболеванию характерно чрезмерное шелушение кожи. В зависимости от степени прогрессирования, ихтиоз проявляется по-разному:
- пациенты переносят его в легкой форме и спокойно могут сосуществовать с данной болезнью всю свою жизнь,
- в более тяжелых ситуациях – ареал поражения распространяется на все тельце ребенка и может привести к летальному исходу (ихтиоз плода).
Вместе со стремительным прогрессом жизни заболевание также не стоит на месте и постоянно мутирует, из-за этого возникает все больше и больше новых форм, которые специалистами до конца еще не изучены. Насчитывают около 30 разновидностей ихтиоза. Все больше врачей склоняются во мнении к тому, что причины генной мутации спровоцированы:
- недостатком в организме витамина А,
- или же когда нарушается работа эндокринной системы.
Главным критерием патологии ихтиоза выявлено:
- чрезмерное количество вырабатываемого кератина, он же белок кожи,
- кровь переполнена аминокислотами,
- избыток холестерина приводит к нарушению жирового обмена.
Данное заболевание носит врожденный характер, очень редко его можно обозначить, как приобретенное. Характерные особенности ихтиоза кожи:
- во время течения заболевания у пациента отмечается нарушение в питании клеток волос, ногтевых платин и зубов: внешне они меняются и уже не напоминают здоровые,
- наряду с ихтиозом у пациента выявляют другие заболевания, относящиеся к группе инфекционных,
- ихтиоз может поражать глазную сетчатку,
- самым частым видом заболевания называют вульгарный ихтиоз, в 90% случаев у больных выявляют именно его,
- самый критический возрастной промежуток начинается с 12 недели рождения и длится до 50 лет: статистика показывает, что именно в это время появляются первые кинические симптомы,
- на каждые четыре тысячи населения планеты Земля констатируют одного больного ихтиозом и происхождение недуга пока остается неизвестным.
Существует теория, что причиной ихтиоза может быть дефицит витамина А
Причины
Арлекиновый ихтиозом вызван изменениями (мутациями) в гене ABCA12, который дает инструкции для создания белка, необходимого для нормального развития клеток кожи. Ген ABCA12 играет ключевую роль в транспорте жиров (липидов) в самый поверхностный слой кожи (эпидермис), создавая эффективный кожный барьер. Когда этот ген мутирует, кожный барьер разрушается.
Ихтиоз Арлекина наследуется по аутосомно-рецессивному типу. Рецессивные генетические нарушения возникают, когда человек наследует ненормальный ген от каждого родителя. Если человек получает один нормальный ген и один ненормальный ген заболевания, человек будет носителем патологии, но обычно бессимптомным. Риск того, что двое родителей-носителей оба передадут аномальный ген и, следовательно, зачнут больного ребенка, составляет 25% при каждой беременности. Риск иметь ребенка, который будет носителем, как и родители, составляет 50% при каждой беременности. Вероятность для ребенка получить нормальные гены от обоих родителей составляет 25%. Риск одинаков для мужчин и женщин.
Лечение приобретенного ихтиоза
Лечение назначается только после подтверждения диагноза врачом-специалистом. Необходимо лечение основного заболевания — причины ихтиоза. При гиповитаминозе показаны ретиноиды, витамины А, С, В, биотин.
Основные лекарственные препараты
Имеются противопоказания. Необходима консультация специалиста.
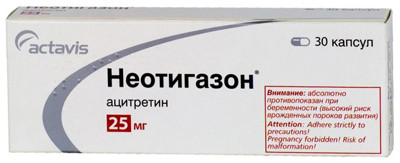
- Ацитретин (Неотигазон) — препарат, применяемый при гиперкератозах, системный ретиноид. Дозировка: при лечении данным препаратом необходим индивидуальный подбор дозировки из-за различий в скорости обмена веществ. Рекомендуется принимать препарат один раз в сутки во время приема пищи или запивать лекарство молоком в суточной дозе 0,5-1,0 мг на килограмм массы тела на протяжении 2-4 недель. При дискератозах чаще всего необходимо поддерживающее лечение, проводящееся минимальными дозами препарата. Дозировка может составлять меньше 20 мг в сутки, но должна превышать 50 мг в сутки.
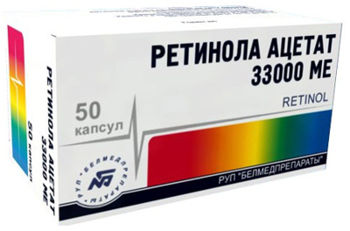
- Ретинола ацетат (Витамин А) — жирорастворимый витамин. Дозировка: препарат принимают внутрь от 3 до 5 драже в день. Масляный раствор витамина А следует принимать в дозировке 10–20 капель 3 раза в день после приема пищи на кусочке черного хлеба, либо 2 раза в день по 5 капель. Доза увеличивается на 5 капель ежедневно до 30 капель 2 раза в день. Принимать препарат в таком объеме следует на протяжении 2–3 месяцев, после дозировка постепенно снижается. Если необходимо, курс лечения можно повторить через 4 месяца.
- Белосалик (препарат с противовоспалительным и кератолитическим действием для наружного применения). Дозировка: мазь в небольшом количестве распределяют равномерным слоем и слегка втирают. Препарат применяют 2 раза в сутки, в легких стадиях хватит однократного применения. Непрерывный курс лечения чаще всего составляет от 3 до 4 недель. Если требуется более длительный курс лечения, препарат нужно использовать через день. Если препарат принимается для лечения хронических заболеваний, после исчезновения симптомов необходимо принимать препарат еще некоторое время под наблюдением лечащего врача.
Симптомы и разновидности вульгарного ихтиоза
Есть две разновидности Ichthyosis vulgaris:
- аутосомно-доминантная;
- рецессивная, связанная с полом (Х-хромосомальная).
Данные разновидности отличатся по клинической картине.
Аутосомно-доминантная форма означает, что мутированные гены наследуются независимо от пола (как мужчины, так и женщины могут быть носителями мутации). Вначале кожа новорожденного не повреждена – симптомы проявляются в конце первого года жизни, иногда – чуть позже (на втором году).
- наличие желтых или коричневых пятен (образованных из роговых клеток поверхностных слоев эпидермиса) размером от нескольких миллиметров до нескольких сантиметров, которые напоминают рыбью чешую;
- изменения, как правило, расположены в пределах грудной клетки, спины, верхних и нижних конечностей (симметрично);
- в целом покровы на всем теле становятся сухими из-за снижения секреции кожного сала и пота, часто наблюдается фолликулярный кератоз на ногах и ягодицах;
- на коже головы тоже наблюдаются характерные отслоения, но волосы при этом не повреждаются.
Ихтиоз вульгарный фото
Часто болезнь сосуществует с фолликулярным кератозом, гиперкератозом внутренних поверхностей рук и ног и атопическим дерматитом.
Важно знать! Ихтиоз вульгарный у детей аутосомно-доминантного типа спонтанно исчезает с наступлением половой зрелости. То есть, даже если вы не будете проводить фармакологическое лечение, малыш «перерастет» эту болезнь
Рецессивная (Х-хромосомальная форма) встречается исключительно у мужчин (женщины являются только носителями дефектного гена) и проявляется уже в момент рождения или первые месяцы жизни. Чешуйчатые изменения поражают все тело, а также область в подмышках, паху, сгибах локтевых суставов и подколенной области. Симптомы ухудшаются с возрастом. Кроме того, у пациентов наблюдаются:
- нарушения зрения (воспаление роговицы, катаракта);
- проблемы с опорно-двигательным аппаратом (неправильное развитие хрящевой и костной ткани, мышечная атрофия);
- потеря слуха;
- нарушения со стороны центральной нервной системы (мышечные спазмы и умственная отсталость).
Следует отметить, что рецессивная форма встречается очень редко – 1 случай на 6000 человек.
Каковы симптомы ихтиоза Арлекина?
Симптомы ихтиоза Арлекина меняются с возрастом и имеют тенденцию быть более серьезными у младенцев.
У новорожденных
Дети с ихтиозом Арлекина обычно рождаются недоношенными. Это означает, что у них может быть более высокий риск других осложнений.
Признак, который люди обычно замечают в первую очередь, — это твердые толстые чешуйки по всему телу, включая лицо. Кожа туго натягивается, чешуя трескается и раскалывается.
Эта огрубевшая кожа может вызвать ряд серьезных проблем, в том числе:
- веки выворачиваются наизнанку
- глаза не закрываются
- губы стянуты, рот остается открытым, что затрудняет уход
- уши срослись с головой
- маленькие опухшие руки и ноги
- ограниченная подвижность рук и ног
- трудности с уходом
- проблемы с дыханием из-за стянутой кожи груди
- инфекции в глубоких трещинах кожи
- обезвоживание
- низкая температура тела
- высокий уровень натрия в крови, известный как гипернатриемия
У детей старшего возраста и взрослых
У детей с ихтиозом Арлекина может наблюдаться задержка физического развития. Но их умственное развитие обычно соответствует уровню других детей их возраста.
Ребенок, рожденный с ихтиозом Арлекина, скорее всего, будет иметь красную чешуйчатую кожу на протяжении всей жизни.
Также они могут иметь:
- редкие или тонкие волосы из-за чешуек на коже головы
- необычные черты лица из-за натянутой кожи
- снижение слуха из-за скопления чешуек в ушах
- проблемы с движением пальцев из-за стянутой кожи
- толстые ногти
- повторяющиеся кожные инфекции
- перегрев из-за чешуек, мешающих потоотделению
Лечение ихтиоза
Лечение ихтиоза происходит на всём протяжении жизни больного человека. Специалист-дерматолог назначит комплексную терапию медикаментами для внутреннего и наружного применения, которое дополнит физиотерапевтическое и санаторно-курортное лечение.
Медикаментозное лечение
Лекарственное лечение — важная составляющая терапии. На изменённый кожный покров воздействуют препараты для наружного и внутреннего применения. Витамины, стероидные гормоны, антисептики размягчают чешуйки, уменьшают сухость, препятствуют проникновению инфекции. Препараты применяются курсами по назначению лечащего врача. Присоединение инфекции — повод для специалиста использовать антибиотики: Ампициллин, Цефтриаксон, Кларитромицин, Тетрациклин.
Препараты для лечения ихтиоза — таблица
- токоферол;
- ретинол.
- бетаметазон;
- салициловая кислота.
- бетаметазон;
- салициловая кислота.
- таблетки;
- раствор для инъекций.
Препараты для лечения ихтиоза — фотогалерея
Дозировки лекарств для детей рассчитываются индивидуально исходя из возраста и веса.
Физиолечение
Ихтиоз — повод для врача назначить специфические физиопроцедуры:
- кислородные ванны. Кислород, растворенный в воде, улучшает кровообращение и обмен веществ в поражённой коже;
- соляные ванны доступны для применения в домашних условиях. Курс процедур уменьшит сухость и воспаление;
- облучение поражённых участков ультрафиолетовым светом. Проводится как для всего тела, так и отдельных частей. Ультрафиолет дезинфицирует кожный покров, уничтожая болезнетворные микробы;
- талассотерапию. Лечение морской водой и грязями благоприятно действует на кожу, изменённую ихтиозом;
- гелиотерапию. Солнечный свет при попадании на кожу способствует образованию витамина Д, а также активирует защитные силы иммунитета;
- лечение иловыми и торфяными грязями. Минералы и соли, содержащиеся в лечебных грязях, улучшают кровообращение и обмен веществ в коже.
Количество процедур и продолжительность курса лечения врач определит индивидуально в зависимости от вида ихтиоза и степени выраженности его проявлений.
Ихтиоз кожи у детей
Подобное наследственное заболевание может проявиться при развитии плода в утробе матери примерно на четвертом или пятом месяце.
При этом дети рождаются с измененной структурой кожи – наличием шелушек и чешуек различного размера. Заболевание может затронуть рот, уши, веки, что может влиять на зрение и прием пищи.
При подобном диагнозе возможны появление перепонок на пальцах и деформация скелета.
Чаще всего заболевание проявляет себя наиболее активно в возрасте до трех лет.
Участки шелушения кожи со временем превращаются в ороговевшую кожу с так называемой рыбьей чешуей серого или темного оттенка, может наблюдаться покраснение кожи с наличием пленки.
Линии на ладонях становятся ярко выраженными. Заболевание может сопровождаться зудом, жжением, болезненными ощущениями при отделении чешуек.
Помимо внешнего проявления болезни, возможны следующие изменения:
- Ухудшение структуры волос и ногтей – их расслоение и ломкость.
- Конъюнктивит глаз.
- Развитие близорукости.
- Аллергические реакции.
- Заболевания почек.
- Кариес зубов и разрушение зубной эмали.
- Сердечная недостаточность.
В подобных случаях нужно немедленно начать лечение по рекомендациям врача и под его контролем.
Для новорожденных предусмотрена ранняя терапия – ребенку требуется поддержание оптимальной температуры и влажности воздуха, для чего его помещают в кувез.
Проводится комплексный осмотр пациента хирургом, офтальмологом и другими профильными специалистами. Далее назначается дополнительное лечение. Оно будет выбрано в зависимости от точного диагноза — типа ихтиоза и тяжести болезни.
Народная медицина в борьбе с ихтиозом
Не только традиционная медицина ищет различные пути для преодоления заболевания ихтиоз. Лечение народными средствами заключается в приготовлении мазей, кремов, настоек, ванн на основе целебных трав. Так, с этой целью используются рябина, посевной овес, пустырник, пижма, облепиха, подорожник, аралия и другие. Народные целители на протяжении длительного периода времени изобретали рецепты для борьбы с патологией под названием ихтиоз. Лечение, отзывы пациентов о котором более чем положительны, дает стойкий эффект и облегчение симптоматики, главное – правильно приготовить средство.
Так, например, для приготовления одного из средств понадобятся листья подорожника, корешки пырея ползучего, цветы пижмы, хвощ полевой, пустырник сердечный. Из растений готовят напиток и употребляют внутрь. Такое лекарство поможет улучшить состояние внутренних органов, повысить иммунитет, размягчить чешуйки на коже. С последней целью активно используют мази на основе прополиса, чистотела, меда и других даров природы.
Симптомы и причины разных видов ихтиоза
Признаки ихтиоза проявляются с первых месяцев жизни в виде избыточного шелушения, обезвоживания и уплотнения кожи. Между чешуйками скапливаются органические кислоты, которые обладают выраженными цементирующими свойствами. Поэтому кожные покровы пациентов становятся шершавыми и грубыми на ощупь. Тяжесть клинических проявлений генодерматоза сильно варьируется. Легкая форма ихтиоза практически не доставляет больным психологического или физического дискомфорта.
Данное заболевание имеет более 30 видов. Оно может возникнуть сразу после рождения либо проявляется в последующие три года. Ороговевшие участки проверяют на наличие молекулы кератин с измененной структурой. Именно такие клетки провоцируют образование различных корок.
В дерматологической практике выделяют 28 форм заболевания. Для каждой из них характерна своя симптоматика и механизмы нарушения процессов ороговения эпидермиса. Чаще всего диагностируются такие типы ихтиоза:
- Вульгарный. Встречается у большинства пациентов, страдающих ихтиозоподобными болезнями. Вульгарный ихтиоз проявляется в первые несколько лет жизни. Генетические сбои и дефекты, которые передаются по аутосомно-доминантному типу, являются причиной его развития. Болезнь носит диссеминированный характер – поражает практически все тело. Чаще всего очаги локализуются на разгибательных поверхностях нижних конечностей. На коже формируются полупрозрачные чешуйки, которые часто закупоривают собой устья фолликулов. Отличительной особенностью вульгарного ихтиоза является отсутствие участков ороговения в сгибательных зонах – под коленями, в подмышечных впадинах и т.д.
- Ламеллярный. Этот генодерматоз развивается по причине дефекта трансглутаминазы, которая регулирует дифференциацию, то есть будущий «профиль» клеток эпидермиса. Мутации в белковых компонентах приводят к ускоренному разрастанию базального слоя, из-за чего кожа утолщается. Ламеллярный ихтиоз у новорожденных проявляется образованием светло-коричневой пленки на теле. Со временем она приобретает вид крупных чешуек. У пациентов кожа на лице выглядит покрасневшей и натянутой. На отдельных участках отмечается избыточное выделение пота и кожного жира.
- Х-сцепленный. Данная форма заболевания проявляется только у мальчиков, девочки являются носителями мутированных генов. Генодерматоз приводит к недостаточной выработке стероидной сульфатазы, которая принимает участие в трансформации стероидных гормонов. Симптомы заболевания проявляются уже через 2-3 недели после рождения. На коже формируются мелкие пластины, напоминающие чешую. У таких пациентов часто диагностируют умственную отсталость и аномальное развитие черепной коробки.
- Фолликулярный дискератоз. Болезнь поражает не только кожные покровы, но и вилочковую и половые железы. Начинается по причине дефекта ферментов, участвующих в кератинизации клеток. Характеризуется разрастанием наружного слоя эпидермиса, нарушением ороговения и проявляется в виде узелковых высыпаний на коже. Со временем покрытые чешуйками папулы сливаются, из-за чего образуются мокнущие очаги.
- Ихтиозиформная эритродермия. Аутосомно-доминантная патология возникает вследствие производства дефектного кератина. Процесс ороговения нарушается по причине изменений в дифференциации клеток эпидермиса. В наружных слоях кожи образуются мелкие пузырьки, а также наблюдается утолщение рогового слоя. Проявляется отеком мягких тканей, мокнущими очагами, расслоением и утолщением ногтей.
Ихтиоз часто сопровождается нарушениями в работе эндокринной, опорно-двигательной и нервной системы. Чаще всего страдают железы надпочечников, гонады и вилочковая железа. К основным проявлениям болезни относят сухость, шелушение, гиперемию (покраснение) и деформацию ногтевых пластин.
Причины и факторы развития
Большинство форм ихтиоза являются наследственными болезнями. Вся информация о человеке заключена в молекуле ДНК. Её отдельные участки — гены — ответственны за конкретные аспекты деятельности организма. Ихтиоз — результат поломки того участка ДНК, который управляет обновлением слоёв эпидермиса. Передача неправильного гена по наследству отличается при разных формах болезни. Один неправильный ген приводит к появлению следующих разновидностей ихтиоза:
- обычного (вульгарного) ихтиоза;
- эпидермолитического ихтиоза;
- иглистого ихтиоза;
- некоторых сочетаний ихтиоза и других анатомических аномалий строения скелета и нервной системы.
Такой механизм наследования носит название аутосомного-доминантного. Как правило, болезнь прослеживается в родословной в каждом поколении. При аутосомно-рецессивном типе наследования родители ребёнка здоровы, однако каждый из них передал свой неправильный ген ихтиоза. Вероятность рождения больного ребёнка в этом случае меньше, чем в предыдущем. Родители зачастую не подозревают о носительстве неправильных генов, поскольку ихтиоз может проявляться только в некоторых поколениях родословной. По такому механизму наследуются следующие типы ихтиоза:
- ихтиоз арлекина;
- ламеллярный ихтиоз;
- болезни, при которых сочетаются поражение кожи, нервной системы и других органов.
В некоторых случаях неправильный ген ихтиоза расположен в Х-хромосоме. У таких женщин проявлений болезни не наблюдается, поскольку они имеют нормальный ген во второй Х-хромосоме. У мужчин Х-хромосома одна, унаследованная от матери. Если в ней находится неправильный ген, у мальчика развивается ихтиоз. Девочки в такой семье не болеют, но передают дефектный ген потомству (носительство).
Тайна ДНК — видео
По-видимому, ороговением верхнего слоя кожи управляют одновременно несколько генов. При их поломке изменения на коже и внутри организма схожи, однако различаются некоторыми особенностями. В норме скорость ороговения верхнего слоя эпидермиса сопоставима со скоростью обновления других — зернистого, блестящего и шиповатого. При ихтиозе эта ситуация кардинально меняется. Нижние слои растут с обычной или замедленной скоростью. Роговой слой при этом растёт чрезвычайно быстро, поэтому во много раз превосходит по толщине нормальный. В некоторых случаях ихтиоз может развиться по причинам, не связанным с наследственностью:
- при дефиците витамина А (гиповитаминозе А);
- на фоне болезней кроветворения;
- как спутник злокачественных опухолей;
- в пожилом возрасте (сенильный ихтиоз).
При ихтиозе изменяется сам характер кожного покрова. В норме ороговевшие чешуйки настолько малы, что неразличимы невооружённым взглядом. При ихтиозе эпидермис ороговевает с образованием крупных очень плотных чешуек различного оттенка, соединённых с нижними слоями основанием. Между рядами чешуек формируются глубокие трещины. Вся картина напоминает рыбью чешую или крокодиловую кожу.
Ихтиоз — проблема не только косметическая. От изменений кожного покрова страдает весь организм. Трещины между чешуйками — широкие ворота для инфекции. В норме кожа защищает человека от попадания в ткани болезнетворных микробов. Этому способствует целостность покрова и дружественные бактерии, обитающие на поверхности под пристальным контролем иммунитета. При ихтиозе отдельные чешуйки не являются препятствием для микробов, поэтому болезнь часто осложняется воспалением глубоких тканей и проникновением возбудителя в кровь (сепсисом). Чешуйчатый кожный покров не способен выполнять ещё одну важную работу — поддерживать должную температуру внутри тела. Для больных ихтиозом опасно и переохлаждение, и перегрев.
Причины и механизм развития ихтиоза
Основная причина ихтиоза – это генная мутация, передаваемая по наследству биохимия которой еще не расшифрована. Нарушения белкового обмена, когда в крови накапливаются аминокислоты и нарушения жирового обмена, которые проявляются повышенным содержанием холестерина, являются основным проявлением генной мутации, которая приводит к ихтиозу.
Все процессы обмена веществ снижаются, терморегуляция организма нарушается, а активность ферментов в окислительных процессах кожного дыхания наоборот усиливается. У пациентов с генной мутацией, которая является причиной ихтиоза, постепенно нарастают или же появляются сразу снижение активности щитовидной железы, надпочечников и половых желез, увеличивается дефицит гуморального и клеточного иммунитета. Нарушение усвоения витамина А вместе со сниженными функциями потовых желез и приводят к нарушению ороговения кожи в сторону гиперкератоза, так как происходит избыточная продукция кератина с измененной структурой, что вместе с замедлением процесса отторжения ороговевшего слоя эпидермиса и вызывает проявления ихтиоза. При ихтиозе между чешуйками скапливаются аминокислотные комплексы, которые обладают цементирующим действием, поэтому чешуйки плотно сцеплены между собой, а их отделение от тела резко болезненно.
Симптомы врожденных ихтиозов
Младенцы с ихтиозом появляются на свет с густыми пластинчатыми образованиями на коже, имеющими форму ромба или других многоугольников. Кожные образования часто покрывают тело новорожденного причудливым геометрическим узором, немного напоминающим одежду Арлекина, откуда и пошло название.
Такие пластины (иногда в виде толстых чешуек) имеют плотную структуру и ширину до 1 см. За счет своего веса они стягивают кожу на лице, поэтому малыши рождаются с дефектами носа, губ и век. Рот новорожденного либо сильно растянут, либо стянут так, что сквозь ротовую щель (губы в большинстве случаев отсутствуют) с трудом помещается трубочка для кормления. Кушать самостоятельно новорожденные дети с тяжелым ихтиозом не могут.
Врожденные аномалии тела при ихтиозе касаются ручек и ножек младенца — они бывают недоразвитыми, опухшими, с деформированными суставами.
Другие симптомы ихтиоза Арлекина:
- у больных наблюдается деформация или визуальное отсутствие ушных раковин — они сливаются с головой толстым кожным покровом;
- дети с ихтиозом нередко рождаются преждевременно, что увеличивает риск появления у них других серьезных осложнений;
- врачи отмечают маленький размер головы новорожденных;
- суставы конечностей и пальцы на руках и ногах недоразвиты, часто на пальцах нет ногтей, на голове отсутствуют волосяные луковицы;
- неврологи диагностируют тяжелые врожденные аномалии центральной нервной системы, малыши страдают от болезненных судорог конечностей.
При рождении, ребенок с ихтиозом словно «упакован» в плотную пленку, светло-коричневого цвета. Это состояние обозначается термином «коллодийный плод». Через определенное время (от нескольких часов до недели) пленка начинает сходить, после чего следует наблюдать за состоянием кожи младенца.
- Выраженная стянутость кожи;
- Веки и губы младенца вывернуты кнаружи;
- Между крупными роговыми чешуйками образуются глубокие трещины. Эти области постоянно мокнут, так как через них свободно проходит межклеточная жидкость;
- На ладошках и стопах – глубокие трещины между толстыми чешуйками.
- Ребенок рождается в «пленке», которая вскоре начинает высыхать, растрескиваться и отделяться;
- Кожа имеет вид обожженной – она ярко красная, с незначительными очагами шелушения;
- Отмечается стянутость кожи, на ее поверхности с возрастом формируются серебристые полоски;
- У части пациентов, уши приобретают неправильную форму.
- Значительным утолщением рогового слоя эпидермиса по всей поверхности тела;
- Выворотом век, губ;
- Глубокими трещинами кожи, по типу открытых ран;
- Уменьшением размеров головки новорожденного – микроцефалией.
С возрастом, выраженность симптомов несколько ослабевает (исключение – синдром арлекина). Кожа приобретает нормальный цвет, но сохраняется ее стянутость и избыточное шелушение. При ламинарной форме у пациента можно наблюдать серебристые полосы, которые сохраняются на всю жизнь.
Первые признаки заболевания у детей начинают проявляться, в среднем, через 2-12 месяцев после рождения. Характерно начало ихтиоза в зимнее время. Симптомы выражены значительно слабее, чем при других формах. Для него характерны следующие проявления:
- Усиленное шелушение кожи по всей поверхности тела, кроме лица, подколенных и подмышечных ямок;
- Ладони и подошвы приобретают характерный вид – значительно усиливается кожный рисунок, борозды на их поверхности углубляются, у кожи снижен тонус. Доктора их образно называют «старческие ладони/стопы»;
- Как правило, на бедрах и плечах значительно утолщается роговой слой отдельными маленькими очагами. Если провести рукой по поверхности кожи в этих местах, она будет иметь ребристую структуру.
Для вульгарного ихтиоза характерно чередование обострений с периодами благополучия. Симптомы усиливаются в зимнее время, несколько уменьшаются – весной и летом.
Рацион опухолевых клеток, или роль питания в терапии рака
Статья на конкурс «Био/Мол/Текст»: Корректировка диеты часто применяется для лечения и профилактики заболеваний. Онкологические заболевания — не исключение: правильное питание может служить не только профилактической мерой, но и повышать эффективность терапии. Здесь мы предлагаем обсудить «вкусовые предпочтения» раковых клеток и разобраться в том, как отдельные питательные вещества могут помочь бороться с опухолью.

Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение: на вкус и цвет товарищей нет
С начала 1980-х годов ведущие организации здравоохранения выпускают рекомендации по питанию и образу жизни, которые позволяют снизить индивидуальный риск развития рака. Данные рекомендации основаны на результатах метаанализов эпидемиологических исследований (иными словами, анализ многолетнего опыта миллионов людей, которые питались тем или иным образом). Эти рекомендации универсальны и просты в исполнении: они не требуют подсчета калорий, строгого контроля состава продуктов, а лишь предлагают общую схему и принцип питания для поддержания здорового веса (рис. 1).
Подобного рода советы относятся к здоровым людям, тогда как для людей, страдающих онкологическими заболеваниями, стандартных рекомендаций по питанию не существует. В то же время, питание пациентов может сильно влиять на успешность терапии злокачественных образований [1]. Почему для людей, больных раком, нельзя составить универсальные рекомендации по составу пищи? Ответ на этот вопрос следует из принципов, согласно которым развиваются все опухоли [2]. Изначально клетка, которая в будущем даст начало опухоли, ничем не отличается от своих соседей. По мере накопления мутаций нормальные клетки могут постепенно эволюционировать и приобретать черты раковых клеток [3], [4]. В 2000 году среди многочисленных особенностей рака, в легендарном обзоре Hallmarks of cancer [3] были обозначены основные признаки, которые определяют биологию опухолевой клетки (рис. 2).
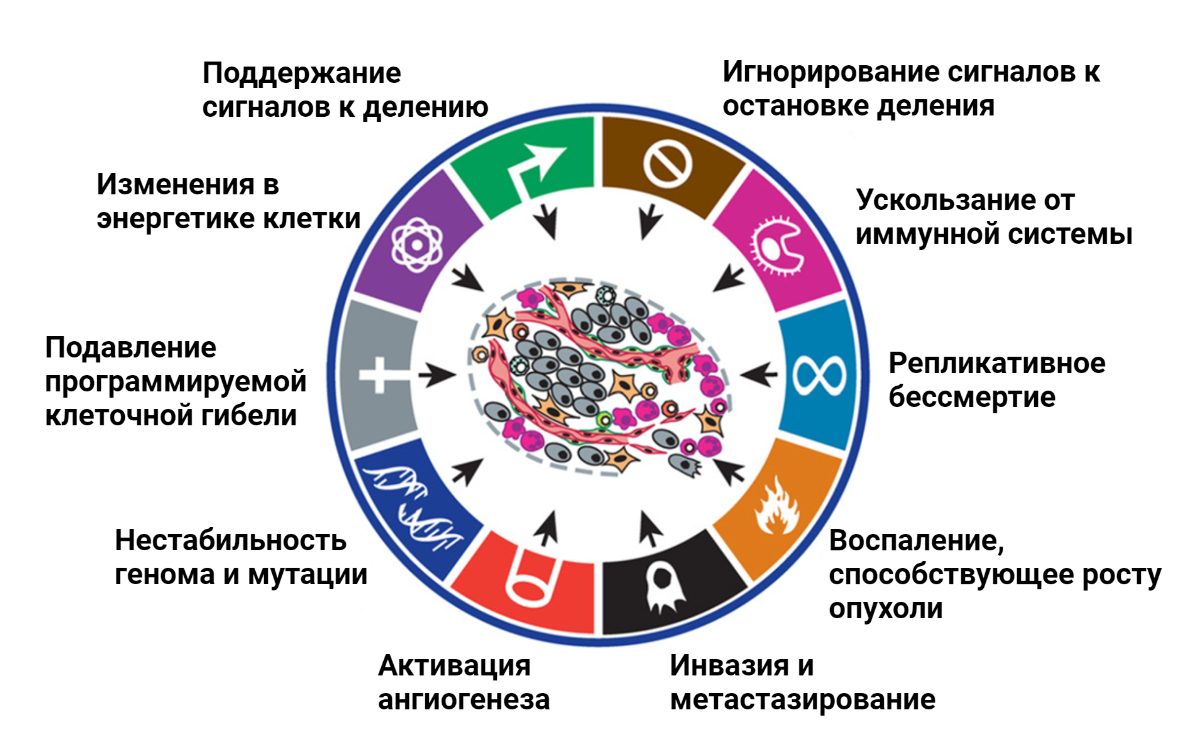
Важнейшей особенностью всех раковых клеток является нестабильность генома, которая приводит к огромному генетическому разнообразию опухолей. Несмотря на ряд свойств, присущих всем раковым клеткам, каждая опухоль обладает уникальным набором мутаций, которые и определяют ее агрессивность, скорость роста, эффективность терапии. Генетическое разнообразие опухолей является основной преградой для составления универсальных рекомендаций по питанию для пациентов.
В последнее время исследователи активно изучают влияние питательных веществ на прогрессию опухоли и эффективность лечения. В основном проводятся экспериментальные работы на животных моделях, но есть и немногочисленные клинические исследования. Мы предлагаем читателям познакомиться поближе с особенностями метаболизма опухолевой клетки. Попытаемся разобраться, как вещества, потребляемые с пищей, могут влиять на опухоль и ее окружение. И, наконец, попробуем ответить на вопрос: может ли диета помочь в борьбе с раком?
Метаболизм
Для того, чтобы разобраться в тонкостях метаболизма раковой клетки, кратко вспомним основные принципы и термины биоэнергетики. Метаболизм — это совокупность химических превращений в клетке, которые направлены на получение энергии и необходимых веществ. Только посмотрите, какое бесчисленное количество реакций включает в себя метаболизм (рис. 3)! Все метаболические пути можно условно разделить на биодеградацию (катаболизм) и биосинтез (анаболизм) [5]. Катаболизм приводит к получению энергии в виде макроэргических соединений (таких как АТФ), а также NADH, NADPH и FADH2 — коферментов, участвующих в окислительно-восстановительных реакциях. Анаболические процессы используют запасенную энергию для синтеза молекул, необходимых для жизни клетки: жиров, нуклеотидов, белков, углеводов.
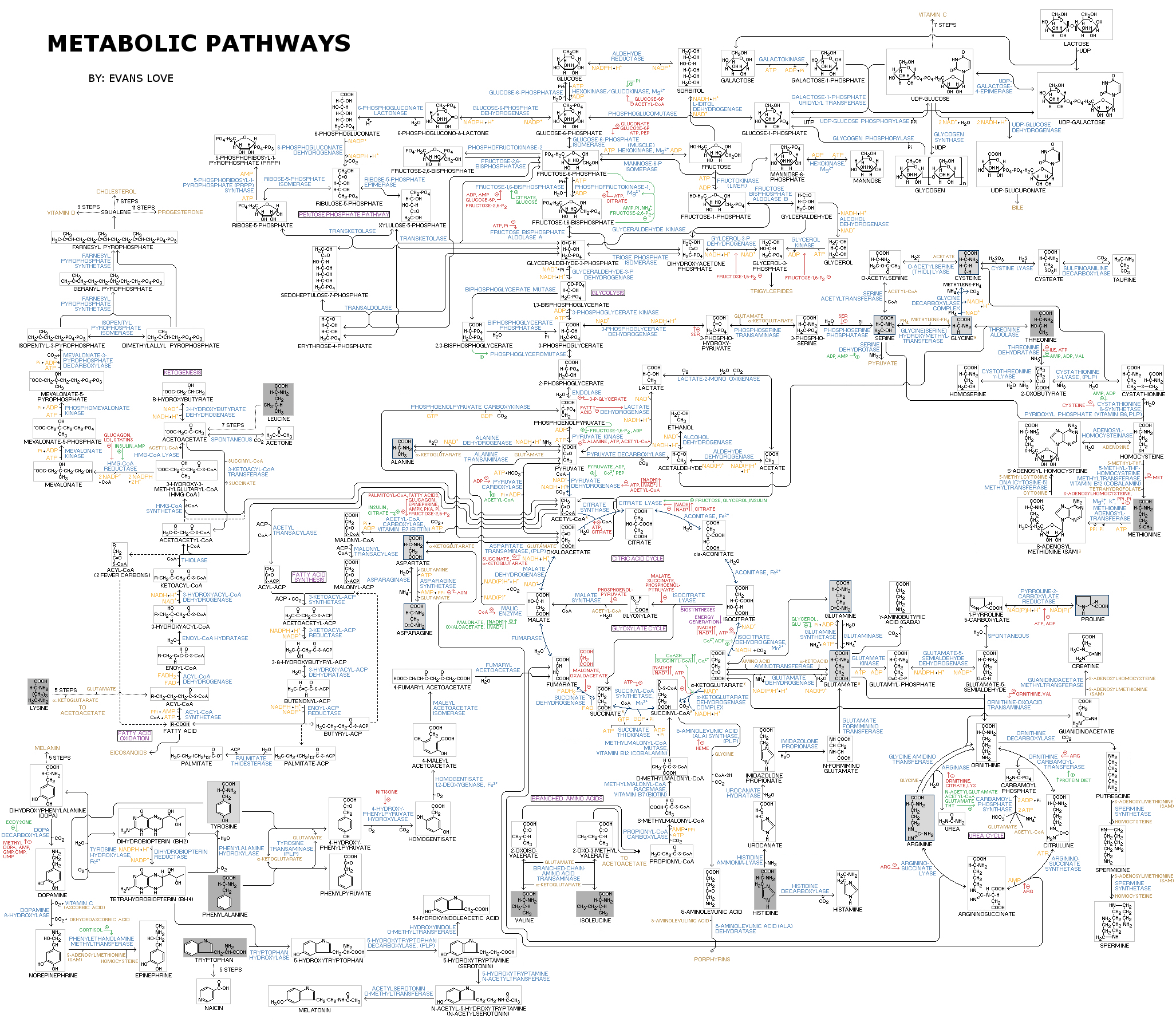
Метаболизм тесно связан с питанием: ежедневно мы потребляем питательные вещества, которые, с одной стороны, участвуют в катаболических реакциях и поставляют энергию клеткам, а с другой — необходимы для синтеза собственных молекул. Углеводы, белки и жиры, которые мы потребляем, разрушаются в пищеварительном тракте до мономерных единиц: углеводы до моносахаридов (глюкоза, фруктоза и др.), жиры до жирных кислот и глицерина, белки до аминокислот. Эти молекулы поступают в клетки организма и принимают участие в метаболических процессах.
В раковой клетке зачастую увеличена активность некоторых метаболических ферментов или целых метаболических путей, а значит, и потребность в питательных веществах у клеток опухоли может отличаться от нормальных клеток [6]. Эти особенности могут быть учтены при лечении опухоли: исключение из рациона пациента определенных компонентов пищи приведет к понижению их содержания в плазме крови, а следовательно, и в окружении раковых клеток, что негативно скажется на их размножении. Кроме этого, некоторые элементы питания могут непосредственно влиять на противоопухолевый иммунитет, что также должно быть учтено при составлении диеты.
Глюкоза
Глюкоза является основным источником энергии для живых организмов. В нормальном рационе человека она встречается как в свободном виде, так и в составе олиго- и полисахаридов (например, в сахарозе, лактозе и мальтозе). Одним из важнейших биоэнергетических путей в клетке является гликолиз — последовательность химических реакций, в результате которых из 1 молекулы глюкозы получается 2 молекулы пировиноградной кислоты, 2 молекулы АТФ и 2 молекулы NADH. Затем пировиноградная кислота может быть вовлечена в цикл трикарбоновых кислот (цикл Кребса) — биохимический процесс, протекающий в митохондриях, который поставляет NADH и FADH2 что, в конечном счете, делает возможным синтез АТФ посредством окислительного фосфорилирования. При этом из 1 молекулы глюкозы можно получить приблизительно 36 молекул АТФ, что гораздо более выгодно с точки зрения энергетики, нежели просто гликолиз. Вследствие этого большинство клеток активно использует цикл трикарбоновых кислот и окислительное фосфорилирование для получения энергии.
Тем не менее, известно множество случаев, когда по разным причинам клетки смещают баланс в сторону гликолиза, используя этот путь в качестве основного источника энергии, ингибируя ферменты цикла трикарбоновых кислот или активируя ферменты гликолиза.
Давно известно, что опухолевые клетки активно используют гликолиз, несмотря на его относительно низкую эффективность с точки зрения энергетической выгоды. Это явление было открыто Отто Генрихом Варбургом в 1924 году. Сам Варбург считал, что нарушение клеточного дыхания — главная причина развития опухоли. Однако оказалось, что клеточное дыхание в большинстве опухолевых клеток не нарушено, а просто подавляется из-за активного гликолиза. Сейчас понятно, что активный гликолиз дает преимущество опухолевым клеткам. Во-первых, гликолиз протекает без кислорода, и, по-видимому, во многом является адаптацией к гипоксии, которая развивается по мере удаления опухолевых клеток от кровеносных сосудов. Частично эта проблема также решается тем, что раковые клетки могут способствовать ангиогенезу — прорастанию сосудов в опухоль за счет продукции ангиогенных факторов, например фактора роста эндотелия сосудов (VEGF, Vascular endothelial growth factor). Во-вторых, активный гликолиз сопряжен с образованием большого количества молочной кислоты, что приводит к закислению среды, тем самым способствуя инвазии опухоли за счет разрушения нормальных популяции клеток и деградации внеклеточного матрикса.
В то же время, нельзя не отметить тот факт, что эффект Варбурга наблюдается не только в опухолевых клетках, но и вообще во всех активно пролиферирующих клетках. Глюкоза — один из основных источников углерода в клетке, и ее полное окисление в цикле трикарбоновых кислот идет вразрез с потребностями пролиферирующей клетки. Некоторая часть глюкозы, а точнее, ее метаболитов, должна быть направлена на пути биосинтеза аминокислот, нуклеотидов и жирных кислот. Важную роль в производстве предшественников нуклеотидов и аминокислот, а также NADPH, необходимого для синтеза жирных кислот, играет пентозофосфатный путь — альтернативный путь окисления глюкозы, который также имеет ключевое значение в поддержании роста раковых клеток.
Итак, глюкоза особенно необходима раковым клеткам в связи с их активным размножением; при этом она служит не только источником энергии, но и важным предшественником для синтеза аминокислот, нуклеотидов и жирных кислот. Однако помимо непосредственной роли глюкозы в клеточном метаболизме, важным физиологическим аспектом также является эффект инсулина на опухолевые клетки.
Как известно, повышение уровня глюкозы в крови вызывает секрецию гормона инсулина бета-клетками поджелудочной железы. Инсулин, в свою очередь, взаимодействует с инсулиновыми рецепторами на поверхностях клеток. Взаимодействие инсулина с его рецептором приводит к активации фосфатидилинозитол-3-киназы (PI3K) — ключевого фермента PI3K/AKT/mTOR сигнального пути: работа PI3K делает возможным фосфорилирование протеинкиназы Akt, что приводит, с одной стороны, к транслокации глюкозных транспортеров на клеточную мембрану (и, как следствие, к увеличению поглощения глюкозы клетками), а с другой стороны — к активации протеинкиназы mTORС1, важнейшего регулятора клеточного метаболизма и роста [1].
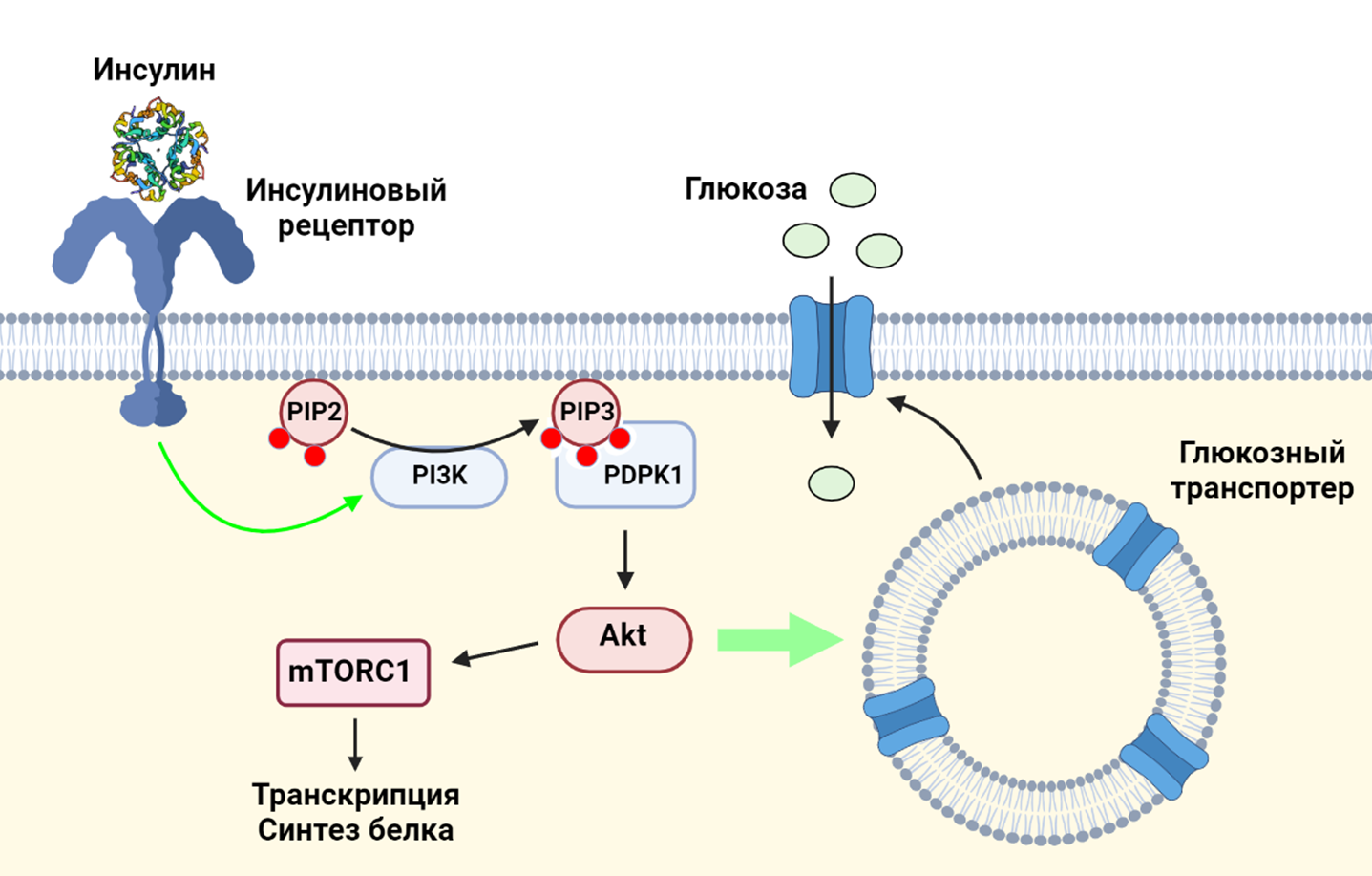
Сигнальный путь PI3K/AKT/mTOR играет важную роль в раковых клетках, которые могут активно экспрессировать рецепторы к инсулину и, получая сигналы при их стимуляции, увеличивать темпы роста и размножения.
Снижение уровня глюкозы в крови пациентов рассматривается как одна из потенциальных диетических стратегий при терапии рака. Такой подход ограничит доступность глюкозы для раковых клеток и понизит секрецию инсулина бета-клетками поджелудочной железы. Как можно понизить содержание глюкозы в крови пациентов? Конечно, уменьшение калорийности пищи приведет к снижению уровня глюкозы в крови, но такой способ не может быть оптимальным, так как поставит под угрозу общее состояние пациента. Куда более выгодной стратегией может стать кетогенная диета, которая предполагает ограничение потребления углеводов с одновременным увеличением доли жиров в рационе. Действительно, есть данные доклинических исследований и немногочисленные клинические испытания, которые говорят, что такая диета может способствовать благоприятному исходу болезни — например, при глиобластоме [7]. Однако важно отметить, что некоторые типы опухолей, наоборот, зависят от жирных кислот, а значит, диета, богатая жирами, может опосредовать проканцерогенный эффект [1], о чем мы поговорим чуть далее.
А что насчет других углеводов?
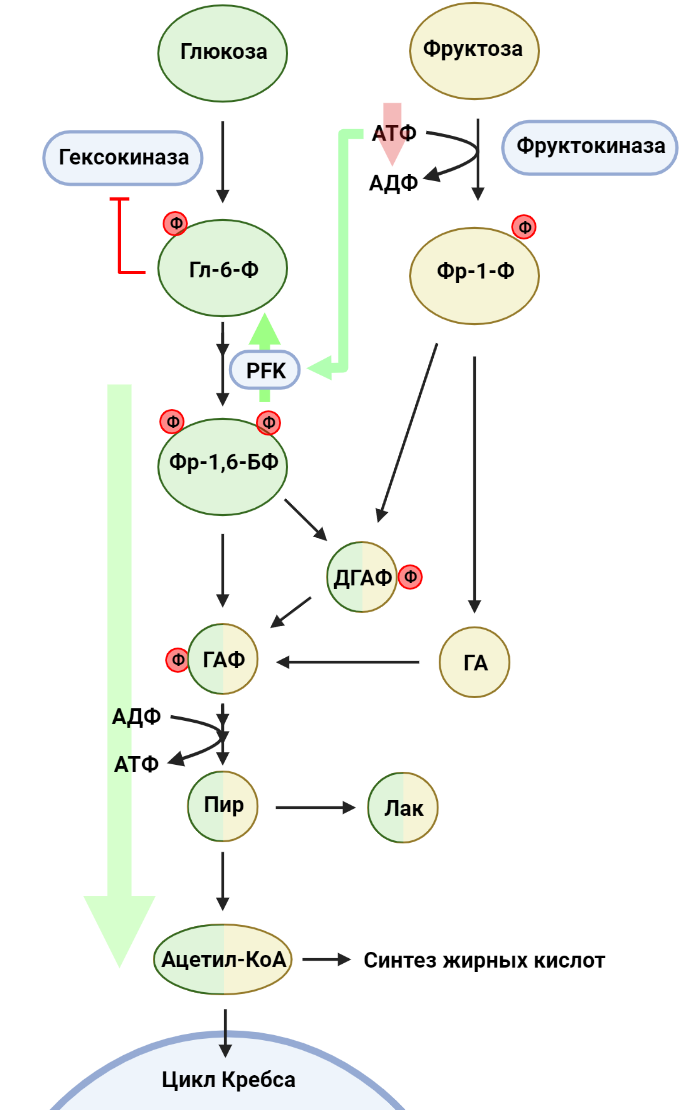
Помимо глюкозы, в наш ежедневный рацион входит множество других углеводов. Например, фруктоза, один из наиболее распространенных в природе сахаров, встречается в пище как в свободном виде, так и в составе олигосахаридов, например, сахарозы. Эпидемиологи связывают рост потребления сахаросодержащих напитков с увеличением частоты заболеваемости раком [8]. Более того, оказывается, что даже умеренное потребление фруктозы (эквивалентное одной банке газировки в день) оказывает негативное воздействие и может способствовать росту опухоли, что было отмечено в экспериментах с мышами на примере колоректального рака [9]. Глюкоза эффективно поглощается эпителиальными клетками тонкого кишечника за счет специальных белков, осуществляющих совместный транспорт глюкозы и ионов натрия. При этом транспорт фруктозы опосредуется пассивным транспортером GLUT5 и потому менее эффективен. В результате значительная часть потребляемой фруктозы проходит тонкую кишку и попадает в толстый кишечник. В случае колоректального рака фруктоза становится одним из потенциальных питательных веществ для опухолевых клеток: действительно, раковые клетки в кишечнике активно экспрессируют как GLUT5, так и ферменты, метаболизирующие фруктозу. Глюкоза и фруктоза похожи между собой с точки зрения строения молекул, однако с точки зрения их метаболизма они немного отличаются (рис. 5). Если говорить про глюкозу, то первая стадия гликолиза представляет собой фосфорилирование глюкозы с затратой АТФ и образованием глюкозо-6-фосфата, причем активность гексокиназ (ферментов, осуществляющих эту реакцию) зависит от концентрации глюкозо-6-фосфата в среде: чем больше продукта для фермента, тем менее активно он работает. Это явление — пример отрицательной обратной связи, важного аспекта регуляции активности метаболических путей. Фруктоза же в первую очередь фосфорилируется фруктокиназой до фруктозо-1-фосфата (Фр-1-Ф), также с затратой АТФ, однако в данном случае активность фермента не зависит от концентрации продукта. Это значит, что киназа будет фосфорилировать всю доступную фруктозу, вне зависимости от того, сколько Фр-1-Ф уже было сделано. Следовательно, при повышенной концентрации фруктозы клетка будет тратить много АТФ на ее фосфорилирование. В ответ на понижение уровня АТФ активируется фермент глизолиза фосфофруктокиназа (PFK), а также, помимо этого, продукты расщепления Фр-1-Ф в конечном счете попадают в реакции гликолиза. Таким образом, фруктоза усиливает гликолиз, что на руку раковым клеткам: в случае колоректального рака активация гликолиза способствует индукции синтеза жирных кислот, необходимых для роста опухоли [9].
Надо отметить, что фруктоза, хоть и способствует росту опухолей в случае колоректального рака, для роста и выживания нормальных клеток вовсе не обязательна, так что фармакологическое подавление переносчиков фруктозы и ферментов, участвующих в ее метаболизме (например, фруктокиназы) может препятствовать прогрессии колоректального рака. И конечно же, исключение фруктозы из рациона пациента также может оказывать благотворный эффект на течение болезни. Однако клинических данных, подтверждающих это, пока недостаточно [1].
Еще один любопытный пример связан с маннозой, моносахаридом, который также часто встречается в рационе как в свободном виде, так и в составе полисахаридов. Манноза поглощается теми же транспортерами, что и глюкоза, но затем накапливается в клетках в виде маннозо-6-фосфата и дальше почти не метаболизируется. В то же время, маннозо-6-фосфат ингибирует некоторые ферменты гликолиза (гексокиназу и глюкозоизомеразу), а также глюкозо-6-фосфатдегидрогеназу — первый фермент пентозофосфатного пути, альтернативного способа окисления глюкозы. Таким образом, накопление маннозо-6-фосфат влечет за собой подавление метаболизма глюкозы, что негативно сказывается на жизнеспособности раковых клеток. Однако не все опухоли чувствительны к маннозе. Дело в том, что в клетках есть фермент маннозо-6-фосфат—изомераза (PMI), который катализирует превращение маннозо-6-фосфата в фруктозо-6-фосфат, метаболит гликолиза. Казалось бы, накопление маннозо-6-фосфата перестает быть проблемой для клетки, но дело в том, что разные опухоли имеют разную активность PMI, и если в каких-то опухолевых клетках его активность понижена, то манноза будет подавлять рост опухоли. Оказалось, что колоректальные опухоли обычно имеют очень низкие уровни PMI, и действительно, на мышиной модели колоректального рака было показано, что биодобавки, содержащие маннозу, значительно подавляют рост опухолей и не оказывают отрицательный эффект на здоровье и вес мышей [10]. Возможно, применение маннозы в виде добавок к пище будет повышать эффективность терапии колоректального рака и у людей, но клинических исследований на этот счет еще не проводилось [1].
Жирные кислоты
Жирные кислоты являются важнейшим источником энергии в клетке, особенно для «энергозатратных» тканей вроде скелетной и сердечной мышечных тканей. При окислении жирных кислот (которое в основном происходит в ходе процесса β-окисления) образуются NADH и FADH2, а также ацетил-КоА — вещества, необходимые для синтеза АТФ при окислительном фосфорилировании. Более того, если сравнить между собой жирные кислоты и углеводы, то окажется, что по отношению к своей сухой массе жирные кислоты обеспечивают больше АТФ, чем углеводы, а значит, они лучше подходят на роль запасного питательного вещества (жирные кислоты запасаются в форме триглицеридов в жировой ткани). Разумеется, не могло бы случиться такого, чтобы не нашлось опухолевых клеток, активно использующих жирные кислоты как источник энергии и восстановительных эквивалентов. Действительно, описаны процессы, когда раковая клетка переходит на β-окисление, а также отдельные опухоли, для которых основной источник энергии — это жиры, а не углеводы [1], [11].
Так, было показано, что окисление жирных кислот критично для клеток рака груди при их откреплении от матрикса. Протоки молочных желез выстланы слоем эпителиальных клеток, которые дают начало опухоли. На ранних стадиях развития рака молочной железы опухолевые клетки открепляются от матрикса, покидают свои ниши, начинают пролиферировать в просветах полых железистых структур, заполняя их. Эпителиальные клетки имеют на своей поверхности рецепторы эпидермального фактора роста (epidermal growth factor receptor, EGFR). При стимуляции EGFR, помимо прочего, происходит активация сигнального пути PI3K/AKT/mTOR, что приводит к росту, пролиферации, а также способствует поглощению глюкозы и подавлению апоптоза. Для эпителиальной клетки очень важен контакт с внеклеточным матриксом. Если клетка по какой-либо причине теряет контакт с матриксом, то экспрессия EGFR падает, и, как одно из следствий, клетка начинает испытывать дефицит в глюкозе. В норме эта череда событий непременно приведет к нехватке АТФ, окислительному стрессу, и наконец — к аноикису— гибели клетки, происходящей в ответ на открепление от матрикса. Но опухолевая клетка не так проста и активно пытается спастись от апоптоза. Активность ряда онкогенов в данном случае способствует активации окисления жирных кислот, что обеспечивает клетку энергией и предотвращает гибель [12].
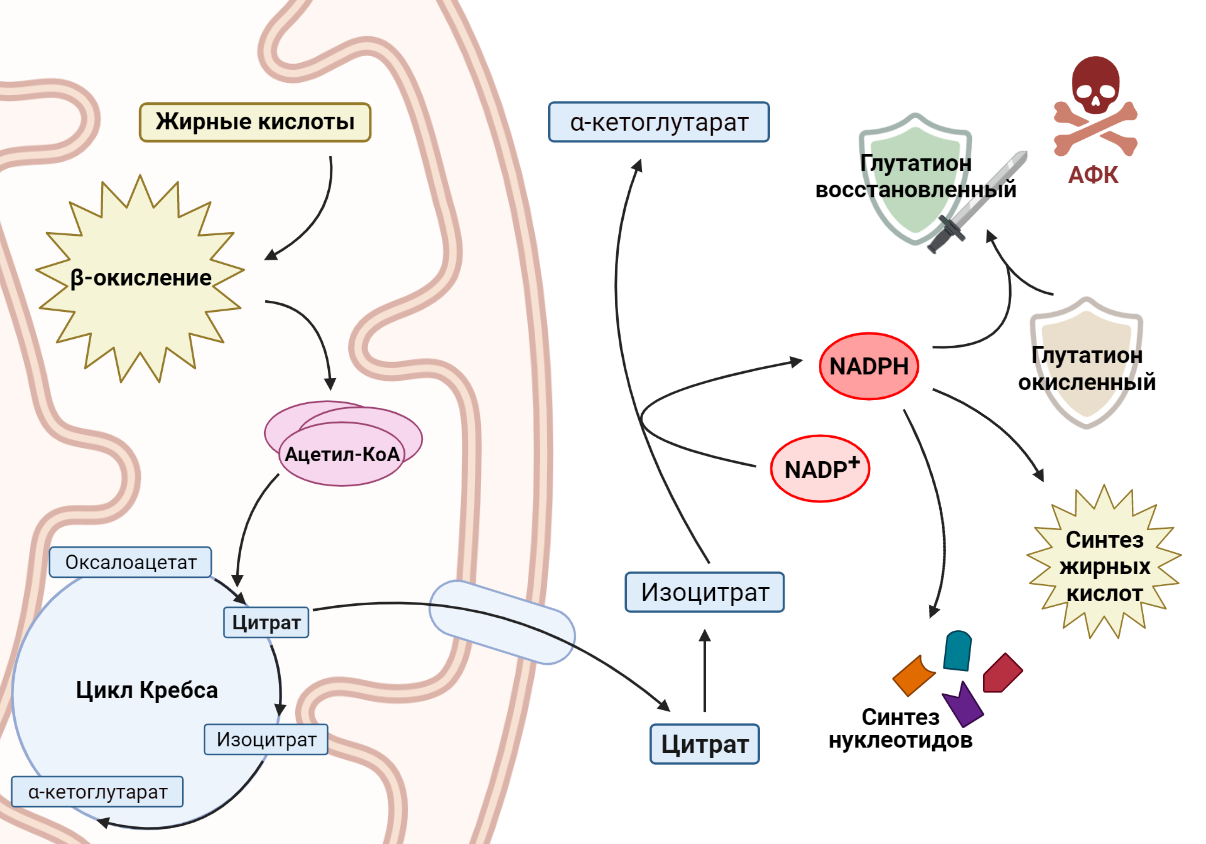
Другой важный пример роли жирных кислот в раковых клетках связан с никотинамидадениндинуклеотидфосфатом (NADPH) — веществом, которое выполняет две основные функции. С одной стороны, он участвует в защите клетки от токсичных активных форм кислорода (АФК), обеспечивая регенерацию антиоксиданта глутатиона (GSH), что особенно важно для выживания раковых клеток в условиях метаболического стресса. С другой стороны, NADPH необходим для синтеза жирных кислот и нуклеотидов, необходимых для поддержания роста и пролиферации клеток, что является неотъемлемой частью биологии опухолевой клетки. Зачастую рост раковой клетки ограничен уровнями NADPH, следовательно, изменения в метаболизме раковой клетки должны учитывать этот важный аспект. Как связаны между собой окисление жирных кислот и производство NADPH? Основным продуктом окисления жиров является ацетил-КоА, который вступает в цикл Кребса и превращается в цитрат. Цитрат может остаться воволеченным в цикл Кребса, а может покинуть митохондрию и выйти в цитоплазму. Там он превратится в изоцитрат, который является субстратом для NADP-зависимой изоцитратдегидрогеназы [13]. Этот фермент окисляет изоцитрат, при этом происходит перенос водорода на NADP+ и образуется NADPH, необходимый раковым клеткам. Например, в клетках глиомы, в которых ингибируется окисление жирных кислот, значительно понижается уровень NADPH, что приводит к накоплению АФК и, как следствие, клеточной гибели [14].
Из данных примеров мы видим, что в некоторых случаях жирные кислоты способствуют выживанию и метастазированию опухолевых клеток. Это значит, что для отдельных пациентов диета с низким содержанием жиров может оказаться полезной. В то же время, кетогенная диета, которую мы обсуждали в главе про глюкозу, может вызывать непредвиденные проканцерогенные эффекты и способствовать росту опухоли. Таким образом, режим питания пациентов должен подбираться индивидуально с учетом стадии опухоли, ее локализации и особенностей метаболизма.
Аминокислоты
Как известно, белки принимают участие в большинстве клеточных процессов: поддерживают форму клетки, обеспечивают ее подвижность, контролируют работу генов, регулируют метаболические процессы и многое-многое другое. Аминокислоты являются строительными мономерными блоками для белков. Удивительно, что при огромном разнообразии белков, все они построены из довольно ограниченного набора аминокислот (рис. 7).
С пищей в организм попадают белки, после чего в желудочно-кишечном тракте они деградируют до отдельных аминокислот. Смесь аминокислот всасывается в тонком кишечнике, поступает в кровь и разносится к каждой клетке организма. В клетках аминокислоты используются уже для синтеза собственных белков, которые необходимы для нормального функционирования организма. Важно отметить, что некоторые из аминокислот клетки нашего организма умеют синтезировать сами (так называемые заменимые аминокислоты), а некоторые непременно должны поступать с пищей (незаменимые аминокислоты). Итак, аминокислоты, которые попали в клетку, могут войти в состав белков, но для нас более интересен тот факт, что отдельные аминокислоты могут выполнять специальные метаболические функции. Далее мы будем рассматривать роль конкретных аминокислот в метаболизме раковых клеток, а также возможные диетические стратегии для пациентов с онкологическими заболеваниями, основанные на ограничении или биодобавках данных аминокислот в рационе.
Метионин
Метионин относится к незаменимым аминокислотам для клеток человека. При этом раковые клетки для своего роста требуют бóльшие количества метионина по сравнению с нормальными клетками. Дело в том, что метионин выполняет ряд регуляторных функций. В клетке есть специальные сенсоры, которые в ответ на высокий уровень метионина (а точнее, его производного — S-аденозилметионина) способны активировать протеинкиназу mTORC1. Эта протеинкиназа крайне важна для раковых клеток: она активирует процесс синтеза белка и, как следствие, ускоряет рост и деление клетки [15]. Кроме этого, S-аденозилметионин является главным донором метильной группы в клетке, то есть обеспечивает метилирование. Метилирование ДНК и гистонов (белков, связанных с ДНК) позволяет «включать» и «выключать» определенные гены. Изменения статуса метилирования гистонов и ДНК регулируют экспрессию генов и вносят свой вклад в рост и развитие опухоли [16]. Начиная с 1990 года проводятся исследования на животных, которые демонстрируют, что ограничение потребления метионина улучшает исход лечения опухолей [1], [17]. Совсем недавно было проведено первое клиническое исследование, которое показало, что снижение количества метионина в рационе пациентов позволяет замедлить прогрессирование опухоли [18]. Таким образом, диетическое ограничение метионина у людей, страдающих онкологическими заболеваниями, является весьма многообещающим подходом [1]. Важно уточнить, что диетическое ограничение тех или иных аминокислот можно осуществить только за счет «искусственных» диет, при которых основным источником белковой пищи являются протеиновые напитки/батончики без содержания определенных аминокислот. Именно такой режим питания соблюдали пациенты, принявшие участие в клиническом испытании диеты с низким содержанием метионина: 75% белковой пищи представляли из себя протеиновые напитки без метионина [18].
Серин
Аминокислота серин принимает участие во множестве метаболических процессов: в синтезе нуклеотидов и липидов; она может превращаться в пируват и поступать в цикл Кребса, и так далее. Серин относится к заменимым аминокислотам и может синтезироваться в нормальных клетках из глюкозы и глицина (самой простой аминокислоты). Для раковых клеток, которые активно используют гликолиз и, соответственно, остро нуждаются в глюкозе, синтез серина из глюкозы непременно обернется потерями в количестве АТФ и скорости размножения. Именно поэтому можно сказать, что для опухолевых клеток серин является незаменимой аминокислотой, то есть обязательно должен поступать извне. Путь синтеза серина из глицина для раковых клеток тоже крайне нежелателен, так как глицин принимает непосредственное участие в синтезе нуклеотидов, а значит, превращение глицина в серин опять же ставит под угрозу скорость деления раковых клеток. Таким образом, ограничение потребление серина действительно может помочь в терапии опухолей. Эффективность такой диеты уже была показана в экспериментах на мышах, но клинических исследований пока не проводилось [1].
Аргинин
В нормальных клетках аргинин способен образовываться de novo, то есть является заменимой аминокислотой. В опухолевых клетках меланомы, гепатоцеллюлярной карциномы и рака простаты синтез аргинина сильно снижен. Это связано с низким уровнем фермента аргининосукцинатсинтетазы, участвующем в образовании аргиинина. Выходит, что некоторые раковые опухоли требуют поступление аргинина извне (для клеток этих опухолей аргинин — незаменимая аминокислота). «Аргининовая зависимость» опухолей может быть использована для терапии, причем как в фармакологических подходах, так и в простом диетическом ограничении аргинина. Про фармакологическое снижение аргинина в раковых клетках уже кое-что известно из научных работ: так, например, препараты, снижающие уровень аргинина в плазме крови пациентов, оказались эффективными при лечении гепатоцеллюлярной карциномы и меланомы [19].
Однако аргинин может негативно сказываться на противоопухолевом иммунитете. Важнейшими клетками, участвующими в борьбе с опухолью, являются T-лимфоциты. Аргинин активно поглощается активированными T-клетками, затем метаболизируется, что приводит к увеличению выживаемости клеток и усилению противоопухолевого Т-клеточного ответа. В мышиной модели рака кожи увеличение количества потребляемого с пищей аргинина привело к уменьшению размера опухолей, способствовало выживанию мышей [20].
Не менее важную роль в противоопухолевом иммунитете играют NK-клетки (Natural killer cells, натуральные киллеры) — иммунные клетки, способные уничтожать опухолевые клетки. Исследования показали, что потребление аргинина с пищей увеличивает количество и активность NK-клеток [21], и, наоборот, дефицит аргинина угнетает работу и жизнеспособность натуральных киллеров [22], что может негативно сказаться на борьбе с опухолью.
Таким образом, аргинин необходим как некоторым опухолям для роста, так и иммунным клеткам, сражающимся с опухолью. По-видимому, только масштабные клинические испытания помогут понять, в каких случаях стоит исключать или, наоборот, увеличивать содержание аргинина в пище для достижения максимального эффекта терапии.
Цистин и цистеин
Одна из важнейших функций аминокислоты цистеина в клетке — защита от активных форм кислорода (например, перекиси водорода), которые повреждают ДНК, липиды и белки, вызывая в клетке окислительный стресс. Раковые клетки, по сравнению с нормальными, испытывают сильный окислительный стресс и требуют большого количества цистеина. Действительно, для некоторых опухолевых клеток снижение уровня цистеина губительно: клетки «сгорают» из-за накопленных активных форм кислорода. Цистеин образуется из неклассической аминокислоты цистина, которая поступает в клетку из плазмы крови [1]. Препараты, снижающие уровень цистина в плазме крови, тормозят рост опухолей с мутантным рецептором эпидермального фактора роста (например, немелкоклеточного рака легких) у мышей [23]. Теоретически, достичь снижения уровня цистина в плазме крови пациентов можно при помощи корректировки диеты, без применения препаратов, но такой подход пока не исследован.
Гистидин
При деградации гистидина в клетке тратится тетрагидрофолат — кофактор, который необходим для синтеза нуклеотидов, а значит, определяет скорость деления раковых клеток. Чем больше в раковую клетку поступает гистидина, тем больше тетрагидрофолата тратится на распад гистидина и тем медленнее клетка делится. Применение гистидина вместе с пищей может помочь в терапии некоторых видов опухолей. В частности, такой диетический подход может стать особенно эффективным при лечении рака химиотерапевтическим агентом — метотрексатом (часто применяется для лечения злокачественных заболеваний крови). Метотрексат нарушает синтез тетрагидрофолата, что приводит к остановке синтеза нуклеотидов и к гибели раковых клеток. Оказалось, что эффективность лечения лейкемии метотрексатом заметно увеличивается при добавлении к пище аминокислоты гистидина — это было показано на мышиной модели [24].
Биодобавки фолиевой кислоты
В заключение мы хотим уделить внимание витаминам. Витамины необходимы для протекания многих биохимических реакций и должны поступать в организм с пищей. Существует распространенное заблуждение о том, что прием витаминных биодобавок может послужить защитой от рака и других заболеваний. На самом деле, витамины должны поступать исключительно с пищей, а дополнительный прием витаминов здоровым людям в основном не рекомендован (за некоторыми редкими исключениями). Регулярный прием биодобавок может оказаться не только неэффективными, но и вредным, особенно людям, страдающим онкологическими заболеваниями. Давайте рассмотрим пример того, как дополнительный прием витаминов способствует росту опухоли.
Фолиевая кислота (фолат, витамин B9) является необходимым веществом для синтеза нуклеотидов. Опухолевые клетки быстро делятся и нуждаются в больших количествах нуклеотидов для синтеза ДНК, поэтому активно потребляют фолат. Еще в 1948 году стало известно, что биодобавки фолиевой кислоты способствуют росту некоторых видов опухолей [25]. На сегодняшний день метаболизм фолиевой кислоты является фармакологической мишенью для терапии рака: упоминавшийся ранее химиотерапевтический препарат метотрексат нарушает метаболизм фолата и ингибирует пути синтеза нуклеотидов. Надо подчеркнуть, что антифолиевая терапия рака пока что является сугубо фармакологической и не предполагает корректировки диеты [1].
Однако потенциальные негативные эффекты фолата в опухолевой прогрессии на этом не заканчиваются. Ряд исследований показал, что присутствие в крови неметаболизированной фолиевой кислоты, связанное с ее избыточным потреблением, влекло за собой снижение количества и активности NK-клеток [26-28]. Упоминавшиеся ранее NK-клетки — это иммунные клетки, одна из основных функций которых состоит в защите организма от раковых клеток. Следовательно, снижение числа и подавление активности NK-клеток может повлечь за собой повышенный риск образования и прогрессии рака, хотя конкретных исследований о влиянии высоких доз фолата на противоопухолевый иммунитет не проводилось.
Таким образом, витамины необходимы для поддержания функций организма, однако чрезмерное потребление некоторых из них может привести к негативным последствиям, в том числе и к прогрессии опухоли, как в случае с витамином B9. Возможно, диета с низким содержанием фолата будет полезной для некоторых пациентов.
Заключение
Мы постарались кратко охарактеризовать некоторые особенности метаболизма опухолевых клеток и роль питательных веществ в прогрессии рака. В заключение мы хотели бы еще раз обратить внимание на то, что не существует какой-либо универсальной диеты для людей, страдающих онкологическими заболеваниями. Это связано с тем, что опухоли сильно различаются по своему метаболизму. Перечисленные диетические подходы пока что не могут использоваться повсеместно, так как перед внедрением любого из них для каждого типа рака, его локализации и стадии заболевания должны быть проведены масштабные клинические испытания, подтверждающие безопасность и эффективность нового метода лечения. Однако, ввиду многообещающих результатов исследований, модификации диеты являются перспективным подходом к лечению рака. Мы уверены, что в скором времени контроль состава диеты пациентов станет важной частью терапии онкологических заболеваний и поможет спасти многие жизни. А пока что давайте просто стараться питаться правильно и вести здоровый образ жизни. Будьте здоровы!
Литература
- Naama Kanarek, Boryana Petrova, David M. Sabatini. (2020). Dietary modifications for enhanced cancer therapy. Nature. 579, 507-517;
- Путь клетки «из греков в варяги». Малигнизация: причины и следствия;
- Douglas Hanahan, Robert A Weinberg. (2000). The Hallmarks of Cancer. Cell. 100, 57-70;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Метаболизм клетки;
- Вослед Варбургу — последние достижения в изучении биоэнергетики рака;
- Colin E. Champ, Joshua D. Palmer, Jeff S. Volek, Maria Werner-Wasik, David W. Andrews, et. al.. (2014). Targeting metabolism with a ketogenic diet during the treatment of glioblastoma multiforme. J Neurooncol. 117, 125-131;
- Julie K. Bassett, Roger L. Milne, Dallas R. English, Graham G. Giles, Allison M. Hodge. (2020). Consumption of sugar‐sweetened and artificially sweetened soft drinks and risk of cancers not related to obesity. Int. J. Cancer. 146, 3329-3334;
- Marcus D. Goncalves, Changyuan Lu, Jordan Tutnauer, Travis E. Hartman, Seo-Kyoung Hwang, et. al.. (2019). High-fructose corn syrup enhances intestinal tumor growth in mice. Science. 363, 1345-1349;
- Pablo Sierra Gonzalez, James O’Prey, Simone Cardaci, Valentin J. A. Barthet, Jun-ichi Sakamaki, et. al.. (2018). Mannose impairs tumour growth and enhances chemotherapy. Nature. 563, 719-723;
- Arkaitz Carracedo, Lewis C. Cantley, Pier Paolo Pandolfi. (2013). Cancer metabolism: fatty acid oxidation in the limelight. Nat Rev Cancer. 13, 227-232;
- Zachary T. Schafer, Alexandra R. Grassian, Loling Song, Zhenyang Jiang, Zachary Gerhart-Hines, et. al.. (2009). Antioxidant and oncogene rescue of metabolic defects caused by loss of matrix attachment. Nature. 461, 109-113;
- Alessandra Castegna, Pasquale Scarcia, Gennaro Agrimi, Luigi Palmieri, Hanspeter Rottensteiner, et. al.. (2010). Identification and Functional Characterization of a Novel Mitochondrial Carrier for Citrate and Oxoglutarate in Saccharomyces cerevisiae. Journal of Biological Chemistry. 285, 17359-17370;
- Lisa S. Pike, Amy L. Smift, Nicole J. Croteau, David A. Ferrick, Min Wu. (2011). Inhibition of fatty acid oxidation by etomoxir impairs NADPH production and increases reactive oxygen species resulting in ATP depletion and cell death in human glioblastoma cells. Biochimica et Biophysica Acta (BBA) — Bioenergetics. 1807, 726-734;
- Xin Gu, Jose M. Orozco, Robert A. Saxton, Kendall J. Condon, Grace Y. Liu, et. al.. (2017). SAMTOR is an S -adenosylmethionine sensor for the mTORC1 pathway. Science. 358, 813-818;
- Samantha J. Mentch, Mahya Mehrmohamadi, Lei Huang, Xiaojing Liu, Diwakar Gupta, et. al.. (2015). Histone Methylation Dynamics and Gene Regulation Occur through the Sensing of One-Carbon Metabolism. Cell Metabolism. 22, 861-873;
- Raghu Sinha, Timothy K. Cooper, Connie J. Rogers, Indu Sinha, William J. Turbitt, et. al.. (2014). Dietary methionine restriction inhibits prostatic intraepithelial neoplasia in TRAMP mice. Prostate. 74, 1663-1673;
- Xia Gao, Sydney M. Sanderson, Ziwei Dai, Michael A. Reid, Daniel E. Cooper, et. al.. (2019). Dietary methionine influences therapy in mouse cancer models and alters human metabolism. Nature. 572, 397-401;
- Francesco Izzo, Paolo Marra, Gerardo Beneduce, Giuseppe Castello, Paolo Vallone, et. al.. (2004). Pegylated Arginine Deiminase Treatment of Patients With Unresectable Hepatocellular Carcinoma: Results From Phase I/II Studies. JCO. 22, 1815-1822;
- Roger Geiger, Jan C. Rieckmann, Tobias Wolf, Camilla Basso, Yuehan Feng, et. al.. (2016). L-Arginine Modulates T Cell Metabolism and Enhances Survival and Anti-tumor Activity. Cell. 167, 829-842.e13;
- K.G.M. Park, P.D. Hayes, O. Eremin, H. Sewell, K.G.M. Park, P.J. Garlick. (1991). Stimulation of lymphocyte natural cytotoxicity by L-arginine. The Lancet. 337, 645-646;
- Bruno Lamas, Juliette Vergnaud-Gauduchon, Nicolas Goncalves-Mendes, Olivier Perche, Adrien Rossary, et. al.. (2012). Altered functions of natural killer cells in response to L-Arginine availability. Cellular Immunology. 280, 182-190;
- Ioannis Poursaitidis, Xiaomeng Wang, Thomas Crighton, Christiaan Labuschagne, David Mason, et. al.. (2017). Oncogene-Selective Sensitivity to Synchronous Cell Death following Modulation of the Amino Acid Nutrient Cystine. Cell Reports. 18, 2547-2556;
- Naama Kanarek, Heather R. Keys, Jason R. Cantor, Caroline A. Lewis, Sze Ham Chan, et. al.. (2018). Histidine catabolism is a major determinant of methotrexate sensitivity. Nature. 559, 632-636;
- Sidney Farber, Louis K. Diamond, Robert D. Mercer, Robert F. Sylvester, James A. Wolff. (1948). Temporary Remissions in Acute Leukemia in Children Produced by Folic Acid Antagonist, 4-Aminopteroyl-Glutamic Acid (Aminopterin). N Engl J Med. 238, 787-793;
- Hathairat Sawaengsri, Junpeng Wang, Christina Reginaldo, Josiane Steluti, Dayong Wu, et. al.. (2016). High folic acid intake reduces natural killer cell cytotoxicity in aged mice. The Journal of Nutritional Biochemistry. 30, 102-107;
- Aron M. Troen, Breeana Mitchell, Bess Sorensen, Mark H. Wener, Abbey Johnston, et. al.. (2006). Unmetabolized Folic Acid in Plasma Is Associated with Reduced Natural Killer Cell Cytotoxicity among Postmenopausal Women. The Journal of Nutrition. 136, 189-194;
- Clovis Paniz, Juliano Felix Bertinato, Maylla Rodrigues Lucena, Eduardo De Carli, Patrícia Mendonça da Silva Amorim, et. al.. (2017). A Daily Dose of 5 mg Folic Acid for 90 Days Is Associated with Increased Serum Unmetabolized Folic Acid and Reduced Natural Killer Cell Cytotoxicity in Healthy Brazilian Adults. The Journal of Nutrition. 147, 1677-1685.
Эшерихиоз — коли-инфекция — виды, симптомы, пути передачи, методы лечения
Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн.
- Запись опубликована: 22.08.2021
- Reading time: 7 минут чтения
Эшерихиоз (колибактериоз) – инфекционное заболевание, вызываемое патогенной кишечной палочкой (E. coli). Проявляется остро — диареей часто с кровью или слизью, лихорадкой, болями в животе. В зависимости от возбудителя заболевание может осложняться гемолитико-уремическим синдромом (ГУС) и тромботической тромбоцитопенической пурпурой (ТТП).
Возбудители эшерихиоза
Кишечная палочка (E. coli) — грамотрицательная палочковидная бактерия, содержащаяся в составе обычной кишечной флоры в виде непатогенных штаммов.
Наибольшее значение при диарейной патологии имеют четыре группы E. coli:
- энтерогеморрагическая E. coli (EHEC);
- энтеротоксигенная E. coli (ETEC);
- энтероинвазивная E. coli (EIEC);
- энтеропатогенная E. coli (EPEC).
Заболевание, вызываемое каждой группой, имеет разный патогенез, возбудители обладают разными вирулентными свойствами и разными серотипами O:H. Синдромы, вызванные E. coli, также могут быть различными в разных группах.
Эшерихия стабильна в окружающей среде, может поддерживать жизнеспособность в почве, воде и кале до нескольких месяцев. В пище, особенно в молоке, размножается, многочисленными колониями, легко переносит сушку. Кишечная палочка погибает при кипячении и дезинфекции.
Классификация колибактериоза
Эшерихиозы классифицируются по этиологическом принципу в зависимости от группы возбудителя — энтеропатогенные, энтеротоксические, энтероинвазивные, энтерогеморрагические.
Также существует клиническая классификация — гастроэнтерическая, энтероколитарная, гастроэнтероколитическая и общая формы заболевания. Генерализованная форма может быть представлена деятельностью кишечной палочки в различных органах и системах, в результате чего развивается, например, менингит, менингоэнцефалит, пиелонефрит и др.
Эшерихиоз может протекать легко, быть средней и тяжелой степени.

Пути распространения инфекции — как можно подцепить коли-инфекцию
Резервуар и источник инфекции — больные или здоровые носители. Опасные распространители эпидемии — больные колибактериозом, обусловленным типами EPEC и EIEC, другие группы бактерий менее опасны. Группы кишечных палочек разделяют у пациентов на 1-3 неделе. Выделение возбудителя может длиться довольно длительное время, особенно у детей.
Механизм передачи E. coli – фекально-оральный. Наиболее часто заражение через пищу происходит энтероинвазивной E. coli.
- Заражение может осуществляться через воду, когда сточные воды сбрасываются без очистки.
- Заразными могут быть молочные продукты, мясные блюда, напитки (квас, компоты), салаты с отварными овощами. Известны вспышки после употреблением бургеров.
- Среди детей, при нарушении правил гигиены, возможно распространение кишечной палочки через игрушки, грязные руки.
Общие симптомы колибактериоза
Каждая группа заболеваний, вызванная кишечной палочкой, имеет свой инкубационный период, свои симптомы и свою группу риска.
Энтеропатогенный эшерихиоз класса I обычно развивается у маленьких детей, инкубационный период составляет несколько дней. Возникает рвота, жидкий стул, сильное отравление и обезвоживание. Возможен переход в септическую форму. У взрослых диагностируется энтеропатогенный эшерихиоз класса II, заболевание прогрессирует как сальмонеллез.
Энтероинвазивный эшерихиоз характеризуется течением схожим с дизентерией. Инкубационный период длится от одного до трех дней, наблюдается острое проявление, умеренное отравление (головная боль, слабость), лихорадка от субфебрильной до высокой, озноб. Затем возникают боли в животе (преимущественно вокруг пупка), диарея (иногда кровотечение, слизь). Нередко инфекция этого вида протекает легко и стирается. Как правило, продолжительность заболевания не превышает нескольких дней.
Симптомы энтеротоксигенного эшерихиоза похожими на сальмонеллез или сходны с легкой холерой. Инкубационный период составляет 1-2 дня, отравление слабое, температура обычно не повышается, наблюдается рвота, сильная диарея, постепенно усиливается обезвоживание, отмечается олигурия. Появляются боли в эпигастрии, судороги.
Энтерогеморрагический эшерихиоз чаще развивается у детей. Его симптомы: умеренная интоксикация, температура тела в субфебриле, тошнота и рвота, жидкий водянистый стул. При тяжелом течении в 3-4 дня появляются сильные боли в слизистой оболочке желудка, усиливается диарея, в кале может отмечаться смесь крови и гноя. Чаще всего заболевание проходит через неделю, но с трудом (особенно у детей младшего возраста).
На 7-10-й день, после исчезновения диареи, есть вероятность развития гемолитико-уремического синдрома — сочетание гемолитической анемии, тромбоцитопении и острой почечной недостаточности. Возможны нарушения мозговой регуляции: судороги ног, мышечная скованность, потеря сознания до сопора и комы. Смертность из-за развития этих симптомов достигает 5%.

Энтерогеморрагическая кишечная палочка ( EHEC )
Диареи, вызванные EHEC, — основная причина заболеваемости и смертности у детей, особенно в экономически развивающихся странах. Основной серологический тип этой группы E. coli (E. coli O157:H7) был идентифицирован в 1982 году.
- EHEC обычно вызывает геморрагический колит;
- в кале примеси крови могут быть от визуально невидимых до диареи только кровью;
- лейкоциты в кале отсутствуют.
Наиболее тяжелая клиническая форма ЭГКП — гемолитико-уремический синдром, развивающийся в среднем у 5% больных с манифестной (с ярко выраженными симптомами) формой заболевания и тромботическая тромбоцитопеническая пурпура (ТТП).
EHEC производит сильные цитотоксины — Шига 1 и Шига 2. Токсин Шига 1 идентичен токсину, продуцируемому штаммом Shigella dysenteriae 1. Сейчас эти токсины называют вероцитотоксинами 1 и 2 или шигаподобными токсинами I и II.
Основной резервуар EHEC — крупный рогатый скот. Заражение происходит в основном через зараженную пищу: сырое или недостаточно термически обработанное мясо, мясные продукты, молоко. Частые пути распространения инфекции — фекальное загрязнение воды и пищи, а также перекрестное загрязнение пищи во время ее приготовления.
Известно о вспышках E. coli O157 с заражением через гамбургеры, колбасы, стейки из говядины, молоко, свежий яблочный сок, йогурты, сыры, майонез, салат. Возбудитель достаточно устойчив к кислоте и выживает в ферментированной пище, маринованных овощах.
Инфекция может распространяться через загрязненную питьевую воду, открытые водоемы и бытовые контакты. Также заболеть можно после прямого контакта с животным-переносчиком.
В дополнение к классическому серологическому типу инфекции EHEC, E. coli O157:H7, известно более 100 различных серологических типов вероцитотоксин-продуцирующих E. coli (VTEC). Чаще встречаются O26: H11, O111: H8, O103: H2, O113: H21, O104: H21. Эти возбудители вызывают диарею, аналогичную инфекции E. coli O157:H7. Общий атрибут всех VTEC — производство вероцитотоксинов vtx 1 и 2.
Исследования в европейских странах, показали, что диарея, связанная с VTEC встречается несколько реже, чем сальмонеллез и кампилобактериоз, но значительно чаще, чем шигеллез и дизентерия. Примерно у каждого второго пациента с инфекцией VTEC обнаруживаются возбудители, не относящиеся к типу O157. Заболевания, вызванные VTEC, не являющимися O157, также могут осложняться гемолитико-уремическим синдромом.
Основной источник VTEC, не являющихся O157, — жвачные животные. Уч. Беттельхайм установил, что выделенные серологические типы таких VTEC, такие же, как и те, что выделены у пациентов с синдромом гемолитико-уреемией и геморрагическим колитом (HC).
Чаще всего больные получают инфекцию через сырое мясо и молоко, зараженные во время обработки.
Основные факторы риска заражения VTEC:
- высокая распространенность агентов VTEC у животных;
- загрязнение пищевых продуктов навозом животных и перекрестное загрязнение сырой и термически обработанной животной пищи;
- неправильная термическая подготовка корма для животных;
- контакт с инфицированными людьми, домашними животными, носителями VTEC.
Энтеротоксигенная e. coli (ETEC)
Это наиболее распространенная инфекция среди путешествующих в экономически развивающиеся страны с жарким климатом и низкой гигиенической культурой. Заболевание, вызванное энтеротоксигенными бактериями, — основная причина обезвоживания у младенцев и детей младшего возраста в этих странах.
Симптомы ETEC похожи на Vibrio cholerae и вызывают обильную, водянистую диарею без крови и слизи.
ETEC производит TS и TL энтеротоксины. Наиболее распространенные серологические типы — O6, O8, O15, O20, O25, O27, O63, O78, O80,O114, O115, O128ac, O148, O153, O159, O167.
В развивающихся странах дети сталкиваются с бактериями ETEC в первые 3 года жизни, приобретая иммунитет, поэтому взрослые жители страдают от этой инфекции редко. Но это не касается наших туристов, не имеющих иммунитета — им инфекция грозит в любом возрасте.
Источник энтеротоксигенной e. coli – человек. Инфекция чаще всего распространяется через пищу, реже через воду. Также возможно бытовое заражение от больного.
Энтероинвазивная E. coli (EIEC)
Инфекция EIEC проявляется сильными болями в животе, недомоганием, водянистой диареей и лихорадкой. При прогрессировании заболевания примерно у 10% больных хорошо заметны кровь и слизь в стуле. Инфекцию EIEC можно заподозрить, если в кале обнаруживается большое количество лейкоцитов Но диагноз подтверждается бактериологическими, серологическими и иммунологическими тестами.
Основные серологические типы EIEC — O28ac, O29, O112, O124, O136, O143, O144, O152, O167.
Резервуар энтероинвазивной палочки — человек. Эта инфекция эндемична для экономически развивающихся стран, но единичные случаи инфицирования и вспышки EIEC регистрируются и в развитых странах. Считается, что чаще всего заражение происходит через пищу, но эпидемиология инфекции, вызванной этой группой бактерий, и экология возбудителей мало известны.
Энтеропатогенная E.coli (EPEC)
Вызванная EPEC диарея, чаще диагностируется у младенцев в возрасте до 1 года. Заболевание проявляется опасными симптомами:
- водянистой диареей со слизью;
- лихорадкой;
- обезвоживанием.
Диарея у младенцев часто бывает тяжелой и затяжной, а в экономически слаборазвитых странах становится причиной младенческой смерти.
Наиболее часто выявляемые серологические типы группы EPEC — O55, O86, O111, O119, O125, O126, O127, O128ab и O142.
Источник энтеропатогенной E. coli – человек. Инфекция может распространяться через любое детское питание, включая молочные смеси. В родильных домах, детсадах, детдомах заражение происходит через предметы обихода и немытые руки персонала.

Осложнения эшерихиоза
Как правило, колибактериоз не склонен к осложнениям, но при инфекции, вызванной возбудителем энтерогеморрагической группы, возможны осложнения со стороны мочевыделительной системы, развитие гемолитической анемии и нарушений работы головного мозга.
Диагностика эшерихиоза
При диагностике заболевания возбудитель определяется в кале и рвотных массах, в случаях генерализации – в крови, моче, желчи. Проводится бактериологическое исследование, посев в питательную среду. Учитывая антигенное сходство возбудителей колибактериоза с бактериями, входящими в нормальную флору кишечника, серологическая диагностика неинформативна.
Для лабораторной диагностики инфекций, вызванных энтерогеморрагической группой, возможно обнаружение бактериальных токсинов в кале. При этом типе колибактериоза в пробе крови могут наблюдаться признаки гемолитической анемии, повышенный уровень мочевины и креатинина. Анализ мочи обычно показывает протеинурию, лейкоцитурию и гематурию.
Лечение колибактериоза
При течении заболевания без тяжелых симптомов назначается амбулаторное лечение. Пациентов с тяжелыми формами и высоким риском осложнений госпитализируют.
Больным рекомендуется специальная диета, назначаемая при диареях. Умеренное обезвоживание регулируется приемом внутрь жидкости и регидратацией, при повышенной и выраженной степени обезвоживания проводятся внутривенные вливания.
Патогенетическое лечение выбирается в зависимости от вида возбудителя.
- В качестве антимикробной терапии назначают препараты Нитрофурана (фуразолидон).
- Тяжелые энтероинвазивные инфекции лечат фторхинолонами (ципрофлоксацин). Препараты назначаются на 5-7 дней.
- Лечение энтеропатогенного эшерихиоза у детей должно проводиться с использованием комбинации сульфаметоксазола и триметоприма, антибиотикотерапии. Распространенные формы лечат цефалоспоринами второго и третьего поколения.
- В комплексную терапию при длительном течении заболевания для нормализации пищеварения и восстановления биоценоза кишечника входят ферментативные препараты и эубиотики.
- Современные принципы лечения колибактериоза, вызванного бактериями энтерогеморрагической группы, включают применение антитоксических терапевтических средств (сыворотка, экстракорпоральная адсорбция антител).
Прогноз излечения
Прогноз для взрослых и детей старшего возраста – благоприятный, бывают случаи самоизлечения. Маленькие дети могут столкнуться с тяжелой формой, что однозначно ухудшает прогноз из-за развития осложнений. Особенно тяжелые формы колибактериоза без своевременной медицинской помощи приводят к гибели.
Противоэпидемические мероприятия и профилактика
Эшерихиоз – заболевание, связанное со слабой гигиенической культурой. Личная профилактика этих инфекций включает соблюдение гигиенических норм, особенно в отношении детей, мытья рук, продуктов питания, игрушек и предметов домашнего обихода.
Общая профилактика направлена на контроль за соблюдением санитарно-гигиенических требований в детских учреждениях, на предприятиях пищевой промышленности, медицинских учреждениях, в месте сбросов сточных вод и состоянием источников воды. Работников пищевой промышленности нужно регулярно проверять на выделение болезнетворных микроорганизмов, отстраняя их от работы в случае положительного теста.
Клиническое выздоровление пациентов должно подтверждаться результатами трех бактериологических тестов. Прием в детский коллектив, контакт с больным, также должен осуществляться после бактериологической диагностики и подтверждения отсутствия выделения возбудителя.
В случае вспышки инфекции, в связи с тяжестью заболеваний, вызываемых ЭГКП, необходимо как можно скорее выявлять факторы риска распространения инфекции для применения специфических профилактических мер. В случае подозрения на вспышку необходимо:
- найти конкретные факторы передачи инфекции (продукты питания, вода и т.д.)
- оценив риск распространения инфекции, обеспечить контроль для локализации и искоренения очага.
В случае вспышки инфекции пищевого происхождения:
- выявить источники загрязнения пищевых продуктов;
- немедленно прекратить производство и провести утилизацию подозреваемых продуктов питания;
- провести микробиологическую оценку подозреваемой пищи и окружающей среды, обследование сотрудников предприятия.
При подозрении на инфекцию, вызванную ЭГКП, в домашних условиях необходимо:
- немедленно обратиться в инфекционное отделение;
- предотвратить распространение инфекции через бытовые контакты.
Чтобы не подцепить эшерихиоз:
- перед едой, после посещения улицы, детских учреждений, рынков и магазинов, мойте руки горячей водой с мылом;
- избегайте непастеризованного молока и продуктов из него;
- употребляйте только хорошо прожаренное и проваренное мясо и мясные продукты.
Воздействие температуры 70 град. в течение 15-16 секунд внутри куска мяса обеспечивает уничтожение бактерий. Чтобы понять, что мясо хорошо термически обработано, можно проверить цвет жидкости, вытекающей из него — это не должна быть кровь.
При поездках в эндемичные страны нужно употреблять только безопасную пищу и питьевую воду, как можно чаще мыть руки с мылом и избегать контактов с больными.
Для профилактики инфекции при уходе за новорожденными очень важны гигиена рук и соблюдение санитарно-гигиенических норм в учреждениях по лечению и уходу за детьми.
Источник https://erc-perm.ru/ihtioz/
Источник https://biomolecula.ru/articles/ratsion-opukholevykh-kletok-ili-rol-pitaniia-v-terapii-raka
Источник https://unclinic.ru/jesherihioz-koli-infekcija-vidy-simptomy-puti-peredachi-metody-lechenija/











