Лечение психических расстройств: с древности до наших дней

Психические расстройства – это обширная группа заболеваний, сопровождающаяся личностными и поведенческими изменениями. Проявления их достаточно разнообразны. Прежде всего, они захватывают психическую деятельность человека, но учитывая, что причины подобных патологий носят не только социальный, но и физиологический характер, лечение психических расстройств требует комплексного подхода.
Окунемся в историю
Способы нейтрализации душевных болезней известны еще с давних времен. В древнем мире психически больных людей принимали за что-то сверхъестественное, демоническое и колдовское. Чтобы изгнать из больного злого духа, в его черепе делали дыру. Из нее, собственно, демон и выходил наружу — вот такая, своего рода, трепанация.
Древние египтяне были более снисходительны к психически больным людям. Они полагали, что облегчить страдания им помогут увеселительные мероприятия.
Качественно новый подход в лечении психических болезней предложил Гиппократ. Он предположил, что они возникают из-за дисбаланса в организме основных жидкостей: крови, лимфы и желчи. Исходя из этого, по отношению к душевнобольным применяли такие методы лечения как кровопускание, флеботомия, очищение организма через правильное питание. Гиппократ также считал, что большую роль на психическое состояние человека оказывает его среда.
Долгое время психически больных людей считали изгоями. Их прятали от общества или выгоняли на улицу. Особо буйных и опасных отправляли в тюрьмы или подземелья.
В дальнейшем для них создали сумасшедшие дома и приюты. Однако и там отношение к ним не отличалось гуманностью: больные люди терпели насилие со стороны персонала, их приковывали кандалами, им запрещалось свободно передвигаться. Посещали их исключительно для того, чтобы покормить, а испражнялись они прямо на месте.
Из методов лечения таких пациентов в то время применяли специальные клетки для душевнобольных, обливания кипятком или ледяной водой для произведения шокирующего эффекта. Кроме этого, использовали прижигание для изгнания дьявола, из более «щадящих» методов – смирительную рубашку.
Истеричных женщин, возбудимых и агрессивных подвергали клиторидэктомии – удалению клитор, так как считалось, что сексуальное возбуждение способно спровоцировать душевную болезнь.
Состоятельных душевнобольных пациентов лечили кровопусканием и пиявками.
Переломным моментом в терапии психических расстройств стало открытие в 1918 году маляротерапии. Метод заключался во внутримышечном введении крови, зараженной 3-дневной малярией. Таким образом удавалось купировать симптомы паралитической деменции.
Вслед за ней была открыта инсулинокоматозная терапия, применяемая по сей день. Больному колют высокие дозы инсулина, вводя его в сопор или кому. Этот метод изначально апробировали на зависимых людях. Он помогал снимать абстинентный синдром.
В настоящее время показаниями к нему служат тяжелые психотические состояния с бредом и галлюцинациями, изменением поведения и мышления. Прежде всего, это касается шизофрении. Метод используется очень редко ввиду тяжелой переносимости пациентами и сложностью проведения.
К другим способам купирования душевных болезней, чей дебют приходится на 30-е годы 20 века, стала судорожная терапия и наркотический сон.
В 1952 году был синтезирован ларгактил, соответствующий по своим свойствам аминазину.
Открытие новых методов терапии, а также психотропных средств, позволило снять клеймо с людей, страдающих психическими расстройствами, и выработать абсолютно иной подход к их лечению.
Однако, несмотря на новые открытия, варварства над больными не удалось избежать полностью. В 40-е годы популярность приобрела лоботомия – удаление части лобных долей, поскольку именно их поражение, по мнению автора метода, вызывает помешательство. Дошло до того, что один американский врач разъезжал на своем автомобиле и производил в нем подобные операции, без соблюдения стерильности и не имея опыта хирургических вмешательств. Сквозь глазное яблоко он вводил нож для раскола льда и проворачивал его, рассекая лобные доли. Естественно, что после такой манипуляции люди превращались в непонятное существо.
От этого метода быстро отказались. Однако его автор все-таки успел получить за свое детище Нобелевскую премию.
Змеиные ямы – еще один метод из прошлого. Еще в середине ХХ века его активно применяли для искоренения злых духов, вызвавших помешательство у человека. Его держали над ямой, кишевшей ядовитыми змеями, в надежде, что демоны испугаются и убегут.
Гидротерапия может стать приятным способом снятия нервного напряжения, возбуждения, тревожности и скованности. Но только не в том случае, когда больного усаживают в холодную ванну на целые сутки либо в голом виде приковывают к стене и обливают его мощным напором воды, как это делали в начале двадцатого столетия.
Индивиды с психическими расстройствами очень долгое время подвергались изгнанию из общества, издевательствам как физическим, так и моральным. Но за какие-то полвека медицина настолько шагнула вперед, что в настоящее время подобные состояния удается успешно корректировать. Люди, страдающие ими, способны жить полноценной жизнью.
Современный подход
В наше время лечение психических расстройств соблюдает правила комплексной терапии, ориентации на синдромальные проявления, учета длительности и прогрессирования процесса. Каждый случай предполагает индивидуальный подход с учетом особенностей пациента и его среды, последовательность применения методов.
Несмотря на то, что способы купирования таких расстройств шагнули далеко вперед, тем не менее существуют еще некоторые проблемы в их осуществлении. В первую очередь, это связано с тем, что до сих пор не удается установить причины возникновения многих психических недугов. Во вторую, в наши дни психогенные болезни неустанно прогрессируют, приобретая новые формы.
Поскольку мозг и психика человека – наименее изученные сферы, они преподносят множество «сюрпризов». И никогда нельзя быть уверенным, что болезнь отступает навсегда.
Условно принципы лечения психических расстройств можно разделить на биологическую терапию и психотерапию.
Биологическая терапия объединяет методы, которые воздействуют на биологические причины расстройства. Наиболее известные из них:
- фармакотерапия;
- эфферентная терапия;
- электросудорожная;
- инсулиношоковая;
- наркопсихотерапия.
Фармакотерапия
Данный метод является основой купирования психических расстройств. Его функциями выступает:
- устранение острого периода заболевания в условиях стационара до наступления ремиссии;
- стабильный прием препаратов в качестве профилактики рецидивов в стационаре либо амбулаторно;
- поддерживающая терапия для достижения стойкой ремиссии.
Прием медикаментозных средств позволяет устранить патологические симптомы и остановить прогрессирование процесса.
Среди психотропных препаратов выделяют несколько классов, воздействующих на определенную группу симптомов:
- антидепрессанты;
- транквилизаторы;
- нейролептики;
- нормотимики;
- ноотропы;
- психостимуляторы.
Антидепрессанты воздействуют на депрессивные признаки, среди подобных препаратов выделяют как стимуляторы, так и седативные средства. С одной стороны, они стимулируют человека к деятельности, устраняют апатию, безволие, мрачные мысли и упадническое настроение, а с другой — снимают тревожность, успокаивают. Представители:
- амитриптилин;
- прозак;
- азафен.
Существует несколько поколений антидепрессантов, каждое последующее из которых отличается более эффективным и менее травмирующим действием.
Транквилизаторы выполняют 5 основных действий: снимают тревогу, успокаивают, нормализуют сон, способствуют мышечному расслаблению и проявляют противосудорожный эффект. Но не все средства этой группы обладают всеми перечисленными свойствами. Каждый класс транквилизаторов «специализируется» в большей мере на нескольких из них. Кроме этого, существуют и те, что проявляют активизирующее воздействие. Показаниями к применению служат неврозы и различного рода тревожные расстройства. Представители:
Нейролептики назначают при появлении в клинической картине заболевания психоположительных симптомов: бред, галлюцинации, мания, искажения поведения и мышления, агрессия. Показаны при психозах. Представители:
- Рисперидон;
- Амисульприд;
- Галоперидол.
- препараты лития;
- Депакин;
- Ламотриджин.
Ноотропы улучшают метаболизм тканей головного мозга и восстанавливают когнитивные функции. Поэтому их широко применяют при психических расстройствах, сопровождаемых изменением мозгового кровообращения, атеросклерозом мозговых сосудов: деменция, неврозы, алкоголизм, вегетососудистая дистония и т.д. Представители:
- Пирацетам;
- Фенибут;
- Ноотропил.
Психостимуляторы активизируют психическую деятельность, повышают двигательную активность. Снимают заторможенность и усталость. Показания: апатия, астения. Представители:
Психотропные средства назначаются исключительно врачом и требуют тщательной корректировки дозы. Некоторые их особенности воздействия становятся большой проблемой на пути к исцелению.
Многие подобные средства обладают перечнем побочных эффектов, с трудом переносимыми больными. Ученые стараются совершенствовать их формулы, разрабатывая новые поколения препаратов, более совершенные и мягкие по своему действию.
Другая проблема – выработка зависимости или, наоборот, устойчивости к их воздействию. Кроме этого, они требуют длительного приема, и порой бывает сложно подобрать подходящее средство и дозировку.
Все эти нюансы приводят к тому, что нередко пациенты отказываются проводить лечение, бросая его на полпути. Это становится огромным шагом назад и перечеркивает достигнутые положительные результаты.
Эфферентная терапия
Данный метод биологической терапии подразумевает очищение крови и улучшение ее показателей. К ее способам относят:
- Плазмаферез – забор у пациента крови, разделение ее на плазму и кровяные клетки. Впоследствии клетки возвращаются пациенту, а плазма заменяется внутривенным введением растворов.
- Криоплазмаферез – плазма подвергается дезинтоксикационной обработке и возвращается пациенту.
- Гемосорбция, плазмосорбция – плазму или кровь пропускают через сорбенты;
- Гемофильтрация – очищение крови в специальном фильтре.
- Термофильтрация – усиление свойств гемофильтрации путем нагрева.
- Гемодиализ или аппарат искусственной почки применяется для выведения токсинов из крови, если почки пациента не работают самостоятельно.
- Ультрафиолетовое облучение крови.
- Лазерное облучение крови.
Перечисленные выше способы оказывают на организм детоксикационный, реовосстанавливающий и иммуностимулирующий эффект. В результате этого в ходе терапии психических расстройств удается достичь антидепрессивного, антипсихотического и психостимулирующего эффектов.
Эта процедура показана при особо токсическом течении заболевания. Например, это относится к фебрильной шизофрении – формы расстройства, сопровождающейся, помимо основных симптомов, изменением сознания по типу онейроида, вегетативными нарушениями. Главный ее признак – это лихорадка. Причем она не подпадает под типичную температурную кривую, характерную для соматических болезней. Возможно появление кровоподтеков, развитие кахексии, то есть истощения. Бред и галлюцинации в этот период достигают своего пика и носят злокачественный характер. Наблюдается каталепсия – так называемая восковая гибкость, когда больной принимает любую форму, приданную ему.
К другим состояниям, требующим эфферентного вмешательства, относят:
- отравления наркотическими и медикаментозными средствами, ядами;
- делирий различного происхождения;
- галлюцинаторные синдромы, не купирующиеся медикаментозно.
Другие методы биологической терапии
К ним причисляют шоковые способы лечения: инсулинокоматозную и электросудорожную терапию.
Шоковая инсулинотерапия – это, как уже говорилось, введение повышенных доз инсулина. Их увеличивают постепенно, доводя пациента сначала до гипогликемии, а затем и до комы. Курс включает до 30 процедур.
Из комы пациента выводят путем введения растворов глюкозы. Метод предполагает стимуляцию адаптационных механизмов организма в шоковых условиях, благодаря чему он сможет противостоять заболеванию.
Данный метод противопоказан при инфекционных заболеваниях, печеночной и почечной недостаточности, эндокринных патологиях, а также во время беременности, при сердечных патологиях и онкозаболеваниях.
Электросудорожная терапия применяется крайне редко в случае, когда медикаментозное лечение не приносит результата. Ее используют обычно для больных с фебрильной шизофренией и в состоянии тяжелой депрессии. Предварительно пациент подвергается тщательному обследованию.
Метод заключается в воздействии на больного разрядом электрического тока с вызыванием судорог. Предполагается, что таким образом происходит стимуляция подкорковых центров головного мозга. Допускается использовать до 10 сеансов такой терапии.
К хирургическим методам лечения психических расстройств прибегают в случаях, когда все остальные методы терапии становятся неэффективны. Аргументом также служит длительность течения процесса (5 лет и более), инвалидизация больного. Главный критерий проведения хирургического вмешательства – наличие структурной мишени, то есть установленной органической причины заболевания.
Психотерапия
Психотерапевтическое лечение – неотъемлемый компонент в терапии психического расстройства. Если биологические методы направлены на восстановление физического баланса, то психотерапия работает с личностью пациента.
Ее используют после подавления острого процесса. Как правило, она применяется по отношению к тем пациентам, которые сохранили ясность сознания. У больных с нарушенным мышлением, с изменением личности, в состоянии эмоционального отупения она малоэффективна.
Чаще всего используют рациональный подход, действующий путем убеждения, аргументаций и переориентировки больного на новые убеждения. Способы внушения подключают крайне редко.
Всего существует около 700 видов различных направлений психотерапии. Среди них распространены:
- поведенческая терапия;
- рациональная;
- гештальт-терапия;
- психоанализ;
- психоэстетотерапия;
- творческие направления – арттерапия, музыкотерапия и т.д.;
- аутотренинги и многие другие.
Психотерапия проводится в индивидуальной и групповой формах. Выделяют семейную терапию.
Многообразие методов лечения психических патологий дает возможность найти индивидуальный подход к каждой из них. Но, как правило, наиболее действенными оказываются смешанные способы излечения. Необходимо помнить, что искоренение психогенных заболеваний – длительный и трудоемкий процесс, требующий времени и терпения.
Генная терапия против рака
Статья на конкурс «био/мол/текст»: Благодаря стремительному развитию медицины создаются инновационные техники, лекарства, оборудование, направленные на лечение сложных заболеваний, таких как рак. В последнее время большое внимание уделяется генной терапии как перспективному методу лечения онкозаболеваний, который в будущем станет особо важным инструментом для предотвращения и снижения смертности от рака. В данной статье кратко рассматриваются пути развития болезни, а также применение инновационных техник генной терапии в онкологии.

Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».

Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Смертельные клешни
Человечество столкнулось с этой загадочной болезнью еще до нашей эры. Ее пытались понять и лечить ученые мужи в самых различных уголках мира: в Древнем Египте — Еберс, в Индии — Сушрута, Греции — Гиппократ. Все они и многие другие медики вели борьбу с опасным и серьезным противником — раком. И хоть эта битва продолжается до сих пор, сложно определить, есть ли шансы на полную и окончательную победу. Ведь чем больше мы изучаем болезнь, тем чаще возникают вопросы — можно ли полностью излечить рак? Как избежать болезни? Можно ли сделать лечение быстрым, доступным и недорогим?
Благодаря Гиппократу и его наблюдательности (именно он увидел сходство опухоли и щупалец рака) в древних врачебных трактатах появился термин «карцинома» (грец. carcinos), или «рак» (лат. cancer). В медицинской практике по-разному классифицируют злокачественные новообразования: карциномы (из эпителиальных тканей), саркомы (из соединительной, мышечной тканей), лейкемия (в крови и костном мозге), лимфомы (в лимфатической системе) и другие (развиваются в других типах клеток, например, глиома — рак головного мозга). Но в быту более популярен термин «рак», который подразумевает любую злокачественную опухоль.
Мутации: погибнуть или жить вечно?
Многочисленные генетические исследования выявили, что возникновение раковых клеток — это результат генетических изменений. Ошибки в репликации (копировании) и репарации (исправлении ошибок) ДНК приводят к изменению генов, в том числе и контролирующих деление клетки. Основными факторами, которые способствуют повреждению генома, а в дальнейшем — приобретению мутаций, — являются эндогенные (атака свободных радикалов, образующихся в процессе обмена веществ, химическая нестабильность некоторых оснований ДНК) и экзогенные (ионизирующее и УФ-излучение, химические канцерогены). Когда мутации закрепляются в геноме, они способствуют трансформации нормальных клеток в раковые. Такие мутации в основном случаются в протоонкогенах, которые в норме стимулируют деление клетки. В результате может получиться постоянно «включенный» ген, и митоз (деление) не прекращается, что, фактически, означает злокачественное перерождение. Если же инактивирующие мутации происходят в генах, которые в норме ингибируют пролиферацию (гены-супрессоры опухолей), контроль над делением утрачивается, и клетка становится «бессмертной» (рис. 1).
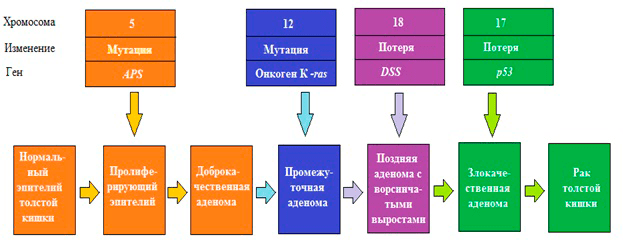
Очевидно, что развитие определенных видов рака включают в себя изменение большинства или даже всех этих генов и может проходить различными путями. Из этого следует, что каждую опухоль следует рассматривать как биологически уникальный объект. На сегодняшний день существуют специальные генетические информационные базы по раку, содержащих данные о 1,2 млн. мутаций из 8207 образцов тканей, относящихся к 20 видам опухолей: атлас Ракового Генома (Cancer Genome Atlas) и каталог соматических мутаций при раке (Catalogue of Somatic Mutations in Cancer, COSMIC) [2].
Результатом сбоя работы генов становится неконтролируемое деление клеток, а на последующих стадиях — метастазирование в различные органы и части тела по кровеносным и лимфатическим сосудам. Это достаточно сложный и активный процесс, который состоит из нескольких этапов. Отдельные раковые клетки отделяются от первичного очага и разносятся с кровью по организму. Затем с помощью специальных рецепторов они прикрепляются к эндотелиальным клеткам и экспрессируют протеиназы, которые расщепляют белки матрикса и образуют поры в базальной мембране. Разрушив внеклеточный матрикс, раковые клетки мигрируют вглубь здоровой ткани. За счет аутокринной стимуляции они делятся, образуя узел (1–2 мм в диаметре). При недостатке питания часть клеток в узле погибает, и такие «дремлющие» микрометастазы могут достаточно долго оставаться в тканях органа в латентном состоянии. В благоприятных условиях узел разрастается, в клетках активируются ген фактора роста эндотелия сосудов (VEGF) и фактора роста фибробластов (FGFb), а также инициируются ангиогенез (формирование кровеносных сосудов) (рис. 2).
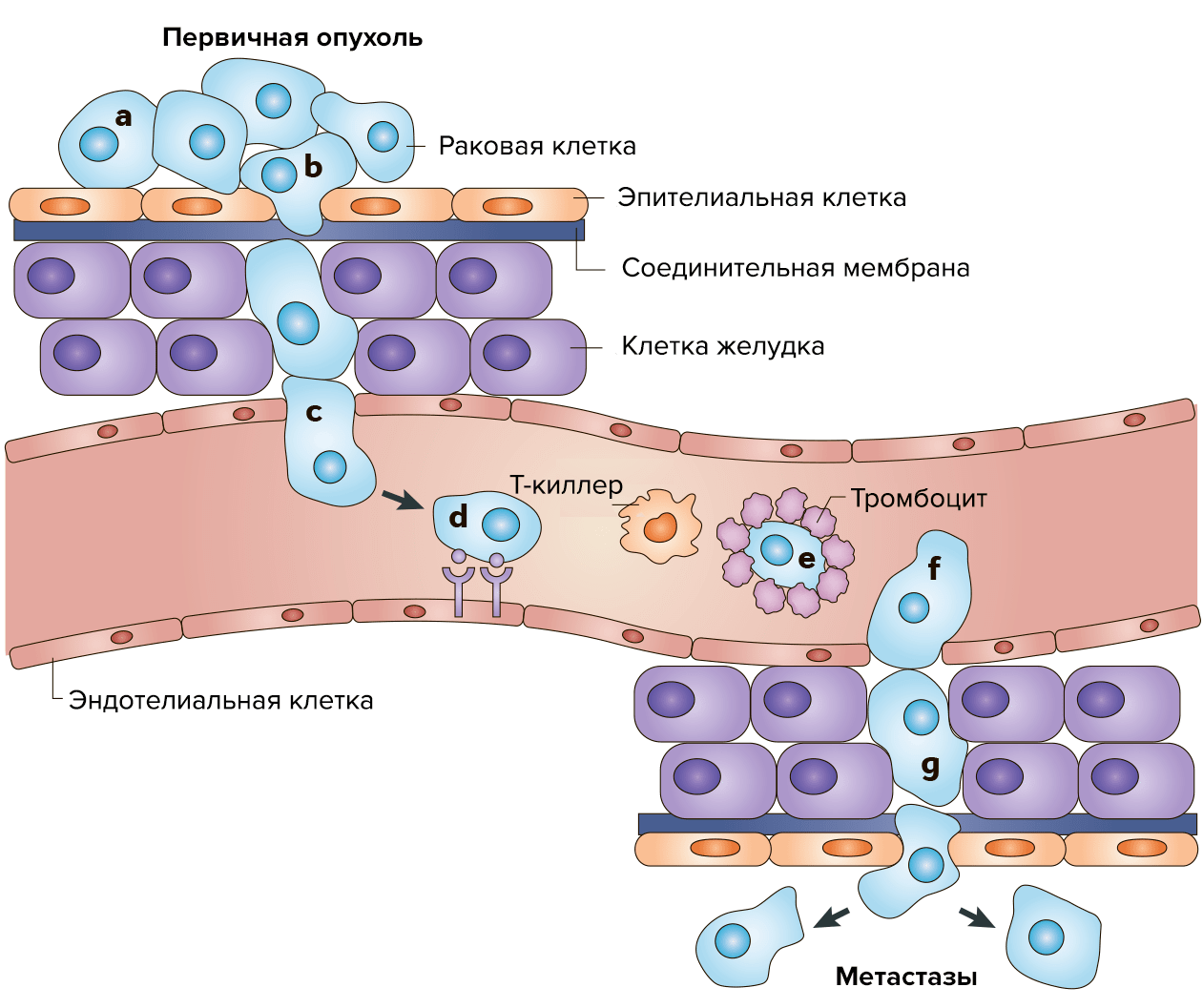
Однако клетки вооружены специальными механизмами, защищающими от развития опухолей:
- импринтинг — механизм эпигенетических модификаций, который контролирует нормальный рост и правильное развитие организма. Любые нарушения в метилировании определенных генов могут поспособствовать возникновению рака. Например, в исследованиях было обнаружено, что потеря импринтинга после инактивации материнского аллеля гена IgF2 увеличивает риск развития рака прямой кишки в 3–5 раз [3];
- репарация ДНК (например, однонуклеотидная эксцизионная репарация защищает ДНК от мутаций, вызванных канцерогенными агентами) [4];
- контрольные точки клеточного цикла — используют специфичные белки-мессенжеры, такие как ATM, ATR и комплекс RAD17-RFC для поиска повреждений в молекулах ДНК. Сигнальные белки активируют р53 и инактивируют циклин-зависимые киназы, что, в свою очередь, ингибирует клеточный цикл от G1 до S (G1/S точка рестрикции), репликацию ДНК в S-фазе и G2-фазу (G2/M-точка рестрикции) [5];
- программируемая клеточная смерть — апоптоз и связанные регуляторные гены имеют огромное влияние на возникновение злокачественного фенотипа. Некоторые онкогенные мутации нарушают апоптоз, что приводит к инициации канцерогенеза и метастазирования [6];
- иммунная система — активация естественных киллеров (NK — natural killer cells), макрофагов, нейтрофилов, эозинофилов и специфических Т-цитотоксических клеток; синтез цитокинов и специфических антител [7].
Традиционные методы и их недостатки
Если системы защиты организма не справились, и опухоль все-таки начала развиваться, спасти может только вмешательство медиков. На протяжении длительного периода врачами используются три основные «классические» терапии:
- хирургическая (полное удаление опухоли). Используется, когда опухоль имеет небольшие размеры и хорошо локализована. Также удаляют часть тканей, которые контактируют со злокачественным новообразованием. Метод не применяется при наличии метастазов;
- лучевая — облучение опухоли радиоактивными частицами для остановки и предотвращения деления раковых клеток. Здоровые клетки тоже чувствительны к этому излучению и часто погибают;
- химиотерапия — используются лекарства, тормозящие рост быстро делящихся клеток. Лекарства оказывают негативное воздействие и на нормальные клетки.
Вышеописанные подходы не всегда могут избавить больного от рака. Часто при хирургическом лечении остаются единичные раковые клетки, и опухоль может дать рецидив, а при химиотерапии и лучевой терапии возникают побочные эффекты (снижение иммунитета, анемия, выпадение волос и др.), которые приводят к серьезным последствиям, а часто и к смерти пациента. Тем не менее, с каждым годом улучшаются традиционные и появляются новые методы лечения, которые могут победить рак, такие как биологическая терапия, гормональная терапия, использование стволовых клеток, трансплантация костного мозга, а также различные поддерживающие терапии. Наиболее перспективной считается генная терапия, так как она направлена на первопричину рака — компенсацию неправильной работы определенных генов.
Генная терапия как перспектива
По данным PubMed, интерес к генной терапии (ГТ) раковых заболеваний стремительно растет, и на сегодняшний день ГТ объединяет ряд методик, которые оперируют с раковыми клетками и в организме (in vivo) и вне его (ex vivo) (рис. 3).
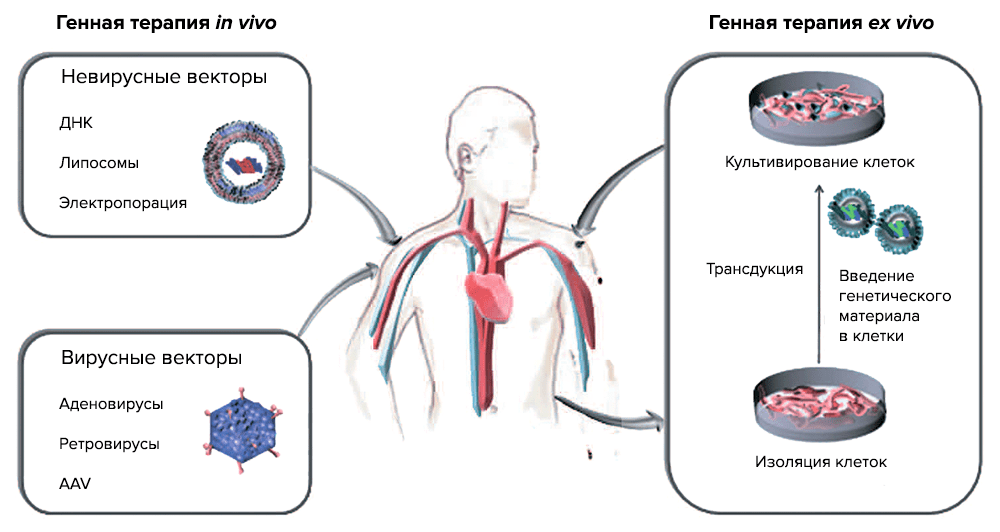
Генная терапии іn vivo подразумевает перенос генов — введение генетических конструкций в раковые клетки или в ткани, которые окружают опухоль [9]. Генная терапия ex vivo состоит из выделения раковых клеток из пациента, встраивания терапевтического «здорового» гена в раковый геном и введения трансдуцированных клеток обратно в организм пациента. Для таких целей используются специальные векторы, созданные методами генной инженерии. Как правило, это вирусы, которые выявляют и уничтожают раковые клетки, при этом оставаясь безвредными для здоровых тканей организма, или невирусные векторы.
Вирусные векторы
В качестве вирусных векторов используют ретровирусы, аденовирусы, аденоассоциированные вирусы, лентивирусы, вирусы герпеса и другие. Эти вирусы отличаются по эффективности трансдукции, по взаимодействию с клетками (распознавание и заражение) и ДНК. Главным критерием является безопасность и отсутствие риска неконтролируемого распространения вирусной ДНК: если гены вставляются в неправильном месте генома человека, они могут создать вредные мутации и инициировать развитие опухоли. Также важно учитывать уровень экспрессии перенесенных генов, чтобы предотвратить воспалительные или иммунные реакции организма при гиперсинтезе целевых белков (табл. 1).
| Вектор | Краткое описание |
|---|---|
| Вирус кори (measles virus) | содержит отрицательную последовательность РНК, которая не вызывает защитного ответа в раковых клетках |
| Вирус простого герпеса (HSV-1) | может переносить длинные последовательности трансгенов |
| Лентивирус | производный от ВИЧ, может интегрировать гены в неделящиеся клетки |
| Ретровирус (RCR) | не способный к самостоятельной репликации, обеспечивает эффективное встраивание чужеродной ДНК в геном и постоянство генетических изменений |
| Обезьяний пенистый вирус (SFV) | новый РНК-вектор, который передает трансген в опухоль и стимулирует его экспрессию |
| Рекомбинантный аденовирус (rAdv) | обеспечивает эффективную трансфекцию, но возможна сильная иммунная реакция |
| Рекомбинантный аденоассоциированный вирус (rAAV) | способен к трансфекции многих типов клеток |
Невирусные векторы
Для переноса трансгенных ДНК также применяют невирусные векторы. Полимерные переносчики лекарственных средств — конструкции из наночастиц — используются для доставки препаратов с низкой молекулярной массой, например, олигонуклеотидов, пептидов, миРНК. Благодаря небольшим размерам, наночастицы поглощаются клетками и могут проникать в капилляры, что очень удобно для доставки «лечебных» молекул в самые труднодоступные места в организме. Данная техника часто используется для ингибирования ангиогенеза опухоли. Но существует риск накопления частиц в других органах, например, костном мозге, что может привести к непредсказуемым последствиям [11]. Самыми популярными невирусными методами доставки ДНК являются липосомы и электропорация.
Синтетические катионные липосомы в настоящее время признаны перспективным способом доставки функциональных генов. Положительный заряд на поверхности частиц обеспечивает слияние с отрицательно заряженными клеточными мембранами. Катионные липосомы нейтрализуют отрицательный заряд цепи ДНК, делают более компактной ее пространственную структуру и способствуют эффективной конденсации. Плазмидно-липосомный комплекс имеет ряд важных достоинств: могут вмещать генетические конструкции практически неограниченных размеров, отсутствует риск репликации или рекомбинации, практически не вызывает иммунного ответа в организме хозяина. Недостаток этой системы состоит в низкой продолжительности терапевтического эффекта, а при повторном введении могут появляться побочные эффекты [12].
Электропорация является популярным методом невирусной доставки ДНК, довольно простым и не вызывающим иммунного ответа. С помощью индуцированных электрических импульсов на поверхности клеток образуются поры, и плазмидные ДНК легко проникают во внутриклеточное пространство [13]. Генная терапия іn vivo с использованием электропорации доказала свою эффективность в ряде экспериментов на мышиных опухолях. При этом можно переносить любые гены, например, гены цитокинов (IL-12) и цитотоксические гены (TRAIL), что способствует развитию широкого спектра терапевтических стратегий. Кроме того, этот подход может быть эффективным для лечения и метастатических, и первичных опухолей [14].
Выбор техники
В зависимости от типа опухоли и ее прогрессии, для пациента подбирается наиболее эффективная методика лечения. На сегодняшний день разработаны новые перспективные техники генной терапии против рака, среди которых онколитическая вирусная ГТ, пролекарственная ГТ (prodrug therapy), иммунотерапия, ГТ с использованием стволовых клеток.
Онколитическая вирусная генная терапия
Для этой методики используются вирусы, которые с помощью специальных генетических манипуляций становятся онколитическими — перестают размножаться в здоровых клетках и воздействуют только на опухолевые. Хорошим примером такой терапии является ONYX-015 — модифицированный аденовирус, который не экспрессирует белок Е1В. При отсутствии этого белка вирус не может реплицироваться в клетках с нормальным геном p53 [15]. Два вектора, сконструированных на базе вируса простого герпеса (HSV-1) — G207 и NV1020 — также несут в себе мутации нескольких генов, чтобы реплицироваться только в раковых клетках [16]. Большим преимуществом техники является то, что при проведении внутривенных инъекций онколитические вирусы разносятся с кровью по всему организму и могут бороться с метастазами. Основные проблемы, которые возникают при работе с вирусами — это возможный риск возникновения иммунного ответа в организме реципиента, а также неконтролируемое встраивание генетических конструкций в геном здоровых клеток, и, как следствие, возникновение раковой опухоли.
Геноопосредованная ферментативная пролекарственная терапия
Базируется на введении в опухолевую ткань «суицидных» генов, в результате работы которых раковые клетки погибают. Данные трансгены кодируют ферменты, активирующие внутриклеточные цитостатики, ФНО-рецепторы и другие важные компоненты для активации апоптоза. Суицидная комбинация генов пролекарства в идеале должна соответствовать следующим требованиям [17]: контролируемая экспрессия гена; правильное превращение выбранного пролекарства в активное противораковое средство; полная активация пролекарства без дополнительных эндогенных ферментов.
Минус терапии состоит в том, что в опухолях присутствуют все защитные механизмы, свойственные здоровым клеткам, и они постепенно адаптируются к повреждающим факторам и пролекарству. Процессу адаптации способствует экспрессия цитокинов (аутокринная регуляция), факторов регуляции клеточного цикла (отбор самых стойких раковых клонов), MDR-гена (отвечает за восприимчивость к некоторым медикаментам).
Иммунотерапия
Благодаря генной терапии, в последнее время начала активно развиваться иммунотерапия — новый подход для лечения рака с помощью противоопухолевых вакцин. Основная стратегия метода — активная иммунизация организма против раковых антигенов (ТАА) с помощью технологии переноса генов [18].
Главным отличием рекомбинантных вакцин от других препаратов является то, что они помогают иммунной системе пациента распознавать раковые клетки и уничтожать их. На первом этапе раковые клетки получают из организма реципиента (аутологичные клетки) или из специальных клеточных линий (аллогенные клетки), а затем выращивают их в пробирке. Для того чтобы эти клетки могли узнаваться иммунной системой, вводят один или несколько генов, которые производят иммуностимулирующие молекулы (цитокины) или белки с повышенным количеством антигенов. После этих модификаций клетки продолжают культивировать, затем проводят лизис и получают готовую вакцину.
Широкое разнообразие вирусных и невирусных векторов для трансгенов позволяет экспериментировать над различными типами иммунных клеток (например, цитотоксическими Т-клетками и дендритными клетками) для ингибирования иммунного ответа и регрессии раковых клеток. В 1990-х годах было высказано предположение, что опухолевые инфильтрирующие лимфоциты (TIL) являются источником цитотоксических Т-лимфоцитов (CTL) и естественных киллеров (NK) для раковых клеток [19]. Так как TIL можно легко манипулировать ex vivo, они стали первыми генетически модифицированными иммунными клетками, которые были применены для противораковой иммунотерапии [20]. В Т-клетках, изъятых из крови онкобольного, изменяют гены, которые отвечают за экспрессию рецепторов для раковых антигенов. Также можно добавлять гены для большей выживаемости и эффективного проникновения модифицированных Т-клеток в опухоль. С помощью таких манипуляций создаются высокоактивные «убийцы» раковых клеток [21].
Когда было доказано, что большинство видов рака имеют специфические антигены и способны индуцировать свои защитные механизмы [22], была выдвинута гипотеза, что блокировка иммунной системы раковых клеток облегчит отторжение опухоли. Поэтому для производства большинства противоопухолевых вакцин в качестве источника антигенов используют опухолевые клетки пациента или специальные аллогенные клетки. Основные проблемы иммунотерапии опухолей — вероятность возникновения аутоиммунных реакций в организме больного, отсутствие противоопухолевого ответа, иммуностимуляция роста опухоли и другие.
Стволовые клетки
Мощным инструментом генной терапии является использование стволовых клеток в качестве векторов для передачи терапевтических агентов — иммуностимулирующих цитокинов, «суицидных» генов, наночастиц и антиангиогенных белков [23]. Стволовые клетки (СК), кроме способности к самообновлению и дифференцировке, имеют огромное преимущество по сравнению с другими транспортными системами (нанополимерами, вирусами): активация пролекарства происходит непосредственно в опухолевых тканях, что позволяет избежать системной токсичности (экспрессия трансгенов способствует разрушению только раковых клеток). Дополнительным позитивным качеством является «привилегированное» состояние аутологичных СК — использованные собственных клеток гарантирует 100%-совместимость и повышает уровень безопасности процедуры [24]. Но все же эффективность терапии зависит от правильной ex vivo передачи модифицированного гена в СК и последующего переноса трансдуцированных клеток в организм пациента. Кроме того, прежде чем применять терапию в широких масштабах, нужно детально изучить все возможные пути трансформации СК в раковые клетки и разработать меры безопасности для предупреждения канцерогенного преобразования СК.
Заключение
Если подвести итоги, можно с уверенностью говорить, что наступает эпоха персонализированной медицины, когда для лечения каждого онкобольного будет подбираться определенная эффективная терапия. Уже разрабатываются индивидуальные программы лечения, которые обеспечивают своевременный и правильный уход и приводят к значительному улучшению состояния пациентов. Эволюционные подходы для персонализированной онкологии, такие как геномный анализ, производство таргетных препаратов, генная терапия рака и молекулярная диагностика с использованием биомаркеров уже приносят свои плоды [17].
Особенно перспективным методом лечения онкозаболеваний является генная терапия. На данный момент активно проводятся клинические испытания, которые часто подтверждают эффективность ГТ в тех случаях, когда стандартное противораковое лечение — хирургия, лучевая терапия и химиотерапия — не помогает. Развитие инновационных методик ГТ (иммунотерапии, онколитической виротерапии, «суицидной» терапии и др.) сможет решить проблему высокой смертности от рака, и, возможно, в будущем диагноз «рак» не будет звучать приговором.
Видео. Рак: узнать, предупредить и устранить болезнь
Литература
- Клаг У.С. и Каммингм М.Р. Мир биологии и медицины. Основы генетики. М.: «Техносфера», 2007. — 726 с.;
- Биоинформатика: большие БД против «большого Р»;
- H. Cui. (2003). Loss of IGF2 Imprinting: A Potential Marker of Colorectal Cancer Risk. Science. 299, 1753-1755;
- Errol C. Friedberg. (2001). How nucleotide excision repair protects against cancer. Nat Rev Cancer. 1, 22-33;
- Aziz Sancar, Laura A. Lindsey-Boltz, Keziban Ünsal-Kaçmaz, Stuart Linn. (2004). Molecular Mechanisms of Mammalian DNA Repair and the DNA Damage Checkpoints. Annu. Rev. Biochem.. 73, 39-85;
- Scott W. Lowe, Athena W. Lin. (2000). Apoptosis in cancer. Carcinogenesis. 21, 485-495;
- Marek Jakóbisiak, Witold Lasek, Jakub Gołąb. (2003). Natural mechanisms protecting against cancer. Immunology Letters. 90, 103-122;
- Marta Compte, Natalia Nuñez-Prado, Laura Sanz, Luís Álvarez-Vallina. (2013). Immunotherapeutic organoids. Biomatter. 3, e23897;
- Dachs G.U., Dougherty G.J., Stratford I.J., Chaplin D.J. (1997). Targeting gene therapy to cancer: a review. Oncol. Res.9, 313–325;
- Ching-Chiu Liu. (2006). Cancer gene therapy targeting angiogenesis: An updated Review. WJG. 12, 6941;
- R. M. Schiffelers. (2004). Cancer siRNA therapy by tumor selective delivery with ligand-targeted sterically stabilized nanoparticle. Nucleic Acids Research. 32, e149-e149;
- Kwang Y.L. (1997). Gene therapy — perspectives and promises. Seminar papers. HKMJ3, 163–172;
- T Muramatsu, A Nakamura, H M Park. (1998). In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review).. Int J Mol Med;
- Takahiko Tamura, Tsuneaki Sakata. (2003). Application of In Vivo Electroporation to Cancer Gene Therapy. CGT. 3, 59-64;
- J. R. Bischoff, D. H. Kirn, A. Williams, C. Heise, S. Horn, et. al.. (1996). An Adenovirus Mutant That Replicates Selectively in p53- Deficient Human Tumor Cells. Science. 274, 373-376;
- Paul J. Cozzi, Sandeep Malhotra, Priscilla McAuliffe, David A. Kooby, Howard J. Federoff, et. al.. (2001). Intravesical oncolytic viral therapy using attenuated, replication‐competent, herpes simplex viruses G207 and Nv1020 is effective in the treatment of bladder cancer in an orthotopic syngeneic model. FASEB j.. 15, 1306-1308;
- Luca Biasco, Cristina Baricordi, Alessandro Aiuti. (2012). Retroviral Integrations in Gene Therapy Trials. Molecular Therapy. 20, 709-716;
- M. Lindauer, T. Stanislawski, Annett Häußler, Edith Antunes, Anne Cellary, et. al.. (1997). The molecular basis of cancer immunotherapy by cytotoxic T lymphocytes. Journal of Molecular Medicine. 76, 32-47;
- K. D. Griffith, E. J. Read, J. A. Carrasquillo, C. S. Carter, J. C. Yang, et. al.. (1989). In Vivo Distribution of Adoptively Transferred Indium- 111- Labeled Tumor Infiltrating Lymphocytes and Peripheral Blood Lymphocytes in Patients With Metastatic Melanoma. JNCI Journal of the National Cancer Institute. 81, 1709-1717;
- Steven A. Rosenberg, Paul Aebersold, Kenneth Cornetta, Attan Kasid, Richard A. Morgan, et. al.. (1990). Gene Transfer into Humans — Immunotherapy of Patients with Advanced Melanoma, Using Tumor-Infiltrating Lymphocytes Modified by Retroviral Gene Transduction. N Engl J Med. 323, 570-578;
- Michael H. Kershaw, Jennifer A. Westwood, Phillip K. Darcy. (2013). Gene-engineered T cells for cancer therapy. Nat Rev Cancer. 13, 525-541;
- A. Van Pel, T. Boon. (1982). Protection against a nonimmunogenic mouse leukemia by an immunogenic variant obtained by mutagenesis.. Proceedings of the National Academy of Sciences. 79, 4718-4722;
- Marina Cihova, Veronika Altanerova, Cestmir Altaner. (2011). Stem Cell Based Cancer Gene Therapy. Mol. Pharmaceutics. 8, 1480-1487;
- Mavroudi M, Zarogoulidis P, Porpodis K, Kioumis I, Lampaki S, et. al.. (2014). Stem cells’ guided gene therapy of cancer: New frontier in personalized and targeted therapy. J Cancer Res Ther. 2, 22-33;
- Avi Schroeder, Daniel A. Heller, Monte M. Winslow, James E. Dahlman, George W. Pratt, et. al.. (2012). Treating metastatic cancer with nanotechnology. Nat Rev Cancer. 12, 39-50.
Современные методы лечения рака

Онкологические заболевания — беда, с которой человечество сталкивается на протяжении всей истории своего существования. рак был однозначным приговором. Постепенно, по мере развития науки и медицины, начали появляться эффективные методы лечения. В прошлом столетии , помимо хирургических вмешательств, стали активно применять лучевую терапию и химиотерапию. Открытия в области молекулярной биологии и генетики способствовали развитию гормональной, таргетной терапии, иммунотерапии. В хирургии стали появляться малоинвазивные методики.

Наш эксперт в этой сфере:

Сергеев Пётр Сергеевич
Заместитель главного врача по лечебной работе. Врач-онколог, хирург, химиотерапевт, к.м.н.
Распространенность рака в современном мире растет. Это заставляет онкологию бурно развиваться. Появляется всё больше возможностей, и пациентам, которые еще десятилетия назад считались бы безнадежными, сегодня можно помочь.
В международной клинике Медика24 доступны наиболее современные методы лечения злокачественных опухолей. Наши врачи применяют практически все доступные инновационные препараты и технологии. Из этой статьи вы узнаете об основных способах лечения рака, которые доступны в настоящее время.
Хирургическое лечение
В большинстве случаев именно хирургия дает возможность полностью избавиться от злокачественной опухоли и добиться ремиссии. Возможности хирургического лечения зависят от типа рака, но в целом, как правило, злокачественную опухоль можно удалить на I, II и зачастую на III стадии.
Помимо радикальных — направленных на полное удаление злокачественной опухоли — в онкологии существуют следующие разновидности операций:
- Циторедуктивные — направлены на удаление максимально возможного количества опухолевой ткани. Циторедукция бывает полной, когда после операции не остается видимых опухолевых очагов (но могут остаться микрометастазы), и частичной — когда удаляют первичную опухоль, но остаются метастазы. Оптимальная циторедукция — операция, во время которой удаляют большую часть опухолевой ткани.
- Паллиативные — хирургические вмешательства, после которых в организме заведомо остаются опухолевые очаги. Их выполняют, чтобы улучшить состояние пациента, если невозможна радикальная операция.
- Симптоматические — операции, целью которых является не удаление злокачественной опухоли, а борьба с симптомами, например, болью или кровотечением.
- Реконструктивные — направленные на восстановление функции, внешнего вида органа после радикального удаления рака.
Развитие современной хирургической онкологии идет в некоторых ключевых направлениях. , хирурги всё больше стремятся выполнять органосохраняющие вмешательства, в случаях, когда это возможно сделать, не повышая риск рецидива. Например, при ранних стадиях рака молочной железы реже стали прибегать к полному удалению органа — мастэктомии. В ходе научных исследований было доказано, что зачастую можно удалить лишь часть груди, в которой находится злокачественная опухоль, а затем провести курс лучевой терапии — при этом риск рецидива не повышается.
В современной онкологии все чаще применяются малоинвазивные операции. Многие злокачественные опухоли в брюшной полости можно удалить лапароскопически — через небольшие проколы вместо разреза. Активно применяется хирургия. Рак на ранних стадиях и предраковые состояния в полых органах могут быть удалены вообще без разрезов, во время эндоскопии. Малоинвазивная хирургия позволяет сократить травматизацию тканей, кровопотерю, восстановительный период. Пациенты переносят такие операции лучше, чем открытые вмешательства.
Находят применение в лечении злокачественных опухолей и инновационные хирургические методики:
- Эндоваскулярная хирургия — вмешательства через просвет сосудов. Например, выполняется внутриартериальная химиотерапия (введение химиопрепаратов в артерию, питающую злокачественную опухоль), эмболизация (введение в сосуд микроскопических частиц, которые перекрывают его просвет и нарушают приток крови к опухоли), химиоэмболизация (введение химиопрепаратов и эмболизирующего препарата).
- Стентирование помогает восстановить проходимость полых органов, заблокированных злокачественной опухолью, например, кишечника, желудка, желчевыводящих путей. Это эндоскопическая процедура, во время которой в заблокированный участок устанавливают стент — трубку с сетчатой стенкой. Сначала она находится в сложенном состоянии, а после установки расправляется и расширяет просвет органа.
- Криохирургия — уничтожение злокачественных новообразований с помощью низкой температуры.
- Лазерная и радиоволновая хирургия — использование вместо скальпеля луча лазера или радиоволн высокой частоты.
- Аблация — процедура, во время которой в опухолевый очаг вводят иглу и разрушают его, например, путем нагревания радиочастотной энергией.
- Стереотаксическая радиохирургия. Эти вмешательства часто называют «операцией без операции». Аппарат генерирует множество рентгеновских или , которые фокусируются в опухолевом очаге и разрушают его.
В международной клинике Медика24 проводятся практически все виды современных хирургических вмешательств в онкологии, в операционных, оснащенных современным оборудованием от ведущих производителей.
Закажите обратный звонок. Мы работаем круглосуточно
Сообщение отправлено!
ожидайте звонка, мы свяжемся с вами в ближайшее время
Химиотерапия
Химиопрепараты представляют собой вещества, которые токсичны для быстро размножающихся опухолевых клеток. Существуют разные группы химиопрепаратов, у которых различаются механизмы действия. Лечение обычно проводят двумя и более химиопрепаратами с разными механизмами действия. Комбинации подбирают в соответствии с протоколами лечения. Эти документы составлены на основе крупных клинических исследований. Международные протоколы лечения регулярно обновляются. Врачи в международной клинике Медика24 работают в соответствии с последними версиями.
Химиотерапию при онкологических заболеваниях применяют с разными целями:
- Неоадъювантная — проводится перед хирургическим вмешательством. Она помогает уменьшить злокачественную опухоль, сократить объем операции, перевести неоперабельный рак в операбельный.
- Адъювантная — назначается после хирургического вмешательства, помогает уничтожить раковые клетки, оставшиеся в организме пациента после операции, и снизить риск рецидива.
- При поздних стадиях рака химиотерапия становится одним из основных методов лечения.
- Также при поздних стадиях химиопрепараты используют для борьбы с симптомами.
Химиотерапию проводят циклами. Каждый цикл состоит из введения препаратов и перерыва, обычно продолжается от 1 до 4 недель. Курс состоит из нескольких циклов. Неоадъювантное и адъювантное лечение всегда состоит из определенного количества курсов. Химиотерапию при неоперабельном раке продолжают в течение неограниченного времени, до тех пор, пока она помогает и не вызывает серьезных побочных эффектов. Со временем в раковых клетках возникают новые мутации, и они становятся устойчивыми к лечению. При этом контрольные обследования показывают, что опухолевые очаги снова начали расти. В таком случае врач подбирает другие препараты, назначает терапию второй линии.
В некоторых случаях химиопрепараты назначают вместе с облучением опухоли. Такое лечение называется химиолучевой терапией.
Если препараты принимают в виде таблеток или вводят внутривенно, такая химиотерапия называется системной. Также противоопухолевые средства можно вводить непосредственно в нужную область тела. Это позволяет достичь высокой концентрации препарата в необходимом месте без риска серьезных побочных эффектов:
- Внутриартериальная химиотерапия — препарат вводят в кровеносный сосуд, который питает злокачественную опухоль.
- Внутрибрюшинная — в брюшную полость.
- Интратекальная — в спинномозговую жидкость.
- Внутрипузырная — в мочевой пузырь.
Инновационная методика, в которой сочетается хирургическое лечение и химиотерапия — гипертермическая интраперитонеальная химиотерапия (HIPEC). Ее применяют при злокачественных опухолях, которые распространились в брюшной полости и вызвали канцероматоз брюшины. Выполняют операцию, во время которой удаляют все макроскопические опухолевые очаги, затем в брюшную полость вводят нагретый до 42 градусов раствор химиопрепарата. Это помогает уничтожить мелкие опухолевые очаги.
Таргетная терапия
Таргетные препараты отличаются от классических химиопрепаратов более прицельным действием. Каждый из них блокирует определенную «мишень» — молекулу, которая необходима раковым клеткам для поддержания жизненно важных процессов, размножения, уклонения от агрессии со стороны иммунной системы. Таргетные препараты могут быть эффективны, когда не помогает химиотерапия, они вызывают меньше побочных эффектов.
Некоторые примеры таргетной терапии при различных онкологических заболеваниях:
- При раке молочной железы в каждом пятом случае на поверхности опухолевых клеток присутствует много молекул белка HER2. Активируясь, этот белок стимулирует размножение клеток. Его можно заблокировать с помощью некоторых таргетных препаратов, в частности, трастузумаба (Герцептин).
- Некоторые злокачественные опухоли экспрессируют большое количество белка EGFR — рецептора эпидермального фактора роста. Он также стимулирует размножение опухолевых клеток. Например, такая ситуация встречается при раке легкого, толстой кишки. Таким пациентам назначают блокаторы EGFR.
- Ингибиторы VEGF блокируют белок (сосудистый эндотелиальный фактор роста) который способствует росту новых кровеносных сосудов, питающих злокачественную опухоль.
- При меланоме в половине случаев встречается мутация в гене BRAF. На данный момент при III и IV стадиях заболевания используется несколько препаратов из группы ингибиторов BRAF.
Иммунотерапия
Иммунотерапия — метод лечения онкологических заболеваний, который помогает иммунной системе распознавать и уничтожать злокачественные опухоли. Существует несколько разновидностей иммунотерапии, наиболее широкое применение в онкологии нашли две: цитокины и ингибиторы контрольных точек.
Цитокинами называют вещества, которые стимулируют иммунный ответ. Для лечения рака используют и . Их назначают пациентам с раком почки и меланомой. Также используется при волосатоклеточном лейкозе, хроническом миелолейкозе, фолликулярной неходжкинской лимфоме, кожной лимфоме, саркоме Капоши.
Ингибиторы контрольных точек — наиболее инновационная разновидность иммунотерапии. Эти иммунопрепараты представляют собой моноклональные антитела, которые блокируют молекулы, подавляющие противоопухолевый иммунный ответ. По сути, это таргетные препараты со специфическими эффектами на иммунную систему. Чаще всего они направлены против контрольных точек , или . В современной онкологии наиболее активно применяются такие иммунопрепараты из этой группы, как ипилимумаб (Ервой), ниволумаб (Опдиво), пембролизумаб (Кейтруда), атезолизумаб (Тецентрик), авелумаб (Бавенсио), дурвалумаб (Имфинзи).
Иммунотерапия ингибиторами контрольных точек, при правильном определении показаний к ее применению, работает намного эффективнее химиотерапии, она помогает продлевать жизнь пациентов с запущенными злокачественными опухолями.
Гормональная терапия
Гормональная терапия — по сути, еще одна разновидность таргетной терапии. Ее применяют при опухолях, в частности, раке молочной железы, простаты, яичников.
Гормональная терапия при раке кардинально отличается от той, которую проводят при эндокринных заболеваниях. Если у человека нарушена работа одной из желез внутренней секреции, ему вводят гормональные препараты, чтобы заместить гормон, который отсутствует или вырабатывается в недостаточном количестве. Такая гормональная терапия называется заместительной. Цель при раке — заблокировать гормональные эффекты, которые способствуют росту злокачественной опухоли.
Лучевая терапия
Лучевая терапия при онкологических заболеваниях, как и химиотерапия, может применяться до, после операции или при поздних стадиях как один из основных методов лечения, чтобы замедлить прогрессирование заболевания, купировать симптомы.
Существуют две основные разновидности лучевой терапии рака: из внешнего источника и брахитерапия. В первом случае процедура напоминает рентгенографию, но доза облучения намного выше. При брахитерапии источник излучения в виде мелких частиц помещают непосредственно в опухолевую ткань, рядом с ней или в просвет полых органов.
Существую современные технологии, которые позволяют очень точно облучать злокачественную опухоль, практически не затрагивая соседние ткани:
- Трехмерная конформная лучевая терапия предполагает использование компьютерных технологий для точного определения расположения опухоли. Аппарат направляет излучение на тело пациента под разными углами, в итоге облучение максимально точно повторяет форму злокачественного новообразования.
- Лучевая терапия с модуляцией интенсивности — усовершенствованная разновидность трехмерной лучевой терапии. Лучи направляют на тело под разными углами и регулируют их интенсивность. Эта технология применяется очень часто, особенно если опухолевые очаги расположены возле важных анатомических структур, например, спинного мозга.
- Стереотаксическая лучевая терапия также предусматривает облучение под разными углами. Стереотаксическая хирургия является разновидностью этой методики.
Фотодинамическая терапия
Фотодинамическая терапия — метод, который применяется для лечения рака и некоторых других заболеваний. Он состоит из двух этапов. Сначала в организм пациента вводят особое вещество — фотосенсибилизатор. Он накапливается в опухолевых клетках. Затем на опухолевую ткань воздействуют светом определенного спектра. В результате фотосенсибилизатор активируется, становится токсичным для раковых клеток и уничтожает их.
Фотодинамическую терапию применяют при раке поджелудочной железы, желчных протоков, пищевода, легких, раке и предраковых заболеваниях кожи.
Узнать подробнее. Заказать обратный звонок
Источник https://arbat25.ru/myi-lechim/psixicheskie-rasstrojstva/lechenie-psixicheskix-rasstrojstv-s-drevnosti-do-nashix-dnej
Источник https://biomolecula.ru/articles/gennaia-terapiia-protiv-raka
Источник https://medica24.ru/zdorovyj-obraz-zhizni/sovremennye-metody-lecheniya-raka