Протоколы диспансерного наблюдения и лечения больных вич инфекцией
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
- Издательство «Медиа Сфера»
- (бесплатный номер по вопросам подписки)
пн-пт с 10 до 18
- Издательство «Медиа Сфера»
а/я 54, Москва, Россия, 127238 - info@mediasphera.ru
- вКонтакте
- Telegram
- Издательство
- «Медиа Сфера»
Результаты поиска: 0
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
ФГБУ «Федеральный научно-исследовательский центр эпидемиологии и микробиологии им. акад. Н.Ф. Гамалеи» Минздрава РФ
Дирекция по науке ООО «НТФФ «Полисан», Санкт-Петербург
Балтийский федеральный университет им. И. Канта, Калининград
ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора, Москва, Россия
Центральный НИИ эпидемиологии Роспотребнадзора, Москва
ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва

Продолжительность течения ВИЧ-инфекции и влияющие на нее факторы
Подробнее об авторах
Скачать PDF
Связаться с автором
Оглавление
Романцов М.Г., Ершов Ф.И., Коваленко А.Л., Белова О.Г., Покровская А.В., Попова А.А., Ладная Н.Н., Юрин О.Г. Продолжительность течения ВИЧ-инфекции и влияющие на нее факторы. Терапевтический архив. 2014;86(11):20‑23.
Romantsov MG, Ershov FI, Kovalenko AL, Belova OG, Pokrovskaia AV, Popova AA, Ladnaia NN, Iurin OG. The duration of an HIV infection course and its influencing factors. Terapevticheskii Arkhiv. 2014;86(11):20‑23. (In Russ.)

Читать метаданные
Резюме. Цель исследования. Изучение продолжительности естественного течения ВИЧ-инфекции и определение влияющих на нее факторов. Материалы и методы. Проведен ретроспективный анализ 938 амбулаторных карт взрослых ВИЧ-позитивных пациентов, состоящих на диспансерном учете, и данных 3403 пациентов со СПИДом, зарегистрированных в компьютерной базе, в том числе 2588 умерших. Применены анализ выживаемости Каплана-Мейера и регрессионная модель Кокса. В качестве потенциальных факторов, влияющих на естественное течение ВИЧ-инфекции, рассмотрены пол, возраст и путь инфицирования. Результаты. В России до начала массового применения антиретровирусной терапии (АРТ) медиана продолжительности жизни ВИЧ-инфицированных лиц от заражения до смерти составляла 11,8 года, от заражения до установления СПИДа — 11,6 года, после диагноза СПИДа средняя продолжительность жизни была 1,9 мес. Основным фактором, влияющим на течение ВИЧ-инфекции, являлся возраст пациента: у лиц, заразивших ВИЧ в возрасте старше 35 лет, снижение количества лимфоцитов CD4 и клиническое прогрессирование происходили быстрее, чем у инфицированных в более молодом возрасте. После 5 лет инфицирования ВИЧ не менее 50% больных нуждались в АРТ. Заключение. Без АРТ продолжительность жизни ВИЧ-инфицированного сокращается почти в 2 раза. Необходимы раннее выявление ВИЧ-инфекции и регулярное наблюдение пациентов независимо от давности инфицирования для своевременного начала лечения.
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
ФГБУ «Федеральный научно-исследовательский центр эпидемиологии и микробиологии им. акад. Н.Ф. Гамалеи» Минздрава РФ
Дирекция по науке ООО «НТФФ «Полисан», Санкт-Петербург
Балтийский федеральный университет им. И. Канта, Калининград
ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора, Москва, Россия
Центральный НИИ эпидемиологии Роспотребнадзора, Москва
ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва
За 30 лет распространения эпидемии инфекции, вызванной вирусом иммунодефицита человека — ВИЧ (ВИЧ-инфекции), все более очевидным становится ее влияние на изменение продолжительности жизни не только ВИЧ-инфицированных пациентов, но и популяции в целом в странах, затронутых эпидемией. Ожидаемая продолжительность жизни в некоторых странах Африки южнее Сахары уменьшилась на 20 лет. Демографы подсчитали, что в отсутствие ВИЧ-инфекции средняя продолжительность жизни общей популяции, например в Камбодже была бы на 4 года больше, в Доминиканской Республике — на 3 года, на Украине — на 2 года. Предполагается, что при сохранении темпов распространения ВИЧ-инфекции и отсутствии лечения потери в продолжительности жизни в Российской Федерации увеличатся с 1 года в 2000-2005 гг. до 3 лет в 2015-2020 гг. [1]. Кроме того, в России на долю лиц трудоспособного возраста приходится 98% всех ВИЧ-инфицированных граждан. Смертность и инвалидизация в результате заболевания в данной группе населения ведут не только к демографическим, но и к значительным экономическим потерям.
Несмотря на достижения в области антиретровирусной терапии (АРТ) ВИЧ-инфекции, дающей возможность увеличить ВИЧ-инфицированным продолжительность жизни, знание о естественном течении болезни (без применения АРТ) по-прежнему очень актуально. Эти знания необходимы для прогноза течения заболевания, принятия верного решения о сроках начала АРТ у конкретного пациента, планирования затрат на обследование и лечение ВИЧ-позитивных лиц, а также для дальнейшей оценки влияния лечения или иных воздействий на продолжительность жизни больных ВИЧ-инфекцией.
Предполагается, что естественное течение ВИЧ-инфекции может быть связано с путем заражения, полом и возрастом инфицирования, а также доступностью и качеством медицинской помощи. В связи с этим оно может значительно отличаться не только у пациентов, но и в разных странах. Полностью экстраполировать зарубежные данные для России невозможно в силу климатических, социально-экономических, популяционных и других различий [2, 3].
Целью данной работы были изучение продолжительности естественного течения ВИЧ-инфекции и определение влияющих на нее фактов в России для совершенствования системы наблюдения и оказания медицинской помощи больным ВИЧ-инфекцией.
Материалы и методы
Проведен ретроспективный анализ 938 амбулаторных карт взрослых пациентов (старше 16 лет), состоящих к 1 января 2011 г. на диспансерном наблюдении с диагнозом ВИЧ-инфекции в Клинико-диагностическом отделении СПИД ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора с последующей статистической обработкой результатов регулярного клинико-лабораторного обследования в соответствии со стандартами диспансерного наблюдения за пациентами с ВИЧ-инфекцией (Методические рекомендации Минздравсоцразвития РФ №7124-РХ от 09.12.2006).
Проанализированы данные 3403 пациентов с синдромом приобретенного иммунодефицита (СПИД), зарегистрированных в компьютерной базе данных по 72 субъектам РФ с 1987 г. по 1 января 2007 г., т.е. до массового начала применения АРТ в России, из них 2588 случаев смерти лиц с диагнозом СПИДа.
Статистическую обработку данных проводили в программе Statistica 6.0. Достоверность результатов при сравнении двух выборок оценивали по критерию Манна-Уитни, при сравнении нескольких групп — по критерию Крускала-Уоллиса. В работе также применяли анализ выживаемости Каплана-Мейера и регрессионную модель Кокса.
Изучали следующие периоды ВИЧ-инфекции:
— от заражения ВИЧ до наступления показаний к назначению АРТ;
— от заражения ВИЧ до установления диагноза СПИДа;
— от диагноза СПИДа до смерти;
— от заражения ВИЧ до смерти.
Проведено изучение и сравнение продолжительности течения данных периодов в группах пациентов по полу, возрасту и путям инфицирования. При сравнении выживаемости в 3 группах использованы логарифмический ранговый критерий и обобщенный Геханом критерий Вилкоксона, при сравнении нескольких групп — многовыборочный критерий.
Результаты
Для анализа продолжительности естественного течения ВИЧ-инфекции от момента заражения среди 938 пациентов отобрана группа с известным временем инфицирования. В качестве пациентов с известным временем инфицирования определены те, у кого имелись данные об отрицательном тесте на антитела к ВИЧ в течение 12 мес до первого положительного результата и/или лабораторные признаки сероконверсии методом иммунного блоттинга. Учитывали также наличие клинических проявлений и эпидемиологических факторов, свидетельствующих о вероятном заражении ВИЧ-инфекцией.
Группу пациентов с известным временем инфицирования составили 126 человек, из них 77 (61,1%) мужчин; 88,9% заразились ВИЧ в возрасте моложе 35 лет (средний возраст 26,6 года, медиана 25,5 (16-48) года). Женщины в исследуемой когорте при заражении ВИЧ были достоверно моложе мужчин (средний возраст мужчин 27,8 года, медиана 27 лет; средний возраст женщин 24,9 года, медиана 24 года; р<0,01).
Половым путем заразились ВИЧ 76,2% пациентов, он был основным и у мужчин (79,2%), и у женщин (71,4%). Внутривенное употребление психоактивных веществ явилось причиной заражения 18,3% пациентов. У 2,4% пациентов инфицирование предположительно произошло при гемотрансфузии. В 4 (3,1%) случаях путь заражения достоверно установить не удалось. Лица, заразившиеся при употреблении парентеральных наркотиков, были достоверно моложе заразившихся половым путем (р=0,03).
При первом обследовании после установления диагноза ВИЧ-инфекции средний уровень лимфоцитов CD4 составил 457,0±221,0 в 1 мкл, медиана 429 (14-1080) в 1 мкл. Количество лимфоцитов CD4 у мужчин и женщин статистически значимо не различалось (р=0,9). Количество лимфоцитов CD4 сопоставимо и в разных возрастных группах (р=0,5). Установлено, что у потребителей инъекционных наркотиков (ПИН) имелись самые высокие средние показатели иммунного статуса (количество лимфоцитов CD4 544,4±238,4 в 1 мкл) по сравнению с таковыми у пациентов, заразившихся при половых контактах (461,7±205,5 в 1 мкл при гетеросексуальных и 389,4±229,1 в 1 мкл при гомосексуальных; p=0,04).
В соответствии с рекомендациями по лечению ВИЧ-инфекции у 38 (30,2%) человек (15 женщин и 23 мужчины) имелись показания к началу АРТ при первом обследовании; 25 (19,8%) пациентов начали получать АРТ в стадии первичной ВИЧ-инфекции коротким курсом (в течение 6-12 мес).
К концу периода исследования этиотропное лечение ВИЧ-инфекции было показано уже 54 (53,5%) пациентам. Медиана периода от заражения до показаний к началу АРТ (количество лимфоцитов CD4 350 в 1 мкл и менее), рассчитанная по Каплану-Мейеру для всех пациентов, составила 53,7 мес. Таким образом, 50% пациентов нуждались в АРТ через 4,5 года после инфицирования, 25% — через 25,6 мес, 75% — через 128,2 мес.
Расчет медианы количества лимфоцитов CD4 в зависимости от пола показал, что у мужчин снижение этого показателя до 350 в 1 мкл и менее происходило быстрее, чем у женщин (38,6 и 89,2 мес соответственно; р<0,01).
Продолжительность периода до начала АРТ была неодинаковой и в группах с разными путями инфицирования (р=0,02): самая короткая — у мужчин, вступающих в половые контакты с мужчинами — МСМ (медиана 20,9 мес), самая длительная у ПИН (медиана 87, 6 мес).
Однако при учете различий по возрасту мужчин и женщин на момент заражения, а также среди пациентов, инфицированных различными путями, после поправки на возраст связь скорости снижения количества лимфоцитов CD4 с полом пациентов и путем инфицирования не подтвердилась. Анализ с помощью пропорциональной регрессионной модели Кокса показал, что достоверное значение для скорости прогрессирования заболевания до начала АРТ имел только возраст пациента на момент сероконверсии (р=0,009).
Анализ продолжительности жизни от момента заражения ВИЧ до развития СПИДа определил медиану времени в 11,6 года. Кумулятивная вероятность развития СПИДа в течение 5 лет инфицирования составила 3,7%, в течение 8 лет — 14,5%, в течение 12 лет — 57,3%.
Установлено, что у пациентов старше 35 лет заболевание прогрессировало до СПИДа быстрее, чем в более младших возрастных группах (р=0,03). Кумулятивная выживаемость без СПИДа в течение 5 лет в возрастных группах 16-25, 26-35 и 36-46 лет составила 96, 95 и 66,6% соответственно. В нашем исследовании статистически значимых различий в прогрессировании ВИЧ-инфекции до СПИДа в зависимости от пола (р=0,8) и пути заражения ВИЧ (р=0,5) не получено.
Для оценки выживаемости больных с диагнозом СПИДа из единой базы данных ВИЧ-позитивных лиц выбрана группа пациентов (n=3062), соответствующая критериям исследования (возраст старше 16 лет на момент установления ВИЧ-инфекции, граждане РФ), из них 76% мужчины. Средний возраст больных на момент установления диагноза СПИДа составил 32,9 года, медиана 31 год (16-75 лет). Средний возраст женщин (31,4 года) был достоверно меньше, чем мужчин (33,4 года; р<0,001). Более 50% пациентов, у которых известен путь инфицирования, заразились при употреблении парентеральных наркотиков (66,8%); при гетеросексуальных контактах - 23,6%, при гомосексуальных - 8,7%. У мужчин с диагнозом СПИДа доминировал парентеральный путь передачи ВИЧ (70,9%), у женщин преобладание этого пути передачи выражено в меньшей степени (53,2%). ПИН на момент установления диагноза СПИДа были достоверно моложе тех, кто заразился половым путем (р<0,001).
Общая медиана продолжительности жизни ВИЧ-инфицированных от заражения ВИЧ до смерти без применения АРТ составила 11,8 года.
Обсуждение
В России до начала массового применения АРТ продолжительность жизни ВИЧ-инфицированных пациентов (11,8 года) была сопоставима с продолжительностью жизни больных, не получавших АРТ, в экономически развитых станах Европы, США и Австралии, где этот показатель составлял 11,2 года [4]. В странах Африки и других странах с низким и средним доходом продолжительность жизни ВИЧ-инфицированных пациентов составляла от 7,5 до 11,6 года [5]. Общая длительность заболевания в нашем исследовании обусловлена несколько более длительным периодом от инфицирования ВИЧ до развития СПИДа (11,6 года) по сравнению с таковым в европейских странах. Так, по данным большинства европейских и американских работ медиана этого периода составляла 9-10 лет [6, 7]. В экономически менее развитых странах медиана сильно варьирует: от 4,4 до 9,4 года [5]. После установления диагноза СПИДа продолжительность жизни пациентов, полученная в нашем исследовании (1,9 мес), была значительно короче, чем в Европе и США, и в большей степени соответствовала таковой в странах Африки. По данным исследований, медиана жизни со СПИДом в развивающихся странах колебалась от 6 до 19 мес, а в развитых индустриальных — от 9,5 до 22 мес [8, 9].
С одной стороны, полученные результаты могут быть связаны как с действительно более медленным прогрессированием ВИЧ-инфекции до стадии СПИДа в России, что обусловлено более молодым возрастом инфицирования ВИЧ в нашей стране. С другой стороны, это расхождение может быть обусловлено не истинными различиями по длительности течения заболевания, а недостатками диагностики состояний, относящихся к СПИДу, и несовершенством системы регистрации случаев СПИДа, что искусственно удлиняет бессимптомную стадию заболевания и укорачивает жизнь пациентов со СПИДом. Кроме того, критерии установления диагноза СПИДа неодинаковы в разных странах (например, в США этот диагноз устанавливается не только по клиническим данным, но и при количестве клеток CD4
В Дании в период с 1995 по 2000 г. медиана продолжительности жизни 25-летних ВИЧ-инфицированных больных была на 31,2 года меньше, чем у их ровесников в общей популяции [10]. В исследовании продолжительности жизни ВИЧ-инфицированных в Краснодарском крае РФ показано, что «нелеченная ВИЧ-инфекция» отнимает в среднем около 30 лет жизни у пациентов, у которых заболевание диагностировано в возрасте моложе 30 лет [11]. Результаты нашего исследования совпадают с этими данными: для человека, инфицированного ВИЧ в период с 2003 по 2006 г. в возрасте 25-26 лет и не получающего АРТ, среднее число потерянных лет жизни гипотетически составляет 30-31 год. Пациенты исследуемой группы при условии отсутствия АРТ доживут в среднем только до 38 лет.
Установлено, что наибольшее влияние на течение ВИЧ-инфекции имеет возраст пациента: заболевание протекает тем быстрее, чем старше человек на момент заражения. Сходные данные о значительно более высокой выживаемости пациентов, инфицированных в возрасте 15-30 лет, по сравнению с заразившимися в старшем возрасте отмечены и в зарубежных исследованиях в разных географических регионах [3, 4]. Аналогичные результаты получены и в единичной работе, проведенной в России [11]. Возрастные особенности течения ВИЧ-инфекции должны быть учтены лечащими врачами при наблюдении пациентов и составлении индивидуальных рекомендаций. По современным протоколам терапии ВИЧ-инфекции пациентам старше 50 лет рекомендовано начинать лечение в более ранние сроки [12, 13]. С учетом увеличения возраста инфицирования ВИЧ в РФ в последние годы и постепенным «старение» пациентов это негативно отразится и на продолжительности жизни ВИЧ-инфицированных в отсутствие АРТ и на ее стоимости.
В нашей работе установлено, что уже через 4,5 года после заражения ВИЧ нуждаться в АРТ будут 50% пациентов, а через 10 лет — 75%. Позднее выявление, поздняя постановка на учет приводят к запоздалому началу терапии, что сказывается на качестве и продолжительности жизни больных.
Заключение
При естественном течении (без АРТ) жизнь ВИЧ-инфицированного человека сокращается почти в 2 раза. Для сохранения жизни пациентов необходимо раннее выявление ВИЧ-инфекции и регулярное наблюдение на всех сроках инфицирования для своевременного начала лечения.
ВИЧ-инфекция: актуальные проблемы диагностического поиска на этапах оказания специализированной медицинской помощи

ВИЧ-инфекция занимает первое место среди причин летальности от инфекционных болезней в РФ. В случаях с атипичным течением болезни, ранняя диагностика представляет определенные сложности, особенно на уровне первичного врачебного звена, так как клинические
2019-11-26 12:18
23453 прочтения
HIV infection: actual problems of diagnostics at different stages of specialized medical care M. V. Nagibina, A. I. Mazus, T. P. Bessarab, N. N. Martynova, Yu. Ya. Vengerov, N. A. Smirnov
HIV-infection is number one cause of mortality among all the infectious diseases in the Russian Federation. In cases of atypical clinical course early diagnosis is an issue, especially in primary health clinics, as clinical manifestation often carries polymorphic features. Thus, the late prescription of antiretroviral therapy, combined with opportunistic infections therapy often contributes to exacerbation of the patient’s condition, to severe complications and disability. This article discusses examples of such clinical cases.
ВИЧ-инфекция относится к социально значимым инфекционным болезням, поскольку пандемия заболевания продолжается [1–4]. ВИЧ-инфекция занимает первое место среди причин летальности от инфекционных болезней в РФ, что в том числе связано с поздней диагностикой заболевания, снижением настороженности врачей первичного звена в отношении этой многоликой инфекции и недостаточностью охвата населения обследованием на ВИЧ-инфекцию в поликлиниках и стационарах неинфекционного профиля [5–7].
Клиническая картина заболевания при типичном течении позволяет специалисту своевременно предположить диагноз ВИЧ-инфекции, подтвердить его лабораторно и начать специфическую антиретровирусную терапию (АРТ). В случаях с атипичным течением болезни ранняя диагностика представляет определенные сложности, особенно на уровне первичного врачебного звена, так как клинические проявления ВИЧ-инфекции отличаются исключительным полиморфизмом [8, 9]. Они могут быть обусловлены как самим вирусом иммунодефицита человека (ВИЧ), так и широким кругом ВИЧ-ассоциированных инфекций, злокачественных новообразований, аутоиммунных поражений и отличаются длительным, прогредиентным течением. Больные могут до полугода и более наблюдаться в различных лечебных учреждениях вне обследования на антитела к ВИЧ и не получать необходимого таргетного лечения, что приводит к прогрессированию болезни и в ряде случаев заканчивается фатально.
По данным Единой межведомственной информационно-статистической системы (ЕМИСС) на диспансерном учете состоит 65,8% выявленных пациентов с ВИЧ-инфекцией. В то же время значимую часть составляют так называемые «скрытые источники» инфекции, причем их доля за последнее десятилетие имеет тенденцию к увеличению [2, 3, 9]. Следует отметить, что у около четверти ВИЧ-инфицированных пациентов, поступающих в стационарные отделения ИКБ № 2 г. Москва в тяжелом и крайне тяжелом состояниях, имелся положительный иммуноблотинг (ИБ) в течение 8 и более лет, о результатах которого они не знали или по разным причинам скрывали. Эти пациенты, не зная о своем заболевании или скрывая его, при появлении признаков болезни обращаются за помощью в неинфекционные медицинские учреждения к специалистам различного профиля. Особенно часто это происходит при доминировании симптомов поражения только одного органа, поэтому врачи первичного звена при обращении пациентов часто ставят соответствующий органопатологии диагноз и проводят обследование и лечение в соответствии с клинической картиной и, как правило, без достижения должного положительного эффекта. Так как в настоящее время обследование на ВИЧ-инфекцию в стационарах неинфекционного профиля не является обязательным в силу ряда причин, то установление правильного диагноза становится очевидно несвоевременным и эффективное лечение, включая АРТ, стартует со значительным опозданием.
В частности, при ВИЧ-инфекции нередко изолированно поражаются почки, ЦНС и легкие, примеры таких клинических случаев, с которыми, к сожалению, в последние годы приходится встречаться довольно часто, приводятся далее.
Поражение почек при ВИЧ-инфекции наблюдается у 20–30% больных и характеризуется в ряде случаев тяжелым течением [10–12]. Патология почек может существенно влиять на прогноз заболевания и социальную жизнь пациента, приводя к развитию хронической почечной недостаточности, требующей постоянного гемодиализа. В первую очередь это касается ВИЧ-ассоциированной нефропатии — поражения почек, обусловленного экспрессией генома ВИЧ в почечную ткань с поражением эпителия почечных клубочков и канальцев [10]. Если же диагноз ВИЧ-инфекции не установлен (или пациент скрывает его), то при появлении клинической картины поражения почек больные чаще всего длительное время находятся под наблюдением терапевта и/или нефролога.
Клиническое наблюдение 1
Пациент Д., 33 лет, находился в ИКБ № 2 г. Москва с 30.05.18 г. по 26.06.18 г. (54 койко-дня) с диагнозом: «ВИЧ-инфекция, стадия 4В, фаза прогрессирования вне АРТ: ВИЧ-ассоциированная нефропатия (гистологически по типу псевдоволчаночного нефрита). Двусторонняя пневмония неуточненной этиологии. ИБ (+) от 20.05.2018 г. Осложнения: диализпотребная почечная недостаточность. Анемия тяжелой степени. Артериальная гипертензия III степени, 3-я стадии, риск ССО 4».
При плановом обследовании в августе 2017 г. впервые были выявлены изменения в анализе мочи: протеинурия до 0,9 г/л, микрогематурия до 100 эритроцитов в поле зрения, повышение уровня креатинина до 150 мкмоль/л, повышение артериального давления (АД) до 160/100 мм рт. ст. Наблюдался терапевтом в поликлинике по месту жительства, консультировался нефрологом — генез поражения почек оставался неясным. С апреля 2018 г. состояние ухудшилось: появились одышка, отеки нижних конечностей, повысился уровень креатинина до 220 мкмоль/л, снизился гемоглобин до 60 г/л, в связи с чем 03.05.18 г. пациент был госпитализирован в нефрологическое отделение многопрофильной больницы г. Москвы. При предоперационной подготовке к диагностической биопсии почки пациент обследован на антитела к ВИЧ и были получены положительные результаты — иммуноферментный анализ (ИФА) и ИБ. Произведена биопсия почки — морфологическая картина соответствует псевдоволчаночной форме ВИЧ-нефропатии. При дальнейшем обследовании: эхокардиография (ЭхоКГ) от 05.05.18 г. — в полости перикарда около 500–600 мл жидкости, признаков тампонады сердца не выявлено. Компьютерная томография (КТ) органов грудной клетки (ОГК) 08.05.18 г. — обнаружен двусторонний минимальный плевральный выпот, бронхопневмония верхней доли правого легкого, при КТ органов брюшной полости (ОБП) — минимальный выпот в малом тазу. В апреле 2018 г. в связи с выявлением ВИЧ-инфекции и развитием верифицированной ВИЧ-ассоциированной нефропатии консультирован инфекционистом МГЦ СПИД, поставлен на учет, назначена АРТ: схема — ламивудин/абакавир/элсульфавирин. Так как почечная дисфункция прогрессировала, АРТ была отменена, проводились курсы гемодиализа. Учитывая отрицательную динамику (появление инфильтрации легочной ткани) на КТ ОГК от 20.05.18 г. и субфебрилитет до 37,5 °C, для дальнейшего обследования и лечения больной был переведен в ИКБ № 2. От назначения цитостатиков для лечения нефропатии было решено воздержаться. В ИКБ № 2 при исследовании иммунного статуса от 31.05.18 г. CD4 + лимфоциты (CD4 + ) 385 мкл -1 (24%), CD8 + лимфоциты (CD8 + ) 1045 мкл -1 (64%), иммунорегуляторный индекс (CD4 + /CD8 + — ИРИ) — 0,38. Вирусная нагрузка (ВН) методом полимеразной цепной реакции (ПЦР): РНК ВИЧ 823 коп/мл; ДНК цитомегаловируса (ЦМВ) 58 коп/мл. Общий анализ крови от 30.05.18 г.: гемоглобин (Hb) 79 г/л, эритроциты (RBC) 2,63 × 10 12 /л, лейкоциты (WBC) 5,7 × 10 9 /л, тромбоциты (PLT) 171 × 10 9 /л, эозинофилы (EOS) 3%, лимфоциты (LYM) 31%, моноциты (М) 10,8%, СОЭ 21 мм/час. Общий анализ мочи от 31.05.18 г. — уд. вес 1000 г/л, белок 5,6 г/л, эпителий 0–1 в п./зр., лейкоциты 49–99 в п./зр., эритроциты 46–90 в п./зр., бактерии — 8,8 × 10 3 /л, цилиндры восков. 3–4 в п./зр., зернистые 3–4 в п./зр. В динамике Hb в пределах 58–80 г/л, RBC от 1,88 до 2,55 × 10 12 /л. Гипостенурия до 1,009 г/л, протеинурия 0,96–5,6 г/л, микролейкоцито- и эритроцитурия, бактериурия от 9,1 × 10 2 /л до 4,7 × 10 4 /л. При биохимическом исследовании крови выявлена тенденция к снижению уровня белка от 51,0 до 43,6 г/л, калия до 2,04 ммоль/л, повышение уровня креатинина от 192,3 до 700,9 мкмоль/л и фибриногена до 6,8 г/л. Посев мокроты, кала, мочи на микобактерии туберкулеза (бациллы Коха, ВК) дал отрицательный результат. При посеве крови на стерильность роста микрофлоры нет. ПЦР бронхоальвеолярного лаважа (БАЛ) от 05.06.18 г.: обнаружены ДНК ЦМВ (7,3 × 10 3 копий/мл), ДНК вируса Эпштейна–Барр (ВЭБ) (3,8 × 10 5 копий/мл), ДНК C. albicans (2,7 × 10 4 копий/мл). При рентгенологическом исследовании и КТ ОГК выявлена двусторонняя полисегментарная пневмония, лимфаденопатия средостения, небольшой выпот в плевральные полости и в полости перикарда. При ультразвуковом исследовании (УЗИ) ОБП, почек и надпочечников от 01.06.18 г. — увеличение и умеренные диффузные изменения в паренхиме печени и селезенки. Выраженные диффузные изменения в паренхиме почек. При ЭхоКГ от 01.06.18 г. выявлено умеренное расширение полости левого желудочка, умеренное утолщение стенок левого желудочка, уплотнение створок митрального клапана, снижение сократительной способности миокарда до нижней границы нормы, фракция выброса 54%. Расхождение листков перикарда. УЗИ плевральных полостей от 15.06.18 г. — расхождение листков плевы до 30 мм. Консультирован специалистами: фтизиатром, терапевтом, гематологом и кардиологом. Получал лечение: Эритропоэтин 10 тыс. МЕ через день, ванкомицин 2 г/сут + дорипенем 1,5 г/сут в течение 14 дней в/в, затем, учитывая отрицательную динамику поражения легких, произведена замена антибиотика на тигециклин 500 мг 2 раза/сут в/в, амоксициллин/клавулановая кислота 1000 мг/сут в/в, флуконазол 200 мг в/в, назначен иммуноглобулин человека нормальный в/в, эуфиллин в/в, пентоксифиллин в/в, метопролол 50 мг 2 раза/сут, амлодипин 5 мг 2 раза/сут, фамотидин 40 мг/сут. Дважды проводились сеансы гемодиализа. Начата АРТ по альтернативной схеме — этравирин 200 мг 2 раза/сут, ралтегравир 400 мг 2 раза/сут, ламивудин 150 мг через день. На фоне проводимой терапии состояние больного улучшилось: температура нормализовалась, клинически и рентгенологически отмечалась положительная динамика процесса в легких. В крови выявлено снижение уровня мочевины и креатинина, уменьшение протеинурии. На фоне АРТ (в течение 20 дней) уровень СD4 + достиг 944 мкл -1 (26%), ВН РНК ВИЧ стала неопределяемой. В биохимическом анализе крови отмечалось стойкое снижение показателей азотемии при отсутствии сеансов гемодиализа. Учитывая сохранение лабораторных признаков снижения клубочковой фильтрации, высокое содержание СD4 + , пациент был направлен в нефрологическое отделение для проведения цитостатической терапии. По данным амбулаторного наблюдения пациента в дальнейшем на фоне приема АРТ и цитостатиков отмечалась нормализация показателей крови и мочи, отсутствие клинических проявлений нефропатии.
У 10–20% больных ВИЧ-инфекцией в стадии первичных проявлений доминируют поражения ЦНС в виде острого асептического менингита, демиелинизирующей полинейропатии. У 30–45% пациентов в стадии вторичных заболеваний встречаются СПИД-энцефалопатия, менингоэнцефалиты цитомегаловирусной, герпетической, JC-вирусной, токсоплазмозной, криптококковой этиологии, а также неопластическое поражение ЦНС [13–15]. Число таких больных неуклонно увеличивается ежегодно, в последнее время все чаще можно наблюдать манифестацию ВИЧ-инфекции с клинических проявлений поражения ЦНС (головная боль, судороги, кратковременная потеря сознания, очаговые и менингеальные симптомы). Так как симптомы прогрессируют постепенно, то больные обращаются к неврологам, врачам скорой медицинской помощи (СМП), при ухудшении состояния — госпитализируются в неврологические отделения многопрофильных стационаров, где длительно обследуются для исключения чаще всего объемного образования головного мозга и другой патологии ЦНС, не получают этиологического лечения, что неблагоприятно отражается на течении и прогнозе болезни.
Клиническое наблюдение 2
Пациентка К., 31 год, находилась на лечении в ИКБ № 2 с 20.05.19 г. по 17.06.2019 г. (27 койко-дней) с клиническим диагнозом: «ВИЧ-инфекция, стадия 4В, фаза прогрессирования вне АРТ. Токсоплазмоз головного мозга. Диссеминированный туберкулез легких в фазе инфильтрации, туберкулез внутригрудных лимфатических узлов. Снижение массы тела > 10%. Тромбоцитопения. ИБ (+) от 13.08.16 г.». Поступила с жалобами на головную боль, судороги правых конечностей. Заболела остро 25.04.19 г., когда появились непроизвольные сокращения мышц правых верхней и нижней конечностей, обратилась в поликлинику по месту жительства к терапевту, предположен невроз и назначен алимемазин. На фоне терапии состояние не улучшалось. 01.05.19 г. обратилась в поликлинику к неврологу, предположена хорея, рекомендован прием аминофенилмасляной кислоты — без эффекта. С 17.05.19 г. температура тела стала повышаться до 38 °C, отметила кратковременную потерю сознания, непроизвольные сокращения правых верхней и нижней конечностей усилились и стали чаще. Повторно обратилась в поликлинику, невролог предположил эпилепсию, рекомендовал магнитно-резонансную томографию (МРТ) головного мозга. 20.05.19 г. — повторная потеря сознания, температура 38,8 °C, врач вызванной бригады СМП предположил серозный менингит и предложил госпитализацию в ИКБ № 2. При поступлении состояние средней тяжести. В сознании, контактна, поведение адекватное. Кожный покров и видимые слизистые оболочки обычной окраски, умеренной влажности, чистые. В легких жесткое дыхание, хрипов нет. ЧДД 16 в мин. Тоны сердца ритмичные, ЧСС 68 в мин, АД 100/60 мм. рт. ст. Язык обложен белым налетом. Живот мягкий, безболезненный. Печень не увеличена. Стул оформлен, мочеиспускание не нарушено. Менингеальных симптомов нет. Периодически непроизвольные хаотичные сокращения мышц правых верхней и нижней конечностей. Из анамнеза известно, что в 2010 г. употребляла психоактивные вещества (ПАВ) в/в (в настоящее время не употребляет) и более 5 лет назад внезапно умер муж от передозировки ПАВ. При обследовании в общем анализе крови — тромбоцитопения до 94 × 10 9 /л, анализ мочи, биохимическое исследование крови, коагулограмма без патологических изменений. При исследовании спинномозговой жидкости (СМЖ) изменений не выявлено, ликворное давление повышено — 220 мм. вод. ст. Методом ПЦР в СМЖ обнаружена ДНК T. gondii. Выявлена значительная иммуносупрессия: CD4 + 92 мкл (7%), CD8 + 856 мкл -1 (64%) и высокая ВН РНК ВИЧ в крови 1 304 809 копий/мл. Методом ИФА в сыворотке крови обнаружены антитела к T. gondii IgM 156,6 г/л и IgG > 500 г/л. На МРТ головного мозга от 23.05.19 г. выявлено очаговое поражение вещества мозга в области левого полушария воспалительного характера (токсоплазмоз?). При рентгенографии ОГК от 21.05.19 г. патологии легких не выявлено. Получала лечение: сульфаметоксазол + триметоприм 1920 мг 2 раза/сут в/в 21 день, патогенетическая терапия и АРТ: схема — лопинавир/ритонавир/ламивудин/тенофовир с 30.05.19 г. На фоне проводимой терапии состояние улучшилось, мышечные подергивания прекратились. С 06.06.19 г. — повышение температуры до 39 °C. На рентгенограмме ОГК появились воспалительные изменения в верхних долях легких, лечение дополнено цефоперазоном/сульбактамом 4 г/сут в/в. При КТ ОГК от 11.06.19 г. — картина двусторонней диссеминации в легких, лимфаденопатия средостения. При фибробронхоскопии 13.06.19 г. патологии не выявлено. Диаскинтест положительный от 14.06.19 г. Фтизиатром диагностирован диссеминированный туберкулез легких, лимфоузлов средостения. Для дальнейшего лечения переведена в туберкулезную больницу.
Наиболее часто при ВИЧ-инфекции поражаются органы дыхания. Поражение легких в виде пневмонии (чаще пневмоцистной, кандидозной, цитомегаловирусной этиологии), а также туберкулез наблюдаются у 60–70% больных ВИЧ-инфекцией и могут стать причиной летального исхода, особенно в случаях, когда ВИЧ-инфекция не диагностирована, АРТ не проводится, своевременно не назначается эффективная патогенетическая терапия [16]. Еще несколько десятков лет назад летальность от пневмоцистной пневмонии у больных ВИЧ-инфекцией составляла > 60% [16–18]. Современные способы диагностики и лечения позволили снизить этот показатель до 10–25%. Необходимо отметить, что в 30% случаев пневмоцистная пневмония рентгенологически не выявляется в ранние сроки болезни [19].
Клиническое наблюдение 3
Больная М., 26 лет, находилась на лечении в ИКБ № 2 с 12.07.19 г. по 09.08.19 г. (28 койко-дней). Клинический диагноз: «ВИЧ-инфекция, стадия 4В, фаза прогрессирования вне АРТ. Двусторонняя пневмония смешанной этиологии (пневмоцистная + бактериальная), тяжелое течение. Манифестная ЦМВ-инфекция с поражением легких. Орофарингеальный кандидоз. Дефицит массы тела > 10%. ДН 1-й ст. ИБ (+) от 17.05.18 г.». Поступила с жалобами на слабость, повышение температуры тела до 38,5 °C, одышку при минимальной физической нагрузке. Заболела в конце мая 2019 г. (1,5 мес назад), когда появились общая слабость, сухой кашель, периодическое повышение температуры до 37,5 °C. Обратилась в поликлинику по месту жительства к терапевту, диагностирована ОРВИ, назначено полоскание горла, таблетки от кашля. В общем анализе крови, мочи и биохимическом анализе патологических отклонений нет. На фоне проводимой терапии состояние не улучшилось, присоединилась одышка при физической нагрузке. При рентгенографии ОГК от 14.06.19 г. выявлено усиление легочного рисунка, инфильтративных очагов не обнаружено. Диагностирован острый бронхит, выдан лист нетрудоспособности и назначена антибактериальная терапия амоксициллином/клавулановой кислотой 1000 мг 2 раза/сут на 7 дней без эффекта, сохранялись ежедневная лихорадка 38–39 °C, кашель, нарастала одышка. Дважды вызывала бригаду СМП, которыми было рекомендовано наблюдение и лечение по месту жительства. Учитывая ухудшение состояния (стало трудно дышать, повысилась температура тела до 39,6 °C, появилось чувство страха смерти), 21.06.19 г. по СМП была госпитализирована в терапевтическое отделение многопрофильной больницы г. Москвы, где при рентгенологическом обследовании выявлена двусторонняя пневмония, назначено лечение цефтриаксоном 2 г/сут в/в с небольшой положительной динамикой. При контрольном рентгенологическом исследовании через 10 дней — в легких без динамики, к терапии добавлен левофлоксацин 500 мг × 2 раза/сут в/в. Несмотря на проводимую терапию состояние не улучшалось, повышение температуры тела и затрудненное дыхание сохранялись, по ночам отмечалась сильная потливость, присоединилась диарея до 2 раз/сут, нарастала слабость, не могла встать с кровати, находилась в вынужденном полусидячем положении. 07.07.19 г. на КТ ОГК — диффузные двусторонние интерстициальные изменения в легких по типу «матового стекла». Впервые взят анализ на антитела к ВИЧ, при обнаружении которых в тяжелом состоянии была переведена в ИКБ № 2. При поступлении состояние тяжелое, положение в постели вынужденное, умеренный цианоз губ, гиперемия кожи лица, ЧДД 30 в мин, ЧСС 120 в мин, АД 110/60 мм рт. ст., в легких жесткое дыхание, ослабленное в нижних отделах, хрипы не выслушиваются. Сатурация артериальной крови кислородом (SaO2) 76%. При исследовании иммунного статуса от 13.07.19 г. выявлено снижение CD4 + до 62 мкл -1 (7%), CD8 + до 472 мкл -1 (57%), ИРИ 0,2. РНК ВИЧ 696 985 копий/мл. ДНК ЦМВ в крови 3 761 копий/мл. Общий анализ крови от 12.07.19 г.: Hb 114 г/л, RBC 4,4 × 10 12 /л, WBC 2,9 × 10 9 /л, PLT 114 × 10 9 /л, EOS3%, LYM 31%, М 10,8%, СОЭ 21 мм/час. Общий анализ мочи от 31.05.18 г.: уд. вес 10 14 г/л, белок 0,6 г/л, эпителий 0–1 в п./зр., лейкоциты 2–4 в п./зр., эритроциты ед. в п./зр. В биохимическом исследовании крови без патологических отклонений. При анализе кислотно-щелочного состояния (КЩС) определяется дыхательный ацидоз. Посев крови на стерильность — роста нет. ПЦР БАЛ от 16.07.19 г.: обнаружены ДНК ЦМВ (2,3 × 10 4 копий/мл), ДНК P. jirovecii 4,1 × 10 5 копий/мл). При УЗИ ОБП — единичные увеличенные лимфатические узлы ворот печени, парапанкреальные, мезентеральные, правые подвздошные. Проведено лечение: сульфаметоксазол + триметоприм 1920 мг 4 раза/сут в/в, флуконазол 400 мг/сут в/в, ганцикловир 500 мг/сут в/в, кларитромицин 500 мг/сут per os, с 22.07.19 г. назначена АРТ (эфавиренз/ламивудин/тенофовир) с положительным эффектом. На 7-й день лечения состояние улучшилось, температура 36,8 °C, ЧСС 82/мин, ЧДД 20/мин. SaO2 96%. При рентгенологическом исследовании и КТ ОГК от 28.07.19 г. выраженная положительная динамика. Выписана в удовлетворительном состоянии, трудоспособность восстановлена.
Таким образом, следует также подчеркнуть, что при углубленном обследовании ВИЧ-инфицированных пациентов в специализированном стационаре могут выявиться и другие оппортунистические ВИЧ-ассоциированные заболевания, протекающие бессимптомно и требующие тщательного диагностического поиска и выбора оптимальной тактики лечения.
Заключение
Приведенные клинические примеры показывают важность обследования на ВИЧ-инфекцию всех стационарных больных, а в амбулаторном звене — пациентов с длительно текущей органной патологией, без определенного диагноза, а также при отсутствии эффекта от проводимой терапии с целью своевременного выявления и лечения ВИЧ-инфекции и профилактики ее грозных осложнений и сопутствующих состояний.
Литература
- Бартлетт Дж., Редфилд Р., Фам П., Мазус А. И. Клинические аспекты ВИЧ-инфекции. Российское издание 2013. М.: ГРАНАТ, 2013. 696 с.
- Беляков Н. А., Рассохин В. В., Трофимова Т. Н. и др. Коморбидные и тяжелые формы ВИЧ-инфекции в России // ВИЧ-инфекция и иммуносупрессии. 2016. 3 (8). С. 9–25.
- Ермак Т. Н., Кравченко А. В., Шахгильдян В. И. и др. Развитие оппортунистических поражений у больных ВИЧ-инфекцией при отсутствии выраженного иммунодефицита // Тер. архив. 2018. Т. 90, № 11. С. 9–12.
- Ющук Н. Д., Венгеров Ю. Я. (колл. авт.) Лекции по инфекционным болезням. Учебник в 2 т. 4-е изд., пер. и доп. М.: Гэотар-Медицина, 2016. 652 с.
- Ющук Н. Д., Нагибина М. В., Венгеров Ю. Я. и др. Интенсивная и паллиативная терапия больных ВИЧ-инфекцией // Лечащий Врач. 2008. № 9. С. 49–53.
- Мазус А. И., Бессараб Т. П., Цыганова Е. В., Серебряков Е. М. и др. Национальные клинические рекомендации по диагностике и лечению ВИЧ-инфекции у взрослых. М.: НВА, 2014. 75 с.
- Дащук А. М., Черникова Л. И. ВИЧ/СПИД-инфекция. Х.: С.А.М., 2015. 248 с.
- Мазус А. И., Бессараб Т. П. ВИЧ-инфекция. В кн.: Инфекционные болезни: национальное руководство / Под ред. Н. Д. Ющука, Ю. В. Венгерова. 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2018. С. 708–739.
- Филиппов П. Г., Тимченко О. Л., Огиенко О. Л., Михнева С. А., Попова Т. И., Сергеева Т. В., Соседова М. А. Острая ВИЧ-инфекция: проблемы ранней диагностики (клинические наблюдения) // Инф. болезни. Новости. Мнения. Обучение. 2017. № 5, с. 77–82.
- Волгина Г. В., Гаджикулиева М. М. Хроническая болезнь почек у ВИЧ-инфицированных пациентов (причины, диагностика, принципы ведения). Национальные клинические рекомендации. М., 2015. 34 с.
- Ando М., Yanagisawa N. Epidemiology, clinical characteristics, and management of chronic kidney disease in human immunodeficiency virus-infected patients // World J Nephrol. 2015. July 6. 4 (3): 388–395.
- Mocroft A., Ryom L., Reiss P. et al. A comparison of estimated glomerular filtration rates using Cockcroft-Gault and the Chronic Kidney Disease Epidemiology Collaboration estimating equations in HIV infection // HIV Med. 2014. 15: 144–152.
- Конькова-Рейдман А. Б., Рухтина О. Л., Буланьков Ю. И., Радзиховская М. В. Клинико-эпидемиологические аспекты инфекционных поражений ЦНС у ВИЧ-позитивных пациентов // Журн. инфектологии. 2014. № 4. Т. 6. С. 36–40.
- Benjamin L. A., Corbett E. L., Connor M. D. et al. HIV, antiretroviral treatment, hypertension, and stroke in Malawian adults: A case-control study // Neurology. 2016, Jan 26. 86 (4). 324–333.
- Шеломов А. С., Степанова Е. В., Леонова О. Н., Смирнова Н. Л. Оппортунистические заболевания как причины поражения ЦНС у больных ВИЧ-инфекцией // Журн. инфектологии. 2016. 3 (8). С. 107–115.
- Пузырева Л. В., Сафонов А. Д., Мордык А. В. Заболевания органов дыхания при ВИЧ-инфекции (обзор) // Журн. инфектологии. Т. 8, № 2, 2016, с. 17–25.
- Cribbs S. K. et al. Correlation of the lung microbiota with metabolic profiles in bronchoalveolar lavage fluid in HIV infection // Microbiome. 2016; 4 (1): р. 3–7.
- Samuelson D. R. et al. Oral Immunization of Mice with Live Pneumocystis murina Protects against Pneumocystis Pneumonia // J. Immunol. 2016; 196 (6), р. 2655–2665.
- An P. et al. Role of APOBEC3F Gene Variation in HIV-1 Disease Progression and Pneumocystis Pneumonia // PLoS Genet. 2016; 12 (3): р. 112–125.
М. В. Нагибина* , 1 , доктор медицинских наук
А. И. Мазус**, доктор медицинских наук
Т. П. Бессараб**, кандидат медицинских наук
Н. Н. Мартынова**, кандидат медицинских наук
Ю. Я. Венгеров*, доктор медицинских наук, профессор
Н. А. Смирнов*
* ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, Москва
** МГЦ СПИД ДЗМ, Москва
ВИЧ-инфекция: актуальные проблемы диагностического поиска на этапах оказания специализированной медицинской помощи/ М. В. Нагибина, А. И. Мазус, Т. П. Бессараб, Н. Н. Мартынова, Ю. Я. Венгеров, Н. А. Смирнов
Для цитирования: Лечащий врач № 11/2019; Номера страниц в выпуске: 20-23
Теги: иммунодефицит, ранняя диагностика, оппортунистические заболевания
Диагностика ВИЧ: методы и исследования
Ранняя диагностика заболеваний – залог успешного лечения. Ставшее крылатым выражение, особенно актуально для ВИЧ-инфекции. Ведь заболевание неизлечимо полностью, и только своевременная диагностика позволяет взять течение болезни под контроль и выбрать тактику лечения, чтобы жить полноценной жизнью.

Важность клинической диагностики ВИЧ
В понимании многих людей ВИЧ-инфицированный человек выглядит болезненно, изнеможенно. Он кашляет, чихает, чешется, стонет, у него все болит… На самом деле это не так! Проблема в том, что после инфицирования ВИЧ и в последующий инкубационный период симптомы полностью отсутствуют. Затем наступает острая фаза, на протяжении которой присутствуют симптомы, напоминающие ОРВИ или грипп. Но и они вскоре проходят, и наступает, так называемый, латентный период – продолжительный промежуток времени, когда ВИЧ-инфекция себя ничем не выдает. С момента инфицирования и до стадии пред-СПИДа может пройти порядка 10 лет, в течение которых, ни сам пациент, ни его окружение, даже и не подозревают о болезни. А когда она уже на полную мощность заявляет о себе, контролировать ее очень трудно. Сложно противостоять осложнениям ВИЧ, поддерживать практически разрушенную иммунную систему человека.
Очень важно понимать, что, хотя и есть группы риска – гомосексуалисты, наркозависимые и девушки легкого поведения – в основной массе, пациенты с ВИЧ-инфекцией – это обычные люди. Они учатся, ходят на работу, посещают общественные места, знакомятся в интернете – в общем, живут как все. К сожалению, но от ВИЧ никто не застрахован. Незащищенный половой контакт в порыве страсти, заветное тату без соблюдения стерильности, маникюр за полцены у начинающего мастера, уличная драка – все эти и множество других житейских ситуаций могут обернуться инфицированием ВИЧ.
Не ошибается лишь тот, кто не живет! Мы не можем знать все наперед, не можем исправить уже совершенных ошибок, но мы можем предпринять простые шаги для исправления их последствий – обратиться в ближайший кожно-венерологический диспансер, в местную клинику или специализированный СПИД-центр для сдачи анализов и ранней диагностики ВИЧ.
Благоприятные сроки для диагностики ВИЧ
Факт возможного инфицирования и плохое самочувствие без видимых причин – два веских основания для обращения к специалистам. Но отрицательный результат тестирования на антитела не всегда означает, что человек не инфицирован, так как существует период “серонегативного окна” (время между заражением и появлением антител), который составляет около трех месяцев. Поэтому лучше повторить их спустя 3 месяца с момента возможного инфицирования. Если же ответ опять будет отрицательным, но ваша тревога не проходит, и вы уверены в заражении ВИЧ, тогда лабораторную диагностику необходимо повторить спустя 6 месяцев после факта заражения.
Что касается плохого самочувствия, то поводом провериться на ВИЧ может быть сочетание следующих симптомов:
- увеличение лимфатических узлов на шее, в паху, в области подмышек;
- лихорадка;
- мышечные или головные боли;
- молочница и грибковые поражения, в том числе кандидоз полости рта;
- воспаление слизистой носа, рта или глотки;
- ночная потливость;
- ломота в суставах;
- длительная диарея;
- тошнота, рвота;
- резкое снижение массы тела;
- высыпания на коже.
Важно понимать, что с момента, когда проявляются первые признаки ВИЧ-инфекции и до момента, когда заболевание переходит в латентную стадию, проходит очень мало времени – около 3-6 недель с факта инфицирования. Нельзя упускать из вида этот промежуток времени! Поскольку последующие 8-10 лет вы будет жить, нормально себя чувствовать и даже не подозревать о том, что больны ВИЧ-инфекцией. Драгоценное время будет упущено.
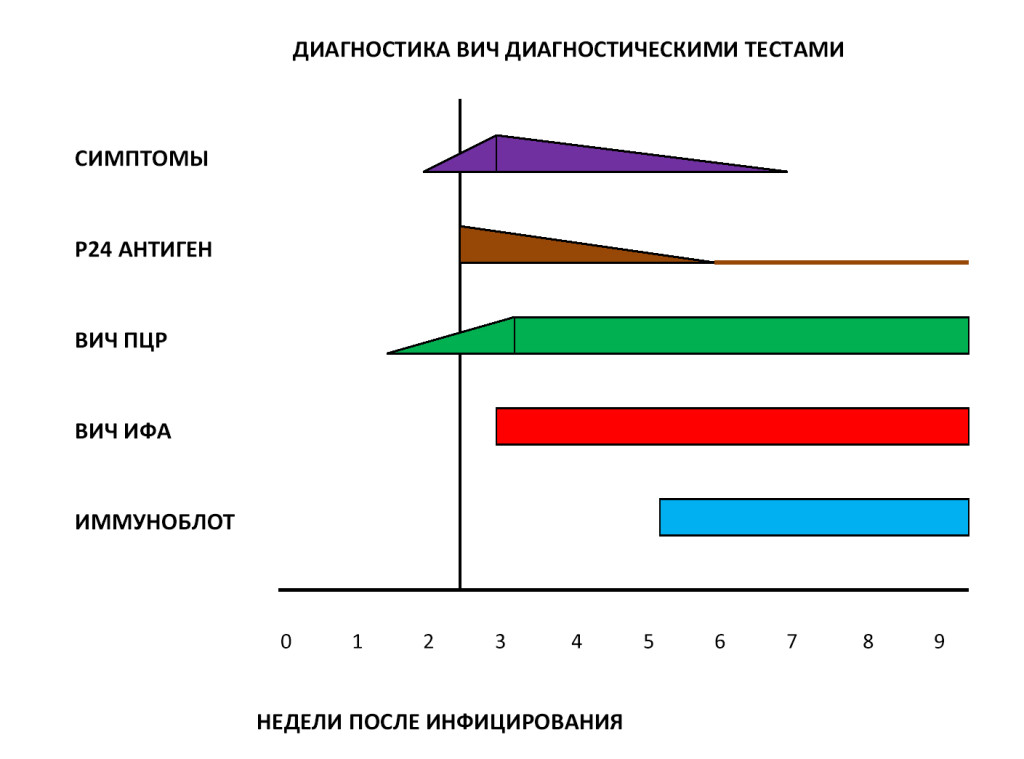
Современные методы диагностики ВИЧ
В настоящее время в диагностике ВИЧ используется двухуровневый подход – косвенные и прямые тесты. Косвенные тесты позволяют обнаружить в крови пациента специфические антитела к ВИЧ, а прямые тесты помогают выявить собственно сам ВИЧ и определить степень вирусной нагрузки на организм. В России стандартная диагностика ВИЧ включает следующие методы лабораторных исследований:
- ИФА (иммуноферментный анализ).
- Иммуноблот (иммунный блоттинг).
Также могут быть применены следующие методики:
- Экспресс-тест ИХА (иммунохроматография).
- ПЦР (полимеразная цепная реакция).
Диагностические принципы лабораторных исследований и степень их достоверности приведены в нижеследующей таблице.
Источник https://www.mediasphera.ru/issues/terapevticheskij-arkhiv/2014/11/030040-36602014114
Источник https://www.lvrach.ru/2019/11/15437428
Источник https://profilaktica.ru/for-population/profilaktika-zabolevaniy/vich-infektsiya/profilaktika-vich-infektsii/diagnostika-vich-metody-i-issledovaniya/