Системная красная волчанка
Системная красная волчанка (СКВ) – системное аутоиммунное ревматическое заболевание, неизвестной этиологии, характеризующееся гиперпродукцией органоспецифических аутоантител к различным компонентам клеточного ядра с развитием иммуновоспалительного повреждения тканей и внутренних органов[1-6].Болезнь отличается широким спектром клинических проявлений и непредсказуемым течением, поражающим любые органы и системы, которые развиваются в течение нескольких месяцев или лет со стойкими или быстро меняющимися клиническими проявлениями, волнообразным течением, периодами относительной ремиссии и обострения, лечение может повлиять на течение болезни и выраженность симптомов. В патогенез СКВ вовлечены генетические, иммунологические, гормональные факторы и условия среды [1-11].
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| M32 | Системная красная волчанка |
| M32.0 | Лекарственная системная красная волчанка |
| M32.1 | Системная красная волчанка с поражением других органов или систем |
| M32.8 | Другие формы системной красной волчанки |
| M32.9 | Системная красная волчанка неуточненная |
Дата разработки/пересмотра протокола:2016 год (пересмотр в 2021 г.)
Сокращения, используемые в протоколе:
| АТ | — | антитела |
| Анти-дсДНК | — | аутоантитела, направленные против собственной двухспиральной дезоксирибонуклеиновой кислоты. Синонимы: анти-ДНК, антитела к нативной ДНК, антитела к двуспиральной ДНК |
| Анти-РНП | — | антитела к ядерным рибонуклеопротеидам |
| Анти-Sm | — | антитела к антигену Sm (Smith) |
| Анти-Ro/SSA | — | антитела к антигену Ro/SSA, Ro по фамилии больного Robair /SS-A — Sjogren’s syndrome A antigen. Синонимы: антитела к SS-A антигену молекулярной массы 52 и 60 кДа, анти-Ro |
| АЗА | — | азатиоприн |
| АНА,АНФ | — | антинуклеарные антитела, антинуклеарный фактор |
| АНЦА | — | антинейтрофильные цитоплазматические антитела |
| aβ2-ГП I | — | антитела к β2-гликопротеиду 1 |
| АПФ | — | ангиотензин-превращающий фермент |
| АЛТ | — | аланинаминотрансфеpаза |
| АСТ | — | аспартатаминотрансфераза |
| АФС | — | антифосфолипидный синдром |
| АФЛ | — | антифосфолипидные антитела |
| АСК | — | ацетилсалициловая кислота |
| БАК | — | биохимический анализ крови |
| БРА | — | блокаторы рецепторов ангиотензина II |
| в/в, в/м | — | Внутривенное, внутримышечное введеение |
| ВОЗ | — | Всемирная организация здравоохранения |
| ВН | — | волчаночный нефрит |
| ГКС | — | глюкокортикостероиды |
| ГИБП | — | генно-инженерный биологический препарат |
| ГИБТ | — | генно-инженерная биологическая терапия |
| ГХ | — | гидроксихлорохин |
| ЖКТ | — | желудочно-кишечный тракт |
| ИК | — | ингибитор кальциневрина |
| ИФА | — | иммуноферментный анализ |
| ЛС | — | лекарственные средства |
| MHO | — | международное нормализованное отношение |
| ММФ | — | мофетила микофенолат |
| МП | — | метипреднизолон |
| НМГ | — | низкомолекулярные гепарины |
| НПВП | — | нестероидные противовоспалительные препараты |
| нРИФ | — | непрямая реакция иммунофлуоресценции |
| ОАК | — | общий анализ крови |
| ОАМ | — | общий анализ мочи |
| ПЗШ | — | предварительно заполненный шприц |
| ПЗ | — | преднизолон |
| ПТ | — | пульс-терапия |
| РА | — | ревматоидный артрит |
| р/сут,р/нед,р/мес | — | раз в сутки, раз в неделю,раз в месяц |
| СЗП | — | свежезамороженная плазма |
| СКВ | — | системная красная волчанка |
| СКФ | — | скорость клубочковой фильтрации |
| СОЭ | — | скорость оседания эритроцитов |
| СРБ | — | С-реактивный белок |
| ССЗ | — | сердечно-сосудистые заболевания |
| ССД | — | системная склеродермия |
| УД | — | уровень доказательности |
| УЗИ ОБП | — | ультразвуковое исследование органов брюшной полости |
| УЗДГ | — | ультразвуковая допплерография сосудов |
| ФГДС | — | фиброгастродуоденоскопия |
| ХПН | — | хроническая почечная недостаточность |
| ЦНС | — | центральная нервная система |
| ЦОГ-2 | — | циклооксигеназа-2 |
| ЦФ | — | циклофосфамид |
| ЦсА | — | циклоспорин А |
| ЭКГ | — | электрокардиография |
| ЭХО-КГ | — | эхокардиография |
| ACR | — | Американская коллегия ревматологов (от анг. American College of Rheumatology) |
| EULAR | — | Европейская Лига против Ревматизма (от анг. European League against Rheumatism) |
| HELLP-синдром | — | гемолиз, повышение активности ферментов печени, тромбоцитопения (от анг. hemolysis, elеvated liver enzymes, lоw рlаtelet соunt) |
| Hep-2 | — | перевиваемая линия эпителиальных клеток аденокарциномы гортани человека, являются очень удобным субстратом для лабораторного исследования, так как обладают крупными ядрами и на стеклах растут в один слой. АНА выявляются при связывании с внутриклеточными антигенами клеток НЕр-2 ( от анг. Human epithelial type 2 сells) |
| SLICC/ ACR | — | индекс повреждения, разработанный Международной организацией сотрудничества клиник СКВ при содействии АCR ( от анг. Systemic Lupus International Collaborating Clinics / American College of Rheumatology) |
| SLEDAI –2K | — | валидированный индекс активности СКВ, модифицированный во время проведения исследования SELENA ( от анг. Systemic lupus erythematosus disease activity index) |
Пользователи протокола: ревматологи, врачи общей практики, терапевты, акушер-гинекологи.
Категория пациентов: взрослые, в том числе беременные.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
+7 938 489 4483 / +7 707 707 0716 / + 375 29 602 2356 / office@medelement.com
Мне интересно! Свяжитесь со мной
Классификация
Классификация [4-6,20]
I.По характеру течения, началу болезни и дальнейшему прогрессированию
выделяют варианты течения: рецидивирующее-ремиттирующее течение — от 2 и более обострений СКВ по индексу SLEDAI2К в течение одного года; хронически активное течение — персистирующая активность заболевания в течение года (SLEDAI-2К>0 за счет клинического и иммунологического составляющих индекса); ремиссия СКВ-полное отсутствие клинических проявлений в течение одного года при возможном наличии незначительного увеличения уровня антител к ДНК, снижения С3-или С4-компонентов комплемента (SLEDAI-2К 0-4 балла за счет иммунологических составляющих индекса).
II.По степени активности (таблица 1):
Таблица1 -Индекс активности СКВ по шкале SLEDAI 2K
| Балл | Проявление | Определение |
| 8 | Эпиприступ | Возникший в течение последние 10 дней, исключая метаболические, инфекционные и лекарственные причины |
| 8 | Психоз | Нарушение способности выполнять действия в нормальном режиме из-за выраженного изменения восприятия действительности:галлюцинации, бессвязность, значительное снижение ассоциативных способностей, истощение мыслительной деятельности, выраженное алогичное мышление; странное, дезорганизованное или кататоническое поведение (кроме вызванных уремией или лекарственными препаратами) |
| 8 | Органические мозговые синдромы | Нарушение умственной деятельности, ориентации, памяти или других интеллектуальных способностей, острое начало и нестойкие клинические проявления:затуманенность сознания со снижением концентрации, неспособность сохранять внимание к окружающему; плюс до 2признаков — нарушение восприятия, бессвязная речь, бессонница или сонливость в дневное время, снижение/повышение психомоторной активности (кромеметаболического, инфекционного и лекарственного воздействия) |
| 8 | Зрительные нарушения | Изменения в глазу/ на сетчатке: клеточные тельца, кровоизлияния, серозный экссудат / геморрагии в сосудистой оболочке или неврит зрительного нерва, склерит, эписклерит (кроме причин — гипертензия, инфекция и лекарства) |
| 8 | Расстройство состороны ЧМН | Впервые возникшая чувствительная / двигательная невропатия черепно-мозговых нервов (ЧМН), включая головокружение, развившееся вследствие волчанки |
| 8 | Головная боль | Выраженная персистирующая головная боль (может быть мигренозной), не отвечающая на наркотические анальгетики |
| 8 | ОНМК | Впервые возникшее острое нарушение мозгового кровообращения (ОНМК), исключая таковое, вследствие атеросклероза или гипертензии |
| 8 | Васкулит | Язвы,гангрена, болезненные узелки на пальцах, околоногтевые инфаркты, геморрагии, данные биопсии/ангиограммы |
| 4 | Артрит | 2 и >болезненных суставов (болезненность, отек или выпот) |
| 4 | Миозит | Проксимальная мышечная боль/слабость с повышением уровня КФК/альдолазы или данные ЭМГ/ биопсии, подтверждающие миозит |
| 4 | Цилиндрурия | Зернистые или эритроцитарные цилиндры |
| 4 | Гематурия | >5 эритроцитов в п/ зрения, исключая камни, инфекционные и др. |
| 4 | Протеинурия | Острое начало или недавнее появление в количестве >0,5 г/сутки |
| 4 | Пиурия | >5 лейкоцитов в п/ зрения, исключая камни, инфекционные и др. |
| 2 | Высыпания | Новые/продолжающаяся сыпь на коже воспалительного характера |
| 2 | Алопеция | Впервые возникшее или продолжающееся повышенное очаговое или диффузное выпадение волос вследствие активности волчанки |
| 2 | Язвы слизис-тых оболочек | Впервые возникшее или продолжающееся изъязвление слизистых оболочек рта и носа вследствие активности волчанки |
| 2 | Плеврит | Боль в грудной клетке с шумом трения плевры или выпотом, или утолщение плевры вследствие волчанки |
| 2 | Перикардит | Перикардиальная боль с одним из следующих признаков: шум трения перикарда, ЭКГ подтверждение |
| 2 | Низкий комплемент | Снижение СН50, С3 или С4 < нормы тестирующей лаборатории |
| 2 | Повышение уровня анти-тел к ДНК | >25% связывания по методу Farr или превышение нормальных значений тестирующей лаборатории |
| 1 | Лихорадка | >38 0 С, исключить инфекционные причины |
| 1 | Тромбоцито-пения | |
| 1 | Лейкопения | |
| Общий балл (сумма баллов проявленийна момент осмотра / в течение 10 предшествовавших дней ) | ||
- нет активности (SLEDAI 0 баллов);
- низкая активность (SLEDAI 1–5 баллов);
- средняя степень активности (SLEDAI 6–10 баллов);
- высокая степень активности (SLEDAI 11–19 баллов);
- очень высокая степень активности (SLEDAI >20 баллов).
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [1-28]
Диагностические критерии [1-20]
- усталость, слабость, быстрая утомляемость, похудание, повышение температуры без видимой причины;
- боли или отечность крупных, мелких суставов и миалгия;
- покраснения кожи щек и носа—симптом «бабочки», покраснение зоны «декольте», усиливающееся от волнения, пребывания на солнце, воздействия мороза и ветра; высыпания на коже; выпадение волос, язвы наслизистых губ, полости рта, носоглотки и синяки на коже;
- одышка, кашель, боли в грудной клетке, в области сердца; головная боль, судороги (при исключении метаболических, инфекционных и лекарственных причин).
- Поражение кожи и слизистых оболочек:сыпь на скулах в виде фиксированной эритемы, имеющая тенденцию к распространению к носогубной зоне; дискоидная сыпь в виде эритематозных приподнимающихся бляшек с прилипающими кожными чешуйками и фолликулярными пробками, на старых очагах могут быть гиперпигментация, атрофические изменения; высыпания в виде красных колец с более бледной кожей внутри кольца, изъязвление губ, полости рта или носоглотки, обычно безболезненное;поражение сосудов кожи: капилляриты—точечные эритемы на концевых фалангах пальцев рук, ладонях; высыпания геморрагического характера;бледность кожных покровов.
- Поражение костно-суставной системы:неэрозивные артриты, с поражением 2 или более периферических суставов, с болезненностью, отёком и выпотом.
- Поражение легких и сердца: шум трения плевры, шум трения перикарда.
- Поражение почек: отеки, которые располагаются на лице, особенно на веках.
Таблица 2 -Классификационные критерии СКВ (SLICC) [5]:
| Клинические критерии: | |
| 1 | Острое, активное поражение кожи: |
| □ | Сыпь на скулах (не учитываются дискоидные высыпания) |
| □ | Буллезные высыпания |
| □ | Токсический эпидермальный некроз как вариант СКВ |
| □ | Макулопапулезная сыпь |
| □ | Фотосенсибилизация: сыпь, возникающая как реакция на солнечный свет |
| □ | Или подострая кожная волчанка (неиндурированные псориазоформные и/иликруговые полициклические повреждения, проходящие без образованиярубцов, но с возможной поствоспалительной депигментацией или телеангиоэктазиями) |
| 2 | Хроническая кожная волчанка: |
| Классическая дискоидная сыпь | |
| □ | Локализованная (выше шеи) |
| □ | Генерализованная (выше и ниже шеи) |
| □ | Гипертрофические (бородавчатые) поражения кожи |
| □ | Панникулит |
| □ | Поражение слизистых |
| □ | Отечные эритематозные бляшки на туловище |
| □ | Капилляриты (красная волчанка обморожения, Гатчинсона, проявляющаяся поражением кончиков пальцев, ушных раковин, пяточных и икроножных областей) |
| □ | Дискоидная красная волчанка по типу красного плоского лишая или overlap |
| 3 □ | Язвы слизистых (исключая васкулит, болезнь Бехчета¸ вирус герпеса, воспалительные заболевания кишечника, реактивный артрит и употребление кислых пищевых продуктов):ротовой полости: неба, щек, языка или носовой полости |
| 4 | Нерубцовая алопеция: (истончение/ повышенная хрупкость волос с обломанными кончиками) (исключая очаговую алопецию, лекарственную, андрогенную и дефицит железа ) |
| 5 | Артрит: |
| □ | Синовит с участием 2 или > суставов (отек /выпот или болезненность 2 или > суставов и утренняя скованность до 30 минут |
| 6 | Серозит: |
| □ | Типичный плеврит в течении более чем 1 дня |
| □ | Или Плевральный выпот или шум трения плевры |
| □ | Перикардиальная боль, купирующаяся при положении сидя с наклоном вперед в течении более чем 1 день |
| □ | Или Перикардиальный выпот или шум трения перикарда |
| □ | Или ЭКГ- признаки перикардита (кроме инфекции, уремии и перикардита Дресслера) |
| 7 | Поражение почек: |
| □ | Соотношение уровня белок/креатинин (или суточная протенурия)500 мг и > белка за 24 ч |
| □ | Или эритроциты в моче 5 или более или цилиндры в моче 5 или более |
| 8 | Нейропсихические поражения: |
| □ | Эпилептический приступ |
| □ | Психоз |
| □ | Моно/полиневрит (кроме первичного васкулита) |
| □ | Миелит |
| □ | Патология черпно-мозговых нервов/периферическая нейропатия (кроме первичного васкулита, инфекции и сахарного диабета) |
| □ | Острое нарушение сознания (кромеуремии, токсических / метаболически , лекарственных воздействии) |
| 9 | Гемолитическая анемия |
| 10 | Лейкопения (кроме синдрома Фелти, лекарственной и портальной гипертензии) |
| Или Лимфопения (кроме, обусловленной кортикостероидами, лекарствами и инфекцией) | |
| 11 | Тромбоцитопения ( |
| Иммунологические критерии: | |
| 1 | ANA выше уровня диапазона референс-лаборатории |
| 2 | Anti—dsDNA>уровня диапазона референс-лаборатории /(или >2-х кратного увеличения методом ELISA) |
| 3 | Anti—Smналичие антител к ядерному антигену Sm |
| 4 | Антифосфолипидные антитела определенные любым из следующих способов: |
| □ | Положительный волчаночный антикоагулянт |
| □ | Ложно положительная реакция Вассермана |
| □ | Средний или высокий титр антител к кардиолипину уровня (IgA, IgG, или IgM) |
| □ | Положительный результат теста на анти-β2-гликопротеин I (IgA, IgG,или IgM) |
| 5 | Низкий комплемент |
| □ | Низкий С3 или Низкий С4 или Низкий СH50 |
| 6 | Положительная реакция Кумбса при отсутствии гемолитической анемии |
| Критерий | Определение |
| АНА | ANA при титре ≥1: 80 на клетках HEp-2 или эквивалентном положительном тесте хотя бы один раз. Тестирование иммунофлуоресценцией на клетках HEp-2 или твердом геле. |
| Лихорадка | Температура >38,3 0 С |
| Лейкопения | Количество лейкоцитов |
| тромбоцитопения | Количество тромбоцитов |
| Аутоиммунный гемолиз | Доказательства гемолиза: ретикулоцитоз, низкий гаптоглобин, повышенный непрямой билирубин и лактатдегидрогеназа иположительный тест Кумбса (прямой антиглобулин). |
| Делирий | (1) Изменение сознания или уровня возбуждения с пониженной способностью фокусироваться; (2) развитие симптомов в течение нескольких часов до |
| Психоз | (1) бред и / или галлюцинации без понимания и (2) отсутствием делирия |
| Припадок | Первичный генерализованный или частичный / очаговый припадок |
| Алопеция | Нерубцовая алопеция, наблюдаемая врачом |
| Язвы слизистых | Язвы полости рта, наблюдаемые врачом * |
| Подострая кожная волчанка (ПККВ) (наблюдение врача *) или дискоидная Волчанка (ДКВ)(наблюдение врача *) | ПККВ: кольцевидная или псориазоподобная кожная сыпь, чаще с фотодистрибуцией; ДКВ: эритематозно-ломкие кожные поражения с атрофическими изменениями (рубцевание, депигментация, часто фолликулярный гиперкератоз /скальп), приводящий к рубцеванию алопеции (прибиопсии кожи — типичные изменения); ПККВ: вакуолярный дерматит из периваскулярного лимфогистиоцитарного инфильтрата, часто с кожным муцином. ДКВ: вакуолярный дерматит из периваскулярного и /или лимфогистиоцитарного инфильтрата. На коже головы могут быть фолликулярные кератиновые пробки, при давних поражениях — отложение муцина и утолщение базальной мембраны. |
| Острое, активное поражение кожи(наблюдение врача). | Маларгическая сыпь или генерализованная макулопапулезная сыпь. Прибиопсии кожи — типичные изменения: вакуольный дерматит, состоящий из периваскулярного лимфогистиоцитоза, инфильтрат, часто с кожным муцином. Возможен периваскулярный нейтрофильный инфильтрат. |
| Плевральный или перикардиальный выпот | Визуальные доказательства плеврального или перикардиального выпота или обоих: ультразвук, рентген, компьютерная томография (КТ), магнитно-резонансная томография (МРТ) |
| Острый перикардит | ≥2 из (1) перикардиальная боль в груди (обычно острая, усиливающаяся при вдохе, улучшающаяся при наклоне вперед), (2) шум перикарда, (3)электрокардиограмма с новым распространенным подъемом сегмента ST или депрессией PR, (4) свежий или усиление выпота в перикарде при визуализации (УЗИ, рентген, КТ, МРТ). |
| Совместное участие | ЛИБО (1) синовит с участием 2 или > суставов с припухлостью или выпотом ИЛИ (2) болезненность в 2 или > суставах и, по крайней мере,30 минут утренней скованности. |
| Протеинурия >0,5 г за 24 часа | Протеинурия >0,5 г за 24 часа в моче или эквивалентное соотношение уровня белка и креатинина в моче за 24 часа. |
| Волчаночный нефрит (ВН) класса II или V в почкахбиопсия в соответствии с ISN / RPS 2003 классификацией | Класс II: мезангиопролиферативный ВН — чисто мезангиальная гиперцеллюлярность любой степени или расширение мезангиального матрикса световой микроскопии с мезангиальным иммунным депозитом. Несколько изолированных субэпителиальных или субэндотелиальных отложений могут быть видны при иммунной флуоресценции или электронной микроскопии, но не с помощью световой микроскопии.Класс V: мембранозный ВН — глобальные или сегментарные субэпителиальные иммунные отложения или их морфологические последствия с помощью световой микроскопиии иммунофлуоресценции или электронной микроскопии, с мезангиальными изменениями или без них. |
| Волчаночный нефрит класса III или IV на биопсии почки | Класс III: очаговый ВН: активный или неактивный очаговый, сегментарный или глобальный эндокапиллярный или экстракапиллярный гломерулонефрит с участием |
| Положительные антифосфолипидные антитела | Антитела к кардиолипину (IgA, IgG или IgM) со средним или высоким титром (> 40 A фосфолипидов (APL), единиц GPL или MPL или> 99-го процентиля)или положительные антитела на анти β2-гликопротеину I (β22GP1) (IgA, IgG или IgM), или антикоагулянт волчанки (ВА). |
| Низкий комплемент С3,С4 | Низкий С3 или С4 ниже нижнего предела нормы. Оба C3 и C4 ниже своих нижних пределов нормы. |
| АТ к дсДНК АТ или ядерному Sm-антигену | Антитела дсДНК в иммуноанализе с продемонстрированной специфичностью ≥90% к СКВ выше уровня диапазона референсной лаборатории ИЛИ анти-Sm антитела. |
* Это может включать клиническое наблюдение или просмотр фотографии.
Антифосфолипидный синдром – симптомокомплекс, включающий рецидивирующие тромбозы (артериальный и/или венозный), акушерскую патологию (чаще синдром потери плода) и связанный с синтезом АФА: аКЛ, и/или ВА и/или анти β2-ГП-1[14-16].
- Первичный АФС.
- Вторичный АФС.
- Катастрофический АФС.
- Серонегативный АФС.
- Вероятный АФС, или преАФС.
- Микроангиопатический АФС.
- Перекрестный АФС.
Таблица 4 -Международные диагностические критерии АФС [15]
| Клинические критерии: |
| Сосудистый тромбоз: один и более эпизодов тромбоза (артериального, венозного, тромбоза мелких сосудов). Тромбоз должен быть подтвержден при помощи инструментальных методов или морфологически. Морфологическое подтверждение должно быть представлено без значительного воспаления сосудистой стенки. |
| Патология беременности: один и более случаев внутриутробной гибели морфологически нормального плода после 10 недель гестации (нормальные морфологические признаки плода документированы на УЗИ или непосредственно осмотром плода), илиодин и более эпизодов преждевременных родов морфологически нормального плода до 34 недель гестации из-за выраженной преэклампсии или эклампсии или плацентарной недостаточности; три и более последовательных случаев спонтанных абортов до 10 недель гестации (исключение: анатомические дефекты матки, гормональные нарушения, материнские и отцовские хромосомные нарушения). |
| Лабораторные критерии: |
| аКЛ IgG или IgM-изотипов, выявляемые в сыворотке в средних и высоких титрах, по крайней мере,2 раза не менее чем через 12 нед стандартизованнымИФА методом. |
| Анти –β ВА в плазме в двух или более случаях исследования с промежутком не менее 12 нед, определяемый стандартизованным методом. а) удлинение времени свертывания плазмы в фосфолипидзависимых коагулогических тестах (АПТВ, тесты с ядами Расселя); б) отсутствие коррекции удлинения времени свертывания в скрининговых тестах при проведении тестов смешивания с донорской плазмой; в) укорочение или коррекция удлинения времени свертывания в скрининговых тестах при добавлении фосфолипидов; д) исключение других коагулопатий ( ингибитора фактора VIII свертывания крови). |
| АФС диагностируется на основании наличия одного клинического и одного лабораторного критерия. АФС исключается, если аФЛ выявляется менее 12 нед или более 5 лет в отсутствие клинических проявлений АФС. Наличие врожденных или приобретенных факторов риска тромбозов не исключают АФС. Больные должны быть стратифицированы с наличием и отсутствием факторов риска тромбозов. |
- Неврологические: преходящие ОНМК, ишемические инсульты, хореиформные гиперкинезы, эпилепсия, деменция, поперечный миелит, энцефалопатия, мигрень, поражение ЦНС, тромбоз венозных синусов, множественные мононевриты.
- Офтальмологические: тромбоз артерии и/или вены сетчатки, синдром преходящей слепоты.
- Кожные: тромбофлебиты поверхностных вен, язвы ног, дистальная ишемия, синдром фиолетового пальца стопы.
- Кардиологические: инфаркт миокарда, поражение клапанов сердца от утолщения до формирования вегетации на клапанах, внутрисердечные тромбы, атеросклеротическое поражение сосудов.
- Легочные: легочная эмболия, легочная гипертензия, тромбоз легочной артерии, альвеолярные геморрагии.
- Почечные: тромбоз артерий/вены почек, инфаркты почек, острая почечная недостаточность, протеинурия, гематурия, нефротический синдром.
- Гастроинтестинальные: синдром Бадда-Киари, инфаркты печени, желчного пузыря, кишечника и селезенки; панкреатиты, асциты, перфорация пищевода, ишемические колиты.
- Эндокринные: инфаркт надпочечников, или надпочечниковая недостаточность, инфаркты яичка, предстательной железы, гипофиза или гипоталамо-гипофизарная недостаточность.
- персистирующая протеинурии> 0,5 г в сутки и/или 5 эритроцитов, 5 лейкоцитов, цилиндров в поле зрения при отсутствии инфекции мочевыводящих путей;
- дополнительно – данные биопсии почки с подтверждением у морфолога [18-21]. Биопсия почки с диагностической целью показана всем пациентам с СКВ с клиническими признаками активного ВН (при отсутствии строгих противопоказаний) (УД – А) [18,21]:
Лабораторные исследования [1-10, 15-25] (УД– С):
- ОАК: увеличение СОЭ встречается часто, но не коррелирует с активностью заболевания и необъяснимое увеличение её указывает на наличие интеркуррентной инфекции;лейкопения (обычно лимфопения, нейтропения или сочетание обеих) ассоциируется с активностью болезни; тромбоцитопения обычно при АФС или аутоиммунной тромбоцитопении; гипохромная анемия, связана с хроническим воспалением, желудочным кровотечением или приемом некоторых ЛС;возможно развитие аутоиммунной гемолитической анемии (у 10% больных).
- ОАМ: протеинурия, гематурия, лейкоцитурия, цилиндрурия — выраженность зависит от клинико-морфологического варианта ВН.
- Коагулограмма: контроль гемостаза, маркеров тромбоза и гиперкоагуляция при АФС.
- БАК: креатинин, общий белок, АЛТ, АСТ, общий билирубин, общий холестерин, глюкоза – неспецифичные изменения при поражении внутренних органов;
- СРБ – увеличение содержания отражает наличие сопутствующей инфекции.
| Признак | Баллы |
| Орган зрения (каждый глаз) при клинической оценке:любая катаракта | 1 |
| изменения сетчатки или атрофия зрительного нерва | 1 |
| Нервная система и почки | |
| Когнитивные нарушения (снижение памяти, трудности со счетом, речи , письма, нарушенный уровень исполнения, плохая концентрация) или большие психозы | 1 |
| Судорожные припадки, требующие лечения более 6 мес | 1 |
| Инсульты когда-либо (счет 2 балла, если >1) | 1 2 |
| Черепно-мозговая или периферическая невропатия (исключая зрительную) | 1 |
| Поперечный миелит | 1 |
| Клубочковая фильтрация < 50 мл/мин | 1 |
| Протеинурия >3,5 г/24 часа | 1 |
| ИЛИ Конечная стадия почечного заболевания (диализ или трансплантация) | 3 |
| Легки , сердечно-сосудистая система и периферические сосуды | |
| Легочная гипертензия (выбухание правого желудочка или звонкий II тон) | 1 |
| Легочный фиброз (физикально и рентгенологически) | 1 |
| Сморщенное легкое (рентгенологически) | 1 |
| Плевральный фиброз (рентгенологически) | 1 |
| Инфаркт легкого (рентгенологически) | 1 |
| Стенокардия или аорто-коронарное шунтирование | 1 |
| Инфаркт миокарда когда-либо (счет 2 балла, если >1) | 1 2 |
| Кардиомиопатия (дисфункция желудочков) | 1 |
| Поражение клапанов (диастолический или систолический шум >3/6) | 1 |
| Перикардит в течение 6 мес (или перикардэктомия) | 1 |
| Перемежающаяся хромота в течение 6 мес | 1 |
| Небольшая потеря ткани («подушечка» пальца) | 1 |
| Значительная потеря ткани когда-либо (пальца или конечности) (счет 2 если > чем в одном месте) | 1 2 |
| Венозный тромбоз с отеком, изъязвлением или венозным стазом | 1 |
| Желудочно-кишечный тракт | |
| Инфаркт, резекция кишечника (ниже 12-перстной кишки), селезенки, печени или желчного пузыря, когда-либо по любым причинам (счет 2 если > 1) | 1 2 |
| Мезентериальная недостаточность | 1 |
| Хронический перитонит | 1 |
| Стриктуры или хирургические операции на верхней части ЖКТ | 1 |
| Костно-мышечная система и кожа | |
| Мышечная атрофия или слабость | 1 |
| Деформирующий или эрозивный артрит (включая вправимые деформации, исключая аваскулярные некрозы) | 1 |
| Остеопороз с переломами/ коллапсом позвонков (исключая аваскулярный некроз) | 1 |
| Аваскулярный некроз (счет 2 балла, если >1) | 1 2 |
| Остеомиелит | 1 |
| Рубцовая хроническая алопеция | 1 |
| Обширное рубцевание / панникулит (кроме волосистой части и подушечек пальцев) | 1 |
| Изъязвления кожи (исключая тромбоз) в течение 6 мес | 1 |
| Поражение половой системы | 1 |
| Сахарный диабет (вне зависимости от лечения) | 1 |
| Малигнизация (исключая дисплазии) (счет 2 балла, если более чем в одном месте) | 1 |
| Общий балл |
- АНА – гетерогенная популяция аутоантител, реагирующих с различными компонентами клеточного ядра (у 95% пациентов методом АНА на клетках Нер-2 с помощью нРИФ или эквивалентным методом (при первичном диагнозе СКВ);
- АТ к дсДНК АТ или ядерному Sm — АТ против дсДНК в иммуноанализе с продемонстрированной специфичностью ≥90% к СКВ выше уровня диапазона референсной лаборатории или анти-Sm антитела (10-30% пациентов);
- С3, С4 компоненты комплемента — при установленном диагнозе с целью мониторинга активности СКВ;
- АФА — определять у всех пациентов с СКВ (УД А) [7,8]. Диагностические лабораторные критерии маркеры АФС: АФЛ, ложноположительная реакция Вассермана, антикоагулянт волчанки.
- рентгенография ОГК или флюорография (плеврит, легочная гипертензия, пневмонит, тромбоэмболия легочной артерии);
- ЭКГ (изменения, характерные для ишемии миокарда, нарушения ритма сердца (полная АВ-блокада, пароксизмальная тахикардия, мерцание предсердий, суправентрикулярная тахиаритмия);
- ЭхоКГ (перикардит, миокардит, эндокардит: вальвулит, вегетации на клапанах; коронариит; поражение клапанного аппарата сердца с наиболее частым поражением митрального, аортального и трикуспидального клапанов с развитием недостаточности или стеноза; легочная гипетензия);
- УЗИ ОБП, УЗИ почек (инфаркты печени и/или селезенки, признаки панкреатита, панкреонекроза, холестаза; инфаркта почки; нефрита, нарушений почечного кровотока с обеднением его по периферии, нарушением дифференцировки почечных слоев);
- Эзофагогастродуоденоскопия с биопсией слизистой оболочки желудка и двенадцатиперстной кишки (наличие диспептических явлений и/или длительном применении ГКС, и/или иммунодепрессантов, и/или ГИБП; перед назначением или коррекции противоревматической терапии с целью выявления активности болезни; при контроле эффективности и безопасности противоревматической терапии). Возможно эрозивно-язвенное поражение верхних отделов желудочно-кишечного тракта.
- консультация нефролога – с целью определения совместной тактики ведения пациента при волчаночном нефрите (поликлиника и стационар);
- консультация невролога – в случае присоединения поражения нервной системы и развитии неврологической симптоматики (поликлиника и стационар);
- консультация психиатра – при наличии психотических расстройств, для решения вопроса о назначении психотропной терапии, необходимости лечения в специализированном стационаре (психоз, депрессия, сопровождающиеся суицидальными мыслями) (поликлиника и стационар);
- консультация офтальмолога – при развитии патологии глаза (поликлиника и стационар);
- консультация акушер-гинеколога – совместная тактика ведения в период беременности (врач общей практики и акушер-гинеколог стационара);
- консультация хирурга – при присоединении болевого синдрома, сопровождающейся рвотой «кофейной гущей», диареей, абдоминальными кризами, панкреатитом (поликлиника и стационар);
- консультация ангиохирурга – при наличии АФС с тромбозами сосудов конечностей (поликлиника и стационар);
- консультация эндокринолога – для выработки тактики ведения при стероидном диабете, сопутствующем аутоиммунном тиреоидите и другой эндокринной патологии (поликлиника и стационар);
- консультация инфекциониста – при подозрении на сопутствующий вирусный гепатит, интеркуррентную инфекцию (поликлиника и стационар);
- консультация гастроэнтеролога – при поражении слизистой рта, при дисфагии (часто ассоциируется с феноменом Рейно), при анорексии, тошноте, рвоте, диарее, пептических язвах (возможно побочные эффекты медикаментозной терапии), панкреатите.
Таблица 6 — Алгоритм диагностики СКВ (EULAR/ACR)[6]
| Критерий включения: ANA в титре ≥1:80 на НЕр-2 клетках или эквивалентный положительный тест (когда-либо) → Если отсутствует, то не классифицируйте как СКВ; если присутствует, то примените дополнительные критерии | |||
| Дополнительные критерии: — не рассматривайте критерий, если ему имеется более вероятное объяснение, чем СКВ; — достаточно хотя бы однократного обнаружения критерия; — наличие хотя бы одного клинического критерия; — критерии не обязательно должны присутствовать одновременно; в пределах каждого домена в общий счет включается только критерийс максимальным «баллом» | |||
| Клинические критерии: | Балл | Иммунологические критерии: | Балл |
| Конституционные: лихорадка | 2 | Антифосфолипидные антитела: Антитела к кардиолипину, либо антитела к анти-β2-GP1, либо волчаночный антикоагулянт | 2 |
| Гематологические: Лейкопения Тромбоцитопения Аутоиммунный гемолиз | 3 44 | Белки комплемента: низкий С3, либо низкий С4 низкий С3 и низкий С4 (совместно) | 3 4 |
| Нейропсихиатрические: Делирий Психоз Судороги | 2 3 5 | Высокоспецифичные антитела: Анти-дсДНК, либо антитела Smith | 6 |
| Кожно-слизистые: Нерубцовая алопеция Язвы во рту Подострая либо дискоидная кожная волчанка Острая кожная красная волчанка | 2 2 4 | ||
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований [1-16, 25-28]
Таблица 7 — Дифференциальная диагностика системной красной волчанки:
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Ревматоидный артрит | Чаще у женщин симметричный полиартрит мелких суставов кистей и несуставные проявления (дигитальный артериит, полисерозиты, поражение почек). Положительный тест на АНФ в 25% случаев. | ИФА: АЦЦП,РФ, рентгенография кистей с захватом лучезапястных суставов | Поражение суставов носит стойкий, прогрессирующий характер. Утренняя скованность. По мере прогрессирования болезни развивается деструкция суставных поверхностей и деформация суставов, не хараткерной для СКВ. Эрозивные изменения на рентгенограммах. Тяжелое поражение внутренних органов встречается реже. |
| Синдром Стилла у взрослых | Артриты, миалгии, лихорадка, папулезная сыпь, лимфоаденопатия, спленомегалия, серозит | Определение ферритина в крови,УЗИ ОБП | В период активности — нейтрофильный лейкоцитоз (не лейкопения, как при СКВ). Тест на АНФ отрицательный. Кожные изменения носят кратковременный характер. |
| Системные васкулиты | Лихорадка, поражение кожи, суставов, почек, ЦНС, легких | Иммунологические исследования (АНЦА). УЗДГ сосудов | Чаще болеют мужчины (исключениеболезнь Такаясу). Нередко триггер — инфекция (вирусная, бактериальная). Ишемические изменения в органах и тканях вследствие воспаления и некроза сосудистой стенки. Поражение НС –множественный мононеврит. Лейкоцитоз, тромбоцитоз, выявление АНЦА. |
| Системная склеродермия | Симметричный полиартрит, синдром Рейно, полисерозит, конституциональные нарушения | Определение антицентромерныхАТ, АНФ, АТ к Scl-70, биопсия кожно-мышечного лоскута, капилляроскопия. | Изменения кожи, сосудов и подкожной клетчатки (уплотнение, атрофия, нарушение пигментации, телеэнгиэктазии), суставов (преобладание фиброзных изменений) и ЖКТ. Рентгенологические признаки (остеолиз, резорбция концевых фаланг), кальциноз мягких тканей. |
| Синдром лекарственной волчанки | Полиартрит, кожный синдром, фотосенсибилизация, гепатоспленомегалия, полисерозит, лихорадка, лейкопения, положительные анализы на АНФ, LE-клетки. | Анамнез- прием ЛС, способных индуцировать волчаночноподобный синдром (антигипертензивные, антиаритмические, противосудорожные, сульфаниламиды, кон-трацептивы). | Редко встречают тяжелое поражение почек и ЦНС, тромбоцитопению. После отмены лекарственного препарата клиническая симптоматика регрессируют в течение 4-6 нед (положительный тест на АНФ сохраняется до 1 года). |
- Гемостазиограмма: определение функций адгезии и агрегации тромбоцитов -при тромбоцитопении и наличии вторичного АФС;
- Проба Кумса обнаруживают у 10% пациентов с СКВ -для дифференциации с гемолитической анемией;
- сывороточное железо – при наличии анемии, относится к неспецифическим изменениям и отражает поражение внутренних органов;
- Денситометрия – при длительной кортикостероидной терапии;
- исследование ликвора, электроэнцефалограмма, МРТ головного и спинного мозга – при наличии симптомов нейролюпуса; при подозрении на тромботические осложнения — МРТ ангиография, при подозрении на острое нарушение мозгового кровообращения — КТ/МРТ головного мозга в сосудистом режиме.
- биопсия почки при раннем выявлении признаков поражения почек для достижения оптимальных результатов лечения [УД – B]. В случае стабильной функции почек или ее улучшения, но неполного ответа со стороны почек (персистирующая протеинурия 0,8–1 г/24 ч после >1 года иммуносупрессивного лечения), показана повторная биопсия с определением преобладающего процесса (активного или хронического) поражения почек [УД — С].
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ [6-10,13, 15-19, 22-23, 28-112]
- СКВ – полиорганное заболевание, диагностируемое по клиническим признакам при наличии характерных серологических нарушений.
- Лечение СКВ требует понимания многочисленных аспектов и проявлений заболевания, применения мультидисциплинарного подхода и должно основываться на совместном решении пациента и лечащего врача.
- Лечение при СКВ должно быть направлено на достижение ремиссии или минимальной активности заболевания (УДB) и предотвращение обострений (УД –B). Для поддерживающей терапии следует использовать минимально возможную дозу глюкокортикостероидов (ГКС).
- Обострение СКВ необходимо лечить в зависимости от степени тяжести поражения органов, при необходимости осуществляется коррекция терапии: увеличение дозы ГКC, иммуномодулирующих средств, «переключение» с одного препарата на другой или добавление новых методов лечения (УД C).
- Амбулаторно-поликлиническая форма оказания медицинской помощи применяется у пациентов СКВ, находящихся в ремиссии, с хроническим течением с низкой или средней степенью активности без угрозы развития полиорганной, почечной недостаточности и/или поражением ЦНС (судорожный синдром, психоз, поперечный миелит и т.д.) [6-10, 16-19, 22-50].
- Лечение СКВ зависит от клинических проявлений и активности заболевания, включает применение интенсивной иммуносупрессивной терапии, длительного периода динамического наблюдения и коррекцию терапии с целью предупреждения обострений (особенно тяжелых), мониторинга клинико-лабораторной активности СКВ и профилактики побочного действия лекарственной терапии (УД – В).
- Всем пациентам с СКВ необходима образовательная программа с целью обеспечения информации, знаний и навыков для самоконтроля заболевания.
- Исключить факторы, провоцирующие обострение болезни: психоэмоциональная нагрузка, интеркуррентные инфекции, инсоляции (УД – В).
- Избегать солнечных лучей: одежда, солнцезащитные кремы УФ-А и УФ-В (SPF30 или эквивалент без парааминобензойной кислоты); в жаркой половине дня с преимущественной инсоляцией УФ-В (с 10 до 16ч) — камуфляжная косметика.
- Отказ от курения, что может усилить эффект от антималярийных препаратов.
- Не травмировать кожу: избегать татуировок, пирсинга.
- Отказаться от немотивированного приема медикаментов: тиазиды, НПВП и фторированных ГКС местно, которые могут вызвать атрофию кожи (УД – D).
- В период обострения заболевания и на фоне лечения цитотоксическими препаратами необходима эффективная контрацепция (для безопасных пероральных контрацептивов — УД –А). Не следует принимать пероральные контрацептивы с высоким содержанием эстрогенов, поскольку он могут вызывать обострение СКВ.
- С целью профилактики ОП рекомендуется: снизить потребление кофеина и алкоголя, прекращение курения, употребление пищи с высоким содержанием кальция и витамина D; физические упражненияне менее 30 мин в день, адекватное потребление белка, использование протекторов тазобедренного сустава при риске потерь равновесия (УД – D) [7, 8]
- С целью профилактики атеросклероза, диабета рекомендуется: диета с низким содержанием жиров и холестерина, прекращение курения, контроль массы тела (УД – D), физические упражнения.

Рисунок 1 – Алгоритм наблюдения и лечения пациентов с СКВ [13]
Медикаментозное лечение:
Основными лекарственными средствами в лечении пациентов с СКВ являются ГКС, иммуносупрессивные препараты азатиоприн (АЗА), циклофосфамид (ЦФ), метотрексат (МТ), гидроксихлорохин (ГХ), микофенолата мофетил (ММФ) и циклоспорин (ЦсА) (УД – А), генно-инженерные биологические препараты (ГИБП) [1,7 -10, 13,15-19,21-24,28-112].
ГКС короткого действия — преднизолон (ПЗ) и метилпреднизолон (МП) являются наиболее эффективными и предпочтительными ЛС для лечения СКВ. Пациентам с низкой активностью СКВ назначают небольшие дозы ГКС МП < 7,5 мг/сут)- при неэффективности НПВП и антималярийных ЛС, с умеренной активностью - средние дозы ГКС (МП 16—32 мг/сут) в течение 4 нед (артрит, полисерозит, гемолитическая анемия, тромбоцитопения) с постепенным снижением до поддерживающей дозы [7, 8, 10,17,19,25-56, 83-88].
Перед назначением ГКС необходимо исключить инфекцию, которая может симулировать обострение СКВ (лихорадка, легочные инфильтраты, гематурия с лейкоцитурией). Дозы ГКC, способы введения зависят от типа и степени поражения органов (УД – C). Длительность приёма высоких доз ГКС в зависимости от клинического эффекта колеблется от 4 до 12 нед, снижение дозы следует проводить постепенно, под тщательным клинико-лабораторным контролем, а поддерживающие дозы (≤7.5 мг/сут) пациентам следует принимать в течение многих лет, до возможной полной отмены при стойкой ремиссии. Применение иммуносупрессивных препаратов позволяет быстро уменьшить дозу или отменить ГКС (УД – B).
Антималярийные (аминохинолиновые) ЛС при отсутствии противопоказаний должны назначаться всем без исключения пациентам с СКВ, независимо от применения других методов лечения и активности заболевания (УД – A) в дозе, не превышающей 5мг/кг в сутки (УД – C). Длительный прием препаратов обеспечивает профилактику обострений, снижение активности и кардиоваскулярного риска (УД – А) [7,8, 29-46,74-77,91]. Эффективны при поражениях кожи, суставов, конституциональных нарушениях; предотвращают обострения у пациентов с умеренно выраженной активностью болезни; снижают уровень липидов и уменьшают риск тромботических осложнений.
- СКВ без поражения жизненно важных органов (кожные проявления, артрит, конституциональные нарушения);
- в составе комбинированной терапии при поражении почек и ЦНС; поддержание ремиссии ВН;
- профилактика обострения заболевания, в т. ч. во время беременности и лактации;
- профилактика раннего атеросклероза;
- профилактика тромботических осложнений;
- профилактика развития нового органного поражения;
- стероидосберегающее действие.
Иммуносупрессанты –МТ (УД – B), АЗА (УД – C) или ММФ (УД – B) назначают при отсутствии эффекта применения ГХ (в виде монотерапии или в сочетании с ГКС) или при невозможности уменьшить дозу ГКС до поддерживающей. Иммуносупрессивные препараты должны быть включены в терапию при поражении жизненно важных органов (УД – C). АЗА (1-4 мг/кг/сут), МТ (15 мг/нед) и ЦсА (5 мг/кг/сут) показаны для лечения менее тяжелых, но торпидных к ГКС проявлений СКВ и в качестве компонента поддерживающей терапии, позволяющей вести пациентов на более низких дозах ГКС.
ММФ–селективный иммунодепрессант, характеризуется наличием цитостатической, а не цитотоксической активности, реже вызывает побочные эффекты, чем АЗА. Терапевтическая доза составляет 2-3 г/сут, рекомендуется принимать в 2 приёма с интервалом в 12 ч, поддерживающая доза 1 г/сут. Начальная доза 1 г/сут, при хорошей переносимости ЛС через 2 нед можно увеличить дозу до 2 -3 г/суткив течение 6 мес. Нежелательные эффекты: поражение ЖКТ (тошнота, рвота, диарея, боли в животе), лейкопения и увеличение частоты вирусных инфекций.
ЦФ и ММФ начав применять в комбинации с пульс-терапией 6-МПс последующим назначением ГКС внутрь в дозе 0,5-1,0 мгкг (УД – А). Индукционная терапия ММФ и ГКС проводится в течение 3-6 мес. При достижении клинико-лабораторного эффекта цитостатики используются в качестве поддерживающей терапии: ММФ в дозах 1-2 г в деньили АЗА 2 мгкг в день в течение не менее 6 мес (УД – А). В отдельных случаях может быть использован ЦсА или такролимус [7, 17,19,22,28-36, 54- 61, 80-85].
МТ целесообразно назначать при рефрактерном к монотерапии ГКС волчаночном артрите и поражениях кожи. Рекомендуемая суточная доза – не более 10-15 мг/нед [62].
ЦсА ( НПВП используются для купирования конституциональных и мышечно-скелетных клинических проявлений СКВ, а также умеренно выраженного серозита. У пациентов с СКВ могут развиться нарушение функции почек и некоторые побочные эффекты (гепатит, асептический менингит). НПВП применяется в течение короткого времени и только у пациентов с низким риском развития побочных эффектов [7 -10, 16,19, 28, 30-34, 90- 93].
При отсутствии клинических симптомов заболевания не рекомендуется усиление терапии у пациентов только на основании стабильной или персистирующей серологической активности [7,8, 25,26,29-42].
ГИБП. Белимумаб (БЛМ) назначается пациентам как продолжение лечения начатоговв стационарных условияхпо 10 мг/кг веса и далее в амбулаторных условиях ежемесячно в течение не менее 6 мес. Показания: высокая иммунологическая и клиническая активность (высокий уровень анти–ДНК, снижение С3 и С4 компонентов комплемента, SLEDAI (6-10 баллов), без клинических признаков активного ВН и поражения ЦНС. Рекомендуется применение анти-BLyS терапии БЛМ по 10 мг/кг ежемесячно (УД – А), назначается при отсутствии эффекта от стандартной терапии (комбинация ГХ и ГКС с иммуносупрессантами или без них) и/или при частых обострениях заболевания, невозможности уменьшения дозы ГКС (УД – A) [7,8, 66,68]. БЛМ эффективен упациентов при поражении кожи, слизистых оболочек, суставов, неактивном ВН (протеинурия ≤ 2г), с не критическим уровенем анемии, тромбоцитопении, лейкопении, с частым развитием обострений и с зависимостью от приема средних и высоких доз ГКС, высоким риском развития осложнений от терапии (повреждение органов), инфекции.
Ритуксимаб (РТМ) для лечения пациентов с СКВ пациентам с рефрактерным к терапии поражением жизненно-важных органов и при угрожающих состояниях или при непереносимости/противопоказаниях к стандартным иммуносупрессантам (УД – C) [7, 66,67,71-75,80,81,87]. Препарат высокоэффективен у пациентов с СКВ, прогрессирующим ВН (III-IV морфологический тип по классификации ВОЗ) и внепочечными проявлениями болезни (серозит, полиартрит, поражение кожи, стоматит, лихорадка, анемия). Предварительные результаты свидетельствуют о высокой эффективности повторных курсов терапии РТМ в случае развития обострения. Назначается РТМ по 500-1000 мг еженедельно (максимальная суммарная доза 2000 мг) (УД – С) 1 раз в 6 мес как продолжение начатого в стационарных условиях.
Всем пациентам с СКВ, получающим РТМ (и в сочетании с ЦФ), рекомендуется назначение ко-тримоксазола [сульфаметоксазол +триметоприм], для профилактики развития пневмоцистной пневмонии [7,69-73,87, 89, 96] (УД – D). Применяется ко-тримоксазол перорально в дозе 5 мг/кг массы тела в сутки на время лечения РТМ, а также в течение 1 года после его отмены.
Всем пациентам с СКВ, получающими РТМ, при появлении катаральных явлений, лихорадки и признаков пневмонии по КТ рекомендуется начать в/в введение ко-тримоксазола [сульфаметоксазол + триметоприм]15 мг/кг в сутки (по триметоприму), кларитромицина 15 мг/кг в сутки и цефтриаксона 50–100 мг/кг (УД – D).
Лечение кожных проявлений СКВ включает местные препараты: ГКС, ингибиторы кальциневрина (ИК) (УД – B), противомалярийные средства — ГХ, хлорохин (УДА) и/или системные ГКС (УДС).
МТ [УД B], ретиноиды [УД C], дапсон [УД C] или ММФ [УД C] могут быть назначены пациентам, не реагирующим на лечение или требующим высоких доз ГКС [7,8,91].
Лечение нейропсихиатрической волчанки включает применение ГКС или иммуносупрессанта для симптомов, связаных с воспалением [УДA], и антитромбоцитарного или антикоагулянтного препарата при тромбозе или симптомах, связанных с наличием АФА [УД – C] [7,8, 25,26,29-42,58,82,90-94, 102-104].
При наличии гематологических нарушений возможно назначениеиммуносупрессанта/щадящий ГКС, ММФ [УД – C], АЗА [УД – C] или ЦсА [УД – C], могут использоваться для поддержания ответа.
Фармакотерапия при лечении СКВ без поражения почек [7,8, 31-36]: легкая степень тяжести (общие симптомы, легкий артрит, поражение кожи ≤9%, тромбоцитов 50-100/мкл, SLEDAI≤6) : лечение 1-ой линии — ГХ [УД – A], ГКС п/о или в/м [УД – A] , 2-ой линии — ГХ [УД – A], ГКС п/о или в/м [УД – A], МТ или АЗА [УД – B].
При лечении поражения почек при СКВ всегда применяется иммуносупрессивная терапия — при ВН III, IV, V классов. При определенных клинических и лабораторных показателях она используется и при ВН I и II классов, но, таким пациентам назначения иммуносупрессантов не всегда требуется. При VI классе (склероз >90% клубочков) показана подготовка к гемодиализу и трансплантации почки, в этих случаях иммуносупрессивная терапия используется только при наличии внепочечных проявлений СКВ
Рекомендуется выбор терапии от классификационного типа нефрита.
Активный ВН: ГКС + цитостатики + ГХ (200-400 мг/сут) (УД – С);при наличии протеинурии более 0,5 г/24 ч — блокаторы рецепторов ангиотензина II (УД – А); при повышении уровня ЛПНП в сыворотке крови более 100 мг/дл рекомендуется назначение статинов (УД – С).
ВН класса I или II: назначение иммуносупрессивной и ГКС терапии не проводится (УД – С). При наличии протеинурии более 0,5 г/24 ч и эритроцитурии рекмендуется назначение ГКС и АЗА.
При лечении иммуносупрессантами выделяют индукционную фазу, направленную на достижение ремиссии (до 3–6 мес) и фазу поддерживающую ремиссию. Терапия, начатая в стационарных условиях, должна быть продолжена амбулаторно под наблюдением профильных специалистовс тщательным мониторингом развития неблагоприятных реакций (инфекции, цитопения, тератогенный эффект и др.) с госпитализацией на период интенсивной терапии.
Для начального (индукционного) лечения при люпус-нефритеIII и IV классов (рекомендации ВОЗ) применяют следующие режимы:
1.ЦФ назначается в «низких дозах» по 500 мг в/в 1 раз в 2 нед на протяжении 3 мес или ММФ по 2–3 г/сут в течение 6 мес в сочетании с высокими дозами ГКС – в/в МП по 500–750 мг 3 дня подряд + прием ПЗ per os в дозе 0,5 мг/кг/сут в течение 4 нед.
2. ЦФ -«высокие дозы» — в/в по 0,5–1 г/м2 1 раз в месяц на протяжении 6 мес в сочетании с ПЗ перорально в дозе 0,7–1,0 мг/кг/сут с последующим переходом на низкие дозы ГК (УД – А).
Использовать ММФ [УД – A] или ЦФ в низких дозах [УД – B] рекомендуется из-за лучшего соотношения эффективности и побочных эффектов. Для поддерживающей терапии следует использовать ММФ [УД – A] или АЗА [УД – A] в дозе 2 мг/кг/сут, который может применяться в индукционную фазу у пациентов с ВН III, IV классов, не имеющих факторов неблагоприятного прогноза и при наличии противопоказаний к терапии ЦФ, ММФ или их недоступности, а также у пациентов с ВН II класса с уровнем протеинурии >1 г/сут и/или гематурией в сочетании с ПЗ per os 0,25–0,5 мг/кг/сут.
Индукционная терапия ВН V класса с нефротическим синдромом включает применение ММФ 2–3 г/сут в течение 6 мес в комбинации с ПЗ 0,5 мг/кг/сут, альтернативой могут быть ЦФ, ЦС, такролимус. При ВН V класса без нефротического синдрома успешно используются АЗА и ЦС. Поддерживающая фаза терапии ВН III, IV, V классов: ММФ 2 г/сут или АЗА 2 мг/кг/сут на протяжении не менее 3 лет в сочетании с низкими дозами ПЗ (5–7,5–10 мг/сут), возможно применение ЦС. ММФ можно сочетать с низкими дозами ИК при тяжелом нефротическом синдроме [УД – C] или неполном почечном ответе [УД –C], если нет неконтролируемой артериальной гипертензии, высокого индекса хронизации при биопсии почки и/или снижения СКФ [7,8].
Использованием антитромбоцитарного препарата [УД – C] можно применить у пациентов СКВ с профилем АФА высокого риска, особенно при наличии других факторов риска развития атеросклероза или тромбоза с учетом риска кровотечения. При вторичной профилактике (тромбоз в анамнезе, осложнения при беременности или потеря беременности) лечение должно быть таким же, как при первичном АФС [УД – B]. В случае «трипозитивности» и высокого тромботического риска используется хроническая антикоагуляция, что следует учитывать, особенно в случае рефрактерного ВН [7,8,15,90- 93].
Таблица 8 — Перечень основных лекарственных средств:
| Фармакотера- певтическая группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности | |
| Глюкокортикоиды | ||||
| Синтетический глюкокортикостероидный гормональный препарат | Метилпреднизолон | Таблетки внутрь 4 мг 2-8 р/ сут, длительно. | УД-А [7,8,10,17-19,22-58,83-88] | |
| Метилпреднизолон | Таблетки внутрь 16 мг 1-3 р/ сут, длительно. | УД-А[7,8,10,17-19,22-58, 83-88] | ||
| Метилпреднизолон | В/в введение, флакон, 250-1000 мг, 30 мин – 1 час ежемесячно курсами до 6 мес | УД-С [7,8,10,17-19,22-58, 83-88] | ||
| Преднизолон,5мг | Таблетки внутрь по 5-15 мг 1-4 р/сут, длительно | УД-А [1,7,8,10,17-19,22,58,83-88] | ||
| Преднизолон | В/в, в/м ампулы 30мг/1мл 3-5 р/сут курсами | УД-А[1,7,8,10,17-19,22-58,83-88] | ||
| Цитостатики | ||||
| Антималярийный препарат | Гидроксихлорохин | Таблетки внутрь 200 — 400 мг, 1-2 р/сут длительно | УД-A[7,8,29-46,74-77, 91] | |
| Иммуносупрессант | Циклофосфамид | Флакон в/в, по 400-1000 мг, 1-2 р/ мес – 3-6 мес | УД-C [7,8,17,22,28-50,57-61,80-85] | |
| Микофенолата мофетил | Таблетки внутрь 500-2000 мг, 1-3 р/ сут, длительно | УД-A [7,8,58-61,80-85] | ||
| Антиметаболит | Метотрексат | Таблетки внутрь 7,5-25 мг внутрь 1 р/нед, длительно. | УД-С [7,8,22-52,62] | |
| Метотрексат | Раствор шприц-ручка 7,5мг, 10, 12,5, 15, 17,5 и шприц 20мг, п/к 1 р/нед, длительно. | УД-С [7,8,56,59,62] | ||
| Иммуносупрессант | Азатиоприн | Таблетки внутрь 50-150 мг 1-3 приема в сутки до 3-6 мес | УД-С[7,8,22-50,55,56,60] | |
| Циклоспорин | Капсула внутрь 50-200мг, 1-2 р/ сут длительно | УД-B [7,8,22-52] | ||
| Нестероидные противовоспалительные препараты | ||||
| Производный уксусной кислоты | Диклофенак | Таблетки внутрь 50-200 мг, 1-2 р/ сут, курсами. | УД-С[7 -10,16,19, 28, 30-34,90-93]. | |
| Диклофенак | В/м, ампула3 мл/75 мг 1-2 р/ сут курсами | УД-С[7 -10,16,19, 28, 30-34,90-93]. | ||
| Производное фенилуксусной кислоты | Ацеклофенак | Таблетки внутрь 100 мг, 1 р/сут, курсами. | УД-С[7 -10,16,19, 28, 30-34,90-93]. | |
| Коксибы | Эторикоксиб | Таблетки внутрь по 60-120 мг, 1-2 р/ сут, курсами. | УД-С[7 -10,16,19, 28, 30-34,90-93]. | |
| Производное оксикама, селективный ингибитор ЦОГ-2 | Лорноксикам | Таблетки внутрь 8-32мг, 1-2 р/сут, курсами. | УД-С[7 -10,16,19, 28, 30-34,90-93]. | |
| Мелоксикам | Таблетки внутрь 7,5-15 мг, 1 р/ сут, курсами. | УД-С[7 -10,16,19, 28, 30-34,90-93]. | ||
| Анальгезирующее средство со смешанным механизмом действия. Список сильнодействующих веществ. | Трамадол | Таблетки внутрь 50-100 мг, 1-4 р/ сут, курсами. | УД-С[7 -10,16,19, 28, 30-34,90-93]. | |
| Трамадола гидрохлорид | Ампулы в/м 50- 100 мг, 1-4 р/сут, курсами. | УД-С[7 -10,16,19, 28, 30-34,90-93]. | ||
| Генно-инженерные-биологические препараты | ||||
| Полностью человеческие моноклональные антитела класса IgGλ | Белимумаб | Флакон в/в, по 120 мг, 1-3 флакона, ежемесячно в течение 6 мес, продолжение стационарного лечения | УД-А[34,35,38,68,69,70-78,94] | |
| Синтетические химерные моноклональные антитела | Ритуксимаб | Флакон в/в, по 500–1000 мг 1 раз в 1–2 нед, максимально2000 мг 1 раз в 6 мес | УД-С[38,64- 66,67,71-75,78- 80,81,87] | |
| Иммуноглобулины | ||||
| Иммуноглобулин человека | Иммуноглобулин человека нормальный | В/в флакон от 0,4 – 2г/кг/сут в течение 4-5 дней | УД-С[7,8,56,65,73,84-89] | |
Перечень дополнительных лекарственных средств (для лечения сопутствующей коморбидной патологии).
При сердечно-сосудистой патологии руководствоваться необходимо действующими клиническими протоколами по кардиологии.
При наличии ишемии миокарда, коронариите: см. клинический протокол диагностики и лечения «ИБС. Стабильная стенокардия напряжения».
Артериальная гипертензия: см. клинический протокол диагностики и лечения «Артериальная гипертензия».
Поражение клапанного аппарата сердца с поражением митрального, аортального и трикуспидального клапанов с развитием недостаточности или стеноза: см. клинический протокол диагностики и лечения «Хроническая сердечная недостаточность».
При нарушении ритма сердца (полная АВ-блокада, пароксизмальная тахикардия, мерцание предсердий, суправентрикулярная тахиаритмия): см. клинический протокол диагностики и лечения «Нарушения проводимости сердца (АВ-блокада)».
Миокардит, эндокардит (вальвулит, вегетации на клапанах): см. клинический протокол диагностики и лечения «Миокардиты».
Легочная гипетензия и синдром Рейно: см. клинический протокол диагностики и лечения «Легочная гипертензия»; «Синдром Рейно»
При поражении легких руководствоваться необходимо действущими клиническими протоколами по пульмонологии: «Пневмония у взрослых (внебольничная пневмония)».
При наличии диспептических явлений и/или длительном применении ГКС, и/или иммунодепрессантов, эзофагите: см. клинический протокол диагностики и лечения «Гастропатии, индуцированные приемом нестероидных противовоспалительных препаратов»; «Гастроэзофагеальная рефлюксная болезнь».
При холестазе, токсическом гепатите, панкреатите: см. клинический протокол диагностики и лечения «Неалкогольная жировая болезнь печени»; «Хронический холецистит»; «Хронический панкреатит».
При нефрите, нефротическом синдроме: см. клинический протокол диагностики и лечения «Нефротический синдром»; «Хроническая болезнь почек (ХБП)».
При поражении нервной системы и психотических расстрйствах: см. клинический протокол диагностики и лечения «Последствие инфаркта мозга»; «Хроническая воспалительная демиелинизирующяя полинейропатия»; «Хроническая ишемия головного мозга».
При нарушении системы гемостаза: см. клинический протокол диагностики и лечения «Железодефицитная анемия»; «Аутоиммунные гемолитические анемии».
Хирургическое вмешательство [1,2,12]: проведение консультации травматолога-ортопеда по показаниям: тунельный синдром для декомпрессии запястного канала. Вмешательство — высвобождение сухожилий.
- Пациенты с СКВ должны находиться под постоянным динамическим наблюдением ревматолога, участкового терапевта или врача общей практики с привлечением специалистов других медицинских специальностей (нефрологи, дерматологи, гематологи, кардиологи, невропатологи, психиатры и др.) и основываться на совместном решении пациента и врача (УД – С).
- У пациентов повышен риск развития летальности в виду наличия коморбидной патологии (сахарный диабет, атеросклероз, интеркуррентные инфекции, злокачественные заболевания), поэтому они подлежать наблюдению вместе с профильными специалистами (УД – С).
- После выписки из медицинского учреждения для них разрабатывается индивидуальный план наблюдения и амбулаторного лечения, от которых во многом зависит как физическая активность пациентов, так и прогноз заболевания. У пациентов с СКВ, не получающих адекватного лечения, инвалидизация развивается уже через 3-5 лет от начала заболевания.
- На каждого пациента заполняется контрольная карта динамического наблюдения. При постановке на учет в амбулаторной карте пациента заполняется графа «первичный эпикриз», в которой отражается характер течения заболевания и его длительность, системные проявления, степень нарушения функции органов, основные лабораторные показатели, данные рентгенологических исследований, развернутый диагноз заболевания, сопутствующие заболевания, а также план лечебных мероприятий и даты контрольных осмотров.
- Для мониторинга за течением заболевания и эффективностью проводимой терапии пациентам СКВ необходимо оценивать: посещение ревматолога 2 раза в 3 месяца (не реже), каждые 3 месяца – общие анализы крови и мочи, биохимический анализ крови.
- Активность СКВ оценивать с помощью индекса SLEDAI2K, которая проводится при каждом визите пациента. Степень повреждения органов с помощью Индекса Повреждения SLICC/ACR — оцениватся 1 раз в год.
- Оценивать наличие сопутствующей патологии при каждом визите и безопасность принимаемых препаратов. Пациенты с СКВ должны быть обследованы на наличие общих и связанных с болезнью факторов риска инфекций, таких как пожилой возраст или синдром старческой астении [УД – D], сахарный диабет [УД – D], поражение почек [УД – B], (особенно стойкая протеинурия и/или СКФ
- Проходить оценку на наличие общих [УД – B, C] и связанных с болезнью факторов риска сердечно-сосудистых заболеваний, включая персистирующее активное заболевание [УД – B]. В зависимости от индивидуального сердечно-сосудистого риска пациентам с СКВ может проводиться профилактика, как и в общей популяции, включая низкие дозы ацетилсалициловой кислоты [УД – D] и/или гиполипидемических препаратов [УД – D].
- При постоянном приеме НПВП, ГКС 1 раз в 6 мес. (по показаниям — чаще) проводится контрольная эзофагогастродуоденоскопия.
- Ежегодно: исследование липидного профиля, денситометрия, офтальмологическое обследование, определение титров аФЛ (при наличии вторичного АФС и планирования беременности), рентгенография костей таза (диагностика асептического некроза головки бедренной кости).
- Мониторинг эффективности терапии оценивается по результатам анализа анти дсДНК, который проводится — 1 раз в год; АФА – контроль 2 раза в год.
- Назначение цитостатиков как в индукционной фазе, так при поддерживающей терапии, биологических препаратов как БЛМ, РТМ должно находиться под постоянным контролем врача-ревматолога или профильного специалиста. Мониторинг безопасности терапии: ОАК (с подсчётом лейкоцитарной формулы) необходим каждые 2 нед в течение 1 — го месяца приёма ЛС, затем — 1 раз в месяц. При достижении эффекта и назначении поддерживающей терапии — 1 раз в 2 месяца (не реже). При достижении ремиссии — 1 раз в год.
- При ухудшении клинико-лабораторных данных (снижении лейкоцитов ниже 4 тыс, тромбоцитов ниже 180 тыс., эритроцитов ниже 3 млн., либо при повышении уровня креатинина, мочевины, билирубина, трансаминаз) решение вопроса экстренной госпитализации.
- Рекомендуется использовать общие методы профилактики (в том числе прививки) и ранней диагностики и лечения инфекций/сепсиса [УД – D]. Необходима вакцинация от гриппа [88].
- Медикаментозная ремиссия, которая поддерживается на фоне терапии (только стабильный прием ГХ и ПЗ ≤5мг/сут, иммунодепрессантов).
- Немедикаментозная – ремиссия, сохраняющаяся без лечения (допускается только прием ГХ).
- Низкая активность СКВ – значение SLEDAI≤4баллов и общая оценка врача PGA (physicianglobalassessment)≤1 балла на фоне приема ГК≤7,5мг/сут, иммуносупрессивных препаратов.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ на стационарном уровне [7 -10, 13-19,21-24,28- 112]
Карта наблюдения пациента, маршрутизация пациента (схемы, алгоритмы)
С учетом факторов риска неблагоприятного исхода болезни предлагается алгоритм по ведению и лечению пациентов с СКВ (см. Амбулаторный уровень, рис. 1).
- Режим II, свободный.
- Стол №15 или 7 (при поражении почек).
- Проводится интенсифицированная терапия с применением высоких доз ГК, цитостатиков, а при необходимости ГИБП, плазмафереза, инфузий внутривенного иммуноглобулина (ВВИГ) [7-10,13,15,17,19, 22,23,28-36,52-112].
Иммуносупрессивная терапия.
ЦФ используется при тяжелом течении СКВ с поражением внутренних органов и при отсутствии эффекта от применения других иммуносупрессантов (УД – C).
Генно-инженерные биологические препараты.
БЛМ: упациентов с высокой иммунологической и клинической активностью (высокий уровень анти–ДНК, снижение С3 и С4 компонентов комплемента, SLEDAI 6-10 баллов), без клинических признаков активного ВН и поражения ЦНС. Рекомендуется применение анти-BLyS терапии БЛМ по 10 мг/кг ежемесячно (УД – А); при отсутствии эффекта от стандартной терапии (комбинация ГХ и ГКС с иммуносупрессантами или без них) и/или при частых обострениях заболевания, невозможности уменьшения дозы ГКС следует использовать БЛМ (УД – A) [7,8, 66,68].
Показания для БЛМ: поражение кожи, слизистых оболочек, суставов, неактивный ВН (протеинурия ≤ 2г), с не критическим уровенем анемии, тромбоцитопении, лейкопении, с частым развитием обострений и с зависимостью от приема средних и высоких доз ГКС, высоким риском развития осложнений от терапии (повреждение органов), инфекции. Первые 3 инфузии по 10 мг/кг веса назначаются в стационаре (0-14-28 день).
РТМ: показано применение пациентам с рефрактерным к терапии поражением жизненно-важных органов и при угрожающих состояниях или при непереносимости/противопоказаниях к стандартным иммуносупрессантам (УД – C) [66,67,71-75,80,81,87].
Показания для РТМ: высокоэффективно у пациентов с СКВ с прогрессирующим ВН (III-IV морфологический тип по классификации ВОЗ) и внепочечными проявлениями болезни (серозит, полиартрит, поражение кожи, стоматит, лихорадка, анемия). Является препаратом выбора у пациентов с критическим течением СКВ, обусловленным тяжелым поражением ЦНС (коматозное состояние, судороги, психоз), а также мультиорганным тромбозом при катастрофическом АФС (КАФС). Предварительные результаты свидетельствуют о высокой эффективности повторных курсов терапии РТМ в случае развития обострения. Назначается РТМ по 500-1000 мг еженедельно (максимальная суммарная доза 2000 мг) (УД – С) 1 раз в 6 мес. Первая инфузия проводится в стационаре с последующим продолжением инфузии с возможной проведением инфузии в стационарозамещающих или стационарных условиях.
- лечение 1-ой линии — ГХ [УД – A], ГКС п/о или в/в [УД – A], МТ или АЗА [УД – B], ИК [УД – B], ММФ [УД – B].
- 2-ой линии — ГХ [УД A], ГКС п/о или в/в [УД – A], БЛМ [УД – А], ИК [УД –С], ММФ [УД – С].
Лечение психоневрологических нарушений [7,8,25,26,29-42,58,82-84,90-94,102-104] обусловленных воспалением, включает ГК/иммуносупрессанты (УД A);при нарушениях связанных с атеротромбозом/аФЛ–антиагреганты/антикоагулянты (УД – C).В случаях тяжелых, жизненно-угрожающих состояний при поражении ЦНС: судороги, поперечный миелит, неврит зрительного нерва, цереброваскулит — рекомендуется в экстренном порядке начать проведение интенсивной терапии инфузии ЦФ по 1000-500 мг и 6 МП по 1000 мг несколько дней подряд с последующим назначением ГКС внутрь 0,5-1,0 мгкгдень (УД – С).
При неэффективности проводимой терапии в течение первых 3-4 дней от начала интенсивного курса рекомендуется назначать РТМ по 500-1000 мг еженедельно (максимальная суммарная доза 2000 мг) (УД – С). Данные рекомендации по применению РТМ при жизненноугрожающем поражении ЦНС основаны на высокой эффективности анти В — клеточной терапии у больных СКВ с развитием комы, каталепсии, поперечного миелита и психоза, в случаях отсутствии эффекта от применения пуль-терапии ГКС, ЦФ, ВВИГ и плазмафереза [1,7,8,71-73,81-85].
Лечение тромбоцитопении включает применение высоких доз ГКС (введение МП в/в) (УД – С) и/или в/в IgG (УД – С). Пациентам с рефрактерным к стандартной терапии гематологическими проявлениями показано лечение РТМ (УД – C) или ЦФ (УД – С).
Почечные проявления (волчаночный нефрит, ВН) [7,8, 61, 64- 73,83-85].
Для начального (индукционного) лечения при люпус нефрите III и IV классов применяют режимы, с началом в стационарных условиях (см.подпункт 3.2).
Пациентам с высоким риском почечной недостаточности (снижение СКФ, гистологические изменения – фиброзные полулуния, фибриноидный некроз, атрофия канальцев или интерстициальный фиброз) показаны аналогичные схемы терапии (п.3.2), а также использование высоких доз ЦФ (УД – A) (высокодозовая схема: 500-1000 мг/м 2 поверхности тела 1 раз в месяц – 6 введений, 6 гр на курс). Для поддерживающей терапии ВН необходимо применять ММФ (УД – А) или АЗА (УД – А). Индукционная терапия ВН V класса с нефротическим синдромом в стационарных условиях (см. Амбулаторный уровень, Медикаментозное лечение)
Выбор терапии от классификационного типа нефрита.
Активный ВН (см.
Амбулаторный уровень, Медикаментозное лечение ).
Резистентный к индукционной терапии ВН:
Замена ММФ на ЦФ или наоборот при отсутствии эффекта от комбинированной терапии в течение 6 мес или обострение через 3 мес после начала терапии + пульс –терапия МП (УД – С); подключение биологической терапии РТМ при отсутствии эффекта от комбинированной терапии ЦФ/ММФ (УД – С); поддерживающая терапия — при достижении клинико-лабораторного эффекта — ММФ 2 г/сут или АЗА по 2 мг/кг в сут (УД – В).
Тактика лечения рефрактерного нефрита: комбинации в/в ведения ЦФ, в том числе мегадозы 0,75–1 г/м2 1 раз в месяц в течение 6 мес, далее 1 раз в 3 мес на протяжении 2–3 лет, или ММФ 2–3 г/сут с ГКС, в/в введение РТМ по 500–1000 мг 1 раз в 1–2 нед, максимально 2000 мг 1 раз в 6 мес, человеческого ВВИГ 0,5–1,0–2,0 г/кг, плазмаферез, иммуноадсорбция, назначение ЦС в виде монотерапии или в комбинации с другими препаратами [7].
В клинической практике применение ВВИГ при СКВ целесообразно в случаях развития иммунодефицита, инфекционных осложнений, а также неэффективности ГКС и иммуносупрессантов, особенно у лиц с аутоиммунными цитопениями, поражением ЦНС, васкулитом и ВН. При ревматических заболеваниях схема введения препарата не стандартизирована, обычно применяются дозы 0,4–2 г/кг в месяц: по 1 г/кг в течение 2 дней или по 0,4 г/кг 5 дней. Курсы лечения повторяют ежемесячно с учетом периода полужизни иммуноглобулина (4 — 6 нед.). При выборе препарата необходимо обращать внимание на содержание IgG (оно должно быть не менее 95%) и IgА (должно быть минимальным) с предварительным определять концентрацию IgA в сыворотке крови пациента (не должно быть его дефицита) во избежание анафилаксии. В очень редких случаях возможно развитие острой почечной недостаточности. До 90% ассоциированных с ВВИГ нарушений функции почек связано с применением препаратов, содержащих сахарозу.
При необходимости, в связи с наличием клинических проявлений активности процесса, повреждении органов, следует включать в программу терапии другие ЛС (антигипертензивные, психотропные,антибактериальные, мочегонные, остеотропные препараты, статины, антикоагулянты, антиагреганты и препараты кальция, гастропротекторы), ВВИГ, свежезамороженная плазма. При поражении ЦНС назначаются седативные, противосудорожные и психотропные препараты. Помимо контроля активности заболевания и предупреждения развития необратимых органных повреждений, лечение должно быть направлено на устранение факторов, отрицательно влияющих на качество жизни, таких как утомляемость, боль и депрессия.
Всем пациентам с СКВ, получающим РТМ (и в сочетании с ЦФ), рекомендуется назначение ко-тримоксазола [сульфаметоксазол +триметоприм] для профилактики развития пневмоцистной пневмонии перорально в дозе 5 мг/кг массы тела в сутки на время лечения РТМ, а также в течение 1 года после его отмены [7, 69-73,87, 89, 96] (УД –D). При появлении катаральных явлений, лихорадки и признаков пневмонии по КТу пациентам с СКВ, получающими РТМ, рекомендуется начать в/в введение ко-тримоксазола [сульфаметоксазол + триметоприм], кларитромицина и цефтриаксона (УД – D). Назначение в/в ко-тримоксазола + триметоприма 15 мг/кг в сутки (по триметоприму), кларитромицина 15 мг/кг в сутки и цефтриаксона 50–100 мг/кг. Всем пациентам с СКВ при выявлении активной герпетической, ЦМВ, Эпштейна–Барр вирусной инфекциирекомендуется назначение ацикловира** 5–10 мг/кгна введение внутривенно каждые 8 ч, или ганцикловира вк (с 12 лет) 5 мг/кг на введение в/в каждые 12 ч в сочетании с ВВИГ, содержащим IgG0,2–0,5 г/кг на курс (УД – D).
Перечень основных лекарственных средств (см. таблицу 8 Амбулаторный уровень).
Перечень дополнительных лекарственных средств: для лечения сопутствующей коморбидной патологии следует руководствоваться соответствующими клиническими протоколами.
Особенности тактики ведения и лечения СКВ у беременных. Назначение стандартной базисной терапии беременным женщинам СКВ
Ведение пациенток с СКВ в период беременности в обязательном порядке проводят врачи-ревматологи совместно с акушерами-гинекологами с привлечением при необходимости врачей других специальностей.
Мониторинг беременной с СКВ рекомендуется проводить ревматологом в каждом триместре (не позднее 10-й, на 21–22-й и 32-й неделе) гестации и в первые 3 мес после родоразрешения (более частые обследования – для беременных группы повышенного риска).
В послеродовом периоде (в случае неосложненных родов) обязательно рекомендуется исследование ОАК и ОАМ, иммунологического анализа крови (АТдс-ДНК, АНФ, С3- и С4-компоненты комплемента), определение уровня суточной протеинурии и СКФ показано больным с поражением почек [18-21].
Лекарственная терапия у пациентов с СКВ во время беременности применяется с осторожностью [7,8,10, 17, 32,34, 49-51,53,56, 63-65, 97].
Глюкокортикостероиды
- ПЗ и другие ГКС короткого действия (преднизон, МП) в дозах (в пересчете на ПЗ) 20 мг/сут относительно безопасны, они большей частью метаболизируются в плаценте, проникая в плодный кровоток в очень незначительном количестве, и не ассоциируются с значительными осложнениями у беременной и аномалиями у плода (УД – А).
- Высокие дозы ГКС ассоциируются с повышенным риском преэклампсии, гипертензии, гестационного диабета, инфекцией и преждевременным вскрытием плодного пузыря.
- Фторсодержащие ГКС (бетаметазон и дексаметазон) проникают через фетоплацентарный барьер практически в неизмененном виде, в связи, с чем их назначение должно ограничиваться лишь теми случаями, когда необходимо достичь повышенной концентрации ГКС в кровотоке плода, например, при неональной волчанке с признаками атовентрикулярной блокады сердца. Из фторсодержащих ГКС при необходимости антенатальной терапии должен предпочитаться бетаметазон, а не дексаметазон (УД – D).
- Грудное вскармливание разрешается при умеренных дозах ГКС короткого действия, при дозах более 40 мг обсуждается возможность грудного вскармливания в пределах 4 часов после приема препарата.
- Применение средних и высоких доз ГКС в настоящее время также не рекомендуется из-за отсутствия доказательной базы их эффективности, а также возможного негативного действия на организм матери и плода.
- Назначение ГКС возможно при вторичном АФС для купирования высокойактивности СКВ, синдрома Шёгрена и ряда других аутоиммунных заболеваний.
- Стрессовые дозы ГКС при родах рекомендуются у пациентов бывших на длительной глюкокортикоидной терапией (УД – D). В случае воздействия в утробе материфторсодержащих ГКС обсуждается постнатальное назначение новорожденным ГКС, если неонатологом подтверждается надпочечниковая недостаточность (УД – D).
- Для купирования суставного синдрома возможно применение низких доз НПВП. Неселективные НПВП и ПЗ могут использоваться во время всей беременности при необходимости контроля за активностью процесса. В I и III триместре возможно с определенными ограничениями (УДВ). Неселективные ингибиторы ЦОГ не тератогенны.
- Селективные ЦОГ-2 отменяются при беременности.
- После 20 недели гестации все НПВП, исключая ацетисалициловую кислоту (АСК) в дозе менее 100 мг/сут, могут вызывать сужение артериального протока и ухудшать функцию почек у плода.
- Все НПВП (кроме АСК в низких дозах) следует отменить на 32 неделе беременности.
- Предлагается прекращение лечения за неделю до планируемого родоразрешения с применением эпидуральной анестезии.
- Кормление грудью непосредственно перед приемом препарата может помочь снизить передачу НПВП младенцу.
- Препарат выбора у фертильных женщин при необходимости терапии (не сопровождается неблагоприятным воздействием на мать и плод).
- Препарат совместим с кормлением грудью
- Цитостатические препараты (ЦФ, МТ, ММФ) противопоказаны при беременности, однако в ряде случаев возможно назначение АЗА и ЦсА. Наиболее безопасной считается ситуация, когда цитостатические препараты отменяют за 6 мес до наступления беременности, а при необходимости проведения иммуносупрессивной терапии ММФ или МТ заменяют на АЗА.
- Грудное вскармливание при терапии цитостатиками не рекомендуется.
- АЗА является самым безопасным базисным препаратом у пациенток, которым необходима дополнительная иммуносупрессивная терапия
- При обострении ВН во время беременности можно использовать АЗА (до 2мг/кг в день), поскольку он метаболизируется плацентой и лишь в малых количествах проникает в кровоток плода.
- При обострении СКВ на позднем сроке III триместра при необходимости может использоваться ЦФ внутривенно.
ВВИГ может применяться при беременности и грудном вскармливании.
ГИБП противопоказаны при беременности и лактации.
- в случае отсутствия активности ВН и внепочечных проявлений СКВ — специальной терапии не требуется
- при минимальной активности -е ГХ 200–400 мг/сут
- при выраженной активности ВН и/или внепочечных проявлениях болезни — ГКС в дозах, позволяющих контролировать течение болезни, при необходимости в комбинации с АЗА.
- Пациенткам с СКВ стоит планировать беременность, только если заболевание контролируется на протяжении 6 месяцев и более.
- Воздержаться от беременности при активном нефрите или креатинине>2мг/дл
- ММФ, ЦФ должны быть отменены минимум за 3 месяца, а биологическая терапия – за 4 месяца до планируемой беременности
- Рекомендуется ведение беременности у пациентки с ВН мультидисциплинарной командой с проведением оценки состояния каждые 4 недели
- Во время беременности пациентки продолжают получать ГХ, АЗА, ПЗ
- АД контролируется без применения иАПФ (тератогенный эффект), с заменой их на лабеталол или нифедипин, как только наступит беременность.
- АСК назначается для профилактики преэклампсии
- Пациентки с нефротическим уровнем протеинурии часто нуждаются в проведении антикоагулянтной терапии
- Пациентки с перенесенным в анамнезе ВН без признаков активности не требуют лечения во время беременности
- Во время беременности необходимо контролировать уровни компонентов комплемента (С3, С4), помня о том, что в норме во время беременности они повышаются
- Мониторинг обострения ВН у беременных осложняется трудностями диагностики с преэклампсией
- После родов пациентки нуждаются в тщательном наблюдении для предупреждения развития почечной недостаточности/обострения, в т.ч. с применением, кроме прочей терапии, ВВИГ в/в, плазмафереза.
- Пациенткам со стойким увеличением концентрации аФЛ рекомендуется лечение ГХ (первичная профилактика тромбозов) (УД D).
- Варфарин отменяют, как только наступит беременность (тератогенный эффект)
- Пациентки со стойким увеличением концентрации аФЛ, имеющих высокий риск тромбоза (периооперационный период, длительная иммобилизация) рекомендуется лечение гепарином (УД – D).
- Беременным с АФС рекомендуется лечение гепарином (нефракционированным или НМГ) с низкими дозами АСК (УД – С) для профилактики неблагоприятных исходов беременности
- Вторичная профилактика тромбоза у женщин с АФС в послеродовом периоде пожизненая и основана на назначении варфарина в дозе с целевым значением МНО> 3,0 при артериальных тромбозах и МНО 2,0-3,0 при венозных (УД – В).
- Низкие дозы АСК и гепарин натрий (5000-7000 ЕД каждые 12 ч) в течение I триместра; 5000—10 000 каждые 12 ч во II и III триместрах до момента родов. Возобновить лечение гепарином через 12 ч после родов в течение 6 нед или НМГ (эноксапарин натрий 40 мг/день или дал-тепарин натрий 5000 ЕД/день). При сохраняющемся риске преждевременных родов следует заменить НМГ на гепарин натрий.
- При изолированном повышении АФЛ (без других критериев АФС) — низкие дозы АСК или НМГ.
- При неэффективности стандартной терапии в период следующей беременности: в/в ВВИГ (0,4 г/кг в течение 5 дней каждого месяца беременности).
- Всем пациенткам, принимающим гепарин, следует назначать кальций (1500 мг/сут) и холекальциферол (800 МЕ/сут) для профилактики ОП.
- тяжелые, жизнеугрожающие состояния (пневмонит, поражение ЦНС, быстропрогрессирующий люпус-нефрит с почечной недостаточностью, резистентный к стандартной терапии ГК и иммуносупрессантами, ассоциированный с криоглобулинемией и развитием гиперкоагуляции, тромботической тромбоцитопенической пурпуры) — от 3 до 5 сеансов (удаление 1500–2500 мл плазмы), интервалы между ними в 2–3 дня, возможно проведение в течение 3 нед;
- поражение ЦНС (кома, сопор, прогрессирующий миелит), высокий уровень антиATds-ДНК иили криоглобулинов в сыворотке крови — ежедневно или через день, с эксфузией 20-30 мл/кг веса плазмы (УД С).
- Асептический некроз головки бедренной кости
- 3–4-й стадия вторичного коксартроза
Дальнейшее ведение [2,3,4,6, 37,39, 54, 96]: см. Амбулаторный уровень
- Медикаментозная – ремиссия, которая поддерживается на фоне терапии (только стабильный прием ГХ и ПЗ ≤5мг/сут, иммунодепрессантов).
- Немедикаментозная – ремиссия, сохраняющаяся без лечения (допускается только прием ГХ).
- Низкая активность СКВ – значение SLEDAI≤4баллов и общая оценка врача PGA (physicianglobalassessment)≤1 балла на фоне приема ГК≤7,5мг/сут, иммуносупрессивных препаратов.
Госпитализация
Показания для госпитализации с указанием типа госпитализации [1,6-8, 15-17]
- Уточнение диагноза, подбор иммуносупрессивной терапии.
- II, III степени активности СКВ при остром и подостром течении.
- Средне-тяжелые и тяжелые (неугрожающие жизни) состояния, развившиеся от побочного действия лекарственной терапии.
- Программное плановое проведение пульс терапии для достижения индукции ремиссии.
- Плановое проведение I и II инфузий ГИБТ.
- III-IV степень активности СКВ с поражением жизненно важных органов с угрожающими жизни состояниями при любом типе течения;
- развитие сопутствующей инфекции;
- развитие цитопении;
- диффузное поражение ЦНС (поперечный миелит, полиневропатии неврит зрительного нерва);
- активные формы волчаночного нефрита;
- тромбозы и тромбоэмболии;
- поражение кожи и слизистых оболочек (более 18% поверхности тела);
- поражение легких (пневмонит, экссудативный плеврит);
- поражение сердца (эндо- и миокардит, перикардит);
- гематологические нарушения: тромбоцитопения (
- осложнения СКВ, проводимой лекарственной терапии с тяжелым поражением внутренних органов и систем.
- сохранении активного ВН;
- полиорганном поражении, наличии большого числа диагностических критериев СКВ по ACR;
- неудаче проведенной агрессивной терапии, развитии осложнений, связанных с СКВ и с токсичностью препаратов;
- не достигнут контроль активности процесса.
Информация
Источники и литература
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2021
- 1. Rheumatology,2-VolumeSet. 7-th Edition.Hochberg M.SilmanA, Smolen J, Weinblatt M, Weisman M. 2018. P.2048 2. Mosca M, Costenbader KH, Johnson SR et al. How do patients with newly diagnosed systemic lupus erythematosus present? A multicenter cohort of early systemic lupus erythematosus to inform the development of new classification cri-teria. Arthritis Rheumatol 2019;71:91–8. 3. Leuchten N, Milke B, Winkler-Rohlfing B. et al. Early symptoms of systemic lupus erythematosus (SLE) recalled by 339 SLE patients. Lupus 2018;27:1431–6. 4. Schmajuk G, Hoyer BF, Aringer M. et al. SLE Classification Criteria Steering Committee and the International SLE Expert Panel of the Initiative. Multicenter Delphi exercise to identify important key items for classifying systemic lupus ery-thematosus. Arthritis Care Res (Hoboken) 2018;70:1488–94. 5. Petri M, Orbai A-M, Alarcón GS, et al. Derivation and validation of the Sys-temic Lupus International Collaborating Clinics. Classification Criteria for systemic lupus erythematosus.Arthr.Rheum.2012;64(8):2677-86.pp.2677-2686. doi: 10.1002/art.34473. 6. Aringer M..Costenbader K.,Daikh D. et al. 2019 European League Against Rheumatism/American College of Rheumatology classification criteria for systemic lupus erythematosus. Ann Rheum Dis. 2019;0:1151-1159.doi.10.1136/anrheumdis-2018-214819. 7. Fanouriakis A., Myrto Kostopoulou, Alessia Alunno et al. 2019 update of the EULAR recommendations for management of systemic lupus erythematosus. Ann Rheum Dis. 2019;78:736-745.doi.10.1136/anrheumdis-2019.215089. 8. НасоновЕЛ, редактор. Российскиеклиническиерекомендации. Ревматоло-гия. Москва:ГЭОТАР-Медиа;2019.С.113-36. 9. PyleК, KennedyL. Diagnosis and treatment in rheumatology. The Problematic Approach; per. from English under the editorship of Shostak NA. Mos-cow:GEOTAR-Media;2011:143-60 10. GordonС, Amissah-ArthurMB, Gayed M. et al. The British Society for Rheuma-tology guideline for the management of systemic lupus erythematosus in adults. Rheumatology,V.57,Issue1,January2018,P.e1–e45, https://doi.org/10.1093/rheumatology/kex286 11. BengtssonAA, Rönnblom L.Systemic Lupus erythematosus:still achellenge for physicians.Intern Med.2017;Jan 281(1):52-64.doi:10.1111/Joim.12529.Epub 2016 Jun 16. 12. Centers for Disease Control and Prevention, National Center for Health Statis-tics. Compressed MortalityFile1999–2016 on CDC WONDER Online Data-base. http://wonder.cdc.gov/cmf-icd10.html. Accessed June 1, 2018. 13. ИсаеваБГ, Асеева ЕА. Системная красная волчанка: диагностические кри-терии, оценка активности и рекомендации по лечению. – Алматы, 2020, С. 176. 14. Diagnosis and classification of the antiphospholipid syndrome / J. A. Gómez-Puerta, R. Cervera // J. Autoimmun. — 2014. — Vol. 48-49.-Р. 20-25. 15. Tektonidou MG, Andreoli L, Limper M, et al. EULAR recommendations for the management of antiphospholipid syndrome in adults. Ann Rheum Dis. 2019;78(10):1296-304. doi: 10.1136/annrheumdis-2019-215213. 16. Johnson S.European League Against Rheumatism and American College of Rheumatology present new SLE classification criteria at the 2017 ACR/ARHP Аn-nual meeting. Presentation at:ACR/ARHP 2017 Annual Meeting;November 3-8, 2017;San Diego. 17. Bertsias GK, Tektonidou MG, Amoura Z.et al. Joint European Leagur Against Rheumatism and European Renal Association-European Dialisis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of adult and pediatriclupusnephritis//AnnRheumDis.2012.Vol.71.P.1771-1782.doi:0.1136/annrheumdis-2012-201940. 18. Weening JJ, D’Agati VD, Schwartz MM, et al. The classification of glomerulo-nephritis in systemic lupus erythematosus revisited. Kidney Int. 2004;65(2):521-30. doi: 10.1111/j.1523-1755.2004.00443.x. 19. Hahn B.N., McMahon M.A,Wilkinson A et al. American College of Rheumatol-ogy guidelines for screening, treatment, and management of lupus nephri-tis//Arthritis Care Res. (Hoboken). 2012. Vol.64.P.797-808. 20. Gladman DD, Ibanez D,Urowitz MB. Systemic lupus erythematosus disease activity index 2000. J. Rheumatol 2002; 29:288–91. 21. Rijnink EC, Teng YKO, Wilhelmus S, et al. Clinical and histopathologic charac-teristics associated with renal outcomes in lupus nephritis.Clin J AmSocNephrol. 2017;12(5):734-43. 22. Jung J-H, Soh M-S, Ahn Y-H, et al. Thrombocytopenia in systemic lupus ery-thematosus: clinical manifestations, treatment, and prognosis in 230 patients. Med-icine (Baltimore). 2016;95(6). 23.Chaturvedi S, Arnold DM, McCrae KR. Splenectomy for immune thrombocyto-penia: down but not out. Blood. 2018;131(11):1172-82. 24. Duarte-Garcia A, Barr E, Magder LS, et al. Predictors of incident proteinuria among patients with SLE. Lupus Sci Med. 2017;4(1). 25. Pisetsky DS, Bossuyt X, Meroni PL. ANA as an entry criterion for the classifi-cation of SLE. Autoimmun Rev. 2019 Oct 19:102400. doi: 10.1016/j.autrev.2019.102400. 26. Agmon-Levin N, Damoiseaux J, Kallenberg C, et al.International recommenda-tions for the assessment of autoantibodies to cellular antigens referred to as anti-nuclear antibodies. Ann Rheum Dis. 2014;73:17-23. doi: 10.1136/annrheumdis-2013-203863. 27. Choi MY, Clarke AE, St Pierre Y, et al. Antinuclear antibodynegative systemic lupus erythematosus in an international inception cohort. Arthritis-CareRes (Hoboken). 2019;71(7):893-902.doi: 10.1002/acr.23712. 28.СоловьевСК,АсееваЕА,ПопковаТВидр.Системнаякраснаяволчанка: но-выегоризонтыдиагностикиитерапии.Научно-практическаяревматология.2020;58(1):5-14. 29.Gatto M, Zen M, Iaccarino L, Doria A. New therapeutic strategiesin systemic lupus erythematosus management. Nat RevRheumatol. 2019;15(1):30-48. doi: 10.1038/s41584-018-0133-2 30.Mosca M, Boumpas D, Bruce IN, et al. Treat-to-target in systemic lupus ery-thematosus: where are we today? ClinExp.Rheumatol. 2012;30(suppl.73): S112-115. 31.Клюквина НГ. Алгоритм лечения системной красной волчанки. Современ-ное состояние проблемы. Медицинский совет. 2016;(8):99-105 32.Andreoli L, Bertsias GK, Agmon-Levin N, et al. EULAR recommendations for women’s health and the management of family planning, assisted reproduction, pregnancy and menopause in patients with systemic lupus erythematosus and/or antiphospholipid syndrome. Ann Rheum Dis. 2017;76(3):476-85. 33. Boumpas DT, Bertsias GK, Fanouriakis A.2008–2018: a decade of recommen-dations for systemic lupus erythematosus. Ann.Rheum Dis.2018;77(11):1547-8. doi: 10.1136/annrheumdis-2018-214014. 34.Van der Heijde D, Aletaha D, Carmona L. 2014 Update of the EULAR stand-ardised operating procedures for EULAR-endorsed recommendations. Ann Rheum Dis. 2015;74(1): 8-13. doi: 10.1136/annrheumdis-2014-206350 35.Van Vollenhoven R, Voskuyl A, Bertsias G, et al. A framework for remission in SLE: consensus findings from a large international Task Force on definitions of re-mission in SLE (DORIS). Ann Rheum Dis. 2017;76(3):554-61. doi: 10.1136/annrheumdis-2016- 209519. 36.СоловьевСК,АсееваЕА,ПопковаТВидр.Стратегиялечениясистемнойкраснойволчанки≪додостиженияцели≫(Treat-to-TargetSLE). Рекомендациимеждуна-роднойрабочейгруппыикомментариироссийскихэкспертов.Научно-практическаяревматология. 2015;53(1): 9-16 37.Medina-QuinonesCV, Ramos-MerinoL, Ruiz-SadaP, etal. Analysis of complete remission in systemic lupus erythematosus patients over a 32-year period. Arthritis Care Res (Hoboken).2016;68(7):981-7. doi: 10.1002/acr.22774 38.Steiman AJ, Urowitz MB, Ibanez D, et al. Prolonged clinical remission in pa-tients with systemic lupus erythematosus. J Rheumatol.2014;41(9):1808-16. doi: 10.3899/jrheum.131137 39.Ugarte-Gil MF, Wojdyla D, Pons-Estel GJ, et al. Remission and low disease ac-tivity status (LDAS) protect lupus patients from damage occurrence: data from a multiethnic, multinational Latin American lupus cohort (GLADEL). Ann Rheum Dis.2017;76(12):2071-4. doi: 10.1136/annrheumdis-2017-211814 40.Tsang-A-Sjoe MWP, Bultink IEM, Heslinga M, et al. Both prolonged remission and lupus low disease activity state are associated with reduced damage accrual in systemic lupus erythematosus. Rheumatology (Oxford).2017;56(1):121-8. doi: 10.1093/rheumatology/ kew377 41. Zen M, Iaccarino L, Gatto M, et al. Lupus low disease activity state is associ-ated with a decrease in damage progression in Caucasian patients with SLE, but overlaps with remission. Ann Rheum Dis. 2018;77(1):104-10. doi: 10.1136/annrheumdis-2017- 211613 42. Polachek A, Gladman DD, Su J, et al. Defining low disease activity in systemic lupuserythematosus.ArthritisCareRes (Hoboken).2017;69(7):997-1003.doi: 10.1002/acr.23109 43. Tselios K, Gladman DD, Touma Z, et al. Clinical remission and low disease activity have comparable outcomes over 10 years in systemic lupus erythematosus. Arthritis Care Res (Hoboken).2019;71(6):822-8. doi: 10.1002/acr.23720 44. IudiciM, PantanoI, FasanoS, etal. Health status and concomitant prescription of immunosuppressants are risk factors for hydroxychloroquine non-adherence in systemic lupus patients with prolonged inactive disease. Lupus. 2018;27(2):265-72. doi: 10.1177/0961203317717631. 45. Mok CC, Penn HJ, Chan KL, et al. Hydroxychloroquine serum concentrations and flares of systemic lupus erythematosus: a longitudinal cohort analysis. Arthritis Care Res (Hoboken). 2016;68(9):1295-302. doi: 10.1002/acr.22837. 46. Kim J-W, Kim YY, Lee H, et al. Risk of retinal toxicity in longterm users of hydroxychloroquine. J Rheumatol. 2017;44(11):1674-9. 47. Mackay M, Dall’Era M, Fishbein J, et al. Establishing surrogate kidney end-points for lupus nephritis clinical trials: development and validation of a novel ap-proach to predict future kidney outcomes. Arthritis Rheum. 2019;71(3):411-9. doi: 10.1002/art.40724 48. Franklyn K, Lau CS, Navarra SV, et al. Definition and initial validation of a lupus low disease activity state (LLDAS). AnnRheum. Dis. 2016;75(9):1615-21. doi: 10.1136/annrheumdis-2015-207726. 49. СоловьевСК, АсееваЕА, ЗоткинЕГидр. Проблемы низкой активности и ремиссии при системной красной волчанке. Научно-практическая ревматоло-гия. 2019;57(2):218-21. 50. Keeling SO, Alabdurubalnabi Z, Avina-Zubieta A, et al. Canadian Rheumatol-ogy Association Recommendations for the Assessment and Monitoring of Systemic Lupus Erythematosus. J Rheumatol. 2018;45(10):1426-39. 51. Bruce IN, O’Keeffe AG, Farewell V, et al. Factors associated with damage ac-crual in patients with systemic lupus erythematosus: results from the systemic lu-pus international collaborating clinics (SLICC) inception cohort. Ann Rheum Dis. 2015;74(9):1706-13. 52. Chen H-L, Shen L-J, Hsu P-N, et al. Cumulative burden of Glucocorticoid-related adverse events in patients with systemic lupus erythematosus: findings from a 12-year longitudinal study. J Rheumatol. 2018;45(1):83-89. 53. Al Sawah S, Zhang X, Zhu B, et al. Effect of corticosteroid use by dose on the risk of developing organ damage over time in systemic lupus erythematosus – the Hopkins Lupus Cohort. Lupus Sci Med. 2015 Mar;2(1):e000066. 54. Ruiz-Arruza I, Barbosa C, Ugarte A, et al. Comparison of high versus low-medium prednisone doses for the treatment of systemic lupus erythematosus pa-tients with high activity at diagnosis. Autoimmun Rev. 2015;14(10):875-9. 55. Ruiz-Irastorza G, Ugarte A, Saint-Pastou Terrier C, et al. Repeated pulses of methylprednisolone with reduced doses of prednisone improve the outcome of class III, IV and V lupus nephritis: an observational comparative study of the Lupus- Cruces and lupus-Bordeaux cohorts. Autoimmun Rev. 2017;16(8):826-32. 56. Pego-Reigosa JM, Cobo-Ibanez T, Calvo-Alen J, et al. Efficacy and safety of nonbiologic immunosuppressants in the treatment of nonrenal systemic lupus ery-thematosus: a systematic review. Arthritis Care Res (Hoboken). 2013;65(11):1775-85. 57. Tamirou F, Husson SN, Gruson D, et al. Brief report: The Euro- Lupus low-dose intravenous cyclophosphamide regimen does not impact the ovarian reserve, as measured by serum levels of antimullerian hormone. Arthritis Rheum. 2017;69(6):1267-71. 58. Gupta N, Ganpati A, Mandal S, et al. Mycophenolate mofetil and deflazacort combination in neuropsychiatric lupus: a decade of experience from a tertiary care teaching hospital in southern India. Clin Rheumatol. 2017;36(10):2273-9. 59. Tselios K, Gladman DD, Su J, et al. Mycophenolate mofetil in nonrenal mani-festations of systemic lupus erythematosus: an observational cohort study. J Rheumatol. 2016;43(3):552-8. 60. Ordi-Ros J, Saez-Comet L, Perez-Conesa M, et al. Enteric-coated mycopheno-late sodium versus azathioprine in patients with active systemic lupus erythemato-sus: a randomised clinical trial. Ann Rheum Dis. 2017;76(9):1575-82. 61. Walsh M, Solomons N, Lisk L, et al. Mycophenolate mofetil or intravenous cyclophosphamide for lupus nephritis with poor kidney function: a subgroup anal-ysis of the Aspreva lupus management study. Am J Kidney Dis. 2013;61(5):710-5. 62. Sakthiswary R, Suresh E. Methotrexate in systemic lupus erythematosus: a systematic review of its efficacy. Lupus. 2014; 23:225-35. 63. Knight JH, Howards PP, Spencer JB, et al. Characteristics related to early sec-ondary amenorrhoea and pregnancy among women diagnosed with systemic lupus erythematosus: an analysis using the goal study. Lupus Sci Med. 2016;3(1). 64. Cobo-Ibanez T, Loza-Santamaria E, Pego-Reigosa JM, et al. Efficacy and safe-ty of rituximab in the treatment of non-renal systemic lupus erythematosus: a sys-tematic review. Semin Arthritis Rheum. 2014;44(2):175-85. 65. Rovin BH, Furie R, Latinis K, et al. Efficacy and safety of rituximab in pa-tients with active proliferative lupus nephritis: The Lupus nephritis assessment with rituximab study. Arthritis Rheum. 2012;64(4):1215-26. 66. Furie R, Petri M, Zamani O, et al. A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum. 2011;63(12):3918-30. 67. Navarra SV, Guzman RM, Gallacher AE, et al. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebocontrolled, phase 3 trial. Lancet. 2011;377(9767):721- 31. 68. Iaccarino L, Andreoli L, Bocci EB, et al. Clinical predictors of response and discontinuation of belimumab in patients with systemic lupus erythematosus in real life setting. Results of a large, multicentric, nationwide study. J Autoimmun. 2018; 86:1-8. 69. Duxbury B, Combescure C, Chizzolini C. Rituximab in systemic lupus ery-thematosus: an updated systematic review and metaanalysis. Lupus. 2013;22(14):1489-503.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТКОЛА
Список разработчиков протокола с указанием квалификационных данных:
- Исаева Бакытшолпан Габдулхакимовна – доктор медицинских наук, ревматолог, профессор кафедры ревматологии НАО «Казахский Национальный медицинский университет им. С.Д.Асфендиярова».
- Омарбекова Жазира Есенгельдиевна – кандидат медицинских наук, ревматолог, ТОО «Нейролаб».
- Сапарбаева Майра Максутовна – ревматолог, ассистент кафедры ревматологии НАО «Казахский Национальный медицинский университет им. С.Д.Асфендиярова».
- Кайыргали Шарбану Максотовна – магистр медицинских наук, ревматолог, и.о. заведующей клинико-диагностического отделения городского ревматологического центра г. Алматы.
- Ахметова Жаркынай Сметовна – ревматолог, заместитель директора городского ревматологического центра г. Алматы
- Ералиева Бибихан Абдалиевна — кандидат медицинских наук, клинический фармаколог, заведующая кафедрой общей и клинической фармакологии АО «Казахский медицинский университет непрерывного образования».
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
- Абишева Сауле Тлеубаевна – доктор медицинских наук, ревматолог , профессор, заведующая кафедрой «Семейная медицина № 1» НАО «Медицинский университет Астана».
Указание условийпересмотра протокола: пересмотр протокола через 5 летпосле его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Глюкокортикостероиды при системной красной волчанке: перспективы стероидосберегающей терапии
Новиков П.И. Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва , Моисеев С.В. Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
DOI 10.32756/0869-5490-2022-4-18-27 Количество просмотров 524 Скачать статью в PDF
Разработка и внедрение в клиническую практику глюкокортикостероидов (ГКС) стали одним из самых больших достижений медицины XX века, сопоставимым по значению с открытием инсулина или антибиотиков. Однако одновременно с противовоспалительной активностью ГКС были описаны многочисленные нежелательные эффекты препаратов этой группы, которые развиваются даже при их применении в низких дозах. ГКС остаются одним из основных компонентов лечения у пациентов с системной красной волчанкой (СКВ). Изучение геномных и негеномных механизмов действия ГКС обосновывает их применение в более низких стартовых дозах (не более 30-40 мг/сут), в том числе при наличии волчаночного нефрита. Чтобы обеспечить возможность быстрого снижения дозы ГКС вплоть до полной их отмены у пациентов с СКВ, целесообразно проводить пульс-терапию метилпреднизолоном и назначать гидроксихлорохин и иммуносупрессивные препараты. Разрабатываются также новые препараты, обладающие стероидосберегающей активностью, такие как ингибиторы рецептора интерферонов I типа (анифролумаб) и ингибиторы кальциневрина (воклоспорин), эффективность которых установлена у пациентов с активной СКВ и волчаночным нефритом, соответственно.
Метки статьи
В середине 30-х гг. прошлого столетия Edward Kendall (США) и Tadeus Reichstein (Швейцария) выделили кортикостероиды из коры надпочечников, а в 1948 г. Philip Hench, руководивший отделением ревматологии в клинике Мейо (США), впервые ввел кортизон прикованной к инвалидному креслу 29-летней пациентке с ревматоидным артритом, которая уже после первых инъекций смогла ходить. В 1950 г. три ученых были удостоены Нобелевской премии по физиологии и медицине за открытие гормонов коры надпочечников. Вскоре глюкокортикостероиды (ГКС) стали широко применять для лечения не только ревматоидного артрита, но и системной красной волчанки (СКВ) и других ревматических заболеваний, хотя уже в 1951 г. были описаны побочные эффекты длительной терапии ГКС в группе пациентов с ревматоидным артритом (отеки, округлость лица, тахикардия, артериальная гипертония и бессонница) [1]. В нашей стране первый опыт применения ГКС для лечения СКВ был опубликован в 1960 г. Е.М. Тареевым и В.А. Насоновой, которые отмечали не только эффективность, но и недостатки препаратов этой группы, в том числе риск развития стероидозависимости и нежелательных эффектов [2]. Е.М. Тареев говорил о необходимости пройти между Сциллой и Харибдой при лечении ГКС, т.е. подавить активность болезни и в то же время избежать осложнений [3]. Спустя 70 лет ГКС сохраняют ведущие позиции в лечении многих системных иммуновоспалительных заболеваний, хотя не прекращаются попытки ограничить их применение, прежде всего из-за побочных эффектов, которые в ряде случаев нивелируют пользу терапии.
Механизмы действия и место глюкокортикостероидов в лечении СКВ
ГКС дают быстрый эффект, который обычно проявляется уже в первые дни после начала приема, и, наряду с гидроксихлорохином, остаются одним из компонентов терапии у пациентов с любыми проявлениями СКВ [4]. Величина стартовой дозы и скорость ее снижения зависят от активности заболевания и наличия и тяжести поражения внутренних органов, прежде всего почек и центральной нервной системы. В последних рекомендациях EULAR по лечению СКВ (2019 г.) рекомендуемые стартовые дозы ГКС не указаны, однако в одновременно опубликованных рекомендациях по лечению волчаночного нефрита отмечено, что начальные дозы преднизолона для приема внутрь составляют 0,30,5 мг/кг [5]. Таким образом, у большинства пациентов с СКВ, в том числе с поражением почек, начинать лечение преднизолоном целесообразно в дозе не более 30-40 мг/сут. Стартовую дозу желательно постепенно снизить по крайней мере до 7,5 мг/сут в течение 3-6 мес. Чтобы обеспечить эффективность относительно невысоких стартовых доз ГКС и возможность более быстрого их снижения, эксперты EULAR рекомендуют два подхода, которые не исключают друг друга: (1) внутривенное введение метилпреднизолона в дозе от 250 до 1000 мг/сут на протяжении 3 дней и (2) применение иммуносупрессивных препаратов (метотрексат, азатиоприн, циклофосфамид, ингибиторы кальциневрина и др.) [4]. У пациентов со средне-тяжелым и тяжелым течением СКВ последние целесообразно назначать уже на первом этапе терапии. Например, лечение волчаночного нефрита предполагает применение ГКС в сочетании с циклофосфамидом в низкой дозе (500 мг каждые 2 недели в течение 3 мес) или микофенолатом мофетилом (2-3 г/сут).
Обоснованием современных схем применения ГКС являются представления о механизмах противовоспалительного действия препаратов этой группы, которые разделяют на геномные и негеномные [6]. Геномные эффекты ГКС опосредуются цитозольными глюкокортикоидными рецепторами, с которыми они связываются после прохождения через клеточную мембрану. Образующийся комплекс ГКС с рецептором проникает в ядро клетки, ингибирует активность различных факторов транскрипции и вызывает снижение синтеза провоспалительных цитокинов, таких как интерлейкин (ИЛ)-6 и фактор некроза опухоли α. Этот эффект ГКС называют трансрепрессией. При увеличении концентрации ГКС в цитоплазме они взаимодействуют с определенными последовательностями ДНК (глюкокортикоид-отвечающими элементами) и активируют транскрипцию некоторых генов, в том числе участвующих в обмене веществ. Полагают, что этот процесс – трансактивация – в основном опосредует нежелательные эффекты ГКС, такие как усиление глюконеогенеза, инсулинорезистентность, ингибирование костеобразования и др. [7], хотя механизмы противовоспалительного и токсического действия ГКС не следует трактовать упрощенно. Например, трансактивация сопровождается индукцией ИЛ-10, который подавляет прововоспалительные цитокины, а некоторые побочные эффекты ГКС могут быть связаны с трансрепрессией [6].
Негеномные эффекты ГКС опосредуются их взаимодействием с глюкокортикоидными рецепторами, расположенными в цитоплазме или связанными с мембранами, и неспецифическим взаимодействием с клеточными мембранами. Комплекс ГКС с цитозольным рецептором может оказывать прямое блокирующее действие (т.е. независимо от транскрипции) на фосфолипазу А2 и образование арахидоновой кислоты, в то время как активация мембранных рецепторов вызывает снижение активности лимфоцитов за счет р38 митогенактивируемой протеинкиназы [8]. Неспецифическое взаимодействие ГКС с оболочками иммунных клеток приводит к ингибированию образования АТФ и снижению клеточной активности. Негеномное действие ГКС начинается очень быстро (в течение 15 мин), так как оно не предполагает модуляцию транскрипции генов и синтез белков.
Возможность нарастания противовоспалительного действия, опосредованного геномными механизмами, при увеличении дозы ГКС зависит от степени насыщения глюкокортикоидных рецепторов (рис. 1) [9]. При применении низких доз ГКС, эквивалентных ≤7,5 мг преднизолона, степень связывания рецепторов составляет менее 50%. Противовоспалительная активность таких доз ГКС небольшая, однако она достаточна для поддерживающей терапии, направленной на сохранение достигнутой ремиссии иммуновоспалительного заболевания. При назначении средних доз ГКС (от 7,5 до 30 мг в пересчете на преднизолон) степень насыщения глюкокортикоидных превышает 50% и прогрессивно увеличивается, что позволяет использовать указанные дозы для стартовой терапии. Степень насыщения рецепторов достигает 100% при увеличении дозы ГКС примерно до 100 мг/сут, однако сегодня такие дозы не используются в клинической практике из-за высокой токсичности. Как видно на рис. 1, степень связывания глюкокортикоидных рецепторов близка к максимальной при применении ГКС в дозах 30-40 мг/сут. Это означает, что применение более высоких доз пероральных ГКС чаще всего не имеет смысла, так как не позволяет достичь значительного усиления геномного действия этих препаратов, в то время как увеличение их кумулятивной дозы приводит к более частому развитию побочных эффектов.
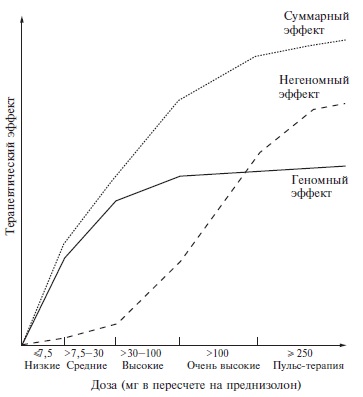
Дополнительный противовоспалительный эффект очень высоких доз ГКС опосредуется негеномными механизмами, что послужило основанием для внедрения пульс-терапии, т.е. кратковременного (в течение 13 дней) внутривенного введения метилпреднизолона в дозе ≥250 мг/сут, которое обеспечивает быстрый и выраженный противовоспалительный эффект и позволяет проводить терапию пероральными ГКС в более низких дозах и, соответственно, уменьшить их побочные эффекты, обусловленные геномными механизмами. По негеномной активности метилпреднизолон и дексаметазон в несколько раз превосходят преднизолон, поэтому для пульс-терапии предпочительно применять первые два препарата [10]. В рекомендациях EULAR метилпреднизолон предлагается вводить в дозе до 1000 мг/сут (суммарная доза 3000 мг), хотя результаты ряда исследований свидетельствуют о том, что дозы 250-500 мг/сут не менее эффективны и более безопасны при обострениях СКВ [11-13]. Некоторые авторы считают возможным вводить метилпреднизолон и в более низкой дозе – 125 мг [6]. Четких рекомендаций по выбору доз метилпреднизолона для пульс-терапии у пациентов с СКВ нет, поэтому этот вопрос следует решать индивидуально с учетом активности заболевания и тяжести висцеральных проявлений. Необходимо отметить, что пульс-терапия показана не всем пациентам с СКВ и обоснована только при средней или высокой активности заболевания [4].
Нежелательные эффекты глюкокортикостероидов
ГКС вызывают многочисленные побочные эффекты, включая кушингоид, ожирение, стрии, остеопороз и остеонекроз, сахарный диабет, дислипидемию, катаракту, артериальную гипертонию и др., риск развития которых зависит от дозы и длительности лечения, т.е. кумулятивной дозы (рис. 2) [14]. J. Curtis и соавт. с помощью почтового опроса изучили частоту основных нежелательных эффектов ГКС у 2446 пациентов (средний возраст 53±14 лет, 71% женщин) с различными заболеваниями, включая СКВ, получавших препараты этой группы в средней дозе 16±14 мг в пересчете на преднизолон в течение по крайней мере 60 дней [15]. По крайней мере одно нежелательное явление при лечении ГКС отметили более 90% респондентов. Наиболее распространенными побочными эффектами ГКС были увеличение массы тела, изменения кожи (истончение, синяки, акне) и расстройства сна, а также катаракта (15%) и переломы костей (12%). Риск побочного действия ГКС зависел от дозы и длительности лечения. В задачи настоящей публикации не входило обсуждение всех возможных побочных эффектов ГКС, поэтому ниже рассматриваются лишь некоторые из них.
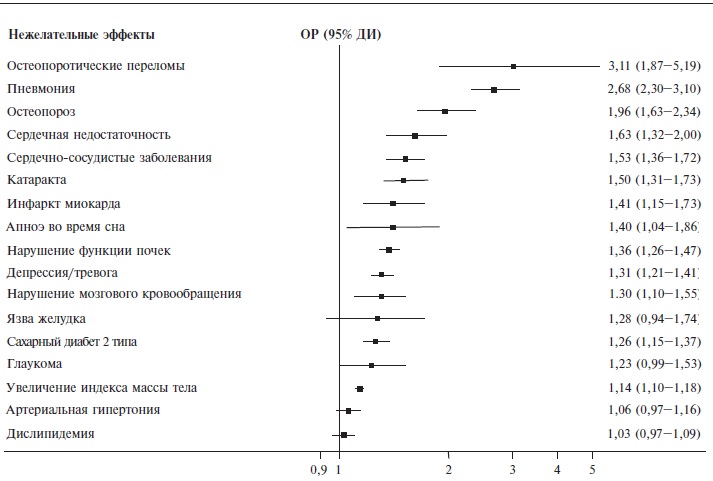
Одним из серьезных побочных эффектов ГКС является остеопороз, хотя при иммуновоспалительных ревматических заболеваниях, таких как СКВ, в патогенезе его играют роль различные факторы, в том числе возраст, пол, гормональные расстройства, воспаление и др. [16]. По данным мета-анализа 31 исследования, частота остеопороза, подтвержденного при денситометрии, у 3089 пациентов с СКВ составила 16%, а наличие его ассоциировалось с кумулятивной дозой и длительностью терапии ГКС, а также возрастом больных, длительностью заболевания и менопаузой [17]. Относительный риск развития остеопороза у больных СКВ был в 2,03 (95% доверительный интервал 1,33– 3,10, р=0,001) раза выше, чем в контрольной группе. Выраженный остеопороз нередко осложняется переломами позвонков и других костей, частота которых у пациентов с СКВ увеличивается в 1,2-4,7 раза [18]. В разных исследованиях переломы позвонков наблюдали у 18-50% больных СКВ. При мета-анализе 21 исследования было показано, что риск любых переломов у пациентов с СКВ увеличен в 2,07 раза (p<0,001), в том числе шейки бедра в 1,99 раза (p<0,001), остеопоротических переломов в 1,36 раза (p<0,001) и переломов позвонков в 2,97 раза (p<0,001) [19]. В крупном популяционном исследовании одним из факторов риска перелома было применение ГКС в течение предыдущих 6 мес [20]. Риск переломов значительно увеличивается при лечении ГКС в дозе более 7,5 мг в пересчете на преднизолон [21], хотя частота переломов повышается и при применении ГКС в более низких дозах [22]. После отмены пероральных ГКС риск переломов быстро снижается до исходного уровня [22].
К тяжелым осложнениям лечения ГКС относится аваскулярный остеонекроз, нередко мультифокальный, частота которого у пациентов с СКВ составляет 10-15% [23]. У 90% больных наблюдается двустороннее повреждение головок бедренных костей. Остеонекроз сопровождается болью и ограничением подвижности в суставах, хотя возможно и бессимптомное его течение. Патогенез остеонекроза изучен недостаточно, а в развитии его могут играть роль не только ГКС, но и другие факторы, в том числе специфичные для СКВ. В пользу последней гипотезы свидетельствует тот факт, что остеонекроз у пациентов с СКВ встречается чаще, чем у пациентов с другими заболеваниями, требующими лечения ГКС [24].
Лечение любыми иммуносупрессивными препаратами, включая ГКС, сопровождается повышением риска развития инфекционных осложнений, которые остаются ведущей причиной смертности пациентов с СКВ, в том числе в экономически развитых странах [25]. По данным анализа американской базы данных Medicaid, среди 33565 пациентов с СКВ частота серьезных инфекций составила 10,8 на 100 пациенто-лет, а среди больных волчаночным нефритом – 23,9 на 100 пациенто-лет [26]. У пациентов, получавших ГКС, риск инфекционных осложнений был в 1,5 раза выше, чем у больных, которые никогда не принимали препараты этой группы. Следует отметить, что лечение гидроксихлорохином, наоборот, ассоциировалось со снижением риска развития инфекций. Сходные данные были получены и в других исследованиях. Например, при мета-анализе 26 клинических исследований у 2611 пациентов с волчаночным нефритом самое значительное увеличение частоты тяжелых инфекций было выявлено при лечении ГКС в высоких дозах, в то время как частота инфекционных осложнений была ниже при лечении некоторыми иммуносупрессивными препаратами, такими как такролимус, микофенолат мофетил и азатиоприн [27]. Увеличение риска инфекций было отмечено даже при применении ГКС в низких дозах. Например, в японском исследовании частота серьезных инфекций у пациентов, получавших преднизолон в дозе 5,0-7,5 мг/сут, была достоверно выше, чем у больных, у которых доза препарата составляла 0-2,5 мг (скорректированное отношение рисков 6,80, 95% доверительный интервал 2,17-21,27) [28].
У пациентов с СКВ риск развития сердечно-сосудистых осложнений в 2-3 раза выше, чем в общей популяции [29], а сердечно-сосудистые заболевания, наряду с инфекциями и злокачественными опухолями, являются основной причиной смерти таких больных [30]. Увеличение риска сердечно-сосудистых осложнений при СКВ, как и других иммуновоспалительных заболеваниях, объясняется различными причинами, включая персистирующее воспаление, которое способствует развитию эндотелиальной дисфункции и повреждения сосудов. ГКС вызывают повышение АД и различные метаболические нарушения, которые вносят вклад в повышение сердечно-сосудистого риска у пациентов с СКВ. По данным систематизированного обзора клинических исследований, применение ГКС в высоких дозах было независимым предиктором сердечно-сосудистых осложнений, утолщения интимы-медии сонных артерий, образования бляшек, кальциноза коронарных артерий и увеличения жесткости артерий [31]. Увеличение риска развития субклинического атеросклероза было выявлено и при мета-анализе клинических исследований, в которых оценивали состояние сонных артерий у пациентов с СКВ [32]. Одним из факторов, способствовавших утолщению интимы-медии сонных артерий и образованию атеросклеротических бляшек, было лечение ГКС.
Какова безопасная доза глюкокортикостероидов и возможна ли их отмена при СКВ?
Целью лечения СКВ является достижение полной ремиссии заболевания, которая, в соответствии с критериями EULAR, характеризуется отсутствием клинической активности на фоне приема только гидроксихлорохина [4]. На практике более реалистичной целью терапии представляется низкая активность СКВ: счет SLEDAI ≤4 на фоне приема гидроксихлорохина, преднизолона в дозе ≤7,5 мг/сут и/или хорошо переносимых иммуносупрессивных препаратов в стабильных дозах. В американской когорте вероятность достижения низкой активности СКВ у пациентов европеоидной расы составила 52% через 1 год и 93% через 5 лет, а у больных волчаночным нефритом – 33% и 89%, соответственно [33]. Доза преднизолона 7,5 мг/сут считается относительно безопасной, хотя результаты ряда исследований свидетельствуют о том, что применение ГКС даже в более низких дозах сопровождается увеличением риска различных побочных эффектов, в частности инфекционных осложнений и остеопороза. Кроме того, кумулятивная доза ГКС зависит не только от величины поддерживающей дозы, но и длительности ее применения. Эти данные свидетельствуют о том, что абсолютно безопасной дозы ГКС не существует, поэтому в идеале необходимо стремиться к полной их отмене, хотя прекращение терапии может привести к развитию обострения СКВ.
А. Mathian и соавт. в 12-месячном рандомизированном клиническом исследовании изучали последствия отмены преднизолона у 124 пациентов с СКВ, у которых в течение года отсутствовала активность СКВ, а поддерживающая доза препарата составляла 5 мг/сут [34]. Продолжение приема преднизолона в дозе 5 мг/сут в течение 1 года сопровождалось более низким риском обострений СКВ, в том числе средне-тяжелых и тяжелых, по сравнению с таковым у пациентов, прекративших прием препарата (7% и 27%, соответственно). L. Ji и соавт. провели мета-анализ исследований, в которых изучалась возможность отмены ГКС в целом у 738 пациентов с СКВ [35]. Частота обострений заболевания после прекращения приема ГКС составила 24%, в том числе серьезных – 13%, а средний срок до развития обострения – около 21 мес. Отмена ГКС сопровождалась увеличением риска любых обострений СКВ на 38% (относительный риск 1,38; 95% доверительный интервал 1,01-1,89), в то время как повышение риска серьезных обострений не достигло статистической значимости. Те же авторы показали, что риск обострения СКВ после прекращения терапии ГКС был выше у пациентов молодого возраста, но не зависел от пола, длительности болезни, ремиссии и лечения ГКС, а также приема иммуносупрессивных препаратов [36]. Вероятность обострения снижалась при лечении гидроксихлорохином, хотя этот эффект был недостоверным. Помимо возраста, фактором риска развития обострения СКВ после отмены ГКС является сохранение серологических признаков активности (антител к дсДНК и/или гипокомплементемии) несмотря на отсутствие клинических проявлений заболевания [37,38]. Интересные результаты получили Y. Hao и соавт. в клиническом исследовании у 139 пациентов с СКВ, достигших низкой активности или ремиссии заболевания [39]. Безрецидивная выживаемость, рассчитанная с помощью метода Каплана-Мейера, у больных, прекративших прием ГКС, была значительно ниже, чем у пациентов, продолживших лечение преднизолоном в дозе ≤7,5 мг/сут (p=0,004), однако частота обострений существенно не отличалась при применении преднизолона в различных диапазонах низких доз (0-2,5 мг, 2,55,0 мг или 5,0-7,5 мг). В другом исследовании медленное снижение поддерживающей дозы преднизолона по 1 мг каждые 7 недель вплоть до полной отмены позволило избежать увеличения риска обострений в течение 2 лет по сравнению с таковым при продолжении приема препарата в дозе 5 мг/сут [40].
Хотя эксперты EULAR рекомендуют стремиться к полной отмене ГКС после достижения ремиссии СКВ, вопросы о том, когда, как и в каких случаях следует прекращать поддерживающую терапию этими препаратами, остаются спорными [41]. В клинических исследованиях отмена поддерживающих доз ГКС, особенно быстрая, сопровождалась увеличением риска развития обострений СКВ. Тем не менее, у большинства пациентов, как продолжавших, так и прекративших терапию ГКС после достижения стойкой ремиссии, обострения заболевания отсутствовали, что обосновывает попытки их отмены у многих пациентов. Факторами риска обострений СКВ после прекращения терапии были более молодой возраст и серологические признаки активности заболевания, в то время как медленное снижение подерживающих доз ГКС ассоциировалось со снижением вероятности ухудшения состояния больных. Тем не менее, предсказать возможные обострения СКВ при отмене ГКС сложно.
В рекомендациях EULAR одним из критериев низкой активности СКВ является доза ГКС, которая не должна превышать 7,5 мг/сут в пересчете на преднизолон, хотя на практике достаточная поддерживающая доза часто составляет 2,5-5 мг/сут.
- SLEDAI = 0.
- Общее мнение врача об активности
- Наличие серологических признаков активности (антитела к ДНК и/или снижение содержания комплемента) не препятствует установлению ремиссии.
- Пациент может принимать гидроксихлорохин, ГКС в низких дозах (преднизолон ≤5 мг/сут) и/или иммуносупрессивные препараты, в том числе генно-инженерные, в стабильных дозах.
В отличии от критериев EULAR, предложенное определение допускает возможность установления ремиссии СКВ при отсутствии клинических признаков активности у пациентов, продолжающих прием не только гидроксихлорохина, но и ГКС в дозе ≤5 мг/сут в пересчете на преднизолон. Основаниями для разработки нового определения СКВ послужили следующие соображения: с одной стороны, ремиссия СКВ после прекращения иммуносупрессивной терапии (за исключением гидроксихлорохина) на практике сохраняется редко, а, с другой стороны, активные попытки полной отмены иммуносупрессивных/противовоспалительных препаратов у пациентов, ответивших на лечение, могут оказаться излишними и привести к негативным последствиям. По мнению многих членов группы DORIS, желательной целью является достижение “безстероидной» ремиссии СКВ, однако эксперты все же приняли решение не включать отмену ГКС в критерии ремиссии, но “ограничили» их дозу.
Необходимо учитывать, что кумулятивная доза ГКС в значительной степени зависит от стартовых доз этих препаратов и темпов их снижения [43]. Соответственно, ограничение экспозиции ГКС на начальном этапе лечения (в том числе доз метилпреднизолона для пульстерапии) может иметь более важное значение для профилактики нежелательных эффектов, чем прекращение приема преднизолона в поддерживающей дозе 2,5-5,0 мг/сут. Очевидно также, что прекращение длительной терапии ГКС в низких дозах у части пациентов невозможно из-за сниженной эндогенной продукции кортизола.
Перспективы стероидосберегающей терапии
Эксперты EULAR рекомендуют всем пациентам с СКВ назначать гидроксихлорохин [4]. Чтобы избежать токсических эффектов препарата, прежде всего ретинопатии, суточная доза его не должна превышать 5 мг/кг (т.е. 300-400 мг в большинстве случаев), хотя в клинических исследованиях препарат изучался в дозе 6,5 мг/кг. По данным мета-анализов, лечение гидроксихлорохином снижает частоту обострений СКВ и инфекционных осложнений, увеличивает выживаемость больных, предупреждает прогрессирующее необратимое повреждение органов, тромбозы и снижение массы тела, улучшает липидный профиль [44-46]. Основным побочным эффектом гидроксихлорохина является ретинопатия, однако частота ее низкая [47]. Безопасность препарата подтверждена у беременных женщин, поэтому отменять препарат во время беременности не следует [48]. Несмотря на доказанные эффективность и безопасность гидроксихлорохина в лечении СКВ, на практике врачи далеко не всегда назначают этот препарат. Например, в российском многоцентровом исследовании ESSENCE, проводившемся в 6 городах, было показано, что ГКС получали практически все пациенты с СКВ, а производные аминохинолина – менее половины [49].
При среднетяжелом течении СКВ гидроксихлорохин и ГКС целесообразно применять в сочетании с метотрексатом или азатиоприном, а также микофенолата мофетилом, ингибиторами кальциневрина или белимумабом. В более тяжелых случаях, например, при наличии волчаночного нефрита III-IV класса обосновано назначение микофенолата мофетила или циклофосфамида, а при их неэффективности – ритуксимаба [4,5].
Несмотря на иммуносупрессивную терапию, у части больных СКВ сохраняется воспалительная активность и/или наблюдаются обострения. В канадском исследовании стойкая ремиссия заболевания была достигнута только у 10% пациентов, в то время как у 9% – персистировала активность, а у 67% – развивались обострения СКВ [50]. В многоцентровом 2-летнем исследовании, проводившемся в нескольких странах Европы, обострения СКВ были зарегистрированы более чем у половины из 412 пациентов [51]. В другом исследовании признаки воспалительной активности несмотря на иммуносупрессивную терапию были выявлены у 40% из 332 больных СКВ [52]. Приведенные данные свидетельствуют о том, что для улучшения результатов лечения многие пациенты с СКВ нуждаются в новых препаратах, обладающих стероидосберегающей активностью и позволяющих ограничить применение ГКС, в том числе за счет профилактики обострений заболеваний, которые обычно предполагают необходимость в увеличении дозы ГКС или возобновлении их приема.
В настоящее время в клинических исследованиях у пациентов с СКВ изучаются многочисленные лекарственные препараты (как генно-инженерные биологические препараты, так и синтетические молекулы), действующие на различные мишени в системе иммунного ответа (табл. 1) [53]. Разработка большинства из них еще продолжается, однако некоторые препараты, в частности воклоспорин и анифролумаб, уже прошли необходимые испытания и в некоторых странах одобрены для применения в клинической практике.
ТАБЛИЦА 1. Новые препараты, которые разрабатываются для лечения СКВ
Мишень Препараты Механизм действия В-клетки Обинутузумаб Антитело к CD-20, вызывающее деплецию В-клеток Обекселимаб Антитело к CD-19, одновременно блокирующее Fc-рецепторы В-клеток Телитацицепт Рекомбинантный белок, блокирующий активность BlyS и APRIL и подавляющий выживаемость зрелых В-клеток и плазматических клеток Т-клетки Белатацепт Белок, состоящий из Fc фрагмента IgG1 и внеклеточного домена CTLA-4 и блокирующий стимуляцию Т-клеток Лулизумаб Антитело к CD28, необходимому для активации Т-клеток Ригеримод Фрагмент рибонуклеопротеина U1-70K, ингибирующий активность Т-клеток Дапирозулимаб пэгол Пегилированный Fab фрагмент антитела к CD40L, блокирующий взаимодействие Т-клеток и антигенпрезентирующих клеток Итолизумаб Антитело к CD6 рецептору на поверхности Т-клеток, ингибирующее Т-клеточный иммунный ответ Плазматические клетки Даратумумаб Антитело к CD38, вызывающее деплецию плазматических клеток Интерферон Анифролумаб Антитело к рецептору интерферона I типа Интерлейкины Устекинумаб Антитело к р40 субъединице ИЛ-12 и ИЛ-23 Секукинумаб Антитело к ИЛ-17 Кальциневрин Воклоспорин Новый аналог циклоспорина mTOR Сиролимус Блокирует активацию Т- и В-клеток за счет ингибирования сигнальной молекулы mTOR (mammalian target of rapamycin) JAK Барицитиниб Ингибитор сигнальной системы JAK-STAT Тирозинкиназа Брутона Фенебрутиниб Ингибитор внутриклеточной сигнальной молекулы, модулирующей созревание, выживаемость и активацию В-клеток Комплемент Нарсоплимаб Антитело к MASP-2 – сериновой протеазе, участвующей в активации лектинового пути S1P (сфингозин-1-фосфат) Финголимод Модулирует S1P-рецепторы лимфоцитов рецепторы Ценеримод Селективный агонист S1P-рецепторов Воклоспорин – это новый ингибитор кальциневрина, который имеет определенные преимущества перед другими препаратами этой группы, включая отсутствие необходимости в мониторировании сывороточных концентраций во время лечения. Кроме того, воклоспорин в меньшей степени влияет на уровни липидов и глюкозы и не изменяет концентрации микофеноловой кислоты. Эффективность и безопасность воклоспорина в сочетании с ГКС и микофенолата мофетилом изучались в двойном слепом, рандомизированном, плацебо-контролируемом исследовании AURORA-1 у 357 пациентов с активным волчаночным нефритом, подтвержденным при биопсии почек (III, IV или V класс) [54]. Из исследования исключали пациентов со скоростью клубочковой фильтрации (СКФ) ≤45 мл/мин/1,73 м 2 . Терапию воклоспорином в дозе 23,7 мг два раза в сутки или плацебо продолжали в течение 52 недель. Пациенты обеих групп получали также микофенолата мофетил в дозе 2 г/сут и ГКС (метилпреднизолон в дозе 500 мг/сут внутривенно в первые два дня, а затем преднизолон внутрь в дозе 20-25 мг/сут). Дозу преднизолона быстро снижали до 2,5 мг/сут в течение 16 недель. Первичным показателем эффективности был полный почечный ответ: отношение белок/креатинин в моче ≤0,5 мг/кг, стабильная функция почек (СКФ≥60 мл/мин/1,73 м 2 или отсутствие снижения СКФ более чем на 20%) и доза преднизолона не более 10 мг. Кроме того, оценивали частичный почечный ответ (снижение отношения белок/креатинин в моче по крайней мере на 50%) и ряд других вторичных конечных точек.
Важную роль в патогенезе СКВ играют интерфероны (ИФН) I типа (α, β, ε, κ и ω), которые через сигнальную систему JAK/STAT инициируют транскрипцию различных провоспалительных генов и оказывают действие на системы врожденного и адаптивного иммунного ответа [55,56]. Анифролумаб – это человеческое моноклональное антитело, взаимодействующее с рецептором ИФН I типа и блокирующее действие всех ИФН I типа. Эффективность и безопасность анифролумаба в лечении СКВ были установлены в рандомизированном, плацебо-контролируемом клиническом исследовании 3 фазы TULIP-2, в которое были включены 362 пациента со средней или высокой активностью СКВ [57]. Исследуемый препарат в дозе 300 мг или плацебо вводили внутривенно каждые 4 недели в течение 48 недель. Первичным показателем эффективности была частота ответа по критериям BICLA. Кроме того, изучали различные вторичные показатели эффективности, включая стероидосберегающее действие у 170 пациентов, которые исходно получали ГКС в дозе ≥10 мг/сут в пересчете на преднизолон.
По первичному показателю эффективности анифролумаб достоверно превосходил плацебо: через 52 недели частота ответа на лечение в двух группах составила 47,8% и 31,5%, соответственно (p=0,001) (рис. 5). Частота обострений СКВ при лечении анифролумабом была ниже, чем в контрольной группе, хотя разница не достигла статистической значимости (р=0,08). Кроме того, терапия анифролумабом оказывала благоприятное влияние на поражение кожи и привела почти к двукратному увеличению доли пациентов, у которых дозу преднизолона к 40-й неделе удалось снизить до 7,5 мг/сут и/или менее (51,5% против 30,2% в группе плацебо; р=0,01). В группе анифролумаба было отмечено увеличение частоты опоясывающего герпеса (7,2% против 1,1% в группе плацебо), однако кожные высыпания во всех случаях прошли, несмотря на продолжение лечения. Таким образом, результаты исследования TULIP-2 показали, что применение анифролумаба позволяет добиться увеличения частоты ответа на лечение у пациентов с активной СКВ, получающих гидроксихлорохин, ГКС и/или иммуносупрессивные препараты, и оказывает стероидосберегающее действие.
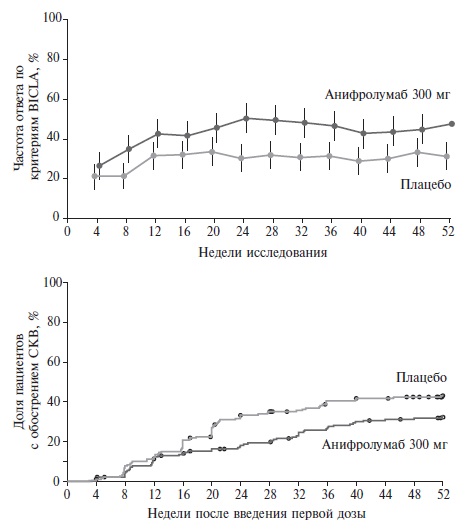
Заключение
Несмотря на высокий риск нежелательных эффектов, ГКС остаются основой лечения СКВ и на протяжении нескольких десятилетий используются как для индукции ремиссии заболевания, так и поддерживающей терапии. Изучение геномных и негеномных механизмов действия ГКС обосновывает их применение в более низких стартовых дозах, в том числе при наличии висцеральных проявлений СКВ, таких как волчаночный нефрит. Чтобы избежать нежелательных эффектов ГКС и прогрессирующего накопления повреждения внутренних органов, пациентам с активной СКВ целесообразно проводить пульс-терапию метилпреднизолоном и уже на начальном этапе лечения назначать гидроксихлорохин и иммуносупрессивные препараты. Стандартная пульс-терапия предполагает внутривенное введение метилпреднизолона в дозе 1000 мг/сут в течение 3 дней, хотя во многих случаях не менее эффективны более низкие дозы препарата. Например, при среднетяжелом течении СКВ, проявляющейся артритом, кожными высыпаниями и перикардитом, достаточным может быть применение метилпреднизолона в дозе 125-250 мг/сут в течение 3 дней.
Несмотря на стандартную иммуносупрессивную терапию, у части пациентов с СКВ персистирует воспалительная активность и/или развиваются обострения, что определяет необходимость в разработке новых препаратов, обладающих стероидосберегающей активностью и позволяющих улучшить результаты лечения. К таковым, в частности, относятся воклоспорин, ингибирующий кальциневрин, и анифролумаб, блокирующий рецепторы ИФН I типа, эффективность и стероидосберегающее действие которых установлены в контролируемых клинических исследованиях у пациентов с волчаночным нефритом и активной СКВ, соответственно.
Используемые источники
- Freyberg RH, Traeger CH, Patterson M, et al. Problems of prolonged cortisone treatment for rheumatoid arthritis; further investigations. J Am Med Assoc 1951;147(16):1538–43.
- Тареев Е.М., Насонова В.А. Место стероидных гормонов в комплексном лечении так называемых больших коллагенозов. Сов мед 1960;12:3-12.
- Тареев Е.М. Современные представления о лечении больных коллагенозами. Врачебное дело 1965;8:80-6.
- Fanouriakis A, Kostopoulou M, Alunno A, et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus. Ann Rheum Dis 2019;78(6):736-45.
- Fanouriakis A, Kostopoulou M, Cheema K, et al. 2019 Update of the Joint European League Against Rheumatism and European Renal AssociationEuropean Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of lupus nephritis. Ann Rheum Dis 2020;79(6):713-23.
- Ruiz-Irastorza G, Ugarte A, Ruiz-Arruza I, Khamashta M. Seventy years after Hench’s Nobel prize: revisiting the use of glucocorticoids in systemic lupus erythematosus. Lupus 2020;29(10):1155-67.
- Porta S, Danza A, Arias Saavedra M, Carlomagno A, et al. Glucocorticoids in systemic lupus erythematosus. Ten questions and some issues. J Clin Med 2020;9(9):2709.
- Strehl C, Buttgereit, F. Unraveling the functions of the membrane-bound glucocorticoid receptors: First clues on origin and functional activity. Ann N Y Acad Sci 2014;1318:1–6.
- Buttgereit F, da Silva J, Boers M, et al. Standardised nomenclature for glucocorticoid dosages and glucocorticoid treatment regimens: current questions and tentative answers in rheumatology. Ann Rheum Dis 2002;61:718–22.
- Schmid D, Burmester GR, Tripmacher R, et al. Bioenergetics of human peripheral blood mononuclear cell metabolism in quiescent, activated, and glucocorticoid-treated states. Biosci Rep 2000;20:289–302.
- Danza A, Borgia I, Narvaez JI, et al. Intravenous pulses of methylprednisolone to treat flares of immunemediated diseases: how much, how long? Lupus 2018; 27:1177–84.
- Kong KO, Badsha H, Lian T, et al. Low-dose pulse methylprednisolone is an eective therapy for severe SLE flares. Lupus 2004;13:212–3.
- Badsha H, Kong K, Lian T, et al. Low-dose pulse methylprednisolone for systemic lupus erythematosus flares is ecacious and has a decreased risk of infectious complications. Lupus 2002;11:508–13.
- Price DB, Trudo F, Voorham J, et al. Adverse outcomes from initiation of systemic corticosteroids for asthma: long-term observational study. J Asthma Allergy 2018;11:193-204.
- Curtis JR, Westfall AO, Allison J, et al. Population-based assessment of adverse events associated with long-term glucocorticoid use. Arthritis Rheum 2006;55(3):420-6.
- Bultink IE, Lems WF. Lupus and fractures. Curr Opin Rheumatol 2016;28(4):426-32.
- Gu C, Zhao R, Zhang X, Gu Z, et al. A meta-analysis of secondary osteoporosis in systemic lupus erythematosus: prevalence and risk factors. Arch Osteoporos 2019;15(1):1.
- Bultink IEM, Lems WF. Systemic lupus erythematosus and fractures. RMD Open 2015;1:e000069.
- Wang X, Yan S, Liu C, Xu Y, et al. Fracture risk and bone mineral density levels in patients with systemic lupus erythematosus: a systematic review and metaanalysis. Osteoporos Int 2016;27(4):1413-23.
- Bultink IE, Harvey NC, Lalmohamed A, et al. Elevated risk of clinical fractures and associated risk factors in patients with systemic lupus erythematosus versus matched controls: a population-based study in the United Kingdom. Osteoporos Int 2014;25:1275–83.
- Al Sawah S, Zhang X, Zhu B, et al. Effect of corticosteroid use by dose on the risk of developing organ damage over time in systemic lupus erythematsosus – the Hopkins Lupus Cohort. Lupus Sci Med 2015;2:e000066.
- Van Staa TP, Leufkens HG, Abenhaim L, et al. Use of oral corticosteroids and risk of fractures. J Bone Miner Res 2000;15(6):993-1000.
- Hussein S, Suitner M, Beland-Bonenfant S, et al. Monitoring of osteonecrosis in systemic lupus erythematosus: a systematic review and metaanalysis. J Rheumatol 2018;45:1462–76.
- Fukushima W, Fujioka M, Kubo T, et al. Nationwide epidemiologic survey of idiopathic osteonecrosis of the femoral head. Clin Orthop Relat Res 2010;468:2715-24.
- Моисеев С.В., Новиков П.И., Буланов Н.М. Системная красная волчанка: эпидемиология, отдаленные исходы и бремя болезни. Клин фармакол тер 2021;30(4):13-22 [Moiseev S, Novikov P, Bulanov N. Systemic lupus erythematosus: epidemiology, outcomes and burden. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(4):13-22 (In Russ.)].
- Feldman CH, Hiraki LT, Winkelmayer WC, et al. Serious infections among adult Medicaid beneficiaries with systemic lupus erythematosus and lupus nephritis. Arthritis Rheumatol 2015;67(6):1577-85.
- Singh JA, Hossain A, Kotb A, et al. Risk of serious infections with immunosuppressive drugs and glucocorticoids for lupus nephritis: a systematic review and network meta-analysis. BMC Med 2016;14:137.
- Abe K, Ishikawa Y, Kita Y, et al. Association of low-dose glucocorticoid use and infection occurrence in systemic lupus erythematosus patients: a prospective cohort study. Arthritis Res Ther 2022;24(1):179.
- Schoenfeld SR, Kasturi S, Cos KH. The epidemiology of atherosclerotic cardiovascular disease among patients with SLE: a systematic review. Semin Arthritis Rheum 2013;43:77–95.
- Barber M, Drenkard C, Falasinnu T, et al. Global epidemiology of systemic lupus erythematos. Nat Rev Rheumatol 2021;17:515-32.
- Tselios K, Sheane BJ, Gladman DD, et al. Optimal monitoring for coronary heart disease risk in patients with systemic lupus erythematosus: a systematic review. J Rheumatol 2016;43:54–65.
- Wu G-C, Liu H-R, Leng R-X, et al. Subclinical atherosclerosis in patients with systemic lupus erythematosus: a systemic review and meta-analysis. Autoimmun Rev 2016;15:22–37.
- Babaoğlu H, Li J, Goldman D, et al. Time to lupus low disease activity state in the Hopkins Lupus Cohort: role of African American ethnicity. Arthritis Care Res (Hoboken) 2020;72(2):225-32.
- Mathian A, Pha M, Haroche J, et al. Withdrawal of low-dose prednisone in SLE patients with a clinically quiescent disease for more than 1 year: a randomised clinical trial. Ann Rheum Dis 2020;79(3):339-46.
- Ji L, Xie W, Zhang Z. Low-dose glucocorticoids should be withdrawn or continued in systemic lupus erythematosus? A systematic review and meta-analysis on risk of flare and damage accrual. Rheumatology (Oxford) 2021;60(12):5517-26.
- Ji L, Xie W, Fasano S, Zhang Z. Risk factors of flare in patients with systemic lupus erythematosus after glucocorticoids withdrawal. A systematic review and meta-analysis. Lupus Sci Med 2022;9(1):e000603.
- Ji L, Gao D, Hao Y, Huang H, et al. Low-dose glucocorticoids withdrawn in systemic lupus erythematosus: a desirable and attainable goal. Rheumatology (Oxford) 2022 Apr 12:keac225.
- Fasano S, Coscia MA, Pierro L, Ciccia F. Which patients with systemic lupus erythematosus in remission can withdraw low dose steroids? Results from a single inception cohort study. Lupus 2021;30(6):991-7.
- Hao Y, Ji L, Gao D, Fan Y, et al. Flare rates and factors determining flare occurrence in patients with systemic lupus erythematosus who achieved low disease activity or remission: results from a prospective cohort study. Lupus Sci Med 2022;9(1):e000553.
- Tselios K, Gladman DD, Su J, Urowitz MB. Gradual glucocorticosteroid withdrawal is safe in clinically quiescent systemic lupus erythematosus. ACR Open Rheumatol 2021;3(8):550-7.
- Ruiz-Irastorza G. Prednisone in systemic lupus erythematosus: taper quickly, withdraw slowly. Rheumatology (Oxford) 2021;60(12):5489-90.
- van Vollenhoven RF, Bertsias G, Doria A, et al. 2021 DORIS definition of remission in SLE: final recommendations from an international task force. Lupus Sci Med 2021;8(1):e000538.
- Ruiz-Irastorza G, Garcia M, Espinosa G et al. First month prednisone dose predicts prednisone burden during the following 11 months: an observational study from the RELES cohort. Lupus Sci Med 2016;3:e000153.
- Ruiz-Irastorza G, Ramos-Casals M, Brito-Zeron P, Khamashta MA. Clinical efficacy and side effects of antimalarials in systemic lupus erythematosus: a systematic review. Ann Rheum Dis 2010;69(1):20-8.
- Pego-Reigosa JM, Nicholson L, Pooley N, et al. The risk of infections in adult patients with systemic lupus erythematosus: systematic review and meta-analysis. Rheumatology 2021;60:60–72.
- Tao CY, Shang J, Chen T, et al. Impact of antimalarial (AM) on serum lipids in systemic lupus erythematosus (SLE) patients: a systematic review and meta-analysis. Medicine 2019;98:e15030.
- Dima A, Jurcut C, Chasset F, Felten R, Arnaud L. Hydroxychloroquine in systemic lupus erythematosus: overview of current knowledge. Ther Adv Mus culo -skelet Dis 2022;14:1759720X211073001.
- Clowse MEB, Eudy AM, Balevic S, et al. Hydroxychloroquine in the pregnancies of women with lupus: a meta-analysis of individual participant data. Lupus Sci Med 2022;9(1):e000651.
- Насонов Е.Л., Соловьев С.К., Лила А.М. Клиническое течение и стандартная терапия системной красной волчанки в Российской Федерации. Современная ревматология. 2016;10(2):12-6 [Nasonov EL, Solovyev SK, Lila AM. The clinical course and standard therapy of systemic lupus erythematosus in the Russian Federation. Modern Rheumatology Journal 2016;10(2):12-6 (In Russ.)].
- Tselios K, Gladman DD, Touma Z, et al. Disease course patterns in systemic lupus erythematosus. Lupus 2019;28(1):114-122.
- Cervera R, Doria A, Amoura Z, et al. Patterns of systemic lupus erythematosus expression in Europe. Autoimmun Rev 2014;13(6):621-9.
- Gioti O, Chavatza K, Nikoloudaki M, et al. Residual disease activity and treatment intensification in systemic lupus erythematosus: A cross-sectional study to quantify the need for new therapies. Lupus 2022 Sep 28:9612033221129776.
- Liossis SN, Staveri C. What’s new in the treatment of systemic lupus erythematosus. Front Med (Lausanne) 2021;8:655100.
- Rovin BH, Teng YKO, Ginzler EM, Arriens C, et al. Efficacy and safety of voclosporin versus placebo for lupus nephritis (AURORA 1): a double-blind, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet 2021;397(10289): 2070-80
- Gallucci S, Meka S, Gamero AM. Abnormalities of the type I interferon signaling pathway in lupus autoimmunity. Cytokine 2021;146:155633.
- Насонов Е.Л., Авдеева А.С., Попкова Т.В. Новые возможности фармакотерапии системной красной волчанки: перспективы применения анифролумаба (моноклональные антитела к рецепторам интерферона типа I). Научно-практическая ревматология 2021;59(5):537-46 [Nasonov EL, Avdeeva AS, Popkova TV. New possibilities of pharmacotherapy for systemic lupus erythematosus: Prospects for the use of anifrolumab (monoclonal antibodies to type I interferon receptor). Rheumatology Science and Practice 2021;59(5):537-46 (In Russ.)].
- Morand EF, Furie R, Tanaka Y, et al; TULIP-2 Trial Investigators. Trial of anifrolumab in active systemic lupus erythematosus. N Engl J Med 2020;382(3):211-21.
Системная красная волчанка препараты для лечения
Е.А. Асеева (1), С.К. Соловьев (2), Н.Ю. Никишина (2), Е.Л. Насонов (1), А.М. Лила (1)
1) Научно-исследовательский институт ревматологии им. В.А. Насоновой, Москва, Россия; 2) КДЦБ МЕДСИ, Москва, Россия
В представленном обзоре литературы описаны сохраняющие свое значение стандартные методы терапии системной красной волчанки, включая глюкокортикостероиды, цитостатческие и аминохинолиновые препараты. Обсуждаются перспективы инновационных методов лечения: анти В-клеточная терапия; применение ингибиторов интерферона, JAK-STAT и провоспалительных цитокинов.
Ключевые слова: системная красная волчанка, генно-инженерные биологические препараты
Введение
Еще 70 лет назад системная красная волчанка (СКВ) считалась заболеванием с фатальным прогнозом, а попытки терапии с применением антибиотиков, сульфаниламида и солей металлов были признаны безуспешными [1]. Только после открытия P. Hench и E. Kendall гормона надпочечников кортизола и описания высокой эффективности его применения шестью больными СКВ начинается новая эра лечения этого заболевания [2]. Глюкокортикостероидные гормоны (ГКС) и в настоящее время остаются основным препаратом лечения СКВ [3].
ГКС в лечении СКВ
ГКС с 1957 г. наряду с аспирином и гидроксихлорохином официально рекомендованы FDA (Food and Drug Administration) для лечения СКВ [4]. Эффективность применения высоких доз ГКС при высокой активности и критическом течении СКВ в реальной клинической практике не вызывает сомнения. Пульс-терапия и пероральный прием 0,5–1,0 мг/кг массы тела в сутки считаются стандартной терапией при активном люпус-нефрите (ЛН), нейро-люпусе, цитопеническом кризе, васкулите и полиорганной недостаточности. А длительное применение поддерживающей терапии низкими дозами ГКС в большинстве случаев обеспечивает развитие низкой активности и ремиссии [5–7]. С другой стороны, когортные исследования подтверждают связь длительного многолетнего применения ГКС при СКВ и развития многочисленных необратимых органных повреждений, которые приводят к сокращению продолжительности жизни, удорожанию стоимости лечения, ухудшению качества жизни и социальной адаптации пациентов с СКВ [8–14]. Таким образом, новая стратегий терапии СКВ, основанная на концепции Treat-to-Target, сохраняет большое значение ГКС в терапии самых различных вариантов течения болезни, но в то же время обязывает минимизировать их токсическое влияние за счет снижения ежедневной дозы до ≤5 мг или полной отмены, а также более широкого использования иммунодепрессантов (ИД) и генно-инженерных биологических препаратов (ГИБП) [15–20].
Иммунодепрессанты
За последние несколько десятилетий благодаря многочисленным исследованиям в клинической практике терапии СКВ появилось несколько цитостатических иммунодепрессантов – циклофосфамид, азатиоприн (АЗА), хлорамбуцил (ХБ), циклоспорин (ЦС), метотрексат и др. [4].
Циклофосфамид (ЦФ). Высоко-дозные инфузии ЦФ в комбинации с ГКС прочно входят в стандарты терапии индукционной фазы терапии ЛН, поражении центральной нервной системы и других критических вариантах течения СКВ [22]. Несмотря на высокую эффективность ЦФ, его применение ограничивает ряд опасных побочных эффектов: лейкопению, инфекции, острый геморрагический цистит и потенциальный риск развития злокачественных новообразований, в связи с чем реальной альтернативой его применения является назначение микофенолата мофетила или АЗА [3, 23].
Микофенолата мофетил (ММФ). В настоящее время в лечении волчаночного нефрита все более важное место занимают ММФ и ингибиторы кальциневрина, по эффективности не уступающие ЦФ и обладающие лучшим профилем безопасности. ММФ – иммуносупрессивный препарат, механизм действия которого связан с обратимой ингибицией фермента инозин-5-монофосфат-дегидрогеназы. ММФ обладает способностью подавлять синтез лимфоцитами широкого спектра «провоспалительных» и «иммунорегуляторных» цитокинов (интерлейкин-2 – ИЛ-2, -3, -4, -5, -6, ИЛ-10, интерферона γ – ИФН-γ, фактора некроза опухоли α – ФНО-α) [18–20]. Особый интерес представляет тот факт, что у пациентов с СКВ, получающих лечение ММФ, отмечается снижение уровня ИФН типа I, занимающего центральное место в иммунопатогенезе СКВ. Механизмы действия ингибиторов кальциневрина (циклоспорин А, такролимус, волкоспорин) заключаются в предотвращении транслокации фактора транскрипции NFАТ (nuclear factor of activated Тcells), ингибиции активации Т-клеток (снижение синтеза ИЛ-1, ИФН-γ, ИЛ-6, -10) и подавлению функции В-клеток. Кроме того, ингибиторы кальциневрина обладают способностью улучшать функцию почек за счет стабилизации подоцитов и подавления пролиферации мезангиальных клеток. Комбинация ингибиторов кальциневрина с ММФ составляет основу т.н. политаргетной терапии ЛН, которая представляет собой применение препаратов с различными (возможно, «синергичными») механизмами действия, что позволяет использовать их в более низких дозах и тем самым снижать риск развития побочных эффектов. Так, при ЛН применение комбинированной терапии такролимусом (4 мг/сут), МФМ (1 г/сут) и ЦФ оказалось более эффективным и безопасным, чем монотерапия ЦФ (0,5–1,0 г/м2) [18–20]. Для подавления высокой активности и достижения ремиссии ММФ назначается пациентам с ЛН в дозах от 2 до 2,5 и 3 г/сут в течение не менее 6 месяцев. Отмечается высокая эффективность ММФ при васкулите, поражении кожи и полиартрите [3].
Метотрексат (MTX, аметоптерин или 4-амино-N10-метилптероил-глутаминовая кислота) является аналогом фолиевой кислоты, действие которого можно классифицировать на антипролиферативное (опосредованное дигидрофолатредуктазой – DHFR) и противовоспалительное действия (не DHFR). [50, 51]. По данным последнего систематического обзора, МТХ оказывает достоверное действие на пациентов с СКВ с преимущественным поражением кожи, слизистых оболочек и суставов. У пациентов, получающих МТХ, наблюдалось значительное снижение индекса активности СКВ (SLEDAI) по сравнению с контрольной группой (р=0,001). Также наблюдалось значительное снижение средней дозы ГКС среди пациентов, получавших МТХ, по сравнению с контрольной группой (р=0,001) [3, 52, 53].
В соответствии с рекомендациями EULAR/ACR (European League Against Rheumatism/American College of Rheumatology, 2019) МТХ назначают пациентам с СКВ с поражением кожи, слизистых оболочек, полиартритом по 15–20 мг еженедельно в комбинации с фолиевой кислотой, ГКС и гидроксихлорохином – ГХК [3, 52–54].
Ингибиторы кальциневрина
Такролимус (ТАС). TAC в течение многих лет успешно используется в трансплантологии с целью предотвращения развития криза отторжения. Как ингибитор кальциневрина он тормозит активацию Т-клеток, тормозит синтез ИЛ-2, -4, -5, ИФН-γ и ФНО-α [55, 56]. Результаты клинических исследований подтверждают эффективность различных режимов применения ТАК в индукционной и поддерживающей фазах терапии ЛН [57]. Для клинической практики большое значение имеют результаты мета-анализа результатов клинических исследований по сравнению эффективности и безопасности режимов ТАК+ГКС против ЦФ+ГКС. Оказалось, что ТАК превосходит ЦФ по таким показателям, как достижение полной и частичной ремиссии, протеинурия, уровень а-ДНК и индекса активности SLEDAI. При применении ТАК реже наблюдались такие побочные эффекты, как поражение желудочно-кишечного тракта, нарушение менструального цикла и лейкопения, инфекции, алопеция и нарушение функции печени. В то же время применение ТАК чаще ассоциировалось с повышением артериального давления, гипергликемией и повышением уровня креатинина [58–60]. В нескольких исследованиях различий в эффективности применения ТАК и ММФ при ЛН не выявлено [61, 62]. В свете политаргетной терапии комбинация низких доз ММФ+ТАК+ГКС превосходит монотерапию ЦФ и ММФ по таким показателям, как протеинурия, уровень альбумина и достижение ремиссии (все р<0,05) [63]. Высокоэффективна также комбинация ТАК с ЦС и ЦФ [64, 65]. Таким образом, доказанная высокая эффективность применения ТАК и приемлемая безопасность, особенно в комбинации с ММФ (политаргетная терапия), позволяют использовать этот препарат в терапии прогрессирующего ЛН, преимущественно в случаях неэффективности стандартной терапии.
Циклоспорин (ЦС) относится к ингибиторам кальциневрина, однако иммуносупрессивная активность ЦС in vitro и in vivo в 10–100 раз ниже, чем у ТАК [66]. Рандомизированные клинические исследования (РКИ) не выявили преимуществ ЦС в терапии СКВ перед ЦФ как в индукционной, так и поддерживающей фазах ЛН, а также в терапии внепочечных проявлений СКВ по сравнению с азатиоприном – АЗА [67].
Воклоспорин является химическим аналогом ЦС, но обладает более сильной способностью к связыванию с циклофилином А и значительно более выраженно ингибирует кальциневрин. Вероятно, волкоспорин – более эффективный препарат, чем ЦС, для него характерна более стабильная концентрация в плазме и быстрое выведение [68]. Эффективность ЦС при СКВ оценена в плацебо-контролируемой фазе IIb РКИ (AURA) у 265 рандомизированных пациентов с активным ЛН (RPS/ISN классы III/IV/V) (NCT02141672). В основной группе пациенты получали одну из двух доз воклоспорина (23,7 или 39,5 мг 2 раза в сутки), в группе плацебо – 2 г ММФ в дополнение к ГКС [69]. Полный ответ на 24-й неделе (33 против 19%) и частичный почечный ответ (70 против 49%) были значительно выше в группе с низкой дозой волкоспорина, чем плацебо. На 48-й неделе полный и частичный почечные ответы наблюдались достоверно чаще в группах волкоспорина по сравнению с плацебо.
В то же время частота летальных исходов и серьезные побочные эффекты чаще были при применении волкоспорина. Перспективные данные этого исследования привели к началу более широкой III фазы РКИ (NCT03021499). Благодаря результатам РКИ, проведенных за последние 20 лет, уточнены основные механизмы действия и разработаны показания к применению ИД при СКВ (табл. 1).
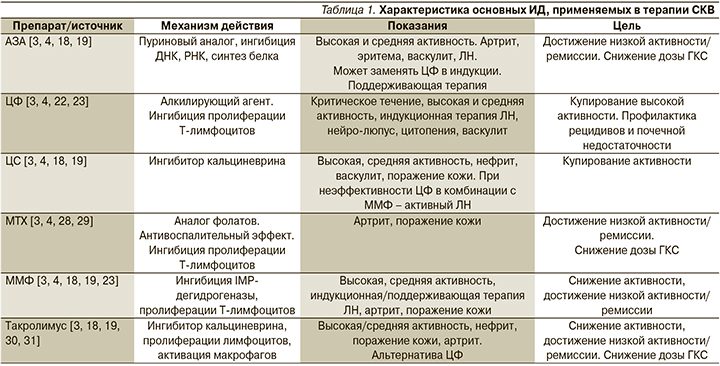
Гидроксихлорохин
Гидроксихлорохин (ГХК) остается одним из основных препаратов в терапии СКВ с достаточно высокой эффективностью при поражении кожи, артрите, применяется для предотвращения обострений, снижения риска тромбоза при антифосфолипидном синдроме, атеросклероза и диабета 2 типа [24–25]. Иммунологические эффекты ГХК включают снижение экспрессии HLA класса II и презентацию антигена, снижение продукции провоспалительных цитокинов (ИЛ-1β и ФНО), контроль активации Toll-подобного рецептора (TLR) 9 и уменьшение генерации активных форм кислорода иммунной системой клетки [25, 27]. В соответствии с современными рекомендациями EULAR/ACR (2019) ГХК назначают всем пациентам с СКВ в отсутствие противопоказаний [19, 20].
Генно-инженерные биологические препараты
Появление в конце ХХ в. ГИБП, обладающих способностью целевого блокирования молекул и клеток, которые являются ключевым звеном патогенеза многих ревматических заболеваний, неизбежно привело к попыткам применения этих препаратов при СКВ [3, 4, 32].
В последние годы продолжаются многочисленные клинические исследования целесообразности назначения ГИБП пациентам с СКВ с недостаточной эффективностью/непереносимостью стандартной терапии. Достижение стойкой ремиссии и восстановление толерантности иммунной системы являются основными целями применения ГИБП при СКВ. Вероятно, что их достижение будет возможно при выявлении целевых путей патогенеза в определенных подгруппах пациентов с СКВ (персонифицированная терапия).
Механизмы действия и данные РКИ по применению некоторых ГИБП при СКВ представлены в табл. 2.
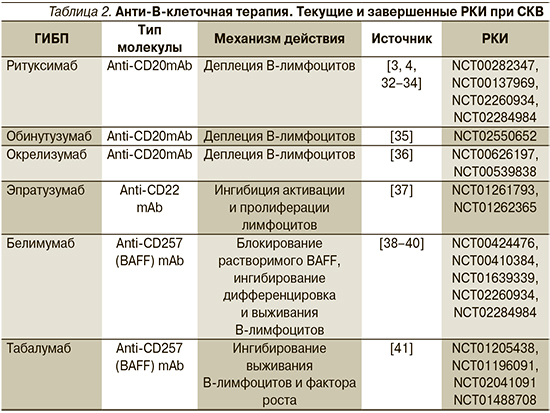
Ритуксимаб (РТМ) характеризуется как анти-CD20 mAb и является прототипом биологического препарата, представляет собой химерный mAb с человеческими доменами IgG1 и мышиными вариабельными областями к CD20. Результаты применения РТМ при СКВ начиная с 2005 г. демонстрируют его эффективность при высокой и средней активности, однако последующие РКИ (LUNAR и EXPLORER) не выявили его преимуществ по сравнению с контрольной группой больных ЛН и внепочечными проявлениями [42–44]. В то же время результаты проспективных и ретроспективных когортных исследований подтверждают достаточно высокую эффективность РТМ (до 74% и более) у пациентов с тяжелым течением СКВ и отсутствием эффекта от стандартной терапии высокими дозами ГКС и ЦФ, а также в виде монотерапии при некоторых формах ЛН [45–47]. В реальной клинической практике в соответствии с последними рекомендациями EULAR/ACR (2019), РТМ назначают больным СКВ с ЛН, нейро-люпусом, тромбоцитопенией, васкулитом в качестве терапии второй линии в отсутствие эффекта или невозможности применения стандартной терапии [19, 20]. Обнадеживают также результаты применения РТМ на ранней стадии СКВ и в комбинации с ММФ при IV–III формах ЛН [48, 49].
Белимумаб (БЛМ) представляет собой полностью гуманизированное моноклональное антитело, которое ингибирует BLyS (B Lymphocyte Stimulator). В двух исследованиях III фазы, BLISS-52 и BLISS-76, изучена эффективность внутривенного введения БЛМ при активной СКВ. БЛМ в дозе 10 мг/кг приводил к значительно более высокому уровню клинико-лабораторного ответа по индексу SRI по сравнению с плацебо в первичной конечной точке через 52 недели [70, 71]. Важным эффектом длительного применения БЛМ оказались значительное уменьшение частоты обострений, выраженный стероидосберегающий эффект, улучшение качества жизни и снижение уровня усталости [72]. Аналогичные результаты получены при проведении другого РКИ III фазы у пациентов с активной СКВ в Китае, Японии и Южной Корее [73]. Эффективность БЛМ при СКВ в реальной клинической практике во многом зависит от правильного выбора пациента. Так, в группу потенциальных «ответчиков» входят пациенты молодого возраста с СКВ высокой и средней степенью активности, с поражением суставов, кожи, слизистых оболочек, серозитом, нефритом (без признаков прогрессирования и ненарушенной азотовыделительной функцией почек), высоким уровнем анти-ДНК, снижением комплемента С3/С4 [39, 74]. Более высокий уровень оптимизации и терапии ГИБП достигнут при создании подкожной формы БЛМ [75, 76].
Важным элементом в совершенствовании терапии СКВ служит создание новых таргетных препаратов и формирование принципиально новых схем терапии. Такая схема может включать последовательное применение двух ГИБП – быстрое снижение активности СКВ с помощью РТМ с последующим назначением БЛМ с целью поддержания эффекта и достижения ремиссии. Перспективы такого лечения могут быть подтверждены детальным изучением механизмов действия препаратов и особенностей патогенетических мишеней (субпопуляций В-лимфоцитов, BLyS), на которые ориентирован каждый ГИБП. Проведенные исследования позволили установить, что у больных СКВ после применения РТМ, как правило, развивается деплеция B-лимфоцитов (CD20) с последующим существенным повышением в сыворотке крови концентрации BlyS(BAFF) – основной мишени для БЛМ [77, 78]. Резкое повышение уровня BLyS, по данным некоторых исследований, служит предиктором обострения СКВ [79, 80]. Высокий уровень BAFF после инфузий РТМ может ограничивать его эффективность в отношении некоторых пациентов с СКВ. Клинические и лабораторные эффекты применения ГИБП служат теоретическим обоснованием для проведения двойной анти-В-клеточной терапии больных СКВ. Проведенные недавно как in vivo, так и ограниченные клинические исследования подтвердили достаточно высокую эффективность последовательного применения РТМ и БЛМ у больных СКВ [81–84]. В настоящее время инициировано несколько РКИ, в которых исследуется комбинированное применение РТМ и БЛМ по сравнению с контрольной группой – пульс-терапия МП (метилпреднизолон), преднизолон 60 мг и ММФ до 2000 мг/сут. Анализ предварительных результатов – октябрь 2020 г. (NCT03747159). Другое РКИ (https://www. isrctn. com/ISRCTN47873003) инициировано профессором D. Aizen-berg, его дизайн заключается в двух последовательных инфузиях РТМ по 1 г с интервалом 2 недели и приемом или инфузией БЛМ 10 мг/кг/4 недели или плацебо. Планируется набор 56 пациентов с достоверной активной СКВ, за исключением пациентов с «критическим течением». В конечной точке – 52-я неделя, будет проведена оценка влияния на уровень анти-ДНК, дозу ГКС, активность, обострения и субпопуляции В-лимфоцитов. Первичная оценка результатов – март–апрель 2020 г. [85]. Еще одно РКИ (BLISS BELIEVE NCT03312907) предусматривает 3 группы пациентов с низкой или средней активностью СКВ: а) БЛМ+РТМ, б) БЛМ+плацебо, в) стандартная терапия. Все пациенты могут получать ГКС не более 5 мг/сут, ГХК и нестероидные противовоспалительные средства без иммунодепрессантов. Большой практический интерес вызывает исследование CALIBRATE (NCT02260934), в котором в откры-том РКИ у 43 пациентов с СКВ с ЛН будет оценена эффективность комбинации РТМ+ЦФ с последующим БЛМ против РТМ+ЦФ. Публикация первых результатов ожидается к концу 2020 г.
Ингибиторы «провоспалительных» цитокинов
Перспективное направление фармакотерапии СКВ связано с лекарственным препаратом устекинумаб (УСТ), который представляет собой моноклональные антитела к общей (р40) субъединице «провоспалительных» цитокинов ИЛ-12 и -23 [86], зарегистрирован для лечения псориаза, псориатического артрита и болезни Крона. ИЛ-12 и -23 (а также ИЛ-17) активно участвуют в патогенезе СКВ, в частности в гиперодукции аутоантител В-клетками [87]. По данным РКИ фазы II, лечение УСТ (6 мг/кг в/в, затем 90 мг п/к каждые 8 недель) ассоциировалось с достоверным снижением активности СКВ (индекс SRI-4) по сравнению с плацебо (р=0,006) [88].
Ингибиторы ИФН
Известно, что гиперпродукция ИФН типа I играет фундаментальную роль в иммунопатогенезе СКВ [89]. Установлено, что при СКВ нуклеиновые кислоты, высвобождающиеся из подвергнутых апопозу клеток и нейтрофильных внеклеточных ловушек (neutrophil extracellulasr traps), активируют плазмоцитоидные дендритные клетки (ДК), синтезирующие ИФН типа I (а также ИФН типа III), который в свою очередь стимулирует миелоидные ДК, вызывающие активацию Тh1, Th17 и В-клетки, в отношении синтеза «провоспалительных» цитокинов и аутоантител и ингибируют активность Т-рег-клеток. Кроме того, ИФН типа I поддерживает развитие и хронизацию воспаления за счет механизмов «обратной связи». Это послужило основанием для клинического изучения эффективности моноклональных антител, в частности анифролумаба (АНИФ) – полностью человеческих моноклональных антител (lgG 1ҡ) к рецепторам ИФН, блокирующиж сигнализацию, опосредованную ИФН-α и -β [90]. Применение анифролумаба приводило к снижению активности заболевания (SIR-4 и SLDAI-2K), положительной динамике поражения кожи по индексу CLASI (Cutaneous Lupus Erythema tosus Disease Area and Severity Index), в меньшей степени – артрита, позволило снизить дозу ГКС и частоту обострений заболевания по сравнению с плацебо.
Ингибиторы JAK-STAT
Патогенетическим обоснованием применения ингибиторов JAK при СКВ является блокирование широкого спектра «патогенетически значимых» цитокинов, включая ИФН типа I, а также ИЛ-12, -23, -6, -10, -21, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и др. [91]. Ингибитор JAK3/JAK1 – тофацитиниб (ТОФА) и ингибитор JAK1/JAK2 барицитиниб (БАРИ), зарегистрированы для лечения ревматоидного артрита, а ТОФА – и псориатического артрита. Недавно продемонстрирована эффективность ТОФА при семейной ознобленной (chilblain) волчанке [92, 93]. Эффективность БАРИ также оценивалась у пациентов с СКВ: так, применение БАРИ приводило к положительной динамике поражения кожи и/или артрита по сравнению с плацебо (р=0,04), индекса SRI-4, BILAG, показателя PGA ( (р=0,02) [127].
Плазмаферез
Терапевтический плазмаферез (ТПФ) используется при лечении различных аутоиммунных заболеваний. Эффективность ТПФ доказана при лечении гемолитико-уремического синдрома и синдрома Гудпасчера. Кроме того, TПФ может быть эффективным при прогрессирующем ЛН, геморрагическом альвеолите и нейро-люпусе, тромботической микроангиопатии или катастрофическом антифосфолипидном синдроме [94–98].
Заключение
Поскольку лечение пациентов с СКВ остается проблемой и в ХХI в., новые препараты позволят расширять терапевтические возможности ревматологов, курирующих это заболевание. Можно надеяться, что ингибиторы провоспалительных цитокинов, ингибиторы JAK-STAT и ингибиторы ИФН будут в ближайшее время применяться пациентами с СКВ наравне с анти-В-клеточными препаратами.
Дополнительная информация
Прозрачность исследования. Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать. Статья предоставлена в качестве информационной и образовательной поддержки врачей. Мнения, высказанные в статье, отражают точку зрения авторов, которая не обязательно совпадает с точкой зрения фармацевтических компаний.
Декларация о финансовых и других взаимоотношениях. Все авторы принимали участие в разработке концепции статьи и написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы подтверждают, что получают гонорары за консультационные услуги в области научной и педагогической деятельности (образовательные услуги, научные статьи, участие в экспертных советах, участие в исследованиях и др.).
Литература
1. Michelson H. The problem of lupus erythematosus. Calif Med. 1949;70(1):5–9.Hench P.S., Kendall E.C.,Slocumb C.H., Polley H.F. Effects of cortisone acetate and pituitary ACTH on rheumatoid arthritis, rheumatic fever and certain other conditions: A study in clinical physiology, Arch Int Med. 1950;85(4):545-666. doi: 10.1001/archinte.1950.00230100002001.
2. Насонов Е.Л., Российские клинические рекомендации. Ревматология М., 2017. 464 с.
3. Wallace D.J. The evolution of drug discovery in systemic lupus erythematosus. Nat Rev Rheumatol 2015;11:616–20. Doi: 10.1038/nrrheum.2015.86.
4. Mosca M., Tani C., Carli L., et al. Glucocorticoids in systemic lupus erythematosus. Clin Exp Rheumatol. 2011;29(5 Suppl. 68):S126–29.
5. Apostolopoulos D., Morand E.F. It hasn’t gone away: the problem of glucocorticoid use in lupus remains. Rheumatol. (Oxford). 2017;56(Suppl. 1):i114–22. Doi: 10.1093/rheumatology/kew406.
6. Fanouriakis A., Kostopoulou M., Alunno A., et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus. Ann Rheum Dis. 2019;78(6):736–45. Doi: 10.1136/annrheumdis-2019-215089.
7. Gladman D.D., Urowitz M.B., Rahman P., et al. Accrual of organ damage over time in patients with systemic lupus erythematosus. J Rheumatol. 2003;30:1955–59.
8. Zonana-Nacach A., Barr S.G., Magder L.S., et al. Damage in systemic lupus erythematosus and its association with corticosteroids. Arthr Rheum. 2000;43:1801–808. Doi: 10.1002/1529-0131(200008)43:83.0.CO;2-O.
9. Dixon W.G., Abrahamowicz M., Beauchamp M.-E., et al. Immediate and delayed impact of oral glucocorticoid therapy on risk of serious infection in older patients with rheumatoid arthritis: a nested case-control analysis. Ann Rheum Dis. 2012;71:1128–33. Doi: 10.1136/annrheumdis-2011-200702.
10. Bruce I.N. ‘Not only… but also’: factors that contribute to accelerated atherosclerosis and premature coronary heart disease in systemic lupus erythematosus. Rheumatol. 2005;44:1492–502. Doi: 10.1093/rheumatology/kei142.
11. Bhangle S.D., Kramer N., Rosenstein E.D. Corticosteroid-induced neuropsychiatric disorders: review and contrast with neuropsychiatric lupus. Rheumatol Int. 2013;33:1923–32. Doi:10.1007/s00296-013-2750-z.
12. Carter E.E., Barr S.G., Clarke A.E. The global burden of SLE: prevalence, health disparities and socioeconomic impact. Nat Rev Rheumatol. 2016;12(10):605–20. Doi: 10.1038/nrrheum.2016.137.
13. Barber M.R.W., Clarke A.E. Socioeconomic consequences of systemic lupus erythematosus. Curr Opin Rheumatol. 2017;29(5):480–85. doi: 10.1097/BOR.0000000000000416.
14. van Vollenhoven R.F., Mosca M., Bertsias G., et al. Treat-to-target in systemic lupus rythematosus: recommendations from an international Task Force. Ann Rheum Dis. 2014;73:958–67. Doi:10.1136/annrheumdis-2013-205139.
15. Соловьев С.К., Асеева Е.А., Зоткин Е.Г. и др. Проблемы низкой активности и ремиссии при системной красной волчанке Научно-практическая ревматология. 2019;57(2):218–21.
16. Соловьев С.К., Асеева Е.А., Насонов Е.Л. и др. Возможности и перспективы отмены глюкокортикоидов при системной красной волчанке. Современная ревматология. 2020;14(1):6–11.
17. Durcan L., O’Dwyer T., Petri M. Management strategies and future directions for systemic lupus erythematosus in adults. Lancet. 2019;393(10188):2332–43. Doi: 10.1016/S0140-6736(19)30237-5.
18. Dörner T., Furie R. Novel paradigms in systemic lupus erythematosus. Lancet. 2019;393:2344–58. doi: 10.1016/S0140-6736(19)30546-X.
19. Соловьев С.К., Асеева Е.А., Попкова Т.В. и др. Системная красная волчанка: новые горизонты диагностики и терапии. Научно-практическая ревматология. 2020;58(1):5–14.
20. Laurie S., Reimold A.M. Research and therapeutics – traditional and emerging therapies in systemic lupus erythematosus. Rheumatol. (Oxford). 2017;56(Suppl. 1):i100–13.
21. Fassbinder T., Saunders U., Mickholz E., et al. Differential effects of cyclophosphamide and mycophenolate mofetil on cellular and serological parameters in patients with systemic lupus erythematosus. Arthr Res Ther. 2015;17:92. Doi:10.1186/s13075-015-0603-8.
22. Mok C.C. Towards new avenues in the management of lupus glomerulonephritis. Nat Rev Rheumatol. 2016;12(4):221–34. Doi: 10.1038/nrrheum.2015.174.
23. Rainsford K.D., Parke A.L., Clifford-Rashotte M., Kean W.F. Therapy and pharmacological properties of hydroxychloroquine and chloroquine in treatment of systemic lupus erythematosus, rheumatoid arthritis and related diseases. Inflammopharmacol. 2015;23:231–69. Doi: 10.1007/s10787-015-0239-y.
24. James J.A., Kim-Howard X.R., Bruner B.F., et al. Hydroxychloroquine sulfate treatment is associated with later onset of systemic lupus erythematosus. Lupus. 2007;16:401–9. Doi:10.1177/0961203307078579.
25. Abarientos C., Sperber K., Shapiro D.L., et al. Hydroxychloroquine in systemic lupus erythematosus and rheumatoid arthritis and its safety in pregnancy. Expert Opin Drug Safety. 2011;10:705–14. Doi:10.1517/14740338.2011.566555.
26. Fox R. Anti-malarial drugs: possible mechanisms of action in autoimmune disease and prospects for drug development. Lupus. 1996;5(Suppl. 1):S4–10.
27. Fortin P.R., Abrahamowicz M., Ferland D., et al. Steroid-sparing effects of methotrexate in systemic lupus erythematosus: a double-blind, randomized, placebo-controlled trial. Arthr Rheum. 2008;59:1796–804.
28. Pego-Reigosa J.M., Cobo-Ibanez T., Calvo-Alen J., et al. Efficacy and safety of nonbiologic immunosuppressants in the treatment of nonrenal systemic lupus erythematosus: a systematic review. Arthr Care Res. 2013;65:1775–85. Doi:10.1002/acr.22035.
29. Bao H., Liu Z.H., Xie H.L., et al. Successful treatment of class V+IV lupus nephritis with multitarget therapy. J Am Soc Nephrol. 2008;19:2001–10. Doi:10.1681/ASN.2007121272.
30. Liu Z., Zhang H., Liu Z., et al. Multitarget therapy for induction treatment of lupus nephritis: a randomized trial. Ann Int Med. 2015;162:18–26. Doi:10.7326/M14-1030.
31. Анти-В-клеточная терапия в ревматологии: фокус на ритуксимаб. Монография. Под ред. Е.Л.Насонова. М., 2011. 344 с.: ил.
32. Duxbury B., Combescure C., Chizzolini C. Rituximab in systemic lupus erythematosus: an updated systematic review and meta-analysis. Lupus. 2013;22:1489–503. Doi:10.1177/0961203313509295.
33. Цанян М.Э., Соловьев С.К., Торгашина А.В. и др. Эффективность терапии ритуксимабом у больных рефрактерной к стандартной терапии системной красной волчанкой при длительном динамическом наблюдении. Научно-практическая ревматология. 2014;52(2):159–68.
34. Reddy V., Dahal L.N., Cragg M.S., Leandro M. Optimising B-cell depletion in autoimmune disease: is obinutuzumab the answer? Drug Discov Today. 2016;21:1330–38. Doi: 10.1016/j.drudis.2016.06.009.
35. Mysler E.F., Spindler A.J., Guzman R., et al. Efficacy and safety of ocrelizumab in active proliferative lupus nephritis: results from a randomized, double-blind, phase III study. Arthr Rheum. 2013;65:2368–79. Doi:10.1002/art.38037.
36. Dorner T., Shock A., Goldenberg D.M., Lipsky P.E. The mechanistic impact of CD22 engagement with epratuzumab on B cell function: Implications for the treatment of systemic lupus erythematosus. Autoimmun Rev. 2015;14:1079–86. Doi: 10.1016/j.autrev.2015.07.013.
37. Vilas-Boas A., Morais S.A., Isenberg D.A. Belimumab in systemic lupus erythematosus. RMD Open. 2015;1:e000011. Doi: 10.1136/rmdopen-2014-000011.
38. Асеева Е.А., Соловьев С.К., Меснянкина А.А., Насонов Е.Л. и др. Результаты наблюдательного проспективного исследования эффективности и безопасности белимумаба (Бенлисты®) при системной красной волчанке в реальной клинической практике. Научно-практическая ревматология. 2016;54(1):31–7.
39. Меснянкина А.А., Соловьев С.К., Асеева Е.А., Насонов Е.Л. Эффективность генно-инженерной биологической терапии и особенности гуморального иммунитета у больных системной красной волчанкой. Научно-практическая ревматология. 2018;56(3):302–9.
40. Vincent F.B., Morand E.F., Schneider P., Mackay F. The BAFF/APRIL system in SLE pathogenesis. Nature reviews. Rheumatol. 2014;10:365–73. doi: 10.1038/nrrheum.2014.33.
41. Duxbury B., Combescure C., Chizzolini C. Rituximab in systemic lupus erythematosus: an updated systematic review and meta-analysis. Lupus. 2013;22:1489–503. Doi:10.1177/0961203313509295.
42. Samotij D., Reich A. Biologics in the Treatment of Lupus Erythematosus: A Critical Literature Review. BioMed Res Int. 2019;Article ID 8142368:17. Doi: 10.1155/2019/8142368.
43. Magro R. Biological therapies and their clinical impact in the treatment of systemic lupus erythematosus. Ther Adv Musculoskel. Dis. 2019;11:1–9. Doi:10.1177/1759720X19874309.
44. McCarthy E.M, Sutton E., Nesbit S., et al. Short-term efficacy and safety of rituximab therapy in refractory systemic lupus erythematosus: results from the British Isles Lupus Assessment Group Biologics Register. Rheumatol (Oxford). 2018;57(3):470–79. Doi: 10.1093/rheumatology/kex395.
45. Chavarot N.,Verhelst D., Pardon A., et al. Rituximab alone as induction therapy for membranous lupus nephritis A multicenter retrospective study. Medicine (Baltimore). 2017;96(27):e7429. Doi:10.1097/MD.0000000000007429.
46. Насонов Е.Л., Соловьев С.К. Перспективы фармакотерапии системной красной волчанки. Научно-практическая ревматология. 2014;52(3):311–21.
47. Condon M.B., Ashby D., Pepper R.J., et al. Prospective observational single-centre cohort study to evaluate the effectiveness of treating lupus nephritis with rituximab and mycophenolate mofetil but no oral steroids. Ann Rheum Dis. 2013;72:1280–86. Doi: 10.1136/annrheumdis-2012-202844.
48. Gracia-Tello B., Ezeonyeji A., Isenberg D. The use of rituximab in newly diagnosed patients with systemic lupus erythematosus: long-term steroid saving capacity and clinical effectiveness. Lupus Sci. Med. 2017;4(1):e000182. Doi: 10.1136/lupus-2016-000182.
49. Sramek M., Neradil J., Veselska R. Much more than you expected: the non-DHFR-mediated effects of methotrexate. Biochim Biophys Acta Gen Subj. 2017;1861:499–503. Doi: 10.1016/j.bbagen.2016.12.014.
50. Chan E.S.L., Cronstein B.N. Molecular action of methotrexate in inflammatory diseases. Arthr Res. 2002;4:266–73. doi: 10.1186/ar419.
51. Sakthiswary R., Suresh E. Methotrexate in systemic lupus erythematosus: a systematic review of its efficacy. Lupus. 2014;23(3):225–35. Doi: 10.1177/0961203313519159.
52. Насонов Е.Л. Метотрексат при ревматоидном артрите – 2015: новые факты и идеи. Научно-практическая ревматология. 2015;53(4):421–33.
53. Gansauge S., Breitbart A., Rinaldi N., Schwarz-Eywill M. Methotrexate in patients with moderate systemic lupus erythematosus (exclusion of renal and central nervous system disease). Ann Rheum Dis. 1997;56(6):382–85. Doi:10.1136/ard.56.6.382.
54. Andersson J., Nagy S., Groth C.G, Andersson U. Effects of FK506 and cyclosporin A on cytokine production studied in vitro at a single-cell level. Immunol. 1992;75(1):136–42.
55. Mok C.C. Calcineurin inhibitors in systemic lupus erythematosus. Best Pract Res Clin Rheumatol. 2017;31(3):429–38. Doi: 10.1016/j.berh.2017.09.010.
56. Zhou T., Lin S., Yang S., Lin W. Efficacy and safety of tacrolimus in induction therapy of patients with lupus nephritis. Drug Des Devel Ther. 2019;13:857–69. doi: 10.2147/DDDT.S189156.
57. Chen W., Tang X., Liu Q., et al. Short-term outcomes of induction therapy with tacrolimus versus cyclophosphamide for active lupus nephritis: a multicenter randomized clinical trial. Am J Kidney Dis. 2011;57(2):235–44. Doi: 10.1053/j.ajkd.2010.08.036.
58. Wang S., Li X., Qu L., et al. Tacrolimus versus cyclophosphamide as treatment for diffuse proliferative or membranous lupus nephritis: a non-randomized prospective cohort study. Lupus. 2012;21(9):1025–35. Doi: 10.1177/0961203312448105.
59. Zhang H., Hu W., Xie H., et al. Randomized controlled trial of tacrolimus versus intravenous cyclophosphamide in the induction trerapy of class V plus IV lupus nephritis. J Nephrol Dialy Transplant. 2006;15(6):508–14.
60. Mok C.C., Ying K.Y., Yim C.W., et al. Tacrolimus versus mycophenolate mofetil for induction therapy of lupus nephritis: a randomised controlled trial and long-term follow-up. Ann Rheum Dis. 2016;75(1):30–6. Doi: 10.1136/annrheumdis-2014-206456.
61. Li X., Ren H., Zhang Q., et al. Mycophenolate mofetil or tacrolimus compared with intravenous cyclophosphamide in the induction treatment for active lupus nephritis. Nephrol Dial Transplant. 2012;27(4):1467–72. Doi: 10.1093/ndt/gfr484.
62. Liu Z., Zhang H., Liu Z., et al. Multitarget therapy for induction treatment of lupus nephritis: a randomized trial. Ann Intern Med. 2015;162(1):18–26. Doi: 10.7326/M14-1030.
63. Sakai R., Kurasawa T., Nishi E., et al. Efficacy and safety of multitarget therapy with cyclophosphamide and tacrolimus for lupus nephritis: a prospective, single-arm, single-centre, open label pilot study in Japan. Lupus. 2018;27(2):273–82. Doi: 10.1177/0961203317719148.
64. Jesus D., Rodrigues M., da Silva J.A.P., Inês L. Multitarget therapy of mycophenolate mofetil and cyclosporine A for induction treatment of refractory lupus nephritis. Lupus. 2018;27(8):1358–62. Doi: 10.1177/0961203318758508.
65. Wiederrecht G., Lam E., Hung S., et al. The mechanism of action of FK-506 and cyclosporin A. Ann N Y Acad Sci. 1993;696:9–19. Doi: 10.1111/j.1749-6632.1993.tb17137.x.
66. Mok C.C. Calcineurin inhibitors in systemic lupus erythematosus. Best Pract Res Clin Rheumatol. 2017;31:429e438. doi: 10.1016/j.berh.2017.09.010.
67. Bîrsan T., Dambrin C., Freitag D.G., et al. The novel calcineurin inhibitor ISA247: a more potent immunosuppressant than cyclosporine in vitro. Transpl Int. 2005;17:767e71. Doi: 10.1007/s00147-004-0799-z.
68. Dooley M.A., Pendergraft III W., Ginzler E.M., et al. Speed of remission with the use of voclosporin, MMF and low dose steroids: results of a global lupus nephritis study
69. Navarra S.V., Guzman R.M., Gallacher A.E., et al. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial. Lancet. 2011;377:721–31. Doi: 10.1016/S0140-6736(10)61354-2.
70. Furie R., Petri M., Zamani O., et al. A phase II, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthr Rheum. 2011;63:3918–30. Doi: 10.1002/art.30613.
71. Strand V., Levy R.A., Cervera R., et al. BLISS-52 and -76 study groups. Improvements in health-related quality of life with belimumab, a B lymphocyte stimulator-specific inhibitor, in patients with autoantibody-positive systemic lupus erythematosus from the randomised controlled BLISS trials. Ann Rheum Dis. 2014;73:838–44.
72. Zhang F., Bae S.C., Bass D., et al. A pivotal phase III, randomised, placebo-controlled study of belimumab in patients with systemic lupus erythematosus located in China, Japan and South Korea. Ann Rheum Dis. 2018;77:355–63. Doi: 10.1136/annrheumdis-2017-211631.
73. Guerreiro Castro S., Isenberg D.A. Belimumab in systemic lupus erythematosus (SLE): evidence-to-date and clinical usefulness. Ther Adv Musculoskelet Dis. 2017;9(3):75–85. Doi: 10.1177/1759720X17690474.
74. Stohl W., Schwarting A., Okada M., et al. Efficacy and safety of subcutaneous belimumab in systemic lupus erythematosus: a fifty-two-week randomized, double-blind, placebo-controlled study. Arthr Rheumatol. 2017;69:1016–27. Doi: 10.1002/art.40049.
75. Doria A., Bass D., Schwarting A., et al. A 6-month open-label extension study of the safety and efficacy of subcutaneous belimumab in patients with systemic lupus erythematosus. Lupus. 2018;27:1489–98. Doi: 10.1177/0961203318777634.
76. Lavie F., Miceli-Richard C., Ittah M., et al. Increase of B cell-activating factor of the TNF family (BAFF) after rituximab treatment:insights into a new regulating system of BAFF production. Ann Rheum Dis. 2007;66(5):700–3. Doi: 10.1136/ard.2006.060772.
77. Carter L.M., Isenberg D.A., Ehrenstein M.R. Elevated serum BAFF levels are associated with rising anti-double-stranded DNA antibody levels and disease flare following B cell depletion therapy in systemic lupus erythematosus. Arthr Rheum. 2013;65(10):2672–9. Doi:10.1002/art.38074.
78. Ehrenstein M.R., Wing C. The BAFFling effects of rituximab in lupus: danger ahead? Nat Rev Rheumatol. 2016;12:367–72. doi: 10.1038/nrrheum.2016.18.
79. Petri M., Stohl W., Chatham W., et al. Association of plasma B lymphocyte stimulator levels and disease activity in systemic lupus erythematosus. Arthr Rheum. 2008;58:2453–59. Doi: 10.1002/art.23678.
80. Wei Yu Lin, Seshasayee D., Lee W.P., et al. Dual B cell immunotherapy is superior to individual anti-CD20 depletion or BAFF blockade in murine models of spontaneous or accelerated lupus. Arthr Rheum. 2015;67(1):215–24. Doi: 10.1002/art.38907.
81. Kraaij T., Huizinga T.W., Rabelink T.J., et al. Belimumab after rituximab as maintenance therapy in lupus nephritis. Rheumatol. 2014;53:2122–24. Doi: 10.1093/rheumatology/keu369.
82. De Vita S., Quartuccio L., Salvin S., et al. Sequential therapy with belimumab followed by rituximab in Sjö gren’s syndrome associated with B-cell lymphoproliferation and overexpression of BAFF:evidence for long-term efficacy. Clin Exp Rheumatol. 2014;32(4):490–94.
83. Меснянкина А.А., Соловьев С.К., Александрова Е.Н. и др. Двойная терапия генно-инженерными биологическими препаратами у пациентов с системной красной волчанкой. Научно-практическая ревматология. 2016;54(3):281–88.
84. Jones A., Muller P., Dore C.J., et al. Belimumab after B cell depletion therapy in patients with systemic lupus erythematosus (BEAT Lupus) protocol: a prospective multicentre, double-blind, randomised, placebo-controlled, 52-week phase II clinical trial. BMJ Open. 2019;9(12):e032569. Doi: 10.1136/bmjopen-2019-032569.
85. Larosa M., Zen M., Gatto M., et al. IL-12 and IL-23/Th17 axis in systemic lupus erythematosus. Exp Biol Med. (Maywood). 2019;244(1):42–51. Doi: 10.1177/1535370218824547.
86. Dai H., He F., Tsokos G.C., Kyttaris V.C. IL-23 Limits the Production of IL-2 and Promotes Autoimmunity in Lupus. J Immunol. 2017;199(3):903–10. Doi: 10.4049/jimmunol.1700418.
87. van Vollenhoven R.F., Hahn B.H., Tsokos G.C., Lipsky P., et al. Maintenance of efficacy and safety of ustekinumab through 1 year in a randomized phase II trial of patients with active systemic lupus erythematosus. Arthr Rheumatol. 2019 Nov 25. Doi: 10.1002/art.41179.
88. Насонов Е.Л, Соловьев С.К. Перспективы фармакотерапии системной красной волчанки. Научно-практическая ревматология. 2014;52(3):311–21. https://doi.org/10.14412/1995-4484-2014-311-321
89. Felten R., Scher F., Sagez F., et al. Spotlight on anifrolumab and its potential for the treatment of moderate-to-severe systemic lupus erythematosus: evidence to date. Drug Des. Devel Ther. 2019;13:1535–43. Doi: 10.2147/DDDT.S170969.
90. Насонов Е.Л., Лила А.М. Ингибиторы Янус-киназ при иммуновоспалительных ревматических заболеваниях: новые возможности и перспективы. Научно-практическая ревматология. 2019;57(1):8–16. Doi: https://doi.org/10.14412/1995-4484-2019-8-16
91. König N., Fiehn C., Wolf C., et al. Familial chilblain lupus due to a gain-of-function mutation in STING. Ann Rheum Dis. 2017;76(2):468–72. Doi: 10.1136/annrheumdis-2016-209841.
92. Rodero M.P., Frémond M.-L., Rice G.I., et al. JAK inhibition in STING-associated interferonopathy. Ann Rheum Dis 2016;75(12):e75–5. Doi: 10.1136/annrheumdis-2016-210504.
93. Hildebrand A.M., Huang S.H., Clark W.F. Plasma exchange for kidney disease: What is the best evidence? Adv Chronic Kidney Dis. 2014;21:217–27. Doi: 10.1053/j.ackd.2014.01.008.
94. Pagnoux C., Korach J.M., Guillevin L. Indications for plasma exchange in systemic lupus erythematosus in 2005. Lupus. 2005;14:871–77. Doi:10.1191/0961203305lu2174rr.
95. Walters G. Role of therapeutic plasmapheresis in ANCA-associated vasculitis. Pediatr Nephrol. 2016;31:217–25. Doi: 10.1007/s00467-014-3038-6.
96. Frausová D., Hrušková Z., Lanska V., et al. Long-term outcome of patients with ANCA-associated vasculitis treated with plasma exchange: A retrospective, single-centre study. Arthr Res Ther. 2016;18:168. Doi: 10.1186/s13075-016-1055-5.
97. Li Q.Y., Yu F., Zhou F.D., Zhao M.H. Plasmapheresis is associated with better renal outcomes in lupus nephritis patients with thrombotic microangiopathy: A case series study. Med. (Baltimore) 2016;95:e3595. Doi: 10.1097/MD.0000000000003595.
Об авторах / Для корреспонденции
Автор для связи: Е.А. Асеева, Научно-исследовательский институт ревматологии им. В.А. Насоновой, Москва, Россия; eaasseeva@mail.ru
Адрес: 115522, Россия, Москва, Каширское ш., 34АИсточник https://diseases.medelement.com/disease/%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%BD%D0%B0%D1%8F-%D0%BA%D1%80%D0%B0%D1%81%D0%BD%D0%B0%D1%8F-%D0%B2%D0%BE%D0%BB%D1%87%D0%B0%D0%BD%D0%BA%D0%B0-%D0%BA%D0%BF-%D1%80%D0%BA-2021/16890
Источник https://clinpharm-journal.ru/articles/2022-4/glyukokortikosteroidy-pri-sistemnoj-krasnoj-volchanke-perspektivy-steroidosberegayushhej-terapii/
Источник https://pharmateca.ru/ru/archive/article/39681