Лечение подагры: что важно помнить, чтобы избежать ошибок
Подагра — системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия в различных тканях и развивающимся в связи с этим воспалением, у лиц с гиперурикемией, обусловленной факторами внешней среды и/или генетическими факторами [3].
Основные принципы лечения подагры за последние 50 лет, с момента внедрения в практику аллопуринола, не претерпели каких-либо глобальных изменений. Но при всей видимой простоте частота ошибок при лечении недуга крайне велика. Несколько лет назад T. R. Mikults и соавт. проанализировали более 500 000 случаев ошибок при назначении 701 лекарственного препарата. оказалось, что частота ошибок при лечении подагры в среднем в 5,5 раза превышала таковую при других заболеваниях, а аллопуринол и колхицин были в числе лекарственных средств, назначение которых наиболее часто приводит к подобным проблемам [29].
Несколько лет назад экспертным комитетом европейской антиревматической лиги были сформулированы рекомендации по лечению недуга. Анализируя эти рекомендации, лечение и профилактику подагры можно условно разделить на четыре этапа: немедикаментозные методы профилактики и лечения, купирование острого приступа артрита, антигиперурикемическая терапия, профилактика обострений артрита.
Цель обзора — подробное рассмотрение основных принципов ведения больных подагрой на разных этапах (применения немедикаментозных методов, купирования артрита, подбора антигиперурикемической терапии, профилактики приступов артрита при инициации антигиперурикемической терапии), а также анализ наиболее распространенных ошибок, совершаемых при лечении подагры.
Немедикаментозные методы профилактики и лечения
ведущим компонентом профилактики и лечения подагры является модификация факторов риска гиперурикемии (ожирения, нарушений углеводного и липидного обменов, артериальной гипертензии), а максимально эффективным методом, позволяющим уменьшить риск развития подагры и избежать приема лекарственных препаратов (или сократить потребность в них у больных с уже имеющимся заболеванием), — диетотерапия [1, 15]. По данным P. Richette и соавт., недостаточный контроль в отношении урикемии больными подагрой ассоциировался в порядке убывания с потреблением ими подслащенных напитков, алкоголя, большей окружностью талии и лишь затем — с меньшей продолжительностью болезни [33].
в последние годы принципы диетотерапии у больных подагрой претерпели некоторые изменения. доказано, что большего снижения сывороточного уровня мочевой кислоты (мк), в сравнении с низкопуриновой диетой, можно добиться при применении низкокалорийной диеты [11], а некоторые из ранее табуированных для больных подагрой продуктов питания не повышают сывороточный уровень мк или даже снижают его (табл. 1) [1].
доказано, что в отличие от потребления пуриносодержащих продуктов животного происхождения включение в рацион питания растительной пищи, в том числе богатых пуринами бобовых, грибов, некоторых овощей и т. д., если и приводит к повышению сывороточного уровня мк, то на очень непродолжительное время. Быстрое нивелирование действия данных продуктов (предположительно за счет флавоноидов, входящих в их состав и способствующих урикозурии) минимизирует их влияние на обмен мк. Эти «послабления» в диете крайне важны: частичная замена животных белков растительными позволяет не только обеспечивать потребность организма в белках, но и расширять рацион питания за счет продуктов в большинстве своем низкокалорийных, что принципиально для больных подагрой с избыточной массой тела и ожирением.
изменить вектор питания в благоприятную сторону могут прежде всего молочные продукты, так как белки, входящие в их состав (лактальбумин и казеин), — мощные урикозурики. так, риск развития подагры у лиц, потребляющих молочные продукты в достаточном количестве (верхний квартиль), снижен почти в 1,8 раза [30]. При этом набор молочных продуктов может быть различным, вплоть до сухого молока, потребление которого снижает риск приступа подагрического артрита [18], но все они должны быть низкокалорийными, иначе урикозурическое действие не реализуется.
цитрусовые обладают рядом преимуществ перед другими фруктами, которые в большом количестве (прежде всего в виде фруктовых соков) за счет фруктозы, блокирующей работу уратных транспортеров в почечных канальцах, могут способствовать повышению урикемии. концентрации витамина С и флавоноидов у цитрусовых максимальны, результатом чего являются урикозурический и кардиопротективный эффекты. кроме того, подобно цитратным смесям, они способны благоприятно влиять на кислотность мочи. Схожие свойства имеет вишня, она оказывает и ангиопротективное действие, что имеет практическое значение, в частности, у больных сахарным диабетом.
Несколько крупных исследований показали и эффективность регулярного потребления кофе. Снижение сывороточного уровня мк было «дозозависимым» (чем больше чашек в день, тем лучше), но не имело связи с содержанием кофеина [9, 14, 36]. Предполагается, что механизмы влияния кофе на уровень урикемии различны: он оказывает аллопуринолоподобное действие, повышает чувствительность тканей к инсулину (при регулярном приеме) и способствует снижению веса [7, 12, 25].
Некоторой «отдушиной» для значительной части больных подагрой могут быть и результаты нескольких работ, продемонстрировавшие, что сухое вино в небольшом количестве (не более одного-двух бокалов в день!), в отличие от других алкогольных напитков, не влияет на сывороточный уровень мк и не увеличивает риск возникновения и развития подагры [9]. в настоящее время основные метаболически благоприятные эффекты вина, включающие снижение Ад, постпрандиального уровня липидов, инсулинорезистентности, связывают с его натуральным компонентом — ресвератролом [13].
Таблица 1
Влияние некоторых продуктов питания на риск развития подагры и гиперурикемии
- Мясо
- Рыба, морепродукты
- Алкоголь, за исключением сухого вина в небольшом количестве
- Фруктозосодержащие продукты (подслащенные сахаром напитки, сладкие фрукты и фруктовые соки, за исключением цитрусовых)
- Овощи, орехи, в том числе богатые пурином
- Сухое вино (до двух бокалов в сутки)
- Цитрусовые
- Чай
- Молочные продукты с высоким содержанием жира
- Кофе (независимо от содержания кофеина)
- Молочные продукты с низким содержанием жира
- Продукты, богатые витамином C
Примечание. ИМТ — индекс массы тела; ОБ — окружность бедер; ОТ — окружность талии.
Купирование приступа подагрического артрита
Для купирования приступа артрита у больных подагрой могут использоваться НПвП, их следует назначать в максимально допустимой дозе, но коротким курсом. Несколько десятков сравнительных исследований не показали глобального преимущества неселективных и селективных к циклооксигеназе 2 (цоГ-2) НПвП друг перед другом при лечении острой боли, однако целесообразно использование средств, противовоспалительный и анальгетический эффект которых наступает максимально быстро и стоек, а частота развития нежелательных явлений при этом меньше, чем у других препаратов.
Этим требованиям в наибольшей степени отвечает эторикоксиб (Аркоксиа), обладающий рядом особенностей, которые позволяют активно использовать его для лечения острой боли. Эторикоксиб — один из немногих НПвП, зарегистрированных для лечения подагры. Пиковая концентрация препарата в крови достигается уже через час, а анальгетический эффект при купировании острой боли наступает через 24 минуты после приема — быстрее, чем, например, при приеме ибупрофена [27]. оптимальный период полувыведения (22 часа) позволяет, в отличие от многих других НПвП, применять препарат всего 1 раз в сутки, обеспечивая стабильный противовоспалительный и обезболивающий эффект.
Возможность использования эторикоксиба подтверждена в наиболее крупных сравнительных исследованиях применения НПвП при подагре [19, 31]. Сравнение эффективности эторикоксиба (120 мг/сут) и индометацина (150 мг/сут) у 150 больных с острым приступом подагрического артрита показало, что уже через 4 часа после приема эторикоксиба у 32% больных наблюдался достаточный анальгетический эффект (легкая боль или ее отсутствие), а спустя то же время после приема индометацина — у 23% больных [31]. к восьмому дню терапии артрит был купирован у 9 из 10 пациентов как в группе принимавших эторикоксиб, так и в группе принимавших индометацин, но определяющими в оценке выбора препарата были различия в безопасности лечения. если прием индометацина у трех пациентов был причиной развития тяжелых побочных эффектов (язва желудка и язвенное кровотечение), то среди больных, получавших эторикоксиб, таких случаев зафиксировано не было.
кроме того, частота лекарственно индуцированных нежелательных эффектов у эторикоксиба (16,5%) была более чем в 2 раза меньше, чем у индометацина (37,2%), по данным другого сравнительного исследования [19]. Этот факт особенно важен, так как столь очевидные различия были отмечены при проведении короткого курса терапии, который чаще всего бывает достаточным для купирования приступа артрита при подагре.
Эффективен и колхицин, алкалоид трополонового ряда, извлекаемый из растения безвременник осенний. в основе действия препарата — подавление миграции лейкоцитов в очаг воспаления и фагоцитоза кристаллов моноурата натрия. в последние годы пересматривается схема терапии колхицином: есть основания считать, что назначение низких доз препарата столь же быстро может приводить к уменьшению боли и воспаления, что и максимальных доз, при этом переносимость низких доз (по 0,5–1 мг 1–2 раза в сутки) намного лучше. данные одной из последних таких работ свидетельствуют, что при сопоставимой эффективности низких и высоких доз колхицин в несколько раз реже отменялся у больных, принимавших его в низких дозах [23]. При этом побочные эффекты со стороны жкт при применении высоких доз колхицина развиваются почти у 100% больных. важно знать, что даже при приеме препарата в низких дозах клинически значимая концентрация сохраняется длительно, что позволяет назначать препарат 1 раз в сутки.
Применения колхицина следует избегать при скорости клубочковой фильтрации менее 10 мл/мин, у больных на гемодиализе, у пациентов с гепатобилиарной дисфункцией и клинически значимой печеночной недостаточностью.
При длительном приеме обязателен контроль за мышечной силой, уровнем креатининфосфокиназы, клиническим анализом крови, так как существует риск развития цитопении и рабдомиолиза, особенно при совместном использовании колхицина с антибактериальными (азитромицин, кларитромицин), липидснижающими препаратами (статины, фибраты), верапамилом и дилтиаземом, циклоспорином, кетоконазолом [6, 34, 35]. данные, свидетельствующие о различиях в эффективности купирования приступа артрита при подагре между колхицином и НПвП, отсутствуют.
В некоторых случаях возможны внутрисуставные инъекции глюкокортикоидов. Перед введением препарата сустав рекомендуется промыть. возможно назначение короткого (!) курса средних доз глюкокортикоидов (до 30–40 мг/сут в пересчете на преднизолон) с быстрой отменой (через несколько дней). Столь же эффективным может быть внутривенное введение метилпреднизолона, однако следует помнить, что это может сопровождаться развитием ряда нежелательных эффектов (ишемия миокарда, нарушения ритма сердца, подъем Ад, гипергликемия и др.) [2]. лечение глюкокортикоидами у больных с кардиоваскулярными заболеваниями и сахарным диабетом желательно проводить в стационаре.
Антигиперурикемическая терапия
К сожалению, изменение образа жизни и диета не часто позволяют обойтись без медикаментозной коррекции гиперурикемии. и именно адекватное снижение уровня мк в крови — основа успешного лечения подагры.
инициирование такой терапии не предопределяется собственно диагнозом подагры.
Абсолютные показания для ее назначения:
- четыре приступа артрита в год и более
- хронический артрит
- наличие подкожных и/или внутрикостных тофусов
- уратный нефролитиаз
- гиперпродукция мк (например, при дефектах энзимов пуринового метаболизма)
- прием препаратов, приводящих к гиперурикемии и урикозурии (например, салицилатов в низких дозах, диуретиков и др.)
- подагрическая нефропатия
Показано, что достигнутая при приеме антигиперурикемических препаратов и стойко (в течение 6 лет) сохраняющаяся нормоурикемия позволяет избегать приступов артрита после отмены такой терапии тем дольше, чем ниже был достигнутый в процессе лечения сывороточный уровень мк [37]. в среднем длительность периода от отмены терапии до первого приступа артрита в зависимости от достигнутого уровня урикемии составляла 34–49 месяцев. Это развенчивает миф о том, что антигиперурикемическая терапия должна быть пожизненной.
Другой частой ошибкой является, напротив, необоснованная отмена аллопуринола при обострении артрита. известно, что риск развития обострения артрита при инициации терапии аллопуринолом в первое время увеличивается. временная его отмена возможна только в первые недели после назначения, в случае длительного приема аллопуринола это недопустимо. При обострении артрита речь может идти только о недостаточной эффективности применяемой дозы препарата, и после купирования приступа артрита следует продолжить титрование дозы до нормоурикемии.
Стартовая суточная доза аллопуринола не должна превышать 100 мг, а дальнейшее ее наращивание следует проводить постепенно, по 50–100 мг каждые 2–4 недели, до достижения целевого уровня урикемии. Независимо от дозы аллопуринол назначают 1 раз в сутки. лечение проводят под строгим лабораторным контролем, даже принимая во внимание, что вероятность гепатотоксического действия препарата при приеме его в низких дозах минимальна. Подобная тактика позволяет минимизировать риск осложнений, связанных с приемом препарата, в том числе вероятность обострений артрита.
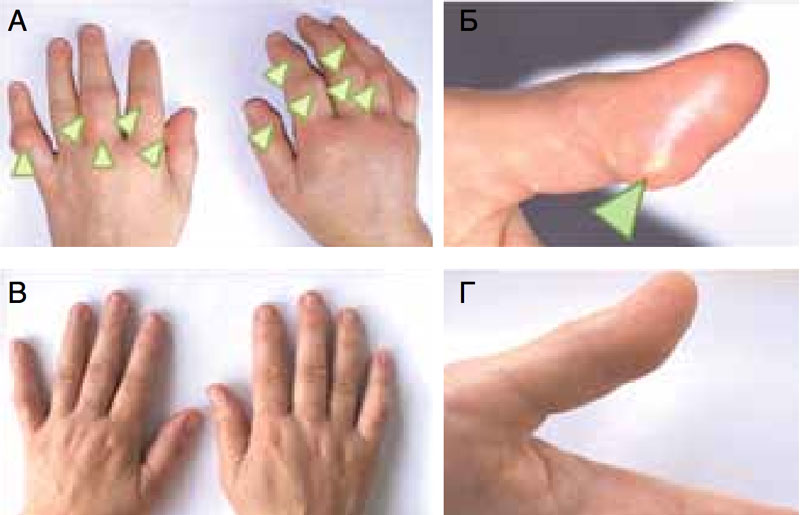
Рис. Больная Г., 53 года. А и Б — до лечения, зелеными стрелками отмечены подкожные тофусы в области мелких суставов и мягких тканей кистей (А) и тофус в области мягких тканей дистальной фаланги 1-го пальца левой кисти (Б). В и Г — через 9 месяцев терапии аллопуринолом. Фото автора.
Наиболее тяжелыми являются связанные с приемом аллопуринола аллергические реакции, частота которых превышает 2% [28]. особенно тяжелые реакции, частота которых достигает 0,4%, включают токсический эпидермальный некролиз, мультиформную эритему и эксфолиативный дерматит, острый гепатит, острый интерстициальный нефрит с развитием почечной недостаточности и лихорадкой, лейкоцитоз и эозинофилию [22]. Смертность при подобных реакциях достаточно высока — 18% [26].
Помимо генетически детерминированных причин (носительство HLA*B5801) [24], развитие аллергических реакций, как предполагается, может быть связано с вирусом герпеса (HHV-6). Подобные реакции чаще развиваются у женщин, у больных с почечной недостаточностью, в пожилом и старческом возрасте, а также в случае отсутствия прямых показаний к приему препарата. По данным исследования, обоснованность назначения аллопуринола была подтверждена только у 36% больных с наличием тяжелых аллергических реакций на препарат [26]. Этот факт подчеркивает, что необходимо очень осторожно подходить к терапии аллопуринолом, особенно в группах риска, и избегать необоснованного назначения препарата. Предложены несколько схем десенсибилизации, но, к сожалению, они не всегда позволяют добиться желаемого результата и могут применяться только при нетяжелых аллергических реакциях [20].
При неэффективности или непереносимости аллопуринола могут применяться другие препараты (табл. 2), однако выбор их весьма скуден, ввиду того что большинство из перечисленных лекарственных средств в россии пока не зарегистрированы.
урикозурические агенты пробенецид и сульфинпиразон могут применяться как альтернатива аллопуринолу у пациентов с нормальной функцией почек, но противопоказаны больным с уролитиазом. в отличие от других урикозуриков, бензбромарон может использоваться даже у больных с почечной недостаточностью, но в связи с гепатотоксичностью его назначение предполагает необходимость динамического лабораторного контроля. При этом средние дозы бензбромарона (100 мг/сут) эффективнее, чем таковые у аллопуринола (300 мг/сут). При применении высоких суточных доз (200 и 600 мг соответственно) эти различия нивелируются [5].
Фебуксостат в настоящее время рекомендуется назначать в качестве средства второй линии терапии при неэффективности или непереносимости аллопуринола. Применение препарата возможно при умеренной почечной недостаточности. в небольших дозах (40–80 мг/сут) он способен значительно чаще, чем аллопуринол в сопоставимых дозах, приводить к нормоурикемии [21].
Препараты уриказы целесообразно назначать при неэффективности других методов лечения подагры, а также онкологическим больным, получающим химиотерапию или лучевую терапию. Эти препараты, назначаемые в виде внутривенных инъекций, к сожалению, часто приводят к посттрансфузионным реакциям.
При назначении лечения следует помнить и о часто необоснованном применении больными, особенно женщинами, диуретиков (как петлевых, так и тиазидных), нередко являющемся основной причиной развития подагры и глобально меняющем течение заболевания [4]. Показано, что риск первого приступа подагрического артрита при приеме диуретиков увеличивается в 2,5 раза [10]. риск приступа артрита у больных подагрой повышается при приеме тиазидных диуретиков в 3,2 раза, а петлевых — в 3,8 раза [32]. таким образом, применение диуретиков больными подагрой возможно только при наличии абсолютных показаний. Следует также помнить, что влияние их на уровень мк дозозависимое.
Напротив, применение лозартана (непептидный блокатор рецептора ангиотензина II) и фенофибрата (активатор рецепторов PPARα) у больных с наличием прямых показаний к их назначению может приводить к умеренному урикозурическому эффекту (не групповому, свойственному только этим лекарственным средствам!), что особенно важно при выборе метода лечения больных подагрой с неэффективностью терапии аллопуринолом или наличием противопоказаний к ней. Назначение лозартана и фенофибрата при подагре обоснованно при наличии прямых показаний: для лозартана — артериальной гипертензии; для фенофибрата — дислипидемии IIа, IV, V типов, неэффективности диетотерапии при дислипидемии IIb, III типов.
Таблица 2. Лекарственные средства с доказанным антигиперурикемическим эффектом
| Типы препаратов по антигиперурикемическому эффекту | Лекарственные препараты |
|---|---|
| Урикостатики | Аллопуринол* Оксипуринол Фебуксостат |
| Урикозурики | Пробенецид Сульфинпиразон Бензбромарон |
| Препараты уриказы (уриколитики) | Уриказа Пегуриказа Расбуриказа |
Примечание. ИМТ — индекс массы тела; ОБ — окружность бедер; ОТ — окружность талии.
Помимо необходимости контроля за сывороточным уровнем мк, не следует забывать о том, что с приемом фенофибрата могут быть связаны повышение показателей печеночных трансаминаз, креатинфосфокиназы, развитие редких, но потенциально жизнеугрожающих осложнений — тромбоэмболии, рабдомиолиза, острой почечной недостаточности.
Профилактика приступов артрита при инициации антигиперурикемической терапии
Согласно рекомендациям экспертного комитета по подагре европейской антиревматической лиги, профилактика суставных атак в течение первого месяца антигиперурикемической терапии может достигаться применением как колхицина (следует использовать низкие дозы препарата, достаточно 0,5–1,0 г/день однократно), так и НПвП (также в минимальной эффективной противовоспалительной дозе, при показаниях — с гастропротекцией) [15]. При наличии противопоказаний к применению НПвП и колхицина возможно назначение низких доз глюкокортикоидов. Подобная превентивная тактика позволяет не только минимизировать риск обострения артрита, но и уменьшить вероятность самостоятельной отмены больными аллопуринола.
Заключение
Важной составляющей лечения при подагре должно быть осуществляемое врачом динамическое наблюдение за больным: частота визитов к врачу для мониторинга подагры и коморбидных заболеваний прямо коррелирует с приверженностью больных к назначаемой терапии [8].
однако значение таких консультаций может быть и обратным. известно, что склонность больных подагрой к лечению очень низкая и намного уступает таковой у больных другими хроническими заболеваниями [16]. Анализ причин отказа больных подагрой от терапии показал, что основным фактором являются некорректные рекомендации врача, а уже затем прием большого числа лекарственных препаратов, обострение артрита в первые недели после начала терапии аллопуринолом, низкая комплаентность и т. д. [21]. иными словами, даже незначительная на первый взгляд врачебная оплошность при ведении больного подагрой может предопределить прогрессирование заболевания на долгие годы. Недопущение подобных ошибок — вполне решаемая задача.
Резюме
Цель обзора — подробное рассмотрение основных принципов ведения больных подагрой на разных этапах, а также анализ наиболее распространенных ошибок, совершаемых при лечении подагры.
Отдельно охарактеризованы немедикаментозные методы профилактики и лечения, купирование острого приступа артрита, антигиперурикемическая терапия, профилактика обострений артрита. важная составляющая лечения при подагре — осуществляемое врачом динамическое наблюдение за больным: частота визитов к врачу для мониторинга подагры и коморбидных заболеваний прямо коррелирует с приверженностью больных к назначаемой терапии. ■
Литература
1. Елисеев М. С. Диета при подагре / М. С. Елисеев, В. Г. Барскова // Доктор.Ру. 2011. No 1 (60). С. 55–58.
2. Кратковременное применение глюкокортикоидов у больных с затяжным и хроническим подагрическим артритом. Часть III: Частота развития нежелательных реакций / А. А. Федорова [и др.] // Науч.-практ. ревматология. 2009. No 2. С. 38–41.
3. Насонова В. А. Ранние диагностика и лечение подагры — научно обоснованное требование улучшения трудового и жизненного прогноза больных / В. А. Насонова, В. Г. Барскова // Науч.-практ. ревматология. 2004. No 1. С. 5–7.
4. Факторы риска подагры: половые различия / М. С. Елисеев [и др.] // Науч.-практ. ревматология. 2011. No 6. С. 27–30.
5. A randomised controlled trial on the efficacy and tolerability with dose escalation of allopurinol 300–600 mg/day versus benzbromarone 100–200 mg/day in patients with gout / M. K. Reinders [et al.] // Ann. Rheum. Dis. 2009. Vol. 68. N 6. P. 892–897.
6. Acute colchicine intoxication during clarithromycin administration / F. Rollot [et al.] // Ann. Pharmacother. 2004. Vol. 38. N 12. P. 2074–2077.
7. Acute effects of decaffeinated coffee and the major coffee components chlorogenic acid and trigonelline on glucose tolerance / A. E. van Dijk [et al.] // Diabetes Care. 2009. Vol. 32. N 6. P. 1023–1025.
8. Adherence with urate-lowering therapies for the treatment of gout / L. R. Harrold [et al.] // Arthritis Res. Ter. 2009. Vol. 11. N 2. P. R46.
9. Alcohol intake and risk of incident gout in men: a prospective study /
H. K. Choi [et al.] // Lancet. 2004. Vol. 363. N 9417. P. 1277–1281.
10.Antihypertensive drugs and risk of incident gout among patients with hypertension: population based case-control study / H. K. Choi [et al.] // BMJ. 2012 Jan. 12. Vol. 344: d8190. DOI: 10.1136/bmj.
d8190.
11. Beneficial effects of weight loss associated with moderate calorie/
carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study / P. Dessein [et al.] // Ann. Rheum. Dis. 2000. Vol. 59. N 7. P. 539–543.
12. Caffeinated coffee, decaffeinated coffee, and caffeine in relation to plasma C-peptide levels, a marker of insulin secretion, in U.S. women / T. Wu [et al.] // Diabetes Care. 2005. Vol. 28. N 6. P. 1390–1396.
13. Calorie restriction-like effects of 30 days of resveratrol supplementation on energy metabolism and metabolic profile in obese humans / S. Timmers [et al.] // Cell. Metab. 2011. Vol. 14. N 5. P. 612–622.
14. Choi H. K. Coffee, tea, and caffeine consumption and serum uric acid level: the Third National Health and Nutrition Examination Survey / H. K. Choi, G. Curhan // Arthritis Rheum. 2007. Vol. 57. N 5. P. 816–821.
15.Clinical Studies Including Therapeutics (ESCISIT) EULAR Standing Committee for International Part II: Management. Report of a task force of the EULAR evidence based recommendations for gout / W. Zhang [et al.] // Ann. Rheum. Dis. 2006. Vol. 65. N 10. P. 1312–1324.
16. Comparison of drug adherence rates among patients with seven different medical conditions / B. A. Briesacher [et al.] // Pharmacotherapy. 2008. Vol. 28. N 4. P. 437–443.
17. Effect of uratelowering therapy on the velocity of size reduction of tophi in chronic gout / F. Perez-Ruiz [et al.] // Arthritis Rheum. 2002. Vol. 47. N 4. P. 356–360.
18. Effects of skim milk powder enriched with glycomacropeptide and G600 milk fat extract on frequency of gout flares: a proof-of-concept randomized controlled trial / N. Dalbeth [et al.] // Ann. Rheum. Dis. 2012. Vol. 71. N 6. P. 929–934.
19. Efficacy and safety profile of treatment with etoricoxib 120 mg once daily compared with indomethacin 50 mg three times daily in acute gout: a randomized controlled trial / B. R Rubin [et al.] // Arthritis Rheum. 2004. Vol. 50. N 2. P. 598–606.
20.Fam A. G. Alternate urate-lowering drugs and the management of hyperuricemia in allopurinol-intolerant patients // Int. J. Adv. Rheumatol. 2003. Vol. 1. N 4. P. 122–130.
21. Febuxostat compared with allopurinol in patients with hyperuricemia and gout / M. A. Becker [et al.] // N. Engl. J. Med. 2005. Vol. 353. N 23. P. 2450–2461.
22.Hande K. R. Severe allopurinol toxicity. Description and guidelines for prevention in patients with renal insufficiency / K. R. Hande, R. M. Noone, W. J. Stone // Am. J. Med. 1984. Vol. 76. N 1. P. 47–56.
23. High versus low dosing of oral colchicine for early acute gout flare: Twenty-four-hour outcome of the first multicenter, randomized, doubleblind, placebo-controlled, parallel-group, dose-comparison colchicine study / R. A. Terkeltaub [et al.] // Arthritis Rheum. 2010. Vol. 62. N 4. P. 1060–1068.
24. HLA-B*5801 allele as a genetic marker for severe cutaneous adverse reactions caused by allopurinol / S. I. Hung [et al.] // Proc. Natl. Acad. Sci. USA. 2005. Vol. 102. N 11. P. 4134–4139.
25.Inverse association between coffee drinking and serum uric acid concentrations in middle-aged Japanese males / C. Kiyohara [et al.] // Br. J. Nutr. 1999. Vol. 82. N 2. P. 125–130.
26. Lee H. Y. Allopurinol hypersensitivity syndrome: a preventable severe cutaneous adverse reaction? / H. Y. Lee, J. T. Ariyasinghe, T. Thirumoorthy // Singapore Med. J. 2008. Vol. 49. N 5. P. 384–387.
27. Malmstrom K. Etoricoxib in acute pain associated with dental surgery: a randomized, double-blind, placeboand active comparator-controlled dose-ranging study / K. Malmstrom, A. Sapre, H. Couglin // Clin. Ther. 2004. Vol. 26. N 5. P. 667–679.
28.McInnes G. T. Acute adverse reactions attributed to allopurinol in hospitalized patients / G. T. McInnes, D. H. Lawson, H. Jick // Ann. Rheum. Dis. 1981. Vol. 40. N 3. P. 245–249.
29. Medication errors with the use of allopurinol and colchicine: a retrospective study of a national, anonymous internet-accessible error reporting system / T. R. Mikults [et al.] // J. Rheumatol. 2006. Vol. 33. N 3. P. 562–566.
30. Purine-rich foods, dairy and protein intake, and the risk of gout in men / H. K. Choi [et al.] // N. Engl. J. Med. 2004. Vol. 350. N 11. P. 1093–1103.
31.Randomised double blind trial of etoricoxib and indometacin in treatment of acute gouty arthritis / H. R. Schumacher [et al.] // BMJ. 2002. Vol. 324. N 7352. P. 1488–1492.
32. Recent diuretic use and the risk of recurrent gout attacks: the online case-crossover gout study / D. J. Hunter [et al.] // J. Rheumatol. 2006. Vol. 33. N 7. P. 1341–1345.
33. Richette P. Factors associated with poor control of urate levels under urate lowering therapy: a cross sectional study of 1689 gouty patients / P. Richette, G. Errieau, R.-M. Flipo // Ann. Rheum. Dis. 2012. Vol. 71. Suppl. 3. P. S440.
34. Simkin P. A. Colchicine use in cyclosporine treated transplant recipients: how little is too much? / P. A. Simkin, G. C. Gardner // J. Rheumatol. 2000. Vol. 27. N 6. P. 1334–1337.
35. Terkeltaub R. A. Colchicine update: 2008 // Semin Arthritis Rheum. 2009. Vol. 38. N 6. P. 411–419.
36. The relation of coffee consumption to serum uric Acid in Japanese men and women aged 49–76 years / N. M. Pham [et al.] // J. Nutr. Metab. 2010. Epub. 2010 Jul 27. PII: 930757. DOI: 10.1155/2010/930757.
37.Using serum urate levels to determine the period free of gouty symptoms after withdrawal of long-term urate-lowering therapy: a prospective study / F. Perez-Ruiz [et al.] // Arthritis Rheum. 2006. Vol. 55. N 5. P. 786–790.
Ключевые слова: подагра, терапия, мочевая кислота (мк), аллопуринол.
Summary
This article discusses the basic principles for treating gout that may help minimize the number of doctors’ errors in administering therapy to patients.
It specifically characterizes separate treatment stages for this patient population: non-pharmaceutical prevention and treatment; treatment for an acute arthritis attack; treatment for hyperuricemia; and prevention of arthritis flare-ups.
Another important component of the strategy for treating gout is repeat follow-ups by a physician: The frequency of medical check-ups to monitor gout and its comorbid conditions correlates directly with the degree of patients’ compliance with the treatment.
Keywords: gout, treatment, uric acid (UA), allopurinol.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Подагра
Клинические рекомендации «Подагра» прошли общественную экспертизу, согласованны и утверждены 17 декабря 2013 г., на заседании Пленума правления АРР, проведенного совместно с профильной комиссией МЗ РФ по специальности «ревматология». (Президент АРР, академик РАН — Е.Л.Насонов)
Подагра — системное тофусное заболевание, характеризующееся отложением в различных тканях кристаллов моноурата натрия (МУН) и развивающимся в связи с этим воспалением у лиц с гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами.
Общая характеристика болезни
Основные клинические проявления подагры: рецидивирующие атаки острого артрита, накопление кристаллов уратов в тканях с образованием тофусов, нефролитиаз, подагрическая нефропатия.
В развитии подагры выделяют 3 стадии:
— острый подагрический артрит
— периоды между приступами подагрического артрита (межприступная подагра)
— хроническая тофусная подагра.
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
+7 938 489 4483 / +7 707 707 0716 / + 375 29 602 2356 / office@medelement.com
Мне интересно! Свяжитесь со мной
Классификация
Классификационные критерии, принципы диагностики подагры
Для диагностики подагрического артрита в 1975 году Американской Ассоциацией Ревматологов (ААР) были рекомендованы предварительные классификационные критерии, одобренные ВОЗ в 2002 году.
Классификационные критерии острого подагрического артрита
А. Наличие характерных кристаллов мочевой кислоты в суставной жидкости
Б. Наличие тофусов, содержание кристаллов мочевой кислоты, в которых подтверждено химически или поляризационной микроскопией
В. Наличие 6 из 12 ниже перечисленных признаков:
1. Более одной атаки острого артрита в анамнезе
2. Воспаление сустава достигает максимума в 1-й день болезни
3. Моноартрит
4. Гиперемия кожи над пораженным суставом
5. Припухание и боль в первом плюснефаланговом суставе
6. Одностороннее поражение первого плюснефалангового сустава
7. Одностороннее поражение суставов стопы
8. Подозрение на тофусы
9. Гиперурикемия
10. Асимметричный отек суставов
11. Субкортикальные кисты без эрозий (рентгенография)
12. Отрицательные результаты при посеве синовиальной жидкости
Диагностика
Клиническая характеристика основных симптомов подагры.
Демонстрация кристаллов моноурата натрия (МУН) в синовиальной жидкости или в содержимом тофуса позволяет поставить определенный диагноз подагры (уровень доказательности IIb). Специфичность метода поляризационной микроскопии для демонстрации кристаллов крайне высока.
Основным клиническим проявлением, который позволяет заподозрить подагру является острый артрит. Острая атака с быстрым развитием выраженной боли и воспаления, которые достигают максимума в течение 6-12 часов, особенно сопровождающиеся эритемой, высоко подозрительны в отношении микрокристаллического воспаления, хотя не специфичны для подагры (уровень доказательности IIb).
Рутинный поиск кристаллов рекомендуется в любой синовиальной жидкости, полученной из воспаленного сустава у больных с отсутствием определенного диагноза (уровень доказательности IV).
Пунктировать суставы в диагностических целях можно и в межприступный период. Идентификация кристаллов МУН из невоспаленного сустава обеспечивает определенный диагноз в межприступном периоде (уровень доказательности IIb).
Подагра и сепсис могут сосуществовать, поэтому при подозрении на септический артрит окраска по грамму и исследования культуры синовиальной жидкости должны выполняться даже в случае идентификации кристаллов МУН (уровень доказательности IIb). Гораздо чаще септического артрита развиваются нагноения мягких тканей в области вскрывшихся подкожных тофусов.
Несмотря на то, что ГУ является наиболее важным фактором риска подагры, сывороточный уровень МК не является фактором исключения или подтверждения подагры: многие люди с ГУ не развивают подагры, а во время острой атаки сывороточный уровень МК может быть нормальным (уровень доказательности Ib).
Почечная экскреция мочевой кислоты должна определяться у некоторых больных подагрой, имеющих семейную историю подагры с ранним началом, начало подагры ранее 25 лет, с анамнезом МКБ (уровень доказательности IIb).
Рентгенологическое исследование суставов помогает в проведении дифференциального диагноза и может демонстрировать типичные признаки хронической подагры, но бесполезно в ранней диагностике подагры (уровень доказательности IIb). Формирование внутрикостных тофусов часто происходит одновременно с подкожными тофусами, в связи с чем, рентгенологическое исследование используется для определения тяжести тофусного поражения. В действительности, при остром подагрическом артрите, рентгенологические изменения не всегда могут быть полезны для постановки диагноза подагры. Тем не менее, в ряде ситуаций выполнение рентгенограмм вполне оправдано для проведения дифференциального диагноза с травмами и т.д.
Факторы риска подагры и сопутствующие болезни должны выявляться, включая признаки метаболического синдрома (ожирение, гипергликемия, гиперлипидемия, гипертензия) (уровень доказательности Ia или Ib для отдельных факторов).
Лечение
Лечение подагры
Общие рекомендации
1. Оптимальное лечение подагры требует комбинации нефармакологических и фармакологических подходов (уровень доказательности Ib) и должно учитывать:
а) специфические факторы риска (уровень мочевой кислоты, количество предшествующих атак, рентгенография) (уровень доказательности IIb)
б) стадию болезни (асимптоматическая гиперурикемия, острый/интермиттирующий артрит, межприступный период, хроническая тофусная подагра) (уровень доказательности Ib)
в) общие факторы риска (возраст, пол, ожирение, гиперурикемические препараты, сопутствующие, полипрагмазия) (уровень доказательности Ib).
2. Обучение больного правильному образу жизни (уменьшение веса тела при ожирении, диета, уменьшение приема алкоголя, особенно пива) — ключевой аспект лечения. Ограничение в пищевом рационе богатых пуринами продуктов животного происхождения и снижение массы тела способствует снижению сывороточного уровня мочевой кислоты (уровень доказательности IIb), а алкоголь, особенно пиво, является независимым фактором риска для подагры (уровень доказательности III).
3. Гиперлипидемия, гипертензия, гипергликемия, ожирение и курение должны выявляться в каждом случае, т.к. являются важными компонентами при ведении больного с подагрой (уровень доказательности Ib).
Лечение острого приступа подагрического артрита
1. НПВП и колхицин могут быть эффективны в терапии острого приступа артрита (уровень доказательности Ib) и являются первой линией терапии. Данные о сравнительной эффективности НПВП и колхицина отсутствуют и при отсутствии противопоказаний, следует считать рациональным назначение НПВП.
2. Высокие дозы колхицина приводят к побочным эффектам, а низкие дозы (например 0,5 мг 3 раза в день) могут быть достаточны у ряда пациентов (уровень Ib).
3. Удаление синовиальной жидкости (уровень доказательности IV) и введение внутрисуставно длительно действующих глюкокортикоидов (уровень доказательности IIb) может быть эффективным и безопасным лечением острого приступа артрита.
4. При наличии противопоказании и/или неэффективности НПВП, колхицина и глюкокортикоидов для купирования острого приступа возможно применение препаратов, блокирующих интерлейкин-1 (уровень доказательности Ib).
Антигиперурикемическая терапия.
1. Антигиперурикемическая терапия показана больным с персистирующей гиперурикемией и острыми атаками, артропатией, тофусами или рентгенологическими изменениями. Проведение антигиперурикемической терапии показано в указанных случаях при неэффективности нефармакологических методов лечения. Решение о подобной терапии должно быть принято индивидуально, учитывать баланс между пользой и потенциальными рисками и согласовано с больным (уровень доказательности IV).
2. Целью антигиперурикемической терапии является предупреждение образование и растворение имеющихся кристаллов моноурата натрия, это достигается поддержанием уровня МК ниже точки супернасыщения сыворотки уратами (
3. Аллопуринол – эффективное средство для долгосрочного медикаментозного лечения у больных с хронической подагрой (уровень доказательности Ib). Назначение аллопуринола – реальная возможность проведения адекватной длительной антигиперурикемической терапии. При этом эффект в отношении снижения сывороточного уровня мочевой кислоты дозозависимый (уровень доказательности IIb).
Препарат должен быть назначен в исходно низкой дозе (100 мг ежедневно) с последующим увеличением (при необходимости) по 100 мг каждые две-четыре недели, что особенно важно у больных с почечной недостаточностью (уровень IV). При наличии почечной недостаточности доза должна быть подвергнута коррекции.
В случае развития побочных эффектов, связанных с применением аллопуринола, возможно назначение других ингибиторов ксантиноксидазы, урикозуриков. Проведение десенсибизизации к аллопуринолу возможно только при умеренных кожных проявлениях аллергической реакции (уровень доказательности IV).
Фебуфорт® – сильный селективный непуриновый ингибитор ксантиноксидазы. Эффективное средство для снижения мочевой кислоты.
— Фебуфорт® — более эффективен в достижении целевого уровня мочевой кислоты ( <360 мкмоль/л), чем аллопуринол в дозе 300 мг в сутки. 1,4
— Нет необходимости в коррекции дозы у пациентов с почечной недостаточностью легкой или средней степени тяжести и у пожилых пациентов. 2
— Было доказано, что Фебуфорт® приводил к уменьшению частоты приступов подагры и тофусов при длительной терапии. 3,4
1 Becker MA, et al. J Rheumatol 2009; 36:1273-82
2 Инструкция по медицинскому применению препарата Фебуфорт® Рег. № ЛП-№(000254)-(РГ-RU) от 27.05.2021
3 Schumacher HR, et al. Rheumatology 2009;48:188-194.
4 Исследования на биоэквивалентность № FBX-11-2017
4. Урикозурические агенты (пробенецид, сульфинпиразон) могут применяться как альтернатива аллопуринолу у пациентов с нормальной функцией почек, но относительно противопоказаны больным с уролитиазом. Эффект в отношении снижения сывороточного уровня мочевой кислоты, меньше, чем у аллопуринола (уровень доказательности IIa). Они не должны использоваться в пациентах со сниженной функцией почек (уровень доказательности IIb).
Бензбромарон может применяться у больных с мягкой и умеренной почечной недостаточностью у некоторых больных, но требует контроля в связи с риском гепатотоксичности (уровень доказательности Ib).
5. Профилактика суставных атак в течение первых месяцев антигиперурикемической терапии может достигаться колхицином (0,5-1,0 грамм в день) (уровень доказательности Ib) и/или НПВП (с гастропротекцией при показании) (уровень доказательности IIa). И колхицин и НПВП имеют потенциально серьезные побочные эффекты и их назначение предопределяет необходимость соотнести потенциальные пользу и вред.
При наличии противопоказании и/или неэффективности НПВП и колхицина для профилактики приступов артрита в первые месяцы антигиперурикемической терапии возможно назначение ингибиторов интерлейкина-1 (уровень доказательности Ib).
6. У больных с подагрой прием диуретиков по возможности отменяют (уровень доказательности IV), но это не касается случаев, когда диуретики назначены по жизненным показаниям. В качестве альтернативы могут быть использованы другие гипотенивные препараты.
Лозартан (уровень доказательности IIb) и фенофибрат (уровень доказательности Ib) имеют умеренный урикозурический эффект, что позволяет их применять у больных резистентных или плохо переносящих аллопуринол или урикозоурики, при наличии гипертензии или МС. Клиническое значение такой терапии и ее рентабельность пока неизвестны.
Информация
Источники и литература
- Федеральные клинические рекомендации по ревматологии 2013 г. с дополнениями от 2016 г.
Информация
Методология
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций является глубина публикаций вошедших в Кохрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 20 лет.
Методы, использованные для оценки качества и глубины доказательств:
· Консенсус экспертов
· Оценка значимости в соответствии с рейтиноговой схемой
Рейтиноговая схема для оценки силы рекомендаций
| Сила | Описание |
| Ia | Мета-анализ рандомизированных контролируемых исследований |
| Ib | Рандомизированное контролируемое исследование |
| IIa | Контролируемое исследование без рандомизации |
| IIb | Квази-экспериментальное исследование |
| III | Неэкспериментальные описательные исследования, таких как сравнительные, корреляционные и исследования случай-контроль |
| IV | Сообщения или мнения экспертных комитетов или клинический опыт |
Описание метода валидизации рекомендаций
Данные рекомендации в проектной версии были рецензированы независимыми экспертами с целью их адаптации для врачей ревматологов и врачей первичного звена.
Комментарии, полученные от экспертов систематизировались и обсуждались членами рабочей группы, внесенные изменения регистрировались для каждого пункта рекомендаций.
Рабочая группа
Для окончательной редакции и контроля качества предложенных рекомендаций они были повторно проанализированы членами рабочей группы, которые пришли к заключении, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок сведен к минимуму.
Современные возможности терапии подагры

Рассмотрены подходы к лечению подагры в соответствии с современными рекомендациями. Уделено внимание и немедикаментозным методам профилактики, представлены рекомендации по диетотерапии при подагре.
2017-10-18 15:00
87917 прочтений
Modern possibilities of gout therapy
Approaches to gout therapy were considered according to modern guidelines. Attention was also paid to non-drug methods of prevention, guidelines on dietary treatment in gout were presented.
Подагра является наиболее частой причиной артрита [1], что обусловлено отложением кристаллов моноурата натрия (МУН) в суставах и мягких тканях. Для формирования кристаллов МУН необходима персистирующая гиперурикемия. При повышении сывороточного уровня мочевой кислоты (МК) происходит насыщение тканей МУН, что создает условия для его кристаллизации и, соответственно, манифестации подагры [2]. Порог насыщения МК составляет около 7 мг/дл (420 мкмоль/л), хотя для пациентов с подагрой рекомендуется достигать сывороточный уровень МК менее 6 мг/дл (360 мкмоль/л), поскольку такой уровень МК приводит к более быстрому уменьшению кристаллических отложений МУН [3–6].
Достигнутые в настоящее время успехи в понимании основных механизмов развития хронической гиперурикемии и подагры позволили пересмотреть многие положения, лежащие в основе диагностики и лечения заболевания. Между тем, несмотря на успехи в понимании патофизиологии подагры и доступность эффективных методов лечения, подагра остается плохо контролируемым заболеванием во всех странах [7, 8]. Пожалуй, самой распространенной проблемой является низкая приверженность пациентов к снижению сывороточного уровня МК, что главным образом связано с недостаточным пониманием цели терапии подагры и врачами, и пациентами. Целесообразно объяснить пациентам цель лечения [9–11], которая заключается в растворении имеющихся отложений кристаллов МУН путем снижения сывороточного уровня МК ниже точки насыщения сыворотки уратами и купировании приступов артрита, если таковые возникают. Следует также поддерживать сывороточный уровень МК ниже порога насыщения, чтобы избежать образования новых кристаллов.
Целью настоящей статьи было предоставить практический обзор существующих подходов к управлению заболеванием в четырех аспектах: немедикаментозные методы профилактики и лечения гиперурикемии; купирование острого приступа артрита; уратснижающая терапия, направленная на профилактику приступов артрита и образование тофусов; профилактика приступов артрита при инициации уратснижающей терапии.
Лечение подагры в соответствии с современными рекомендациями направлено на улучшение исходов заболевания. Эффективность лечебно-профилактических вмешательств при подагре зависит от четкого следования предложенной в них концепции лечения [4, 12, 13].
Немедикаментозные методы профилактики
Немедикаментозные методы профилактики, нацеленные на модификацию факторов образа жизни, связанных с риском развития гиперурикемии, предусматривают индивидуальное или групповое профилактическое консультирование по актуальным вопросам диетотерапии, контролю массы тела при ожирении, достижению целевых уровней артериального давления, коррекции нарушений углеводного и липидного обмена.
Ожирение является ведущим фактором риска подагры, особенно у мужчин, соответственно, контроль массы тела оказывает существенное влияние на частоту приступов подагры [14]. Снижение веса за счет ограничения общей калорийности пищи и потребления углеводов благотворно влияет на уровни сывороточного урата у пациентов с подагрой [15, 16].
Следует отметить, что в настоящее время пересмотрены некоторые принципиальные позиции по диетотерапии при подагре. Так, рекомендация по жесткому ограничению в пищевом рационе пуринсодержащих продуктов распространяется только на животные производные (мясо, морепродукты), поскольку именно такая мера способствует снижению сывороточного уровня мочевой кислоты. При этом богатая пуринами растительная пища не оказывает существенного влияния на урикемию [4, 17]. Показано, что потребление обезжиренных молочных продуктов [18, 19], растительных масел и овощей ассоциируется с уменьшением риска гиперурикемии и приступов подагры [4, 12]. Витамин С увеличивает почечную экскрецию мочевой кислоты, поэтому его можно использовать в качестве дополнительной меры при терапии подагры [20, 21]. Безопасным в отношении сывороточного уровня МК и риска развития подагры считается потребление небольшого количества сухого вина [20, 22]. При этом потребление пива, в т. ч. безалкогольного, крепких спиртных напитков, а также подслащенных безалкогольных напитков с высоким содержанием фруктозы должно быть ограничено максимально [20, 23–25].
Несмотря на то, что основная масса клинических исследований затрагивают оценку эффективности диетотерапии в аспекте профилактики риска развития подагры, а не управления частотой приступов артрита у лиц с верифицированным диагнозом, рекомендации по модификации образа жизни должны даваться всем пациентам с подагрой, в т. ч. получающим медикаментозную терапию.
Купирование острого приступа подагрического артрита
В современных рекомендациях в качестве препаратов первой линии противовоспалительной терапии рассматриваются нестероидные противовоспалительные средства (НПВС), колхицин и глюкокортикостероиды (ГК) [4, 12, 13]. Сравнительно недавний систематический обзор показал, что НПВС (в том числе селективные ингибиторы ЦОГ-2), ГК (перорально и внутримышечно), колхицин и ингибитор ИЛ-1β (канакинумаб) являются эффективными методами лечения острых приступов [26]. Целесообразность персонифицированного выбора режима терапии обусловлена и индивидуальными особенностями больного, и гетерогенностью собственно подагрического процесса, протекающего с вовлечением многих органов и систем организма, что существенно модифицирует фармакодинамику препаратов, приводя к кумуляции нежелательных эффектов.
Терапия НПВС занимает лидирующие позиции в лечении как острого приступа, так и хронического подагрического артрита. Считается, чем раньше назначен препарат, тем быстрее может быть достигнут анальгетический эффект. НПВС следует использовать в максимальных суточных дозах, которые могут быть уменьшены по мере ослабления симптоматики. Выбор конкретного НПВС во многом зависит от личных предпочтений. И селективные ингибиторы ЦОГ-2, и традиционные НПВС эффективны при лечении острых приступов подагрического артрита. Недавний систематический обзор, объединяющий результаты шести рандомизированных клинических исследований (851 пациент), продемонстрировал одинаковый эффект эторикоксиба (120 мг в сутки), индометацина и диклофенака при остром артрите, с лучшей у эторикоксиба переносимостью со стороны желудочно-кишечного тракта [27]. Другой селективный ингибитор ЦОГ-2 — целекоксиб также обнаружил сопоставимый с индометацином эффект в отношении умеренной и выраженной боли у пациентов с острым подагрическим артритом [28]. Еще в одном систематическом обзоре был сделан вывод о том, что НПВС и селективные ингибиторы ЦОГ-2 обнаруживают эквивалентные преимущества в плане уменьшения боли, отечности и улучшения общего самочувствия, однако традиционные НПВС отличаются большей частотой отмены из-за нежелательных явлений [29].
Колхицин — алкалоид, получаемый из растения безвременника осеннего (Colchicum autumnae), используется для лечения острой подагры на протяжении многих десятилетий. Клинические исследования и ежедневная рутинная практика демонстрируют высокую частоту побочных эффектов при применении колхицина, которые, вероятно, можно объяснить назначением в прошлые годы более высоких доз препарата, чем рекомендованы в настоящее время. По крайней мере, большое многоцентровое исследование пациентов с подагрой и сохраненной функцией почек убедительно показало сопоставимую эффективность двух режимов терапии острого подагрического артрита: низкодозового (1,8 мг колхицина в сутки: 1,2 мг сразу и 0,6 мг через час) и высокодозового (4,8 мг колхицина в сутки: 1,2 мг сразу и по 0,6 мг каждый час; 6 раз), с существенно меньшей частотой побочных эффектов со стороны желудочно-кишечного тракта в группе с низкой дозой. Причем эффективность низких доз колхицина была эквивалентна высоким в том случае, если колхицин в низких дозах назначался в течение первых 12 часов после начала острого приступа артрита [30]. Клиническая практика показывает, что колхицин оказывается гораздо менее эффективным, если его назначают после 12–24 часов от начала приступа. Соответственно, более позднее назначение может потребовать больших доз препарата, что практически всегда заканчивается развитием нежелательных лекарственных реакций.
Согласно современным национальным рекомендациям для купирования острой атаки артрита целесообразным считается назначение у большинства пациентов низких доз колхицина (1,5 мг в первые сутки (1 мг сразу и через 1 час еще 0,5 мг) и по 1 мг со следующего дня) [13].
Назначение ГК для купирования острого приступа подагры возможно в виде внутрисуставных (после удаления синовиальной жидкости), внутримышечных инъекций или внутрь.
Пероральный прием преднизолона в суточной дозе 30–35 мг/сут демонстрирует высокую эффективность [31, 32] и рекомендуется группами Американского колледжа ревматологов (American College of Rheumatology, ACR) и Европейской антиревматической лиги (European League Against Rheumatism, EULAR) в качестве терапии первой линии при лечении острого приступа подагры [12, 33]. При этом стартовая доза преднизолона 30–35 мг/сут назначается на несколько (3–6) дней с последующей быстрой (в течение 1 недели) полной отменой.
Внутримышечное введение ГК может быть применено в случаях полиартикулярного поражения суставов [34]. Внутрисуставные инъекции стероидов оказываются очень эффективными и рекомендуются как ACR, так и EULAR при моно- или полиартикулярном поражении суставов, несмотря на отсутствие рандомизированных клинических исследований [12, 33].
Однако важно отметить, что, вопреки бытующему мнению, прием преднизолона не эффективнее НПВС. Так, сравнение двух режимов терапии (преднизолон 35 мг/сут и напроксен 1000 мг/сут) у пациентов с острым подагрическим артритом показало отсутствие различий в динамике интенсивности боли при сопоставимой частоте нежелательных эффектов [35]. Кроме того, ГК не безопаснее НПВС, поскольку способны усугубить течение артериальной гипертонии и сахарного диабета [36]. В исследовании [37] частота побочных эффектов даже на однократное внутрисуставное введение ГК (бетаметазон 7 мг) оказалась чрезвычайно высокой: у 73% пациентов обнаружилось клинически значимое повышение уровня систолического артериального давления, у 23% — гликемия натощак, у 13% — ЭКГ-признаки ишемии миокарда.
При наличии абсолютных противопоказаний и/или неэффективности НПВС, колхицина и ГК, а также отсутствии текущей инфекции, с целью купирования острого артрита возможно применение моноклональных антител к ИЛ-1 (канакинумаб) [12].
Уратснижающая терапия
Нужно заметить, что целесообразность регулярного контроля гиперурикемии на фоне уратснижающей терапии признается далеко не всеми исследователями. По крайней мере, данный подход был опротестован группой ACR, которая рекомендовала врачам назначать терапию подагры с целью управления симптомами, а не уровнем урикемии [38]. Между тем многочисленные клинические и патофизиологические исследования свидетельствуют о том, что снижение уровня МК ниже точки насыщения сыворотки уратами является лучшим и самым надежным способом контроля симптомов подагры в долгосрочной перспективе и что назначение уратснижающей терапии без отслеживания темпов снижения уровня урикемии является частым поводом отказа от лечения подагры для многих пациентов [4, 12, 33].
Поскольку у значительной доли больных хроническое воспаление, обусловленное депозитами моноурата натрия, предшествует клинической манифестации заболевания, то зачастую лечащему врачу довольно сложно принять решение, когда начинать лекарственную уратснижающую терапию: сразу после первого приступа или после повторения двух и более атак острого артрита.
Разумеется, уратснижающая терапия показана всем пациентам со стойкой гиперурикемией и острыми атаками артрита (в том числе в анамнезе), хроническим артритом, наличием тофусов (независимо от их локализации и методов выявления: при осмотре, методами лучевой визуализации). Пациентам с дебютом подагры в возрасте моложе 40 лет, при наличии коморбидной патологии (заболевание почек, артериальная гипертензия, ишемическая болезнь сердца, хроническая сердечная недостаточность) уратснижающая терапия должна быть инициирована сразу после первого приступа подагры, вне зависимости от уровня гиперурикемии. Проведение уратснижающей терапии в других случаях (при неосложненной подагре) показано при неэффективности нефармакологических методов лечения.
Уратснижающими препаратами являются аллопуринол и фебуксостат. Мишенью действия этих препаратов является ключевой фермент пуринового обмена — ксантиноксидаза, которая обеспечивает окисление гипоксантина до ксантина и далее ксантина — до МК. В этой сложной реакции превращения МК из гипоксантина высвобождаются супероксидные анионы и молекулярный кислород, способные вызывать оксидативный стресс и повреждение тканей [39].
Аллопуринол является ингибитором ксантиноксидазы, впервые введенным в клинику в шестидесятые годы. Сегодня он признан препаратом базисной терапии подагры. По своей химической природе аллопуринол — аналог гипоксантина. Механизм действия аллопуринола весьма интересен: в начале реакции он действует в качестве субстрата фермента ксантиноксидазы, а затем — в качестве ее ингибитора. Так, вначале ксантиноксидаза гидроксилирует аллопуринол, превращая его в аналог гипоксантина — аллоксантин (оксипуринол). А далее аллоксантин, прочно связываясь с активным центром ксантиноксидазы, содержащим ион молибдена, меняет ее свойства, в результате чего последующего этапа превращения МК не происходит. Кроме ингибирования трансформации гипоксантина в МК, аллопуринол устраняет выработку продуктов оксидативного стресса [39].
В клинической практике широко используемая доза аллопуринола составляет 300 мг/сут (90–95% пациентов с подагрой) [40], но для контроля гиперурикемии этого довольно часто бывает недостаточно. Так, по данным исследования [41] только 53% пациентов с подагрой достигли сывороточного уровня МК менее 6 мг/дл (360 мкмоль/л) на аллопуриноле 300 мг в день, но когда доза препарата была увеличена до 450–600 мг в сутки, то к целевому уровню МК приблизились все 100% испытуемых. В другом исследовании только 26,0% пациентов, получавших 300 мг аллопуринола в сутки, достигли целевого уровня МК ниже 6 мг/дл (360 мкмоль/л), тогда как 78% пациентов смогли достичь целевых значений только при повышении суточной дозы аллопуринола свыше 600 мг в сутки [42]. Таким образом, стандартная доза аллопуринола 300 мг в сутки зачастую недостаточна для достижения цели и должна титроваться в большую сторону, с учетом целевого уровня МК. Еще один важный момент, который должен учитываться при выборе оптимальной дозы препарата, — это состояние функции почек, поскольку ключевой метаболит аллопуринола — оксипуринол выводится главным образом почками [43]. В свое время, чтобы иметь возможность контролировать токсичность препарата, были предложены правила титрования дозы аллопуринола в зависимости от клиренса креатинина [44], но эта мера довольно часто не позволяла достичь целевых уровней МК [45].
В настоящее время рекомендуется назначать аллопуринол в исходно низкой дозе (50–100 мг в сутки) с последующим увеличением дозы (при необходимости) по 100 мг каждые 2–4 недели, что особенно важно у пациентов с почечной недостаточностью [5, 13]. Такое медленное титрование дозы снижает вероятность острого приступа после старта терапии [3]. Хотя в двух недавних исследованиях было показано, что опасения по поводу вероятности развития острой атаки артрита нередко бывают преувеличенными [46, 47]. По крайней мере, приостанавливать ранее начатую уратоснижающую терапию в случае вспышки острого артрита у большинства больных нет оснований.
Во всяком случае, аллопуринол следует назначать не ранее чем через 2 недели после купирования приступа острого артрита, постепенно титруя дозу до эффективной и отслеживая возможные нежелательные явления, частота которых существенно возрастает параллельно увеличению дозы.
К сожалению, аллопуринол относится к препаратам, на высокие дозы которого возможно развитие серьезных нежелательных явлений в виде прогрессирующей почечной недостаточности, гепатотоксичности, тяжелых аллергических реакций, в т. ч. синдрома Стивена–Джонсона, эпидермального некролиза, DRESS-синдрома [48, 49]. К возможным причинам развития таких тяжелых реакций на аллопуринол относят носительство гена HLA-В 5801, которое с высокой частотой встречается в разных этнических популяциях и максимально распространено в Азии (17%). В России носительство аллеля HLA-В 5801 сопоставимо с таковым в азиатских странах и выше, чем в странах Европы [50].
Впервые за 50 лет в качестве альтернативы аллопуринолу был разработан и внедрен в клиническую практику фебуксостат — сильный селективный непуриновый ингибитор ксантиноксидазы. Мощный уратснижающий эффект препарата связан с селективным подавлением двух изоформ ксантиноксидазы. Известно, что фебуксостат образует прочные высокоаффинные связи с активным молибденовым центром как окисленной, так и восстановленной изоформ ксантиноксидазы. Аллопуринол образует комплексы только с восстановленной изоформой фермента. Поскольку обе изоформы ксантиноксидазы, легко обмениваясь ионами молибдена, могут быстро переходить из одной в другую, это позволяет энзиму ускользать от эффекта аллопуринола. На фоне приема аллопуринола восстановленная форма фермента, под действием спонтанной реоксидации молибденового центра, способна очень быстро реактивироваться. Для фебуксостата характерно длительное и плотное заполнение узких каналов, ведущих к молибденовому центру, обеспечивающее прочность связей и устойчивость энзима к действию каскада окислительных кофакторов. Наконец, фебуксостат, в отличие от аллопуринола, не вступает в иные пуриновые и пиримидиновые реакции, что обеспечивает его селективность и адресное воздействие на синтез МК [51].
Важным преимуществом фебуксостата является смешанный (печеночный и почечный) метаболизм. В отличие от аллопуринола, препарат не требует корректировки дозы у пациентов с легкой или умеренной почечной недостаточностью и общей коморбидностью, которая с высокой частотой отмечается у пациентов с подагрой [52]. Недавние исследования показали, что эффективность и безопасность фебуксостата сохраняется у пациентов с клиренсом креатинина ниже 30 мл/мин [53]. Между тем Европейское агентство лекарственных средств (European Medicines Agency, ЕМА) рекомендует взвешенный подход к титрованию дозы фебуксостата пациентам со сниженной (< 30 мл/мин) скоростью клубочковой фильтрации [54].
В ходе масштабных клинических исследований (APEX, FACT, CONFIRMS, CACTUS, FORTE) фебуксостат доказал более мощный, чем у аллопуринола или плацебо, эффект [55].
В рандомизированном двойном слепом многоцентровом исследовании (с общей численностью больных 760 человек, у 35% из которых имелось легкое или умеренное снижение почечной функции) 52?недельная терапия фебуксостатом в дозах, одобренных для использования в ЕС (80 и 120 мг/день), была значительно более эффективной в отношении снижения сывороточного уровня МК у пациентов с гиперурикемией и подагрой, чем аллопуринол, в дозах, обычно назначаемых в клинической практике (100–300 мг/день). Так, целевого уровня МК (< 360 мкмоль/л) достигли 53% пациентов, принимавших 80 мг фебуксостата, 62% больных, принимавших 120 мг фебуксостата, и 21% принимавших 300 мг аллопуринола (р < 0,001) [56].
Фебуксостат продемонстрировал большую эффективность в снижении урикемии, чем аллопуринол, у пациентов с почечной недостаточностью. Так, в ходе 28?недельного многоцентрового двойного слепого исследования III фазы CONFIRMS с участием 2269 пациентов с подагрой, которые были рандомизированы на 4 группы терапии в зависимости от функции почек: фебуксостат в дозах 40 мг/сут и 80 мг/сут и аллопуринол в дозах 200 мг/сут и 300 мг/сут, было обнаружено, что применение аллопуринола в 300 мг/сут и фебуксостата в дозе 40 мг/сут способствует достижению целевого уровня МК (< 360 мкмоль/л) более чем в 45% случаев. У пациентов, получавших фебуксостат в дозе 80 мг/сут, результат статистически значимо превосходил результаты в двух других группах — 67% (р < 0,001). Подобные результаты были получены при сравнении групп с различной степенью почечной недостаточности: 72% больных, получавших 80 мг/сут фебуксостата, достигли целевых уровней МК, тогда как в группах, принимавших 40 мг/сут фебуксостата или аллопуринол, таких больных было 50% и 42% соответственно [57].
В 28?недельном двойном слепом клиническом исследовании, которое включало 1067 пациентов с подагрой и гиперурикемией более 480 мкмоль/л, пациенты были рандомизированы на группы фебуксостат (80, 120 или 240 мг/сут), аллопуринол (100 или 300 мг/сут) или плацебо. В группах больных, получавших фебуксостат, подбор дозы осуществлялся без учета функции почек. В группах, получавших аллопуринол, учитывался уровень креатинина. Так, больные с уровнем креатинина менее 1,5 мг/дл принимали 300 мг аллопуринола, а больные с уровнем креатинина от 1,6 до 2,0 мг/дл соответственно 100 мг аллопуринола в сутки. Фебуксостат вне зависимости от дозы показал большую эффективность в поддержании уровней сывороточного уровня МК ниже 360 мкмоль/л по сравнению с аллопуринолом или плацебо. Так, доля пациентов, достигших целевых значений МК на дозе фебуксостата 80 мг, 120 мг и 240 мг, составила соответственно 76%, 87% и 94%, тогда как количество больных, достигших целевого уровня МК на аллопуриноле в суточной дозе 300/100 мг и плацебо, составило соответственно 41% и 1% (р < 0,05 для всех групп фебуксостата по сравнению с аллопуринолом и плацебо) [58].
В более позднем ретроспективном исследовании, в котором сравнивалась эффективность фебуксостата и аллопуринола, также была отмечена большая эффективность фебуксостата (40 мг/сут или 80 мг/сут) по сравнению с аллопуринолом (300 мг/сут) в снижении сывороточного уровня МК. Причем исследование показало, что на терапии фебуксостатом клинический эффект достигается быстрее [60].
Переносимость фебуксостата во всех клинических исследованиях была хорошей, а частота нежелательных явлений низкой [58, 61, 62]. Сообщаемые побочные эффекты включали нарушения функции печени, диарею и доброкачественные кожные высыпания, о которых сообщалось примерно у 3% пациентов во время испытаний фазы III. Сообщения о развитии серьезных кожных реакций были крайне редкими [63]. Причем кожные реакции на фебуксостат проявлялись чаще у пациентов с ранее предшествующей кожной непереносимостью аллопуринола. При этом было показано, что повышенный риск кожных реакций у таких пациентов возникает не из-за перекрестной реактивности, а из-за повышенной вероятности того, что любой пациент с аллергической реакцией на известный препарат развивает реакцию кожи на другое лекарственное средство [64]. Было отмечено, что фебуксостат — препарат выбора для пациентов с предшествующей сыпью или реакцией гиперчувствительности на аллопуринол [65], хотя не исключено, что в редких случаях реакция гиперчувствительности на фебуксостат также возможна [66].
Причины отмены также были реже у фебуксостата, за исключением приступов подагры, которые чаще встречались на терапию фебуксостатом (вероятно, из-за более глубокого и более быстрого снижения сывороточного уровня МК при назначении относительно более высоких доз (120–240 мг/сут) препарата).
Препарат применяется в Европе и США с 2008 г. В настоящее время он разрешен к применению в РФ. Рекомендованная доза фебуксостата — 80 мг 1 раз в день. При необходимости доза может быть увеличена до 120 мг в сутки. Общая тактика применения фебуксостата не отличается от таковой при назначении аллопуринола. Лечение фебуксостатом не рекомендуется начинать во время острого артрита.
Профилактика приступов острого артрита при инициации уратснижающей терапии
Увеличение частоты приступов артрита в течение первых недель и даже месяцев после старта уратснижающей терапии происходит независимо от препарата (аллопуринол, фебуксостат) в результате быстрых изменений сывороточного уровня мочевой кислоты [4, 12, 13]. Для профилактики приступов артрита рекомендовано в течение первых 6 месяцев от инициации терапии использовать колхицин в дозе 0,5–1,0 мг/сут или НПВС в низких дозах (с обязательной гастропротекцией при наличии показаний).
В случаях почечной недостаточности или при лечении статинами врач и пациент должны иметь настороженность в отношении потенциальной нейро- и миотоксичности на применение колхицина в качестве средства профилактики острых приступов артрита. Следует также избегать сочетанного назначения ингибиторов Р-гликопротеина (циклоспорин A) или ингибиторов CYP3А4 (кларитромицин, эритромицин, кетоконазол, дилтиазем, верапамил и др.) [67].
Таким образом, современные подходы к лечению подагры позволяют управлять заболеванием при достижении целевых уровней МК в сыворотке крови, опираясь на технологии профилактического консультирования и обучения пациентов, а также применения ингибиторов ксантиноксидазы. Фебуксостат является хорошо исследованным уратснижающим средством, которое обеспечивает эффективную альтернативу аллопуринолу в лечении подагры у широкого круга пациентов.
Литература
- Roddy E., Choi H. Epidemiology of gout // Rheum Dis Clin North Am. 2014; 40: 155–175.
- Mandal A. K., Mount D. B. The molecular physiology of uric acid homeostasis // Annu Rev Physiol. 2015; 77: 323–334.
- Zhang W., Doherty M., Bardin T., Pascual E., Barskova V., Conaghan P. et al. EULAR evidence based recommendations for gout. Part II: management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) // Ann Rheum Dis. 2006; 65: 1312–1324.
- Khanna D., Fitzgerald J., Khanna P., Bae S., Singh M., Neogi T. et al. American College of Rheumatology guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia // Arthritis Care Res. 2012; 64: 1431–1446.
- Sivera F., Andrés M., Carmona L., Kydd A., Moi J., Seth R. et al. Multinational evidence-based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3 e initiative // Ann Rheum Dis. 2014; 73: 328–333.
- Pascual E., Andrés M., Vela P. Gout treatment: should we aim for rapid crystal dissolution? // Ann Rheum Dis. 2013; 72: 635–637.
- Roddy E., Zhang W., Doherty M. Concordance of the management of chronic gout in a UK primary-care population with the EULAR gout recommendations // Ann Rheum Dis. 2007; 66: 1311–1315.
- Pascual E., Sivera F. Why is gout so poorly managed? // Ann Rheum Dis. 2007; 66: 1269–1270.
- Riedel A., Nelson M., Joseph-Ridge N., Wallace K., MacDonald P., Becker M. Compliance with allopurinol therapy among managed care enrollees with gout: a retrospective analysis of administrative claims // J Rheumatol. 2004; 31: 1575–1581.
- Harrold L., Andrade S., Briesacher B., Raebel M., Fouayzi H., Yood R. et al. Adherence with urate-lowering therapies for the treatment of gout // Arthritis Res Ther. 2009; 11: R46.
- Rees F., Jenkins W., Doherty M. Patients with gout adhere to curative treatment if informed appropriately: proof-of-concept observational study // Ann Rheum Dis. 2013; 72: 826–830.
- Richette P., Doherty M., Pascual E., Barskova V., Becce F., Castaneda-Sanabria J. EULAR evidence-based recommendations for the management of gout // Ann Rheum Dis. 2017; 76 (1): 29–42.
- Елисеев М. С. Подагра. В кн.: Российские клинические рекомендации. Ревматология / Под ред. Е. Л. Насонова. М.: ГЭОТАР-Медиа, 2017. С. 372–385.
- Choi H. K., Atkinson K., Karlson E. W., Curhan G. Obesity, weight change, hypertension, diuretic use, and risk of gout in men: the health professionals follow-up study // Arch Intern Med. 2005; 165 (7): 742–748.
- Dessein P. H., Shipton E. A., Stanwix A. E., Joffe B. I., Ramokgadi J. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study // Ann Rheum Dis. 2000; 59 (7): 539–543.
- Timmers S., Konings E., Houtkooper R. H. et al. Calorie restriction-like effects of 30 days of resveratrol supplementation on energy metabolism and metabolic profile in obese humans // Cell. Metab. 2011. Vol. 14 (5). Р. 612–622.
- Сhoi H. K., Atkinson K., Karlson E. W., Willett W., Curhan G. Purine-rich foods, dairy and protein intake, and the risk of gout in men // N Engl J Med. 2004; 350 (11): 1093–1103.
- Dalbeth N., Wong S., Gamble G. D., Horne A., Mason B., Pool B. Acute effect of milk on serum urate concentrations: a randomised controlled crossover trial // Ann Rheum Dis. 2010; 69 (9): 1677–1682.
- Dalbeth N., Ames R., Gamble G. D. et al. Effects of skim milk powder enriched with glycomacropeptide and G600 milk fat extract on frequency of gout flares: a proof-of-concept randomized controlled trial // Ann Rheum Dis. 2012; 71 (6): 929–934.
- Kanbara A., Seyama I. Effect of urine pH on uric acid excretion by manipulating food materials // Nucleosides, Nucleotides Nucleic Acids. 2011; 30 (12): 1066–1071.
- Towiwat P., Li Z. G. The association of vitamin C, alcohol, coffee, tea, milk and yogurt with uric acid and gout // Int J Rheum Dis. 2015; 18 (5): 495–501.
- Choi H. K. Atkinson K, Karlson E. W., Willett W., Curhan G. Alcohol intake and risk of incident gout in men: a prospective study // Lancet. 2004; 363 (9417): 1277–1281.
- Choi H. K., Curhan G. Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study // BMJ. 2008; 336 (7639): 309–312.
- Choi H. K., Willett W., Curhan G. Fructose-rich beverages and risk of gout in women // JAMA. 2010; 304 (20): 2270–2278.
- Kedar E., Simkin P. A. A perspective on diet and gout // Adv Chronic Kidney Dis. 2012; 19 (6): 392–397.
- Khanna P., Gladue H., Singh M., FitzGerald J., Bae S., Prakash S. et al. Treatment of acute gout: a systematic review. Semin Arthritis Rheum. 2014; 44: 31–38.
- Zhang S., Zhang Y., Liu P., Zhang W., Ma J., Wang J. Efficacy and safety of etoricoxib compared with NSAIDs in acute gout: a systematic review and a meta-analysis // Clin Rheumatol June. 2015; Epub ahead of print.
- Schumacher H., Berger M., Li-Yu J., Pérez-Ruiz F., Burgos-Vargas R., Li C. Efficacy and tolerability of celecoxib in the treatment of acute gouty arthritis: a randomized controlled trial // J Rheumatol. 2012; 39: 1859–1866.
- Van Durme C., Wechalekar M., Buchbinder R., Schlesinger N., van der Heijde D., Landewé R. Non-steroidal anti-inflammatory drugs for acute gout // Cochrane Database Syst Rev. 2014; 9: CD010–120.
- Terkeltaub R. A., Furst D. E., Bennett K., Kook K. A., Crockett R. S., Davis M. W. High versus low dosing of oral colchicine for early acute gout flare: Twenty-four-hour outcome of the first multicenter, randomized, double-blind, placebo-controlled, parallel-group, dose-comparison colchicine study // Arthritis Rheum. 2010; 62 (4): 1060–1068.
- Man C. Y., Cheung I. T., Cameron P. A., Rainer T. H. Comparison of oral prednisolone/paracetamol and oral indomethacin/paracetamol combination therapy in the treatment of acute goutlike arthritis: a double-blind, randomized, controlled trial // Ann Emerg Med. 2007; 49 (5): 670–677.
- Rainer T. H., Cheng C. H., Janssens H. J., Man C. Y., Tam L. S., Choi Y. F. Oral prednisolone in the treatment of acute gout: a pragmatic, multicenter, double-blind, randomized trial // Ann Intern Med. 2016; 164 (7): 464–471.
- Khanna D., Khanna P. P., Fitzgerald J. D., Singh M. K., Bae S., Neogi T. American College of Rheumatology guidelines for management of gout. Part 2: therapy and antiinflammatory prophylaxis of acute gouty arthritis // Arthritis Care Res (Hoboken). 2012; 64 (10): 1447–1461.
- Bernal J. A., Quilis N., Andrés M., Sivera F., Pascual E. Gout: optimizing treatment to achieve a disease cure // Ther Adv Chronic Dis. 2016; 7 (2): 135–144.
- Janssens H. J., Janssen M., van de Lisdonk E. H., van Riel P. L., van Weel C. Use of oral prednisolone or naproxen for the treatment of gout arthritis: a double-blind, randomised equivalence trial // Lancet. 2008; 371 (9627): 1854–1860.
- Richette P., Bardin T. Should prednisolone be first-line therapy for acute gout? // Lancet. 2008; 372 (9646): 1301.
- Федорова А. А., Барскова В. Г., Якунина И. А., Насонова В. А. Кратковременное применение глюкокортикоидов у больных затяжным и хроническим подагрическим артритом. Ч. III. Частота развития нежелательных реакций // Научно-практическая ревматология. 2009; № 2. С. 38–42.
- Qaseem A., Harris R. P., Forciea M. A. Management of acute and recurrent gout: a clinical practice guideline from the american college of physicians // Ann Intern Med. 2017; 166 (1): 58–68.
- McLean L., Becker M. A. The pathogenesis of gout. Rheumatology Fourth Edition. Edited by Hochberg M. C., Silman A. J., Smolen J. S. Phyladelphia, 2008. P. 1813–27.
- Annemans L., Spaepen E., Gaskin M., Bonnemaire M., Malier V., Gilbert T. Gout in the UK and Germany: prevalence, comorbidities and management in general practice 2000–2005 // Ann Rheum Dis. 2008; 67 (7): 1021–1030.
- Pérez-Ruiz F., Alonso-Ruiz A., Calabozo M., Herrero-Beites A., García-Erauskin G., Ruiz-Lucea E. Efficacy of allopurinol and benzbromarone for the control of hyperuricaemia. A pathogenic approach to the treatment of primary chronic gout // Ann Rheum Dis. 1998; 57: 545–549.
- Reinders M., van Roon E., Jansen T., Delsing J., Griep E., Hoekstra M. et al. Efficacy and tolerability of urate-lowering drugs in gout: a randomised controlled trial of benzbromarone versus probenecid after failure of allopurinol // Ann Rheum Dis. 2009; 68: 51–56.
- Jennings C., Mackenzie I., Flynn R., Ford I., Nuki G., De Caterina R. et al. Up-titration of allopurinol in patients with gout // Semin Arthritis Rheum. 2014; 44: 25–30.
- Hande K., Noone R., Stone W. Severe allopurinol toxicity. Description and guidelines for prevention in patients with renal insufficiency // Am J Med. 1984; 76: 47–56.
- Dalbeth N., Kumar S., Stamp L., Gow P. Dose adjustment of allopurinol according to creatinine clearance does not provide adequate control of hyperuricemia in patients with gout // J Rheumatol. 2006; 33: 1646–1650.
- Taylor T., Mecchella J., Larson R., Kerin K., Mackenzie T. Initiation of allopurinol at first medical contact for acute attacks of gout: a randomized clinical trial // Am J Med. 2012; 125: 1126–1134.
- Hill E., Sky K., Sit M., Collamer A., Higgs J. Does starting allopurinol prolong acute treated gout? A randomized clinical trial // J Clin Rheumatol. 2015; 21: 120–125.
- Lin M. S., Day Y. S., Pwu R. F. et al. Risk estimates for drugs suspected of being associated with Stevens-Johnson syndrpme and toxic epidermal necrolysis: a case-control study // Inern Med J. 2005; 35 (3): 188–190.
- Yaylact S., Demir M. V., Temis T. et al. Allopourinol-induced DRESS syndrome // Indian J Pharmacol. 2012; 44 (3): 412–414.
- Елисеев М. С. Современные возможности терапии подагры: «вверх по спирали» или «бег на месте» // Ревматология, травматология, ортопедия. 2017; 2: 20–22.
- Zhao L., Takano Y., Horiuchi Y. Effect of febuxostat, a novel non-purine, selective inhibitor of xantin oxidase (NP-SIXO), on enzymes in purine and perimidine methabolism pathway // Arthr Rheum. 2003; 48 (suppl. 9): 531.
- Richette P., Clerson P., Périssin L., Flipo R., Bardin T. Revisiting comorbidities in gout: a cluster analysis // Ann Rheum Dis. 2015; 74: 142–147.
- Juge P. A., Truchetet M. E., Pillebout E., Ottaviani S., Vigneau C., Loustau C. Efficacy and safety of febuxostat in 73 gouty patients with stage 4/5 chronic kidney disease: A retrospective study of 10 centers // Joint Bone Spine. 2016; 364 p.
- EMA® product information. 2015; Available at: http://www.ema.europa.eu.
- Frampton J. E. Febuxostat: a review of its use in the treatment of hyperuricaemia in patients with gout // Drugs. 2015, Mar; 75 (4): 427–438. DOI: 10. 1007/s40265–015–0360–7.
- Becker M. A., Schumacher H. R., Jr, Wortmann R. L., MacDonald P. A., Eustace D., Palo W. A. Febuxostat compared with allopurinol in patients with hyperuricemia and gout // N Engl J Med. 2005; 353 (23): 2450–2461.
- Becker M. A., Schumacher H. R., Espinosa L. et al. The urate-lowering efficacy and safety of febuxostat in treatment of hyperuricemia of gout: the CONFIRMS treal // Arthritis Res. Ther. 2010; 12 (2): ID R63.
- Schumacher H., Becker M., Wortmann R., Macdonald P., Hunt B., Streit J. et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial // Arthritis Rheum. 2008; 59: 1540–1548.
- Schumacher H., Becker M., Lloyd E. et al. Febuxostat is the treatment of gout: 5-yr findingsof the FOCUS efficacy and safety study // Rheumatology (Oxford). 2009; 48 (2): 188–194.
- Singh J., Akhras K., Shiozawa A. Comparative effectiveness of urate lowering with febuxostat versus allopurinol in gout: analyses from large U. S. managed care cohort // Arthritis Res Ther. 2015; 17: 120–139.
- Huang X., Du H., Gu J., Zhao D., Jiang L., Li X. et al. An allopurinol-controlled, multicenter, randomized, double-blind, parallel between-group, comparative study of febuxostat in Chinese patients with gout and hyperuricemia // Int J Rheum Dis. 2015; 17: 679–686.
- Tausche A., Reuss-Borst M., Koch U. Urate lowering therapy with febuxostat in daily practice-a multicentre, open-label, prospective observational study // Int J Rheumatol. 2014; 27: 1–6.
- Chou H. Y., Chen C. B., Cheng C. Y., Chen Y. A., Ng C. Y., Kuo K. L. Febuxostat-associated drug reaction with eosinophilia and systemic symptoms (DRESS) // J Clin Pharm Ther. 2015; 40 (6): 689–692.
- Bardin T., Chales G., Pascart T., Flipo R. M., Korng Ea H., Roujeau J. C. Risk of cutaneous adverse events with febuxostat treatment in patients with skin reaction to allopurinol. A retrospective, hospital-based study of 101 patients with consecutive allopurinol and febuxostat treatment // Joint Bone Spine. 2016; 83 (3): 314–317.
- Chohan S. Safety and efficacy of febuxostat treatment in subjects with gout and severe allopurinol adverse reactions // J Rheumatol. 2011; 38: 1957–1959.
- Abeles A. Febuxostat hypersensitivity // J Rheumatol. 2012; 39: 659–671.
- Terkeltaub R. A. Novel evidence-based colchicine dose-reduction algorithm to predict and prevent colchicine toxicity in the presence of cytochrome P450 3 A4/Pglycoprotein inhibitors // Arthritis Rheum. 2011; 63: 2226–2237.
М. И. Шупина 1 , кандидат медицинских наук
Г. И. Нечаева, доктор медицинских наук, профессор
Е. Н. Логинова, кандидат медицинских наук
ФГБОУ ВО ОмГМУ МЗ РФ, Омск
Источник https://podagra21.ru/gout-treatment/
Источник https://diseases.medelement.com/disease/%D0%BF%D0%BE%D0%B4%D0%B0%D0%B3%D1%80%D0%B0-%D1%80%D0%B5%D0%BA%D0%BE%D0%BC%D0%B5%D0%BD%D0%B4%D0%B0%D1%86%D0%B8%D0%B8-%D1%80%D1%84/15096
Источник https://www.lvrach.ru/2017/10/15436819