Ревматоидный артрит — лечение
Лечение ревматоидного артрита – чрезвычайно сложная задача, особенно принимая во внимание, что это системное заболевание. Поэтому оптимальная терапия болезни возможна только при взаимодействии медицинских специалистов разного профиля (ревматологов, ортопедов, неврологов, окулистов и хирургов), физиотерапевтов и специалистов ЛФК, психологов и социальных работников. Чем раньше начинается медикаментозная терапия, тем лучше шансы на полную регрессию симптомов.
Ревматоидный артрит не лечится. Но благодаря целенаправленной и своевременной терапии есть возможности замедлить развитие заболевания и уменьшить боли.
Цель терапии
- достижение длительной стойкой ремиссии;
- уменьшение воспалительных процессов;
- снятие боли;
- поддержание функции и гибкости суставов;
- снижение риска осложнений и присоединения других болезней;
- коррекция качества жизни.
Достижение таких целей возможно прежде всего благодаря ранней и постоянно адаптированной лекарственной терапии.
В целом, лечение сочетает несколько взаимодополняющих звеньев:
- лекарственная терапия;
- физиотерапия;
- ЛФК;
- психологическая терапия;
- питание;
- обучение пациентов;
- хирургическое вмешательство;
Если лечение подобрано правильно, больные могут избежать мучительных болей, деформированных пальцев рук и ног, они будут вести приемлемый образ жизни, обслуживая себя самостоятельно и плодотворно работая, и могут не беспокоиться, что окажутся в инвалидном кресле.
Остановимся на каждом звене более подробно.
Лекарственные средства
Лекарственная терапия занимает главенствующее положение в лечении недуга. К сожалению, врачи не могут предсказать, какие препараты и какое их сочетание лучше для обратившегося к ним больного. Всё очень индивидуально. Кроме того, потребуется несколько недель, пока врачи смогут оценить, эффективна ли расписанная схема терапии при ревматизме. Иногда проходит много месяцев до того, как будет найдено соответствующее эффективное лекарство или их комбинация.
В ходе лечения применяются следующие медикаменты, чтобы остановить воспаление и уменьшить боли:
- Базисные медикаменты: они замедляют воспаление и останавливают разрушение суставов. Препараты воздействуют, но не сразу, а лишь через несколько недель. Из лекарственных средств, в первую очередь используются медленнодействующие базисные препараты, которые дают стойкий клинический эффект. При невысокой активности процесса и на ранних стадиях болезни обычно применяют монотерапию базисными лекарствами. К таким лекарствам относят Метотрексат, Лефлуномид. Их результативность клинически доказана в многочисленных испытаниях. Оптимальное соотношение эффекта и побочных действий дало основание называть терапию базисными препаратами «золотым» стандартом лечения.
- Биопрепараты. Сравнительно недавно появились биологические препараты (генно-инженерные), которые были созданы специально для лечения РА у больных, резистентных к базисной терапии. Эти препараты обладают высокой избирательностью и действуют локально на очаги иммунного воспаления. Препараты отлично себя зарекомендовали, несмотря на некоторые побочные действия, но они имеют высокую цену и применяются при плохой переносимости метотрексата и других базисных препаратов.
- Средства с кортизоном. В схеме лечения часто фигурируют глюкокортикоиды, которые обладают мощным противовоспалительным действием. В отличие от базовых медикаментов они воздействуют сразу же. Они очень хорошо подавляют воспаление и быстро уменьшают боли. Средства с кортизоном надо применять до того момента, пока не начнут действовать базовые медикаменты. Но длительная гормонотерапия может привести к серьезным побочным осложнениям, поэтому их применение должно контролироваться регулярной сдачей анализов крови.
- Обезболивающие средства. Кроме того, при необходимости, назначают противовоспалительные средства, анальгетики и местные инъекции (те же глюкокортикоиды, радиоактивные вещества (Radiosyniorthese) и другие. Они могу немедленно остановить боли и часто уменьшают воспаление. Но они не останавливают разрушение суставов.
Лекарственная терапия обычно сочетается с различными другими терапевтическими методами (физиотерапией, ЛФК, эргометрией) плюс иногда прибегают к хирургическим вмешательствам (например, синовэктомия и даже эндопротезирование). В этом случае усиливается возможность более эффективно воздействовать на болезнь и как можно скорее подавить процессы боли, воспаления и повреждения.
Все препараты во время лечения ревматизма очень действенны, но они могут иметь и серьезные побочные явления. Поэтому выбор лечения обычно согласовывается с самим пациентом, который должен быть осведомлен обо всех рисках и побочных явлениях терапии.
Более подробно о медикаментозной терапии при ревматоидном артрите можно прочитать здесь, а о хирургических вмешательствах — здесь
Физиотерапия
Цель физической терапии — облегчить боль и поддерживать подвижность суставов как можно дольше. Кроме того, физиотерапия расслабляет мышцы. Терапия теплом и холодом, электротерапия и лечебные ванны, массаж и физические упражнения, лазер и лечебные грязи — спектр лечебных и реабилитационных методик при ревматоидном артрите широк, но применяется после купирования воспаления. Очень важно для каждого пациента составить индивидуальную концепцию терапии и грамотно сочетать физиотерапевтические воздействия.
- Лечение холодом.
Лечение холодом может быть осуществлено, например, с помощью пузыря или пакетов со льдом, пребывания в холодильной камере. Рецепторы боли в коже блокируются холодом в течение короткого времени, что уменьшает передачу боли в нервных волокнах. В то же время гипотремия обладает противоотечным и противовоспалительным эффектом.
Термотерапия способствует усиленной циркуляции крови и мышечной релаксации. В то же время она стимулирует обмен веществ. Тепло может быть создано горячими ваннами, парафиновыми пакетами фанго (термокомпрессы), горячим воздухом, красным светом, ультразвуком или электричеством. Однако при остром воспалении суставов термическая обработка не имеет смысла, поскольку она поддерживает воспалительный процесс.
Бальнеотерапия использует комбинацию различных физиотерапевтических процедур. Холодные или теплые ванны в разных жидкостях (серная ванна, солевая ванна, йодобромная) сочетаются с механическим воздействием (плавучесть) или электрическими токами (Stangerbad).
На разных частотах электротерапия имеет разные способы действия. В диапазоне низких и средних частот она способствует кровообращению и снимает боль, в среднем диапазоне частот она воздействует на мышцы, в высокочастотном диапазоне, как тепловая терапия, проникает в глубину. Пациенты с кардиостимуляторами или металлическими имплантатами (например, искусственные суставы) не могут использовать электротерапию или применять ее в ограниченной степени по назначению врача.
В Европейском Центре ортопедии и терапии боли успешно и активно применяются такие инновационные методы, как ArthrexACP System и уникальная магнитно-резонансная терапия- MBST. Их применение в лечении ревматоидного артрита дает блестящие результаты – снимается боль на первых же сеансах, усиливается обмен веществ, уплотняется структура костной ткани и увеличивается объем хряща.
Физиотерапия, конечно, не может заменить лекарства, но она является незаменимой частью реабилитации, когда воспалительные явления стихают.
Психологическая терапия
Хронические заболевания, такие как ревматоидный артрит, всегда оказывают влияние на психику, так как это серьезный стресс для организма. В последнее время ревматоидный артрит даже рассматривается как психосоматическая болезнь. Больные могут прийти в отчаяние, так как полностью изменяется привычный уклад жизни. Из-за болезни люди ограничивают круг друзей, реже общаются, становятся раздражительными, обидчивыми, взаимоотношения в семье ухудшаются.
На работе тоже появляются проблемы. Свои профессиональные обязанности становится все труднее выполнять – нарушается мелкая моторика, ухудшается зрение. Иногда приходиться менять профессию, что негативно сказывается на эмоциональном состоянии. Заболевание грозит инвалидностью. Молодым людям порой приходится уходить с работы совсем, теряется способность к передвижению, это еще больше усиливает стресс и больной впадает в отчаяние. Возникает порочный круг, ведь уныние усугубляет болезнь.
Основные рекомендации по гармонизации внутреннего состояния:
- Легче справляться с болезнью и болью в центре психологической терапии, общаясь с такими же больными на форумах и в соответствующих блогах.
- Некоторые методы релаксации, такие как аутогенная тренировка, могут помочь страдающим ревматизмом лучше справляться со своими страданиями.
- Ограничить, а еще лучше исключить поток негативной информации (не слушать новости, выбирать для просмотра оптимистичные телевизионные программы, не смотреть агрессивные шоу).
- Создать дружелюбную атмосферу вокруг себя, выбирать позитивных собеседников, знакомиться с интересными людьми.
- Собирать информацию о болезни, быть в курсе инновационных технологий и новых методах лечения артрита.
- Заниматься посильным спортом и адаптированными физическими упражнениями, больше двигаться.
Питание
Специальная диета не может заменить традиционную терапию, но придерживаться правильного рациона необходимо, так как он положительно влияет на динамику процесса.
Ключевые моменты питания при ревматоидном артрите.
- Желательно перейти на диету без мяса. Мясо содержит большое количество арахидоновой кислоты, предшественника провоспалительных простагландинов.
- В меню должны быть продукты, богатые кальцием и витаминами. Это важно для предотвращения остеопороза.
- Следует ограничить потребление рафинированных сахаров, фруктозы и крахмала, так как они резко увеличивают уровень глюкозы в крови.
- В рационе должны быть белковые блюда с небольшим количеством качественных жиров.
- Необходимо периодически устраивать разгрузочные дни – молочные (спорный вопрос, не все эксперты разделяют мнение по поводу молочных продуктов при РА), вегетарианские, овощные
Эффект так называемых радикальных поглотителей (таких как витамин Е и С, селен и цинк) при ревматоидном артрите не доказан с научной точки зрения. Поскольку у этих продуктов также есть побочные эффекты, надо в каждом конкретном случае обращаться за советом к своему врачу!
ЛФК
Регулярная ЛФК является важным элементом в лечении ревматоидного артрита. Пораженным суставам необходимы физические упражнения, растяжки, небольшие нагрузки даже во время обострения. Следует избегать неподвижности даже при болях, потому что неподвижность способствует порочному кругу, она расслабляет мышцы, которые перестают брать на себя дополнительную нагрузку, приходящуюся на больной сустав.
Если воспалительный процесс в активной стадии, то акцент делается на упражнениях пассивного характера – плавных и спокойных. Если в стадии ремиссии, то упражнения становятся более активными. Правильно подобранный комплекс помогает сохранить суставы гибкими и подвижными, укрепить мышцы.
Надо с осторожностью относиться к применению ортезов. Защита больного сустава в течение длительного времени может перегружать здоровые суставы. Если следовать рекомендациям врачей, занимаясь такими видами спорта, как плавание, велоспорт, гимнастика, прогулки, то можно сохранить мобильность и укрепить мышцы. Активные и контактные виды спорта не рекомендуются. Спортивные занятия в группе не только проходят веселее, но и одновременно мотивируют. Поэтому можно остановиться на посещении классов по аквааэробике, по пилатесу, по растяжке. Пациенты с ревматоидным артритом должны всегда обращаться за советом к врачу — какой выбрать вид спорта, как регулярно им заниматься, с какой интенсивностью.
Обучение пациентов и трудотерапия
Если артрит не лечить, то повседневная деятельность человека нарушается. Больному трудно передвигаться, готовить пищу, соблюдать элементарную гигиену, заниматься профессиональной деятельностью. Пациент вынужден постоянно бороться с болезненными симптомами и стараться их контролировать.
Обучение пациентов призвано помочь им справиться с неожиданными для них проблемами и предоставить практическую помощь. Благодаря трудотерапии пациенты адаптируются к новой жизненной ситуации.
Целью профессиональной терапии является поддержание или восстановление независимости. Пациент учится выполнять ежедневные функции, чтобы жить как можно более нормальной жизнью. К счастью, в последнее время появились вспомогательные средства, которые защищают суставы в быту.
Примеры повседневных вспомогательных приспособлений:
- В случае ограниченной подвижности руки используются так называемые «держатели захвата». Благодаря им можно удобно захватить пишущие предметы или столовые приборы.
- Knöpfhilfe — устройство индивидуально адаптировано к форме руки, легко захватывается и облегчает закрытие кнопок, специальное устройство для пуговиц помогает легко застегнуть рубашку
- Чашки, снабженные двумя ручками, позволяют пить, не проливая ничего.
- Открывалка для бутылок. Например, имеются открывалки со специальной рукояткой для винтовых колпачков, которые позволяют открывать с небольшим усилием.
- Нож с толстой рукояткой, специальные модели ложек и вилок с комфортным эластичным ободком, предотвращающим скольжение руки.
- Нескользящие разделочные доски и салфетки для приборов, тарелки с высокими бортиками.
- Расчески, зубные щетки, банные мочалки с длинной и крупной ручкой.
- Специальные приспособления для надевания носков.
Важно, чтобы пациенты не отчаивались и не сдавались. Медицина развивается мощными темпами. Уже сейчас, следуя рекомендациям врачей, придерживаясь выбранной схемы лечения, можно добиться длительной стойкой ремиссии без каких-либо неприятных симптомов, а используя всевозможные приспособления в быту можно значительно улучшить качество жизни и облегчить повседневную деятельность.
ДЛЯ СВЯЗИ С НАМИ
Чтобы получить полную информацию о видах лечения и профилактике заболеваний ортопедии, ревматологии или неврологии, пожалуйста, обратитесь к нам:
 телефон +7(495)120-46-92
телефон +7(495)120-46-92
 эл.почта info@euromed.academy
эл.почта info@euromed.academy
Форма обратной связи  Напишите нам в Telegram
Напишите нам в Telegram  Напишите нам в WhatsApp
Напишите нам в WhatsApp

Наш адрес — г. Москва, ул. Трифоновская 11
Ревматоидный артрит, новый подход к лечению
Ревматоидный полиартрит является очень распространенным заболеванием, им страдают около 1% населения земного шара. Болеют, преимущественно, женщины пожилого возраста. При прогрессировании в 50% случаев приводит к разной степени инвалидности. Поэтому необходимо уделять пристальное внимание его лечению.
Ревматоидный полиартрит характеризуется хроническим воспалением соединительной и хрящевой ткани суставов.. Преимущественно заболевание начинается с мелких суставов кистей рук и стоп. Заболевание часто захватывает суставы симметрично.
Далее оно распространяется и на средние по величине суставы, часто на коленные.

Воспаление кистей рук
Как возникает заболевание
Единой причины начала заболевания не установлено. Среди микроорганизмов, запускающих болезнь, большое значение уделялось стрептококкам, микоплазмам, ретровирусам. Но далее появляется усиленная реакция всего иммунитета организма, которая проявляется в поражении связочно-суставного аппарата, изъязвлению костных и хрящевых поверхностей, преимущественно в местах прикрепления связочного аппарата. Провоцирующими факторами являются : переохлаждение, стресс, перенапряжение, травма. В крови появляются антитела- ревмофактор, увеличивается СОЭ выше 16 мм,час, положителен С- реактивный белок.
Клиника артрита
У человека появляются постоянные ноющие боли(особенно по утрам), припухлость и покраснение- вначале мелких суставов кистей и стоп, далее голеностопных, лучезапястных, далее локтевых, коленных, плечевых суставов и , в последнюю очередь, поражаются крупные суставы, такие как тазобедренный. Постепенно развивается деформация суставов, контрактуры ( рубцевание соединительной ткани после воспаления и ограничение движений в суставе).
После острого периода наступает ремиссия, которая может быть длительной.Иногда атака артрита бывает однократной, обычно при правильном лечении.
Деформации суставов формируются в течении 5 лет после обострения.
Рентгенологическая диагностика и классификация артритов
Рассмотрим, что же происходит в суставе, что выявляется при рентгенологическом исследовании.
На 1-й стадии заболевания, начальной, рентгенологически виден выпот в суставе,признаки неполноценности костной ткани.
2-я стадия: умеренного воспаления характеризуется сужением суставной щели (за счет уменьшения суставной жидкости и дистрофии хрящевой ткани , ее эрозирования) .
На этой стадии заметно существенное разрушение костной ткани, видны ее мелкие краевые дефекты, усиливается разрежение костной ткани.
3-я стадия тяжелая, фиброзно- склеротическая. Видны четкие явления разрушения хрящей, костной ткани, деформация сустава и развитие анкилоза (тугоподвижности).
4-я стадия- терминальная. На рентгенограмме виден полный фиброз и анкилоз сустава.

Клиническая классификация базируется не рентгенологической. 1-я стадия называется экссудативной. 2-я -пролиферативная, 3-я- фиброзно-склеротическая.
Лечение ревматоидного артрита
На разных этапах заболевания лечение назначается различное. Традиционно необходимо провести обезболивающее и противовоспалительное лечение, назначаются неспецифические противовоспалительные препараты, такие как: диклофенак, ибупрофен, кетонал, нимесулид, флурбипрофен и пр. Применяются препараты золота, иммунодепрессивный препарат- метотрексат, лефлуномид. Глюкокортикоиды подавляют агрессивные реакции организма и гасят воспалительные изменения в суставах:дексаметазон, преднизолон, гидрокортизон, метипред.
Используется селективное противовоспалительное средство- мовалис. Для остановки воспалительных процессов используются и противомалярийные средства: плаквенил, хлорохин, гидроксихлорохин.
Новые методы лечения
Современные средства для лечения делятся на две группы: ортопедическое и эндопротезирование, вторая группа- использование генно- инженерных разработок.
Генно-инженерный препарат-ремикейд- подавляет агрессивную реакцию организма, он создан путем синтеза человеческого и мышиного ДНК. Ремикейд быстро и эффективно останавливает воспалительный процесс, дает длительную ремиссию ( на несколько лет), эффективен даже в тяжелых случаях. Недостатки препарата: очень высокая цена, необходимость лечения в стационаре, так как препарат вводится внутривенно, капельно. При лечении возможны аллергические реакции и побочные действия.

Обследование в клинике
Перечисленные методы лечения направлены на уменьшение воспаления в суставе.
Восстанавливает функцию сустава и удлиняет ремиссию метод эндопротезирования.
Метод представляет собой внутрисуставные инъекции препаратов, замещающих синовиальную жидкость. Препараты могут быть органического происхождения и синтетические биополимеры.
Органические препараты созданы на основе гиалуроновой кислоты, из животного сырья, что имеет родственный состав с суставной жидкостью. Но, как все органические препараты, может вызывать аллергические реакции и достаточно быстро разрушается ферментами организма.
Группа биополимеров более перспективна, так как не вступает в реакции с тканями и не разрушается ферментами, и, конечно же, не дает аллергических реакций. Биополимеры различаются по степени вязкости ( молекулярной массе). Гидрогели третьего поколения, например, действуют до трех лет. А такой препарат, как Нолтрексин, содержит еще и ионы серебра, уменьшающие воспалительные изменения в суставе.
Препараты этих групп доступны в цене, вводятся , как правило, однократно; быстро, эффективно и надолго восстанавливают двигательную активность и прекращают дальнейшее травмирование костно-хрящевой ткани, разъединяя трущиеся поверхности.
При ревматоидном полиартрите в качестве дополнительного противовоспалительного фактора используется физиолечение:лазеротерапия, ультразвук, фонофорез, электрофорез, криотерапия, ВЛОК и другие.
Ревматоидный артрит очень серьезная болезнь, требующая комплексного подхода и тщательного подбора методов лечения. При правильном и последовательном лечении достигается не только длительная ремиссия , но и улучшение качества жизни, свободы движений, удается избежать инвалидности.
Спецагенты по борьбе с аутоиммунным воспалением: место моноклональных антител в современной ревматологии
Статья на конкурс «био/мол/текст»: Вам когда-нибудь снились кошмары о том, как организм разъедает себя изнутри? А что если это становится реальностью? Именно процессы аутофагии лежат в основе развития ревматических заболеваний. В борьбе с аутоиммунным воспалением медицина слишком часто проигрывала. пока не появились они. Моноклональные антитела.

Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

Системные ревматические заболевания — это патологии, которые возникают из-за агрессивного воздействия иммунитета на собственные ткани. В основе их развития лежит ошибка иммунной системы , которая неправильно распознает нормальные составляющие человеческого тела — аутоантигены. Иммунные клетки принимают их за чужеродные агенты, в которых видят угрозу для организма. Активируется защитная функция, и начинается «бомбардировка» здоровых клеток факторами иммунной системы — аутоантителами (рис. 1).
Основы нормального иммунитета и аутоиммунного процесса в доступной форме изложены на «Биомолекуле» в статье «Иммунитет: борьба с чужими и. своими» [1].
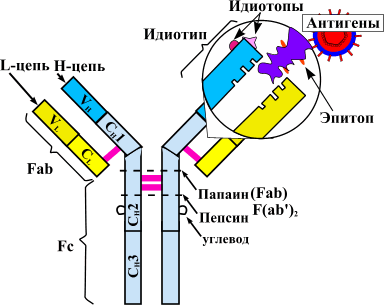
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
В 2017 году «Биомолекула» опубликовала спецпроект, посвященный аутоиммунным заболеваниям.
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
Лекарства, применяемые при ревматических болезнях
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
Разберемся, почему нужны новые лекарства. В качестве примера можно рассмотреть классическую терапию одного из самых распространенных аутоиммунных заболеваний — ревматоидного артрита [3]. Современные стратегии борьбы с этой патологией должны соответствовать концепции Treat to target — «лечение до достижения поставленной цели». Она направлена на ремиссию (исчезновение симптомов) заболевания или резкое снижение активности артрита [5], [6].
«Золотым стандартом» в терапии заболевания является метотрексат (рис. 2). Препарат входит в группу базисных противовоспалительных средств.
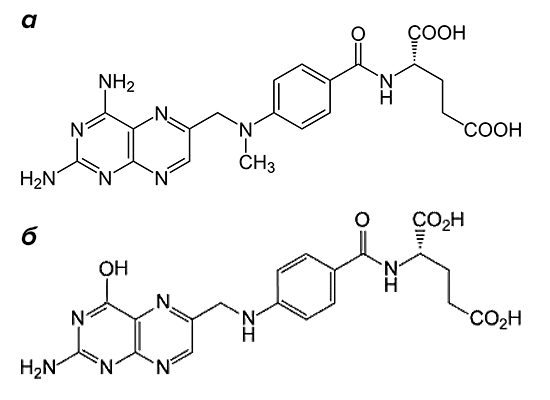
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
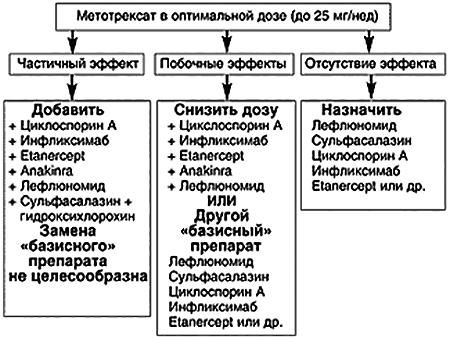
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
Иммунная система — это сложный механизм, состоящий из множества «винтиков» — иммунных клеток. Каждая из них имеет свои функции и занимает определенное место в общей структуре защитной системы. В ответ на поступление «вражеского» агента (антигена) включаются компоненты врожденного иммунитета — неспецифические факторы защиты. Это нейтрофилы, эозинофилы и базофилы, которые первыми стоят на пути у вредного воздействия.
Винтики крутятся — активируются новые компоненты иммунной системы. В борьбу с патогеном вступают Т- и В-лимфоциты. Они включают более тонкие механизмы защиты — специфическую цитотоксичность. Вырабатываются антитела, ищут себе «жертву» Т-киллеры. Тонкая регуляция процесса с помощью цитокинов позволяет быстро достигнуть поставленной цели. Согласованное действие всех компонентов иммунитета приводит к выполнению программы — уничтожению патологического агента.
Во время подбора подходящих «деталей» для механизма — при селекции лимфоцитов — неизбежно возникают ошибки. Иммунная система производит аутореактивные клоны — клетки, которые специфичны к антигенам тканей организма. В норме они отсеиваются в «мастерских» — тимусе и лимфатических узлах. Те клоны лимфоцитов, которые не различают собственные и чужеродные антигены, сразу же уничтожаются еще до того, как они приступят к выполнению своей функции. Но что происходит, если «винтики» выпадают из машины иммунитета? Поломка возникает в специфической части механизма — в работе Т- и В-лимфоцитов. При нарушении процесса селекции аутореактивные клетки выходят в кровь. Они ищут своих «жертв» и находят их в нормальных элементах собственных тканей.
В зависимости от типа реакции отличается патофизиологический процесс, лежащий в основе аутоиммунной агрессии. Т-лимфоциты могут самостоятельно убивать клетки тела, а могут и работать «чужими руками» — активировать выработку аутоантител В-лимфоцитами. При поражении В-клеточного иммунитета аутофагия реализуется через систему комплемента, а также путем формирования цитотоксических иммунных комплексов [13], [14]. Подробнее о механизмах нормального и измененного иммунного ответа можно почитать на «Биомолекуле» [1], а также в статьях [15], [16].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
Биологические агенты воздействуют на отдельные «винтики» механизма иммунной защиты. Их мишенями могут быть цитокины и их рецепторы, мембранные молекулы лимфоцитов. В зависимости от точки приложения препарата моноклональные антитела делятся на группы (рис. 4):
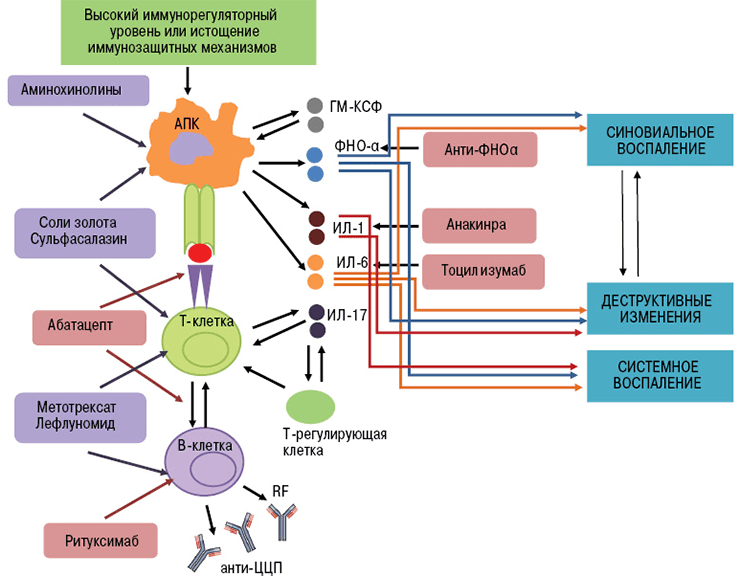
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы ФНО
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
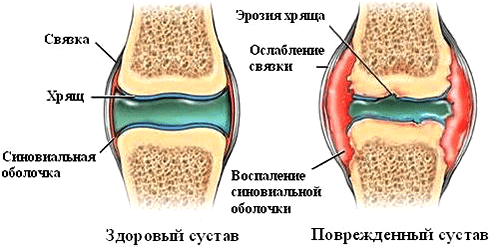
Однако влияние ФНО на суставы при ревматических заболеваниях нельзя назвать положительным. Так, при ревматоидном артрите цитокин стимулирует размножение синовиальных фибробластов — клеток оболочки сустава. Это приводит к формированию паннусов — разрастаний агрессивной ткани. С течением заболевания процесс воспаления и деструкции распространяется на суставный хрящ и подлежащие кости (рис. 5). Ткани сустава заполняются иммунными клетками — макрофагами, Т- и В-лимфоцитами, нейтрофилами. Эти механизмы лежат в основе развития хронического воспаления. Освежить знания о патогенезе ревматоидного артрита можно в статье «Ревматоидный артрит: изменить состав суставов» [3].
Одним из ингибиторов ФНО является препарат инфликсимаб. Он имеет «человеческую» и «мышиную» области. Примерно 25% всех аминокислот в составе моноклонального антитела получены из организма мышей. Это Fab-фрагмент — специфический участок, отвечающий за связывание с ФНО. Fc-фрагмент белка образуется из IgG1 — антитела человека.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
Механизм действия инфликсимаба понятен из его строения. Fab-фрагмент молекулы связывает фактор некроза опухолей, образуя с ним устойчивый комплекс. Такое взаимодействие полностью блокирует активность цитокина, препятствуя его соединению с мембранными рецепторами p55 и p57. Инфликсимаб «обезвреживает» как растворимую, так и мембраноассоциированную формы ФНО (рис. 6). В клетках суставов снижается содержание и других провоспалительных факторов — ИЛ-1, ИЛ-6, монооксида азота.
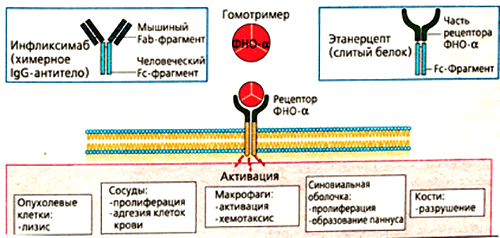
Немного другую структуру имеет еще один эффективный препарат из группы ингибиторов ФНО — этанерцепт. В его состав входит внеклеточная часть рецептора к фактору некроза опухолей. Она «подсоединяется» к человеческому IgG1. Гибридная молекула вступает в жесткую конкуренцию за свободный ФНО и обезвреживает его до того, как цитокин успевает связаться с рецепторами и запустить воспалительную реакцию. Дополнительное действие этанерцепта, которого нет у других ингибиторов ФНО, — это нейтрализация лимфотоксина. Это вещество тоже относится к провоспалительным цитокинам. Выработка лимфотоксина стимулирует пролиферативные процессы в суставах. Соответственно, блокировка его действия снижает активность воспаления при ревматологических заболеваниях [18].
Ингибиторы ФНО хорошо показали себя не только при лечении ревматоидного артрита, но и при других аутоиммунных патологиях. Например, у пациентов с болезнью Бехтерева широко используют новые препараты. Замедление прогрессирования патологии в этом случае очень важно, так как аутоагрессия направлена на суставные и костные образования позвоночника. С течением времени болезнь превращает позвоночный столб в «бамбуковую палку» — монолитное негнущееся образование. Анкилоз развивается постепенно, но неотвратимо. С каждым годом двигательные возможности больных становятся все более ограниченными. Применение биологических препаратов позволяет снизить активность воспаления в позвоночнике. Это замедляет процесс формирования анкилоза [19].
Блокаторы интерлейкиновых рецепторов
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
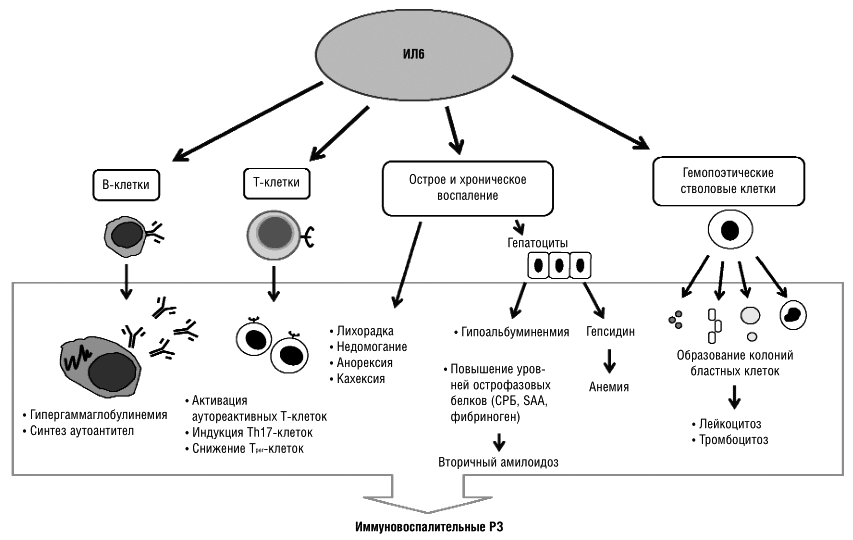
Влияние интерлейкинов — один из «спусковых крючков» воспалительного процесса. Поэтому блокировка их активности улучшает состояние пациентов с аутоиммунными заболеваниями. Приостановить работу интерлейкинов можно, если связать их рецепторы — молекулы, передающие сигнал иммунным клеткам. На этом основан механизм действия моноклональных антител из группы ингибиторов интерлейкиновых рецепторов.
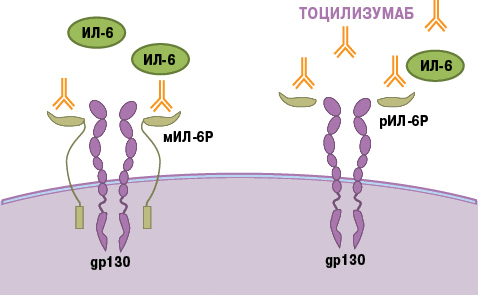
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Анти-B-клеточная терапия
Одними из главных элементов, участвующих в аутоиммунном воспалении, являются В-лимфоциты. Именно они вырабатывают аутоантитела, которые связываются со здоровыми клетками организма. Образовавшийся комплекс антитела и аутоантигена атакует система комплемента или цитотоксические лимфоциты. Этот процесс лежит в основе воспалительной реакции при таком ревматическом заболевании, как системная красная волчанка. Ей на «Биомолекуле» посвящена отдельная статья: «Системная красная волчанка: болезнь с тысячью лиц» [2].
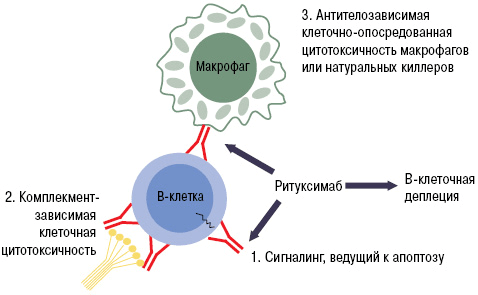
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
Благодаря этой особенности белок CD20 является идеальной «жертвой» для биологических препаратов. При «выключении» его активности не нарушается ни образование новых лимфоцитов, ни выработка нормальных антител. Одним из лекарств с таким механизмом действия является ритуксимаб. Моноклональное антитело связывается с молекулой CD20. Это приводит к запуску иммунологических реакций по отношению к B-лимфоцитам, которые обеспечивают разрушение (лизис) этих клеток (рис. 9).
Анти-Т-клеточная терапия
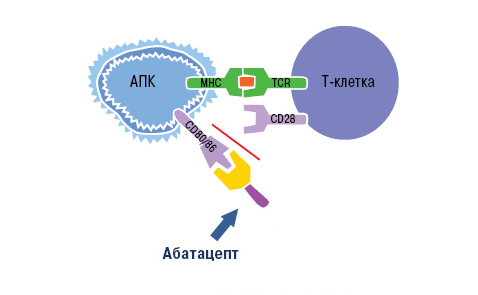
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
Не всё так просто: возможные проблемы при использовании моноклональных антител
Препараты моноклональных антител уже довольно долго используют в ревматологической практике. Однако назначают их далеко не всем — не каждому первому и даже не каждому второму пациенту. Главным ограничением, с которым сталкиваются врачи и больные, является действительно «заоблачная» стоимость препаратов этой группы. Ревматические заболевания нельзя вылечить за неделю или месяц — они требуют многолетнего (или даже пожизненного) использования терапии. Поэтому при подборе лекарственного средства важна не только его эффективность, но и цена.
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Поэтому лечение ревматических заболеваний проводят по строгим алгоритмам. При выявлении патологии пациенту назначают базисный препарат. К примеру, при ревматоидном артрите основным лекарством, вероятнее всего, станет метотрексат. Добавлять моноклональные антитела к стандартной схеме лечения врачи будут только в исключительных случаях. В России их считают препаратами резерва — дополнительными средствами, которые стоит «оставить на потом», даже несмотря на высокую эффективность. Так, если выраженность симптомов не снижается долгое время (как минимум 6 месяцев!), к метотрексату могут добавить биологический препарат. Базисная терапия при этом не отменяется.
Если заболевание изначально имеет высокую активность, быстро прогрессирует и сопровождается внесуставными осложнениями, то больному сразу могут назначить комбинированное лечение базисными средствами и моноклональными антителами. Это связано с тем, что лучше всего биологические препараты работают именно в «остром периоде», когда выраженность симптомов максимальная. Кроме того, эффект от их использования наблюдается быстрее. Лечение инфликсимабом дает результаты уже через 2–4 недели, тогда как метотрексат «включается в работу» только через несколько месяцев.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Назначение и реализация биологических препаратов контролируется государством. Многие средства из группы моноклональных антител (инфликсимаб, этанерцепт, тоцилизумаб, голимумаб) входят в «Перечень жизненно необходимых и важнейших лекарственных средств». В соответствии с ним формируется список лекарств, которые поступают в стационары по всей России. Конечно, биологические препараты сегодня есть далеко не в каждой больнице. Обычно их используют в региональных центрах или специализированных стационарах.
При неспособности обеспечить себя лекарствами пациенты получают инвалидность и проходят терапию за счет государства. Это право закреплено в действующей «Программе государственных гарантий оказания бесплатной медицинской помощи». Лечение биологическими препаратами предоставляется при ревматоидном артрите, болезни Бехтерева, СКВ, дерматополимиозите, ювенильном артрите и других заболеваниях. При этом врачи должны определить четкие показания к назначению того или иного средства. Получить дорогостоящее лечение довольно сложно — нужно пройти полное обследование, собрать документы. Однако предоставление государственной квоты для многих пациентов является последним шансом на полноценную жизнь.
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Аутоиммунные синдромы, спровоцированные введением лекарства, обычно представлены васкулитами, СКВ, антифосфолипидным синдромом, псориазом [25]. Высокой иммуногенностью обладает инфликсимаб, в составе которого есть чужеродные мышиные фрагменты. Менее активно провоцируют иммунитет полностью «человеческие» препараты. Но даже при их применении есть высокий риск развития побочных аутоиммунных реакций. Чтобы устранить эти нарушения, необходимо скорректировать схему лечения больного. В нее включают дополнительные иммуносупрессоры, которые будут подавлять осложнения. Возможно, поэтому комбинации биологических препаратов с базисными лекарствами часто более эффективны, чем изолированная терапия, пусть даже и самыми новыми средствами [24].
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Литература
- Иммунитет: борьба с чужими и… своими;
- Системная красная волчанка: болезнь с тысячью лиц;
- Ревматоидный артрит: изменить состав суставов;
- Насонов Е.Л., Александрова Е.Н., Новиков А.А. (2015). Аутоиммунные ревматические заболевания — проблемы иммунопатологии и персонифицированной терапии. Вестник РАМН. 2, 169–182;
- Бабаева А.Р., Калинина Е.В., Звоноренко М.С. (2016). Новые возможности повышения эффективности и безопасности лечения ревматоидного артрита. Медицинский алфавит. 22, 5–12;
- Josef S Smolen, Robert Landewé, Ferdinand C Breedveld, Maya Buch, Gerd Burmester, et. al.. (2014). EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis. 73, 492-509;
- Насонов Е.Л. (2015). Метотрексат при ревматоидном артрите — 2015: новые факты и идеи. Научно-практическая ревматология. 4, 421–433;
- Каневская М.З. и Гурская С.В. (2013). Метотрексат в лечении ревматических заболеваний. Современная ревматология. 4, 47–53;
- D. T. Felson, J. S. Smolen, G. Wells, B. Zhang, L. H. D. van Tuyl, et. al.. (2011). American College of Rheumatology/European League Against Rheumatism Provisional Definition of Remission in Rheumatoid Arthritis for Clinical Trials. Annals of the Rheumatic Diseases. 70, 404-413;
- Patrick Durez, Jacques Malghem, Adrien Nzeusseu Toukap, Geneviève Depresseux, Bernard R. Lauwerys, et. al.. (2007). Treatment of early rheumatoid arthritis: A randomized magnetic resonance imaging study comparing the effects of methotrexate alone, methotrexate in combination with infliximab, and methotrexate in combination with intravenous pulse methylprednisolone. Arthritis Rheum. 56, 3919-3927;
- Моноклональные антитела;
- 12 методов в картинках: иммунологические технологии;
- Аутофагия, протофагия и остальные;
- Нобелевская премия по медицине и физиологии 2016: за самоедство;
- Зайчик А.М., Полетаев А.Б., Чурилов Л.П. (2013). Распознавание «Своего» и взаимодействие со «Своим» как основная форма активности адаптивной иммунной системы. Вестник СПбГУ. Серия 11. Медицина. 1;
- Аутоиммунитет. Современные взгляды на физиологические и патологические аспекты аутоиммунитета. Электронный архив НГУ;
- Впервые за полвека появилось новое лекарство от волчанки;
- Насонов Е.Л. и Каратеев Д.Е. (2013). Применение генно-инженерных биологических препаратов для лечения ревматоидного артрита: общая характеристика (лекция). Научно-практическая ревматология. 2, 163–169;
- Логвиненко С.И., Щербань Э.А., Придачина Л.С., Придачина А.Н., Маслова Ю.Ю., Кашичкина А.А. (2016). Генная инженерия в лечении анкилозирующего спондилита (болезни Бехтерева). Научные ведомости БелГУ. Серия: Медицина. Фармация. 19, 179–182;
- Masahiko Mihara, Misato Hashizume, Hiroto Yoshida, Miho Suzuki, Masashi Shiina. (2012). IL-6/IL-6 receptor system and its role in physiological and pathological conditions. Clin. Sci.. 122, 143-159;
- Насонов Е.Л., Александрова Е.Н., Авдеева А.С., Панасюк Е.Ю. (2013). Ингибиция интерлейкина 6 — новые возможности фармакотерапии иммуновоспалительных ревматических заболеваний. Научно-практическая ревматология. 4, 416–427;
- Супоницкая Е.В., Александрова Е.Н., Алексанкин А.П., Насонов Е.Л. (2015). Влияние терапии генно-инженерными биологическими препаратами на субпопуляции В-лимфоцитов при ревматических заболеваниях: новые данные. Научно-практическая ревматология. 1, 78–83;
- Бабаева А.Р., Черевкова Е.В., Гальченко О.Е., Солоденкова К.С. (2012). Биологические агенты в базисной терапии ревматоидного артрита. Лекарственный вестник. 7, 3–9;
- Муравьев Ю.В. и Муравьева Л.А. (2016). Несвоевременные мысли о применении генно-инженерных биологических препаратов при ревматических болезнях. Научно-практическая ревматология. 3, 361–366;
- Псориаз: на войне с собственной кожей.
Источник https://euromed.academy/revmatologiya-v-moskve/revmatoidnyj-artrit/lechenie-revmatoidnogo-artrita
Источник https://www.noltrexsin.ru/publikacii/revmatoidnyy-artrit-novyy-podhod-k-lecheniyu/
Источник https://biomolecula.ru/articles/spetsagenty-po-borbe-s-autoimmunnym-vospaleniem-mesto-monoklonalnykh-antitel-v-sovremennoi-revmatologii