Острый миелобластный лейкоз лечение у взрослых
Острая миелоидная лейкемия у взрослых — клиника, лечение
В большинстве случаев анамнез и выявляемые при осмотре симптомы сходны с таковыми при ОЛЛ. Боли в костях и выявляемые при рентгенологическом обследовании инфильтраты в них при ОМЛ менее распространены. Заболевания ЦНС встречаются очень редко. Увеличение лимфатических узлов также менее распространено, чем при ОЛЛ.
При миеломоноцитарной (М4) и моноцитарной (М5) лейкемии являются обычными инфильтраты в деснах, приводящие к «гипертрофии» десен. Кожные инфильтраты также нередки при этих формах лейкемии и связаны с высоким тотальным уровнем WBC и высоким уровнем лизозимов сыворотки крови и мочи, которые выделяются опухолью.
Наиболее распространенные диагностические признаки: бледность кожных покровов, гепатоспленомегалия, пурпура и боли в костях. Часто повышен уровень WBC, как правило, хорошо выявляются миелобласты. Для подтверждения диагноза проводят исследование костного мозга с использованием специального соответствующего окрашивания.

Морфологическая классификация острых лейкемий. Доля подтипов острых лейкемий миелоидного и моноцитарного происхождения (%).
Лечение острой миелобластной лейкемии
Индукция ремиссии: целью индукции является восстановление костного мозга и клиническая ремиссия. Чтобы этого добиться, необходима интенсивная терапия крови, тромбоцитов и применение антибиотиков в период гипоплазии, неизбежно сопровождающее химиотерапию.
Используется комбинация высоких доз цитозинарабинозида и даунорбицина. Идарубицин и митоксантрон не представляются более эффективными, чем даунорбицин. Добавление таких трех лекарств, как этопозид, флюдарабин или тиогуанин, не дает улучшения результатов. Количество бластов в крови и костном мозге обычно быстро снижается при супрессии нормального гематопоэза.
В настоящее время, когда возможно применить врачебные навыки, смертность на этой стадии составляет 10%. В период гипоплазии дальнейшая цитотоксическая терапия часто необходима, если все еще есть проявления болезни со стороны костного мозга, которые приводят к интенсификации гипоплазии и повышают риск.
Поэтому индукция ремиссии является процедурой, требующей очень хороших навыков, которую лучше проводят в учреждениях, имеющих подготовленный медицинский персонал и сиделок. Очень важен внимательный контроль жидкости и электролитного баланса, быстрое оперативное выявление и лечение инфекций. Профилактическое лечение ЦНС обычно не проводят.
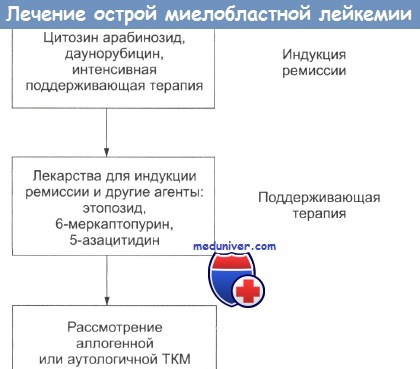
Поддерживающая терапия острой миелобластной лейкемии
Поддержание продукции элементов крови очень важно в фазе интенсивной индукции ремиссии. Трансфузия тромбоцитов оказывается наиболее действенной в предотвращении гибели от геморрагии. Показания к трансфузии тромбоцитов обсуждаются в отдельной статье на сайте (рекомендуем пользоваться формой поиска на главной странице сайта).
Переливание крови весьма важно при анемии, но его нужно избегать в ситуациях, когда WBC очень высок (выше 100 х х 109/л), поскольку могут возникнуть лейкостазы в сосудах головного мозга. Для снижения WBC перед трансфузией могут быть использованы химиотерапия и, если необходимо, лейкаферез. Применение гемопоэтических ростовых факторов описано в отдельной статье на сайте (рекомендуем пользоваться формой поиска на главной странице сайта).
Во время интенсивной терапии хорошо помогает использование подкожно вводимых внутривенных подключичных катеторов (катетер Хикмана).
Для предотвращения инфекции пациентов инструктируют, как правильно мыться, особенно аккуратно в области промежности. При выявлении сепсиса зубов и полости рта нужно немедленно приступать к лечению. Пища должна быть термически обработана и чистая — свежие салаты лучше исключить. Очень важно регулярное обследование полости рта, кожи и промежности, должны проводиться регулярные посевы для выявления патогенов, таких как Klebsiella или Pseudomonas. В некоторых случаях дается котримоксазол с профилактической целью для предотвращения развития оппортунистических инфекций, таких как Pneumocystis carinii.
У многих пациентов развивается жар, лихорадка на некоторых стадиях в период нейтропении. Лечение инфекции у больных с нейтропенией обсуждается в отдельной статье на сайте (рекомендуем пользоваться формой поиска на главной странице сайта). Часто невозможно поставить бактериологический диагноз. Наиболее фатальными инфекциями являются те, которые вызваны представителями группы граммотрицательных микроорганизмов. Инфекции, появляющиеся вокруг линии Хикмана, вызывают микроорганизмы, частично присутствующие на коже в норме, такие как Staphyloccocus epidermidis и S. aureus. Для лечения этих явлений часто используют антибиотики ванкомицин и тейкопланин.
Оппортунистические инфекции являются причиной значительных затруднений в диагностике у пациентов с высокой температурой и легочными инфильтратами. Инфекции, вызванные микроскопическими грибами, Pneumocystis carinii, и менее распространенные цитомегаловирусные и другие вирусные инфекции должны быть также приняты во внимание.

После того как взяты посевы крови при приступе жара, проводится внутривенная терапия широким спектром антибиотиков. Такие режимы обычно включают аминогликозид и цефалоспорин, часто добавляют метронидазол, особенно если наблюдают ухудшение клинических проявлений через 24 ч. При выявлении легочных инфильтратов могут применяться высокие дозы котримоксазола для борьбы с Pneumocystis, амфотерицин В для подавления грибной инфекции и ацикловир для подавления герпеса.
Результаты лечения и новые подходы: Полная ремиссия наблюдается у 65% пациентов моложе 60 лет и у 50% — старше этого возраста. Поэтому развитие новых подходов к индукции ремиссии в группах с плохим прогнозом является важной областью в дальнейших исследованиях. Новые подходы включают в себя использование анти-CD33 моноклональных антител (гемтузумаб).
Более интенсивные поддерживающие режимы также изучаются и могут пролонгировать длительность ремиссии. У пожилых пациентов токсичность повышена и интенсификация режимов проблематична. Худший исход наблюдается у тех больных старше 60 лет, у которых высокий уровень WBC и плохие характеристики статуса, а также у пациентов, у которых ОМЛ развилась после миелодиспластического синдрома (9:11).
Цитогенетические изменения прогностически важны: t(q;11), 5q, inv3 — неблагоприятны, и t(8;21) — имеет благоприятный прогноз. В общем, выживаемость в течение 10-летнего периода без проявления болезни составляет около 30%.
Несмотря на то что результаты стандартной интенсивной химиотерапии при ОМЛ улучшаются, долгосрочный прогноз до сих пор остается плохим для большинства пациентов. Подходы с использованием ТКМ (особенно аллогенной) не годятся для большинства пациентов, так как ОМЛ — болезнь людей пожилого возраста. Аллогенная ТКМ обычно применяется при первом полном ответе и, по сравнению со стандартным лечением, похоже, снижает лейкемические рецидивы на 20%. Некоторые из этих положительных результатов проявляются из-за лейкемического эффекта отторжения.
Современные исследования показывают преимущество аллогенной трансплантации с долгосрочным эффектом без проявлений болезни у примерно 50% пациентов. Этому необходимо противопоставить острую смертность, особенно от аллогенной ТКМ. Показано, что аутологичная ТКМ снижает риск рецидивов. Эта процедура более широко применима, чем аллогенная ТКМ, поскольку подходящий донор не нужен. При аллогенной ТКМ обычно используются высокие дозы циклофосфамида и ТО. При аутологичной ТКМ режимы могут базироваться лишь на одной химиотерапии. Гемопоэтические ростовые факторы делают возможным повышение интенсивности лечения, не вызывая стимуляции лейкемической пролиферации.
Для пожилых пациентов в большинстве случаев есть дополнительные проблемы, связанные с сопутствующими заболеваниями, не позволяющие применить интенсивный метод. Несмотря на это, во многих исследованиях исключают пациентов старше 60 лет без достаточных оснований, и требуется более усовершенствованный метод. Возможно, аллогенная или аутологичная трансплантация более низкой интенсивности даст лучший результат.
Лечение рецидивов острой миелобластной лейкемии
Хотя индукция второй ремиссии возможна у пациентов, которые дали рецидив после прерывания лечения, такая ремиссия обычно непродолжительна. Для пациентов моложе 60 лет вторая ремиссия иногда может быть достигнута использованием высоких доз цитозинарабинозида. Для молодых людей и тех, у кого обнадеживающий прогноз, есть шанс лечения с использованием аллогенной или аутологичной ТКМ, обычно с предшествующей реиндукционной химиотерапией.
Исследования, сравнивающие аллогенную и аутологичную трансплантацию, не могут быть рандомизированы, за исключением тех двух случаев, когда донор пригоден или не пригоден к рассмотрению как суррогатная «генетическая» случайная выборка. Поэтому и технические, и клинические трудности не вносят ясности, какой метод предлагает лучший результат. Рецидивы со стороны центральной нервной системы лечат по сходной схеме как при ОЛЛ.
Лечение острой промиелоцитарной лейкемии (M3)
Острая промиелоцитарная лейкемия (ОПЛ) составляет 10% от общего количества случаев заболевания ОМЛ. Индукция ремиссии осложняется десеменированной внутрисосудистой коагуляцией в тех случаях, когда применяется цитохимическая химиотерапия. Представляется, что это происходит из-за высвобождения прокоагулянтов (цистеиновая протеиназа).
Клетки дифференцируются in vitro в ответ на полностью транс-ретиноивую кислоту (ATRA, третинон). Когда применяют ATRA для лечения пациента с ОПЛ, костный мозг медленно (в течение 2 месяцев) возвращается в норму (кроме типичного t(15;17) кариотипа) и десеменированной внутрисосудистой коагуляции не происходит. Побочные эффекты: сухая кожа, головные боли и потенциально опасный гиперлейкоцитоз (который может вызвать отек легких). Через 6 месяцев у пациентов бывают рецидивы.
Новые исследования предполагают, что химиотерапия как дополнение к лечению ATRA может дать хорошие результаты. Точка разрыва при транслокации хромосом t(15;17) расположена около гена, кодирующего а-рецептор ретиноевой кислоты на 17 хромосоме, и использование ATRA только улучшает ситуацию в тех случаях, когда у пациента имеется такая транслокация.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Классификация и морфология острых лейкемий
- Хромосомные нарушения при лейкемиях — варианты, частота
- Острая лейкемия у детей — клиника, диагностика
- Лечение острой лейкемии у ребенка и ее прогноз
- Острая лимфобластная лейкемия у взрослых — клиника, лечение
- Острая миелоидная лейкемия у взрослых — клиника, лечение
- Миелодиспластические синдромы — клиника, лечение
- Хроническая лимфоцитарная лейкемия — клиника, стадии
- Лечение хронической лимфоцитарной лейкемии и ее прогноз
- Хроническая Т-клеточная лимфоцитарная лейкемия — диагностика
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Острый миелобластный лейкоз (миелоидный)

Сегодня все чаще можно услышать об онкологических заболеваниях, которые пугают возможными исходами. Один из таких коварных недугов — миелобластный лейкоз. Эта патология страшна тем, что даже при яркой клинической картине подтвердить этот диагноз врачу достаточно сложно. На пациентах такое развитие событий сказывается очень плохо — тяжело бороться с онкологическим заболеванием, не зная его сути. Патология часто проявляется во взрослом возрасте, особенно у пожилых людей. Истинная причина возникновения болезни до сих пор неизвестна, но врачи связывают ее с загрязнением окружающей среды и радиацией.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обратиться к профильному специалисту.

Признаки острого миелобластного лейкоза
Большинство симптомов этой патологии связаны с тем, что опухоль в костном мозге постепенно замещает настоящие кровяные тельца ложными. В результате из-за недостаточного числа лейкоцитов в крови пациент становится очень восприимчивым к инфекциям. Даже несмотря на то, что клетки продуцируются тем же органом и имеют похожую структуру — бороться с вредоносными бактериями они не могут. Снижение количества красных кровяных телец провоцирует появление таких симптомов:
- лихорадка;
- снижение веса;
- одышка;
- анемия;
- кровоточивость эпителия;
- боль в суставах и костях.
Нередко при проявлении острого миелобластного лейкоза увеличивается в размерах селезенка, однако самостоятельно заметить это практически невозможно. Она растет всего на 10-15% и это не сопровождается дискомфортом или болью. Отдельного внимания также заслуживает повышенная кровоточивость, которая является следствием пониженного числа тромбоцитов. Выражается она в таком виде:
- мелкие подкожные кровоизлияния;
- кровоточивость десен;
- общая слабость;
- кровоточивость носа и матки.
Как правило, именно эти симптомы пациенты замечает в первую очередь. Частая кровоточивость вызывает волнение, и главное, чтобы человек обратился к доктору вовремя для постановки правильного диагноза и последующего лечения заболевания в стационарных условиях.

Причины
За все время, что врачи знают о существовании миелоидного лейкоза, точный источник патологии установлен не был. При этом специалисты утверждают, что даже если удастся понять, как именно зарождается это заболевание, на качестве лечения это не скажется. Тем не менее врачи выделили ряд факторов, которые провоцируют эту патологию:
- пре-лейкоз;
- воздействие химиотерапии;
- радиоактивное излучение;
- генетические отклонения.
Чаще всего острый миелобластный лейкоз наблюдается у людей, прошедших химиотерапию. После нее резко возрастает риск появления этой болезни. В некоторых случаях через 5-6 лет становятся заметны изменения в лейкозных хромосомах, после чего патология бурно развивается. К опасным химическим соединяем, которые могут провоцировать это заболевание относят:
- антрациклины;
- эпиподофилотоксины;
- бензолы.
Насчет последнего многие специалисты спорят до сих пор. Считается, что воздействие бензола и других ароматических растворителей не может заставить мутировать лейкозные хромосомы. Однако статистика говорит об обратном: среди людей, профессионально и на протяжении многих лет контактирующих с химическими веществами на основе бензола, большое количество заболевших.
Какой врач спасет?
Острый миелоидный лейкоз специалисты относят к онкологическим заболеваниям, так как в процессе его развития формируется опухоль кровяного ростка. Однако, данная патология поражает лимфоидные тельца, а это уже входит в сферу другого врача. Поэтому в данном случае требуется помощь сразу двух специалистов:
Острый миелобластный лейкоз у взрослых
Острый миелобластный лейкоз (миелоидный) – гетерогенное опухолевое заболевание системы крови, характеризующееся клональной экспансией миелобластов в костном мозге, периферической крови и в других тканях и органах.
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10: 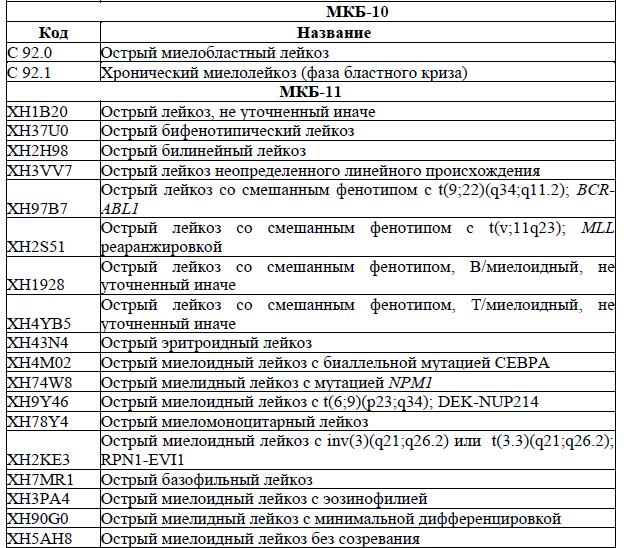
Дата разработки/пересмотра протокола: 2015 г. (пересмотрен в 2018 г.; 2022 г.)
Пользователи протокола: врачи общей практики, терапевты, онкологи, гематологи, акушер – гинекологи.
Категория пациентов: взрослые, в том числе беременные.

Шкала уровня доказательности [1]:
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
+7 938 489 4483 / +7 707 707 0716 / + 375 29 602 2356 / office@medelement.com
Мне интересно! Свяжитесь со мной
Классификация
Классификация [3-8]:
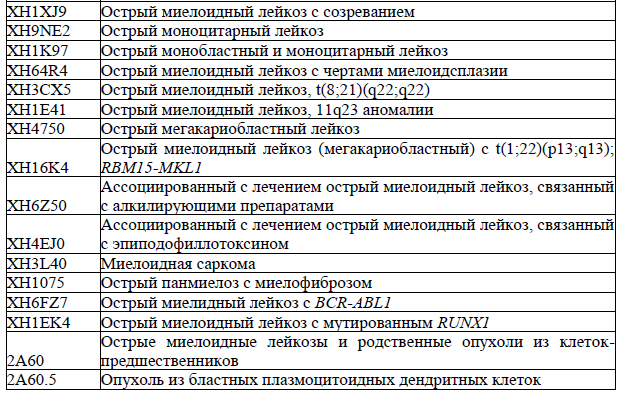
1) Острые миелоидные лейкозы (ОМЛ) и родственные новообразования ОМЛ с повторяющимися генетическими аномалиями (≥10% бластов в КМ или ПК) (ВОЗ 2022г)
ОМЛ (промиелоцитарный) с PML-RARA;
ОМЛ с t(8;21)(q22;q22.1); RUNX1-RUNX1T1;
ОМЛ с inv(16)(p13.1q22) или t(16;16)(p13.1;q22); CBFB-MYH11;
ОМЛ с t(9;11)(p21.3;q23.3); MLLT3-KMT2A;
ОМЛ с t(6;9)(p23;q34.1); DEK-NUP214;
ОМЛ с inv(3)(q21.3q26.2) или t(3;3)(q21.3;q26.2); GATA2, MECOM;
ОМЛ (мегакариобластный) с t(1;22)(p13.3;q13.3); RBM15-MKL1;
ОМЛ с t(9;22)(q34.1;q11.2)/ BCR-ABL1;
ОМЛ с мутированным NPM1;
ОМЛ с другими редкими повторяющимися транслокациями;
ОМЛ с мутацией внутри bZIP CEBPA.
2) ОМЛ (≥20% бластов в КМ или ПК) или МДС/ОМЛ (10-19% бластов в КМ или ПК):
ОМЛ с мутацией TP53;
ОМЛ с генными мутациями, связанными с миелодисплазией Определяетсямутациями в ASXL1 , BCOR , EZH2 , RUNX1 , SF3B1 , SRSF2 , STAG2 , U2AF1 и/или ZRSR2
ОМЛ с цитогенетическими аномалиями, связанными с миелодисплазией
ОМЛ не классифицированный
3) Миелоидная саркома;
4) Миелоидные пролиферации, связанные с синдромом Дауна:
Преходящий аномальный миелопоэз, ассоциированный с синдромом Дауна;
Миелоидный лейкоз, ассоциированный с синдромом Дауна.
5) Новообразование из бластных плазмоцитоидных дендритных клеток
6) Острые лейкозы (ОЛ) неопределенного линейного происхождения
Острый недифференцированный лейкоз
Острый лейкоз с t(9;22)(q34.1;q11.2) BCR-ABL1+
Острый лейкоз с t(v;11q23.3); с перестройкой KMT2A
Острый лейкоз со смешанным фенотипом В/миелоидный неуточненный
Острый лейкоз со смешанным фенотипом Т/миелоидный неуточненный
Молекулярно-генетическая стратификация пациентов по группам риска ELN 2022 [9 – 12] 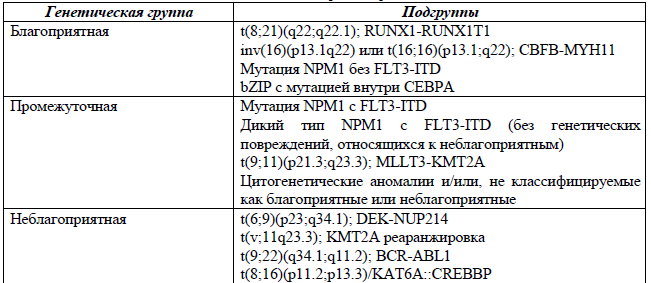

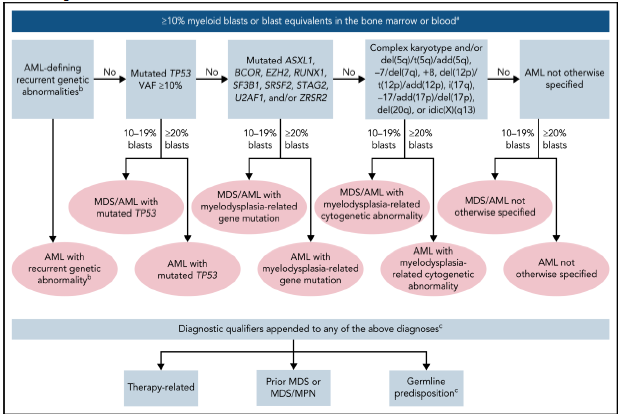
Иерархическая классификация Международной согласованной классификации ОМЛ ELN 2022
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [2,6,7,13-18,20]
Диагностические критерии
Жалобы и анамнез:
В ряде случаев у пациентов в течение нескольких месяцев до обращения может наблюдаться немотивированная слабость. Геморрагический синдром в виде петехий, кровоточивости десен, рецидивирующих носовых кровотечений, гиперполименорреи. При остром миеломонобластном лейкозе и остром миелобластном лейкозе характерна гиперплазия десен и пациенты могут первоначально обращаться к стоматологу [2].
Пациенты с ОМЛ обычно имеют симптомы, связанные с осложнениями панцитопении (например, анемия, нейтропения и тромбоцитопения), включая слабость и быструю утомляемость, инфекции различной степени тяжести и/или геморрагические признаки, такие как кровоточивость десен, экхимозы, носовое кровотечение. или меноррагии. Часто встречаются сочетания этих симптомов. Как правило, трудно точно датировать начало ОМЛ.
Физикальное обследование [13]: признаки пролиферативного синдрома (спленомегалия, увеличение лимфатических узлов), кожные лейкемиды. Лейкемиды выявляются в 13% случаев и имеют вид узлов c измененным цветом кожи над ними. В остальном проявления малоспецифичены и включают симптомы, связанные с анемией и тромбоцитопенией. [13]
Лабораторные исследования [6,7,14-18]:
ОАК: как правило, выявляется нормохромная, нормоцитарная анемия различной степени тяжести. Количество ретикулоцитов в пределах нормы или снижено. Примерно у 75% пациентов имеется тромбоцитопения. Средний уровень лейкоцитов на этапе установления диагноза около 15х109/л. 20% пациентов имеют лейкоцитоз более 100х109/л. У 25-40% пациентов уровень лейкоцитов не превышает 5х109/л. В 95% случаев при цитологическом исследовании периферической крови выявляют циркулирующие бласты [14].
ОАМ: при выраженном геморрагическом синдроме может наблюдаться гематурия.
Исследование костного мозга: миелоидная направленность бластов подтверждается на основании следующих признаков:
— палочки Ауэра по данным световой микроскопии;
— по данным цитохимического исследования позитивная реакция на Судан черный В, миелопероксидазу, хлорацетатэстеразу или неспецифическую эстеразу; [6,7]
— по данным проточной цитометрии идентифицируется экспрессия миелоидных антигенов на бластных клетках. В 20% случаев ОМЛ имеется коэкспрессия лимфоидных маркеров (например, CD7, CD19, CD2). «Истинный» лейкоз со смешанным фенотипом (бифенотипический, билинейный) встречается редко (в 2-5% случаев) и диагностируется на основе оценки балов по шкале Европейской группы по иммунологической характеристике лейкемий (EGIL). [15].
Иммунофенотипирование с помощью многопараметрической проточной цитометрии (MFC) необходимо для точной диагностики ОМЛ путем идентификации маркеров на поверхности и внутри клеток. Из-за гетерогенности ОМЛ ни один маркер не экспрессируется во всех случаях. Также важно идентифицировать ассоциированные с лейкемией иммунофенотипы (LAIP) для последующего мониторинга минимальной остаточной болезни (МОБ) с помощью MFC. Роль оценки МОБ при ОМЛ и использованием MFC в настоящее время продолжает изучаться в рамках клинических исследований. В случаях, когда невозможно получить аспират и отсутствуют циркулирующие бласты, миелоидный фенотип может быть подтвержден при гистологическом исследовании костного мозга и иммуногистохимии.
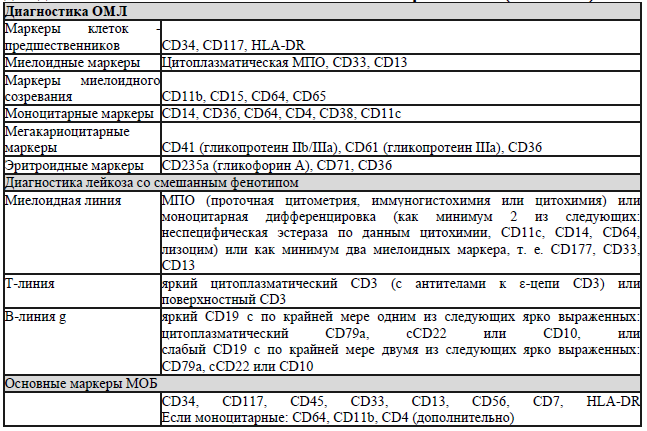
Экспрессия клеточно-поверхностных и цитоплазматических маркеров для диагностики ОМЛ и лейкоза со смешанным фенотипом (ELN 2022)
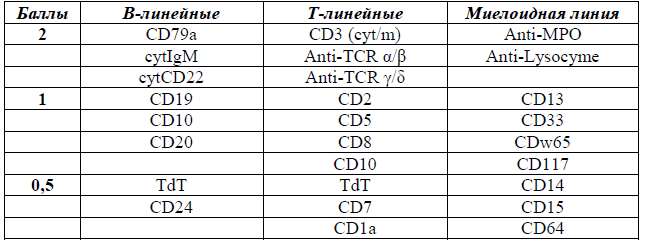
Пересмотренная шкала EGIL для бифенотипических острых лейкозов.

— стандартное цитогенетическое исследование и исследование методом FISH позволяет выявить маркеры благоприятного прогноза (t(8;21)/RUNX1/AML1; inv(16)/CBFB/MYH11) и прогностически неблагоприятные маркеры (моносомальный кариотип, t(9;11)/MLL, комплексные хромосомные абберации и др.) в связи с чем, должно проводиться всем пациентам до начала химиотерапии. Около 50% пациентов имеют те или иные цитогенетические аномалии. [16]
молекулярно-генетическое исследование выявляет генетические аномалии, такие как FLT3, NMP1, KIT, CEBPA, MLL имеющие прогностическое значение и позволяющие проводить мониторинг минимальной остаточной болезни. [17]
Цитогенетические маркеры необходимо определять в течение первых 5 – 7 дней от момента установления диагноза. Генетические мутации NPM1 и FLT3 необходимо определять в течение 48 – 72 часов (как минимум, у пациентов, являющихся кандидатами для проведения интенсивной химиотерапии и ТКМ), и другие генетические маркеры – в течение первого индукционного цикла. [18]
— Скрининг генных мутаций для определения тактики терапии
— FLT3, IDH1, IDH2 NPM1 CEBPA, DDX41, TP53; ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1, ZRSR2
— Скрининг генных перестроек PML::RARA, CBFB::MYH11, RUNX1::RUNX1T1, KMT2A реанжировки, BCR::ABL1, и др. (если доступны)
— Дополнительные гены, рекомендуемые для тестирования
— ANKRD26, BCORL1, BRAF, CBL, CSF3R, DNMT3A, ETV6, GATA2, JAK2, KIT, KRAS, NRAS, NF1, PHF6, PPM1D, PTPN11, RAD21, SETBP1, TET2, WT1
— Если в лечебном учреждении определение данных молекулярных аномалий невозможно, необходимо сохранить материал исходного диагностического образца для возможного его молекулярного анализа в другой лаборатории после получения полных цитогенетических данных.
Инструментальные исследования:
УЗИ органов брюшной полости – выявление увеличения размеров печени, селезенки;
КТ грудного сегмента – выявление инфильтративных изменений легочной ткани;
ЭКГ – выявление нарушения проводимости импульсов в сердечной мышце;
ЭхоКГ – оценка функционального состояния сердечной мышцы;
ФГДС – оценка состояния слизистой оболочки пищевода, желудка, двенадцатиперстной кишки, обнаружение источника кровотечения
Бронхоскопия – оценка состояния слизистой оболочки трахеи, бронхов, обнаружение источника кровотечения
Показания для консультации специалистов: по показаниям.
Диагностический алгоритм:
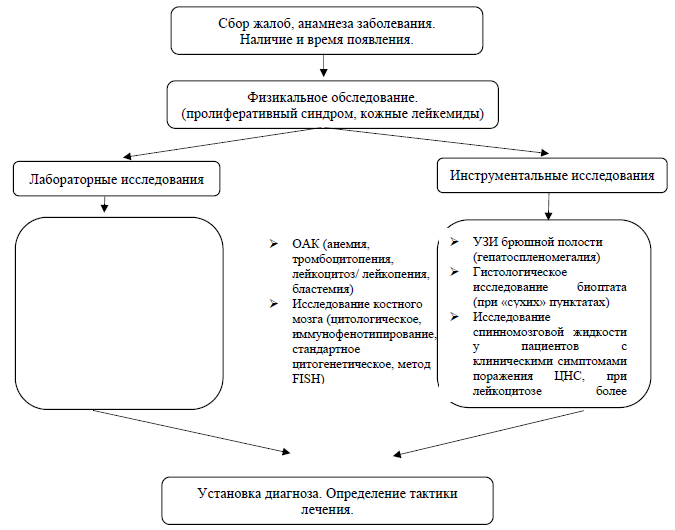
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований [14, 19]: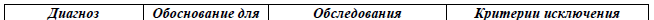
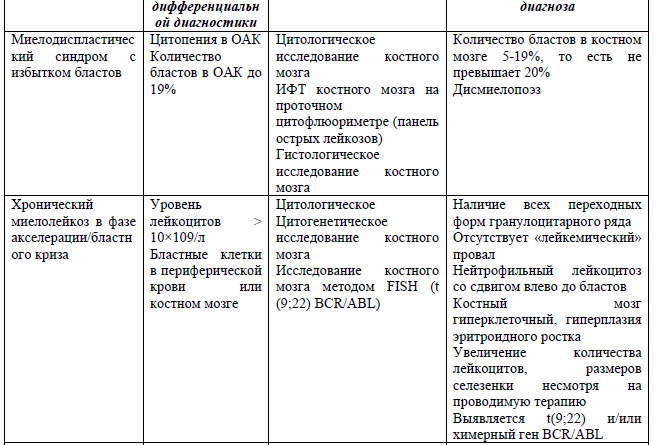
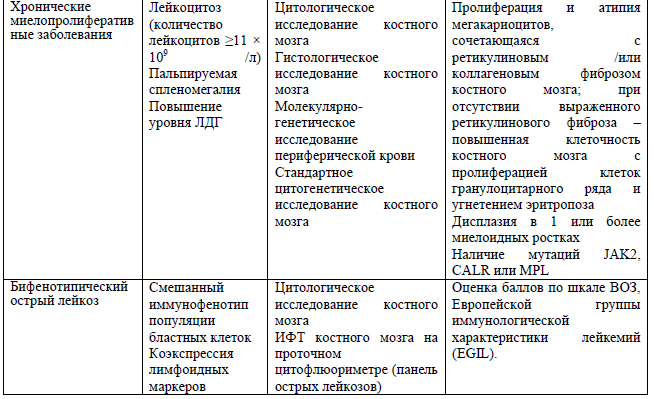

Критерии диагностики острых лейкозов со смешанным фенотипом в соответствии с классификацией ВОЗ [20]
Дополнительные исследования
Исследование спинномозговой жидкости у пациентов с клиническими симптомами поражения ЦНС, при лейкоцитозе более 30*10 9 /л
Гистологическое исследование биоптата (гребень подвздошной кости) – при получении «сухих» пунктатов
КТ и/или ЯМРТ грудного сегмента, брюшного сегмента, головы, малого таза (по показаниям) — оценка размеров, структуры инфильтрированных органов, наличие образований и свободной жидкости
Биохимический анализ крови (глюкоза, натрий, калий, кальций, креатинин, аспартат аминотрансфераза, аланин аминотрансфераза, щелочная фосфатаза, лактатдегидрогеназа, билирубина, мочевины, общий белок, мочевая кислота, креатинин).
Коагуляционные тесты: протромбиновое время, международное нормализованное отношение, активированное частичное тромбопластиновое время.)
ПЦР на вирусные инфекции (вирусные гепатиты, цитомегаловирус, вирус простого герпеса, вирус Эпштейна-Барр, вирус Varicella/Zoster) ВИЧ
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ [9,21-26] :
I этап: для первичных пациентов – выявление заболевания, госпитализация в профильное отделение.
II этап: для пациентов с установленным диагнозом поддерживающая химиотерапия может проводиться в амбулаторных условиях, контроль показателей общего анализа крови (лейкоформула + тромбоциты) каждые 1 – 3 месяца в течение 2-х лет, затем каждые 3 – 6 месяцев до 5 лет.
Немедикаментозное лечение
Режим: общеохранительный
Диета: стол №15 (общая).
Медикаментозное лечение
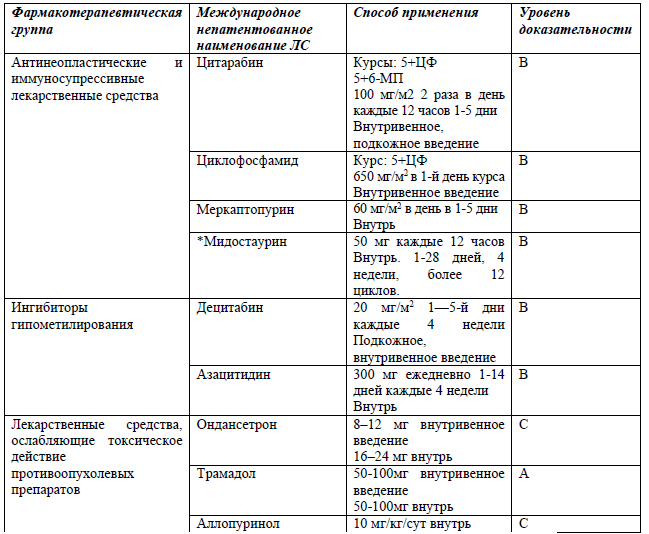
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
*В соответствии с правилами применения незарегистрированных ЛС.
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство: нет.
Дальнейшее ведение:
после завершения лечения согласно протоколу, пациенты в течение 2х лет получают поддерживающую терапию. При условии сохранения ремиссии заболевания, после окончания поддерживающей терапии, пациенты находятся на динамическом наблюдении и наблюдаются у гематолога по месту жительства в течение 5 лет.
Индикаторы эффективности лечения [9,21-26]:
Критерии ремиссии [21-23]:
Полная ремиссия (СR).
Бласты костного мозга < 5%; отсутствие циркулирующих бластов; отсутствие экстрамедуллярного заболевания; абсолютное количество нейтрофилов ≥ 1,0 × 109/л (1000/мкл); количество тромбоцитов ≥ 100 × 109/л (100 000/мкл)
Полная ремиссия с неполным восстановлением периферической крови (CRi)
Все критерии полного ответа, кроме остаточной нейтропении
Нет ответа
Пациенты, поддающиеся оценке ответа, но не соответствующие критериям ответа, классифицируются как не имеющие ответа. Пациенты, не достигшие ответа, определяются как имеющие рефрактерное заболевание.
Рефрактерность заболевания [9]
Отсутствие CR или CRi, т. е. после 2 курсов интенсивной индукционной терапии (7+3 или интенсивнее).
Рецидив заболевания
Бласты костного мозга ≥ 5%; или повторное появление бластов в крови как минимум в 2 образцах периферической крови с интервалом не менее одной недели; или развитие экстрамедуллярного заболевания.
Минимальная остаточная болезнь [24-26]
Оценка МОБ при ОМЛ используется для установления статуса ремиссии; оценки риска рецидива после ремиссии; определения развития рецидива. В настоящее время двумя наиболее используемыми методами являются МОБ на основе многопараметрической проточной цитометрии (MFC-МОБ) и молекулярная MRD (Mol-МОБ), оцениваемые с помощью qПЦР. [25]
Новые методы исследования — это секвенирование следующего поколения (NGS) и dПЦР. [26]


Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [27-32]
Карта наблюдения пациента, маршрутизация пациента: см. Приложение 1.
Индукция ремиссии [27, 28].
Общепринятым режимом индукции ремиссии у пациентов всех возрастов является схема 7+3 (антрациклины и цитарабин). Альтернативным вариантом является FLAG-IDA (флударабин, цитарабин, гранулоцитарный колониестимулирующий фактор и идарубицином). Стандартом также является включение ингибитор киназы мидостаурин в терапии первой линии для пациентов с FLT3-мутантным ОМЛ. Мидостаурин улучшил 4-летнюю ОВ на 7,1%, с 44,3 до 51,4% при использовании в индукции даунорубицин-цитарабин и высокие дозы цитарабина в консолидации у пациентов в возрасте от 18 до 59 лет.
После трёх дней введения антрациклинов и 7 дней введения цитарабина полная ремиссия достигается у 60-80% более молодых пациентов и у 40-60% более пожилых пациентов (60 лет и старше) (УД –А) [29]
Применение даунорубицина в дозе 45 мг/м2 в течение 3-х дней ассоциируется с низкой частотой достижения полных ремиссий и более высокой частотой рецидивов вводимого в режиме одного цикла индукции. [30, 31] У пациентов в возрасте 60-65 лет повышение дозы даунорубицина до 90 мг/м2 сопровождается повышением вероятности достижения ремиссии после первого курса, но не влияет на общую выживаемость. [30, 32]
Имеющиеся в настоящее время доказательства позволяют рекомендовать даунорубицин для проведения индукции в режиме «7+3» в дозе не ниже 60 мг/м2 (УД – А).
Показатели достижения полной ремиссии при применении идарубицина в дозе 12мг/м2 в течение 3 дней, находятся в диапазоне 60-70% у пациентов в возрасте моложе 50 лет. Как высокая доза даунорубицина, так и идарубицина приводит к 5-летней выживаемости от 40% до 50%. [33]
Для более пожилых пациентов (старше 60 лет) с плохим соматическим статусом, которым не может быть выполнена интенсивная терапия, выбор средств альтернативной терапии достаточно ограничен и включает паллиативную помощь, терапию низкой интенсивности, или клинические исследования с применением новых препаратов. К терапии низкой интенсивности относятся малые дозы Ara-C или гипометилирующие препараты. Малые дозы цитарабина обычно хорошо переносится и приводит к полной ремиссии в 15–25% случаев, хотя общая непродолжительная выживаемость (медиана 5–6 месяцев) считается неудовлетворительным результатом. Лечение гипометилирующими препаратами увеличивает общую выживаемость при применении децитабина по сравнению с низкодозным цитарабином (7.7 против 5.0 месяцев). [34] Азацитидин при сравнении с тремя общепринятыми режимами химиотерапии у пациентов старше 65 лет с количеством бластов более 30% и показал продление выживаемости (медиана выживаемости, 10.4 против 6.5 месяцев). Применение азацитидина может иметь особые преимущества в группе с генетикой неблагоприятного риска. Превосходство азацитидина над общепринятой терапией ранее было показано при остром миелобластном лейкозе с количеством бластных клеток 20–30%. (УД – А) [34]
Рефрактерные формы заболевания. Первично рефрактерные или резистентные формы ОМЛ, когда не удается достичь полной ремиссии (после 1 – 2 курсов интенсивной индукционной терапии) встречаются в 10% — 40% от общего числа пациентов. В настоящее время не определены высокоэффективные и стандартизованные режимы химиотерапии данных форм ОМЛ. В данных случаях необходимо оценить возможность проведения ТГСК, своевременное проведение HLA-типирования пациента, потенциальных доноров, оценить все характеристические показатели пациента, его возраст, общее состояние, наличие сопутствующих заболеваний, результаты цитогенетического, молекулярно-генетического исследования и предпочтения самого пациента. В качестве режима терапии применяется курс FLA-IDA, HAM. При условии наличия аллогенного донора, определяется стратегия терапии пациента в качестве «моста к трансплантации» с целью достижения ремиссии основного заболевания, так как наиболее значимым фактором перед проведением аллогенной ТГСК является статус заболевания. Достижение полной ремиссии после режима FLAG-IDA в 30 – 50% случаев с возможностью дальнейшего проведения ТГКСК по сравнению со стандартными режима индукции. [35]
Консолидация ремиссии.
Стратегия постремиссионной терапии включает в себя интенсивную и высокодозную терапию, за которой следуют преимущественно аллогенная или аутологичная трансплантация костного мозга [36].
Режимы консолидации включают в себя монотерапию цитарабином или многокомпонентную химиотерапию, которые приводят к одинаковым результатам.
После достижения полной ремиссии пациентам проводится консолидация с режимами, которые включают цитарабин в средней дозе. Введение до 3-х курсов высокодозного цитарабина (HiDAC; 2000-3000 мг/м2) широко применяется в рутинной клинической практике. В настоящее время отсутствуют убедительные доказательства более высокой эффективности высокодозного цитарабина 3000 мг/м2 по сравнению с цитарабином в промежуточной дозе 1000 – 1500 мг/м2 в монотерапии или в комбинации с антрациклинами. [37, 39] Также отсутствуют четкие данные о преимуществах усиленной консолидации у пациентов из группы высокого риска, особенно у пожилых пациентов. [38]
Более ранняя алло-ТКМ от совместимого донора, родственного или неродственного, в настоящее время является терапией выбора для пациентов из группы неблагоприятного риска в первой ремиссии. Проведение ТКМ позволяет статистически значимо улучшить долгосрочные результаты (общую и безрецидивную выживаемость).
Именно для пациентов группы высокого риска крайне важно соблюдать рекомендации по HLA-типированию пациента до начала первого индукционного курса, а после достижения первой полной ремиссии — начало поиска потенциальных доноров.
Оптимальными курсами консолидации у пациентов ОМЛ в возрасте моложе 60 лет после 1-2 курсов индукции являются 2 — 4 курса консолидации цитарабином (IDAC). [30, 31] Если по организационным причинам нет возможности выполнить консолидацию проведением курсов IDAC, как дополнительный вариант может рассматриваться выполнение еще двух курсов 7+3 с идарубицином или митоксантроном в индукционных дозах (УД – С).
Для пациентов с неблагоприятным риском в первой ремиссии необходима оценка МОБ для выбора тактики лечения консолидации. Пациенты с предполагаемым риском рецидива, превышающим 35-40%, консолидация с аллогенной ТКМ остается предпочтительным вариантом после ремиссии, сюда относятся также пациенты с ОМЛ неблагоприятного риска или с персистирующей МОБ. [40]
Таким образом, у пациентов из группы высокого и промежуточного риска при отсутствии возможности аллогенной трансплантации ГСК выполняется консолидация не менее, чем двумя курсами. В большинстве случаев, за исключением пациентов молодого возраста с нормальным кариотипом и без дополнительных молекулярных маркеров плохого прогноза могут использоваться режимы со стандартными дозами. [36]
Проведение постремиссионной терапии у пожилых пациентов определяется индивидуально в зависимости от общего состояния и коморбидного статуса и варьируется от аллогенной транспланатации ГСК с кондиционированием пониженной интенсивности до проведения паллиативной терапии или адекватного ухода без специфического лечения.
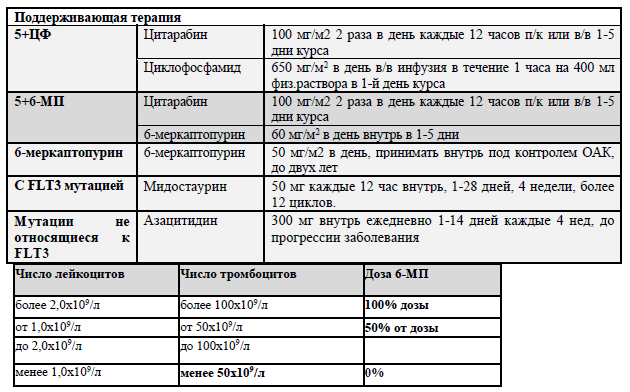
Поддерживающая терапия.
Поддерживающая терапия имеет значение у пациентов в возрасте старше 55-60 лет, которые не являются кандидатами на аллоТКМ и получают терапию низкой интенсивности и у пациентов с FLT3 позитивным ОМЛ, получающих терапию мидастаурином в случае, если аллоТКМ по каким-либо причинам не может быть выполнена.
Основной целью поддерживающей терапии является проведение минимально токсичной терапии, способной снизить риск развития рецидива. [42] Пероральный азацитидин рекомендуется в течение 14 дней в 28-дневных циклах после достижения ремиссии для снижения риска рецидива среди пациентов старше 55 лет не кандидатов на аллогенную ТКМ. [43] Пероральный азацитидин продлевает ОВ независимо от статуса МОБ. [44] Пероральный азацитидин одобрен для продолжения лечения пациентов с ОМЛ в первой полной ремиссии после интенсивной индукционной химиотерапии, которым невозможно проведение интенсивной терапии, в том числе аллогенной ТКМ.
Пациенты, получавшие мидостаурин во время индукции и консолидации, могут продолжать прием этих препаратов в соответствии с фазой 3. [45]
Пациенты, не подходящие для интенсивной терапии.
Существенный прогресс достигнут в лечении пациентов, признанных непригодными для интенсивной химиотерапии (пожилые или неподходящие для интенсивной терапии пациенты с ОМЛ). [46] По сравнению с одним азацитидином добавление ингибитора BCL2 венетоклакс улучшает клинический ответ. [47, 48] Для пациентов, которые не могут получать гипометилирующие агенты (HMA), низкие дозы цитарабина (LDC) в сочетании с венетоклаксом представляют собой альтернативный вариант лечения. У пациентов, получающих комбинированную терапию на основе гипометилирующих агентов с венетоклакс, ответ следует оценить в начале первого цикла (на 14-21 день) и необходимости перенести или изменить дозировку при стойкой цитопении в костном мозге. Вторая оценка обычно проводится после 3 циклов, а затем повторять каждые 3 цикла для пациентов в стадии ремиссии. [49]
Рецидив или рефрактерность.
Повторное молекулярное исследование очень важно при рецидиве для определения таргетных вариантов терапии. Пациенты, не достигшие ремиссии после 2 циклов индукции (включая не менее 1 цикла средние дозы цитарабина) определяются как первичный рефрактерный ОМЛ. Пациенты должны быть рассмотрены для аллогенной ТКМ. Факторы, связанные со снижением выживаемости при рецидиве ОМЛ, включают: более короткий период безрецидивной выживаемости (менее 6-12 месяцев), неблагоприятный кариотип риска при постановке диагноза, пожилой возраст (> 45-55 лет) или предшествующую ТКМ. Если проведение ТКМ не рассматривается (например, у пожилых пациентов), целесообразным контролем заболевания является использование неинтенсивного варианта, такого как гипометилирующие агенты в комбинации с венетоклаксом или без него. [53]
Аллогенная трансплантация гемопоэтических стволовых клеток.
ОМЛ является наиболее частым показанием для проведения аллогенной ТГСК, частота которой ежегодно в мире увеличивается на 10% [54, 55]. Немиелоаблативные режимы кондиционирования ил режимы кондиционирования со сниженной токсичностью (RIC) позволяют проводить аллогенную ТГСК пациентам в старшей возрастной группе. Тем не менее, только небольшому количеству пациентов с ОМЛ проводится ТГСК по причине более пожилого возраста пациентов, наличия сопутствующих заболеваний, токсичности предшествующей терапии, невозможности достижения полной ремиссии, раннего развития рецидива или рефрактерной формы лейкоза [56, 57]. Принятие решения по поводу проведения трансплантации зависит от оценки соотношения риска и пользы (например, соотношение риска смерти или осложнений, не связанных с рецидивом, к снижению риска рецидива), основанной на цитогенетических и молекулярно-генетических критериях заболевания, а также на соматическом статусе пациента, донора и других факторах предстоящей трансплантации. При остром миелобластном лейкозе с генетикой благоприятного риска проведение ТГСК в первой ремиссии не показано [58]. Как правило, ТГСК рекомендуется проводить, когда риск рецидива в случае не проведения ТГСК превышает 35 – 40%. В группе пациентов с генетикой неблагоприятного риска считается общепринятым, что трансплантацию необходимо проводить сразу после достижения полной ремиссии. [59]
Для пациентов с перстистирующей МОБ или с ранним появлением МОБ необходимо проведение терапии спасения с последующей ТГСК до развития гематологического рецидива. [60].
Прогноз у пациентов с морфологическим рецидивом в течение первых 12 месяцев после ТКМ плохой, хотя быстрое снижение иммуносупрессии или инфузия донорских лимфоцитов может помочь пациентам с ранним молекулярным или цитогенетическим рецидивом. Азацитидин с инфузией донорскими лимфоцитами или без них и режимы спасения на основе венетоклакса могут достичь ремиссии у небольшой части пациентов с меньшей токсичностью в сравнении с интенсивной химиотерапией. При достижении второй ПР рекомендуется рассмотреть инфузию донорских лимфоцитов или вторую аллогенную ТКМ. [61]
Терапевтическая тактика в ходе проведения индукционного лечения.
Первым курсом индукции должно быть 7-дневное введение цитарабина в дозе 100-200 мг/м2 либо 2 раза в сутки как короткая инфузия либо в виде непрерывной в/в инфузии в сочетании с 3-дневным введением антрациклинов (даунорубицина в дозе как минимум 60 мг/м2 или идарубицина или митоксантрона в дозе 12 мг/м2). Схема “7 + 3” в настоящее время является стандартом индукционной терапии. До начала терапии необходимо определить, может ли быть выполнена пациентам интенсивная индукционная химиотерапия. Несмотря на то, что оценка риска смертности, обусловленной интенсивной химиотерапией (TRM), наиболее актуальна для более пожилых пациентов (обычно старше 65 лет), однако возраст не должен быть решающим определителем при выборе интенсивности терапии [62]. Если после первой индукции на 14 или 21 день курса констатирована ремиссия, существует несколько подходов к постремиссионной терапии ОМЛ: выполнение ТКМ, традиционная консолидационная ХТ. Трансплантация аллогенного костного мозга или аллогенных гемопоэтических стволовых клеток (алло-ТКМ/алло-ТГСК) в постремиссионной терапии ассоциирована с самым низким риском развития рецидива. Если ремиссия не достигнута, то пациент ведется по программе «двойной индукции».
Снижение доз препаратов производят:
при почечной недостаточности;
при печеночной недостаточности.

Нарушения со стороны почек и печени необходимо принимать во внимание не изолированно, а в контексте с другими сопутствующими заболеваниями, при необходимости для снижения доз препаратов, но данные нарушения в чистом виде не должны считаться причиной отнесения пациентов к группе, которой не может быть выполнена интенсивная индукционная терапия. После завершения первого курса химиотерапии необходимо выполнение программы сопроводительной терапии.
Первая контрольная пункция костного мозга выполняется на 14 – 21 день от начала терапии первого индукционного курса (но не позже 21 дня) независимо от показателей периферической крови.
Ремиссия констатируется при наличии в пунктате костного мозга 5% и менее бластных клеток (при подсчете не менее чем на 200 клеток) при количестве нейтрофилов в периферической крови более 1,5 х109/л, при количестве тромбоцитов более или равном 100х109/л, при отсутствии экстрамедуллярных очагов лейкемического роста.
Если при исследовании костного мозга на 14 – 21 день после начала терапии, констатируется выраженная остаточная болезнь без гипоплазии костного мозга (гипоплазия определяется, когда количество клеток
Исключение: начало курса откладывается при некупирующихся инфекционных осложнениях (пневмонии, инвазивного аспергиллеза, диссеминированного кандидоза, сепсиса и т.д.), вопрос о пролонгировании перерыва после первой индукции решается индивидуально.
Максимальный срок удлинения межкурсового интервала после 7+3 в отсутствии бластоза составляет 35 дней. Обязательно выполняется вторая контрольная пункция уже после восстановления показателей.
Если цитопения после первого индукционного курса очень глубокая – число лейкоцитов 1,0х109/ л и менее сохраняется к 35 дню после курса, то рекомендуется выполнить повторную пункцию костного мозга с подсчетом миелограммы, оценить вероятность инфицирования вирусами (периферическая кровь и костный мозг на маркеры вирусов гепатитов, группы герпеса), выполнить трепанобиопсию (при возможности, следует выполнить и иммуногистохимическое исследование антигенов вирусов семейства герпеса и вирусов гепатитов в трепанобиоптате).
Если в трепанобиоптате на фоне глубокой цитопении продолжительностью более 35 дней выявляется нормоклеточный или гиперклеточный костный мозг независимо от процента бластных клеток в пунктате, то пациентам может быть начат второй курс индукции. Если в трепанобиоптате определяется значительная аплазия при отсутствии увеличенного процента бластных клеток в пунктате, то рекомендуется еще на неделю (+42 день после курса) отложить начало курса консолидации.
До начала второго курса индукции производят перерасчет доз цитостатических препаратов, поскольку высока вероятность того, что после первого курса вес пациента уменьшился, и общая поверхность тела изменилась.
Этот курс требует такого же выполнения алгоритмов сопроводительной терапии, что и первый индукционный (антиэметическая терапия, заместительная терапия компонентами крови, антибиотическая терапия при развитии инфекционных осложнений).
Если у пациента после второго курса индукции на 14 или 21 день в контрольном пунктате костного мозга определяется более 5% бластных клеток то констатируется резистентная форма острого лейкоза, и пациент переводиться на протоколы лечения рефрактерных ОМЛ.
При установлении диагноза ОМЛ всем пациентов и сибсам обязательно проведение HLA-типирования (среднее разрешение).
Терапевтическая тактика в ходе проведения консолидирующего лечения.
Обычный срок начала первого курса консолидации — 28-35 день второго курса индукции, максимальный — 42 дня. Максимальный срок определяется лишь наличием тяжелых инфекционных осложнений, не купированных в течение послекурсового периода.
Всем пациентам независимо от возраста целесообразно исследовать функциональное состояние сердечной мышцы (перед курсами консолидации и ТКМ обязательно). При обнаружении значительного снижения сократительной способности миокарда (фракция выброса менее 40%) или повышения концентрации предсердного натрий уретического пептида более 100 нг/мл целесообразна консультация кардиолога и выбор курсов без антрациклинов.

Современные антрациклины, применяемые в терапии ОМЛ, характеризуются различным диапазоном кумулятивных доз, приводящих к развитию кардиотоксичности:
Для проведения консолидации рекомендуются режимы, не содержащие антрациклины. Это связано с развитием токсических реакций, обусловленных миелотоксичностью, при применении антрациклинов в режимах консолидации [43].
Дозы цитостатических препаратов в курсах консолидации, включающих промежуточные дозы цитарабина, назначают соответственно площади поверхности тела пациента, определенной перед каждым курсом. [63]
Инфузия цитарабина при проведении курсов IDAC должна осуществляться в течение 3 часов. При избыточно коротком введении (до 1 часа) и очень длительном (круглосуточно) возможно развитие легочного дистресс-синдрома, связанного цитарабиновой эндотелиопатией. Премедикация перед введением цитарабина в высоких дозах проводиться дексаметазоном 4-8 мг в/в или метилпреднизолоном в перерасчете на дексаметазон. За 12 часов до начала курса IDAC пациенту назначаются глазные капли с кортикостеридами и проводится все 5 дней курса + первый день перерыва. Сопроводительная терапия осуществляется по тем же принципам, как и в период индукционного лечения.
Контрольную пункцию костного мозга после каждого курса консолидации производят:
1. После курса «IDAC» – на 28 день;
2. После других программ ПХТ – на 21 день.
Если после программ консолидации показатели периферической крови не восстанавливаются к 35 дню, то необходимо выполнить тот же алгоритм обследования пациента с цитопенией, который описан для индукционного курса.
Если пациент был отнесен к группе низкого риска, но после первого курса индукции, проведенного в полных дозах ремиссии не достигнуто, то пациента относят к группе высокого риска.
В дополнение к исходным факторам риска, оценка МОБ при ПР рекомендуется для пациентов с неблагоприятным риском в первой ремиссии для обоснования выбора консолидирующей терапии. Для пациентов с оценочным риском рецидива, превышающим 35-40%, консолидация с аллогенной HCT остается предпочтительным вариантом после ремиссии. [64] К ним относятся пациенты с ОМЛ с неблагоприятным риском или болезнью без неблагоприятного риска с персистенцией МОБ. [36]
Дальнейшее ведение.
Перерывы в терапии допустимы только в случаях инфекционных осложнений, в том числе фебрильной нейтропении, в случае отсутствия эффекта от стартовой антибактериальной терапии. Лейкопения (агранулоцитоз) и/или тромбоцитопения сами по себе не являются достаточным основанием для прерывания химиотерапии в периоде индукции. Если число лейкоцитов менее 1,0х10 9 /л, но отсутствуют инфекционные осложнения – терапия не прекращается.
Вакцинация против вирусных инфекций гриппа [65] и COVID-19 рекомендуется всем пациентам для снижения риска тяжелых инфекций.
Использование факторов роста обычно не рекомендуется, исключение только у отдельных пациентов (например, в случае тяжелых инфекций) или в определенных условиях лечения (например, для уменьшения времени гематологического восстановления в циклах консолидации). [66]
Новые агенты: тактика при нежелательных явлениях [47] 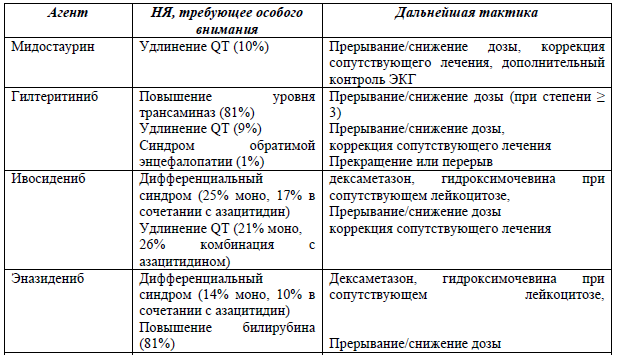

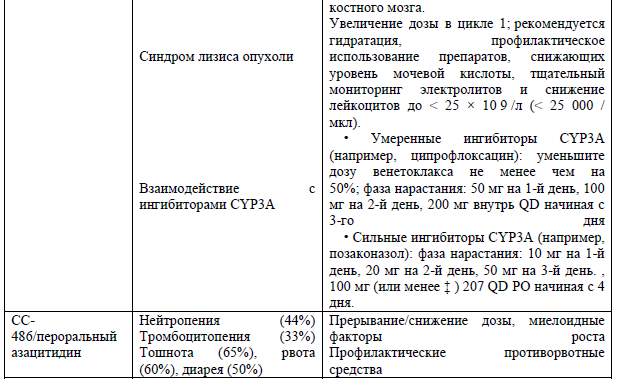
Особенности лечения у беременных.
При диагностике острого лейкоза в первый триместр беременности до начала химиотерапии рекомендуется обсудить вопрос о прерывании беременности. Химиотерапия в первом триместре беременности имеет 10-20% риск развития тяжелых аномалий развития [67]. Необходимо обсудить с пациентом все аргументы за и против искусственного прерывания беременности (УД — IIС). Химиотерапию у беременных рекомендуется начинать не раньше второго триместра (после 14-15 недель гестации), когда завершается формирование гемоплацентарного барьера [68]. Диагностика ОМЛ, начиная со II триместра и до 34 недель беременности, является показанием к проведению индукционной ХТ в полных дозах. Данная тактика направлена на наиболее быстрое достижение полной ремиссии ОЛ, так как родоразрешение, при возможности, должно выполняться на фоне ремиссии ОМЛ вне цитопении, что позволит сделать необходимый для восстановления после родов интервал между курсами цитоститической терапии как минимум 2-3 недели. При применении любых лекарственных препаратов во время беременности необходимо всегда оценивать соотношение риска и пользы (УД — IC). Препараты в высоких дозах, идарубицин, даунорубицин и липосомальный доксорубицин могут проникать через гемоплацентарный барьер и оказывать токсическое влияние на плод, в том числе влиять на функцию миокарда. При выборе антрациклиновых антибиотиков предпочтение скорее должно отдаваться даунорубицину, нежели идарубицину, учитывая его бóльшую липофильность, облегчающую его трансплацентарный транспорт. Кроме того, идарубицин обладает и бóльшей аффинностью к ДНК. В качестве индукционной химиотерапии предпочтительна стандартная комбинация даунорубицина и цитарабина (УД — IB). Расчет доз препаратов должен проводиться на основании фактической массы тела с учетом изменений массы тела во время беременности (УД — IC). При проведении сопроводительной терапии у беременных необходимо исключить использование фторхинолонов (риск развитии артропатии, нарушение остеогенеза), тетрациклинов, сульфаниламидов (дефекты нервной трубки, мальформация сердца) (УД — IB). Необходимости аборта в поздние сроки беременности (16—28 нед) нет, риск выполнения этой процедуры (малое кесарево сечение, искусственные роды) превышает риск проведения химиотерапии: вероятность массивного кровотечения, наличие очага инфекции, затягивание начала индукционного курса, возможность гибели плода. При выявлении ОМЛ на сроке беременности более 34 недель целесообразно выполнить родоразрешение с последующим проведением индукционной ПХТ (УД — IIC). Терапевтическая тактика при ОМЛ определяется необходимостью в срочном начале лечения после оценки гематологического статуса, прогнозом заболевания, риском химиотерапии для плода, риском прерывания беременности или её сохранения. Современные методы лечения позволяют женщинам во время беременности проходить химиотерапию и рожать абсолютно здоровых детей. Шансы на успешное лечение и выживаемость, абсолютно такие же, как и у всех остальных пациентов. Беременность не влияет на исход болезни, если лечение проводится в полной мере и вовремя [69].
Трансфузионная поддержка.
Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения.
Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходимости профилактичесиких трансфузий концентрата тромбоцитов.
Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней.
Эритроцитарная масса/взвесь:
• Уровень гемоглобина не нужно повышать, пока обычные резервы и компенсационные механизмы достаточны для удовлетворения потребностей тканей в кислороде;
• Существует только одно показание для трансфузий эритроцитсодержащих сред при хронических анемиях – симптомная анемия (проявляющаяся тахикардией, одышкой, стенокардией, синкопе, de novo депрессией или элевацией ST);
• Уровень гемоглобина менее 30 г/л является абсолютным показанием для трансфузии эритроцитов;
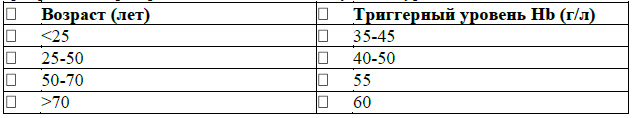
• При отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях могут быть уровни гемоглобина:
Концентрат тромбоцитов:
• При снижении уровня тромбоцитов менее 10 х109/л или появлении геморрагических высыпаний на коже (петехии, синячки) проводится профилактическая трансфузия аферезных тромбоцитов;
• Профилактическая трансфузия аферезных тромбоцитов у пациентов с лихорадкой, пациентам, которым планируется инвазивное вмешательство может проводится при более высоком уровне – 20 х109/л;
• При наличии геморрагического синдрома петехиально-пятнистого типа (носовые, десневые кровотечения, мено-, метроррагии, кровотечения других локализаций) трансфузия концентрата тромбоцитов проводится с лечебной целью.
Свежезамороженная плазма:
• Трансфузии СЗП проводятся у пациентов с кровотечением или перед проведением инвазивных вмешательств;
• Пациенты с МНО ≥2.0 (при нейрохирургических вмешательствах ≥1.5) рассматриваются как кандидаты для трансфузии СЗП при планировании инвазивных процедур. При плановых вмешательствах возможно назначение не менее, чем за 3 дня до вмешательства фитоменадиона не менее 30 мг/сут внутривенно или внутрь.
Немедикаментозное лечение:
Режим: общеохранительный
Диета: стол №15 (общая).
Лучевая терапия. Если вследствие осложнений или технических трудностей не представляется возможным провести полную программу профилактики нейролейкемии интратекальными введениями цитостатических препаратов, то пациентам рекомендуется выполнить краниальное облучение в дозе 24 Гр.
Медикаментозное лечение:

Программы индукционной, консолидирующей терапии (ECOG 0-2; CCI 0-2; 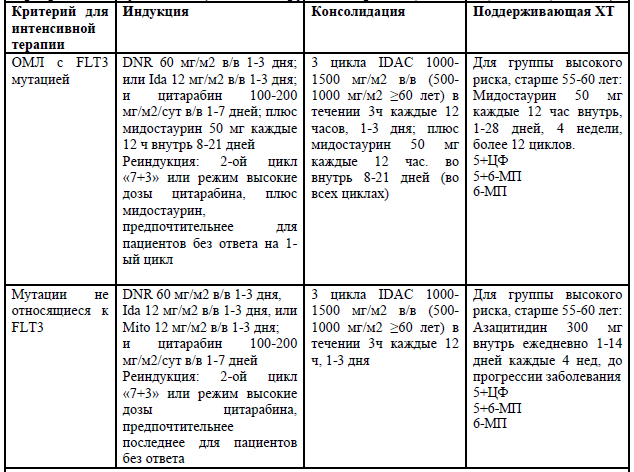


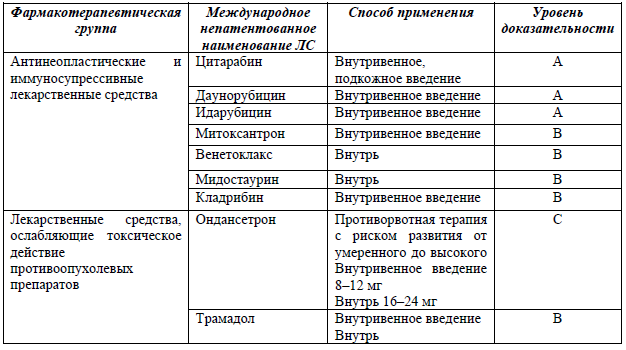
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство при развитии инфекционных осложнений пациентам могут также проводиться вмешательства, направленные на дренирование/устранение инфекционного очага.
Иссечение анальной трещины (острой/хронической) — по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
Удаление геморроидальных узлов (геморроидэктомия) — по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
Вскрытие парапроктита/инфильтрата — по показаниям в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
Выведение стомы кишечника — по показаниям (при острой и хронической анальной трещины) в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
Плевральная пункция — по показаниям при гидротораксе плеврите.
Лапароцентез — по показаниям при асците.
Основным противопоказанием к хирургическим вмешательствам является не купируемый геморрагический синдром
Источник https://meduniver.com/Medical/onkologia/ostraia_mieloidnaia_leikemia.html
Источник https://openclinics.ru/bolezni/leykoz/ostryy-mieloblastnyy-leykoz-mieloidnyy/
Источник https://diseases.medelement.com/disease/%D0%BE%D1%81%D1%82%D1%80%D1%8B%D0%B9-%D0%BC%D0%B8%D0%B5%D0%BB%D0%BE%D0%B1%D0%BB%D0%B0%D1%81%D1%82%D0%BD%D1%8B%D0%B9-%D0%BB%D0%B5%D0%B9%D0%BA%D0%BE%D0%B7-%D1%83-%D0%B2%D0%B7%D1%80%D0%BE%D1%81%D0%BB%D1%8B%D1%85-%D0%BA%D0%BF-%D1%80%D0%BA-2022/17552