Гепатит С. Рекомендации ВОЗ 2016 года

Гепатит С – антропонозное инфекционное заболевание вирусной природы, которое возникает в результате проникновения в организм человека вируса гепатита С (ВГС), передающегося от человека к человеку через заражённую вирусными частицами кровь, и протекает в виде острого или хронического гепатита. Своим часто встречаемым эпитетом «ласковый убийца», гепатит С, обязан бессимптомному течению заболевания на протяжении многих лет. Но, в большинстве случаев, хроническая инфекция приводит к угрожающим жизни состояниям (цирроз, рак, варикозное расширение вен пищевода и желудка), и становится одной из основных причин, по которым в настоящее время проводят трансплантации печени.
ВГС — возбудитель одного из пяти вирусных гепатитов (A,В,C.D.E), был открыт в 1989 году, благодаря внедрению в практику лабораторной диагностики высокотехнологичных методов молекулярной биологии. Генетическая информация вируса содержится в РНК. Вариабельность структуры вирусной РНК обусловливает разнообразие генотипов вируса и высокий мутагенный потенциал ВГС. Генотипирование вируса в дебюте диагностики и в процессе лечения играет решающую роль в выборе противовирусных препаратов прямого действия и определении длительности терапии. Выделяют 6 генотипов ВГС, в каждом из которых существуют несколько субтипов, с географическими особенностями генотипического превалирования, что, безусловно осложняет проблему создания вакцины и возможности пан-генотипической терапии. Частота встречаемости различных генотипов ВГС в мире представлена на диаграмме 1.
Частота встречаемости различных генотипов ВГС в мире
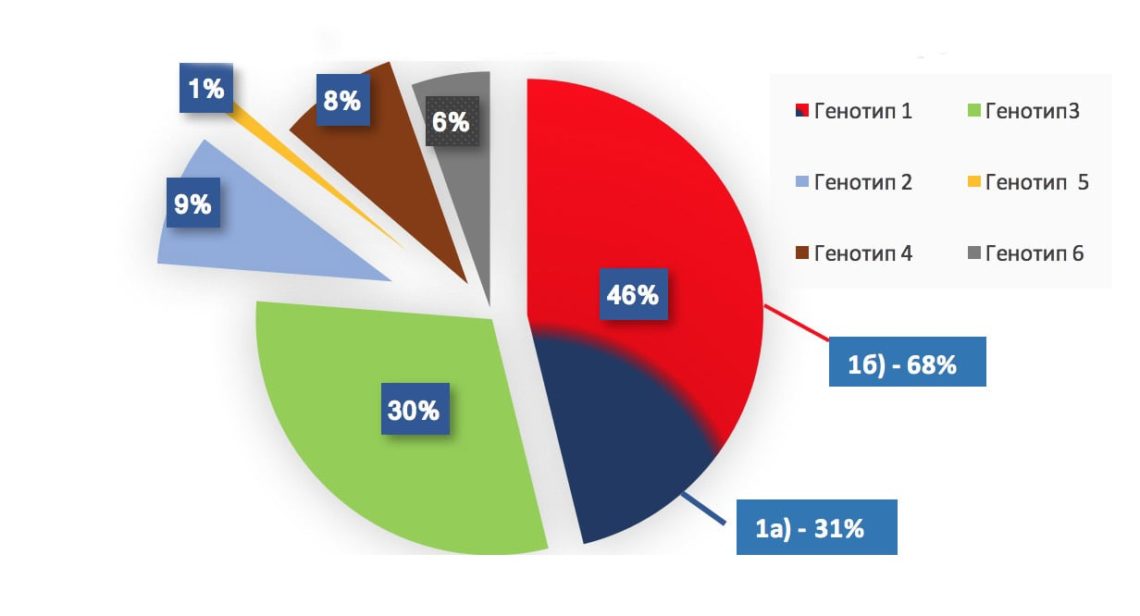
Распространённость различных генотипов ВГС
Генотипы 1 (субтип 1б) и 3 является наиболее распространёнными. Их выявляют в 46,2% и 31% всех случаев гепатита С соответственно. В РБ основная доля ВГС-инфекции вызвана генотипом 1 (> 75% всех случаев). Эпидемиологические данные свидетельствуют, что глобальное распространение генотипа 1 началось из регионов западной Африки и Юго-Восточной Азии после первой мировой войны и существенно возросло после второй мировой, что связывают с широким использованием крови и компонентов, инфекционную безопасность которых в годы военных баталий не контролировали. (Nokano T., 2004), (Holmes EC., 2008).
Распространённость различных генотипов ВГС в РБ

Jane P. Messina et al. (2015)
В соответствии с рекомендациями ВОЗ 2016 года, 90% эррадикация генотипа 1 ВГС достигается терапевтическими схемами, включающими исключительно противовирусные препараты прямого действия второго поколения. Генотип 3 ВГС, ответственный за треть всех случаев хронической инфекции в мире, отличается устойчивостью к противовирусным препаратам первого поколения и слабым ответом на противовирусные препараты прямого действия второго поколения в сравнении с другими генотипами. Стратификация генотипа ВГС на популяционном и регионарном уровнях чрезвычайно важна для выбора оптимальной терапевтической стратегии и разработки вакцины. Генетическая вариабельность ВГС в рамках отдельных популяций является основной причиной затруднений в создании вакцины против вируса гепатита С.
Медицинское сообщество во всех странах обеспокоено глобальным ростом заболеваемости и смертности от вирусного гепатита С (ВГС). По данным специалистов ВОЗ 2016 года, в мире более 185 миллионов человек болеют хронической инфекцией ВГС, и более 700 000 человек ежегодно погибают от ВГС-ассоциированных осложнений, основными из которых являются цирроз и гепатоцеллюлярной карцинома. Ежегодно в мире регистрируют около 4 миллионов новых случаев инфицирования. В целом, по оценкам ВОЗ, около 3% населения планеты инфицированы вирусом гепатита С (Shepard CW., 2005). Вирус передаётся парентерально, главным образом, при выполнении лечебно-диагностических процедур (ятрогенный путь передачи) и среди лиц, злоупотребляющих инъекционными наркотическими препаратами. Различным генотипам вируса свойственен свой преимущественный путь передачи: так для генотипов 1б и 2 более характерно ятрогенное парентеральное инфицирование, а для 1а и 3а чаще передаются при употреблении инъекционных наркотических препаратов (Shepard CW., 2005). Несмотря на высокую распространённость инфекции, большинство пациентов не подозревают о своём заболевании. Вследствие высокой стоимости лечения, значительная часть инфицированных остаётся без необходимых средств терапии. При этом, современные подходы к терапии гепатита С обеспечивают полное выздоровление и предупреждают развитие таких грозных исходов хронической инфекции, как цирроз и рак печени.
Первая редакция рекомендаций ВОЗ 2014 года и последняя 2016 года, относительно трансмиссивных инфекций, являются основными документами, регламентирующим стратегии скрининга, диагностики и лечения пациентов с гепатитом С. Последние годы ознаменованы выдающимися успехами в области создания высокоэффективных противовирусных препаратов прямого действия, обеспечивающих полное излечение и выздоровление от гепатита С. Эволюция фармакологических средств позволяет добиться полного излечения более, чем 90% пациентов от всех, известных ныне генотипов, которые прежде были абсолютно инкурабельны. Современная схема терапии гепатита С включает в себя комплекс препаратов: пегелированный и стандартный интерферон, рибавирин, ингибиторы протеаз (симепревир), NS5B ингибитор нуклеотид полимеразы – софосбувир и арсенал высокоэффективных противовирусных препаратов прямого действия второго поколения, которые дают меньше побочных эффектов и позволяют сократить продолжительность терапии (даклатасвир, ледипасвир, омбитасвир). Ожидается, что в ближайшие несколько лет, будут лицензированы ещё несколько высокоэффективных противовирусных препаратов. В представляемой редакции ВОЗ 2016 года, предложены схемы терапии, наиболее эффективные для лечения различных генотипов вируса С и в зависимости от наличия клинических признаков цирроза печени (Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. 2016. WHO). По мере поступления новых препаратов, рекомендации ВОЗ в области лечебных подходов будут непрерывно обновляться.
В основу разработанных алгоритмов скрининга, диагностики и лечения инфекции гепатита С, положен метод GRADE (Grading of Recomendations Assessment, Development and Evaluation), предоставляющий получение заключений доказательной медицины с различным уровнем доказательности и силой рекомендаций. Финальные документы, регламентирующие подходы к тактике ведения HCV инфицированных, были впервые созданы по результатам консенсуса рабочей группы специалистов в июне 2013 года. Ко времени созыва этой рабочей группы, в США в лечебные протоколы уже были включены два новых противовирусных препарата (симепревир и софосбувир), которые было решено так же включить и в рекомендации ВОЗ 2014 года по тактике лечения пациентов с гепатитом С.
Рекомендации по скринингу HCV инфекции
- Идентификация пациентов с HCV инфекцией.
С этой целью используют серологический тест определения общих антител к вирусу гепатита С (anti-HCV total) (сильные рекомендации, средний уровень доказательности);
- Подтверждение хронической HCV инфекции.
Позитивный серологический тест является основанием для проведения молекулярной диагностики с целью выявления вирусной РНК для установления наличия хронической HCV инфекции (условные рекомендации, низкий уровень доказательности).
Рекомендации по ведению пациентов с хронической HCV инфекцией
- Скрининг на применение алкоголя и снижение приема, вплоть до полного отказа.
Для всех пациентов с хронической HCV инфекцией необходимо рекомендовать полный отказ от использования алкогольных напитков (сильные рекомендации, средний уровень доказательности).
- Оценка степени фиброза или цирроза печени.
С этой целью специалисты ВОЗ рекомендуют использовать индексы APRI или FIB4, которые менее затратны среди прочих неинвазивных методов диагностики фиброза и цирроза печени, включая эластографию и Фибротест (условные рекомендации, слабый уровень доказательности).
Рекомендации по лечению пациентов с HCV инфекцией (2016 год)
- Все пациенты (взрослые и дети) с хронической HCV инфекцией должны получать противовирусные препараты (сильные рекомендации, средний уровень доказательности);
- Лечение противовирусными препаратами прямого действия.
Для лечения гепатита С, вызванного различными генотипами вируса, предпочтительными схемами терапии являются комбинации противовирусных препаратов прямого действия, которые являются более эффективными в сравнении с пегилированным интерфероном и рибавирином. (Сильные рекомендации, высокий уровень доказательности).
Для лечения хронической инфекции, вызванной генотипом 3 вируса гепатита С, осложнённой циррозом, и генотипов 5 и 6, вне зависимости от наличия признаков цирроза, рекомендуют комбинацию софосбувира с пегилированныи интерфероном и рибавирином, как альтернативную схему терапии. (Сильные рекомендации, высокий уровень доказательности);
- В рекомендациях ВОЗ 2016 для лечения пациентов с хронической инфекцией гепатита С отменено использование боцепревира и телапревира. (Сильные рекомендации, средний уровень доказательности).
- Лечение пациентов с генотипом 1а. Семипревир назначают в комбинации с софосбувиром в течение 24 недель или с добавлением рибавирина в течение 12 недель для лечения пациентов с генотипом 1а без Q80K полиморфизма. Схема терапии, включающая омбитасвир, паритапревир, ритонавир и дасабувир назначается на 24 недели. (Сильная рекомендация, высокий уровень доказательности).
- Лечение пациентов с генотипом 1б. Схема терапии, включающая омбитасвир, паритапревир, ритонавир и дасабувир назначается на 12 недель.
- Лечение пациентов с генотипами 2 и 3. Предпочтительными схемами терапии для пациентов с генотипами 2 и 3, вне зависимости от наличия цирроза, являются комбинации софосбувира с пегилированным интерфероном и рибавирином в течение 12 недель.
Оптимальные, схемы терапии в зависимости от генотипа вируса гепатита С и наличия цирроза представлены в таблицах 1 и 2 (Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. 2016. WHO).
Схемы терапии гепатита С для пациентов без цирроза.
| Генотип | Даклатасвир/софосбувир | Ледипасвир/софосбувир | Софосбувир/рибавирин |
|---|---|---|---|
| 1 | 12 недель | 12 недель | |
| 2 | 12 недель | ||
| 3 | 12 недель | 24 недель | |
| 4 | 12 недель | 12 недель | |
| 5 | 12 недель | ||
| 6 | 12 недель |
Схемы терапии гепатита С для пациентов с циррозом.
| Генотип | Даклатасвир/софосбувир | Даклатасвир/софосбувир/рибавирин | Ледипасвир/софосбувир | Ледипасвир/софосбувир/рибавирин | Софосбувир/рибавирин |
|---|---|---|---|---|---|
| 1 | 24 недели | 12 недели | 24 недели | 12 недели | |
| 2 | 16 недели | ||||
| 3 | 24 недели | ||||
| 4 | 24 недели | 12 недели | 24 недели | 12 недели | |
| 5 | 24 недели | 12 недели | |||
| 6 | 24 недели | 12 недели |
Маркёры HCV инфекции
Существуют два типа лабораторных тестов для диагностики и мониторинга HCV-инфекции: непрямой серологический тест определения общих антител к гепатиту С и прямые тесты, которые позволяют определить вирусную РНК и ядерный антиген. Таким образом, общие анти-HCV антитела, ядерный антиген, HCV РНК и HCV генотип – это полный арсенал лабораторных тестов, позволяющих определить наличие острой или хронической HCV-инфекции и назначить соответствующий генотипу вируса протокол лечения.
HCV РНК – это прямой маркёр виремии. В периферической крови вирусную РНК можно определить уже через 1-2 недели после предполагаемого инфицирования. Инкубационный период составляет 4-7 недель. В острую фазу заболевания, т.е. в период клинических проявлений значения вирусной РНК достигают максимальных пиковых значений. В течение хронической инфекции наступает период стабилизации показателей HCV РНК, которые выходят на определённое плато (Nguyen TT,1996). Количество вирусной РНК не коррелирует с выраженностью клинико-лабораторных проявлений поражения печени (Duvoux C.,1999).
Диагностика
Острый гепатит С
С целью скрининга и при подозрении на наличие острой или хронической HCV инфекции показано определение общих антител к HCV (Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. 2016. WHO).
Специфические общие анти-HCV антитела определяются, как правило, на 7-8 неделе, после предполагаемого инфицирования (Hino K.,1994). С этой целью, в настоящее время используют тест-системы третьего поколения, определяющие антитела к ядерному антигену, а также к NS3, NS4, NS5 со специфичностью выше 99%. Обнаружение общих антител к HCV требует проведения высокочувствительного молекулярного теста с нижним лимитом определения не выше 50 МЕ/мл, для выявления вирусной РНК и установления, тем самым, наличия виремии, острой или хронической инфекции, а также для мониторинга эффективности терапии (EASL International Consensus Conference on Hepatitis C, 1999). HCV РНК обнаруживают через 1-2 недели после инфицирования. Наличие вирусной РНК при отсутствии общих антител к HCV может быть в начале острого периода заболевания, что подтверждается последующей сероконверсией. С другой стороны, серопозитивность при отсутствии вирусной РНК является неоспоримым доказательством отсутствия заболевания. В такой ситуации можно предполагать, что произошла самоэлиминация вируса, которую отмечают в 15-45% случаев. Однако, ПЦР следует повторить через несколько недель, поскольку перед формированием хронической стадии инфекции, возможно временное «исчезновение» вирусной РНК (Jean-Michel Pawlotsky, 2004).
Хронический гепатит С
Если в течение 6 месяцев не произошло самоэлиминации вируса и при наличии положительных тестов на общие антитела и вирусную РНК, констатируют хроническую HCV инфекцию, которую обнаруживают либо по результатам рутинного скринингового обследования, либо диагностического, при наличии жалоб и клинической картины, которая складывается из симптомов поражения печени и внепечёночных проявлений. Более чем у 70% больных гепатит С протекает с наличием одного из многих экстрапечёночных клинических симптомов хронической HCV инфекции, наиболее частыми из которых, являются артралгии, системные васкулиты, артериальная гипертензия, пурпура, сопровождающиеся криоглобулинемией, а также повышением антиядерных антител и антител к гладкой мускулатуре (MULTIVIRC GROUP, 1999). Мультивариантный анализ показал, что основными факторами риска, с которыми ассоциируются эксрапечёночные проявляния хронической HCV инфекции, являются возраст, женский пол и выраженный фиброз печени (MULTIVIRC GROUP, 1999).
Отсутствие общих антител к HCV с доказанной виремией невозможно у иммунокомпетентных пациентов. Такое возможно только если пациент находится на гемодиализе, либо при глубокой иммуносупрессии (Pawlotsky JM.,1998), (Thio CL., 2000).
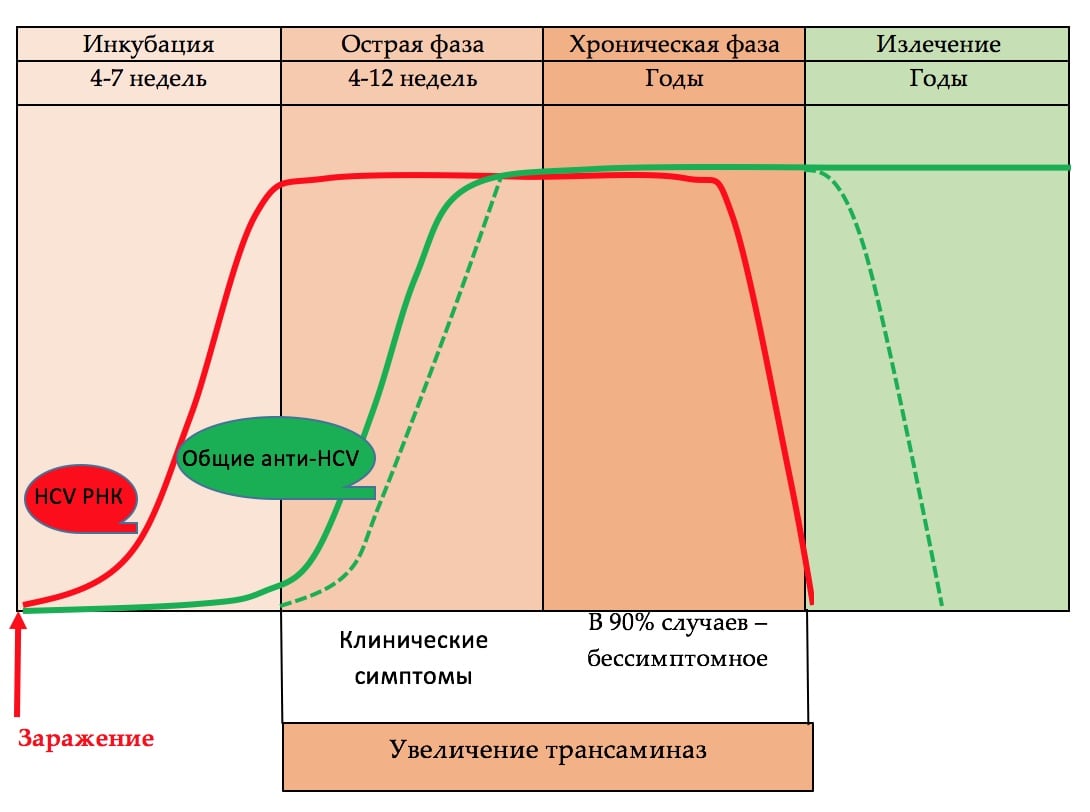
Динамика маркёров HCV инфекции в различные фазы заболевания
Вертикальный путь передачи вируса гепатита С
Диагностика внутриутробного заражения вирусом гепатита С основана на выявлении вирусной РНК методом высокочувствительной ПЦР. Трансплацентарный перенос материнских антител, которые могут персистировать у ребёнка в течение года после рождения, делает нецелесообразным использование серологического теста для диагностики вирусной инфекции в этот период (Ohto H., 1994). Хотя вирусную РНК можно выявить уже через несколько дней после рождения, оптимальным возрастом ребёнка для проведения тестирования методом ПЦР считают 6-12 месяцев. Высокие титры анти-HCV антител, определяемые через год после рождения, и положительный тест на HCV РНК позволяют констатировать внутриутробное заражение вирусом гепатита С (Ohto H., 1994).
В группу риска развития HCV инфекции входят следующие категории населения:
- пациенты, которым проводили переливание инфицированной крови и компонентов, в условиях не соблюдения требований, предъявляемых к гемотрансфузиям;
- пациенты на гемодиализе;
- люди, употребляющие инъекционные и интраназальные наркотики;
- люди с татуировками и пирсингом;
- гомосексуалы;
- дети, рождённые от инфицированных матерей.
ВОЗ рекомендует проведение скринингового серологического тестирования в популяциях с высоким уровнем серопозитивности, либо при наличии в анамнезе указанных факторов риска. В странах с неудовлетворительным инфекционным контролем и высоким уровнем серопозитивности, ВОЗ рекомендует проводить скрининговое обследование всем без исключения жителям. Пациенты, которые входят в группы риска, потенциально могут быть подвержены риску развития других трансмиссивных инфекций, таких как, гепатит В, ВИЧ, что требует обязательного тестирования на эти инфекции пациентов с доказанной хронической HCV инфекцией.
Тактика медицинского наблюдения за пациентами с хронической HCV инфекцией.
Между инфицированием и клиническими проявлениями HCV-ассоциированными поражениями печени могут пройти многие годы. В течение этого времени важно отслеживать развитие патологии печени и других проявлений HCV инфекции, таких как инсулинорезистентность и диабет. На прогноз хронической инфекции существенное влияние оказывает наличие ко-морбитных состояний, таких как высокий индекс массы тела, курение, приём алкоголя, ко-инфекция, а также следует избегать возможности реинфекции. Поскольку алкоголь существенно ускоряет развитие цирроза печени, ВОЗ рекомендует для пациентов с хронической инфекцией полностью отказаться от приёма алкогольных напитков. Для эффективного контроля полного отказа от вредных привычек, специалисты ВОЗ рекомендуют использовать комплексное обследование ASSIST (Alcohol, Smoking and Substance Involvement Screening Test). В тех странах, где основным фактором заражения гепатитом С является использование инъекционных наркотиков, ВОЗ настоятельно рекомендует специальную обширную программу, предусматривающую оказание медицинской помощи пациентам с наркотической зависимостью.
Оценка наличия и степени фиброза печени.
Принятие решения о начале специфической противовирусной терапии, зависит от характера поражения печени. Долгие годы биопсия печени была “золотым стандартом” диагностики степени фиброза и цирроза. Однако, этот метод дорогой, требует гистологической интерпретации, при которой частота расхождений в оценке тканевых изменений колеблется от 10% до 20%, и как все инвазивный методы, сопровождается угрожающими жизни осложнениями, основным из которых является кровотечение (Bedossa P., 1994). Кроме того, объём биопсийного материала составляет приблизительно 1/50000 часть от общего объёма печени, что может быть одной из причин ложноотрицательных заключений биопсии (Regev A.,2002). Для корректной оценки диффузных изменений в печени необходим образец размером не менее 25 мм, что позволяет поставить точный диагноз по шкале (METAVIR) в 75% случаев (Bedossa P., 2003). В последние годы широкое применение в практике получили неинвазивные методы оценки фиброза с использованием эластометрии и, основанных на математическом анализе, комплексов лабораторных показателей, получивших название фибротестов. Как биохимические (фибротесты), так и морфологические (эластометрия) неинвазивные методы диагностики фиброза печени, в большинстве случаев являются несомненной альтернативой трудоёмкой и небезопасной биопсии.
В настоящее время существует большое количество фибротестов, отличающихся, главными образом, по составу биохимических показателей, по сложности математического алгоритма расчётов, и, следовательно, по стоимости. Как правило, они просты, легко воспроизводимы, недороги и позволяют провести расчёты индекса, указывающего на угрозу развития печёночных осложнений непосредственно на приёме у врача. Большинство фибротестов, широко используемых в настоящее время в клинической практике, характеризуются достаточно высоким позитивным предиктивным уровнем особенно для диагностики выраженного фиброза, соответствующего стадиям по шкале METAVIR F3-F4, а также цирроза (Anais Vallet-Pichard, 2007). Принимая во внимание соотношение цены и информативности неивазивных тестов, рабочей группой специалистов ВОЗ по менеджменту пациентов с хронической инфекцией гепатита С рекомендовано, в качестве фибротестов использовать APRI и FIB4 (Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. 2016. WHO). Последние два десятилетия ознаменованы значительным количеством работ, посвящённых изучению различных рутинных лабораторных тестов, которые с высокой диагностической точностью могли бы указывать на развитие фиброза и цирроза печени при хронической инфекции гепатита С и избежать необходимости проведения биопсии(Pohl A., 2001), (Poynard T., 1997), (Chun-Tao Wai, 2003). Chun-Tao Wai с коллегами в мультивариантном анализе комплекса показателей 270 пациентов с хронической инфекцией гепатита С, показали, что количество тромбоцитов и уровень АСАТ являются наиболее информативными показателями угрозы развития как фиброза так и цирроза печени. Прогрессия фиброза печени при хронической HCV инфекции, приводит к нарастанию портальной гипертензии, увеличению селезёнки и проявлению симптомокомплекса гиперспленизма, одним из значимых проявлений которого является повышенные секвестрация и разрушение тромбоцитов (Aster R.,1996). Развитие фиброза печени приводит также к снижению продукции гепатоцитами тромбопоэтина, что существенно подавляет продукцию тромбоцитов в костном мозге (Kawasaki T., 1999). Фиброз замедляет клиренс АСАТ и приводит к поражению митохондрий, что увеличивает сывороточные значения фермента и соотношение АСАТ/АЛАТ (Okuda M.,2002). Показатели эффективности (AUC) определения числа тромбоцитов и АСАТ составили 0.87 и 0.93 соответственно, что свидетельствует о достаточно высоких значениях чувствительности и специфичности этих тестов в прогнозе вероятности развития как фиброза, так и цирроза печени (Chun-Tao Wai, 2003). При этом, выраженность фиброза достоверно возрастала по мере увеличения АСАТ и снижения числа тромбоцитов. Авторы работы впервые предложили простую, единую для вычисления риска развития как фиброза, так и цирроза, формулу индекса, учитывающего значения АСАТ и числа тромбоцитов, и назвали его APRI (AST to platelet ratio index).
APRI = АСАТ (МЕ/л)/АСАТ (верхнее значение референтного интервала) (МЕ/л) / Число тромбоцитов (109/л) * 100
При этом индекс APRI более выраженно коррелирует со стадией фиброза и цирроза, чем показатели АСАТ и числа тромбоцитов, взятые в отдельности. AUC APRI для фиброза и цирроза составил 0.88 и 0.94 соответственно. По данным различных авторов, добавление различных показателей в фибротестах не сказывается на точности прогноза фиброза. Так, индекс фиброза от MULTIVIRC GROUP включает комбинацию 6 маркёров (α2 макроглобулин, гаптоглобин, γ-ГТП, γ-глобулин, Апо-А1, общий билирубин) и позволяет прогнозировать развитие фиброза с AUC 0.84 (Imbert-Bismut F.,2001).
На основании характеристических кривых (ROC), построенных для оценки предиктивной ценности индекса APRI в оценке развития фиброза, были выбраны 2 cut-off точки, в качестве пороговых значений индекса, позволяющих с высокой долей вероятности предсказать отсутствие или наличие фиброза у пациента с хронической HCV инфекцией: при значениях APRI – развитие фиброза маловероятно, а значения APRI > 1.50 указывают на высокую вероятность развития фиброза. Аналогичные 2 cut-off точки для отрицательного и положительного предиктивного уровня APRI были выбраны для оценки развития цирроза. Отрицательное предиктивное значение APRI для развития цирроза составляет 98% при его значениях 2.0. Исследования показали, что при использовании cut-off значений APRI 1.00 и 2.00, отсутствие или наличие цирроза может быть достоверно установлено у 81% пациентов (Chun-Tao Wai, 2003). В мета-анализе 40 исследований, посвящённых эффективности использования APRI в идентификации пациентов с угрозой развития цирроза при хронической HCV инфекции, было установлено, что чувствительность и специфичность значений индекса APRI >1.0 составляют соответственно 76% и 72%. Использование cut-off значения APRI >2.0, позволяет повысить чувствительность до 91%, но при этом специфичность составляет 46% (Lin ZH.,2011).
В таблице 3 представлены значения APRI, при которых с достаточно высокой точностью можно предполагать развитие фиброза и цирроза печени при хронической HCV инфекции.
| APRI | Результат | ОПЗ | ППЗ |
|---|---|---|---|
| Фиброз 1,5 | Отрицательно Положительно | 86% | 88% |
| Цирроз 2,0 | Отрицательно Положительно | 98% | 57% |
ОПЗ – отрицательное предиктивное значение;
ППЗ – положительное предиктивное значение.
Индекс FIB4 включает в себя четыре показателя: возраст, АСАТ, АЛАТ и число тромбоцитов. Расчёт проводят по следующей формуле:
Индекс FIB4 = Возраст (годы) * АСАТ (МЕ/л) / Число тромбоцитов (109/л) * √АЛАТ(МЕ/л)
Для индекса Fib4 выбрана сut-off точка 1.45, ниже которой, отрицательное предиктивное значение Fib-4 составляет 90% для выраженного фиброза (F3-F4). Вторая cut-off точка -3.25, выше которой, позитивное предиктивное значение индекса составляет 65%. Точность Fib-4 в диапазонах 3.25 такова, что она позволяет в 87% случаев избежать биопсии печени (Sterling RK.,2006). Сравнение эффективности использования Fib4 с результатами биопсии и Fibro-Test показало конкордантность диагностики фиброза различной степени выраженности с использованием данных подходов. В таблице 4 представлены результаты сравнения индекса Fib-4 и FibroTest (Anais Valet-Pichard, 2007).
Сравнение результатов диагностики фиброза различной степени выраженности с использованием Fib-4 и FibroTest.
| Fib4 | FibroTest (METAVIR) | |
|---|---|---|
| F0-F1-F2 | F3-F4 | |
| 92.1% (n=409) | 7,9% (n=35) | |
| 1.45-3.25 | 62.2% (n=178) | 37,8% (n=108) |
| >3.25 | 24% (n=12) | 76% (n=38) |
Таким образом, использование только Fib4 позволяет корректно определить выраженность фиброза у пациентов с хронической HCV инфекцией и избежать в 70% случаев проведения биопсии (Anais Valet-Pichard, 2007). Значения AUC характеристической кривой, описывающей диагностическую точность анализа Fib4 для выраженного фиброза (>=F3) составляет 0.85, что абсолютно сопоставимо с данными по APRI, FibroTest и FibroScan, AUC которых составляет 0,84, 0,90 и 0,90 соответственно (Castera L., 200
При выборе тактики лечения, степень выраженности фиброза имеет одно из ключевых значений. Всегда следует придерживаться баланса “польза-вред” проводимой терапии: с одной стороны — снижение риска развития цирроза и гепатоцеллюлярной карциномы, с другой- гепатотоксичность препаратов и стоимость лечения. Иными словами, пациенты, у которых по шкале METAVIR определён фиброз F3 и F4, получают специфическую терапию в первую очередь. При наличии соответствующих ресурсов можно начинать терапию при менее выраженном фиброзе, соответственно на стадиях F1 и F2.
В настоящее время специалистами ВОЗ, для оценки риска развития фиброза и цирроза, рекомендовано использование APRI и FIB4 в комплексе с эластометрией (Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. 2016. WHO).
Вирусный гепатит С: группы риска и лечение
По данным Всемирной организации здравоохранения, гепатитом С (ВГС, HCV) страдают более 70 000 000 людей во всем мире. Более того, врачи отмечают, что поскольку болезнь часто диагностируется с опозданием, уже на стадии осложнений, количество инфицированных может быть значительно больше. MedAboutMe разбирался, чем же опасен вирусный гепатит С, почему порой так сложно его выявить и что делать, если инфекция обнаружена.

Уход за кожей: скрабы для тела и гели для душа
Эффективные продукты для поверхностного и глубокого очищения кожи тела.
Вирус гепатита С и воспаление печени
Вирусные гепатиты – это воспаление печени, вызванное вирусами. Исследователи выделяют пять основных видов инфекции: А, В, С, D и E. А и Е чаще всего переносятся легко и не переходят в хроническую форму. Так, болезнь Боткина (гепатит А) характерна для детей, и хотя в острой форме заболевание приводит к существенному ухудшению самочувствия, проходит оно без долговременных последствий для печени.
Вирусы В и С наиболее опасны. Связано это с тем, что такие инфекции могут протекать хронически, и длительное патологическое воздействие существенно повреждает ткани печени. А заражение вирусом С чаще всего приводит именно к такому развитию болезни – хроническая форма диагностируется у 55-85% инфицированных.
К тому же вирус гепатита С обладает прямым цитопатическим действием, то есть непосредственно повреждает клетки печени. Поэтому и осложнения у инфицированных этим типом болезни наступают быстрее, чем при заражении вирусом В – в течение 20 лет цирроз развивается у 30% больных.
Опасность гепатита типа С связана и с тем, что вирус быстро мутирует. Постоянная изменчивость приводит к тому, что иммунная система не успевает производить подходящие антитела и победить инфекцию. Именно этим объясняется тот факт, что болезнь часто переходит в хроническую форму.
Пути заражения вирусным гепатитом С
Вирусы гепатита попадают в организм человека двумя путями – алиментарным (через загрязненную воду и продукты питания) и гемолитическим (через кровь и биологические жидкости). Первый характерен для инфекций А и Е, а вот вирус гепатита С передается вторым путем. То есть источником инфекции становятся больные в острой и хронической фазе или вирусоносители (те, у кого заболевание протекает бессимптомно), а также предметы, на которых может оставаться зараженная кровь, например, шприцы. При этом бытовым путем, например, через прикосновение, болезнь не передается.
В группы риска по заражению попадают следующие категории людей:
- Инъекционные наркоманы.
- ВИЧ-инфицированные.
- Люди, имеющие много половых партнеров.
- Больные с почечной недостаточностью, находящиеся на гемодиализе.
- Больные, нуждающиеся в переливании крови.
- Лица, контактирующие с больными гепатитом и вирусоносителями.
В редких случаях гепатит С может передаваться при косметологических процедурах или нанесении татуировок через зараженные инструменты. Кроме этого, инфицирование может произойти в родах – HCV передается от матери к ребёнку.
Симптомы гепатита С
Инкубационный период болезни длится от 20 до 150 суток. При этом острая фаза вирусного гепатита С нередко протекает бессимптомно. По данным Всемирной организации здравоохранения, у 80% зараженных HCV протекает именно так. Поэтому и диагностируется заболевание часто с опозданием, когда печень уже существенно поражена и пациента беспокоят признаки осложнений. Иногда впервые о своей болезни человек узнает спустя десятилетия после заражения.
Если острая фаза инфекции все же протекает с симптомами, то среди них будут следующие:
- Тошнота.
- Повышение температуры тела.
- Ухудшение или полная потеря аппетита.
- Боли в области печени.
- Потемнение мочи и белесый кал.
- Желтушность кожи, слизистых и белков глаз (поздний симптом).
Стоит отметить, что симптоматика ВГС не является специфической – такие недомогания испытывают пациенты с разными формами поражения печени, в том числе и неинфекционной природы. Поэтому диагноз ставится исключительно по результатам анализов.
Диагностика гепатита
Если есть подозрение на гепатит С, что делать пациенту? В первую очередь пройти необходимые анализы. Согласно рекомендациям Всемирной организации здравоохранения, диагностика включает в себя два этапа:
- Серологический анализ крови на антитела к ВГС
Желательно использовать современные тест-системы иммуноферментного анализа (ИФА), поскольку они достаточно точны. При этом пациенту нужно помнить про «окно антител» – период после заражения, когда вирус уже проявляет активность, но антитела против него организм еще не начал вырабатывать. При HCV такой период может длиться иногда до 6 месяцев. Поэтому при повышенной вероятности заражения лучше всего дополнительно сдать контрольный анализ.
- Тест на наличие РНК вируса гепатита
Проводится в том случае, если серологический анализ был положительным. Такая уточняющая диагностика рекомендована для подтверждения наличия болезни. Дело в том, что, как и при других вирусных гепатитах, при заражении типом С организм может самостоятельно победить инфекцию, без дополнительного лечения. В случае с HCV это фиксируется у 30% зараженных. При этом в крови могут оставаться антитела, но самого вируса не будет, а значит и в лечении человек не нуждается.
Гепатит С: что делать
Долгое время лечение гепатита С было достаточно длительным и тяжелым. Использовалась стандартная схема терапии вирусных инфекций, в которой главная роль отводилась интерферону, повышающему сопротивляемость клеток против вируса. Однако высокая изменчивость HCV делала такое лечение малоэффективным.
В последние годы в протоколы лечения были внесены существенные изменения – появились противовирусные препараты прямого действия (ПППД). Согласно руководству Всемирной организации здравоохранения, такие лекарства рекомендованы всем группам больных, даже тем, у кого уже развились осложнения в виде цирроза печени. Эффективность ПППД – 90%, при этом удалось существенно сократить курс лечения, и сейчас он составляет не более 24 недель. Основным препаратом ПППД остается софосбувир в сочетании с другими лекарствами.
Недавно Европейская комиссия и FDA в США одобрили применение препарата нового поколения Маривета (глекапревир/пибрентасвир), курс лечения которым для взрослых без цирроза печени составляет всего 8 недель. Более того, медикамент доказал свою эффективность для тех пациентов, у которых лечение софосбувиром оказалось неудачным.
Вирусный гепатит С перестал быть приговором – новые методы лечения дают шанс на выздоровление большинству пациентов. При этом крайне важно вовремя диагностировать болезнь, ведь именно позднее выявление инфекции сегодня остается главной проблемой.
Читайте далее

Где можно сдать анализ на гепатит
Можно ли обследоваться на наличие гепатита бесплатно? Какие анализы и где можно сдавать, какие нужны направления и подготовка.
К вопросу о современной тактике лечения вирусных гепатитов

Вирусные гепатиты (ВГ) в настоящее время представляют серьезнейшую медико-биологическую и социальную проблему для всего человечества. Сейчас в мире насчитывается более 500 млн. носителей вирусных гепатитов с парентеральным путем заражения, которые
#11/02 Ключевые слова / keywords: Гастроэнтерология, Gastroenterology
2002-11-22 00:00
79796 прочтений

Вирусные гепатиты (ВГ) в настоящее время представляют серьезнейшую медико-биологическую и социальную проблему для всего человечества. Сейчас в мире насчитывается более 500 млн. носителей вирусных гепатитов с парентеральным путем заражения, которые в большинстве случаев приобретают хроническое течение с формированием тяжелых исходов — цирроза печени и гепатоцеллюлярной карциномы [1]. С 1961 года, по данным ВОЗ, в США и странах Западной Европы среди причин смерти хронические гепатиты и циррозы печени переместились с 10-го на 5-е место [1]. В настоящее время выделяют семь типов ВГ: А, В, С, D, Е, F, G. Недавно открыт вирус ТТV, передающийся при трансфузии и рассматривающийся как этиологический фактор гепатита ни А, ни Е. В настоящее время лабораторным путем можно обнаружить маркеры всех видов вирусов, за исключением возбудителя вирусного гепатита F. В большинстве регионов мира и Российской Федерации среди всех ВГ преобладают гепатиты В и С. Именно для этих форм гепатитов характерны непрерывный рост заболеваемости и частые неблагоприятные исходы. Эпидемия наркомании также привела к широкому распространению HBV- и HCV-инфекции. От 50 до 90% инъекционных наркоманов инфицированы этими вирусами [2, 3].
Целью нашей статьи является рассмотрение комплекса средств противовирусной терапии, применяющихся для лечения вирусных гепатитов на современном этапе.
В 70 — 80-е годы ХХ века происходил интенсивный поиск этиотропной терапии острых и хронических вирусных гепатитов. Во многих странах мира создавались и изучались препараты, направленные на подавление репликации вирусов гепатита и их элиминацию. В настоящий момент проводятся теоретические и клинические исследования следующих групп препаратов: интерфероны, противовирусные средства (аналоги нуклеозидов), индукторы интерферонов, иммуномодуляторы, блокаторы кода вирусов — препараты, действующие на молекулярном уровне и обеспечивающие полное торможение репликации вируса и экспрессии гена (стратегическое направление терапии, имеющее большие перспективы в будущем) [1].
Интерфероны
Наиболее эффективными в лечении ВГ препаратами в настоящее время признаны интерфероны. Интерфероны (ИФН) — группа аутогенных гликопротеинов, биомеханизм действия которых связан с одновременным противовирусным эффектом — активацией клеточных генов, в результате чего синтезируются белки, ингибирующие синтез вирусной ДНК (РНК) и обладающие иммуномодулирующим эффектом — способностью усиливать экспрессию антигенов HLA на клеточных мембранах и увеличивать активность цитотоксических Т-клеток и естественных киллеров [4]. ИФН подразделяются на два типа. К первому типу, действующему как ингибиторы репликации вируса и оказывающему преимущественно противовирусный эффект, относятся 22 различных подтипа ИФН-α и один подтип ИФН-β. Ко второму типу, проявляющему иммуномодуляторную активность, относятся ИФН-γ.
Существует три иммунологически различных класса ИФН: ИФН-α, ИФН-β, ИФН-γ. К ИФН естественного происхождения относятся лимфобластоидный и лейкоцитарный ИФН (ИФН-α), синтезируемые соответственно стимулированными моноцитами и В-лимфоцитами человека, которые затем экстрагируются и очищаются; фибробластный ИФН (ИФН-β), получаемый из культуры фибробластов человека, и Т-лимфоцитарный ИФН (ИФН-γ). К искусственно синтезируемым ИФН относится рекомбинантный ИФН-α, который представляет собой высокоочищенный единственный подтип ИФН-α, получаемый по рекомбинантной молекулярной технологии.
Среди рекомбинантных ИФН выделяют ИФН-α-2а (роферон-А), ИФН-α-2b (интрон-А), ИФН-α-2с (бероферон). Коммерческое название препарата лимфобластоидного ИФН-α — веллферон, а человеческого лейкоцитарного интерферона — реаферон (Россия). Кроме того, совсем недавно в клинической практике начали использоваться препараты рекомбинантных ИФН-α пролонгированного действия (конъюгированные ИФН-α), производимые в виде коммерческих препаратов пегасис и пегинтрон. Пегасис — это препарат ИФН-α-2а, соединенный с молекулой полиэтиленгликоля с общей молекулярной массой 40 кDa, пегинтрон — препарат ИФН-α-2b, объединенный с молекулой полиэтиленгликоля с молекулярной массой 12 кDa. Данные препараты обладают наибольшей противовирусной активностью среди всех рекомбинантных ИФН-α.
Рекомбинантные ИФН-α являются в настоящее время препаратами выбора при лечении гемоконтактных ВГ. Основными показаниями для лечения ими стало наличие активной вирусной репликации, маркерами которой в крови являются: при HBV-инфекции — HBeAg, DNA HBV; при HDV-инфекции — anti-HDV-IgM, RNA HDV; при HCV-инфекции — RNA HCV.
Благоприятными в прогностическом отношении факторами у больных хроническими вирусными гепатитами B, C, D при проведении ИФН-терапии могут считаться: небольшая длительность заболевания (менее 5 лет), молодой возраст (менее 45 лет), отсутствие гистологических признаков цирроза печени, низкий уровень аминотрансфераз сыворотки крови (не более 3 норм), низкое содержание железа в ткани печени (менее 650 мкг/г нативной массы) и нормальные показатели сывороточного железа (17–22 мкмоль/л) [5, 6, 7].
Противопоказаниями к назначению ИФН-терапии являются: декомпенсированный цирроз печени, тяжелые сопутствующие сердечно-сосудистые и психические заболевания, наркомания, алкоголизм, аутоиммунные заболевания, хроническая почечная недостаточность.
Использующиеся сейчас многочисленные схемы лечения различных по этиологии и активности вирусных гепатитов можно подразделить на три вида (терапия интроном А).
Режим высоких доз — 10 000 000 МЕ ежедневно до получения нормальных трансаминаз, затем 3 000 000 МЕ 3 раза в неделю в течение 6 месяцев.
Режим средних доз — 5 000 000 МЕ 3 раза в неделю в течение 2 — 3 месяцев, затем 3 000 000 МЕ 3 раза в неделю в течение 4 — 12 месяцев.
Режим малых доз — 3 000 000 МЕ 3 раза в неделю в течение 3 месяцев.
Режим высоких доз часто применяется при острой фазе течения вирусных гепатитов. При хроническом течении начинают с режима высоких или средних доз, если имеется неудовлетворительная переносимость ИФН, переходят на режим малых доз [5, 6, 8].
Оценка эффективности ИФН-терапии проводится в соответствии с тестами контроля за лечением хронических вирусных гепатитов: нормализацией уровня трансаминаз, устранением маркеров фазы репликации вирусов гепатита В, С, D и морфологическим изменением ткани печени до и после курса лечения.
На фоне проводимой терапии рекомбинантными ИФН-α могут наблюдаться побочные эффекты, наиболее распространенным из которых является гриппоподобный синдром (лихорадка, озноб, головные боли, миалгии), развивающийся в первую или вторую неделю лечения, который может быть ослаблен, как показали клинические наблюдения, инъекциями ИФН-α в вечерние часы. Кроме того, у пациентов отмечаются диспепсические явления, нарушения сна, потеря веса, слабость, лейкопения, тромбоцитопения у 12% больных, а также развитие тиреотоксикоза [15]. Большинство побочных эффектов являются дозозависимыми и могут быть устранены тщательным подбором дозы препарата [1, 5, 6].
Эффективность терапии ИФН-α довольно высока. Примерно у трети больных с хроническим гепатитом В и С и у 10% больных с HDV-инфекцией достигается устойчивый положительный ответ на лечение ИФН-α в обычных дозах (отсутствие репликации вируса, нормальный уровень АЛТ и АСТ через 6 месяцев после окончания монотерапии ИФН-α). Вместе с тем большинство авторов сегодня разделяют мнение о том, что лечение гемоконтактных вирусных гепатитов уже не может и не должно осуществляться с помощью одной только ИФН-терапии [9, 10, 11, 12]. Стала очевидной необходимость одновременного использования нескольких препаратов, способных воздействовать как на различные звенья собственно репликации вируса, так и на иммунную систему в целом, хотя интерфероны продолжают оставаться базисным компонентом лечения. Например, в случае возникновения рецидива после первого курса монотерапии ИФН-α предусматриваются комбинации ИФН-α с ламивудином при HBV-инфекции [5] и ИФН-α с рибавирином при HCV-инфекции с положительным эффектом у значительной части больных [11]. Изложенные на 36-м конгрессе Европейской ассоциации по изучению болезней печени в Праге в апреле 2001 года результаты исследования клинической эффективности применения конъюгированного рекомбинантного ИФН-α — пегинтрона в сочетании с рибавирином свидетельствуют о еще более высокой противовирусной активности комбинированной терапии HCV-инфекции. Частота доказанного ответа у пациентов с не-1b-генотипом HCV превышает 55%. Еще более обнадеживающими кажутся результаты, полученные при использовании конъюгированного рекомбинантного ИФН-α — пегасиса: даже монотерапия этим новым препаратом, согласно предварительным данным, по своей эффективности превосходит комбинированное применение пегинтрона и рибавирина [12].
Аналоги нуклеозидов
Аналоги нуклеозидов — это группа средств, проявляющих свое действие в отношении генома вирусов гепатита.
Ламивудин (зеффикс) является препаратом, ингибирующим РНК-зависимую обратную транскриптазу, необходимую для транскрипции прегенома HBV РНК в HBV ДНК. Ламивудин обладает выраженной противовирусной активностью в отношении вируса гепатита В. Препарат снижает уровень митохондриальной ДНК и вызывает незначительную митохондриальную токсичность [1, 14]. Лечение ламивудином показано больным с доказанной репликацией вируса гепатита В (наличие НВеАg и HBV ДНК), при наличии мутантного штамма HBV в pre-core-зоне, при повышении уровня активности АЛТ в 3 и более раза и изменении гистологической картины в печени, а также у пациентов в стадии декомпенсации хронического гепатита и цирроза печени с сохраняющейся репликацией HBV [5, 14].
Детям до 12 лет ламивудин назначается в дозировке 3 мг/кг массы тела в день, детям старше 12 лет в дозе 100 мг 1 раз в день, взрослым в дозе 100 — 300 мг в день в течение 12 недель.
Критериями эффективности терапии ламивудином служат снижение концентрации HBV ДНК, исчезновение HBe Ag и появление anti-HВe, нормализация цифр АЛТ, уменьшение прогрессирования фиброза в печени и замедление перехода в цирроз [14].
Побочные эффекты при лечении ламивудином (недомогание, головная боль, тошнота, повышение температуры, лейкопения, депрессивный синдром) наблюдаются у 1 — 5% больных [14].
Терапия ламивудином, по данным литературы [16], позволяет уже через 1 — 3 месяца лечения добиться подавления репликации и снижения уровня HBV ДНК до минимальных значений. Однако после завершения годичного и даже трехгодичного курса терапии у большинства больных уровень HBV ДНК в сыворотке крови вновь повышается, хотя и не достигает первоначальных значений. Кроме того, при длительной терапии ламивудином у больных развивается резистентный к ламивудину штамм HBV с мутациями в YMDD-зоне [16], вероятность появления которого после годичной терапии составляет 24%, а после 3 лет лечения — 49% [14]. С целью повышения эффективности специфической терапии HBV-инфекции многими клиниками мира проводится сочетание ИФН-терапии с ламивудином.
Фамцикловир, также являющийся аналогом нуклеозидов, обладает сходным с ламивудином механизмом действия, однако несколько уступает последнему по эффективности. Он подавляет репликацию ДНК НВV, снижая уровень ДНК НВV в сыворотке крови до минимальных определяемых значений. Назначается в дозе 500 мг 3 раза в день per os на 1 — 6 месяцев. После курса монотерапии фамцикловиром только у 19% больных уровень HBV ДНК не возрастает вновь до исходных значений [5].
Рибавирин — это аналог гуанозина, который вызывает торможение РНК-полимеразы вируса и непрямое торможение синтеза протеина. Он оказывает вирусостатическое действие в отношении многих ДНК- и РНК-содержащих вирусов. Доза препарата 1000–1200 мг/сутки в два приема в течение 12–24–48 недель. Рибавирин является достаточно токсичным препаратом. Среди его побочных эффектов головокружение, тошнота, депрессия, гемолиз эритроцитов. Кроме того, даже длительная монотерапия рибавирином не приводит к элиминации вируса. Поэтому применение рибавирина в комбинированной терапии с ИФН-α значительно усиливает противовирусный эффект, особенно у больных, «не ответивших» на монотерапию интерферонами, и у больных, у которых не удалось добиться стойкого эффекта при лечении ИФН [9,10]. Сочетание ИФН-α с рибавирином является официально лицензированной Минздравом России схемой лечения хронического гепатита С [12]. Препарат пегасис пока не рекомендован Минздравом для этих целей. ИФН назначается в дозе 3 000 000 МЕ 3 раза в неделю в течение 24 недель, рибавирин — в дозе 1000–1200 мг/сутки в два приема также на 24 недели. После курса лечения у 40% больных стойко исчезает HCV РНК, снижается активность АЛТ и уменьшается воспалительно-некротический процесс по данным пункционной биопсии печени [1]. Следует отметить, что появился отечественный производитель рибавирина — компания «Верофарм». Выпускаемый ею препарат веро-рибавирин сопоставим по качеству с европейскими аналогами, но значительно ниже по цене.
Индукторы интерферонов
Индукторы интерферонов являются препаратами с комбинированным эффектом: этиотропным, направленным непосредственно на вирус-возбудитель, и иммуномодулирующим, то есть корригирующим нарушения системы иммунитета. Индукторы интерферонов представляют собой весьма разнородное по составу семейство высоко- и низкомолекулярных природных и синтетических соединений, объединенных способностью вызывать в организме образование собственного эндогенного интерферона. Они индуцируют синтез всех иммунологических классов интерферонов: α, β и γ в разных пропорциях. Все они хорошо сочетаются друг с другом, рекомбинантными ИФН-α, иммуномодуляторами и химиотерапевтическими средствами. Комбинированное применение с другими препаратами часто приводит к потенцированию эффектов индукторов интерферонов.
Индукторы интерферонов относятся к новому поколению лекарств и имеют ряд преимуществ перед рекомбинантными ИФН.
- Индукторы интерферонов не обладают антигенностью.
- Естественный, но стимулированный синтез эндогеннного интерферона не вызывает гиперинтерферонэмии, которая нередко возникает при использовании рекомбинантных ИФН, что в свою очередь приводит к побочным эффектам.
- Однократное введение индукторов интерферонов обеспечивает длительную циркуляцию интерферонов на терапевтическом уровне. Для достижения такого уровня экзогенных интерферонов требуется многократное введение высоких доз рекомбинантных ИФН.
- Рекомбинантные ИФН, принимая участие в иммунных реакциях организма, стимулируют неспецифическую цитотоксичность иммуноцитов и вызывают экспрессию молекул HLA в тех популяциях клеток, которые обычно не экспрессируют эти антигены. Это может быть причиной усугубления аутоиммунного ответа организма человека.
- Некоторые индукторы интерферона (амиксин) обладают уникальной способностью запускать синтез интерферона в определенных популяциях клеток, что предпочтительнее, чем поликлональная стимуляция иммуноцитов рекомбинантными ИФН.
- Широко применяемые рекомбинантные ИФН являются препаратами α-интерферона, что существенно ограничивает их противовирусные свойства, так как для эффективной противовирусной защиты необходимо наличие всех трех классов интерферонов, синтез которых вызывается индукторами интерфероногенеза.
В настоящий момент проходят период клинических испытаний и уже применяются в практическом здравоохранении более десяти индукторов интерферона природного и синтетического происхождения. Часть из них используются для профилактики и лечения вирусных гепатитов.
Амиксин — известный отечественный препарат, является первым пероральным индуктором эндогенных интерферонов α, β, γ. Он наиболее полно сочетает в себе все преимущества индукторов интерферона. Являясь поликлональным стимулятором, амиксин вызывает синтез интерферонов первого и второго типа в Т-лимфоцитах, энтероцитах кишечника, гепатоцитах, проникает через гематоэнцефалический барьер и индуцирует интерферон в клетках мозга. У него отсутствуют мутагенный, тератогенный, эмбриотоксический, канцерогенный и другие токсические эффекты. Препарат не обладает антигенностью. Важной особенностью амиксина является вызываемая им длительная циркуляция в организме терапевтической концентрации интерферонов (50 — 100 ЕД/мл в сыворотке крови).
Препарат выпускается в таблетках по 0,125 г, по 6 или 10 таблеток в упаковке.
Сочетание в одном препарате этиотропных, иммуномодулирующих и патогенетических свойств, а также его полная совместимость с антибиотиками и другими средствами традиционного лечения вирусных и бактериальных инфекций позволяют применять амиксин для лечения таких заболеваний, как острые и хронические вирусные гепатиты, грипп, другие ОРВИ, герпес, рассеянный склероз, клещевой энцефалит, СПИД и др.
Исследования, проводившиеся в клинике инфекционных болезней РМАПО (Москва) и в клинике детских болезней ВМА по изучению эффективности амиксина при вирусных гепатитах, показали, что при остром течении вирусных гепатитов амиксин сокращает «вирусную нагрузку», способствует элиминации вирусов в первые 2 — 3 недели лечения, ускоряет процессы нормализации клинико-биохимических показателей. При лечении хронических гепатитов, особенно вызываемых HCV, или микст-инфекции, в случае удовлетворительного ближайшего эффекта требуется дальнейшее курсовое применение амиксина в течение года [13].
Лечение амиксином острых и хронических форм вирусных гепатитов В, С, В + С проводится на фоне общепринятой базисной терапии под контролем маркеров вирусной инфекции в крови: HBeAg и ДНК HBV при HBV-инфекции, РНК HCV при HCV-инфекции, а также HBsAg и показателей уровня билирубина, АлТ, АсТ, щелочной фосфатазы.
Для лечения острой формы вирусных гепатитов В, С, В + С амиксин назначается одним курсом по схеме: в первый день — 2 таблетки по 0,125, затем через каждые 48 ч по 0,125 (10 — 12 таблеток на курс).
Для лечения хронических вирусных гепатитов В, С, В + С назначается от 4 до 6 курсов по 10 — 12 таблеток (общее количество — от 40 — 48 до 60 — 72 таблеток).
Неовир — низкомолекулярный синтетический супериндуктор ИФН. Представляет собой производное карбоксиметилакридона с молекулярной массой менее 300. Неовир активирует стволовые клетки костного мозга, устраняет дисбаланс в субпопуляциях Т-лимфоцитов с активацией эффекторных звеньев Т-клеточного иммунитета и макрофагов. Неовир усиливает активность естественных киллеров, стимулирует продукцию интерлейкина-2 (ИЛ-2), нормализует продукцию фактора некроза опухоли, обеспечивая антитуморогенный эффект. Он также оказывает выраженный стимулирующий эффект на активность полиморфно-ядерных лейкоцитов.
Неовир применяется при остром гепатите А, хронических гепатитах В и С, герпесвирусных инфекциях, а также для лечения и профилактики респираторных инфекций, вызванных вирусами парагриппа, риновирусами, РС-вирусом, аденовирусами, вирусом гриппа.
Неовир выпускается в инъекционной форме в виде стерильного 12,5%-ного раствора в 2 мл физиологически совместимого буфера. Проводится системное (в/в, в/м) введение препарата.
У 3 — 4% больных на фоне лечения неовиром наблюдается подъем температуры до субфебрильных цифр, сопровождающийся артралгиями. В этих случаях рекомендуется комбинированная терапия неовиром и НПВС [13].
Циклоферон — метилглюкаминовая соль карбоксиметилакридона, является синтетическим аналогом природного алкалоида Citrus Grandis. Он обладает пролонгированным противовирусным, противовоспалительным и иммуномодулирующим действием. Циклоферон способен вызывать образование α-, β- и γ-интерферонов в организме. Стимулированная индукция интерферона достигает 60 — 80 ЕД/мл в сыворотке крови. Эндогенный интерферон продуцируют иммунокомпетентные клетки — лейкоциты, макрофаги, фибробласты и эпителиальные клетки человека. Для циклоферона характерна низкая токсичность, отсутствие мутагенного, тератогенного, эмбриотоксического, канцерогенного эффекта, мягкое пролонгированное иммуномодулирующее действие, препарат хорошо сочетается с традиционными средствами терапии.
Выпускается циклоферон в виде 12,5%-ного стерильного водного раствора в ампулах по 2 мл, а также лиофилизированного порошка в ампулах или флаконах по 0,25 г активного вещества. В упаковке содержится 5 ампул или флаконов.
Циклоферон эффективен в отношении вирусов гепатита А, В, С, D, Е, клещевого энцефалита, герпеса, цитомегаловирусной инфекции, ВИЧ-инфекции и др. С успехом применяется для лечения хламидиоза, в комплексной терапии реактивного и ревматоидного артрита. Циклоферон вводится в/в или в/м 1 раз в сутки в дозе 2 мл — 250 мг на 1, 2, 4, 6, 8, 10, 12-й день курса лечения. В острый период заболевания в первый день дополнительно назначается одна в/в или в/м инъекция 4 мл — 500 мг. Для закрепления эффекта возможно повторение курса лечения. Схемы лечения гепатитов: гепатит А — курс лечения 23 дня (на курс 10 инъекций), острая фаза гепатита В — курс лечения 23 дня (на курс 10 инъекций), хронические гепатиты В и С — лечение в течение 70 дней (3 курса по 10 инъекций по 4 мл — 500 мг в/в). Положительный эффект от лечения наблюдается при гепатите А в 98% случаев, остром гепатите В — 75%, хроническом гепатите В — в 60%, хроническом гепатите С — в 25% случаев.
Полудан (полиаденур) — синтетический индуктор интерферона, состоит из двухнитевого комплекса полиадениловой и полиуридиновой кислот. Он обладает иммуномодулирующим действием, индуцируя образование эндогенного α- и β-интерферона. Показано применение полудана при гепатите В, герпетических кератитах и кератоконъюнктивитах. При лечении хронического гепатита В полудан вводится в/в по 150 мг дважды в неделю на 24 недели. Для повышения эффекта от лечения сразу после окончания 6-месячного курса полуданом больного переводят на терапию ИФН-α.
Полигуацил — индуктор интерферона, относящийся к синтетическим полимерам с двуспиральной ДНК. Он стимулирует выработку эндогенного интерферона в клетках крови, печени, затем повышение уровня интерферона наблюдается в селезенке, легких, мышечной ткани, лимфоидных органах. Спектр активности полигуацила охватывает острую фазу вирусных гепатитов, острые энцефалиты, грипп, бешенство. Применение полигуацила системное: в/в, в/м, возможно подкожное, интраназальное и аэрозольное применение препарата.
Кагоцел — препарат природных индукторов интерферонов, который относится к низкомолекулярным полифенолам, производным госсиптола. Он вызывает повышение уровня эндогенного интерферона в крови, печени, селезенке, почках, лимфоидных органах. Кагоцел применяется при гепатитах, клещевом энцефалите, бешенстве, гриппе, ОРВИ. Вводится в/м, п/о.
Рогасин — препарат природных индукторов интерферонов из той же группы, что и кагоцел. Вызывает повышение уровня эндогенного интерферона в крови, печени, селезенке, кишечнике. Доклиническими исследованиями было установлено, что рогасин эффективен в лечении гепатитов А и В и новообразований. Вводится он системно: в/в, в/м, п/к, п/о.
Иммуномодуляторы со способностью индукции эндогенных интерферонов
- Цитокины-интерлейкины.
Интерлейкин-2 (ИЛ-2) представляет собой гликопротеин, индуцирующий пролиферацию и дифференцировку Т-лимфоцитов. Усиление с помощью ИЛ-2 продукции ИФН-α ведет к активации макрофагов.
Интерлейкин-12 (ИЛ-12) активирует ТНJ-лимфоциты и NK-клетки, а также индуцирует выработку ИФН-α и ИЛ-2.
ИЛ-2 и ИЛ-12 назначаются в дозе 500 мкг п/к 2 — 5 раз в неделю на 4 — 6 месяцев. Неспецифическая стимуляция ими ингибирует репликацию ДНК НВV без уничтожения инфицированных гепатоцитов. Биохимическая ремиссия достигается в 20% случаев. Однако после окончания лечения уровень трансаминаз вновь повышается и нормальные показатели сохраняются лишь у 8% больных.
Глицирризин оказывает выраженный иммуномодулирующий эффект, характеризующийся усилением Т-клеточной активности, стимуляцией и продукцией эндогенного g-интерферона, повышением фагоцитарной активности и антителообразования. Глицирризин применяется в лечении хронического репликативного гепатита В. В первый месяц лечения препарат назначают по 40 мл 3 раза в неделю, затем 2 раза в неделю. Терапию глицирризином продолжают не менее года, после чего назначается ИФН. Такое предлечение потенцирует последующий эффект интерферонотерапии у 60% больных с сероконверсией HBeAg, а у части больных наблюдается исчезновение ДНК HBV. Допускается и прямое ингибирующее влияние глицирризина на репликативную активность HBV.
Амантадин — препарат, широко применяющийся для лечения гриппа. В последние годы он стал использоваться для лечения больных хроническими гепатитами. Амантадин использовался в качестве монотерапии в дозе 1000 мг 2 раза в день в течение 6 месяцев. У 30% больных к концу лечения была достигнута биохимическая ремиссия и у более 50% снизилась виремия [1]. В ряде европейских стран (Австрия, Германия) официально применяются схемы «тройной» терапии хронического гепатита С, в ходе которой наряду с ИФН-α и рибавирином используются препараты амантадиновой группы (амантадин, ремантадин, симметрель, мидантан) в суточной дозе 200 мг. Частота доказанного ответа при таком режиме лечения у пациентов с не-1b-генотипом вируса составляет 60 — 70% и 50% у больных с 1b-генотипом вируса, не ответивших до этого на монотерапию ИФН-α или с рецидивом после ее отмены [12].
Тимозин-α — пептид, состоящий из 28 аминокислот, способный модифицировать иммунный ответ организма человека. Используется в клинической практике для лечения «дикого типа» (HBeAg+) HBV-инфекции. Назначается 1 мг тимозина-α 2 раза в день на 6 — 12 месяцев. Однако более целесообразно комбинированное лечение тимозином-α в дозе 1мг 2 раза в день и лимфобластоидным ИФН-α в дозе 3000000 ЕД 3 раза в неделю. После курсового лечения в 1 год эффективность терапии составляет 40 — 73% [1].
Все вышеуказанные препараты уже нашли свое место в клинической практике. Однако в гепатологии существует еще несколько перспективных направлений создания новых противовирусных лекарственных препаратов, о которых нельзя не упомянуть. Помимо недавно вышедших на рынок конъюгированных рекомбинантных ИФН-γ пролонгированного действия, которые сейчас всесторонне изучаются практической медициной, интересным представляется применение в будущем высокоактивных химических соединений, блокирующих ряд ферментов вируса гепатита С — геликазу, протеазу, РНК-зависимую РНК-полимеразу, принимающих участие в механизмах репликации. Клинические испытания проходит схема генной терапии хронического гепатита В с использованием противосмысловых олигонуклеотидов и рибозимов. Разработан также принципиально новый подход к лечению хронического гепатита С, когда в качестве объекта внешнего воздействия («рибосомальные ножницы», Pipe-line) выступает наиболее стабильная часть генома — Core-протеин. Результатом такого подхода стало создание препарата heptozyme, проходящего сейчас вторую фазу клинических испытаний [11, 12].
Литература
- Недогода В. В. Фармакотерапия хронических диффузных заболеваний печени // Новые лекарства и новости фармакотерапии. 2000. № 6. С. 3 — 16.
- Ивашкин В. Т. Терминология хронических гепатитов, реакции отторжения печеночного аллотрансплантата и узловых поражений печени // Русский медицинский журнал. 1995. № 6. С. 26 — 30.
- Иоаниди Е. А. Клинико-иммунологическая характеристика и наш опыт лечения гемоконтактных вирусных гепатитов // Новые лекарства и новости фармакотерапии. 2000. № 8. С. 3 — 6.
- Материалы Третьей Российско-Итальянской конференции по инфекционным болезням «Вирусные гепатиты В, С, D: противовирусная терапия на рубеже веков». М., 1999.
- Ивашкин В. Т. Комбинированное лечение хронического гепатита В // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1998. № 5. С. 57 — 60.
- Горбаков В. В. Современные подходы к диагностике и лечению вирусного гепатита С // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1998. № 5. С. 61 — 67.
- Никитин И. Г., Кузнецов С. Л., Сторожаков Г. И. Уровень сывороточного железа и результаты интерферонотерапии у больных с хроническим гепатитом С // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2000. № 3. С. 32 — 36.
- Вирусный гепатит В: клиника, диагностика, лечение. Информационный бюллетень Шеринг Плау в РФ. 1998. Июнь. С. 14.
- Соринсон С. Н., Корочкина О. В., Жданов Ю. Е. и др. Острая фаза гепатита С: диагностика, перспективы интерферонотерапии // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1999. № 1. С. 40 — 44.
- Ивашкин В. Т., Маммаев С. Н., Лукина Е. А. Особенности иммунного ответа у больных хроническим гепатитом С // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2001. № 3. С. 24 — 30.
- Павлов Ч. С. Гепатит С: естественное течение и подходы к терапии // Клинические перспективы гастроэнтерологии, гепатологии. 2001. № 3. С. 2 — 6.
- Никитин И. Г., Сторожаков Г. И. Хронический гепатит С: актуальные вопросы диагностики и лечения // Клинические перспективы гастроэнтерологии, гепатологии. 2001. № 3. С. 7 — 11.
- Петров В. А., Заболотняя Г. А. Индукторы интерферонов в лечении и профилактике вирусных инфекций // Новые лекарства и новости фармакотерапии. 2000. № 8. С. 7 — 12.
- Заболотняя Г. А., Петров В. А. Ламивудин в лечении хронического гепатита В // Новые лекарства и новости фармакотерапии. 2000. № 8. С. 13 — 19.
- Roti E., Minelly R., et al. Multiple changes in thyroid function in patients with chronic active HCV-hepatitis treated with recombinant interferon-alpha // The American Journal Of Medicine. 1996. November. Volum 101. P. 482 — 487.
- Leung N. Liver disease — significant improvement with lamivudine // Journal of Medicine Virology. 2000. № 61. P. 380 — 385.
В. В. Недогода, доктор медицинских наук
В. В. Скворцов, кандидат медицинских наук
З. С. Скворцова, кандидат медицинских наук
Р. Г. Мязин, кандидат медицинских наук
ВМА, Волгоград
Обоснование длительности терапии и дозы препаратов
Инфицированные вирусом с генотипом 1 и с высоким уровнем HCV-РНК (>2х10 6 копий/мл) лучше реагировали на 48-недельный курс комбинированной терапии рибавирином и интерфероном, чем на 24-недельный.
Международный консенсус Европейской Ассоциации по изучению печени (EASL, 1999 г.)
Эффективность терапии рибавирином
В настоящее время комбинированная терапия пигелированным интерфероном α + рибавирином признана новым «золотым» стандартом в лечении гепатита С.
| Химическая природа | Препарат |
| А. Синтетические соединения | |
| Низкомолекулярные (ароматические) углеводы: | |
| Флуореноны | Амиксин |
| Акриданоны | Циклоферон, неовир |
| Полимеры (двуспиральные РНК): | |
| Поли(А) поли(У) | Полудан |
| Поли(Г) поли(Ц) | Полигуацил |
| Б. Природные соединения | |
| Низкомолекулярные полифенолы (производные госсипола) | Кагоцел, рогасин |
Источник https://medartby.ru/blog/trendovye-meditsinskie-stati/gepatit-s-rekomendatsii-voz-2016-goda/
Источник https://medaboutme.ru/articles/virusnyy_gepatit_s_gruppy_riska_i_lechenie/
Источник https://www.lvrach.ru/2002/11/4529807