Нетрадиционная медицина при лечении онкологии
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
- Издательство «Медиа Сфера»
- (бесплатный номер по вопросам подписки)
пн-пт с 10 до 18
- Издательство «Медиа Сфера»
а/я 54, Москва, Россия, 127238 - info@mediasphera.ru
- вКонтакте
- Telegram
- Издательство
- «Медиа Сфера»
Результаты поиска: 0
Медицинский радиологический научный центр Минздравсоцразвития России, Обнинск
Медицинский радиологический научный центр им. А.Ф. Цыба — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Обнинск, Россия

Нетрадиционные режимы лучевой терапии немелкоклеточного рака легкого
Подробнее об авторах
Скачать PDF
Связаться с автором
Оглавление
Рагулин Ю.А., Гоголин Д.В. Нетрадиционные режимы лучевой терапии немелкоклеточного рака легкого. Онкология. Журнал им. П.А. Герцена. 2016;5(2):58‑63.
Ragulin IuA, Gogolin DV. Nontraditional radiotherapy regimens for non-small-cell lung cancer. P.A. Herzen Journal of Oncology. 2016;5(2):58‑63. (In Russ.)
https://doi.org/10.17116/onkolog20165258-63

Читать метаданные
Лучевая терапия (ЛТ) играет важную роль в лечении немелкоклеточного рака легкого (НМРЛ) в связи с тем, что у значительного числа больных имеются противопоказания к хирургическому лечению. Однако результаты консервативного лечения НМРЛ нельзя считать удовлетворительными. Современные методы реализации ЛТ позволяют целенаправленно воздействовать на опухоль и свести к минимуму отрицательное влияние на окружающие здоровые ткани. Это создает возможность эскалации дозы и оптимизации радиотерапевтического воздействия для каждого больного. Особое значение это приобретает у больных, имеющих противопоказания к химиотерапии, где есть необходимость увеличения лечебного воздействия самостоятельной радикальной ЛТ. Результаты исследований эффективности различных режимов фракционирования показали, что применение ускоренных режимов является наиболее перспективным направлением в лечении НМРЛ.
Медицинский радиологический научный центр Минздравсоцразвития России, Обнинск
Медицинский радиологический научный центр им. А.Ф. Цыба — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Обнинск, Россия
Рак легкого в настоящее время является одной из самых распространенных опухолей и ведущей причиной смерти от злокачественных новообразований. Несмотря на достижения диагностики, разработку и совершенствование лечебных подходов, внедрение новых групп лекарственных препаратов, отдаленные результаты лечения остаются неудовлетворительными. В схемах радикального лечения хирургия по-прежнему остается ведущим методом. Однако более 80% больных раком легкого к моменту установления диагноза признаются неоперабельными вследствие значительной распространенности, морфологической структуры процесса или тяжелых сопутствующих заболеваний. У данного контингента больных возникает необходимость более широкого применения консервативных методов лечения [1]. На ранних стадиях заболевания, когда полное хирургическое удаление невозможно, лучевая терапия (ЛТ) имеет определяющее значение. При распространенных формах ее роль сводится к уменьшению симптомов заболевания и улучшению качества жизни больных. В развитых странах около 70% пациентов получают ЛТ в качестве этапа лечения рака легкого [2]. В России при самых оптимистических подсчетах этот показатель не достигает 13% [3].
При наиболее часто используемом режиме конвенционального фракционирования 1-летняя выживаемость больных немелкоклеточным раком легких (НМРЛ) составляет 36—45%, 5-летняя — 3—9%, средняя продолжительность жизни — 8,7—10,2 мес. Основная часть больных умирает вследствие локорегионарного прогрессирования, что указывает на необходимость усиления радиационного воздействия на первичную опухоль и зоны регионарного метастазирования. Неудовлетворительные результаты и отсутствие возможности дальнейшего совершенствования позволяют считать традиционные режимы фракционирования малоэффективными при НМРЛ и рекомендовать сокращение частоты их использования при назначении Л.Т. Исследования по повышению эффективности консервативной терапии проводятся в следующих направлениях: пространственно-временная оптимизация ЛТ, использование сочетанного облучения, модификация радиочувствительности опухоли и окружающих тканей, применение новых схем химиотерапии и комбинации их с облучением [4].
В настоящее время установлено, что отрицательное влияние на выживаемость неоперабельных больных НМРЛ оказывает удлинение курса Л.Т. Так исследования группы RTOG показали значимое снижение показателей выживаемости при увеличении сроков лечения [5]. Следовательно, перспективным является применение нетрадиционных режимов в лечении НМРЛ, позволяющих сократить сроки облучения. Большая радиотерапевтическая доза обеспечивает достаточный тумороцидный эффект, но при этом оказывает усиленное воздействие на прилежащие органы и окружающие здоровые ткани. Это ограничение определяет поиск альтернативных режимов фракционирования на основании радиобиологических принципов восстановления, устойчивости, репопуляции и реоксигенации для повышения радиационного воздействия на быстро делящиеся клетки опухоли по сравнению с более медленно делящимися клетками нормальных тканей. Нетрадиционное фракционирование дозы представляется одним из самых привлекательных способов управления радиочувствительностью и, следовательно, эффективностью лечения [6].
Большинство побочных эффектов ЛТ являются предсказуемыми, и эти необратимые на настоящий момент отдаленные последствия лечения могут являться причиной увеличения заболеваемости и смертности, влияющих на отдаленные результаты. Частота и тяжесть постлучевых изменений ограничивают использование доз облучения, которые необходимы для радикального лечения рака легкого.
Прогрессивные методики ЛТ во многом были направлены на снижение риска отдаленных осложнений, в первую очередь за счет использования новых технологий для уменьшения объема облучения нормальной ткани и новых режимов фракционирования с целью достижения необходимой СОД. Нетрадиционные режимы фракционирования разрабатывались и внедрялись на основе глубоких исследований радиобиологических свойств опухолевых и нормальных тканей. Результаты проводимых исследований параллельно с совершенствованием методик ЛТ демонстрировали правильность выбранного пути, поскольку модифицированные режимы фракционирования, направленные на улучшение местного контроля, сопровождались сокращением частоты развития отдаленных метастазов и повышением выживаемости.
Принимая во внимание, что хирургия остается основой радикального лечения НМРЛ, ЛТ с использованием высоких СОД используется для «радикального» лечения потенциально излечимых, но неоперабельных пациентов. Еще в 60-е годы были проведены рандомизированные исследования, которые продемонстрировали преимущество в показателях выживаемости при радикальной ЛТ, однако те дозы и методы сейчас считаются неоптимальными [7]. В 1970-х годах исследование RTOG показало повышение 3-летней выживаемости при увеличении дозы облучения (9, 10 и 15% при 40, 50 и 60 Гр соответственно), в исследовании облучение проводили в традиционном режиме (РОД 2 Гр до СОД 60 Гр в течение 6 нед) [8]. В серии исследований 1980-х и 1990-х годов показан широкий диапазон средней продолжительности жизни и 5-летней выживаемости (16—36 мес и 6—50% соответственно). Ретроспективные данные Surveillance Epidemiology and End Result (SEER) 4357 пациентов, получавших ЛТ с 1998 по 2001 г., указывают на медиану выживаемости около 21 мес и 5-летнюю выживаемость 10% [9]. Это свидетельствует о том, что результаты лечения, полученные в рутинной общеклинической практике, находятся на самом низком уровне широкого диапазона опубликованных данных научных центров, выполняющих исследовательские проекты. В целом накопленный опыт свидетельствовал, что конвенциональная ЛТ способна улучшить медиану выживаемости на 5—7 мес по сравнению с нелеченными больными. При местно-распространенных опухолях в большинстве исследований достигнута 2-летняя выживаемость около 15%. Результаты работ, содержащих данные 4796 пациентов, получивших СОД более 40 Гр, показали, что 5-летняя выживаемость составила 7% [10]. Этот неудовлетворительный результат объясняется неспособностью излечения первичной опухоли и частым развитием отдаленных метастазов. Подтверждением первого положения является наличие остаточной местной опухоли после радикальной ЛТ, выявляемой при бронхоскопии у 85% больных [14], что является дополнительным аргументом в пользу необходимости усиления локорегионарного воздействия.
В большинстве случаев ведущей стратегией улучшения локального контроля является увеличение СОД, подводимой к опухоли. Обобщенные данные последних десятилетий свидетельствуют о несомненной важности СОД в качестве фактора ответа опухоли. При этом практически во всех этих исследованиях применяется конвенциональное облучение (РОД 1,8—2 Гр 5 дней в неделю в течение 5—7 нед). К сожалению, данное обстоятельство не всегда находит отражение в практическом применении; в исследовании RTOG 0617 было оценено увеличение СОД при стандартном фракционировании и одновременной химиотерапии [12]. При этом набор пациентов был досрочно прекращен из-за отсутствия выигрыша выживаемости при подведении высоких СОД (74 Гр за 37 фракций, длительность лечения более 7,5 нед) по сравнению со стандартной дозой облучения (60 Гр за 30 фракций в течение 6 нед).
Применение нетрадиционных режимов фракционирования является альтернативным подходом к увеличению биологической дозы, подводимой к опухоли при НМРЛ. В основе стандартного (традиционного, конвенционального) режима фракционирования лежит использование ежедневных однократных фракций 1,8—2 Гр 5 дней в неделю непрерывно в течение более 4 нед. К нетрадиционным режимам следует относить различные варианты гипофракционирования и гиперфракционирования, сплит-курсы, динамическое и ускоренное фракционирование.
Гипофракционирование
Режимы гипофракционирования позволяют сократить сроки лечения до 4—5 нед, в первую очередь за счет увеличения РОД. Изначально эти подходы использовались для увеличения пропускной способности аппаратуры и удобства больных благодаря сокращению сроков лечения. Накопленный опыт использования широкого спектра разработанных и всесторонне изученных вариантов гипофракционирования позволил внедрять более агрессивные режимы с дозами более 3 Гр 3—4 раза в неделю. Однако последние не показали улучшения результатов лечения, снизив частоту локального контроля заболевания и увеличив частоту поздних осложнений [13]. Радиобиологические предпосылки, основной из которых является предотвращение ускоренной репопуляции в процессе лечения за счет сокращения срока облучения, вполне приемлемые результаты и стоимость лечения способствовали широкому использованию метода [14]. В начале века схема 55 Гр за 20 ежедневных фракций, подведенных за 4 нед, была наиболее часто используемым режимом фракционирования в ряде стран [15]. Данный режим имеет биологический эквивалент дозы 65 Гр при конвенциональном облучении. Анализ его использования в качестве стандартного лечебного подхода у 609 пациентов с НМРЛ I—III стадии показал 50% 2-летней общей выживаемости, с низкой частотой осложнений 3—4-й степени [16]. Эти результаты вполне соответствуют другим опубликованным данным [17].
Гиперфракционирование
Этот режим основан на использовании небольших РОД (1—1,5 Гр), подводимых несколько раз в день. Общее число фракций увеличивается, сроки лечения зависят от количества и величины дневных фракций. Радиобиологической основой его применения является то, что большинство опухолей являются быстро пролиферирующей тканью, и подведение нескольких небольших фракций в день позволяет восстанавливаться здоровым тканям с сохранением высокоэффективного воздействия на опухоль. СОД может быть увеличена, если интервал времени между фракциями составляет 5—6 ч. Таким образом, использование данных режимов позволяет сочетать увеличенное воздействие на раковые клетки с сокращением риска развития поздних лучевых осложнений. Экспериментальными и клиническими исследованиями показано, что использование режимов гиперфракционирования позволяет безопасно увеличивать дозы ЛТ на 20—30% [21].
RTOG было проведено большое исследование II фазы (83−11) с целью выбора оптимальной СОД, в котором пациенты получали ЛТ в широком диапазоне — от 60 до 79,2 Гр. Исследования показали, что облучение до СОД 69,6 Гр демонстрирует лучшие результаты по сравнению с меньшими дозами, в то время как увеличение СОД не влияет на отдаленные результаты и увеличивает частоту осложнений [19]. В сравнительном исследовании RTOG 88−08 больные НМРЛ II—IIIВ стадии были разделены на три группы: получавшие традиционную ЛТ, традиционную ЛТ с индукционной ПХТ и ЛТ в режиме гиперфракционирования (1,2 Гр дважды в день до СОД 69,6 Гр). Показатели однолетней выживаемости и медиана составили 46% и 11,4 мес, 60% и 13,8 мес, 51% и 12,3 мес соответственно. Различия в показателях выживаемости не были статистически достоверны, что, возможно, связано с недостаточным числом включенных пациентов [20]. В качестве дальнейшей перспективы улучшения результатов авторы предполагают комбинирование режимов гиперфракционирования с химиотерапией. Результаты одного из исследовательских центров подтвердили, что режим гиперфракционирования хорошо переносится: медиана и 5-летняя выживаемость составляют 29 мес и 29% соответственно, демонстрируя значительное улучшение по сравнению с историческим контролем при обычной СОД 60 Гр в конвенциональном режиме [21].
Сплит-курс
Сплит-курс — использование ежедневных фракций по 2 Гр в течение 2—3 нед с перерывом 2—4 нед, предпринимаемым для восстановления нормальных тканей, и последующим продолжением лечения по той же схеме до запланированной СОД. Помимо процессов репарации в облучаемых здоровых тканях, окружающих новообразование, перерыв способствует реоксигенации опухоли, повышая ее радиочувствительность. Однако, несмотря на убедительность теоретических предположений, клинические данные не показали преимущества сплит-курса перед конвенциональным облучением [22, 23]. Кроме того, было показано негативное влияние на выживаемость и/или местный контроль при увеличении частоты постлучевых осложнений. Эти результаты стали свидетельством того, что потенциальные преимущества сплит-курса не способны нивелировать отрицательного влияния ускоренной репопуляции опухолевых клеток, развивающейся в конце перерыва в лечении, а использование больших доз облучения приводит к повышению риска развития поздних лучевых осложнений.
Ускоренные режимы ЛТ
Увеличение СОД при использовании конвенциальных режимов облучения значительно продлевает срок лечения, и ускоренная репопуляция опухоли становится серьезной проблемой их использования. Следовательно, увеличение времени лечения сводит на нет эффективность повышения подводимой к опухоли дозы. Гиперфракционирование создает необходимые условия для сокращения продолжительности лечения и создания условий для предотвращения репопуляции опухоли. D. Ball и соавт. [27] предпринята попытка сокращения лечения до 3 нед, ЛТ в РОД 2 Гр 2 раза в день до СОД 60 Гр. При промежуточном анализе у первых 100 рандомизированных больных было отмечено повышение частоты лучевых реакций, наиболее выраженных в виде эзофагита, его частота 3—4-й степени увеличилась с 9% при конвенциональном облучении до 35% при ускоренном, у 6 пациентов потребовалась дилатация стриктуры пищевода. Указанные обстоятельства определили резистентность слизистой оболочки пищевода основным сдерживающим фактором для использования данного режима Л.Т. Другим вариантом ускоренного облучения является гиперфракционирование, когда дневная доза подводится за 2 или 3 фракции с интервалом 5—6 ч, при этом РОД меньше, а дневная доза больше, чем фракции традиционного облучения 1,8—2,2 Гр. Подобный подход позволяет реализовать основные преимущества ускоренного и фракционированного облучения: сокращение сроков лечения и создание более благоприятных условий для восстановления нормальных тканей по сравнению с опухолевыми.
Были предложены варианты непрерывного лечения — continuous hyperfractionated accelerated radiotherapy (CHART) и с перерывами на выходные дни — continuous hyperfractionated accelerated radiotherapy — weekend less (CHARTWELL). Убедительным доказательством того, что ускоренные режимы лучевой терапии могут улучшить локальный контроль и повысить выживаемость, являются результаты большого рандомизированного исследования, сравнивающего непрерывное ускоренное гиперфракционирование (УГФ) и конвенциональное облучение. В исследование включили 563 больных, которые были рандомизированы в 2 группы: CHART (фракции по 1,5 Гр с минимальным интервалом между ними 6 ч 3 раза в день в течение 12 дней подряд до СОД 54 Гр) и конвенциальным облучением 2 Гр до СОД 60 Гр [28]. Показатели 2, 3 и 5-летней выживаемости группы конвенциального облучения составили 21, 13 и 7%, в группе УГФ — 30, 18 и 12% соответственно. Различия были более выражены для плоскоклеточного рака с показателями 3- и 5-летней выживаемости — 21 и 15% в группе гиперфракционирования, 11 и 7% в контрольной группе. Было также отмечено выраженное улучшение локального контроля и 9% снижение частоты отдаленных метастазов. Острые реакции чаще развивались при использовании непрерывного УГФ, в первую очередь за счет умеренной или тяжелой дисфагии: 49% против 19%. Важно отметить, что различий в частоте поздних осложнений не было. Использование режима УГФ в рутинной практике (n=583) подтвердило, что лечение переносится удовлетворительно, у 99% больных проведен запланированный курс и менее чем у 1% развились осложнения 4—5-й степени [29]. Медиана выживаемости при этом составила 16,2 мес, а 2- и 3-летняя выживаемость — 33,6 и 20% соответственно. Таким образом, воспроизводимость результатов оригинального исследования была подтверждена в обычной клинической практике. Основным недостатком CHART является трудность проведения лечения в выходные дни, для чего были разработаны режимы без лечения в выходные [27, 28]. Рандомизированные исследования, сравнивающие эти режимы с конвенциональным облучением, не показали существенных преимуществ CHARTWELL.
В клинике РНЦРХТ проведено исследование режима динамического фракционирования с изменением РОД на протяжении курса облучения (d =4 Гр, n=2; d =3 Гр, n=4; d =2 Гр, n=15) до изоэффективной дозы 60—70 Гр [29]. Авторами показаны преимущества нетрадиционного облучения на фоне цитостатической терапии навельбином по сравнению с конвенциональным облучением по показателям ответа опухоли и средней продолжительности жизни. Значимого увеличения частоты ранних и поздних постлучевых осложнений не выявлено. Отмечено сокращение сроков лечения больных, что может оказывать существенный экономический эффект.
Возможности эскалации дозы при нетрадиционных режимах фракционирования
Как уже было отмечено, распространенным подходом к увеличению частоты локального контроля, являвшегося целью многих исследований, было увеличение СОД. Такая возможность без увеличения риска осложнений появилась благодаря техническим достижениям в области диагностики, ЛТ и дозиметрического планирования. Так, использование трехмерной конформной ЛТ, прецизионное воздействие на опухолевый очаг и максимальное щажение здоровых тканей позволило снизить риск развития лучевых осложнений. На первых этапах в ходе изучения возможностей эскалации СОД использовали конвенциональное облучение с увеличением числа дневных фракций и продолжительности лечения. Небольшое повышение дозы до 64—66 Гр не показало улучшения показателей локального контроля опухоли или повышения выживаемости. В трех исследованиях с использованием более высоких доз (до 103 Гр), у больных с учетом предиктивных факторов легочных осложнений, показано, что эскалация СОД позволяет достичь лучших результатов [30, 31]. Анализ в подгруппах показал статистически значимое повышение выживаемости при подведении дозы 80 Гр и более [32].
Следует отметить, что эффективность эскалации дозы также снижается за счет ускоренной репопуляции клоногенов опухоли. Теоретически, нетрадиционные режимы ускоренного фракционирования обладают достаточной способностью решать эту проблему С. McGibney и соавт. [33] показали, что комбинация трехмерной конформной ЛТ с ограничением воздействия на здоровые ткани позволяет осуществлять эскалацию ЛТ в режиме CHART при сохранении оптимального воздействия на опухоль.
Режим CHARTWEL, подразумевающий подведение дозы 60 Гр по 1,5 Гр 3 раза в день, 5 дней в неделю, в течение 18 дней, и аналогичный режим, разработанный ECOG (3 дневных фракции 1,5, 1,8 и 1,5 Гр 5 дней в неделю, 57,6 Гр за 16 дней), продемонстрировали хорошие показатели локорегионарного контроля (55%) и 2-летней выживаемости (45%) [27, 34]. Также в исследованиях по эскалации дозы показано использование фракционирования 2 раза в день. G. Sibley и соавт. [34] при лечении фракциями по 1,6 Гр показали, что с применением конформной ЛТ возможно подведение доз до 80 Гр за 5 нед. De Ruysscher и соавт. [35] использовали дробление на фракции по 1,8 Гр до СОД 68,4 Гр за 25 дней. Другими авторами показано использование такого же фракционирования (1,8 Гр) при индивидуализации подведения максимально допустимой дозы, исходя из толерантности нормальных тканей [36]. У 29 больных показано, что средняя СОД, при которой не развивается тяжелых лучевых осложнений, составляет 63 Гр (диапазон 46,9—79,2 Гр). В других опубликованных исследованиях I—II фазы по эскалации дозы применяли ускоренные режимы гипофракционирования. Так, сообщено о проведении ЛТ до СОД 72 Гр (24 фракции по 3 Гр за 5 нед) у больных НМРЛ I—IIIB стадии [38]. Авторы показали, что лечение хорошо переносится и лучевых осложнений 3—4-й степени не отмечено. Следующее исследование показало максимально переносимую дозу, получаемую в течение 6 нед у пациентов с НМРЛ [39]. Больные начинали лечение по 2,25 Гр в день за одну фракцию, при подведении более чем 30 фракций облучение проводилось 2 раза в день. В зависимости от средней полученной дозы на легкое пациенты были разделены на пять групп риска. Исследование показало безопасное увеличение дозы до 74,25 Гр в группе высокого риска (наибольший объем облучения) и 94,5 Гр в группе низкого риска (наименьший объем облучения).
В ходе накопления клинических данных было показано, что выходные оказывают большее, чем ожидалось, влияние на репопуляцию опухолевых клеток и эти перерывы могут нивелировать преимущества ускоренных курсов Л.Т. Для преодоления указанных трудностей были разработаны режимы с эскалацией дозы (CHART-ED), применявшиеся как за рубежом (лечение проводится в выходные, начиная с 3-й недели, больных облучают 2 раза в день по 1,8 Гр в 15, 16 и 17-й дни), так и в России [40].
Объединенной группой исследователей был проведен мета-анализ, целью которого являлась сравнительная оценка эффективности нетрадиционных режимов фракционирования в лечении неоперабельных больных раком легкого. При анализе результатов лечения 2000 больных были выявлены преимущества модифицированных режимов ЛТ: повышение 5-летней выживаемости на 2,5% (отношение рисков=0,88, 95% ДИ 0,80—0,97; р=0,009). Использование ускоренных режимов и гиперфракционирование сопровождались увеличением частоты эзофагитов без усиления других видов токсичности [42].
Заключение
Таким образом, в онкологическом сообществе назрела необходимость более широкого исследования ускоренных режимов Л.Т. На сегодняшний день неудачи большого количества исследований, обусловленные трудностями набора, скорее всего, означают, что проведение рандомизированных исследований III фазы по изучению радикальной ЛТ, сравнивающих различные режимы фракционирования, является недостижимой целью [43]. Тем не менее важно продолжать развивать доказательную базу по использованию режимов нетрадиционного фракционирования и проводить кооперированные исследования, основываясь на уже имеющемся опыте.
Конфликт интересов отсутствует.
Уникальные технологии в онкологии
Учитывая возросший поток обращений от пациентов, мы, специалисты Онкологических центров и Научно-исследовательских институтов:
— ФГБУ НМИЦ им. Н.Н.Блохина ( онкологический центр на Каширке ),
— НИИ имени Н. Бурденко,
— Институт биологии гена Российской академии наук,
— ФГБУ Институт молекулярной генетики РАН,
создали Общественное объединение для организации инновационного и экспериментального лечения рака.
Наши возможности
— терапия новыми препаратами — для тех, кому не помогает химиотерапия;
— отслеживаем появление новых препаратов в онкоклиниках США и Японии;
— доставим новые препараты из клиник США и Японии;
— получим лицензию и все необходимые документы на производство в РФ запатентованных за рубежом лекарственных средств.
Клеточная терапия уже в Москве
Новая методика позволяет лечить больных даже с тяжелой формой рака. В настоящее время онкологический центр на Каширке имеет возможность проводить экспериментальное лечение рака с помощью новых препаратов даже для больных с 4 стадией рака , продлить жизнь и улучшить ее качество, а в некоторых ситуациях даже полностью вылечить пациента.
Этапы лечения пациента включают в себя проведение диагностики, постановку точного диагноза, подбор наиболее результативного метода лечения, а также контроль эффективности проводимой терапии.
Если по месту своего проживания вы проходите терапию, но результатов она не приносит, предлагаем принять участие в экспериментальном лечении рака инновационными препаратами. Ключевая диагностика проводится на базе отделений онкологического центра на Каширке (Онкоцентра им. Н. Блохина), что обеспечивает абсолютный контроль над состоянием пациента, а также позволяет контролировать результат лечения.
Если химиотерапия не дала результата

Терапия лекарственными препаратами на основе клеточных технологий открывает возможности полностью излечить онкологическое заболевание, которое раньше не поддавалось лечению. Экспериментальное лечение рака на основе клеточных препаратов показали более лучший результат, чем применение химиотерапии при заболеваниях: рак легких 4 стади, метастазы печени, меланома, и некоторых других.
Генноклеточные лекарственные препараты имеют значительные перспективы и способны уничтожать распространение опухолевых клеток в 20% случаев. Стоит отметить, применение биологических вакцин получило высочайшую оценку экспертов Клиник «Сайсэй Мирай» г.Токио и Комплексного центра по исследованию рака «Georgetown Lombardi» г. Вашингтон.
Кто принимает участие в разработке новых препаратов
— Институт биологии гена РАН. Разработка препаратов: противоопухолевые цитотоксические белки ЛАК-клеток, цитотоксические Т-лимфоциты, противоопухолевые цельноклеточные генно-модифицированные вакцины;
— Центр биомедицинских исследований «Генериум», фармкомпании «Биокад» и «Рош» и некоторые другие Научно- исследовательские институты РАН.
О преимуществах программы
Основным достоинством в рассматриваемых программах КИ выступает доступ к современным методам, а также возможность проводить терапию редкими препаратами, не зарегистрированными на сегодняшний день в РФ. Купить такие средства в аптеке невозможно, несмотря на то, что некоторые из них благополучно используются в США и Европе уже достаточно долго.
В каких случаях рак лечится?

Если имеют место распространенные метастазы, то традиционная терапия не дает положительного результата. Согласно статистике, в России более 30% людей, заболевших раком, умирают уже в течение первого года после диагностирования болезни, при этом в 90% из этих случаев причиной являются метастазы в разные органы.
Российские ученые полагают, что более половины людей с запущенной формой рака не получают лечения из-за нежелания онкологов проводить терапию и определения таких пациентов в категорию неизлечимых.
Каждый пациент сталкивается с тем, что химиотерапия на 3 и 4 стадиях перестает уменьшать опухоль и метастазы. Это показатель к тому, что пора переходить на более современные методы терапии рака.
Для подбора эффективного метода лечения вы можете обратиться за
На консультации обсуждаются:
— методы инновационной терапии;
— возможности участия в экспериментальной терапии;
— как получить квоту на бесплатное лечение в онкоцентр;
— организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
 Главная
Главная Консультация онколога
Консультация онколога Что мы лечим
Что мы лечим Карта сайта
Карта сайта Контакты
Контакты
- Чем рискуют
лежачие больные Почему повышается концентрация глюкозы и происходит нарушение кальциевого и азотного баланса.
Почему повышается концентрация глюкозы и происходит нарушение кальциевого и азотного баланса. - С какой скорость
растет опухоль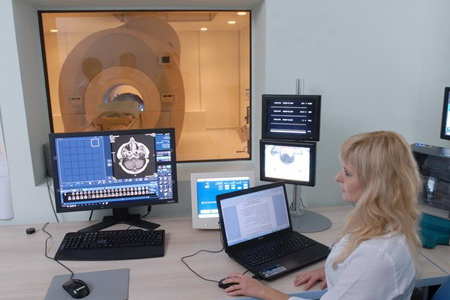 Гибель организма при злокачественном новообразовании возникает вследствие…
Гибель организма при злокачественном новообразовании возникает вследствие… - По каким причинам рак может вернуться?
 Как уменьшить вероятность появления рецидивов. В чем ключевая роль иммунной системы.
Как уменьшить вероятность появления рецидивов. В чем ключевая роль иммунной системы. - Эффективное лечение
рака Какие виды рака не поддаются излечению и какие экспериментальные методы наиболее перспективны
Какие виды рака не поддаются излечению и какие экспериментальные методы наиболее перспективны - Как узнать поможет
ли химиотерапия Анализ на молекулярный биомаркер наиболее точен чем гистологическое или иммуногистохимическое исследование
Анализ на молекулярный биомаркер наиболее точен чем гистологическое или иммуногистохимическое исследование - Секреты иммунотерапии
рака При восстановлении функций иммунитета появляется возможность уничтожить опухолевую ткань.
При восстановлении функций иммунитета появляется возможность уничтожить опухолевую ткань. - Как убить
раковую клетку Как добиться равновесия между противоопухолевой эффективностью химиотерапии и активностью иммунной системы.
Как добиться равновесия между противоопухолевой эффективностью химиотерапии и активностью иммунной системы. - Помощь
тяжелобольным Возможно спасти и значительно продлить жизнь, если вовремя выявить неотложные онкологические состояния.
Возможно спасти и значительно продлить жизнь, если вовремя выявить неотложные онкологические состояния.
Чего Боится Раковая Опухоль?

Орегано, шалфей, майоран, мята и мелисса, укроп и петрушка, эстрагон и другие пряности имеют противораковое действие благодаря наличию насыщенного зеленного оттенка; ячмень – наличие фермента супероксиддисмутаза разрушает свободные радикалы, способствующие росту раковых клеток.
Что останавливает рост раковых клеток?
Исследования показывают, что треть всех случаев онкологии напрямую связаны с пятью основными факторами риска, которые человек может самостоятельно исключить из своей жизни. Это употребление алкоголя, табака, избыточная масса тела, неправильное питание и отсутствие физической активности.
- Убрав из привычной жизни лишь эти вредные факторы человек на 30-40% способен снизить вероятность заболеть онкологией.
- Самый мощный канцероген — табачный дым.
- Он содержит более 60 сильнейших ядов, способных повредить генетический материал клетки.
- Именно никотин виновник почти 22% всех случаев смерти от онкологии.
«Табачный дым вызывает паралич реснитчатого эпителия, и вредные вещества начинают оседать на поверхности бронхов трахеи. В этих местах возникает химический ожег, возникает воспалительный процесс, который носит затяжной характер. В конечном счете под воздействием канцерогенных веществ развиваются злокачественные опухоли», — пояснил главный внештатный онколог министерства здравоохранения Пензенской области Алексей Трунов.
- Онкопроцессу подвержены все органы, которые на своем пути встречает табачный дым, — губы, язык, ротовая полость.85% рака гортани, легких, трахеи и бронхов развивается из-за постоянного долговременного воздействия табачных канцерогенов.
- Поражаются органы, через которые организм выводит вредные токсины, — пищевод, поджелудочная железа, мочевой пузырь и почки.
Наследственность виновата в развитии рака только лишь в 10% случаев. Бактерии и вирусы отвечают тоже за каждый десятый случай возникновения рака. Самые канцерогенные инфекции — вирусы папиломы человека, гепатита А, В, С, Эпштейна-Барр и бактерия Хеликобактер пилори.
- «Особое место в развитии рака желудка занимает хеликобактер пилори.
- Данная бактерия устойчива к кислой среде и может выживать и колонизировать в слизистой желудка, вызывая в ней воспаление, которое в дальнейшем развивается в гастрит, язвенную болезнь.
- При длительном течении язвенная болезнь может переходить в злокачественную опухоль, то есть в рак», — добавил врач.
Единственный способ обезопасить себя — выявить бактерию, пролечить заболевание или привиться от других возможных инфекций. Постоянное воздействие алкоголя может сформировать опухоли в тех органах и системах, через которые яд регулярно поступает в организм.
Более того отсутствие движения способствует развитию опухолей. «Из-за слабости мышц брюшного пресса, из-за недостаточного количества клетчатки в принимаемой пище в кишечнике скапливаются вредные вещества. Они всасываются в кровь и вызывают отравление организма», — отметил онколог. Регулярные физические нагрузки способны заставить организм работать правильно и выводить токсины, поэтому специалисты рекомендуют каждый день не менее 30 минут активных тренировок или совершать не менее 10 тыс.
шагов. «Именно 10 тыс. шагов, потому что за это время организм как раз тратит те лишние 300 килокалорий, которые люди накапливают при сидячем образе жизни», — рассказала ГТРК «Пенза» главный внештатный специалист по медицинской профилактике министерства здравоохранения региона Ирина Пузракова.
Что кормит раковые клетки?
Сахар является главной пищей раковых клеток. Отключив сахар, отсекается важнейший путь поставки питания раковым клеткам.
Какие орехи убивают раковые клетки?
Как заявил врач Уильям Ли, одним из лучших продуктов, способных предотвратить развитие рака, являются орехи, в частности, грецкие, миндаль, фундук, кешью, фисташки и бразильские орехи, потому что они содержат противораковые полифенолы, которые укрепляют иммунную систему в борьбе с раком.
Помимо этого в них содержатся полезные жирные кислоты омега-3. Следующим продуктом, который следует употреблять в пищу, являются помидоры, которые доктор Ли назвал «вкусным средством против рака». Он уточнил, что его «сила» связана с ликопином — веществом, уничтожающим рак. Он отдельно выделил помидоры сорта Сан Марцано, поскольку там ликопин содержится в самых высоких концентрациях.
Еще один хороший продукт в борьбе с раком — фиолетовый картофель, который содержит природное химическое вещество антоцианин. Антоцианин «морит голодом и убивает раковые клетки и уничтожает стволовые клетки рака», заявил эксперт. И последнее, но не менее важное – устрицы.
Что убивает раковые клетки в организме?
Орегано, шалфей, майоран, мята и мелисса, укроп и петрушка, эстрагон и другие пряности имеют противораковое действие благодаря наличию насыщенного зеленного оттенка; ячмень – наличие фермента супероксиддисмутаза разрушает свободные радикалы, способствующие росту раковых клеток.
Можно ли есть бананы при раке?
Некоторые продукты питания, в том числе фрукты, содержат полезные для здоровья соединения, которые могут замедлять рост опухоли и уменьшать некоторые побочные эффекты лечения, облегчая путь к выздоровлению. Когда человек лечится или выздоравливает от рака, выбор продуктов питания становится особенно важным.
- В частности, методы лечения рака, те же химиотерапия и облучение, могут вызывать множество побочных эффектов, которые способны ухудшаться или улучшаться в зависимости от того, что пациент ест и пьет.
- Включение в рацион фруктов при заболевании раком помогает снабжать организм витаминами, минералами и антиоксидантами, которые могут укреплять его, помогать легче переносить непростой период терапии.
Апельсины. Один средний апельсин вполне способен удовлетворить ежедневную потребность организма в витамине С. Данный витамин играет ключевую роль в работе иммунитета, и так же он эффективно поддерживает иммунную систему во время и после лечения рака. Витамин С может уменьшать рост и распространение раковых клеток, а, кроме того, действовать как терапевтическое средство против некоторых видов рака.
Вдобавок он повышает усвоение железа из пищи, что важно для профилактики анемии — распространенного побочного эффекта химиотерапии. В сущности, раковым пациентам будут полезны все цитрусовые. Бананы. Эти фрукты могут быт отличным диетическим дополнением для тех, кто выздоравливает от рака. В отличие от многих твердых плодов, бананы не вызывают проблем с жеванием и глотанием (трудности с этим могут стать следствием болезни или побочным эффектом лечения рака).
При этом бананы снабжают организм многими важными для его восстановления питательными веществами, включая витамин B6, марганец и витамин С. Еще бананы содержат клетчатку, называемую пектином, которая может быть особенно полезна для тех, кто испытывает диарею, вызванную лечением рака.
- В свою очередь, исследования в пробирке показали, что пектин может помочь организму защититься от роста и развития клеток рака толстой кишки.
- Калий, которого много в бананах помогает восполнить электролиты, потерянные в результате диареи или рвоты, возникающих на фоне терапии.
- Грейпфруты.
- Помимо высоких концентраций витамина С, провитамина А и калия, грейпфруты богаты ликопином — каротиноидом с сильным противораковым действием.
Читайте также: Какая Ангина Самая Опасная?
Ряд исследований показывают, что употребление ликопина может уменьшать некоторые негативные побочные эффекты лечения рака (химиотерапии и облучения). В то же время грейпфруты известны своей способностью влиять на усвоение лекарств. Их употребление обязательно нужно согласовывать с врачами.
- Яблоки. Клетчатка, содержащаяся в яблоках, способствует активному движению желудочно-кишечного тракта и предотвращает запоры, являющихся одним из последствий лечения рака.
- Помимо этого, яблоки – богатый источник калия, который влияет на ваш баланс жидкости и не позволяет ей задерживаться в тканях (отечность является распространенным побочным эффектом некоторых видов химиотерапии).
Наконец, витамин С, которого тоже много в яблоках, действует как антиоксидант, поддерживающий иммунную функцию и борющийся с ростом раковых клеток.
Можно ли есть сладкое при раке?
Способствует ли потребление сахара росту раковой опухоли? — Теперь стоит разобраться, оказывает ли губительное влияние сладкое при онкологии, которая уже была обнаружена и подтверждена. Многие больные полностью отказываются от употребления сахара из-за страха усугубить положение, вдобавок отказываясь от хлеба и фруктов.
Такой миф начал распространятся после того, как ученный Отто Варбург высказал мнение о том, что в основе питания каждой клетки лежит именно глюкоза, а раз раковые клетки развиваются в несколько раз быстрее, то и этого вещества им нужно больше. После такого утверждения многие пациенты стали считать, что сладкое и рак это тесно связанные понятия, и посчитали правильным лишить опухоль источника энергии.
Ответить на вопрос «можно ли при раке есть сладкое», поможет следующее объяснение: Для постоянного обеспечения хорошей работоспособности тканей, органов, нервных клеток и головного мозга, уровень сахара в организме всегда держится относительно постоянный.
Его показатели могут меняться в зависимости от того какие продукты были съедены, но такие изменения носят слабый и кратковременный характер, естественно, если не происходит чрезмерного злоупотребления сахаром на постоянной основе. Если запас глюкозы начнет истощаться, то организм способен получить ее из других веществ, таких как белки или жиры.
Это значит, что раковая клетка в любом случае получит свою порцию питания, даже при полном отказе от сахара. Из этого следует вывод, что во время рака можно есть сладкое. Самое главное в этот период это обеспечит себе полный рацион, включающий в себя все важные элементы, чтобы поддерживать свое здоровье на нужном уровне.
Можно ли есть сметану при онкологии?
Лев Кругляк Лечебное питание при раке: Существует ли альтернативная «раковая» диета? Введение Ежегодно в мире от рака умирает около пяти миллионов человек, а перед теми девятью миллионами больных, у которых впервые выявлены злокачественные новообразования, стоит сложная задача выживания.
По некоторым данным, примерно каждый четвертый житель нашей страны в течение жизни встречается с этой грозной патологией. Согласно другим исследованиям, в двух из трех семей имеются родственники, страдающие онкологическим заболеванием. Злокачественные опухоли занимают второе место среди причин смертности населения.
В 2000 году в России 13,9 % мужчин и 13,6 % женщин умерли от различных форм рака. Согласно демографическим показателям, наше общество стареет, следовательно, можно ожидать дальнейший рост злокачественных опухолей. К тому же уже сейчас регистрируется ежегодный прирост подобных заболеваний на 1–2%.
- Большинство заболевших раком старше 60 лет.
- Пожилые люди, как правило, имеют серьезные патологии внутренних органов (сердца, легких, почек, печени).
- Многие страдают от диабета, гипертонии, хронических болей в связи с артрозами суставов, развитием остеопороза.
- Все это зачастую вызывает у больных депрессию, а выявленные злокачественные новообразования усугубляют состояние здоровья.
Всем известно, что для выздоровления очень важно иметь позитивный настрой и большое желание победить болезнь. Добиться этого можно только лишь совместными усилиями врачей, родственников и самих больных. Когда человеку впервые сообщают, что у него рак, он чувствует, что его мир рушится.
Он боится преждевременной смерти и тех страданий, которые приносит недуг. Он переполнен страхом, не зная ни особенностей течения заболевания, ни прогноза. Страшит не только смерть, но и упадок сил, продолжительная болезнь, вынужденная неподвижность, беспомощность и, наконец, необходимость постороннего ухода.
У таких людей появляется бессонница, пропадает интерес к окружающему миру. Душевные страдания чреваты социальной изоляцией, они отражаются на родственниках и близких больных. Напряженные отношения ведут в ряде случаев к разрушению семьи. Истинное состояние пациента, соответствующее результатам медицинского обследования, во многом недооценивается.
Не стоит забывать, что выявление рака на ранней стадии позволяет полностью избавиться от болезни и в дальнейшем вести активную, полнокровную жизнь. А в тех случаях, когда первоначально сложно определить исход заболевания, следует знать, что ни один врач зачастую не может предсказать течение болезни, а значит, у больного почти всегда есть надежда на выздоровление.
До появления явных признаков злокачественной опухоли обычно проходит много времени, при этом на организм воздействуют различные факторы. Наряду с генетическим и постоянным эндогенным (внутренним) влиянием важную роль играют факторы окружающей среды. Питание – это одна из спорных и наиболее часто обсуждаемых тем.
Какие фрукты можно есть при раке?
Питание при раке составляется с применением таких полезных продуктов: —
- Считается, что желтые, оранжевые и красновато-оранжевые фрукты и овощи содержат в своем составе каротиноиды, которые характеризуются благоприятным действием против рака. В первую очередь это: абрикосы, цитрусы, морковка, помидоры, кабачки. Бета-каротин, лютеин, ликопен улучшают иммунитет, оберегают клеточную структуру от радиационного излучения.
- При поражении печени питание должно быть дробным без жирной и тяжелой пищи, включать достаточное количество витаминов, белков, которые легко усваиваются, микроэлементов и клетчатки.
- Брокколи, редис, цветную и брюссельскую капусту, репу, горчицу относят к крестоцветным овощам, которые имеют индол — активный элемент, способствующий очищению печени и нейтрализации вредных химических факторов.
- Некоторые разновидности зеленых растений богаты хлорофиллом, поэтому включение их в питание при раке помогает против аномальных элементов и микробов. К таким представителям относят сине-голубые и одноклеточные зеленые водоросли, зеленый горошек и горчицу, побеги одуванчика, капусту, листья крапивы.
- Различными укрепляющими свойствами знаменит зеленый чай.
- Противоопухолевое действие и стимулирование к детоксикации оказывают ананас, брокколи и чеснок. Они уменьшают вероятность развития нитрозоиндуцированной онкологии.
- При раке груди рекомендуется увеличить потребление витамина D, отрубей, цельнозерновых злаковых и их ростков, бобов, отрубей.
- Эллаговую кислоту, которая препятствует оксидации в мембранах клеток и считается хорошим антиоксидантом, содержат: малина, виноград, клубника, земляника, гранат, черника.
- Фрукты и овощи синего, красного или сиреневого цветов включают антоцианиды — антиоксиданты, которые активизируют защиту организма, снижают действие влияние свободных радикалов, вирусных агентов и канцерогенов, выводят вещества включающие продукты химического распада и вредные элементы. К представителям этой группы относят: синюю капусту, вишню, свеклу, разные виды винограда, ежевику, чернику.
- При онкологии поджелудочной железы нельзя есть некоторые полезные продукты. Например, финики, бананы и виноград. Эффективное действие окажут нежирные молочные продукты.
Читайте также: Какие Спреи Эффективны При Тонзиллите?
Ученые выяснили, что диета и питание при лечении рака, которая содержит коричневые морские (также известна как японская ламинария) и сине-зеленые водоросли, способствует уменьшению размера опухоли. Хорошее действие оказывают различные свежевыжатые соки и морсы.
- Питание больных раком обязательно должно включать еду, в составе которой есть омега-3-жирные кислоты.
- Лучшим примером служат рыбий жир и морская рыба жирного типа.
- Также важные кислоты содержатся в льняном масле и семени.
- Обязательно нужно поддерживать в кишечном тракте благоприятную микрофлору.
- Чтобы ее обеспечить, врачи рекомендуют включить в повседневный рацион оптимальное количество спаржи, чеснока, помидоров, лука, проросшей пшеницы.
Если нужно вызвать слабительный эффект, то можно использовать чернослив.
Какое масло убивает раковые клетки?
В новейшем лабораторном исследовании было показано, что лауриновая кислота (кокосовое масло на 50% состоит из лауриновой кислоты) убивает более 93% опухолевых клеток, вызывающих рак толстого кишечника у человека (Caco-48) после 48 часов лечения. Интересен тот факт, что лауриновая кислота токсична для раковых клеток и одновременно вызывает глубокий оксидативный стресс, вместе с тем снижая уровень глутатиона (который как раз необходим для собственной защиты раковых клеток от растущего оксидативного стресса).
- В то время как противоопухолевый потенциал кокосового масла только изучается, многие другие его полезных для здоровья свойств хорошо известны.
- Масло придает противовирусный, антибактериальный, противогрибковый и антипаразитарный эффекты, способствует пищеварению и активизирует метаболизм печени, уменьшает воспаление, благоприятно сказывается на здоровье кожи и быстро заживляет повреждения кожи при наружном нанесении.
Данные исследования не утверждают, что кокосовое масло — панацея от рака, но означают, что существует множество естественных путей борьбы с раком. И чем больше мы проводим исследований в этой области, тем больше натуральных методов коррекции и профилактических мероприятий по борьбе с болезнями нам становится известно.
Какие сухофрукты можно при онкологии?
Сушеные фрукты и риск рака — Систематический обзор 16 обсервационных исследований, опубликованных в период с 1985 по 2018 год, был проведен для оценки возможности какой-либо связи между традиционным потреблением сухофруктов и риском рака у людей ( Моссин В.В.
Существует обратная связь между потреблением сухофруктов и риском рака. Увеличение потребления сухофруктов, таких как изюм, инжир, чернослив (сушеные сливы) и финики, до 3-5 или более порций в неделю может быть полезным для снижения риска таких видов рака, как рак поджелудочной железы, простаты, желудка, мочевого пузыря и толстой кишки. Основываясь на рассмотренных исследованиях, его потребление не показало защитных эффектов в отношении рака легких или риска рака груди. Потребление сушеных фруктов так же эффективно, как и потребление свежих фруктов, в снижении риска рака.
Сухофрукты богаты клетчаткой, минералами и витаминами, обладают антиоксидантными и противовоспалительными свойствами. Сушеные фрукты, такие как изюм, также могут контролировать уровень сахара в крови. Относительно меньшая порция сухофруктов по сравнению со свежими фруктами может дать те же преимущества, что и употребление свежих фруктов.
- Доклинические исследования также указывают на положительное влияние чернослива / сушеной сливы на сохранение полезной микробной среды и метаболизм в толстой кишке, что способствует снижению риска рака толстой кишки (Derek V Seidel et al, Biochemistry and Molecular Biology, 2017).
- Хотя есть исследования, показывающие, что потребление сушеных фруктов может снизить риск рака, необходимы дополнительные исследования, чтобы установить этот факт.
Но суть в том, что употребление сушеных фруктов может дополнять свежие фрукты и может быть полезным для профилактики рака и общего состояния здоровья и благополучия. Какую пищу вы едите и какие добавки принимать — это ваше решение. Ваше решение должно включать рассмотрение мутаций гена рака, типа рака, продолжающегося лечения и добавок, любых аллергий, информации об образе жизни, весе, росте и привычках.
Планирование питания при раке из аддона не основано на поиске в Интернете. Он автоматизирует процесс принятия решений на основе молекулярной науки, внедренной нашими учеными и разработчиками программного обеспечения. Независимо от того, хотите ли вы понять лежащие в основе биохимические молекулярные пути или нет — для планирования питания при раке это понимание необходимо.

Начните СЕЙЧАС с планированием питания, ответив на вопросы о названии рака, генетических мутациях, текущих методах лечения и добавках, любых аллергиях, привычках, образе жизни, возрастной группе и поле. Больным раком часто приходится иметь дело с разными побочные эффекты химиотерапии которые влияют на качество их жизни и ищут альтернативные методы лечения рака.
Почему клетка становится раковой?
Всемирный день борьбы с раковыми заболеваниями, отмечаемый 4 февраля, — это ежегодное мероприятие, организуемое с 2005 года «Международным союзом по борьбе с онкологическими заболеваниями» (Международный союз против рака) (UICC). Цель этого международного дня — повышение осведомлённости о раке как об одном из самых страшных заболеваний современной цивилизации, привлечение внимания к предотвращению, выявлению и лечению этого заболевания.
Каждый год, начиная с 2008, этот день обозначен определенной темой. Онкологическое заболевание — это всегда трагедия. Не секрет, что рак является одной из ведущих причин смерти во всем мире, каждый год раковые образования появляются у полумиллиона человек. Только подумайте: ежегодно около 500 тысяч людей узнают о том, что больны.
И возможно, неизлечимо. Но специалисты заявляют о том, что в наше время хорошо известны причины возникновения раковых заболеваний, и это дает возможность предотвратить примерно одну треть новых случаев. При обнаружении раковой опухоли на ранних стадиях возможно успешное лечение.
Кроме того, методы борьбы с онкологическими заболеваниями ежегодно совершенствуются, и, возможно, спустя какое-то время появятся вакцины и способы лечения всех видов этого страшного заболевания. А пока стоит помнить главное: при обнаружении раковой опухоли на раннем этапе болезнь еще можно победить. Поэтому врачи советуют не пренебрегать профилактикой.
советуют не пренебрегать профилактикой. А профилактика — это не только регулярные визиты к доктору и медицинские осмотры. Это еще и отказ от вредных привычек, здоровый образ жизни. Около 30% случаев смерти от рака вызваны пятью основными факторами риска, которые связаны с поведением и питанием, такими как: •высокий индекс массы тела, •недостаточное употребление в пищу фруктов и овощей, •отсутствие физической активности, •употребление табака •употребление алкоголя.
- При этом, главное внимание по- прежнему уделяется следующим задачам: 1.
- Выбор здорового образа жизни.2.
- Ранняя диагностика.3.
- Качество жизни.4.
- Лечение для всех.
- В 2019 году Всемирный день борьбы с раковыми заболеваниями проводится под девизом «ЭТО Я И Я БУДУ», призывая осмыслить то, что может сделать каждый в борьбе против этой болезни и внести свой вклад в кампанию против рака.
Читайте также: Когда Можно Чистить Зубы После Удаления Зуба?
Что такое рак? О том, что рак – смертельное заболевание, знали еще древние египтяне. Название этой болезни придумал знаменитый врач древности Гиппократ, который заметил сходство формы раковой опухоли с крабом. Рак – это общее обозначение более чем 100 болезней, которые могут поражать любую часть организма.
Все типы рака зарождаются на том этапе, когда клетки тела начинают расти бесконтрольно. Дело в том, что здоровые клетки организма растут, делятся и умирают упорядоченно. Еще в детстве клетки делятся и растут бурно, но когда человек взрослеет, процесс деления и роста замедляется, и клетки размножаются только для восстановления повреждений и замены изношенных или умирающих клеток.
Раковые же клетки вместо того, чтобы умереть, продолжают всё также расти и размножаться.
Можно ли работать физически при онкологии?
Физические нагрузки ‒ важное «подспорье» для борьбы с болезнью, как на физиологическом, так и на психологическом уровне. Если раньше о спортивных упражнениях говорилось как о способе профилактики рака, то в последнее время ученые делают акцент на их эффективности для онкологических больных.
- Существует стереотип, что людей, заболевших раком надо всячески оберегать от нагрузок.
- Исследования Американского общества по борьбе с раком (American Cancer Society) показывают: физические упражнения не только неопасны в период лечения рака, но и способны ослабить симптомы болезни и улучшить качество жизни.
Не редко на фоне онкологического заболевания возникают слабость, ощущение усталости, апатия и т.д. Кроме того, методы лечения порой отнимают массу сил и энергии. Однако, полное бездействие может усугублять ослабление организма, вести к атрофии мышц и прочим осложнениям.
Как утверждают в «Macmillan Cancer Support» — крупнейшей благотворительной британской организации, обеспечивающей медицинскую и информационную поддержку онкологических больных, физические нагрузки во время лечения и реабилитации снижают частоту многих побочных явлений (таких как усталость, стресс, депрессия и снижение веса, ослабление костей и снижение мышечной массы, ухудшение сна, потеря веса и аппетита, запоры).
Умеренные физические нагрузки снижают риск осложнений со стороны сердечно-сосудистой системы, вызываемые действием некоторых химиотерапевтических препаратов и лучевой терапии. Дозированные нагрузки рекомендуются даже во время прохождения химиотерапии, несмотря на то, что она сопровождается, как правило, синдромом хронической усталости.
Сколько в человеке раковых клеток?
Ученые проследили путь генетической мутации, приводящей к онкологии, и установили, каким может быть период от первых раковых клеток до проявления болезни. Задолго до диагноза Известно, что возраст – наиболее важный фактор риска рака. На момент постановки диагноза, средний возраст больных порядка 66 лет.
- При этом факт обнаружения рака является кульминацией многих лет незаметного развития опухоли в организме.
- Когда же впервые возникает рак? Ответ на этот вопрос нашли гарвардские ученые в своем новом исследовании.
- Они пришли к выводу, что в некоторых случаях первоначальная мутация, вызывающая рак, могла появиться в организме еще за 40 лет до постановки окончательного диагноза! Дело в мутации Реконструируя историю происхождения раковых клеток, ученые вычислили, когда впервые появилась генетическая мутация, которая привела к заболеванию у двух человек.
У 63-летнего пациента это произошло примерно в 19 лет, а у 34-летнего в 9 лет. — В обоих случаях для проявления заболевания потребовались десятилетия, что удивительно, — сказал соавтор исследования Саханд Хормоз. Полученные данные подтверждают, что рак медленно развивается в течение длительного времени, прежде чем проявиться как заболевание.
- Как отмечают авторы, эти результаты могут послужить основой для новых подходов к раннему выявлению, профилактике или лечению онкологических заболеваний.
- В геометрической прогрессии Ученые впервые смогли реконструировать эволюцию раковых клеток, что позволило узнать историю прогрессирования заболевания.
— Изначально есть одна клетка, которая имеет мутацию. И в следующие десять лет будет всего около 100 раковых клеток. Но со временем их число растет в геометрической прогрессии и становится тысячами и тысячами! Мы это узнали впервые, — сказал Саханд Хормоз.
Источник https://www.mediasphera.ru/issues/onkologiya-zhurnal-im-p-a-gertsena/2016/2/112305-218X20150211
Источник http://tumor-clinic.ru/
Источник https://a1med.by/sovety/chego-boitsya-rakovaya-opuhol.html