Диффузная В-крупноклеточная лимфома у взрослых. Клинические рекомендации.
ВДХТ с аутоТГСК – высокодозная химиотерапия с последующей трасплантацией аутологичных гемопоэтических стволовых клеток.
ПМВКЛ — первичная медиастинальная В-крупноклеточная лимфома
ЦНС – центральная нервная система
ПЭТ – позитронно-эмиссионная томография
Термины и определения
Первичная медиастинальная В-крупноклеточная лимфома (ПМВКЛ) относится к первичным экстранодальным опухолям и происходит из В-клеток мозгового слоя вилочковой железы.
Диффузная В-крупноклеточная лимфома (ДВКЛ) является гетерогенной группой лимфатических опухолей с различными клиническими, морфологическими, иммунофенотипическими, цитогенетическими проявлениями и с разным ответом на терапию. Субстратом опухоли являются крупные В-лимфоидные клетки с выраженным атипизмом и полиморфизмом, с размером ядра в два и более раз превышающим размер ядра малого лимфоцита. Опухолевые клетки в большинстве случаев располагаются диффузно, но могут быть и разбросанными среди зрелых В-лимфоцитов, иногда на фоне Т-клеточного окружения, или формировать очаговые скопления [1-3].
Нодальная ДВКЛ – заболевание с первичным и преимущественным поражением лимфоузлов
Экстранодальная ДВКЛ – заболевание с первичным поражением любого органа, кроме лимфоузлов
1. Краткая информация
1.1 Определение
ДВКЛ является гетерогенной группой лимфатических опухолей с различными клиническими, морфологическими, иммунофенотипическими, цитогенетическими проявлениями и с разным ответом на терапию. Субстратом опухоли являются крупные В-лимфоидные клетки с выраженным атипизмом и полиморфизмом, с размером ядра в два и более раз превышающим размер ядра малого лимфоцита. Опухолевые клетки в большинстве случаев располагаются диффузно, но могут быть и разбросанными среди зрелых В-лимфоцитов, иногда на фоне Т-клеточного окружения, или формировать очаговые скопления.
1.2 Этиология и патогенез.
В-клетки образуются в костном мозге, где происходит первичная перестройка генов, кодирующих синтез иммуноглобулинов. Гены вариабельного региона легких цепей (k или ?) собраны с помощью соединяющих (J – joing), а гены вариабельного региона тяжелых цепей — с помощью соединяющих (J) и разнообразных (D – diversity) сегментов.
Клетки с «успешной перестройкой» генов иммуноглобулинов (наивные В-клетки), покидают к/м и попадают во вторичные лимфоидные органы — л/у, миндалины, селезенку, пейеровы бляшки. В них В-клетки, подвергающиеся действию антигена, образуют фолликулы вместе с фолликулярными дендритными клетками и Т-клетками. В результате этого процесса формируются зародышевые центры во вторичных лимфоидных фолликулах. В зародышевом центре вторичных фолликулов наивные B-клетки, не имеющие адекватного антигена и не способные произвести функциональное антитело, подвергаются апоптозу, т.е. погибают. Но в В-клетках с адекватными антигенами и способными произвести функциональное антитело в зародышевом центре происходит переключение класса иммуноглобулина (IgM, IgD на IgG, IgA или IgE), а также соматическая гипермутация (замена одного нуклеотида в гипервариабельных регионах иммуноглобулинов), после чего В-клетки покидают фолликул, становясь окончательно дифференцированными плазматическими клетками или долгоживущими В-клетками памяти. Случайные неудачи в управлении этими процессами и играют решающую роль в развитии B-клеточных опухолей, в том числе ДВКЛ.
Патогенез ДВКЛ плохо изучен. Разнообразие клинических и морфологических проявлений ДВКЛ, иммунофенотипа позволяет предположить, что ДВКЛ является не единой нозологической формой, а группой лимфатических опухолей, имеющих близкий, но неодинаковый патогенез.
Это доказывают и молекулярно-цитогенетические исследования последних лет, позволившие выделить несколько вариантов ДВКЛ в зависимости от уровня дифференцировки опухолевых клеток, типов нарушения клеточных процессов, хромосомных аномалий [4].
В патогенезе ДВКЛ, вероятно, имеют значения многие гены, регулирующие события в зародышевых центрах, но изученным механизмом является перестройка гена Bcl-6, которая вызвана неправильным переключением класса иммуноглобулинов В-клеток в зародышевом центре. Ген Bcl-6 расположен в локусе 3q27 и экспрессируется исключительно В-клетками зародышевого центра.
В физиологических условиях ген Bcl-6 связывается с определенными регулирующими последовательностями ДНК, влияет на транскрипцию других генов, участвующих в В-клеточной активации и терминальной дифференцировке лимфоцитов. При перестройке локуса 3q27 происходит блок дальнейшей дифференцировки В-клеток в плазматические клетки, что приводит к бесконтрольной пролиферации В-клеток зародышевого центра.
1.3 Эпидемиология.
Диффузная В-крупноклеточная лимфома относится к наиболее распространенным вариантам лимфопролиферативных заболеваний взрослых (30-50% от всех неходжкинских лимфом). В возрасте до 18 лет частота этого варианта агрессивной В-клеточной опухоли не превышает 8-10%. Заболеваемость ДВКЛ составляет в среднем 4-5 на 100 000 населения в год. Риск развития опухоли увеличивается с возрастом и значительно выше у людей с серопозитивностью на вирус гепатита С, при наличии вируса иммунодефицита человека (ВИЧ), при аутоиммунных заболеваниях. Мужчины и женщины болеют ДВКЛ с приблизительно равной частотой [2].
1.4 Кодирование по МКБ 10 :
C83.3 Лимфома крупноклеточная (диффузная) — ретикулосаркома
1.5 Классификация.
- Первичная медиастинальная ДВКЛ
- Первичная ДВКЛ ЦНС
- Внутрисосудистая ДВКЛ
- Лимфоматоидный гранулематоз
- Первичная ДВКЛ серозных полостей
- Первичная кожная ДВКЛ, тип «нижних конечностей»
1.6 Клинические признаки
2. Диагностика
2.1 Жалобы и анамнез
- Рекомендуется при сборе жалоб и анамнеза заболевания выяснять следующее:[2, 5]
- когда впервые появились те или иные признаки заболевания;
- имеются ли В-симптомы (потливость, снижение массы тела, лихорадка 38.0 С и выше);
- какое лечение было проведено; была ли терапия глюкокортикостероидами и/или другими цитостатическими препаратами, а также моноклональными антителами;
- имеется ли в семье больной лимфомой.
Уровень убедительности рекомендаций A (уровень достоверности доказательств – I .
Комментарии: сбор жалоб и анамнеза позволит определить характер течения заболевания (первичная ДВКЛ или трансформация индолентной лимфомы). При ДВКЛ жалобы могут быть разнообразными в зависимости от локализации опухоли: головной мозг, средостение, кишка, желудок, орбита, почка, селезенка и так далее. Учитывая агрессивный характер заболевания, анамнез заболевания, как правило, короткий.
2.2 Физикальное обследование больных ДВКЛ не отличается от такового при заболеваниях внутренних органов.
2.3 Лабораторная диагностика
- Рекомендуется выполнить все рутинные общетерапевтические анализы: клинический анализ крови с определением гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, подсчетом лейкоцитарной формулы и количества ретикулоцитов; биохимический анализ крови, общий анализ мочи, коагулограмму, электрофарез белков сыворотки крови, определение маркеров вирусных гепатитов В и С и ВИЧ, прямая проба Кумбса[6,7,8].
Уровень убедительности рекомендаций I (уровень достоверности доказательств –A)
Комментарий: биохимический анализ крови включает обязательное определение следующих параметров — ЛДГ, мочевая кислота, мочевина, креатинин, общий белок, альбумин, билирубин, АСТ, АЛТ, щелочная фосфатаза, электролиты, кальций. Прямой пробы Кумбса выполняется при наличии клинических или лабораторных признаков гемолиза
- Рекомендуется обязательное выполнение биопсии лимфоузла или очага поражения с морфологическим (цитологическим и гистологическим) и иммуногистохимическим исследованием.[9-11]. Уровень убедительности рекомендаций I (уровень достоверности доказательств –A)
Комментарии: диагноз ДВКЛ устанавливают только на основании морфологического исследования биоптата. Морфологическое исследование проводится с помощью гистологического и иммуногистохимического методов. В части случаев необходимо проведение цитологического, молекулярно-биологических и генетических тестов. Одно цитологическое исследование пунктатов или мазков-отпечатков лимфатических узлов или других опухолевых очагов не является достаточным основанием для нозологической верификации лимфом. В исключительных случаях (локализация опухоли в труднодоступных анатомических зонах) объектом исследования может быть тканевой материал, полученный с помощью «пистолетной» («кор»-) биопсии.
- Рекомендуется гистологическое исследование трепанобиоптата костного мозга.[12-19] .
Уровень убедительности рекомендаций I (уровень достоверности доказательств –A)
Комментарии: Морфологическое исследование пунктата костного мозга (стернального или др.) не заменяет гистологическое исследование трепанобиоптата.
- Рекомендуется при наличии лимфоцитоза выполнение иммунофенотипирования (ИФТ) методом проточной цитометрии.
Комментарии: выполнение ИФТ обязательно при наличии лимфоцитоза в общем анализе крови (независимо от числа лейкоцитов), или в миелограмме, а также при преобладании лимфоидных клеток, атипичных лимфоцитов или клеток с бластной морфологией в плевральной, асцитической или других биологических жидкостях. Выполнение ИФТ позволяет быстро провести дифференциальную диагностику опухолевого и реактивного лимфоцитоза, что важно для определения дальнейшей тактики обследования пациента. Материалом для ИФТ могут служить клетки крови, костного мозга, выпотных жидкостей, ликвора, гомогенизированные образцы тканей (селезенка, лимфатические узлы и т.д.), клеточная суспензия, полученная при аспирационной тонкоигольной пункции лимфатических узлов.
- Рекомендуется выполнить люмбальную пункцию с последующим биохимическим анализом и микроскопическим исследованием ликворной жидкости.[20-27].
Уровень убедительности рекомендаций I (уровень достоверности доказательств –A)
Комментарии: если нет нейролейкемии, то в последующем люмбальную пункцию не повторяют.
- Рекомендуется при рецидиве или прогрессировании заболевания обязательное выполнение повторной биопсии и морфологического исследования пораженных лимфатических узлов или очагов, расположенных экстранодально. [28-29].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
Комментарии: повторная биопсия позволит уточнить морфологический вариант рецидива/прогрессии, исключить неопухолевое поражение (например, туберкулез, грибковая инвазия, вторая опухоль). Повторная биопсия также показана, в ряде случаев, при наличии резидуальных очагов для подтверждения или исключения ремиссии.
- Рекомендуется повторная аспирация и трепанобиопсия костного мозга для плановой оценки результатов лечения (при исходном поражении костного мозга) и при появлении клинически немотивированных цитопении и лихорадки (вне зависимости от наличия исходного поражения).[28-31].
Уровень убедительности рекомендаций I (уровень достоверности доказательств –A)
Комментарии: аспират костного мозга может быть информативен для оценки регенерации и диспластических изменений миелопоэза. У больных ДВКЛ с поражением костного мозга цитологическое исследование пунктата для оценки изменений объема опухолевой инфильтрации не информативно.
- Рекомендуется выполнить (у женщин детородного возраста) тест на беременность [32-34].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
2.4 Инструментальная диагностика
- Рекомендуется выполнить КТ головного мозга, шеи, грудной клетки, органов брюшной полости и малого таза, рентгенографию органов грудной клетки в двух проекциях (при невозможности выполнения КТ), УЗИ периферических лимфатических, внутрибрюшных и забрюшинных узлов, органов брюшной полости и малого таза (если нет возможности выполнить КТ указанных областей), ЭКГ и Эхо-КГ, эндоскопического исследования желудка и кишечника при наличии у больного жалоб, указывающих на их поражение[35-38].
Уровень убедительности рекомендаций I (уровень достоверности доказательств –A)
Комментарий: УЗИ может использоваться для контроля за лечением, но не является стандартом при установлении стадии заболевания и при оценке эффективности лечения
2.5 Дополнительные исследования, консультации специалистов
При наличии показаний могут выполняться дополнительные методы исследования:
- Рекомендуется женщинам детородного возраста консультация гинеколога.[33-34].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
- Рекомендуется выполнение сцинтиграфии костей скелета, КТ или МРТ головного мозга, ПЭТ.[39-40].
Уровень убедительности рекомендаций I (уровень достоверности доказательств –A)
Комментарии: сцинтиграфия костей — при необходимости исключения поражения костей, КТ/МРТ головного мозга – при необходимости исключения поражения центральной нервной системы, ПЭТ- при невозможности определения очагов поражения иным методом
- Рекомендуется консультация смежных специалистов при показаниях (исключение туберкулеза, оказание ЛОР-пособия и т.п.)[35-36]. Уровень убедительности рекомендаций I (уровень достоверности доказательств –A)
2.6. Стадирование, формулирование диагноза
Стадирование ДВКЛ осуществляется по классификации Ann-Arbor (табл. № 1).
Стадия
Критерии
Поражение одной группы лимфатических узлов
Очаговое поражение одного сегмента или области нелимфатического органа
Поражение более одной группы лимфоузлов, расположенных по одну сторону от диафрагмы
Очаговое поражение одного сегмента или области нелимфатического органа с его регионарными лимфатическими узлами, с вовлечением или без вовлечения других лимфоузлов, расположенных по одну сторону от диафрагмы
Поражение более одной группы лимфоузлов, расположенных по одну сторону от диафрагмы, в сочетании с поражением селезенки
Поражение групп лимфоузлов, расположенных по обе стороны от диафрагмы
Поражение групп лимфоузлов, расположенных по обе стороны от диафрагмы, в сочетании с локальным поражением нелимфатического органа
Поражение групп лимфоузлов, расположенных по обе стороны от диафрагмы, в сочетании с поражением селезенки
Диффузное или диссеминированное поражение одного или более нелимфатического органа или ткани с поражением или без поражения регионарных и отдаленных лимфоузлов либо изолированное поражение нелимфатического органа с вовлечением в патологический процесс отдаленных лимфоузлов
В формулировке диагноза должно быть указано: что поражено, состояние больного по шкале ECOG, Международный прогностический индекс (IPI), стадия заболевания.
3. Лечение
3.1 Химиотерапия первой линии.
- Рекомендуется провести 4-6 курсов иммунохимиотерапии R-CHOP-21[6, 11, 12].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
3.1.2 Распространенные III-IV стадии
- Рекомендуется провести 6-8 курсов иммунохимиотерапии R-CHOP-21, R-CHOP-14 пожилым больным[28-36].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
Комментарии: больным в старческом возрасте, с выраженной сопутствующей патологией и/или резко ослабленным соматическим статусом рекомендуется применение менее токсичных режимов иммунохимиотерапии, например, R-miniCHOP[6, 8, 11, 17, 20, ].
При наличии серьезной кардиальной патологии (снижение фракции выброса левого желудочка ниже 50%) могут использоваться режимы, не содержащие доксорубицин – R-CEPP, R-CEOP, R-GCVP и др.[41-44].
- Рекомендуется ВДХТ с аутоТГСК молодым больным с высоким риском раннего прогрессирования (IPI>3), при отсутствии полного метаболического ответа после индукционного режима, при DH ДВКЛ.[45-49, 22-23].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
- Рекомендуется провести 6 курсов R-Hyper-CVAD, R-NHL-BFM-90, R-NHL-BFM-95 подросткам и молодым больным с double-hit (DH) ДВКЛ [16, 20, 22, 24]
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C).
3.2 Химиотерапия второй линии.
- Рекомендуется провести химиотерапию второй линии при отсутствии частичной ремиссии или при прогрессировании опухоли, а также больным с рецидивами.[16, 17, 20, 22, 23, 24].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
Комментарии: режимы второй линии: DHAP, ESHAP, ICE, GDP, GemOx, MINE и другие. Ритуксимаб должен применяться с любым из этих режимов в том случае, если рецидив был диагностирован более чем через 6 месяцев после предшествующего введения препарата. Пожилым больным или больным с коморбидностью, которые не являются кандидатами на трансплантацию, могут быть назначены те же режимы второй линии или другие схемы: R-GemOx, R-B, R-CEPP, DA-EPOCH-R, метрономная схема РЕРС. Тактика лечения рецидивов ДВКЛ после аутоТГСК должна определяться индивидуально в зависимости от ранее полученных противоопухолевых режимов и общего состояния больного. Предпочтительными, в том числе и для больных, которые не являются кандидатами на высокодозную химиотерапию с аутоТГСК, может быть включение в клинические исследования. У молодых пациентов с хорошим соматическим статусом можно рассматривать возможность выполнения аллогенной ТГСК.
3.3 Хирургическое лечение.
Хирургического лечения ДВКЛ не существует. Только при первичном поражении селезенки в случае отсутствия доступных для биопсии очагов поражения показана спленэктомия. Во всех остальных случаях, хирургическое вмешательство должно быть ограничено биопсией очага поражения, а также в рамках оказания помощи при жизни угрожающих состояниях.
Коментарии. Основным показанием к диагностической, одновременно и лечебной спленэктомии является наличие гипоэхогенного, накапливающего контрастное вещество при в/в введении, очага/очагов в паренхиме селезенки. При этом размеры селезенки иногда могут быть нормальными, или незначительно увеличенными.
3.4 Лучевая терапия
3.4.1 Локальные I—II стадии
- Рекомендуется с консолидирующей целью после системной химиотерапии в суммарной дозе 30 Гр; при частичном ответе на проведенное лекарственное лечение ЛТ как лечебная опция в дозе 36-40 Гр; при значительных объёмах остаточной болезни после ХТ добавление локального «буста» до 40-45 Гр; в случае отсутствия возможностей выполнения ВДХТ (пожилые или больные с сопутствующими заболеваниями), при достижении стойкого противоопухолевого эффекта c целью консолидации в дозе 40-46 Гр.[6,7,8, 9, 10, 11].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
3.4.2 Распространенные III—IV стадии
- Рекомендуется когда после завершения ХТ регрессия какого-либо единичного остаточного очага может позволить перевести частичную ремиссию в полную или стабилизацию – в частичную ремиссию.[6,7,8, 9, 10, 11].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
3.5 Первичная медиастинальная (тимическая) В-крупноклеточная лимфома
- Рекомендуется в качестве первого метода противоопухолевого воздействия могут использоваться различные режимы иммунохимиотерапии: R-CHOP, MACOP-B+R, DA-EPOCH-R. При не достижении частичной ремиссии и высокой метаболической активности опухоли выполнить — ВДХТ с аутоТГСК с возможной последующей лучевой терапией на остаточную опухоль.[28, 29, 30,31, 32, 33, 34].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
- Рекомендуется провести лучевую терапию: после полного метаболического ответа на проведенную ХТ в качестве консолидации в дозе 30 Гр на зоны исходно поражённых лимфатических узлов; при наличии ПЭТ-позитивной резидуальной опухоли на зоны исходного поражения в дозе 30 Гр + «буст» на остаточную опухоль 6-10 Гр. [6,7,8, 9, 10, 11].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
Комментарии: лимфоузлы корней лёгких включаются в объём облучения только при указании на их поражение, целесообразно проведение 3D CRT с респираторным гейтингом для снижения лёгочной и кардиальной токсичности
3.6 Поддерживающая терапия
- Не рекомендуется
4. Реабилитация
Специальных методов реабилитации при ДВКЛ не существуют. Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий. Рекомендуется вести здоровый образ жизни, исключить избыточную инсоляцию и тепловые физиопроцедуры.
5. Профилактика и диспансерное наблюдение
Методов профилактики ДВКЛ в настоящее время не существует, поскольку неизвестен этиологический фактор(ы), ведущие к развитию заболевания. Диспансерное наблюдение гематологом или онкологом осуществляется в период лечения и после достижения ремиссии лимфомы.
5.1 Профилактика нейролейкемии.
- Рекомендуется на ранних этапах терапии всем больным с высоким риском вовлечения ЦНС и включает 4 интратекальных введения метотрексата (15 мг), цитарабина (30 мг), дексаметазона (4 мг) и 2 системных введения высоких доз метотрексата (1,5-3 г/м2). [17, 23, 32, 35, 37, 39].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
Комментарии: одно интратекальное введение в 1-й день курсов 1-4, метотрексат в высоких дозах может быть введен внутривенно на 15-й день 1 или 2-ого курсов и после завершения лечения.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Ошибки и необоснованные назначения
- Не рекомендуется выполнение пункции лимфоузла (очага поражения)
Комментарии: диагноз лимфомы не может быть установлен по пунктату, без полноценного гистологического и гистохимического исследования
- Не рекомендуется выполнение стернальной пункции
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
Комментарии: поражение костного мозга не может быть диагностировано по пунктату, без полноценного гистологического и гистохимического исследования
- Не рекомендуется «радикальное» удаление пораженных органов и калечащие операции
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
6.2 Лимфомы и беременность
- Рекомендуется со всеми больными детородного возраста обоих полов обсуждать вопрос о возможности криоконсервации спермы или ткани яичника перед началом терапии. С женщинами детородного возраста следует обсуждать вопрос о необходимости гормональной защиты от беременности, а также о методах возможной гормональной защиты яичников при проведении интенсивных программ лечения.[28,29, 30, 31].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
Комментарии: химиотерапия и облучение области таза могут привести к необратимой стерильности пациента
- Не рекомендуется прерывать беременность
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
Комментарии: в случае выявления лимфомы (как правило, первичной медиастинальной В-крупноклеточной) на ранних сроках беременности, необходимо провести химиотерапию с исключением химиопрепаратов, проникающих через плацентарный барьер и довести беременность до 32-36 недель, а после родов продолжить химиотерапии.
6.3 Прогноз
Прогноз зависит от распространенности опухоли, от наличия или отсутствия признаков неблагоприятного прогноза, от химиочувствительности опухоли, а также от полноценной и своевременной диагностики и применения адекватной тактики лечения.
Критерии оценки качества медицинской помощи
Критерии качества
Уровень убедительности рекомендаций
Уровень достоверности доказательств
Выполнена биопсия тканей лимфоузла (очага поражения) и морфологическое (цитологическое) и иммуногистохимическое исследование
Выполнен общий (клинический) анализ крови развернутый
Выполнен биохимический анализ крови (исследование уровня общего белка, альбумина, мочевина, креатинина, мочевой кислоты, аланинаминотрансферазы, аспартатаминотрансфераз, общего и прямого билирубина, холестерина, лактатдегидрогеназы, щелочной фосфатазы, кальция, электролиты крови)
Выполнены компьютерная тогмография и/или ультразвуковое исследование и/или магнитно-резонансная томография грудной полости и брюшной полости и малого таза и дополнительных очагов поражения
Выполнена позитронно-эмиссионная томография
Выполнена трепанобиопсия и морфологическое (гистологическое) исследованием препарата костного мозга
Выполнена коагулограмма (ориентировочное исследование системы гемостаза)
Список литературы
- Harris N.L.; Jaffe E.S.; Diebold J. et al. World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee meeting-Airlie House, Virginia, November 1997. J Clin Oncol. 1999;17(12):3835-49
- Swerdlow S.H.; Campo E.; Harris N.L. et al. World Health Organization Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: IARC 2008
- Поддубная И.В. Неходжкинские лимфомы. «Клиническая онкогематология», издание 2-е, Руководство для врачей под ред. проф. Волковой М.А., Москва, Медицина, 2007, стр. 724-770.
- Hans C.P.; Weisenburger D.D.; Greiner T.C. et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. Blood. 2004;103(1):275-82
- The International Non-Hodgkin»s Lymphoma Prognostic Factors Project. A predictive model for aggressive non-Hodgkin»s lymphoma. N Engl J Med. 1993;329(14):987-94.
- Pfreundschuh M.; Trumper L.; Osterborg A. et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group. Lancet Oncol 2006;7:379-391.
- Bonnet C.; Fillet G.; Mounier N. et al. CHOP alone compared with CHOP plus radiotherapy for localized aggressive lymphoma in elderly patients: a study by the Groupe d»Etude des Lymphomes de l»Adulte. J Clin Oncol. 2007;25(7):787-92.
- Reiter A.; Schrappe M.; Tiemann M. et al. Improved treatment results in childhood B-cell neoplasms with tailored intensification of therapy: A report of the Berlin-Frankfurt-M?nster Group Trial NHL-BFM 90. Blood. 1999;94(10):3294-306
- Miller T.P.; Dahlberg S.; Cassady J.R. et al. Chemotherapy alone compared with chemotherapy plus radiotherapy for localized intermediate- and high-grade non-Hodgkin»s lymphoma. N Engl J Med. 1998;339(1):21-6.
- Shenkier T.N.; Voss N.; Fairey R. et al. Brief chemotherapy and involved-region irradiation for limited-stage diffuse large-cell lymphoma: an 18-year experience from the British Columbia Cancer Agency. J Clin Oncol. 2002;20(1):197-204.
- Horning S.J.; Weller E.; Kim K. et al. Chemotherapy with or without radiotherapy in limited-stage diffuse aggressive non-Hodgkin»s lymphoma: Eastern Cooperative Oncology Group study 1484. J Clin Oncol. 2004;22(15):3032-8.
- Phan J.; Mazloom A.; Medeiros L.J. et al. Benefit of consolidative radiation therapy in patients with diffuse large B-cell lymphoma treated with R-CHOP chemotherapy. J Clin Oncol. 2010;28(27):4170-6.
- Kridel R.; Dietrich P.Y. Prevention of CNS relapse in diffuse large B-cell lymphoma. Lancet Oncol 2011;12:1258–1266.
- Румянцев А.Г.; Птушкин В.В.; Семочкин С.В. Пути улучшения результатов лечения злокачественных опухолей у подростков и молодых взрослых. Онкогематология. 2011;1:20-30
- Бобкова М.М.; Семочкин С.В.; Иванова В.Л. и соавт. Эффективность применения интенсивной полифимиотерапии в лечении молодых больных с диффузной В-крупноклеточной лимфомой из клеток герминального центра. Онкогематология. 2009;4:4-11
- Wilson W.H; Dunleavy K.; Pittaluga S. et al. Phase II study of dose-adjusted EPOCH and rituximab in untreated diffuse large B-cell lymphoma with analysis of germinal center and post-germinal center biomarkers. J Clin Oncol. 2008;26(16):2717-24
- Coiffier B.; Lepage E.; Briere J. et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. N Engl J Med 2002;346:235–242
- Peyrade F.; Jardin F.; Thieblemont C. et al. Attenuated immunochemotherapy regimen (R-miniCHOP) in elderly patients older than 80 years with diffuse large B-cell lymphoma: a multicentre, single-arm, phase 2 trial. Lancet Oncol. 2011;12:460–468
- Chao N.J.; Rosenberg S.A.; Horning S.J. CEPP(B): an effective and well-tolerated regimen in poor-risk, aggressive non-Hodgkin»s lymphoma. Blood. 1990;76(7):1293-8
- Moccia A.A.; Schaff K.; Hoskins P. et al. R-CHOP with Etoposide Substituted for Doxorubicin (R-CEOP): Excellent Outcome in Diffuse Large B Cell Lymphoma for Patients with a Contraindication to Anthracyclines. Blood (ASH Annual Meeting Abstracts) 2009;114:Abstract 408
- Philip T.; Guglielmi C.; Hagenbeek A.; et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin»s lymphoma. N Engl J Med. 1995;333(23):1540-5
- Velasquez W.S.; Cabanillas F.; Salvador P. et al. Effective salvage therapy for lymphoma with cisplatin in combination with high-dose Ara-C and dexamethasone (DHAP). Blood. 1988;71(1):117-22
- Velasquez W.S.; McLaughlin P.; Tucker S. et al. ESHAP—an effective chemotherapy regimen in refractory and relapsing lymphoma: a 4-year follow-up study. J Clin Oncol. 1994;12(6):1169-76.
- Crump M.; Baetz T.; Couban S. et al. Gemcitabine, dexamethasone, and cisplatin in patients with recurrent or refractory aggressive histology B-cell non-Hodgkin lymphoma: a Phase II study by the National Cancer Institute of Canada Clinical Trials Group (NCIC-CTG). Cancer. 2004;101(8):1835-42
- Kuruvilla J.; Nagy T.; Pintilie M. et al. Similar response rates and superior early progression-free survival with gemcitabine, dexamethasone, and cisplatin salvage therapy compared with carmustine, etoposide, cytarabine, and melphalan salvage therapy prior to autologous stem cell transplantation for recurrent or refractory Hodgkin lymphoma. Cancer. 2006;106(2):353-60.
- Zelenetz A.D.; Hamlin P.; Kewalramani T. et al. Ifosfamide, carboplatin, etoposide (ICE)-based second-line chemotherapy for the management of relapsed and refractory aggressive non-Hodgkin»s lymphoma. Ann Oncol. 2003;14 Suppl 1:i5-10
- Coiffier B.; Haioun C.; Ketterer N. et al. Rituximab (anti-CD20 monoclonal antibody) for the treatment of patients with relapsing or refractory aggressive lymphoma: a multicenter phase II study. Blood. 1998;92(6):1927-32
- Мангасарова Я.К.; Магомедова А.У.; Кравченко С.К. и соавт. Диффузная В-крупноклеточная лимфома с первичным вовлечением лимфоузлов средостения: диагностика и лечение. Терапевтический архив. 2010;7:61-65
- Кичигина М.Ю.; Тумян Г.С.; Ковригина А.М. и соавт. Первичная медиастинальная (тимическая) В-крупноклеточная лимфома: обзор литературы и собственные данные. Терапевтический архив. 2011;83(7):38-46
- Savage K.J.; Al-Rajhi N.; Voss N. et al. Favorable outcome of primary mediastinal large B-cell lymphoma in a single institution: the British Columbia experience. Ann Oncol. 2006;17(1):123-30.
- Zinzani P.L.; Stefoni V.; Finolezzi E. et al. Rituximab combined with MACOP-B or VACOP-B and radiation therapy in primary mediastinal large B-cell lymphoma: a retrospective study. Clin Lymphoma Myeloma. 2009;9(5):381-5
- Rieger M.; Osterborg A.; Pettengell R. et al. Primary mediastinal B-cell lymphoma treated with CHOP-like chemotherapy with or without rituximab: results of the Mabthera International Trial Group study. Ann Oncol. 2011;22(3):664-70
- Vassilakopoulos T.P.; Angelopoulou M.K.; Galani Z. et al. Rituximab-CHOP (R-CHOP) and Radiotherapy (RT) for Primary Mediastinal Large B-Cell Lymphoma (PMLBCL). Blood (ASH Annual Meeting Abstracts) 2006;108:Abstract 2745
- Dunleavy K.; Pittaluga S.; Janik J. et al. Primary Mediastinal Large B-Cell Lymphoma (PMBL) Outcome May Be Significantly Improved by the Addition of Rituximab to Dose-Adjusted (DA)-EPOCH and Obviates the Need for Radiation: Results from a Prospective Study of 44 Patients. Blood (ASH Annual Meeting Abstracts). 2006;108:Abstract 209
- Тумян Г.С.; Сорокин Е.Н.; Ковригина А.М. и соавт. Диффузная В-крупноклеточная лимфома с первичной локализацией в яичке. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2008;1(3):206-210
- Сотникова О.П.; Сорокин Е.Н.; Поддубная И.В. Первичные неходжкинские лимфомы яичка. Онкоурология. 2012;1:88-94
- Gundrum J.D.; Mathiason M.A.; Moore D.B.; Go R.S. Primary testicular diffuse large B-cell lymphoma: a population-based study on the incidence, natural history, and survival comparison with primary nodal counterpart before and after the introduction of rituximab. J Clin Oncol 2009;27(31):5227
- Mazloom A.; Fowler N.; Medeiros L.J.; Iyengar P. et al. Outcome of patients with diffuse large B-cell lymphoma of the testis by era of treatment: the M. D. Anderson Cancer Center experience. Leuk Lymphoma 2010;51(7):1217-24
- Vitolo U.; Ferreri A.J.; Zucca E. Primary testicular lymphoma. Crit Rev Oncol Hematol. 2008;65(2):183-189
- Hasselblom S.; Ridell B.; Wedel H. et al. Testicular lymphoma e a retrospective, population-based, clinical and immunohistochemical study. Acta Oncol 2004;43(8):758-765
- Пересторонина Т.Н.; Кравченко С.К.; Губкин А.В. и соавт. Первичная диффузная В-крупноклеточная лимфосаркома яичка с вовлечением центральной нервной системы. Гематология и трансфузиология. 2009;54(3):25-27
- Vitolo U.; Chiappella A.; Ferreri A.J. et al. First-line treatment for primary testicular diffuse large B-cell lymphoma with rituximab-CHOP, CNS prophylaxis, and contralateral testis irradiation: ?nal results of an international phase II trial. J Clin Oncol 2011;29(20):2766-72
- Ahmad S.S.; Idris S.F.; Follows G.A.; Williams M.V. Primary Testicular Lymphoma. Clin Oncol (R Coll Radiol). 2012;24(5):358-65
- Poddubnaya I.; Sotnikova O.; Suborceva I. et al. Rare forms of primary extranodal non-Hodgkin’s lymphomas: distant results after 1st line therapy (experience in one Russian center). Ann Oncol. 2011;22(Supp. 4): Abstract 462
- Davies A.; Merli F.; Mihaljevik B. et al. Pharmacokinetics and safety of subcutaneous Rituximab in follicular lymphoma (SABRINA): stage 1 analysis of a randomised phase 3 study. Lancet Oncol. 2014;15(3):343-352
- Тумян Г.С. Первичная медиастинальная В-крупноклеточная лимфома: диагностика, клиническая картина и лечение Современная онкология. 2008. Т. 10, № 3. С. 66–68.
- Charpentier A. Managing stage I-II follicular lymphoma with upfront definitive radiation therapy: the forty-year experience of the Princess Margaret Cancer Centre Hematological oncology. 2013;31 (Suppl. 1):Abstract 062)
- Lowry L.; Smith P.; Qian W. et al. Reduced dose radiotherapy for local control in non-Hodgkin lymphoma: A randomised phase III trial. Radiother Oncol 2011;100:86-89
- Llidge T.; Specht L.; Yachalom J. Modern radiation therapy for nodal non-Hodgkin lymphoma target – definition and dose guidelines from the ILROG. Int J Radiat Oncol Biol Phys 2014;89:49-58.
Приложение А1. Состав рабочей группы
Коллектив авторов
Асланиди Ираклий Павлович. Доктор медицинских наук, профессор, руководитель отдела ядерной диагностики ФГБУ «Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева»
Байков Вадим Валентинович. Доктор медицинских наук, профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого СПбГМУ им. акад. И.П. Павлова, Санкт-Петербург
Виноградова Юлия Николаевна. Доктор медицинских наук, врач-радиотерапевт, ведущий научный сотрудник отделения лучевой терапии системных заболеваний, возглавляет кафедру радиологии и хирургических технологий ФГБУ «Российский научный центр радиологии и хирургических технологий» МЗ РФ, Санкт-Петербург
Демина Елена Андреевна. Доктор медицинских наук, профессор, врач-онкогематолог, ведущий научный сотрудник отделения химиотерапии гемобластозов ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России, г. Москва.
Екаева Ирина Викторовна, к.хим.н., отдел ядерной диагностики ФГБУ «Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева»
Ильин Николай Васильевич. Доктор медицинских наук, профессор, врач-радиотерапевт высшей категории, руководитель радиотерапевтического отделения № 1 ФГБУ «Российский научный центр радиологии и хирургических технологий» МЗ РФ, Санкт-Петербург
Катунина Татьяна Анатольевна, к.м.н., отдел ядерной диагностики ФГБУ «Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева»
Ковригина Алла Михайловна. Доктор биологических наук, врач-патоморфолог, профессор кафедры патологической анатомии, цитологии и молекулярной патологии ИПК ФМБА РФ, заведующая патологоанатомическим отделением ФГБУ «Гематологический научный центр» МЗ РФ, Москва
Кравченко Сергей Кириллович. Кандидат медицинских наук, врач-гематолог, доцент, заведующий научно-клиническим отделением химиотерапии гемобластозов ФГБУ Гематологический научный центр МЗ РФ, ассистент кафедры гематологии и трансфузиологии ГБОУ ДПО РМАПО, г. Москва
Криволапов Юрий Александрович. Доктор медицинских наук, профессор, врач-патологоанатом, заведующий отделением клинической молекулярной морфологии Северо-Западного государственного медицинского университета им. И. И. Мечникова, Санкт-Петербург
Левшин Николай Юрьевич. Кандидат медицинских наук, доцент кафедры поликлинической терапии и клинической лабораторной диагностики Ярославской государственной медицинской академии, Ярославль
Мационис Александр Эдуардович. Доктор медицинских наук, академик РАЕН, врач-патоморфолог высшей категории, заведующий лабораторией иммуноморфологии ГБУ Ростовской области «Патолого-анатомическое бюро», Ростов-на-Дону.
Михайлова Наталья Борисовна. Доктор медицинских наук, врач-гематолог, руководитель отдела клинической онкологии (химиотерапии) НИИ детской онкологии, гематологии и трансплантологии им. Р.М.Горбачевой, Санкт-Петербург
Мухортова Ольга Валентиновна. Доктор медицинских наук, врач-радилог высшей категории, старший научный сотрудник Отдела ядерной диагностики (ПЭТ-центр) на базе Научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева, Москва
Османов Евгений Александрович. Профессор, доктор медицинских наук, врач высшей квалификационной категории, заведующий отделением химиотерапии гемобластозов РНЦ РАМН, Москва
Поддубная Ирина Владимировна. Член-корреспондент РАН, заслуженный деятель образования РФ, доктор медицинских наук, профессор, заведующая кафедрой онкологии, проректор по учебной работе и международному сотрудничеству ГБОУ ДПО «Российская медицинская академия последипломного образования» (РМАПО) МЗ РФ, г. Москва
Попова Марина Олеговна. Кандидат медицинских наук, врач-гематолог Института детской гематологии и онкологии им. Р.М. Горбачевой, Санкт-Петербург
Ройтман Евгений Витальевич. Доктор биологических наук, профессор кафедры гематологии, онкологии и лучевой терапии ФГБОУ ВО РНИМУ им. Н.И.Пирогова Минздрава России, г. Москва
Сотников Владимир Михайлович. Доктор медицинских наук, профессор, врач-радиолог, врач-онколог высшей категории, главный научный сотрудник, заведующий лабораторией лучевой терапии научно?исследовательского отдела инновационных технологий в радиотерапии и химиолучевого лечения злокачественных новообразований ФГБУ РНЦРР МЗ РФ, Москва
Трофимова Оксана Петровна. Доктор медицинских наук, врач-радиолог, ведущий научный сотрудник радиологического отделения РОНЦ им. Н.Н. Блохина, Москва
Тумян Гаяне Сергеевна. Доктор медицинских наук, врач-онколог, ведущий научный сотрудник отделения химиотерапии гемобластозов ФГБУ «РОНЦ им. Н.Н. Блохина», профессор кафедры онкологии Российской медицинской академии последипломного образования, Москва
Шмаков Роман Георгиевич. Доктор медицинских наук, Главный врач ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» МЗ РФ, г. Москва
Конфликт интересов: авторы не имеют конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Методология сбора доказательств
Методы, использованные для сбора / селекции доказательств:
Поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0.3;
Поиск в электронных базах данных.
Базы данных, использованных для сбора / селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- Обзоры опубликованных мета-анализов;
- Систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- Консенсус экспертов;
- Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл.3,4).
Уровни и степени доказательности
Как минимум одно крупное рандомизированное контролируемое исследование высокого качества (с низкой вороятностью ошибок) или мета-анализ гомогенных рандомизированных исследований высокого качества
Небольшие рандомизированные исследования или крупные рандомизированные исследования с высокой вероятностью ошибок. Мета-анализ подобных исследований или мета-анализ гетерогенных исследований
Проспективные когортные исследования
Ретроспективные когортные исследования или исследования «случай-контроль»
Исследования без контрольной группы, отдельные случаи, мнение экспертов
Достоверные данные о высокой клинической эффективности, настоятельно рекомендуется
Достоверные или убедительные данные об умеренной клинической эффективности, рекомендуется
Недостоверные данные об эффективности, которая не перевешивает риск или недостатки лечения (нежелательные явления, стоимость и т.д.), может применяться как один из вариантов
Индикаторы доброкачественной клинической практики (Good Practice Points – GPPs):
Доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методология валидизации рекомендаций
- Внешняя экспертная оценка;
- Внутренняя экспертная оценка.
Описание методики валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных Федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2015-2016 гг., на Форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний «Лимфорум», ежегодной Российской конференции с международным участием «Злокачественные лимфомы», а также III Конгресса гематологов России.
Окончательная редакция:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Клинические рекомендации утверждены на XIII Российской конференции с международным участием «Злокачественные лимфомы» в 2016.
Приложение Б. Алгоритмы ведения пациента

Приложение В. Информация для пациентов
Диффузная В-крупноклеточная лимфома – агрессивное лимфопролиферативное заболевание. Прогноз зависит от многих факторов, в том числе от объема поражения, в связи с чем необходимо полное и всестороннее обследование.
Своевременное и адекватное лечение является залогом успеха. Поэтому пациент должен четко выполнять все предписания врача относительно времени и сроков выполнения диагностических процедур, а также курсов химиотерапии.
Обязательно должен сообщить о нежелательных явлениях, если таковые имеются, во время прохождения лечения.
Лимфома
Лимфома – это поражение иммунной системы и внутренних органов, в которых скапливаются измененные клетки, нарушающие работу тканей.
Опухоль развивается в лимфатической системе, которая помогает нам бороться с инфекциями и другими заболеваниями. Циркулирующая в ней лимфа омывает все клетки организма и доставляет в них необходимые вещества, забирая отходы. В расположенных по всей ее сети лимфатических узлах опасные вещества обезвреживаются и выводятся из организма.
Лимфосистема дополняет кровеносную и помогает жидкостям перемещаться по телу. В отличие от крови, скорость движения которой задает «насос» – сердце, лимфа медленно циркулирует самостоятельно.
Как развивается лимфома?
Онкология начинается с появления в организме всего лишь одной измененной клетки иммунной системы. Всего выделяют 2 основных их типа:
- В-лимфоциты: вырабатывают антитела – белки, защищающие организм от бактерий и вирусов. Именно в них образуется большинство лимфом.
- Т-лимфоциты, одна часть которых уничтожает микробы и неправильные клетки, а вторая – помогает повысить или замедлить активность иммунитета.
Почти все ненормальные клетки выявляются и уничтожаются нашим иммунитетом, но некоторым из них удается выжить. Они постепенно размножаются, распространяются по всему телу, создают опухоли, скапливаются во внутренних органах и нарушают их работу.
Заболевание может возникать в любой области, где находится лимфатическая ткань, основными участками которой являются:
- Лимфатические узлы – небольшие органы размером с горошину, представляющие из себя скопления клеток иммунной системы, в том числе лимфоцитов. В организме человека их более 500.
- Селезенка, расположенная под нижними ребрами на левой стороне тела. Она производит лимфоциты, хранит здоровые клетки крови и отфильтровывает поврежденные, а также разрушает микробов и чужеродные вещества.
- Костный мозг – губчатая ткань внутри определенных костей. Здесь образуются новые клетки крови, в том числе часть лимфоцитов.
- Тимус, или вилочковая железа – небольшой орган, расположенный за верхней частью грудины перед сердцем. В нем происходит созревание и развитие некоторых лимфоцитов.
- Миндалины, или гланды – скопления лимфатической ткани в задней части глотки. Эти органы помогают вырабатывать антитела – белки, не позволяющие размножаться вдыхаемым или проглатываемым микроорганизмам.
- Пищеварительный тракт: желудок, кишечник и многие другие органы также содержат лимфатическую ткань.
Лимфома – это рак?
Раком официальная медицина России и некоторых других стран называет злокачественные опухоли – опасные для жизни новообразования, которые развиваются в эпителиальных клетках, содержащихся в коже или слизистых оболочках, и выстилающих внутреннюю поверхность органов.
Лимфома – это не рак, а онкологическое заболевание. Она образуется из лимфоцитов, а ее клетки также умеют бесконтрольно делиться, накапливаться в тканях, нарушая их работу, и создавать дополнительные очаги заболевания в различных частях тела.
Типы лимфом
Врачи выделяют 2 их основных класса:
- Лимфома Ходжкина, или лимфогранулематоз: чаще всего начинается в лимфатических узлах верхней части тела – на груди, шее или в подмышках. Как правило, она распространяется в различные лимфоузлы по лимфатическим сосудам, но в редких случаях на поздних стадиях проникает в кровоток и распространяется на другие части тела, такие как печень, легкие или костный мозг. Данный диагноз ставится при выявлении в организме особых клеток – Березовского-Рид-Штернберга, которые представляют из себя измененные В-лимфоциты.
- К неходжкинским лимфомам относят все остальные типы заболевания – их насчитывается около 30. У каждого из них есть свои, особые признаки: расположение первичной опухоли, строение и скорость развития.
Причины развития лимфом
Врачам и ученым точно не известно, почему именно в организме человека начинает развиваться заболевание. Они знают лишь о факторах, которые повышают вероятность образования каждого из типов онкологии.
Для лимфом Ходжкина они выглядят следующим образом:
- Вирус Эпштейна – Барр, вызывающий инфекционный мононуклеоз – поражение лимфоидной ткани, включая аденоиды, печень, селезенку и лимфатические узлы. У части пациентов части вируса обнаруживаются в клетках Березовского-Рид-Штернберга, но у большинства больных его признаков нет.
- Возраст: диагноз может быть поставлен в любом возрасте, но чаще всего он встречается у 20-летних и людей старше 55.
- Пол: среди мужчин заболевание более распространено, чем среди женщин.
- Наследственность и семейный анамнез: риск повышен для братьев и сестер, а также для однояйцевых близнецов Однояйцевые близнецы развиваются из одной яйцеклетки, оплодотворенной одним сперматозоидом. Они бывают только одного пола, имеют одинаковые гены и крайне похожи внешне. обладателей лимфомы Ходжкина. Причина этого точно не известна – возможно, все дело в том, что члены одной семьи в детстве переносят одни инфекции, либо имеют общие унаследованные генные изменения, увеличивающие вероятность развития данного типа онкологии.
- Ослабленная иммунная система. Шансы получить данный диагноз возрастают у людей с ВИЧ инфекцией и нарушениями работы иммунитета, развивающимися в том числе из-за приема подавляющих его препаратов, что нередко требуется после пересадки органов.
Список таких факторов для неходжкинских лимфом выглядит иначе:
- К ним относят воздействие радиации, включая ее дозы, полученные в ходе лучевой терапии, проводимой для лечения других типов онкологии.
- Различные вещества, включая гербициды и инсектициды, убивающие сорняки и насекомых, а также химиотерапевтические препараты.
- Возраст: как правило, чем старше человек, тем выше его риски – в большинстве случаев заболевание встречается в возрасте 60+, но некоторые его виды возникают и у молодых людей.
- Сбои в работе иммунной системы – влияют на шансы возникновения всех видом лимфом.
- Некоторые вирусы могут влиять на ДНК лимфоцитов, в которой зашифрована вся информация о нашем теле, и преобразовывать их в онкологические клетки.
- Инфекции, постоянно стимулирующие иммунитет, и вынуждающие нашу естественную защиту работать в усиленном режиме, также повышают риск получения тяжелого диагноза.
- Наличие близких кровных родственников – родителей, детей, братьев или сестер с данным диагнозом также увеличивает вероятность развития заболевания.
- Некоторые исследования показали, что грудные имплантаты, особенно с шероховатой поверхностью, могут спровоцировать возникновение анапластической крупноклеточной лимфомы. Она развивается на коже, в лимфоузлах или рубцовых тканях, образовавшихся в месте разреза.
Симптомы и признаки лимфомы
Как правило, на ранних этапах данный тип онкологии никак себя не проявляет, а ее обладатель хорошо себя чувствует и не подозревает о болезни – почти все ее симптомы появляются позже, на запущенных стадиях.
Один из наиболее частых признаков – появление припухлости на шее, в подмышках, паху или над ключицей, которая представляет из себя увеличенный лимфатический узел. Обычно такое новообразование не болит, но со временем нередко увеличивается, а рядом с ним или в других областях тела появляются новые шишки.
Лимфомы, которые начинают развиваться или разрастаются в брюшной полости, способны вызвать отек или боль в животе, тошноту и рвоту. Такие ощущения возникают из-за укрупнения лимфоузлов или внутренних органов, таких как селезенка или печень, либо скопления большого количества жидкости.
Изменившаяся в размерах селезенка может давить на желудок, вызывая потерю аппетита и чувство сытости после небольшого количества пищи.
Увеличившиеся тимус Тимус, или вилочковая железа – небольшой орган, расположенный за верхней частью грудины перед сердцем. В нем происходит созревание и развитие некоторых лимфоцитов. или лимфоузлы грудной клетки могут оказывать давление на трахею, по которой воздух проходит в легкие. Это приводит к появлению кашля, затруднению дыхания, болевым ощущениям или тяжести в груди.
Поражения головного мозга способны вызывать головную боль, слабость, изменение личности, проблемы с мышлением и судороги.
Другие типы заболевания могут распространяться на окружающие головной и спинной мозг ткани, из-за чего у пациента двоится в глазах, немеет лицо и ухудшается речь.
Лимфомы кожи часто проявляются в виде зудящих красных бугорков или шишек.
Кроме того, симптомами могут быть:

- потеря веса;
- озноб;
- ночная потливость;
- повышенная температура;
- сильная усталость;
- вздутие живота;
- частые или тяжело протекающие инфекции;
- легко появляющиеся синяки или кровотечения.
Диагностика лимфомы
Большинство пациентов обращаются к врачу из-за наличия определенных признаков заболевания или плохого самочувствия.
Специалисты начинают обследование с осмотра и опроса – о семейных диагнозах, возможных факторах риска и других проблемах со здоровьем. Затем изучают лимфатические узлы и другие части тела, в которых содержится лимфатическая ткань, включая селезенку и печень. После чего назначают целый ряд исследований:
- Анализы крови: позволяют измерять уровни различных клеток в крови, обнаруживать повреждения костного мозга, оценивать работу почек и печени, а также выявлять инфекции и другие нарушения.
- Биопсия – забор частички подозрительной ткани и передача ее для исследования в лабораторию. В зависимости от течения заболевания, докторам может понадобиться биопсия лимфатических узлов, костного мозга, спинномозговой Спинномозговая жидкость омывает и защищает головной и спинной мозг. , а также плевральной – содержащейся в грудной клетке, или перитонеальной – находящейся в животе жидкости.
- Компьютерная томография, КТ– позволяет выявлять очаги заболевания в брюшной полости, тазу, груди, голове и шее.
- Магнитно—резонансная томография, МРТ – создает подробное изображение мягких тканей. Метод обычно используется для исследования спинного или головного мозга.
- Рентгенограмма – помогает обнаруживать увеличенные лимфатические узлы в области грудной клетки или в костях.
- Ультразвук, УЗИ– используется для изучения увеличенных лимфоузлов или различных органов, таких как печень, селезенка или почки.
- Позитронно—эмиссионная томография, ПЭТ – позволяет выявлять лимфомы в увеличенных лимфоузлах, даже в тех, которые выглядят нормальными на КТ. Кроме того, с ее помощью можно определить, поддается ли заболевание лечению.
В онкологическом центре «Лапино-2» проводится полная диагностика лимфомы – быстро, без очередей и потерь драгоценного времени, на самом современном оборудовании.
Наши специалисты ведут пациента «от» и «до» – от обследования до проведения любого лечения.
Стадии лимфомы
Сразу после обнаружения заболевания врачи определяют его стадию – выясняют, как далеко оно успело распространиться и какие ткани повредило. Данная информация крайне важна для специалистов, поскольку она позволяет не только понимать прогнозы пациента, но и подбирать для него самое подходящее лечение.
Стадии лимфомы Ходжкина:
I: измененные клетки обнаружены только в одной группе лимфатических узлов или одном лимфоидном органе, таком как миндалины.
II: они присутствуют в 2 или более группах лимфоузлов, расположенных по одну сторону от диафрагмы Диафрагма – это мышца, которая отделяет грудную полость от брюшной. , либо распространились из одного поврежденного лимфоузла на соседний орган.
III: клетки лимфомы есть в лимфоузлах по обе стороны диафрагмы; либо не только в лимфатических узлах над диафрагмой, но и в селезенке.
IV: заболевание распространилось по крайней мере в один орган, не входящий в лимфатическую систему, такой как печень, костный мозг или легкие.
Стадии неходжкинских лимфом:
I: измененные клетки обнаруживаются только в 1 группе лимфатических узлов или одном лимфоидном органе, например, миндалинах; либо в 1 области одного органа за пределами лимфатической системы.
II: они присутствуют в 2 или более группах лимфоузлов по 1 сторону от диафрагмы; либо в лимфатических узлах и 1 области расположенного рядом одного органа, или в еще одной группе лимфоузлов на той же стороне диафрагмы.
III: клетки лимфомы есть в лимфоузлах по обе стороны от диафрагмы; либо они присутствуют и в лимфатических узлах над диафрагмой, и в селезенке.
IV: заболевание распространилось по крайней мере в один орган, не входящий в лимфатическую систему, такой как печень, костный мозг или легкие.

Лечение лимфомы
Лечение лимфомы – задача непростая. Для ее решения требуется не один доктор, а целая команда профессионалов своего дела – химиотерапевта, радиолога, хирурга, онколога, гематолога и других.
В онкологическом центре «Лапино-2» есть все необходимые специалисты – врачи мирового уровня, которые проводят полную диагностику заболевания и любую необходимую терапию.
У нас вам не придется пересдавать анализы, переделывать исследования и задаваться вопросом «что делать дальше?». Мы полностью ведем пациента и даем ему четкий план действий, следуя которому он получает лучший результат из возможных.
Для борьбы с данным типом онкологии применяется несколько методов:
Основным из них является химиотерапия – препараты, которые уничтожают измененные клетки. Они принимаются в виде таблеток или вводятся в вену, попадают в кровоток и распространяются по всему телу. Лечение проводится циклами, каждый из которых длится несколько недель, после чего следует период отдыха, за время которого организм восстанавливается.
Трансплантация костного мозга или стволовых клеток, из которых образуются клетки крови. Процедура позволяет назначать более высокие дозы химиотерапии, иногда вместе с лучевой терапией, благодаря чему лимфома уничтожается эффективнее. Пересадка возможна не только донорского, но и своего собственного, собранного за несколько недель до вмешательства материала.
Лучевая терапия – уничтожение измененных клеток с помощью радиации. Данный метод подходит для большинства пациентов, и особенно хорошо работает, если заболевание успело поразить небольшое количество тканей. Его применяют как самостоятельно, так и в сочетании с химиотерапией.
Иммунотерапия – препараты, которые помогают собственной иммунной системе человека лучше распознавать и разрушать неправильные клетки. Существует несколько их типов, применяемых при лимфомах. К ним относят:
- моноклональные антитела – белки, разработанные для атаки определенного вещества на поверхности лимфоцитов;
- ингибиторы иммунных контрольных точек – лекарства, не позволяющие измененным клеткам маскироваться под здоровые;
- Т-клеточная терапия: изъятие из крови пациента и изменение в лаборатории иммунных клеток, их размножение и возвращение в организм, где они отыскивают и уничтожают очаги заболевания.
Хирургия: часто используется для получения образцов подозрительных тканей и определения их типа, но редко – для терапии как таковой. В редких случаях операции назначаются при поражениях селезенки или других органов, которые не входят в лимфатическую систему – например, щитовидная железа или желудок.

Прогнозы и продолжительность жизни при лимфоме
Перспективы каждого человека индивидуальны – они зависят от множества различных факторов, таких как тип заболевания, его стадия, ответ на лечение, возраст и общее состояние здоровья.
Наличие некоторых из них говорит о менее благоприятных прогнозах:
- повышенная температура, ночная потливость и снижение веса;
- высокая СОЭ – скорость оседания эритроцитов Эритроциты – это клетки крови, которые доставляют кислород к тканям и органам. – от 50 у людей с вышеперечисленными симптомами, и более 30 у всех остальных;
- возраст старше 45 лет;
- мужской пол;
- высокий уровень лейкоцитов Лейкоциты – это клетки крови, основной задачей которых является борьба с инфекциями. – более 15 тысяч;
- уровень гемоглобина Гемоглобин – это белок клеток крови, переносящий по телу железо. Он удерживает кислород, необходимый для работы всех тканей. ниже 10,5;
- низкий уровень альбумина Альбумин – это белок крови, который переносит различные химические соединения и участвует в обмене веществ. в крови – менее 4.
Для составления примерных прогнозов врачи используют специальный термин – «пятилетняя выживаемость». Это статистический показатель, который ничего не говорит о шансах конкретного человека. Он показывает только количество людей с определенным типом заболевания на конкретной стадии, остающихся в живых спустя 5 или более лет с момента постановки диагноза.
У пациентов с лимфомой Ходжкина эта цифра выглядит следующим образом:
- На локализованном этапе, пока онкология присутствует только в одной группе лимфатических узлов, в одном лимфоидным органе или ткани за пределами лимфатической системы – она составляет примерно 91%.
- На региональном, при повреждении расположенных рядом с лимфоузлами структур, двух или более групп лимфатических узло, находящихся по одну сторону от диафрагмы – около 94%.
- При распространении заболевания на другие части тела, такие как легкие, печень или костный мозг, либо на лимфоузлы ниже и выше диафрагмы – 81%.
Для пациентов с различными видами неходжкинских лимфом – диффузной В-крупноклеточной Диффузная В-крупноклеточная лимфома – это целая группа опухолей лимфатической системы, которая развивается из В-клеток вилочковой железы, или тимуса. и фолликулярной Фолликулярная лимфома – самая распространенная из медленно растущих типов заболевания, она составляет 20-30% от всех впервые диагностированных неходжкинских лимфом. она составляет 73% и 96%, 73% и 90%, 57% и 85% соответственно.
Заболевания
- Острый миелоидный лейкоз
- Лимфома
- Миелома
- Лимфома Ходжкина
- Хронический лимфоцитарный лейкоз
- Неходжкинская лимфома
- Миелодиспластический синдром
- Хронический миелоидный лейкоз
- Острый лимфобластный лейкоз
- Макроглобулинемия Вальденстрема
Зейналова Первин Айдыновна Гематолог, онколог, доктор медицинских наук, профессор, врач высшей категории. Заведующая отделением онкогематологии
Многоликий молекулярно-генетический портрет диффузной В-крупноклеточной лимфомы, или в поисках новых терапевтических подходов
Статья на конкурс «Био/Мол/Текст»: Слово «лимфома» означает опухоль, происходящую из особых клеток иммунной системы — лимфоцитов. Эта опухоль представляет собой скопления злокачественных клеток в организме, предшественниками которых могут быть Т- или В-лимфоциты. В данном обзоре предпринята попытка сконцентрировать наиболее актуальную научную информацию о молекулярной и генетической неоднородности одного из самых распространенных и агрессивных типов лимфом — диффузной В-клеточной крупноклеточной лимфомы, с рассмотрением перспективы персонализированной медицины для данного заболевания.

Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
В онкогематологии все лимфомы классифицируют на два больших класса: лимфома Ходжкина, которая из-за своих уникальных биологических особенностей стоит особняком, и неходжкинские лимфомы. Составляя приблизительно 30% от всех случаев неходжкинских лимфом, диффузная В-клеточная крупноклеточная лимфома (сокращенно ДВККЛ) является одной из самых частых и агрессивных лимфом в мире [1]. На сегодняшний день стандартом первой линии терапии ДВККЛ является режим R-CHOP (читается как «эр-чоп»), в состав которого входят препараты: циклофосфамид, доксорубицин, винкристин и преднизолон с добавлением терапевтического моноклонального антитела ритуксимаб. К сожалению, достигнутыми результатами такой терапии в виде 60% успешного лечения пациентов нельзя удовлетвориться [1]. Остальные 40% больных либо сразу не отвечают на режим R-CHOP, либо довольно быстро рецидивируют, и такие случаи довольно трудно поддаются дальнейшему лечению [1]. Для большего понимания всей драматичности ситуации стоит подчеркнуть, что достижение даже частичной ремиссии по окончании первой линии терапии не является залогом успешного лечения. Именно отсюда такая потребность в поиске новых, альтернативных и перспективных методов в лечении.
Что ж, теперь я хочу пригласить вас в удивительный и сложный мир молекулярного и генетического разнообразия лимфомы. Уверяю вас, что биология рака — как огромный океан: себя можно представить в небольшом батискафе в бездонном морском пространстве; здесь много неизвестного, ты порой не понимаешь, как оценить весь масштаб происходящего, ощущаешь себя мелкой крупицей. Все это пугает и завораживает одновременно. Готовы к погружению?
Такая разная лимфома
Два паттерна экспрессии генов ДВККЛ определяют клинический прогноз
Диффузная В-клеточная крупноклеточная лимфома неспецифицированная (DLBCL, NOS — diffuse large B-cell lymphoma not otherwise specified) представляет собой отдельное заболевание в системе классификации ВОЗ 2017 года [2]. Однако пациенты по-разному отвечают на режим R-CHOP и имеют разный прогноз в отношении выживаемости, что свидетельствует о биологической неоднородности опухоли. Конечно, можно говорить о клинической «разношерстности» пациентов с неодинаковым возрастом, сопутствующей патологией, стадией заболевания на момент постановки диагноза, однако все эти факторы не решают фундаментальной проблемы опухолевой гетерогенности и не дают возможности построения дальнейшей лечебной тактики, основанной на персонализированном подходе.
Наверняка причины опухолевой гетерогенности скрываются в молекулярно-биологических особенностях лимфом. Так, более 20 лет назад была опубликована работа, в которой на основе анализа экспрессии генов методом ДНК-микрочипов исследователи Alizadeh A. и соавторы (2000) выявили три молекулярных подтипа диффузной В-клеточной крупноклеточной лимфомы: GCB- и ABC-подтип, а также неклассифицированный вариант, отличающиеся качественным составом матричной РНК в клетках [3]. GCB-подтип (germinal center B-cell like subtype) ДВККЛ имеет профиль экспрессии генов, соответствующий таковому у B-лимфоцитов герминативного центра лимфатического фолликула (это особенная зона в лимфатическом узле, где В-лимфоцит «обучается» отвечать и реагировать на тот или иной антиген). Стоит полагать, что GCB-подтип лимфомы возникает непосредственно из В-клетки герминативного центра. При злокачественной трансформации этих же клеток может возникать и другой гистологический вариант лимфомы — фолликулярная лимфома, которая характеризуется относительно вялым или, как еще говорят, индолентным течением. Пациенты с фолликулярной лимфомой не всегда требуют начала лечения на момент постановки диагноза, за ними можно просто наблюдать, и в целом фолликулярная лимфома характеризуется более благоприятным прогнозом в сравнении с ДВККЛ.
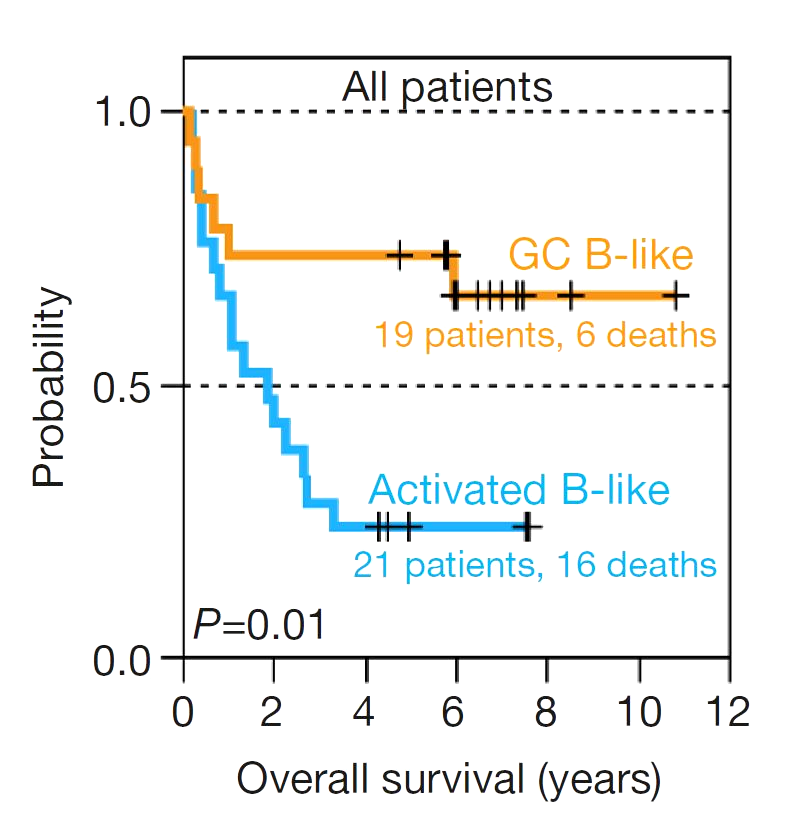
Возможно, именно различия в экспрессии генов лежат в основе различного исхода пациентов? Авторы этого же исследования проанализировали общую выживаемость больных, которые получали сопоставимые схемы лечения. Оказалось, что пациенты с GCB-подтипом ДВККЛ имели статистически значимые различия в выживаемости в сравнении с АВС-подтипом (activated B-cell like subtype) ДВККЛ: в среднем общая пятилетняя выживаемость для всех пациентов составила 52%, однако 76% пациентов с GCB-подтипом по достижении пятилетнего рубежа были все еще живы, в то время как только 16% пациентов с ABC-подтипом остались в живых [3]. Исследовательская группа предоставила данные по выживаемости в виде кривых выживаемости Каплана—Мейера (рис. 1). Эти кривые имеют ступенчатый вид и очень часто используются в клинических исследованиях для оценки выживаемости пациентов. В таких графиках каждая ступенька означает наступление неблагоприятного для пациента события: прогрессирование заболевания (при изучении выживаемости без прогрессирования) или летальный исход (при изучении общей выживаемости).
Таким образом, был получен окончательный вывод: диффузная В-клеточная крупноклеточная лимфома представляет собой не одно заболевание, а группу различных по молекулярному патогенезу заболеваний с неодинаковым клиническим прогнозом.
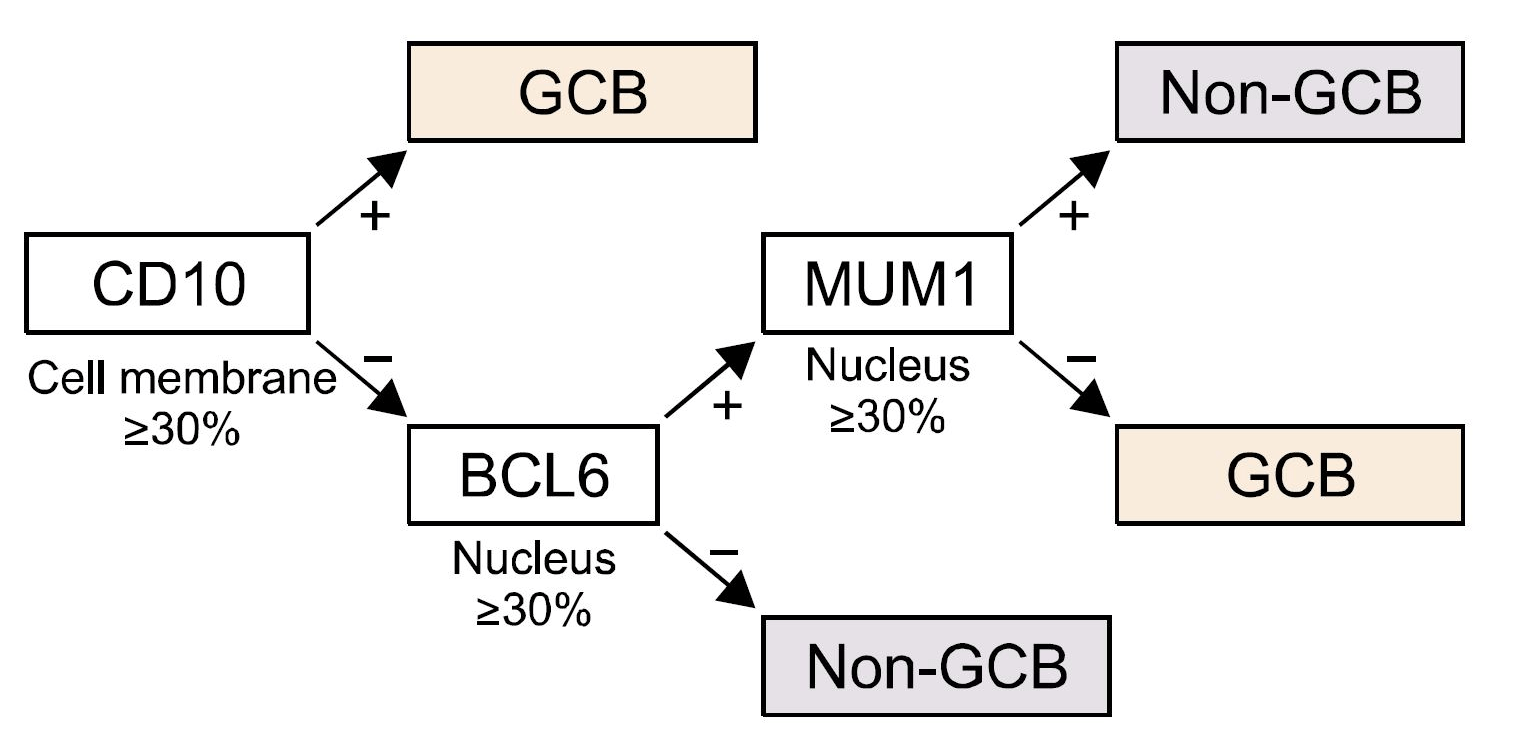
К большому сожалению, даже на сегодняшний день в рутинной онкогематологической практике использование методов анализа экспрессии генов невозможно из-за дороговизны и сложности метода. В качестве альтернативного метода определения молекулярного подтипа ДВККЛ в клинике врачами-патологоанатомами используется окрашивание ткани опухоли в исследовании, основанном на взаимодействии антитела с антигеном — иммуногистохимическая реакция по алгоритму Hans [4], [5]. Данный метод основан на оценке относительного уровня экспрессии всего трех маркеров: CD10, BCL6 и MUM1 (рис. 2). Хоть этот метод более доступен, он не так точен и не позволяет в чистом виде выделить АВС-подтип, поэтому в иммуногистохимическом алгоритме предусмотрено разделение ДВККЛ на GCB- и non-GCB-подтипы.
Молекулярные основы патогенеза ABC- и GCB-подтипов ДВККЛ
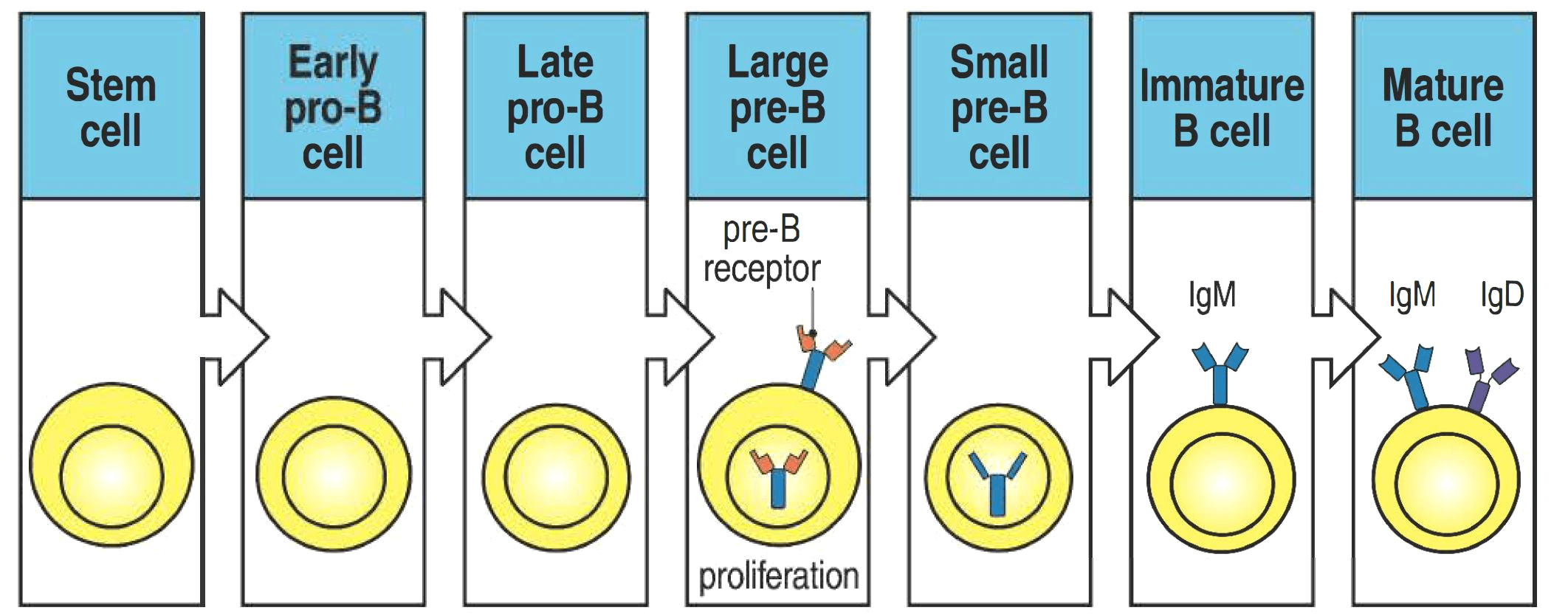
Генетические поломки, обуславливающие формирование злокачественных лимфом, возникают на определенном этапе нормального развития В-лимфоцита. Опухолевые В-лимфоциты неходжкинских лимфом имеют биологические особенности нормальных В-лимфоцитов, и они используют эти свойства для собственного выживания и размножения злокачественного клона. Это означает, что функционирование В-клеток лимфом в значительной степени определяется уровнем развития или дифференцировки В-лимфоцитов, из которых опухоль происходит. Обратите внимание на основные последовательные стадии дифференцировки В-лимфоцита (рис. 3), начиная от стволовой кроветворной клетки и заканчивая плазматической клеткой, основная функция которой — секреция защитных антител [6]. Это знание еще пригодится нам в дальнейшем.
В костном мозге в процессе В-лимфопоэза (формирования В-лимфоцита из стволовой кроветворной клетки) происходит созревание В-клеточного рецептора лимфоцита — будущего специфичного антитела — за счет V(D)J-рекомбинации при участии ферментов RAG1 и RAG2, которые вносят разрывы в двухцепочечную молекулу ДНК, устраняемые простым соединением концов ДНК. Данное молекулярное событие может стать источником формирования хромосомных транслокаций (перестроек) и образования химерных генов, которые в нормальных клетках отсутствуют и гиперэкспрессия которых значима в патогенезе лимфом. Другим потенциальным источником возникновения генетических поломок является герминативный центр лимфатического фолликула, о котором мы уже говорили ранее. Именно здесь происходят события, связанные с модификацией ДНК, которые представляют собой еще один источник мутагенеза — соматическая гипермутация (накопление большего количества мутаций в генах иммуноглобулинов при участии цитозиндезаминазы AID), в процессе которой происходит созревание аффинитета (сродства) В-клеточного рецептора к антигену, и переключение классов иммуноглобулинов. Таким образом, на определенных этапах нормального развития любого В-лимфоцита существуют молекулярные механизмы, которые создают предпосылки к возникновению генетических поломок и, как следствие, — к развитию лимфом. Возникновение той или иной генетической поломки в В-лимфоците носит вероятностный характер.
Мы не будем далее подробно рассматривать все сложные молекулярные механизмы, лежащие в основе развития В-клеточного звена иммунитета. Все, что сейчас достаточно понимать, так это то, что В-лимфоцит берет свое начало в костном мозге от стволовой кроветворной клетки. Далее В-клетка с током крови мигрирует в лимфатические узлы, где образует герминативый центр — своего рода «школу», где происходит отбор и дополнительное созревание, а также «обучение» распознаванию антигена, после чего успешно окончивший «образовательную программу» В-лимфоцит превращается в плазмоцит, готовый синтезировать специфические антитела, или в В-клетку памяти. Давайте подробнее остановимся только на молекулярных характеристиках В-клетки герминативного центра и плазматической клетки, так как это имеет прямое отношение к подтипам ДВККЛ. Целый набор транскрипционных факторов, то есть регуляторов транскрипции генов — BCL6, MTA3, SPIB, BACH2, OCT2, OCAB, IRF8 — формируют фенотип В-клетки герминативного центра (рис. 4) [7]. Эти клетки экспрессируют BCL6, представляющий собой репрессор (то есть подавитель, угнетатель) транскрипции. Белок BCL6 подавляет многие гены, вовлеченные в дифференцировку плазматических клеток, клеточный цикл, ответ на повреждение ДНК и программируемую клеточную смерть. Но как только В-лимфоцит герминативного центра начинает дифференцироваться в плазматическую клетку, повышение уровня экспрессии плазмоклеточных маркеров IRF4 и Blimp-1 угнетает BCL6, тем самым продвигая клетку к конечному, терминальному этапу дифференцировки — плазмоциту.
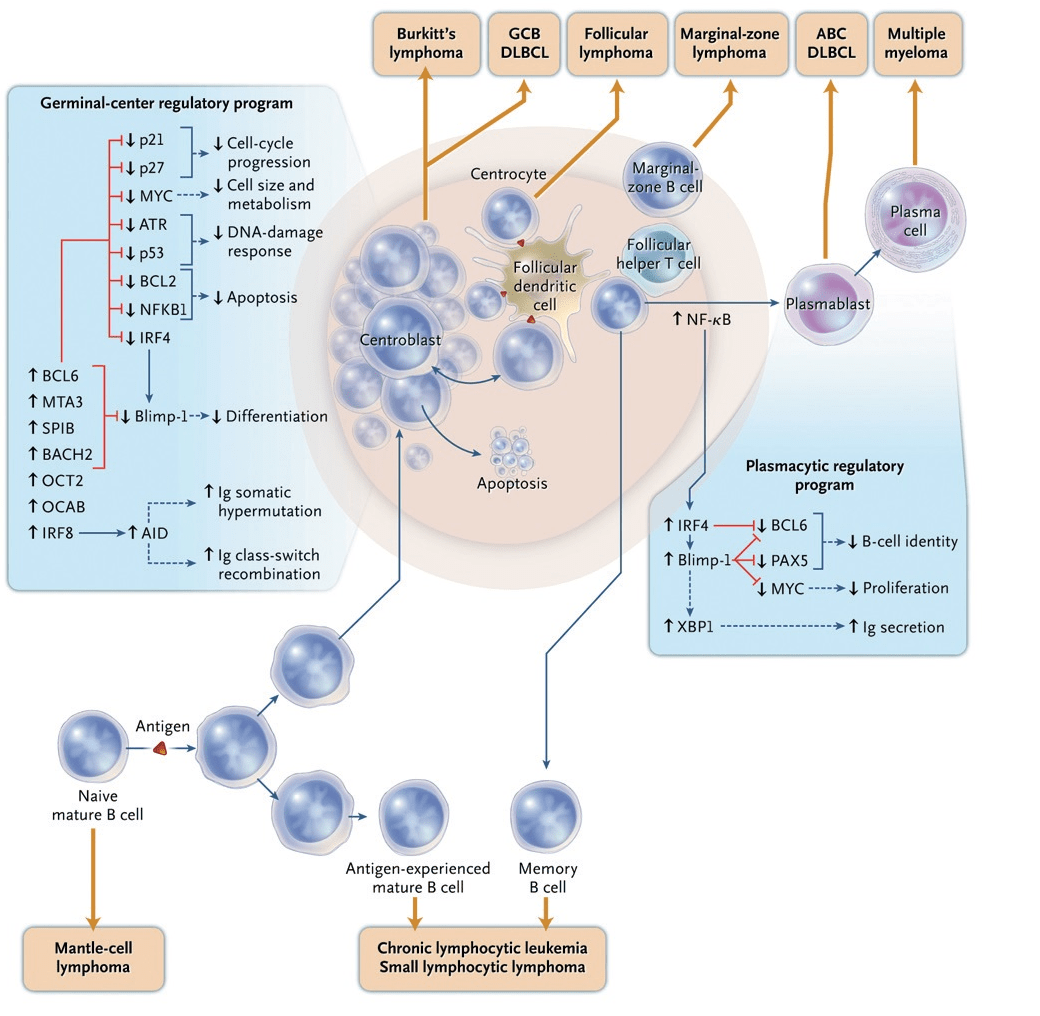
Наконец, мы добрались до кульминационной части данного раздела. В случае прогностически более благоприятного варианта — GCB-подтипа ДВККЛ — экспрессионный профиль генов таков, что он соответствует профилю В-лимфоцита герминативного центра, при этом активность молекулярного сигнального пути NF-kB (nuclear factor kappa-B) в таких клетках снижена [7]. Наоборот, в случае клинически неблагоприятного АВС-подтипа ДВККЛ активность NF-kB высока, что может служить одним из механизмов избегания программируемой клеточной гибели — апоптоза. Такие опухолевые клетки экспрессируют маркеры, характерные для плазматических клеток, включая IRF4 и транскрипционный фактор XBP1 — регулятор секреции иммуноглобулинов. Однако при этом полное развитие В-лимфоцитов АВС-подтипа лимфомы в нормальный плазмоцит невозможно из-за блока дифференцировки [7].
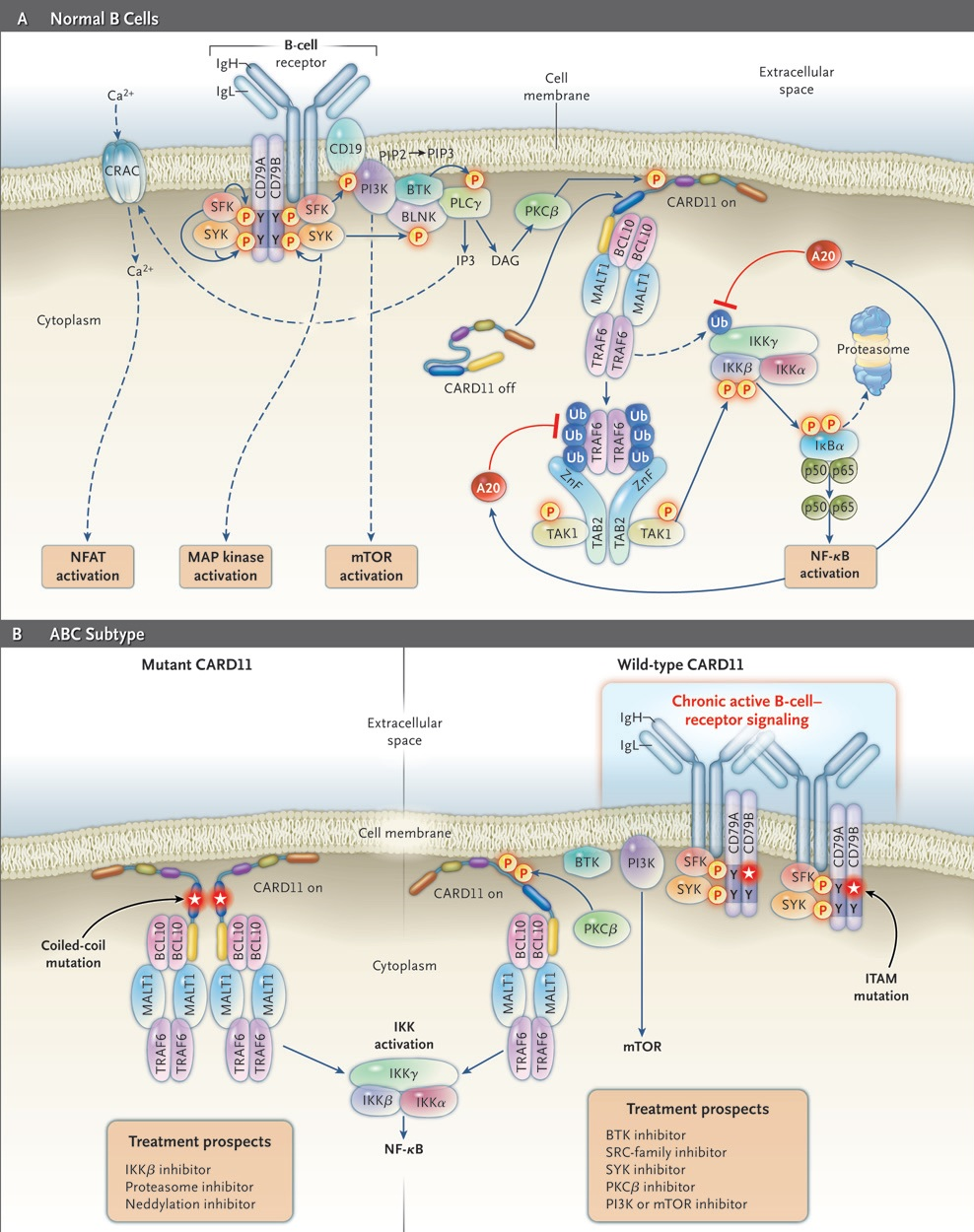
Роль активации NF-kB и сигнального пути В-клеточного рецептора в АВС-подтипе ДВККЛ
Как уже было отмечено ранее, успешная стратегия выживания опухолевого В-лимфоцита может объясняться высокой зависимостью от NF-kB для АВС-подтипа ДВККЛ, но не для GCB-подтипа. А также известно о том, что каскадный внутриклеточный сигнальный путь В-клеточного рецептора в случае АВС-подтипа находится в состоянии хронической гиперактивации [7]. Существует довольно несложный способ продемонстрировать, что эти сигнальные пути являются жизненно важными для опухолевых клеток. Для этого достаточно их заблокировать или выключить. На клеточных линиях, являющихся моделями АВС-подтипа ДВККЛ, исследователи Davis R.E. и соавторы (2010) с помощью явления РНК-интерференции продемонстрировали нежизнеспособность опухолевого клона при подавлении экспрессии одного из ключевых посредников сигнала от В-клеточного рецептора — Брутоновской тирозинкиназы [8]. С другой стороны, Lam L.T. и соавторы (2005) успешно подтвердили токсический эффект блокатора IKK, который связан с путем NF-kB в В-лимфоцитах АВС-подтипа [9].
Что, если результаты этих исследований использовать в терапевтических целях? Сложная система внутриклеточных молекул-посредников злокачественного В-лимфоцита АВС-подтипа ДВККЛ может стать интересным объектом терапевтического воздействия (рис. 5). В фармакологической тяжелой артиллерии врача-гематолога уже сегодня имеются блокаторы В-клеточного рецепторного каскада (ибрутиниб — ингибитор Брутоновской тирозинкиназы, дувелисиб — ингибитор PI3K, полатузумаб ведотин — связывает CD79b) и протеасомные ингибиторы (бортезомиб), которые, косвенно воздействуя на NF-kB, предотвращают его проникновение в клеточное ядро и реализацию программы выживания. Более интересной терапевтической мишенью для лечения ДВККЛ могут стать компоненты комплекса CARD11/BCL10/MALT1 (рис. 5). Приблизительно 10% всех АВС-подтипов лимфом имеют активационную мутацию в CARD11, которая обуславливает автономное формирование внутрицитоплазматических белковых агрегатов CARD11/BCL10/MALT1/TRAF6, что приводит к активации IKK, а в последующем — к запуску NF-kB [7]. Причем такая мутация делает независимым сигнальный путь NF-kB от посредников (мессенджеров) сигнала от В-клеточного рецептора, стоящих выше CARD11.
Использование таргетных препаратов, упомянутых выше, уже одобрено для лечения многих гематологических заболеваний, но в случае с ДВККЛ имеются нюансы, о которых мы подробнее поговорим с вами в разделе «Несменяемый монарх „Сэр“-чоп».
Повторяющиеся мутационные паттерны ДВККЛ отражают профиль экспрессии генов
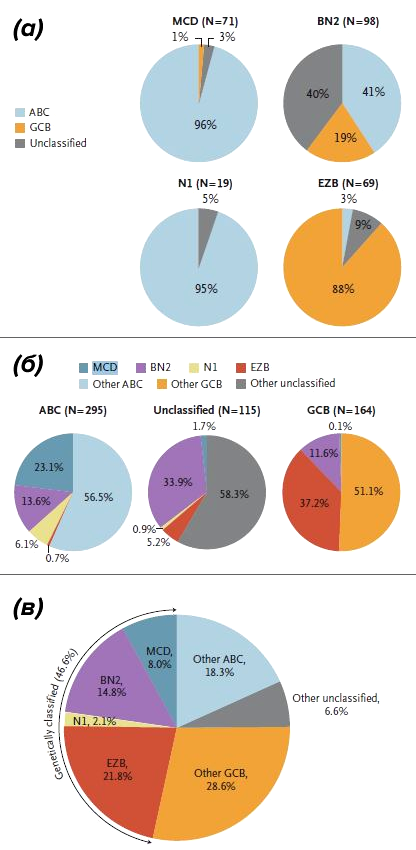
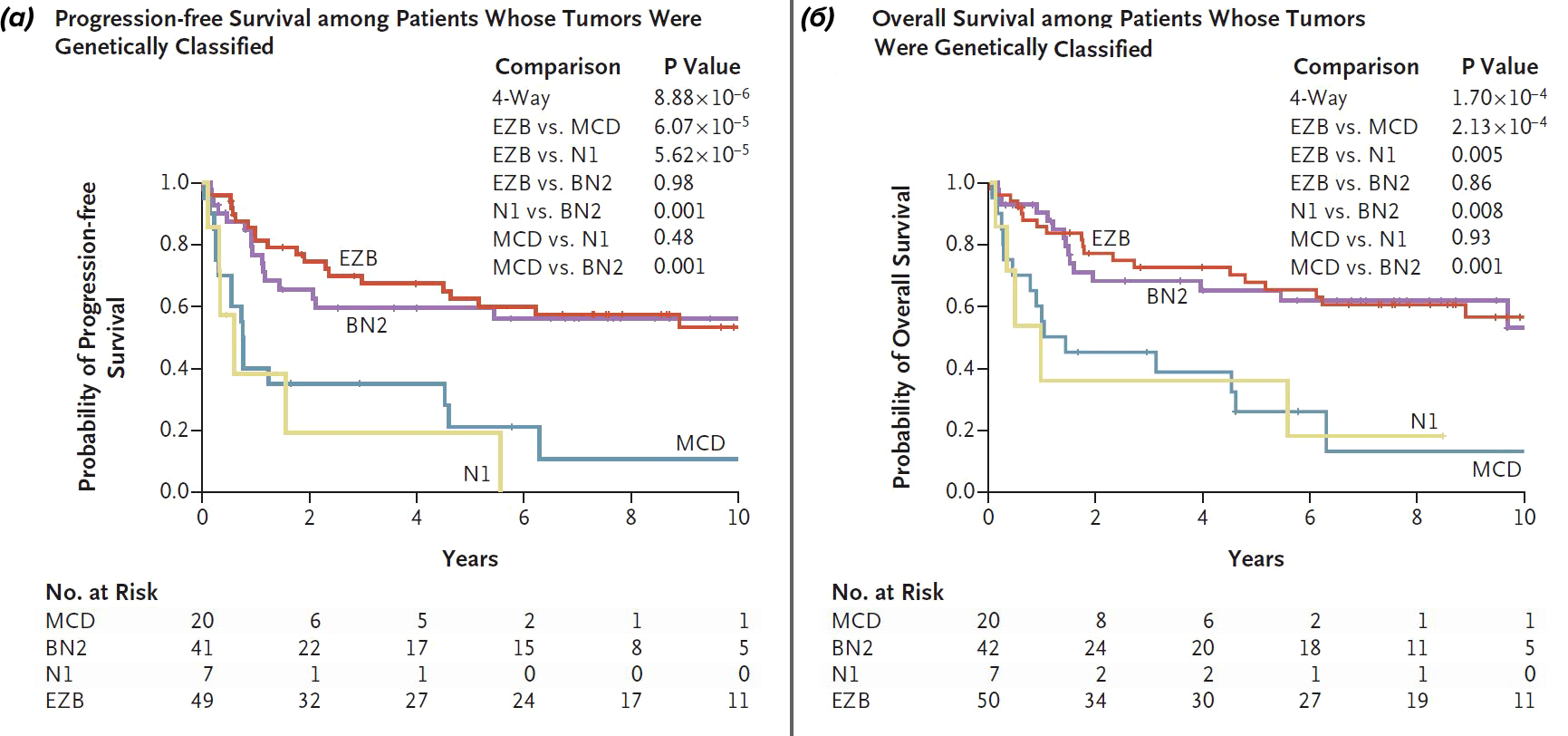
Не так давно представления о разнообразии ДВККЛ несколько усложнились. Schmitz et al. (2018) провели секвенирование экзома [10] и транскриптомный анализ RNA-seq 574 образцов ДВККЛ и выявили группы повторяющихся от случая к случаю мутаций в опухолевой ДНК, которые ассоциированы с одним из молекулярных подтипов [11]. Исследовательской группе удалось выделить четыре генетических типа ДВККЛ: MCD (сосуществующие мутации MYD88 и CD79b в опухоли), BN2 (транслокация BCL6 и мутация NOTCH2), N1 (мутация NOTCH1) и EZB (мутация EZH2 и транслокация BCL2) [11]. Только 46,6% случаев ДВККЛ удалось классифицировать по данным генетическим группам; оставшаяся часть лимфом не может быть отнесена ни к одному из подтипов и считается неклассифицированной. Нетрудно заметить (рис. 6), что подавляющее большинство молекулярных подтипов в случае MCD и N1 генетических вариантов соответствуют АВС-подтипу, а EZB вариант — GCB-подтипу [11]. Примечательно, что определение генетических групп, подобно молекулярным группам, имеет клиническое значение с точки зрения прогноза для пациента. Исследование безрецидивной и общей выживаемости пациентов в свете генетических подтипов позволяет сделать вывод о том, что прогностически более неблагоприятными вариантами можно считать N1 и MCD варианты (рис. 7).
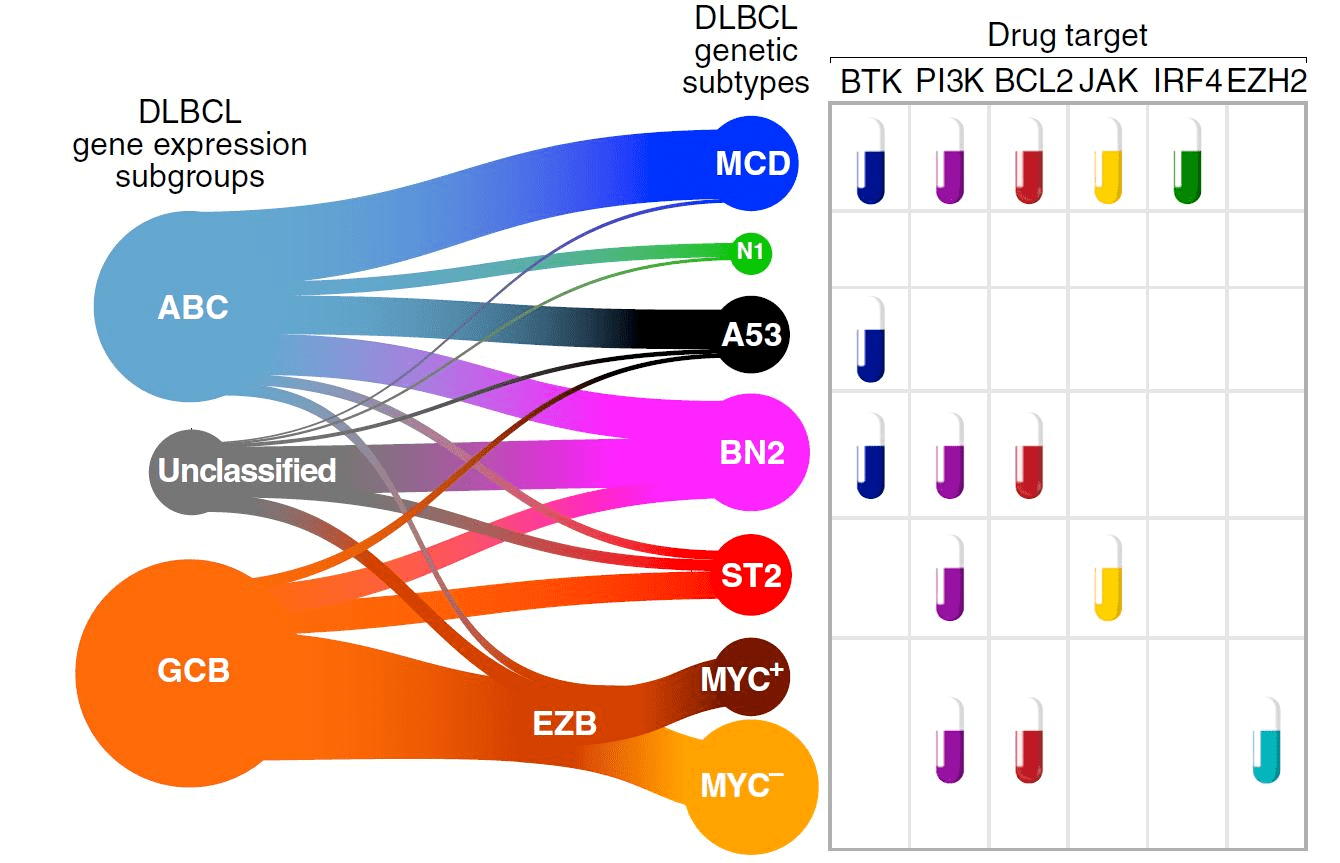
Современный многоликий молекулярно-генетический портрет ДВККЛ был «написан» только в 2020 году. Wright G.W. и соавторы (2020) предложили использовать алгоритм LymphGen для генетической классификации ДВККЛ, расширив уже имеющуюся классификацию двумя новыми вариантами, а именно ST2 и А53 (рис. 8), основываясь на повторяющихся сочетаниях мутаций в SGK1 плюс TET2 и анеуплоидии (т.е. явлении, при котором количество хромосом в клетке становится не кратно 23) с мутацией TP53, соответственно [12]. Таким образом, современный алгоритм LymphGen позволяет распределить по подтипам уже 63,1% случаев диффузной В-клеточной крупноклеточной лимфомы [12].
Несменяемый монарх «Сэр»-чоп
Несмотря на очевидный прогресс в понимании молекулярно-генетического разнообразия и патогенеза ДВККЛ и вопреки многообещающим результатам, полученным при исследовании токсического эффекта таргетных лекарственных препаратов на опухолевые клетки в экспериментальных моделях, на текущий момент в самых последних обновлениях американских клинических онкологических рекомендаций NCCN и в европейских рекомендациях медицинской онкологии ESMO альтернатив режиму R-CHOP в первой линии терапии нет [13].
Такие несоответствия обусловлены тем, что не всегда логичная и стройная идея об эффективности лекарственного препарата, подтвердившаяся в доклинических исследованиях, сможет оправдать себя в клинических исследованиях, в которых принимают участие живые больные люди. Более того, даже наличие статистически значимых различий между экспериментальным лечением и золотым стандартом или плацебо в пользу экспериментального лекарственного препарата не говорит о реальной клинической значимости, выраженной в количестве месяцев или лет жизни, прожитых пациентом в ремиссии в хорошем качестве. Уже имеющиеся результаты крупных клинических исследований II и III фаз по лечению пациентов с впервые выявленной ДВККЛ в попытке улучшить результаты лечения путем добавления ибрутиниба (исследование PHOENIX), леналидомида (исследования ROBUST и E1412) или бортезомиба (исследование REMoDL-B) к стандартному режиму терапии R-CHOP в первой линии, к сожалению, не увенчались успехом [14–17].
Вместо заключения. Зачем изучать такую сложную молекулярную биологию рака?
Если вы уже устали, дойдя до этого момента, из-за всех сложных биологических концепций разнообразия ДВККЛ, то я поспешу вас обрадовать тем, что в этом обзоре освещается лишь только один гистологический вариант лимфомы. Да, современные молекулярно-биологические представления опухолевого роста разнообразны и огромны. Одних внутриклеточных молекулярных посредников, участвующих в каскадных сигналах, существует сколько! А сколько мутаций во всех раковых генах! Весь этот массив информации в голове просто не удержать.
Сегодняшний рынок онкологического биофармацевтического производства представляет совокупность лекарственных препаратов, назначение которых основано на знаниях генетики рака, создавая тем самым возможность прицельного, направленного воздействия на опухоль. Да, да, вы, наверное, уже догадались, что я сейчас говорю именно о персонифицированной или персонализированной медицине в онкологии. Клиницисты сегодня знают довольно немало таких примеров: назначение эрлотиниба пациенту с аденокарциномой легкого при наличии мутации L858R в гене рецептора эпидермального фактора роста EGFR, вемурафениб для лечения распространенной меланомы при обнаруженной мутации в опухоли V600E в гене BRAF, иматиниб как блокатор BCR-ABL при терапии хронического миелолейкоза, мидостаурин в лечении острого миелоидного лейкоза при выявленной мутации в FLT3. Всего этого и многого чего другого просто не было, если бы не развивалась биомедицинская наука. От знаний в молекулярной биологии и генетики выигрывают абсолютно все: ученые удовлетворяют собственный научный интерес и любопытство, врачи принимают участие в клинических исследованиях, развивается фармацевтический рынок, появляются новые профессиональные кадры, а пациенты дольше живут, имея хорошее качество жизни.
Пусть сегодня успехи в выборе клинически эффективного таргетного лекарственного препарата на основе молекулярно-генетических характеристик ДВККЛ не так грандиозны, как хотелось бы, совершенно очевидно одно — дальнейшее усложнение наших представлений в отношении молекулярной генетики опухолей, особенно в условиях расширенной доступности технологий высокопроизводительного секвенирования непременно приведут к революционным терапевтическим подходам в не столь отдаленном будущем. В заключение стоит отметить, что попытка модифицировать схему R-CHOP предпринимается сейчас авторами исследования POLARIX, где они предлагают сравнить режим Pola-R-CHP (полатузумаб ведотин, ритуксимаб, циклофосфамид, доксорубицин, преднизолон) со стандартом, и уже получены результаты: 2-летняя выживаемость без прогрессирования у пациентов из группы лечения Pola-R-CHP составила 76,7% в сравнении с 70,2% у пациентов стандартной терапии R-CHOP. Более того, за последние два года появились возможности лечения рефрактерных или рецидивирующих форм ДВККЛ, такие как биспецифические моноклональные антитела (глофитамаб, мосунетузумаб, эпкоритимаб, одронекстамаб) и CAR-T клеточная терапия.
Литература
- Laurie H. Sehn, Gilles Salles. (2021). Diffuse Large B-Cell Lymphoma. N Engl J Med. 384, 842-858;
- Steven H. Swerdlow, Elias Campo, Stefano A. Pileri, Nancy Lee Harris, Harald Stein, et. al.. (2016). The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 127, 2375-2390;
- Ash A. Alizadeh, Michael B. Eisen, R. Eric Davis, Chi Ma, Izidore S. Lossos, et. al.. (2000). Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature. 403, 503-511;
- Hee Sang Hwang, Dok Hyun Yoon, Cheolwon Suh, Chan-Sik Park, Jooryung Huh. (2013). Prognostic value of immunohistochemical algorithms in gastrointestinal diffuse large B-cell lymphoma. Blood Res. 48, 266;
- 12 методов в картинках: иммунологические технологии;
- Poonam Gulati. (2009). Janeway’s Immunobiology, 7th Edition by Kenneth Murphy, Paul Travers, and Mark Walport. Biochem. Mol. Biol. Educ.. 37, 134-134;
- Georg Lenz, Louis M. Staudt. (2010). Aggressive Lymphomas. N Engl J Med. 362, 1417-1429;
- R. Eric Davis, Vu N. Ngo, Georg Lenz, Pavel Tolar, Ryan M. Young, et. al.. (2010). Chronic active B-cell-receptor signalling in diffuse large B-cell lymphoma. Nature. 463, 88-92;
- Lam L. T., et al. (2005). Small molecule inhibitors of IκB kinase are selectively toxic for subgroups of diffuse large B-cell lymphoma defined by gene expression profiling. Clinical cancer research.11,28–40;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Roland Schmitz, George W. Wright, Da Wei Huang, Calvin A. Johnson, James D. Phelan, et. al.. (2018). Genetics and Pathogenesis of Diffuse Large B-Cell Lymphoma. N Engl J Med. 378, 1396-1407;
- George W. Wright, Da Wei Huang, James D. Phelan, Zana A. Coulibaly, Sandrine Roulland, et. al.. (2020). A Probabilistic Classification Tool for Genetic Subtypes of Diffuse Large B Cell Lymphoma with Therapeutic Implications. Cancer Cell. 37, 551-568.e14;
- H. Tilly, M. Gomes da Silva, U. Vitolo, A. Jack, M. Meignan, et. al.. (2015). Diffuse large B-cell lymphoma (DLBCL): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. 26, v116-v125;
- Anas Younes, Laurie H. Sehn, Peter Johnson, Pier Luigi Zinzani, Xiaonan Hong, et. al.. (2019). Randomized Phase III Trial of Ibrutinib and Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone in Non–Germinal Center B-Cell Diffuse Large B-Cell Lymphoma. JCO. 37, 1285-1295;
- Grzegorz S. Nowakowski, Annalisa Chiappella, Randy D. Gascoyne, David W. Scott, Qingyuan Zhang, et. al.. (2021). ROBUST: A Phase III Study of Lenalidomide Plus R-CHOP Versus Placebo Plus R-CHOP in Previously Untreated Patients With ABC-Type Diffuse Large B-Cell Lymphoma. JCO. 39, 1317-1328;
- Grzegorz S. Nowakowski, Fangxin Hong, David W. Scott, William R. Macon, Rebecca L. King, et. al.. (2021). Addition of Lenalidomide to R-CHOP Improves Outcomes in Newly Diagnosed Diffuse Large B-Cell Lymphoma in a Randomized Phase II US Intergroup Study ECOG-ACRIN E1412. JCO. 39, 1329-1338;
- Andrew Davies, Thomas E Cummin, Sharon Barrans, Tom Maishman, Christoph Mamot, et. al.. (2019). Gene-expression profiling of bortezomib added to standard chemoimmunotherapy for diffuse large B-cell lymphoma (REMoDL-B): an open-label, randomised, phase 3 trial. The Lancet Oncology. 20, 649-662.
Источник https://medi.ru/klinicheskie-rekomendatsii/diffuznaya-v-krupnokletochnaya-limfoma-u-vzroslykh_13923/
Источник https://lapino2.ru/napravleniya/onkogematologiya/limfoma/
Источник https://biomolecula.ru/articles/mnogolikii-molekuliarno-geneticheskii-portret-diffuznoi-limfomy